目錄表
臨牀管道
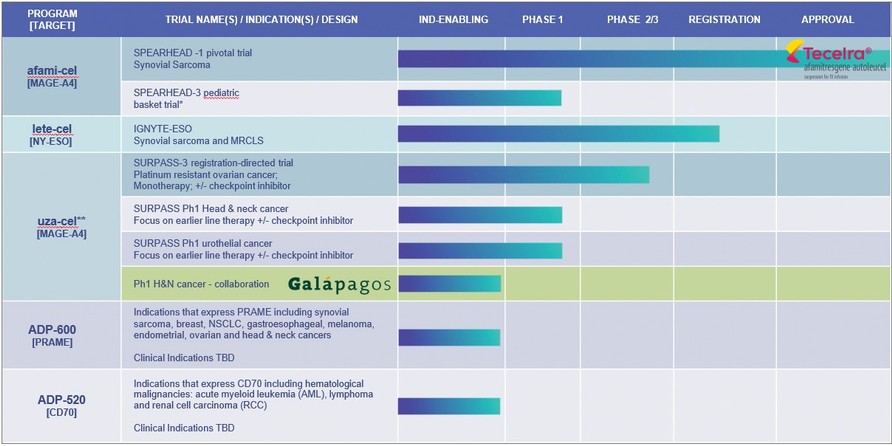
*滑膜肉瘤、惡性周圍神經鞘膜瘤(MPNST)、神經母細胞瘤、骨肉瘤,根據先鋒3號試驗方案暫停登記
**Uzatresgene autleucel,前身為ADP-A2M4CD8;超過Ph1,不再註冊。Adaptimmune和加拉帕戈斯公司將進行一項臨牀概念驗證試驗,以評估加拉帕戈斯分散製造平臺上生產的Uza-cel在治療以下疾病患者中的安全性和有效性
頭頸部癌
我們正在對MAGE-A4抗原表達的某些適應症進行臨牀試驗。
| ● | 在試驗中發揮了帶頭作用。Speearhead試驗正在歐盟進行,用於治療滑膜肉瘤患者。美國正在進行一項針對表達MAGE-A4抗原的腫瘤的兒科試驗,根據協議,這項試驗的登記已被暫停。 |
| ● | Uza-cel的3期2期試驗。針對耐鉑卵巢癌患者的第二階段試驗正在進行中。我們已經從FDA獲得了用於治療這一適應症的再生醫學高級療法(RMAT)的稱號。第二階段試驗評估ADP-A2M4CD8作為卵巢癌的單一治療和與檢查點抑制劑nivolumab聯合治療。該試驗在美國、加拿大、西班牙和英國公開進行。還有法國。 |
我們的ADP-A2AFP第一階段試驗、超越-2試驗、Gavo-cel和TC-510試驗已經結束註冊。Behass階段1試驗的篩選已經停止,註冊將很快結束。
臨牀前渠道
我們的目標是利用我們從臨牀試驗和轉化科學工作中獲得的見解,提高我們現有產品和方法的有效性;並擴大我們細胞療法的範圍和治療越來越多的患者的能力。我們目前正將我們的臨牀前流程集中在針對PRAME(ADP-600)和CD70(ADP-520)的t細胞療法的開發上,以及我們的同種異體細胞治療平臺上。
| ● | PRAME在多種實體腫瘤中高度表達,包括卵巢癌、子宮內膜癌、肺癌和乳腺癌。我們正在開發針對PRAME的tcr t細胞,最初的候選藥物(adp-600)目前處於臨牀前測試階段,下一代候選藥物正在長期開發中。 |
| ● | CD70計劃針對CD70抗原,CD70抗原在一系列血液系統惡性腫瘤(急性)中表達 |
26