

2024 年 8 月公司演講 展品 99.2

免責聲明以下演示文稿, 包括這些幻燈片的任何印刷或電子副本、演講者的演講、任何演示和問答環節中傳達的信息,以及在現場或場內分發的任何文件或材料 與演示文稿(統稱為 “演示文稿”)的關聯由 Cabaletta Bio, Inc.(“我們”、“我們的”、“Cabaletta” 或 “公司”)編寫,用於 僅供參考。本演示文稿無意成為招股説明書,不完整或包含您可能想要的所有信息。除非另有説明,否則此處包含的聲明均自本演示文稿之日起作出, 並且本演示文稿在任何情況下均不得暗示此處包含的信息在該日期之後的任何時候都是正確的,或者該信息將進行更新或修訂以反映隨後的信息 在本協議發佈之日之後可用或發生更改。 諸如(但不限於)“期待”、“相信”、“期待”、“預測” 等詞語 “估計”、“打算”、“計劃”、“將”、“應該” 和 “可以” 以及類似的表述或詞語可識別前瞻性陳述。各種風險、不確定性和假設 可能導致實際業績與我們的前瞻性陳述中的預期或暗示結果存在重大差異。此類風險和不確定性包括但不限於與我們產品的成功、成本和時機相關的風險 候選藥物開發活動、臨牀前研究和臨牀試驗,與我們在臨牀前研究和臨牀試驗中證明足夠的安全性、有效性和耐受性證據的能力相關的風險;以及 CABA-201 Musk-CAART,在設計相似的結構中觀察到的風險,包括但不限於給藥方案,並不能表明我們希望通過 CABA-201 取得的結果,即生物活動跡象的風險 或者持續性可能無法為長期結果提供信息,在有效的 CD19-CAR t 腫瘤學研究中觀察到的持續性與淋巴消耗相結合的風險並不表示也不適用於 mPV 患者的臨牀反應、風險 與低於預期的臨牀試驗場所激活率或入組率有關,我們有能力在其 CABA-201 的臨牀前研究和臨牀試驗中證明足夠的安全性、有效性和耐受性證據;風險 對試驗設計或方法的修改可能沒有預期的好處,可能需要進一步修改試驗設計;我們保護和維護知識產權地位的能力,與我們的關係相關的風險 第三方、與監管機構評估監管文件以及與我們的候選產品相關的其他信息相關的不確定性、我們保留和認可任何孤兒藥提供的預期激勵措施的能力 指定和快速通道指定、與監管申報和潛在許可相關的風險、我們的任何一個或多個候選產品無法成功開發和商業化的風險、結果的風險 臨牀前研究或臨牀研究無法預測與未來研究相關的未來結果,也無法預測與動盪的市場和經濟狀況以及公共衞生危機相關的風險。新的風險和不確定性可能由此產生 不時地,不可能預測所有的風險和不確定性。除非適用法律要求,否則我們不打算公開更新或修改此處包含的任何前瞻性陳述,無論是由於任何新的前瞻性陳述 信息、未來事件、情況變化或其他方面。儘管我們認為此類前瞻性陳述中反映的預期是合理的,但我們無法保證此類預期會被證明是正確的。因此, 提醒你不要過分依賴這些前瞻性陳述。對於任何此類前瞻性陳述的準確性,不作任何陳述或保證(明示或暗示)。有關這些風險和其他風險的討論 以及不確定性和其他重要因素,其中任何一個都可能導致我們的實際業績與前瞻性陳述中包含的業績存在重大差異,請參閲我們最新的年度報告表中標題為 “風險因素” 的部分 10-k,以及我們在其他和隨後向美國證券交易委員會提交的文件中對潛在風險、不確定性和其他重要因素的討論。本演示文稿中包含的某些信息涉及或基於 從第三方來源獲得的研究、出版物、調查和其他數據,以及公司自己的內部估計和研究。儘管該公司認為截至本演示文稿發佈之日這些第三方來源是可靠的,但它 未獨立核實,也未對從第三方來源獲得的任何信息的充分性、公平性、準確性或完整性做出任何陳述。公司是各種商標、商品名稱和服務商標的所有者。 本演示文稿中出現的某些其他商標、商品名稱和服務標誌是第三方的財產。僅為方便起見,本演示文稿中提及的商標和商品名稱不帶® 和 Tm 符號, 但不應將此類提法解釋為表明其各自所有者不會根據適用法律最大限度地主張其相關權利.
開發並推出第一種療法 針對自身免疫性疾病患者的靶向細胞療法
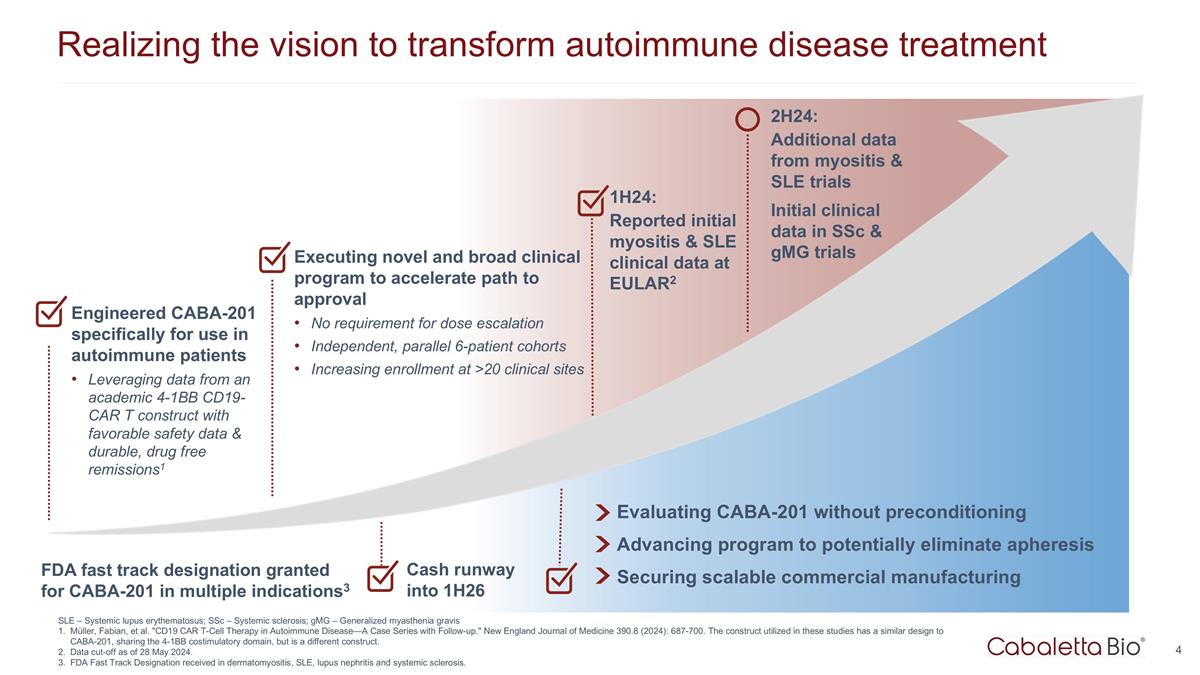
實現變革願景 自身免疫性疾病治療 1H24:在 EULAR2 上報告的初步肌炎和系統性紅斑狼瘡臨牀數據在沒有預處理的情況下評估 CABA-201 推進可能消除血液分離的計劃確保可擴展的商業製造 Cash Runway 進入 1H26 專為自身免疫患者設計的 CABA-201 利用來自學術界 4-1Bb CD19-CAR t 結構的數據,具有良好的安全數據和耐用的無藥物緩解措施1 執行新穎而廣泛的臨牀計劃,以 加快獲得批准的路徑無需增加劑量獨立的、平行的 6 名患者羣組 2H24 年增加 >20 個臨牀場所的入學人數:來自肌炎和系統性紅斑狼瘡試驗的更多數據 ssC 和 GmG 試驗的初始臨牀數據 美國食品藥品管理局批准了多種適應症的 CABA-201 快速通道認證3 SLE — 系統性紅斑狼瘡;ssC — 系統性硬化症;gmG — 全身性重症肌無力 Müller、Fabian 等“CD19 CAR T 細胞療法 自身免疫性疾病——隨訪病例系列。”新英格蘭醫學雜誌 390.8(2024):687-700。這些研究中使用的結構與 CABA-201 的設計相似,共享 4-1Bb 共刺激域,但有所不同 構造。截止日期為 2024 年 5 月 28 日。在皮肌炎、系統性紅斑狼瘡、狼瘡腎炎和系統性硬化症方面獲得了 FDA 快速通道認證。
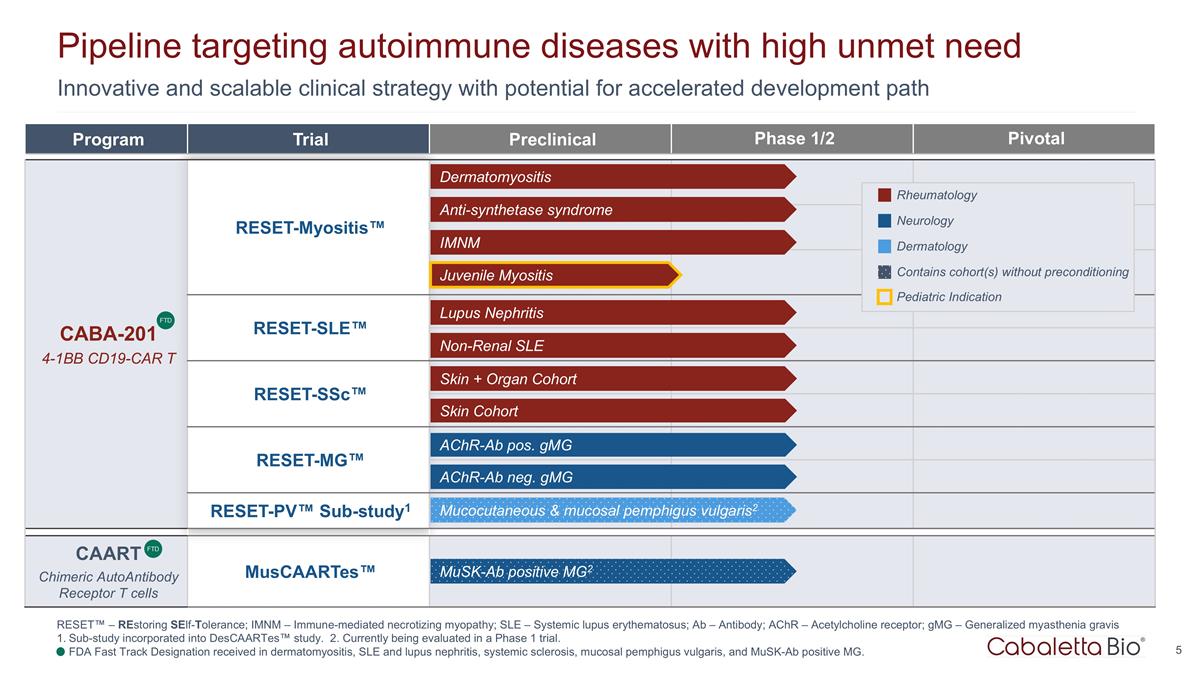
創新且可擴展的臨牀 有可能加快開發路徑的策略研發管道針對需求量高的自身免疫性疾病項目試驗 1/2 期臨牀前 Pivotal CABA-201 4-1Bb CD19-CAR t reset-Myositis™ CARTA 嵌合抗原受體 T 細胞 用於自身免疫 reset-SLE™ reset-SSC™ reset-MG™ reset-PV™ sub-study1 caART 嵌合自身抗體受體 t 細胞 Muscaartes™ 皮肌炎抗合成酶綜合徵 imnM 狼瘡腎炎非腎性 SLE 皮膚 + 器官 隊列 achr-ab neg. gmG achr-ab pos. gmG 皮膚隊列風濕病學神經病學皮膚科 FTD 皮膚粘膜和粘膜尋常型天皰瘡2 包含未預處理的隊列幼年肌炎兒科適應症 musk-ab 陽性 MG2 FTD RESET™ — 恢復自我耐受;imNM — 免疫介導的壞死性肌病;SLE — 系統性紅斑狼瘡;Ab — 抗體;AchR — 乙酰膽鹼受體;gmG — 全身性重症肌無力子研究 已納入 Descaartes™ 研究。2.目前正在 1 期試驗中進行評估。在皮肌炎、系統性紅斑狼瘡和狼瘡腎炎、系統性硬化、尋常型粘膜天皰瘡和Musk-AB陽性MG方面獲得美國食品藥品管理局快速通道認證。

嵌合抗原受體 t 細胞 自身免疫 CABA-201

Cabaletta 的 CD19 活頁夾帶有 體外和體內活性與FMC631,2(學術報告中使用的粘合劑3)相似 CABA-201:CD19-CAR t 專為自身免疫物聯網設計——研究者發起的試驗;Flu/Cy — Fludarabine/環磷酰胺 Peng,Binghao J, 等人。“CABA-201 是一種針對耐藥性自身免疫性疾病的 CD19 CAR t 的全人類 4-1Bb 療法,具有臨牀前特異性和活性。”海報發表於:美國基因與細胞療法學會第26屆年會; 2023 年 5 月 19 日;加利福尼亞州洛杉磯。戴振宇等“用於T細胞療法的新型全人源抗CD19嵌合抗原受體的開發和功能表徵。”細胞生理學雜誌 236.8(2021):5832-5847。 穆勒、法比安等“自身免疫性疾病中的CD19 CAR T細胞療法——隨訪案例系列。”新英格蘭醫學雜誌 390.8(2024):687-700。作為 CT120 的一部分進行了評估,該產品是雙 CD19xCD22 CAR t 候選產品 由南京艾索生物醫藥有限公司(IASO Bio)開發。CABA-201 中的跨膜結構域是 CD8α 與學術結構中使用的 TNFRSF19(特洛伊)的對比。這兩個跨膜結構域尚未被證明具有顯著的 臨牀前研究中功能或IFN-γ產生的差異。tisagenlecleucel 中使用了 CD8α 跨膜結構域。CABA-201 IASO 報告的腫瘤學中使用經許可的 CD19 粘合劑的臨牀數據4 經過全面人體粘合劑評估 作為具有標準 Flu/Cy 預處理的 CD22 粘合劑聯合使用迄今為止中國物聯網中約有 20 名患者報告了數據安全數據支持自身免疫發育全人類抗 CD19 粘合劑相似結合 與 FMC63 的親和力和生物活性,與相同的表位結合1,2 4-1Bb 共刺激結構域與學術研究中使用的 costim. 結構域相同 CD3-Zeta 信號域 CABA-2015

目前正在進行系統性紅斑狼瘡和肌炎試驗 正在報名,擴大產品組合,以實現 CABA-201 恢復自我耐受 (RESET™) 1/2 期試驗的潛力,這些試驗推進了 SLE — 系統性紅斑狼瘡;Dm — 皮肌炎;SSC — 系統性硬化;gMG — 全身性重症肌無力;ESRD — 終末期腎臟疾病 CABA-201 也將在尋常型天皰瘡子研究 CABA-201 ssC gmG 2024 ~8.8萬 ~5.5萬 100萬以上中年發病較為常見 伴有肺、心臟、腎損害的進行性皮膚和器官纖維化雙模式發病年齡平均存活期 12 歲 Rheum Neuro Undiscl 出現肌無力危象的風險,呼吸衰竭 1/2 期試驗 Rheum Neuro Undiscl。 美國患病率臨牀前自身免疫性疾病,其中 b 細胞起關鍵作用 SLE ~16-32萬,影響年輕女性和有色人種約 40% 患有狼瘡性腎炎,其在 10 年內死亡或 ESRD 的風險約為 25% > > > 肌炎 ~68k 典型的中年發病只有經美國食品藥品管理局批准的治療才是 Dm 中的 IvIG 由於肺部和心臟受累導致的高死亡率 >
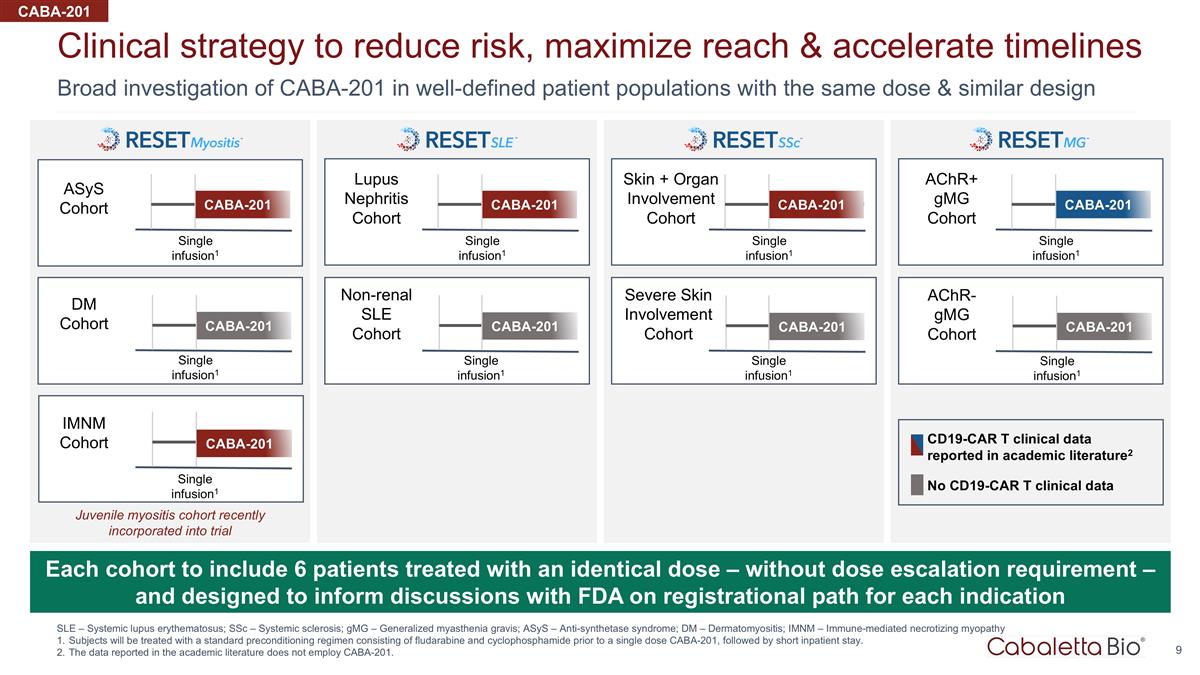
對 CABA-201 的廣泛調查 定義明確的患者羣體、相同劑量和相似設計的臨牀策略,以降低風險、最大限度地擴大覆蓋範圍並加快進度 SLE — 系統性紅斑狼瘡;ssC — 系統性硬化;gmG — 廣義 重症肌無力;ASYs — 抗合成酶綜合徵;Dm — 皮肌炎;imNM — 免疫介導的壞死性肌病受試者將接受由氟達拉濱和環磷酰胺組成的標準預處理方案進行治療 在單劑量 CABA-201 之前,隨後是短暫的住院時間。學術文獻中報告的數據不使用 CABA-201。每個隊列將包括6名接受相同劑量治療的患者——無劑量遞增要求 — 旨在為與美國食品和藥物管理局就每種適應症的註冊路徑進行的討論提供信息 CABA-201 ASYs 隊列單次輸液1 CABA-201 imnM 隊列單次輸液1 Dm 隊列 CABA-201 皮膚 + 器官受累隊列 CABA-201 achr+ gMG 隊列 CABA-201 狼瘡腎炎隊列 CABA-201 非腎性系統性紅斑狼瘡隊列嚴重皮膚受累隊列 achr-gmG 隊列 CABA-201 CABA-201 CABA-201 無 CD19-CAR t 臨牀數據 CD19-CAR t 學術文獻中報告的臨牀數據 t 臨牀數據2 單次輸液1 單次輸液 infusion1 單次輸液1 單次輸液1 單次輸液1 單次輸液1 單次輸液1 CABA-201 青少年肌炎隊列最近納入試驗
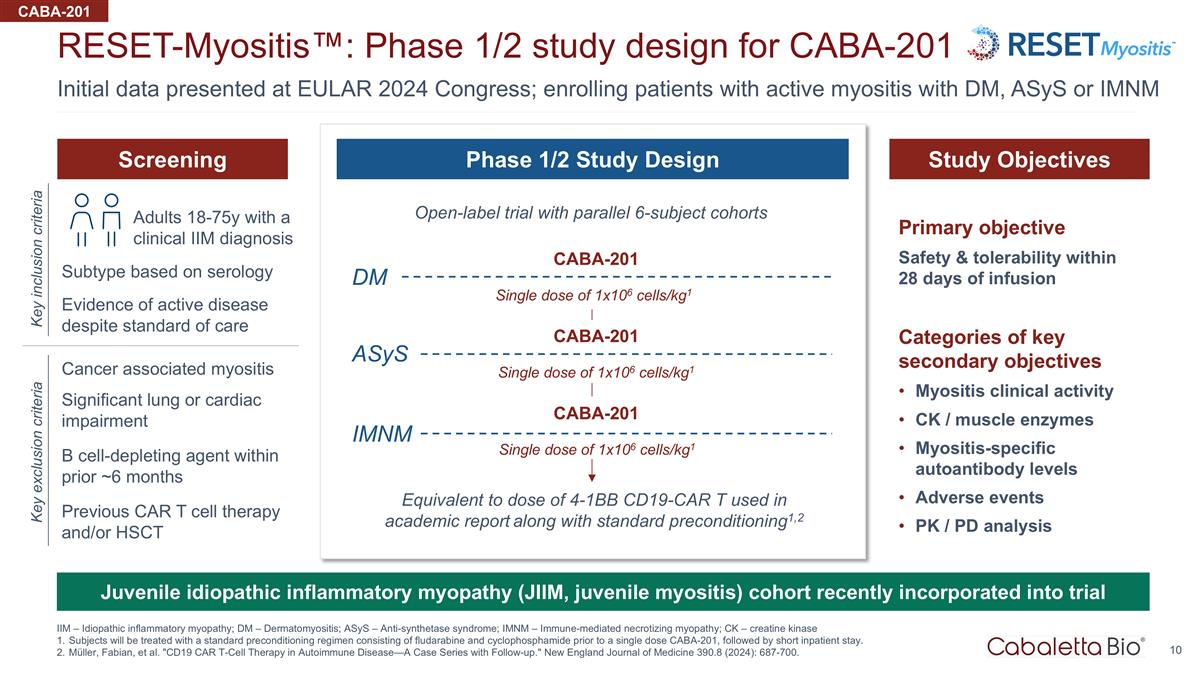
在 EULAR 上提供的初始數據 2024 年國會;招收患有 Dm、ASYs 或 imNM reset-Myositis™ 的活動性肌炎患者:CABA-201 IIM — 特發性炎性肌病;Dm — 皮肌炎;ASYS — 抗合成酶綜合徵的1/2期研究設計; imNM — 免疫介導的壞死性肌病;Ck — 肌酸激酶受試者將在單劑量 CABA-201 之前接受由氟達拉濱和環磷酰胺組成的標準預處理方案進行治療,然後是短劑量 住院。穆勒、法比安等“自身免疫性疾病中的CD19 CAR T細胞療法——隨訪案例系列。”新英格蘭醫學雜誌 390.8(2024):687-700。CABA-201 在過去約 6 個月內被視為細胞消耗劑 主要目標輸液後 28 天內的安全性和耐受性關鍵次要目標類別肌炎臨牀活性 Ck/肌肉酶肌炎特異性自身抗體水平不良事件 Pk/PD 分析開放標籤試驗 平行 6 名受試者隊列相當於學術報告中使用的 4-1Bb CD19-CAR t 劑量以及標準預先條件1,2 篩查研究目標 1/2 階段研究設計儘管有標準護理但仍存在活動性疾病的證據關鍵包括 標準癌症相關性肌炎關鍵排除標準嚴重的肺部或心臟損傷經臨牀診斷的 18-75 歲成年人單劑量 1x106 個細胞/kg1 CABA-201 單劑量 1x106 個細胞/kg1 單劑量 1x106 個細胞/kg1 CABA-201 單劑量 1x106 cells/kg1 CABA-201 Dm imNM 先前基於血清學的 CAR t 細胞療法和/或 hSCT 亞型幼年特發性炎症性肌病(JiiM,幼年肌炎)隊列最近納入試驗
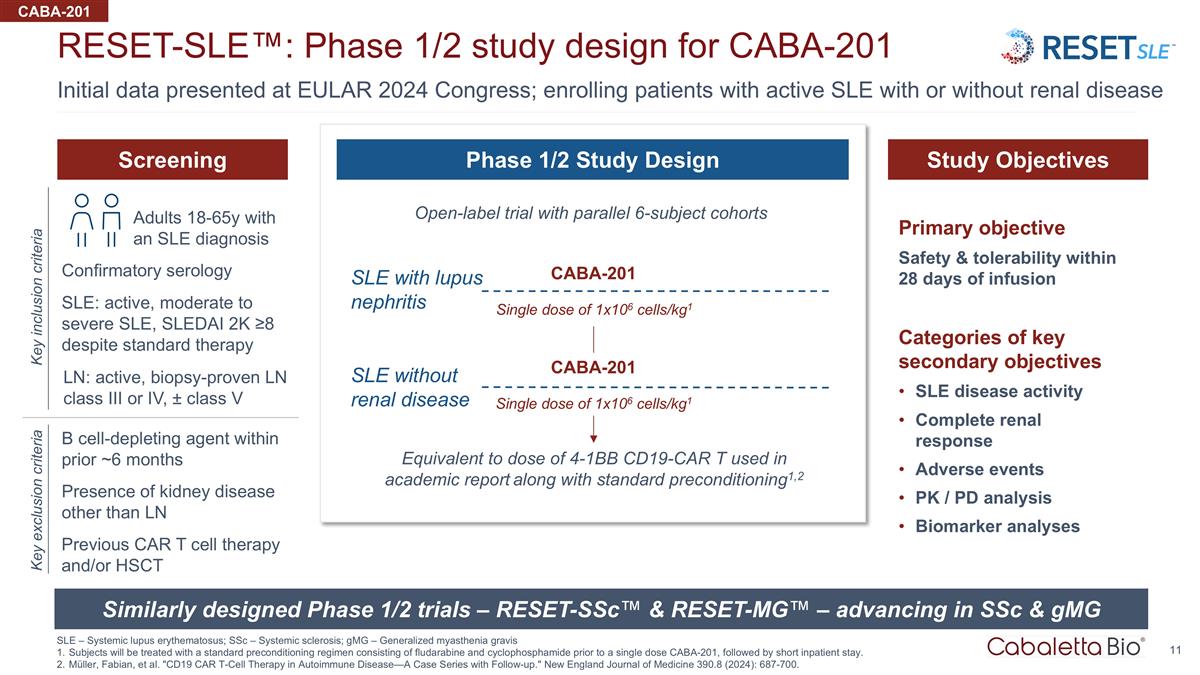
在 EULAR 上提供的初始數據 2024 年國會;招收伴或不伴有腎臟疾病的活動性系統性紅斑狼瘡患者 reset-SLE™:CABA-201 SLE — 系統性紅斑狼瘡 1/2 期研究設計;ssC — 系統性硬化;gmG — 全身性重症肌無力 在單劑量 CABA-201 之前,受試者將接受由氟達拉濱和環磷酰胺組成的標準預處理方案進行治療,然後是短期住院。穆勒、法比安等“CD19 CAR T 細胞療法在自身免疫中的應用 疾病——隨訪病例系列。”新英格蘭醫學雜誌 390.8(2024):687-700。CABA-201 SLE 伴狼瘡腎炎無腎臟疾病的 SLE 與 6 位受試者平行隊列的開放標籤試驗相當於 4-1Bb CD19-CAR T 的劑量 與標準前提條件一起用於學術報告1,2 篩選研究目標 1/2 期研究設計類似設計的 1/2 期試驗 — reset-SSC™ 和 reset-MG™ — 在 ssC 和 gMG 確認方面取得進展 血清學 b 細胞消耗劑在過去 6 個月內 SLE:活動性、中度至重度 SLE,儘管採用標準療法,SLEDAI 0.2萬 ≥8 關鍵納入標準 LN 以外的腎臟疾病的存在關鍵排除標準單劑量 1x106 cells/kg1 CABA-201 單劑量 1x106 個細胞/kg1 CABA-201 診斷為 SLE 的 18-65 歲成人主要目標輸液後 28 天內的安全性和耐受性關鍵次要目標類別系統性紅斑狼瘡疾病活動完全腎臟反應 不良事件 Pk/PD 分析生物標記物分析 LN:活性、經活檢驗證的 LN III 級或 IV 級,± V 級以前的 CAR t 細胞療法和/或 HSCT
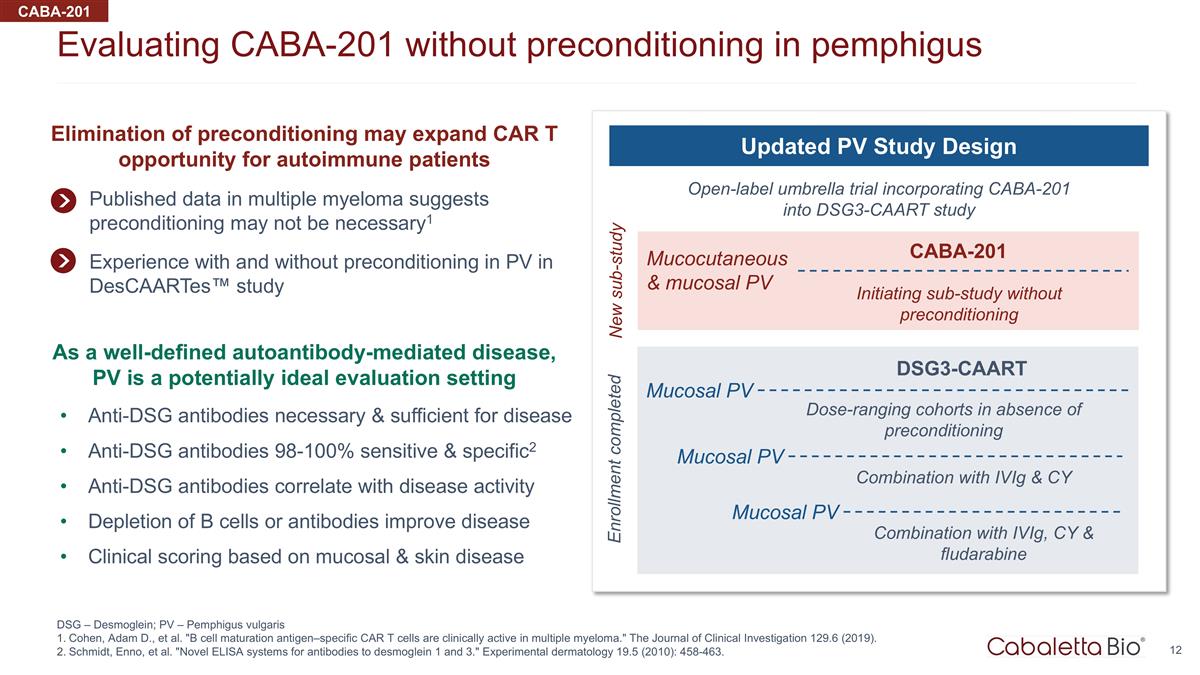
在不使用 CABA-201 的情況下評估 天皰瘡預處理 DSG — Desmoglein; PV — 尋常型天皰瘡 Cohen、Adam D. 等“b 細胞成熟抗原特異性 CAR t 細胞在多發性骨髓瘤中具有臨牀活性。”臨牀雜誌 調查 129.6 (2019)。施密特、恩諾等“用於橋粒細胞 1 和 3 抗體的新型 ELISA 系統。”實驗皮膚病學 19.5(2010):458-463。CABA-201 公佈的多發性骨髓瘤數據表明預處理可能不是 必要1 在 Descaartes™ 研究中對光伏進行預處理和未進行預處理的經驗將 CABA-201 納入 DSG3-CAART 研究的開放標籤傘式試驗更新的 PV 研究設計皮膚粘膜和粘膜 PV 在沒有皮膚和粘膜 PV 的情況下啟動子研究 預處理 CABA-201 新子研究作為一種定義明確的自身抗體介導疾病,PV 是一種潛在的理想評估設定了疾病抗 DSG 抗體所必需且足夠的 98-100% 敏感性和特異性2 抗 DSG 抗體與疾病活性相關性 b 細胞或抗體消耗可改善疾病基於粘膜和皮膚病的臨牀評分取消預處理可能會擴大自身免疫患者的 CAR t 機會 在沒有預處理的情況下,劑量範圍的隊列 dsg3-CAART 粘膜 PV 組合與 iViG 和 CY 粘膜 PV 組合以及 iViG、CY 和氟達拉濱粘膜 PV 註冊已完成
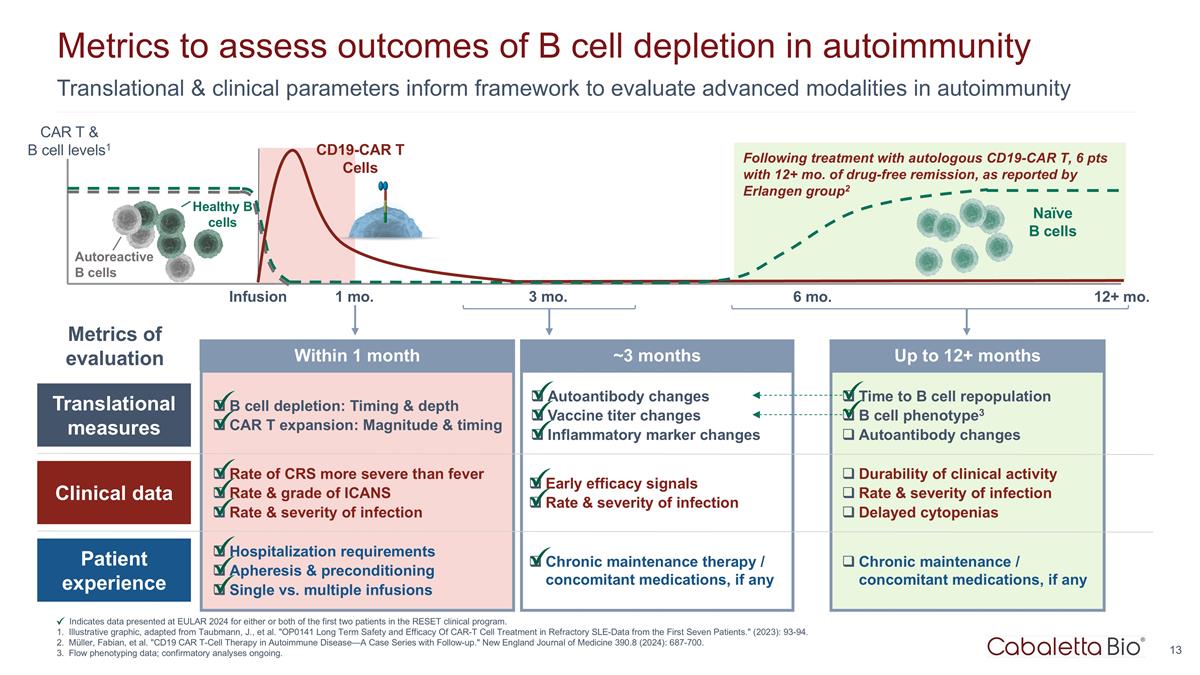
是 b 細胞重組的時候了 b 細胞 phenotype3 自身抗體變化臨牀活性的耐久性感染率和嚴重程度延遲性血細胞減少慢性維持/伴隨用藥物(如果有)長達 12 個月以上的轉化與臨牀參數為框架 評估自身免疫指標中的先進模式以評估自身免疫中b細胞消耗的結果表明在EULAR 2024上提供的有關reSET臨牀項目中前兩名患者中任一或兩名患者的數據。説明性圖形, 改編自 Taubmann, J. 等人。“OP0141 在前七名患者的難治性 SLE-數據中CAR-T細胞治療的長期安全性和有效性。”(2023年):93-94。穆勒、法比安等“CD19 CAR T 細胞療法在自身免疫性疾病中的應用—— 附有後續行動的案例系列。”新英格蘭醫學雜誌 390.8(2024):687-700。流量表型數據;確認性分析正在進行中。據報道,在使用自體 CD19-CAR t 治療後,6 分,無藥物緩解期超過 12 個月 Erlangen group2 輸液 1 個月 3 個月 12+ 第 6 個月CD19-CAR t Cells Naíve b 細胞健康 b 細胞自反應 b 細胞 CAR t 和 b 細胞水平1 轉化測量臨牀數據 b細胞消耗患者體驗:時間和深度 CAR T 擴展:CRS 的幅度和時機比發燒更嚴重的比率和 ICANS 的等級感染率和嚴重程度住院要求血液分離和預處理單次輸液與多次輸液自身抗體變化疫苗 滴度變化炎症標誌物變化早期療效信號感染率和嚴重程度慢性維持治療/伴隨藥物(如果有)在 1 個月內~3 個月內評估指標
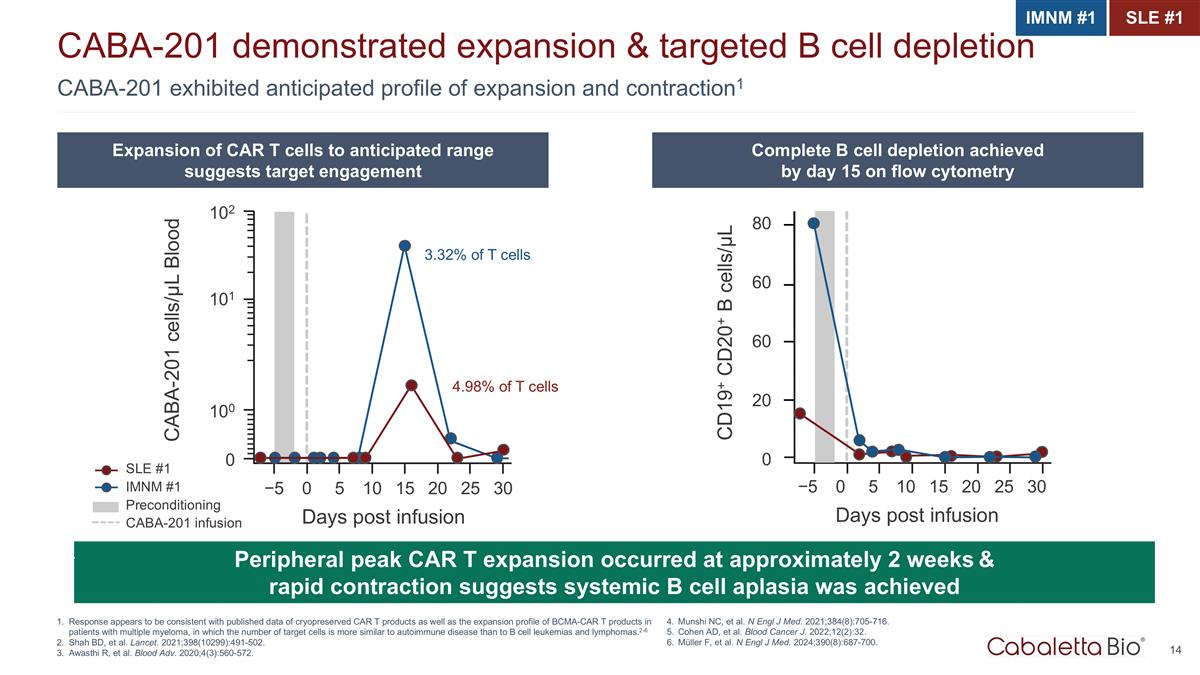
CABA-201 預計展出 膨脹和收縮概況1 CABA-201 顯示了膨脹和靶向 B 細胞耗盡反應似乎與冷凍保存的 CAR T 產品的已發佈數據以及 BCMA-CAR T 產品的膨脹概況一致 多發性骨髓瘤患者,其中靶細胞的數量與自身免疫性疾病的數量比 B 細胞白血病和淋巴瘤更相似。2-6 Shah BD 等人。《柳葉刀》,2021;398(10299):491-502。Awasthi R 等人。Blood Adv.2020; 4 (3): 560-572。 IMNM #1 SLE #1 CAR T 細胞擴展到預期範圍表明靶向參與流式細胞術在第 15 天完成了 B 細胞耗竭外周峯值 CAR T 擴張發生在大約 2 周且快速收縮表明 全身 B 細胞再生障礙實現了 4.98% 的 T 細胞 3.32% CABA-201 細胞/µL 血液 102 101 100 0 −5 0 5 10 15 20 25 30 天輸液後 SLE #1 IMNM #1 預處理 CABA-201 輸液 CD19+ CD20+ B 細胞/µL 60 80 60 20 0 −5 0 5 10 15 20 25 30 天輸液後 Munshi NC 等人N Engl J Med. 2021; 384 (8): 705-716。Cohen AD 等人《血液癌》雜誌,2022年;12(2):32。Müller F 等人。N Engl J Med. 2024; 390 (8): 687-700。
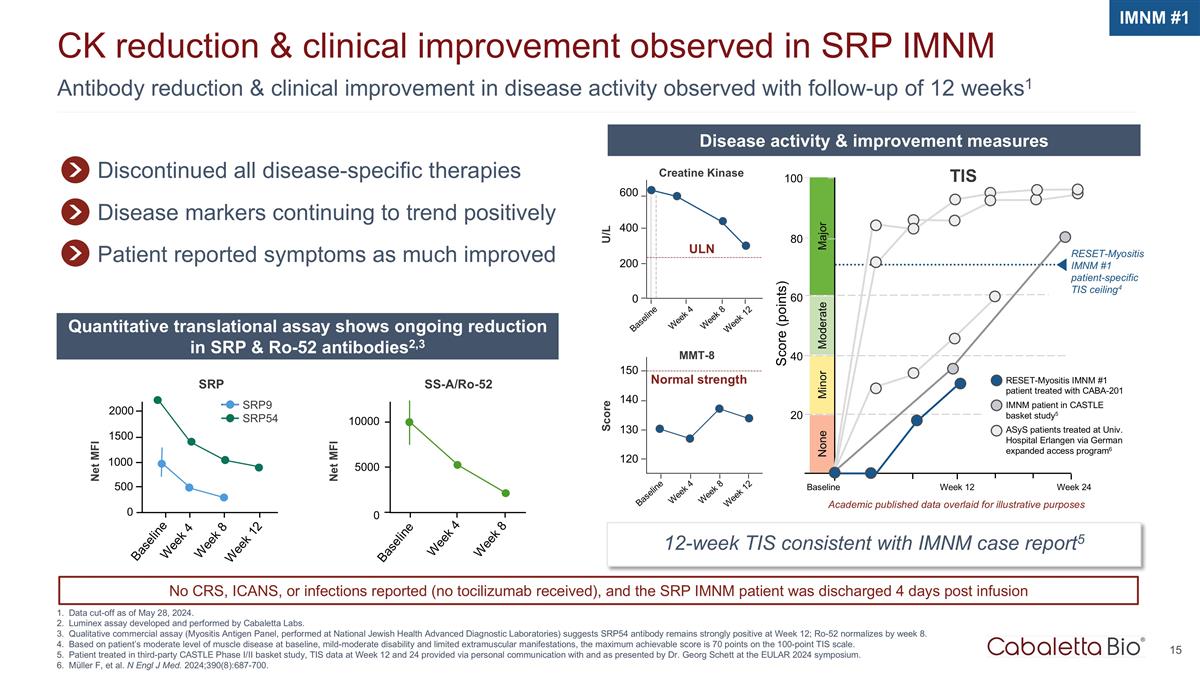
抗體還原和臨牀 截至2024年5月28日,在SRP iMNM數據截止日期中觀察到的12周隨訪1Ck減少和臨牀改善,觀察到疾病活動有所改善。Luminex 檢測由 Cabaletta Labs 開發和執行。定性商業試驗 (在國家猶太人健康高級診斷實驗室進行的肌炎抗原小組)顯示,SRP54 抗體在第 12 周保持強勁陽性;Ro-52 到第 8 周恢復正常。基於患者中等程度的肌肉疾病 基線、輕度至中度殘疾和有限的肌外表現,根據TIS的100分量表,最高可達到的分數為70分。在第三方 CASTLE I/II 期籃子研究中接受治療的患者,第 12 周和第 24 周的 TIS 數據通過 與 Georg Schett 博士在 EULAR 2024 年研討會上的個人溝通,並由他主持。Müller F 等人N Engl J Med. 2024; 390 (8): 687-700。iMNM #1 已停止所有疾病特異性療法疾病標誌物繼續呈正向趨勢 患者報告的症狀大大改善了疾病活性和改善措施定量轉化分析顯示 SRP 和 Ro-52 抗體持續減少2,3 12 周 TIS 與 iMNM 病例報告一致 5 基線周 4 ULN U/L 600 400 0 第 8 周 12 周肌酸激酶正常強度 mmt-8 150 140 130 120 基線周 4 周第 8 周 12 分主要分數(分數)100 80 輕度中度 60 40 20 周基線周 12 無重置肌炎 imnM #1 患者特異性 TIS ceiling4 TIS reset-myositis imnM #1 患者在 CASTLE basket 研究中與 CABA-201 imNM 患者一起接受治療 5 ASYs 患者在大學接受治療埃爾蘭根醫院通過德國擴大准入計劃6 學術界發佈的數據疊加用於説明目的 SRP9 SRP54 SS-a/RO-52 第 8 周第 4 周基線 10000 5000 0 第 8 周基線 1500 500 2000 周 12 1000 0 Net MFI Net MFI SRP 未報告 CRS、ICANS 或感染情況(未收到託珠單抗),SRP iMNM 患者在 4 天后出院 輸液
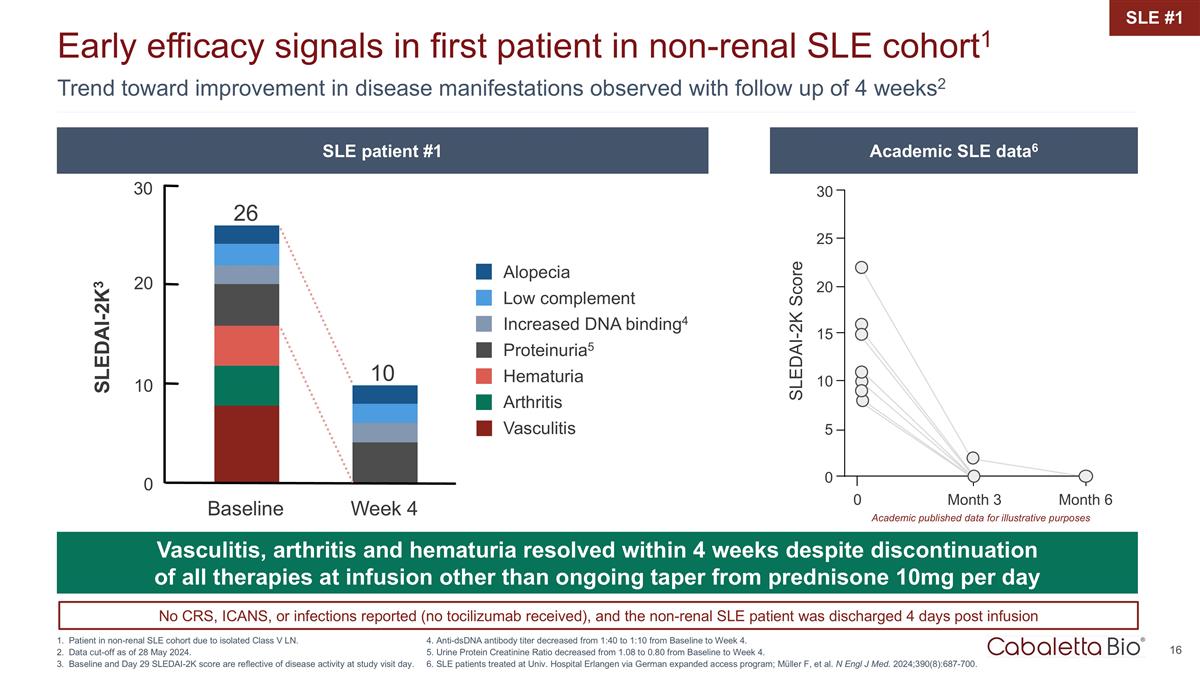
0 0 個月 3 個月 6 個 SLEDAI-0.2萬分數 25 20 30 10 5 15 學術界發佈的數據用於説明目的 4 周隨訪觀察到的疾病表現有改善的趨勢2 非腎性系統性紅斑狼瘡隊列中首位患者的早期療效信號 1 非腎性系統性紅斑狼瘡患者 由於孤立的 V 類 LN 而導致的隊列。截止日期為 2024 年 5 月 28 日。基線和第29天的SLEDAI-0.2萬分數反映了研究訪問當天的疾病活動。SLE #1 儘管停藥,但血管炎、關節炎和血尿在 4 周內得到緩解 在所有輸液療法中,除了持續逐漸減少潑尼鬆 10 毫克每天 10 毫克脱髮低補體增加了 DNA 結合4 proteinuria5 血尿關節炎血管炎 26 10 20 SLEDAI-2K3 10 0 基線周 4 30 SLE 患者 #1 Academic SLE 患者 Academic SLE data6 4.從基線到第 4 周,抗 dsDNA 抗體滴度從 1:40 降至 1:10。5.從基線到第4周,尿蛋白肌酐比率從1.08降至0.80。6.在大學接受治療的系統性紅斑狼瘡患者通過德國擴建的埃爾蘭根醫院 訪問程序;Müller F 等N Engl J Med. 2024; 390 (8): 687-700。未報告CRS、ICANS或感染(未接受託珠單抗),非腎性系統性紅斑狼瘡患者在輸液 4 天后出院
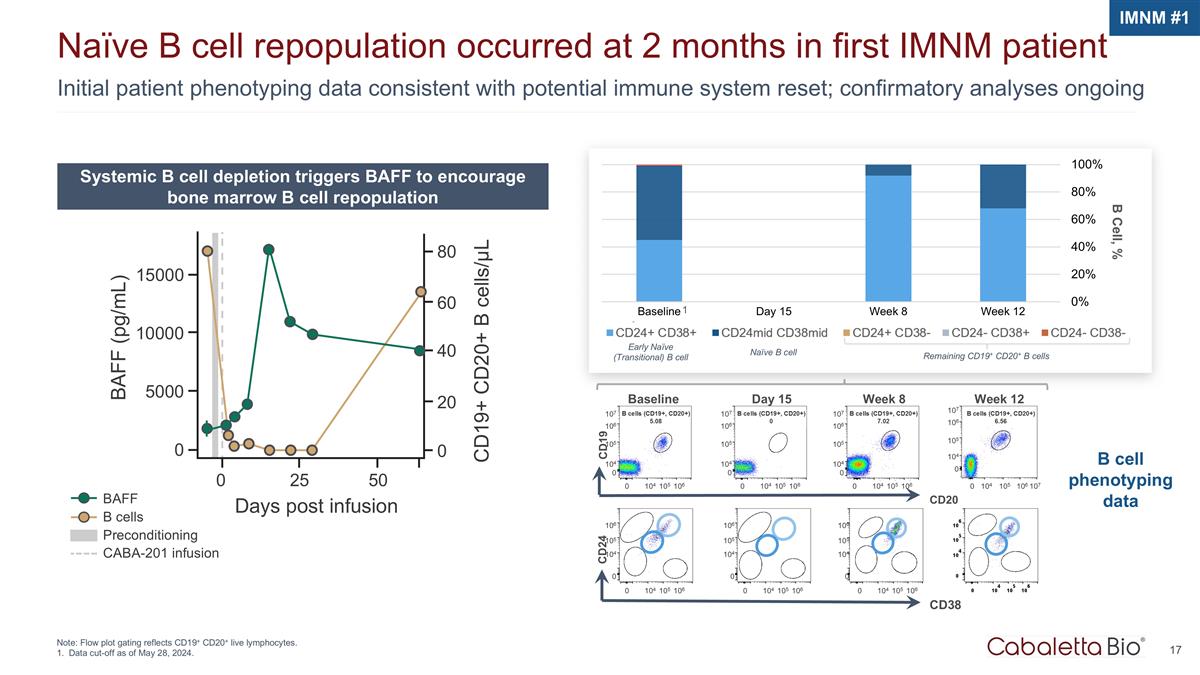
BAFF b 細胞預處理 CABA-201 輸液初始患者表型數據與潛在的免疫系統重置一致;確認性分析仍在進行中 Naíve b 細胞重組發生在首位 imNM 患者 2 個月時注意:流程圖門控反映 CD19+ CD20+ 活淋巴細胞。截止日期為2024年5月28日。系統性 b 細胞消耗觸發 BAFF 促進骨髓 b 細胞重組 imnM #1 15000 10000 5000 0 0 25 50 天輸液後 CD19+ CD20+ b 細胞/µL BAFF (pg/mL) 80 60 40 20 0 B 細胞,% CD20 基線 CD19 107 106 105 104 0 0 0 104 106 1050細胞(CD19+、CD20+)5.08 周 12 107 106 104 0 0 104 0 104 0 104 104 0 104 104 0 104 104 0 104 0 第 8 周 107 106 105 104 0 0 周 8 107 106 104 0 0 104 106 1050細胞(CD19+,CD20+)7.02 CD38 CD24 106 106 104 0 0 0 104 106 106 105 105 105 105 104 0 0 104 0 104 0 0 0 0 104 0 0 104 0 0 104 104 0 0 104 104 104 106 1050細胞表型數據 1 早期天真(過渡)b 細胞天真 b 細胞剩餘 CD19+ CD20+ b 細胞

分階段的方法允許 有效配置資本,同時利用經驗豐富的合作伙伴製造戰略後期和商業化:擴大規模和商業化數據門控、分階段投資早期階段:賓夕法尼亞大學、CDMO和CABA流程正在進行賓夕法尼亞大學有 多年來可靠地提供及時的產品擴大了載體和細胞產品供應方面的商用CDMO合作伙伴關係工藝開發工作步入關鍵研究的商業化就緒流程評估實現商業化就緒的路徑 製造:擴大CDMO關係自動化製造的機會卡巴萊塔運營的工廠戰略合作伙伴關係持續關注創新以解決規模問題內部計劃Cellares技術評估計劃 先進的
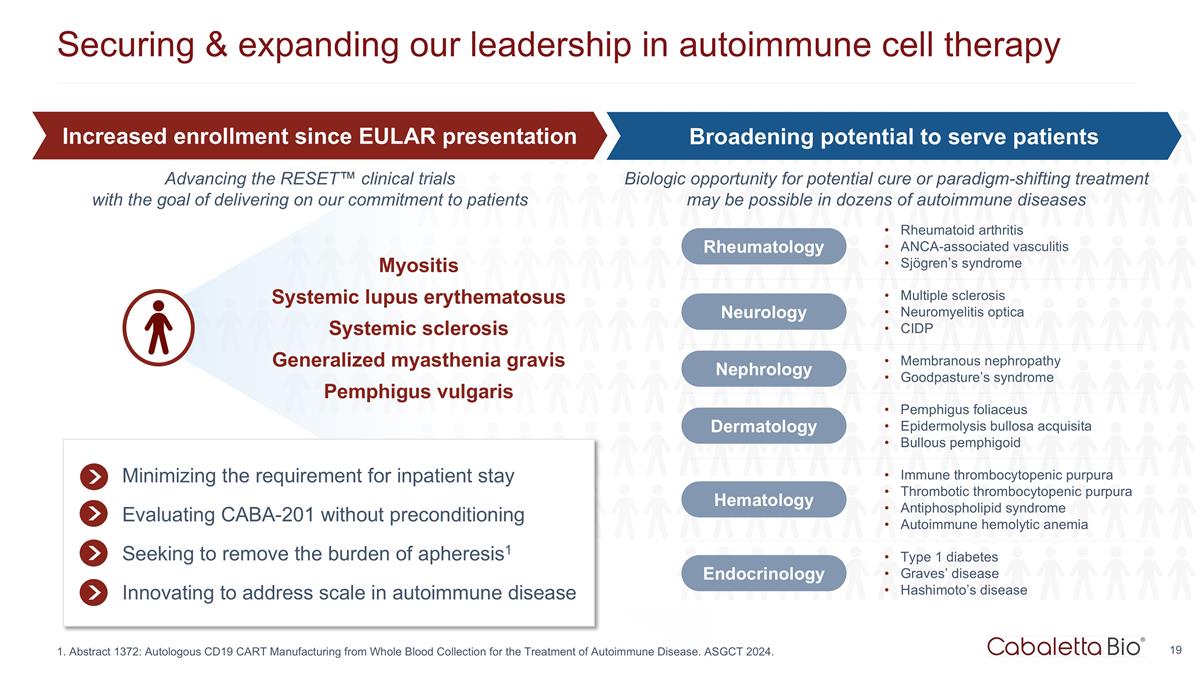
保護和擴展我們的 自身免疫細胞療法的領導地位肌炎系統性紅斑狼瘡系統性硬化症全身性肌無力重症尋常型天皰瘡儘量減少住院要求無需預處理即可評估 CABA-201 消除血管失調的負擔1 創新解決自身免疫性疾病的規模問題免疫性血小板減少性紫癜血栓性血小板減少性紫癜抗磷脂綜合徵自身免疫性溶血性貧血血液學 1 型糖尿病 Graves' 疾病橋本氏病內分泌學風濕病學類風濕關節炎 ANCA 相關血管炎 Sjögren 綜合徵神經病學多發性硬化視神經脊髓炎 CIDP 腎臟病膜性腎病 Goodpasture's 綜合徵皮膚科葉型天皰瘡 Epidermolysis bullosa acquisita bullosa acquisita 大皰性類天皰瘡自 EULAR 出現以來入學人數增加擴大為患者服務的潛力擴大潛在治癒或改變模式的治療的生物學機會 可能用於數十種自身免疫性疾病推進RESET™ 臨牀試驗,目標是兑現我們對患者的承諾 1.摘要 1372:通過採集全血來製造自體 CD19 cART 進行治療 自身免疫性疾病。ASGCT 2024。

企業摘要

運營成功記錄 評估自身免疫領域的新型細胞療法候選藥物 Cabaletta Bio 領導團隊 Anup Marda 首席財務官 Arun Daswand.D. 首席商務官 David J. Changwan.D.D.萬.P.H.,FACR 首席醫學官瑪莎·奧康納 首席人力資源官邁克爾·傑拉德總法律顧問史蒂芬·尼希特伯格萬德總裁、首席執行官兼董事長希瑟·哈特-霍爾首席合規官薩米克·巴蘇萬德首席科學官格温多琳·賓德博士科學與技術總裁 科學顧問委員會 Aimee Paynewand.D.,博士,聯合創始人兼聯席主席 Michael C. Milonewand.D.,博士聯合創始人兼聯席主席 Carl Junewand.D. Jay Siegelwand.D. Brian Danielswand.D.,Drew Weissmanwand.D.,博士。Iain McInnes,博士,FRCP,FRSE, FMedSci Georg Schettwand.D. 董事會 Steven Nichtbergerwand.D. Richard Henriques Scott Brunwand.D. Mark Simon Catherine Bollardwand.D.《財富》雜誌的肖恩·託馬塞洛。©2023 財富媒體知識產權有限公司。版權所有。經許可使用。 Sarah Yuan 首席技術官
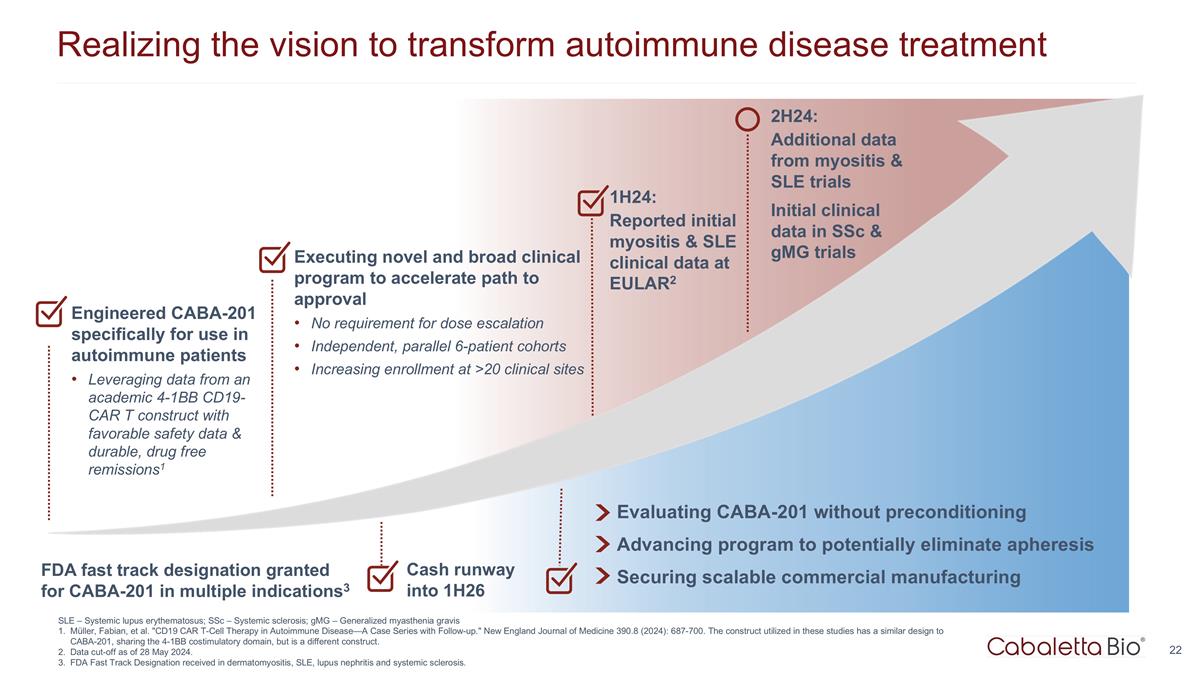
實現變革願景 自身免疫性疾病治療 1H24:在 EULAR2 上報告的初步肌炎和系統性紅斑狼瘡臨牀數據在沒有預處理的情況下評估 CABA-201 推進可能消除血液分離的計劃確保可擴展的商業製造 Cash Runway 進入 1H26 專為自身免疫患者設計的 CABA-201 利用來自學術界 4-1Bb CD19-CAR t 結構的數據,具有良好的安全數據和耐用的無藥物緩解措施1 執行新穎而廣泛的臨牀計劃,以 加快獲得批准的路徑無需增加劑量獨立的、平行的 6 名患者羣組 2H24 年增加 >20 個臨牀場所的入學人數:來自肌炎和系統性紅斑狼瘡試驗的更多數據 ssC 和 GmG 試驗的初始臨牀數據 美國食品藥品管理局批准了多種適應症的 CABA-201 快速通道認證3 SLE — 系統性紅斑狼瘡;ssC — 系統性硬化症;gmG — 全身性重症肌無力 Müller、Fabian 等“CD19 CAR T 細胞療法 自身免疫性疾病——隨訪病例系列。”新英格蘭醫學雜誌 390.8(2024):687-700。這些研究中使用的結構與 CABA-201 的設計相似,共享 4-1Bb 共刺激域,但有所不同 構造。截止日期為 2024 年 5 月 28 日。在皮肌炎、系統性紅斑狼瘡、狼瘡腎炎和系統性硬化症方面獲得了 FDA 快速通道認證。

八月企業演講 2024