

2023 年 12 月 PRECISION1 三分之一 中期分析 NAB-sirolimus 的 PRECISION1 試驗顯示 TSC1 或 TSC2 失活改變對多種實體瘤具有抗腫瘤活性,表現出 99.2

前瞻性陳述肯定 本演示文稿中包含的關於非歷史事實事項的陳述,是經修訂的1934年《證券交易法》第21E條和私人證券訴訟所指的前瞻性陳述 1995 年法案,被稱為 PSLRA。其中包括有關管理層意圖、計劃、信念、預期或未來預測的聲明,因此,提醒您不要過分依賴它們。前瞻性 聲明可能包括但不限於以下方面的聲明:Aadi Bioscience, Inc.(“Aadi”)臨牀試驗的預計開始、註冊、數據發佈和完成時間,包括預期的全面臨牀試驗 在 2024 年春季之前註冊 PRECISION 1 試驗,預計 PRECISION 1 在 2024 年第三季度進行三分之二的中期分析,PRECISION1 研究預計在 2024 年底之前完成,最終的 PRECISION1 數據預計將在年初公佈 2025 年;管理層認為公司有望在 PRECISION 1 研究中提供更多臨牀證據,並推進nab-sirolimus的註冊進程;監管機構申報和批准的時間和可能性 新適應症的FYARRO;基於Aadi臨牀試驗數據的潛在催化劑的預期時機;Aadi的預期現金流;Aadi成為領先精準腫瘤公司的潛力;以及預測 伴有TSC1和TSC2改變的癌症的年發病率及相關的市場機會。任何前瞻性陳述都無法保證,實際結果可能與預期有重大差異。Aadi 使用諸如此類的詞語 “預期”、“相信”、“計劃”、“期望”、“項目”、“打算”、“可能”、“將”、“應該”、“可能”、“估計” “預測”、“潛力”、“繼續” 和類似表述來識別PSLRA安全港條款所涵蓋的這些前瞻性陳述。此類前瞻性陳述 基於我們的預期,涉及風險和不確定性;因此,由於多種因素,包括但不限於不確定性,實際結果可能與聲明中表達或暗示的結果存在重大差異 與FYARRO的臨牀開發和監管批准有關,包括臨牀試驗開始、註冊和完成方面的潛在延遲;與發佈中期、頭條和初步數據相關的風險 臨牀試驗;Aadi開發和商業化FYARRO®(nab-sirolimus,ABI-009)的計劃;Aadi的商業化、營銷和製造能力和戰略;臨牀效用、潛在優勢和市場 對FYARRO的接受;與Aadi現金餘額足以為運營提供資金相關的風險;Aadi研究、開發和商業化其當前和未來候選產品的計劃;Aadi識別其他候選產品的能力 具有巨大商業潛力的產品或候選產品;與市場規模、Aadi的競爭對手及其行業相關的發展和預測;政府法律法規的影響;Aadi保護其的能力 知識產權狀況;以及Aadi對未來收入、支出、資本要求和額外融資需求的估計。Aadi的 “風險因素” 標題下詳細描述了這些風險 截至2023年9月30日的季度10-Q表季度報告於2023年11月8日提交給美國證券交易委員會(“SEC”),以及不時向美國證券交易委員會提交的其他文件。前瞻性 本演示文稿中包含的陳述基於Aadi截至本演示之日獲得的信息。除非法律要求,否則Aadi沒有義務修改或更新任何前瞻性陳述,無論結果如何 新信息、未來事件或其他信息。
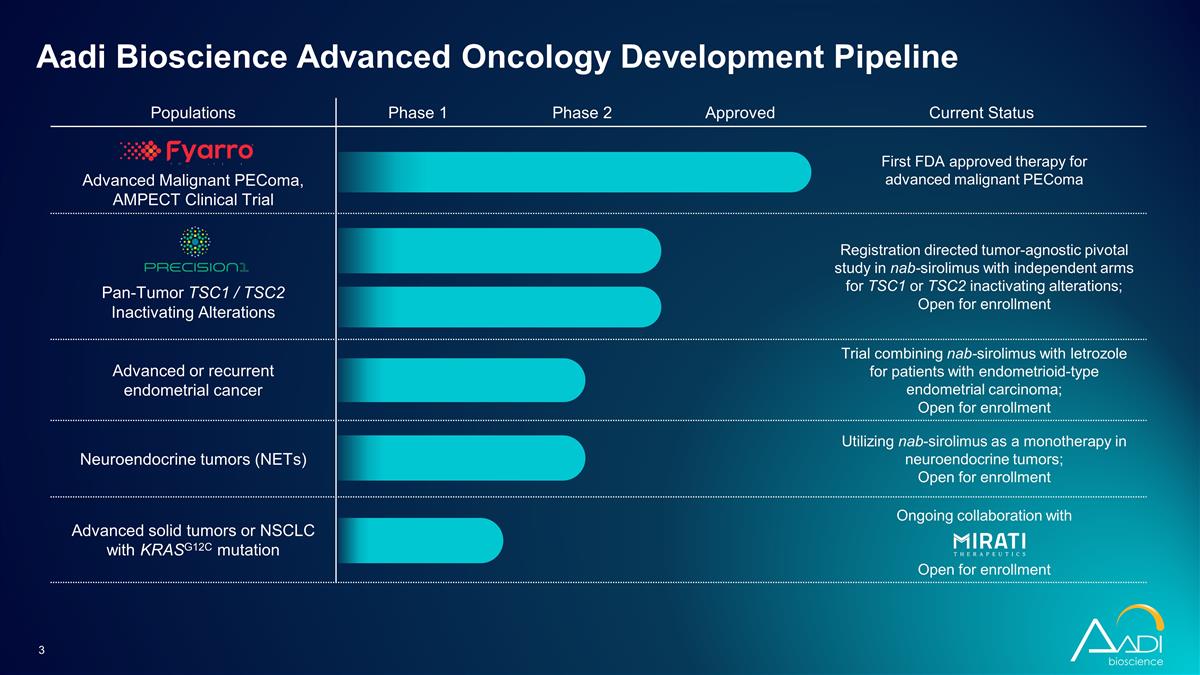
人羣第 1 階段第 2 階段已獲批准 當前狀態晚期惡性 pecoMA,AMPect 臨牀試驗首個 FDA 批准的晚期惡性 peeComa 泛腫瘤療法 TSC1/TSC2 滅活改變註冊指導腫瘤的與腫瘤無關的關鍵性研究 nab-sirolimus 針對 TSC1 或 TSC2 失活變異的獨立分組;開放報名泛腫瘤 TSC2 失活改變針對子宮內膜樣型患者的晚期或複發性子宮內膜癌試驗 nab-sirolimus 和來曲唑聯合使用 nab-sirolimus 和 letrozole 子宮內膜癌;開放註冊神經內分泌腫瘤 (NET) 利用 nab-sirolimus 作為神經內分泌腫瘤的單一療法;開放註冊帶有 KRASG12C 突變的晚期實體瘤或 NSCLC 正在與 Open 合作 供註冊 Aadi Bioscience 高級腫瘤學開發管線

TSC1 和 TSC2 變更:密鑰 mTOR 途徑中的致癌驅動因素 mTOR 信號通路 mTOR S0.6萬 4EBP1 Rheb Raptor PDK1 ampK Akt TSC1/ TSC2 LKB1 (STK11) eRk Mek Raf Ras 在 TSC1 和 TSC2 中的失活突變驅動 mTOR 通路激活和腫瘤生長 TSC1 和 TSC2 是 PI3K/AKT/mTOR 途徑中 mTOR 活性的上游調節劑 TSC1 和 TSC2 突變在癌症中發生的速度約為 2%,每年約為 16,000 例新發病例。沒有批准針對 TSC1 和 TSC2 突變患者的療法,但有大量的病例報告 對 mTOR 抑制的持久反應經過 CLIA 認證的 NGS 試劑盒已經捕獲了 TSC1 和 TSC2 突變,經常在癌症和/或經過驗證的靶標中發生突變
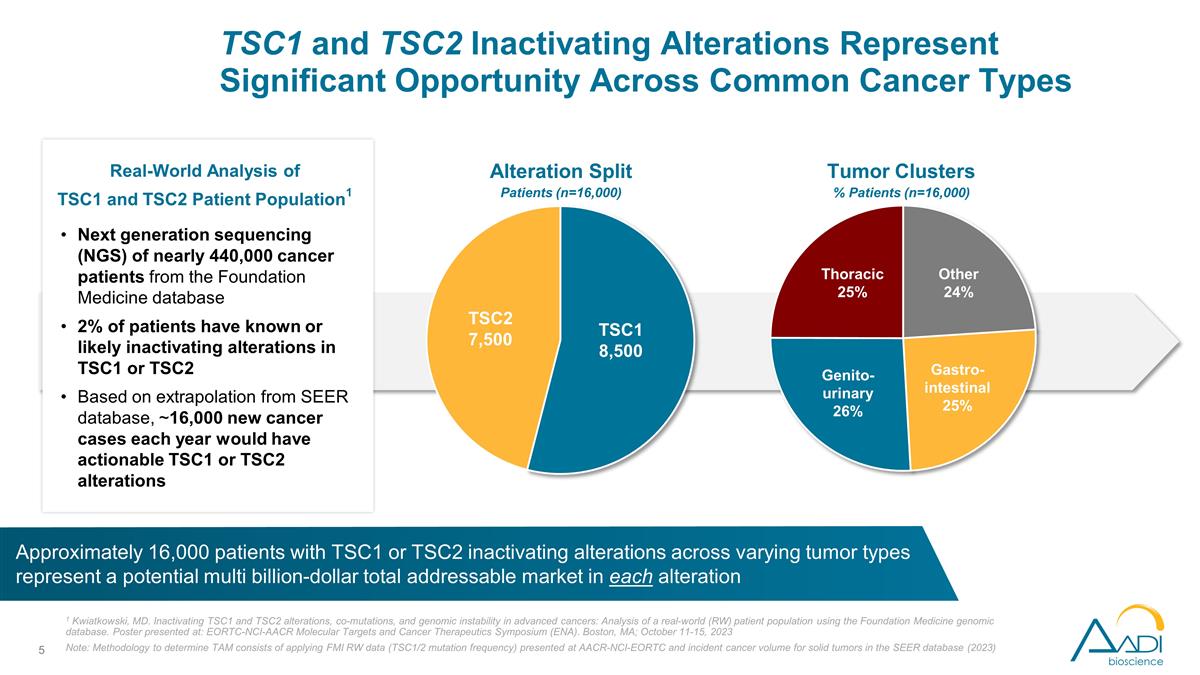
的下一代測序(NGS) 來自基金會醫學數據庫的近44萬名癌症患者2%的患者已知或可能出現TSC1或TSC2的失活變化。根據SEER數據庫的推斷,每年約有16,000例新的癌症病例可以採取行動 TSC1 或 TSC2 改動 1 馬裏蘭州夸特科夫斯基使晚期癌症的TSC1和TSC2改變、共同突變和基因組不穩定性失活:使用基礎醫學基因組數據庫分析現實世界(RW)患者羣體。海報 發表於:EORTC-NCI-AACR分子靶標和癌症治療研討會(ENA)。馬薩諸塞州波士頓;2023 年 10 月 11 日至 15 日注意:確定 tAM 的方法包括應用在 AACR-NCI-EORTC 上提供的 FMI RW 數據(TSC1/2 突變頻率)以及 SEER 數據庫中實體瘤的癌症發病量 (2023) TSC1 和 TSC2 患者羣體的真實世界分析1 大約有 16,000 名不同腫瘤類型的 TSC1 或 TSC2 失活改變的患者有潛力 每種變異的潛在市場總額為數十億美元腫瘤集羣百分比患者(n = 16,000)TSC1 和 TSC2 失活改變代表了常見癌症類型改變的重大機遇分裂患者(n=16,000)TSC1 8,500
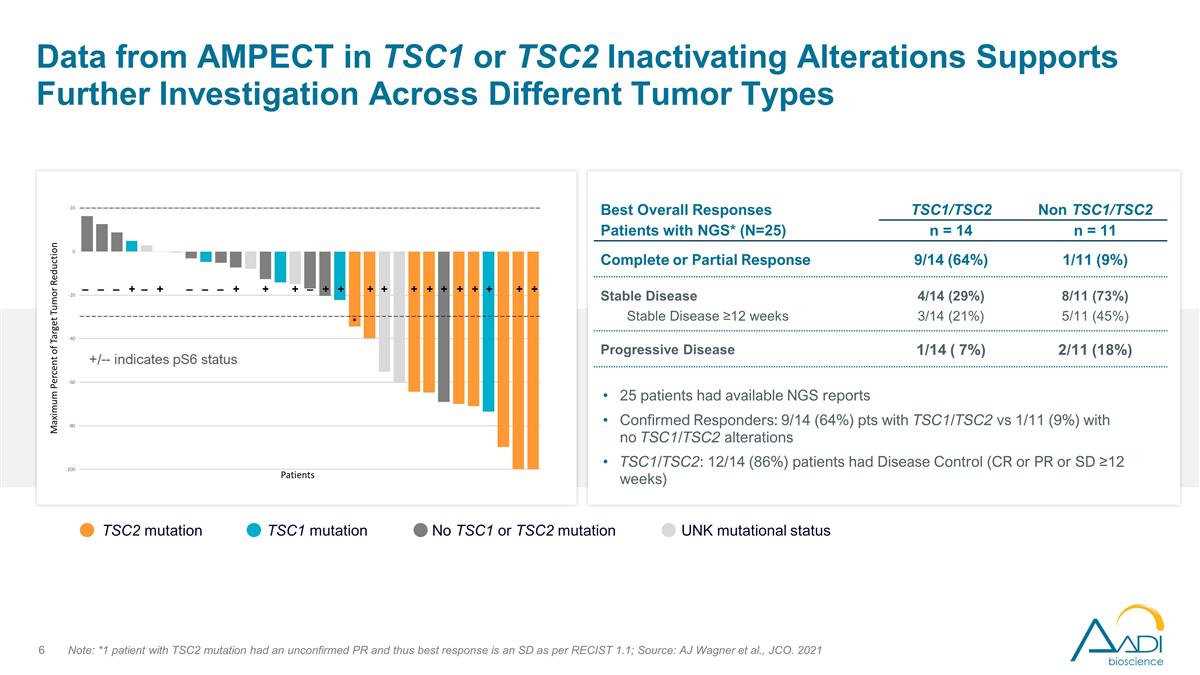
來自 Ampect 在 TSC1 或 TSC2 中的數據 失活改變支持對不同腫瘤類型的進一步研究注意:*1 名 TSC2 突變患者的 PR 未經證實,因此根據 reCist 1.1,最佳反應是 SD;來源:AJ Wagner 等人,JCO。2021 年 TSC2 突變 TSC1 突變沒有 TSC1 或 TSC2 突變 unK 突變狀態 25 名患者有 NGS 報告已確診的應答者:9/14 (64%) pts 有 TSC1/TSC2 與沒有 TSC1/TSC2 改變的 1/11 (9%) pts TSC1/TSC2:12/14 (86%) 患者患有疾病控制 (CR 或 PR 或 SD ≥12 周)最佳總體反應患者 NGS* (N=25) TSC1/TSC2 非 TSC1/TSC2 n = 14 n = 11 完全或部分反應 9/14 (64%) 1/11 (9%) 穩定疾病 4/14 (29%) 8/11 (73%) ≥12 周 3/14 (21%) 5/11 (45%) 進行性疾病 1/14 (7%) 2/11 (18%)

PRECISION1:直接註冊 nab-sirolimus 在 TSC1 或 TSC2 失活改變(N = ~60)(N = ~60)中的腫瘤無關試驗 A 組:TSC1 組 B:TSC2 關鍵資格標準轉移性或局部晚期疾病沒有資格接受手術 mTOR 抑制劑治療 通過 NGS 發現的致病性 TSC1 或 TSC2 失活變異必須接受過該疾病的標準療法,或者研究人員認為不太可能受益 PRECISION1 試驗二項可獨立評估的組,TSC1 和 TSC2 各一個 主要終點:通過盲目獨立放射學審查進行的 ORR 根據當地 NGS 結果計算的患者累積量第一位患者於 2022 年 3 月給藥,預計入組期為 24 個月
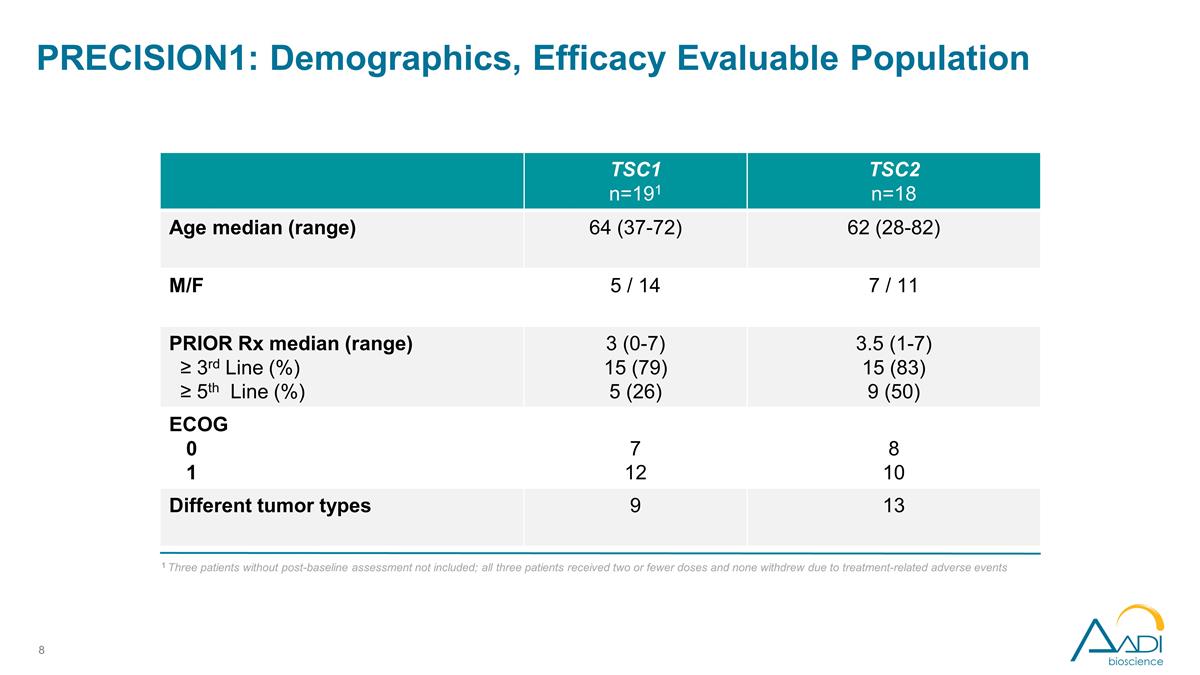
PRECISION1:人口統計、功效 可評估人羣 1 不包括三名未進行基線後評估的患者;所有三名患者均接受了兩劑或更少的劑量,沒有人因治療相關的不良事件而退出 TSC1 n=191 TSC2 n=18 年齡中位數(範圍)64 (37-72) 62 (28-82) M/F 5/14 7/11 PRIOR Rx 中位數(範圍)≥ 第 3 線 (%) ≥ 第 5 線 (%) 3 (0-7) 15 (79) 5 (26) 3.5 (1-7) 15 (83) 9 (50) ECOG 0 1 7 12 8 10 不同的腫瘤類型 9 13
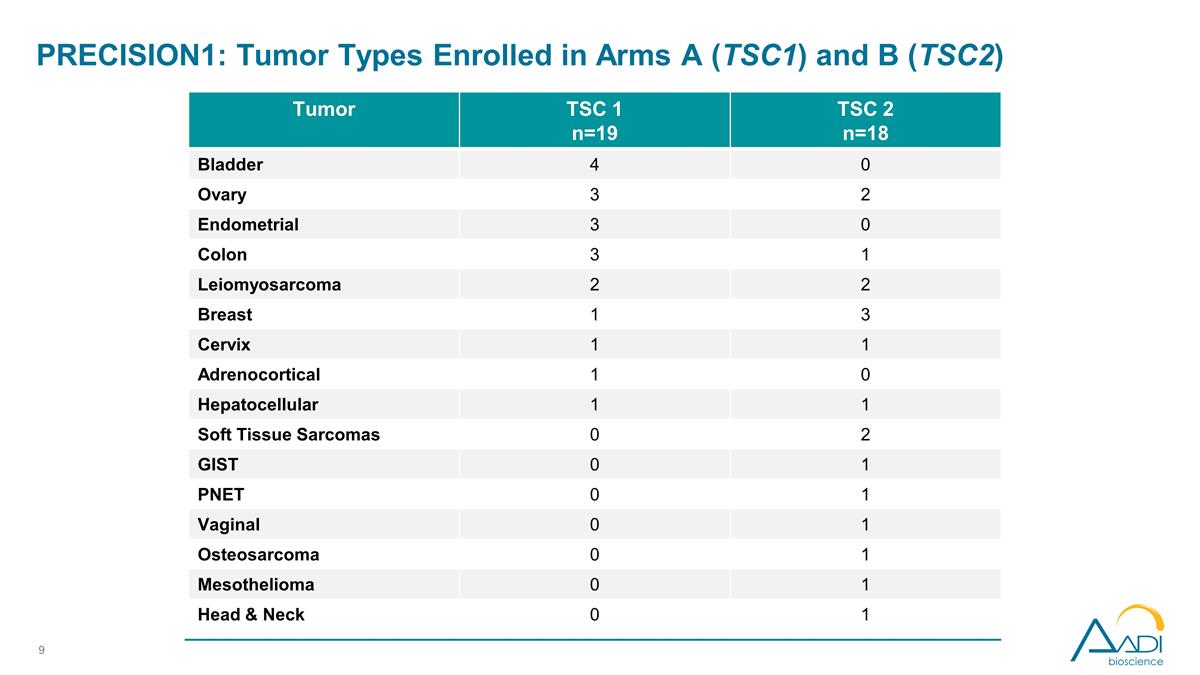
PRECISION1:登記的腫瘤類型 手臂 A (TSC1) 和 b (TSC2) 腫瘤 TSC 1 n=19 TSC 2 n=18 膀胱 4 0 卵巢 3 2 子宮內膜 3 0 結腸 3 1 平滑肌肉瘤 2 2 2 乳房 1 3 子宮頸 1 1 腎上腺皮質 1 0 0 肝細胞 1 1 軟組織肉瘤 0 2 GiST 0 1 Pnet 0 1 陰道 0 1 骨肉瘤 0 1 間皮瘤 0 1 頭部和頸部 0 1
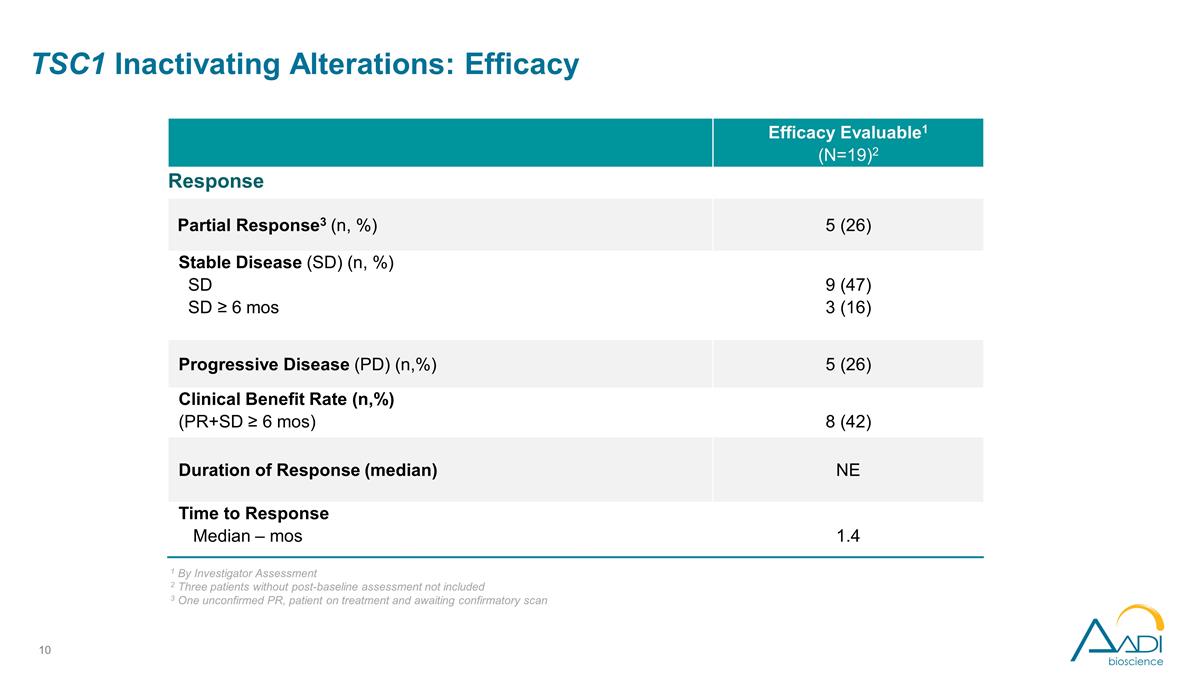
TSC1 停用改動: 療效療效可評估1 (N=19) 2 緩解部分反應3 (n,%) 5 (26) 穩定疾病 (SD) (n,%) SD ≥ 6 mos 9 (47) 3 (16) 進展性疾病 (PD) (n,%) 5 (26) 臨牀獲益率 (n,%) (PR+SD ≥ 6 個月) 8 (42) 持續時間 緩解率(中位數)NE 反應時間中位數 — mos 1.4 1 根據研究者評估 2 不包括三名未進行基線後評估的患者 3 一名未經證實的 PR、正在接受治療並等待確認掃描的患者
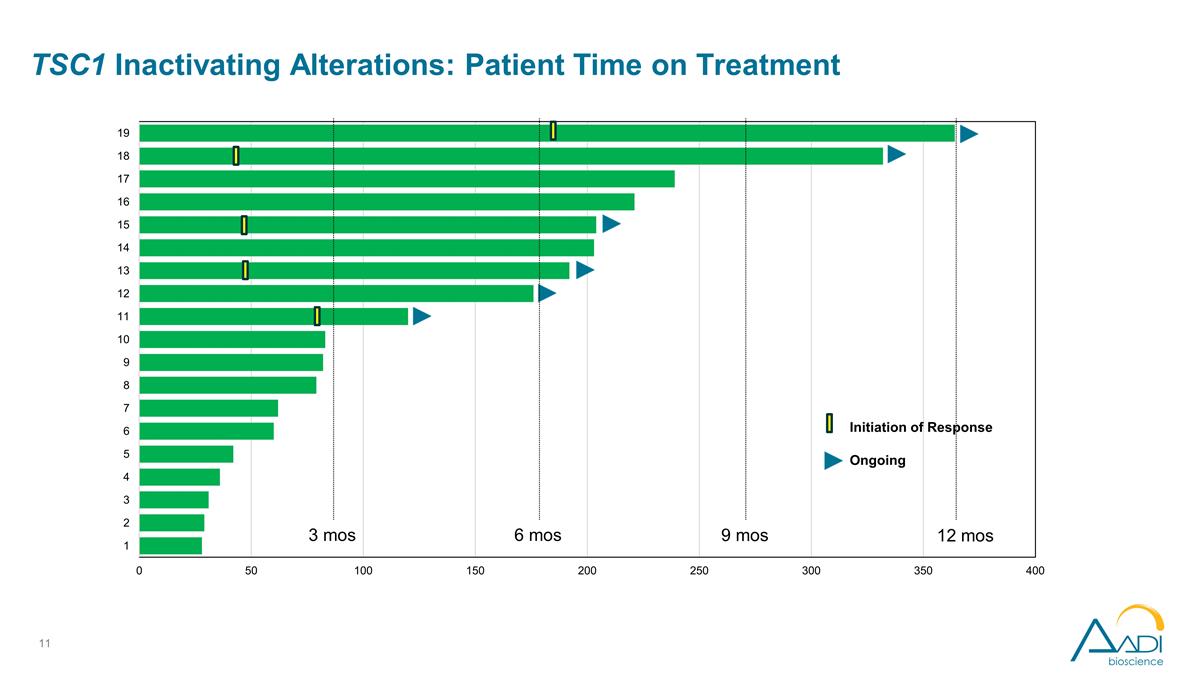
3 mos 6 mos 9 mos 12 mos 初始化 正在進行的 TSC1 失活改動:患者接受治療的時間
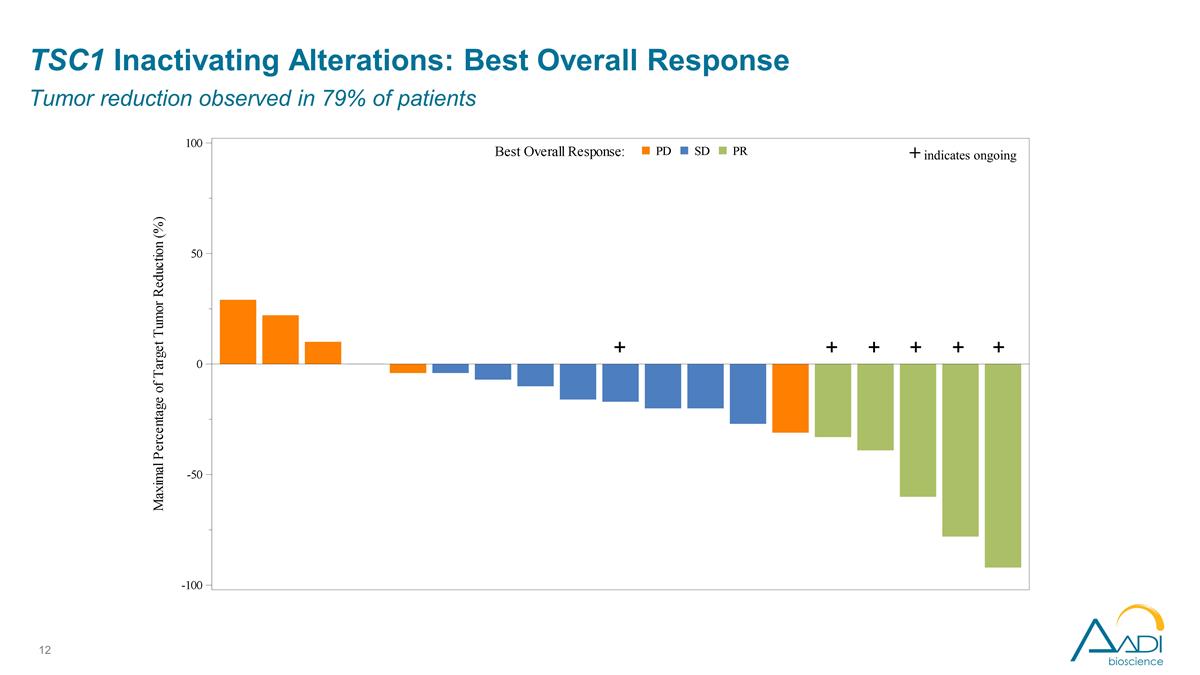
TSC1 停用改動:最佳 總體反應在 79% 的患者中觀察到腫瘤減退 + + + + + + 表明正在進行中

TSC1 停用改動: 研究者評估的療效觀察結果 ORR 為 26%,令人鼓舞,在 4 種不同的上皮癌類型中出現了 5 種反應。大量預先治療的人羣中位數,先前 3 種療法的中位數似乎是早期的、深刻的和持久的 正在進行中;超過一半的減幅超過 50%
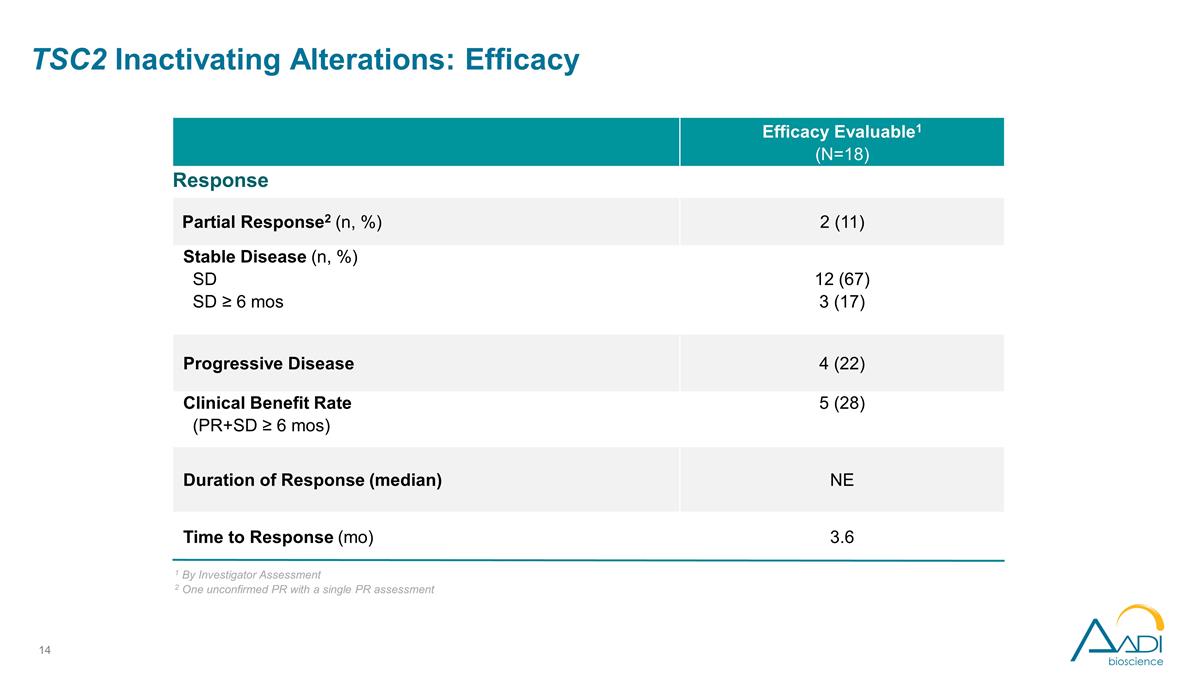
功效可評估 1 (N=18) 反應部分反應2 (n,%) 2 (11) 穩定疾病 (n,%) SD SD ≥ 6 mos 12 (67) 3 (17) 進展性疾病 4 (22) 臨牀獲益率 (PR+SD ≥ 6 個月) 5 (28) 反應時間(中位數)NE 反應時間(mo)3.6 TSC2 失活改變:功效 1 根據研究者評估 2 一項未經證實的 PR 和單一的 PR 評估
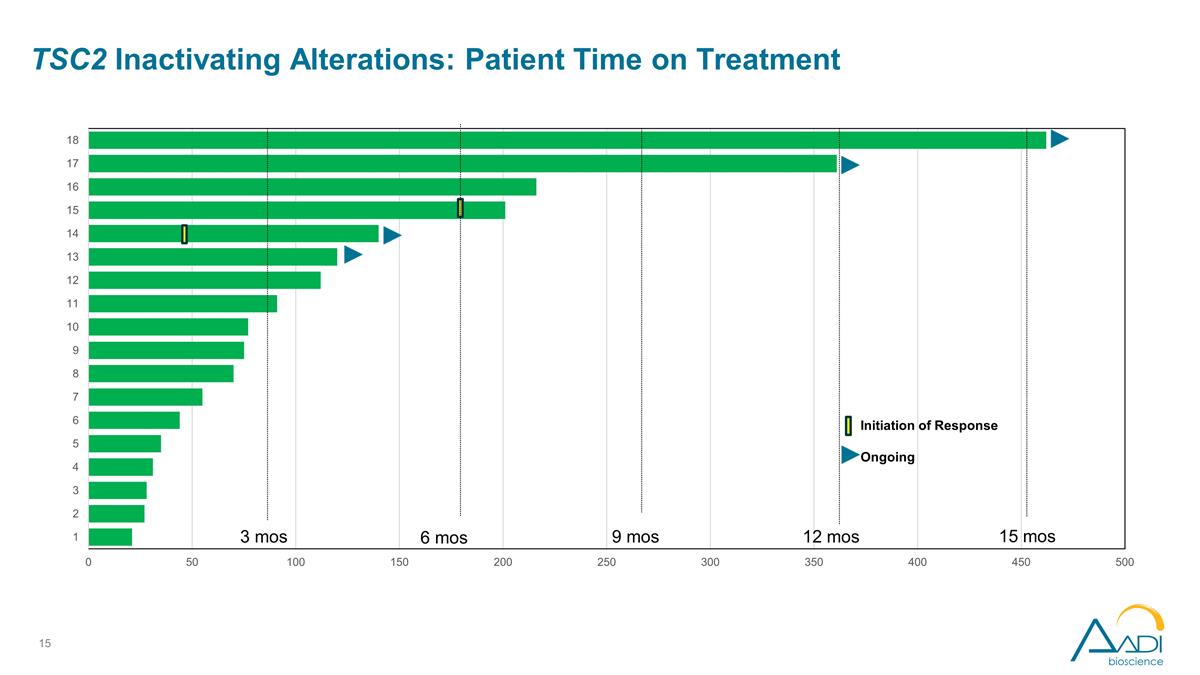
TSC2 停用改動: 患者接受治療的時間
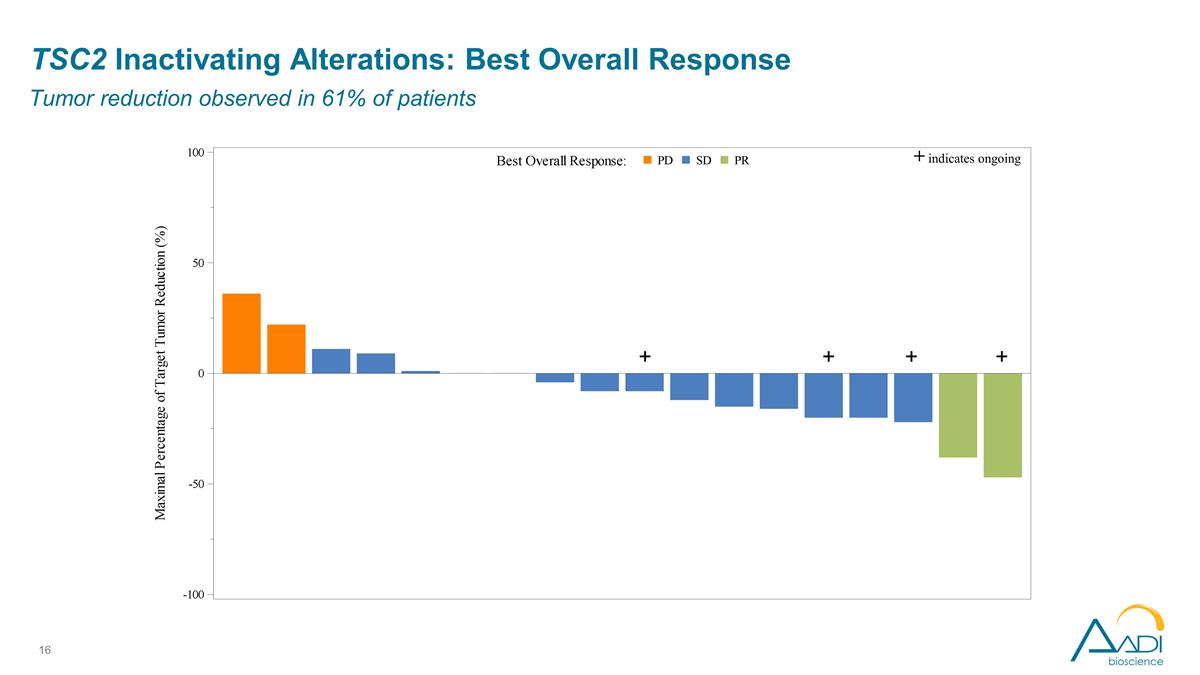
TSC2 停用改動:最佳 總體反應在 61% 的患者中觀察到腫瘤減退 + + + + 表明仍在繼續

TSC2 停用改動: 研究者評估的療效觀察結果 ORR 11% (2/18) 在上皮癌和肉瘤中出現的反應 CBR 28% (2 PR + 3 SD >6 mos) 接受過大量預處理的人羣 9/18 為 ≥ 5 線

PRECISION1:安全結論否 新的安全信號 AE 模式與 nab-sirolimus 標籤和 mTori 類一致 No 4 級 traE 或因研究藥物 1 導致的死亡患者因 2 級複發性肺炎而中止研究

PRECISION1 中期分析摘要 TSC1 組的結果令人鼓舞反應率在我們預期的範圍內,在經過大量預處理的人羣中,反應似乎深度且持久,不同腫瘤類型的反應支持腫瘤不可知的適應症 TSC2 組 ORR 樣本量小、預處理繁重,解釋比較複雜 50% 的患者先前接受過 5 種或更多療法,三分之二的 80 名患者中期入組已完成
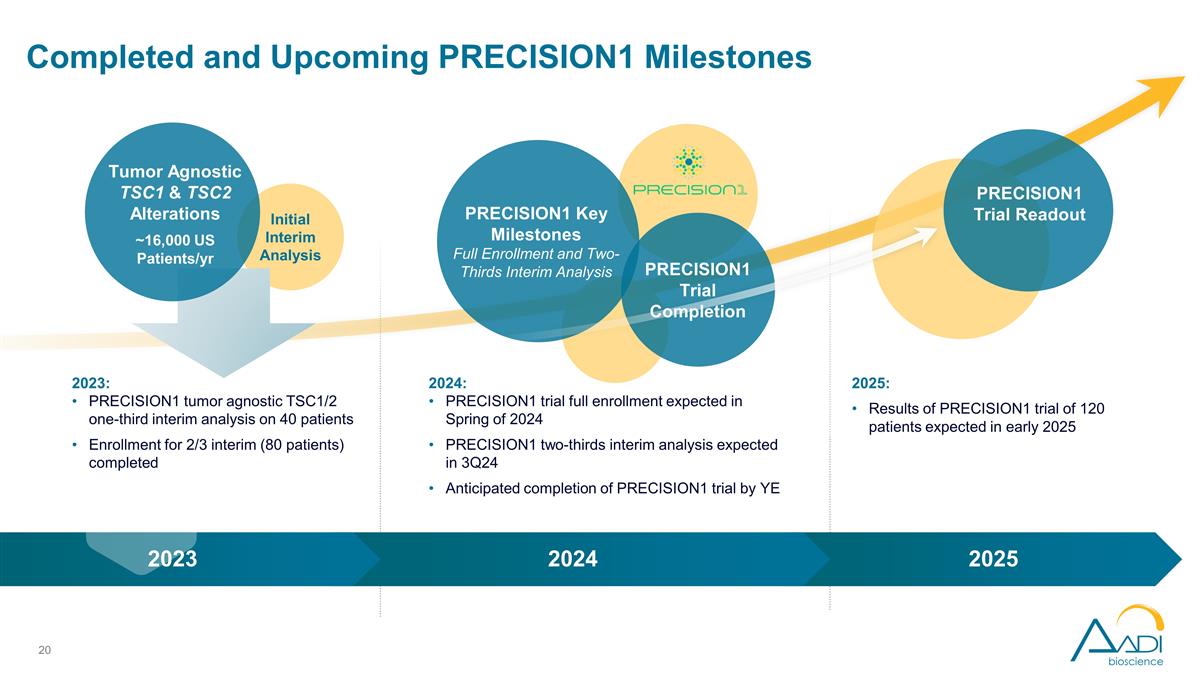
初步中期分析已完成 以及即將到來的 PRECISION1 里程碑 PRECISION1 關鍵里程碑全部入組和三分之二的中期分析 PRECISION1 試驗完成 2024 年:PRECISION1 試驗預計於 2024 年春季全部入組 PRECISION1 三分之二的中期分析 預計在 24 年第 3 季度完成 PRECISION1 試驗預計在 2025 年年初完成:預計 2025 年初 2023 年 2024 年初針對 120 名患者的 PRECISION1 試驗結果腫瘤無關的 TSC1 和 TSC2 變異約 16,000 名美國患者/2023 年:PRECISION1 腫瘤 不可知論者 TSC1/2 對 40 名患者的三分之一中期分析 2/3 名中期患者(80 名患者)的入組已完成 PRECISION1 試驗讀數

謝謝納斯達克:AADI www.aadibio.com