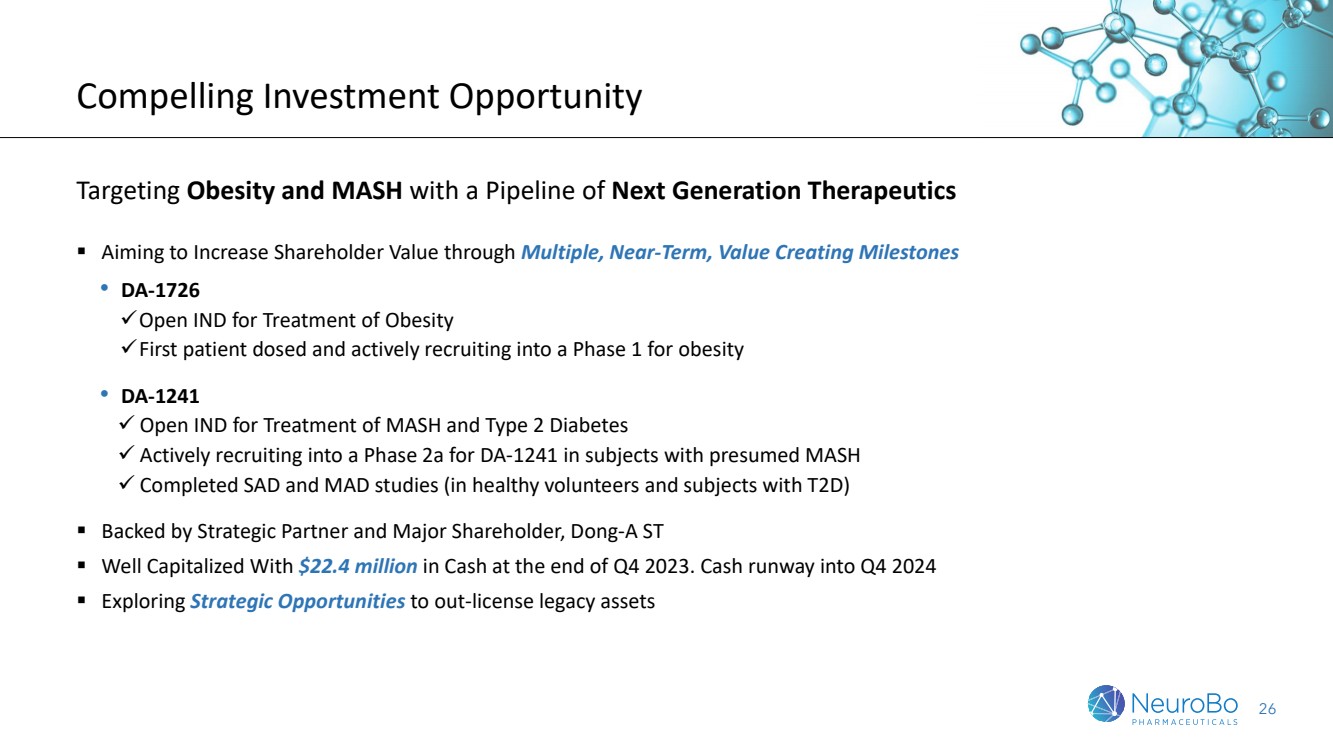| 2023年12月 納斯達克: NRBO 1 2024 年 4 月 神經波 藥品股份有限公司。 |
| 2 前瞻性陳述 本報告中可能包含1995年《私人證券訴訟改革法》中規定的前瞻性陳述。前瞻性陳述包括所有不只涉及歷史或者當前事實的陳述,可以通過使用諸如“相信”、“期望”、“預計”、“可能”、“將”、“應該”、“尋求”、“大約”、“打算”、“項目”、 “計劃”、“估計”或這些詞或其他可比術語(以及其他引用未來事件、條件或情況的單詞或表達方式)來識別。前瞻性陳述是關於未來事件的預測、波動和其他陳述,這些事件基於當前的預期和假設,因此面臨風險和不確定性。這些前瞻性陳述包括關於我們現有和未來產品候選品市場規模和潛在增長機會、資本要求和利用收益、臨牀開發活動、臨牀試驗的時間表和結果、監管提交以及其現有和未來產品候選品的潛在監管批准和商業化。許多因素可能導致實際未來事件與本發佈中的前瞻性陳述有所不同,包括但不限於與其商業策略執行的能力相關的風險;監管提交的時間表;能夠通過現有和未來產品候選品的發展步驟獲得監管批准的能力;能否實現與東亞李氏集團訂立的許可協議的利益,包括神經波對東亞李氏的未來財務和運營結果的影響;我們的代工廠商、臨牀研究合作伙伴及參與我們現有和未來產品候選品開發的其他人之間的合作;我們的產品候選品與任何其他用於治療的產品相結合可能會導致潛在的負面互動;我們能否及時啟動和完成臨牀試驗;我們招募臨牀試驗受試者的能力;我們是否從我們的臨牀試驗中獲得與臨牀前和以前的臨牀試驗結果一致的結果;與許可協議相關的已知和未知成本,包括與許可協議有關的任何訴訟或監管行動的成本;適用法律或法規的變更效果;我們能否保持納斯達克上市要求的合規性;以及股價變化對許可協議和任何未來募資條款的影響。這些前瞻性陳述基於我們目前可用的信息和我們目前的計劃或預期,並且受到許多已知和未知的不確定性、風險和其他重要因素的影響,這些因素可能導致我們的實際結果、表現或成就被前瞻性陳述所表達的結果、表現或成就所暗示的結果、表現或成就所暗示的結果、表現或成就。這些前瞻性陳述不應依賴於表示我們自此演示以來的任何日期的觀點,雖然我們可能將來選擇更新這種前瞻性陳述,但除非法律要求,否則我們否認這樣做的義務,即使後續事件導致我們的觀點發生變化。儘管我們相信這些前瞻性陳述的期望是合理的,但我們無法保證這些期望將被證明是正確的。這些前瞻性陳述不應作為我們在撰寫本演示的日期之後的任何日期代表我們觀點的依據。本演示還可能包含有關我們所在行業市場規模和其他數據的獨立方和我們估計的數據。這些數據涉及許多假設和限制,您被警告不要給予這些估計過高的權重。此外,我們在服務的市場的投資、假設和預測以及市場未來表現以及我們所處市場的預測、假設和預測所涉及的投影,以及支配未來表現和未來表現的各種未來因素是必然承擔極高的不確定性和風險的。 |
| 3 強有力的領導團隊 管理團隊 金亨炫(Hyung Heon Kim),首席執行官 Robert Homolka,高級副總裁臨牀運營 萬·D. 斯蒂芬·哈里森(Stephen Harrison),首席醫學顧問 金美京(Mi-Kyung Kim),藥物博士,藥劑師,首席科學家 Marshall H. Woodworth,首席財務官 ▪ 20多年的併購、融資和公司治理經驗 ▪ 10多年的與東亞集團的許可、併購和合規經驗 ▪ 東亞集團前總法律顧問/高級副總裁 ▪ BA Soonghsil大學,JD Washington大學法學院 ▪ 在東亞ST從事35年以上的藥物發現研究 ▪ 特別是在糖尿病、肥胖症、MASH和免疫介導性疾病方面 ▪ 博士、RPh、梨花女子大學藥學院 ▪ 製藥和生物技術開發領域超過35年 ▪ 曾在Adiso Therapeutics擔任臨牀運營高級總監 ▪ 曾在Shire / Takeda製藥公司擔任臨牀運營總監 ▪ 曾在阿斯利康擔任實驗試驗管理主任 ▪ MASH / NAFLD臨牀試驗專家,擁有近300篇同行評審文章 ▪ 牛津大學肝臟病學的客座教授 ▪ 俄馬哈大學醫學博士 ▪ 上校,美國陸軍醫療兵團 ▪ 金融領域35年以上的經驗 ▪ 20多年與生命科學投資者和分析師合作 ▪ 先後擔任Nevakar Inc.,Braeburn Pharmaceuticals Inc.,Aerocrine Ab和Furiex Pharmaceuticals Inc.的首席財務官 ▪ 馬裏蘭大學學士學位,印第安納大學工商管理碩士學位 |
| 4 引人注目的投資機會 通過一系列下一代治療藥品管線將股東價值最大化 ▪ 通過多個近期的創建價值的里程碑,旨在增加股東的價值 • DA-1726 珂得信(DA-1726) ✓用於肥胖症的開放性IND ✓第一位患肥胖症的患者接受劑量,並積極招募入組進行一項用於肥胖症的1期試驗 • DA-1241 珂得信(DA-1241) ✓用於MASH和2型糖尿病的開放性IND ✓正在對假定患有MASH病人進行先行期2a試驗的招募 ✓已完成SAD和MAD研究(在健康志願者和患有T2D病人中) ▪ 得到戰略夥伴和主要股東-東亞ST的支持 ▪ 資本充足,在2023年Q4結束時有2240萬現金。現金運營週期到達2024年Q4 ▪ 探索戰略機會以轉讓舊資產 |
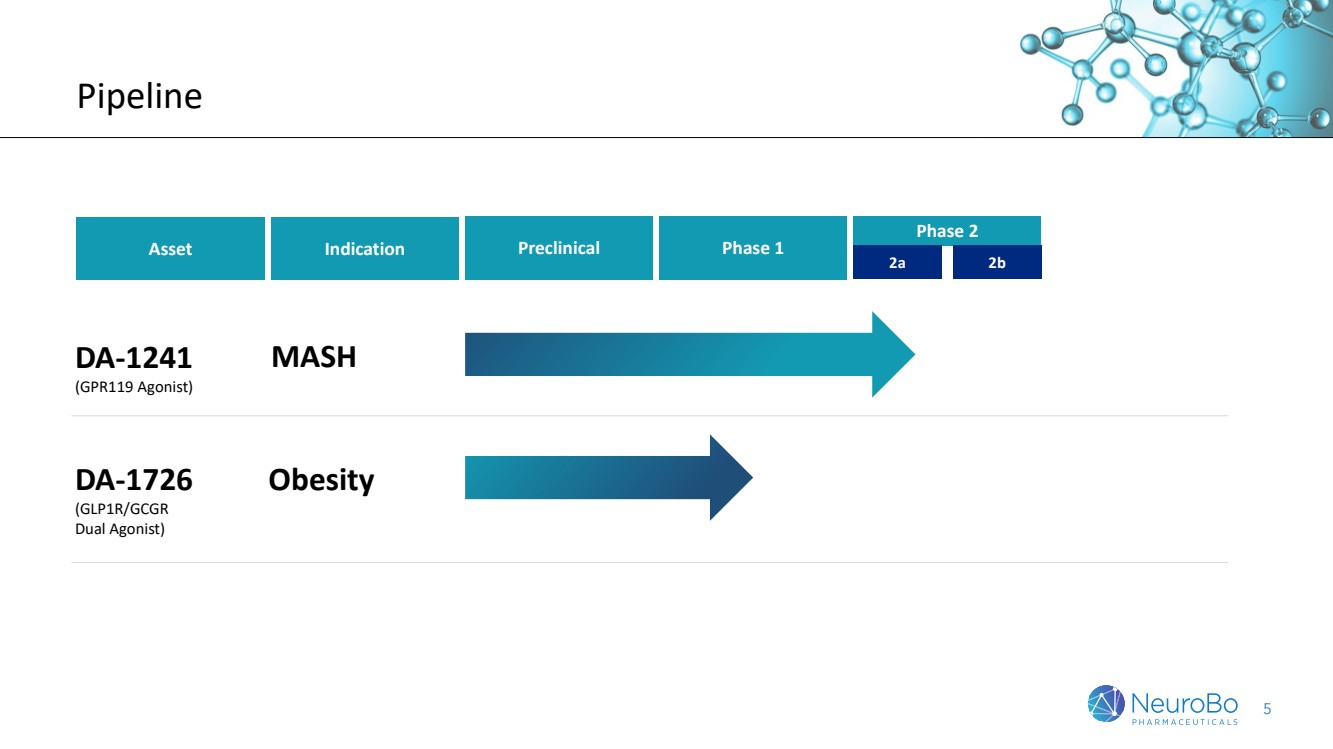
| 5.管道 資產 臨牀前 1期 2期 DA-1241 (GPR119激動劑) DA-1726 (GLP1R/GCGR雙激動劑) 肥胖症 適應症 MASH 肥胖症 |
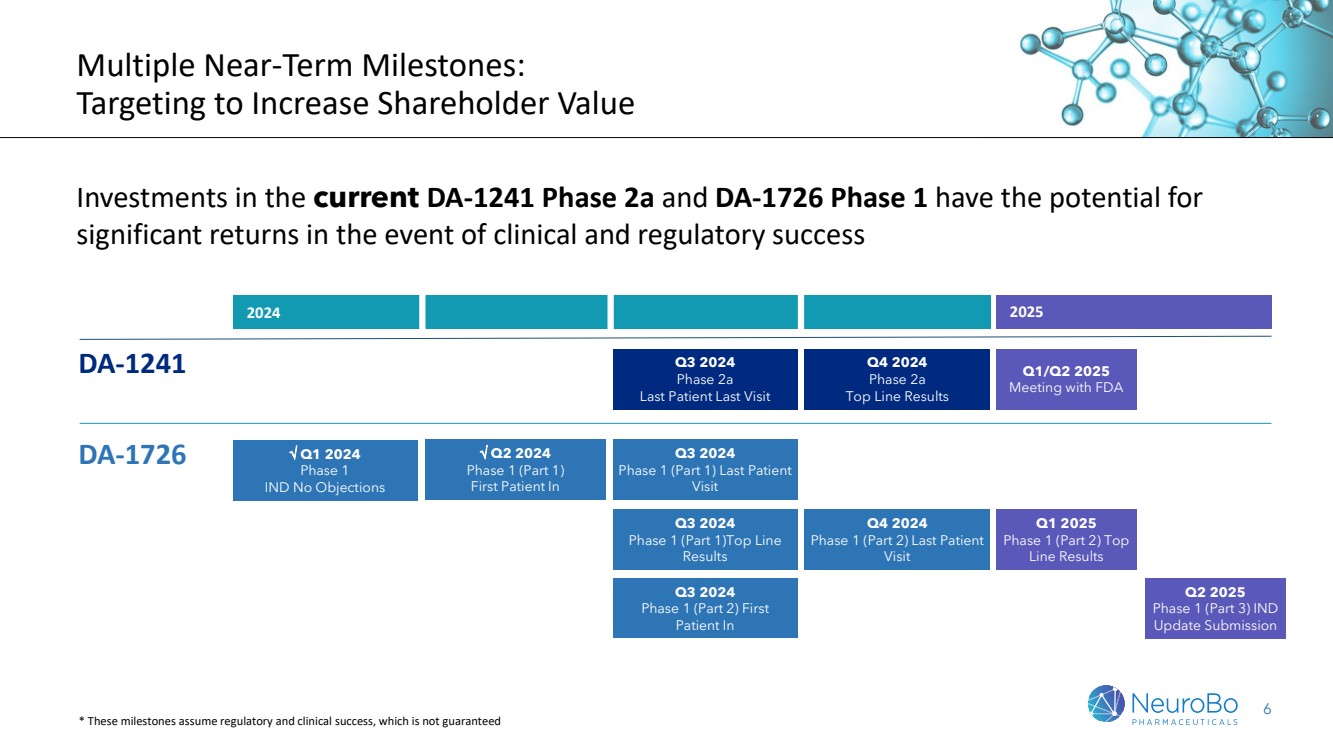
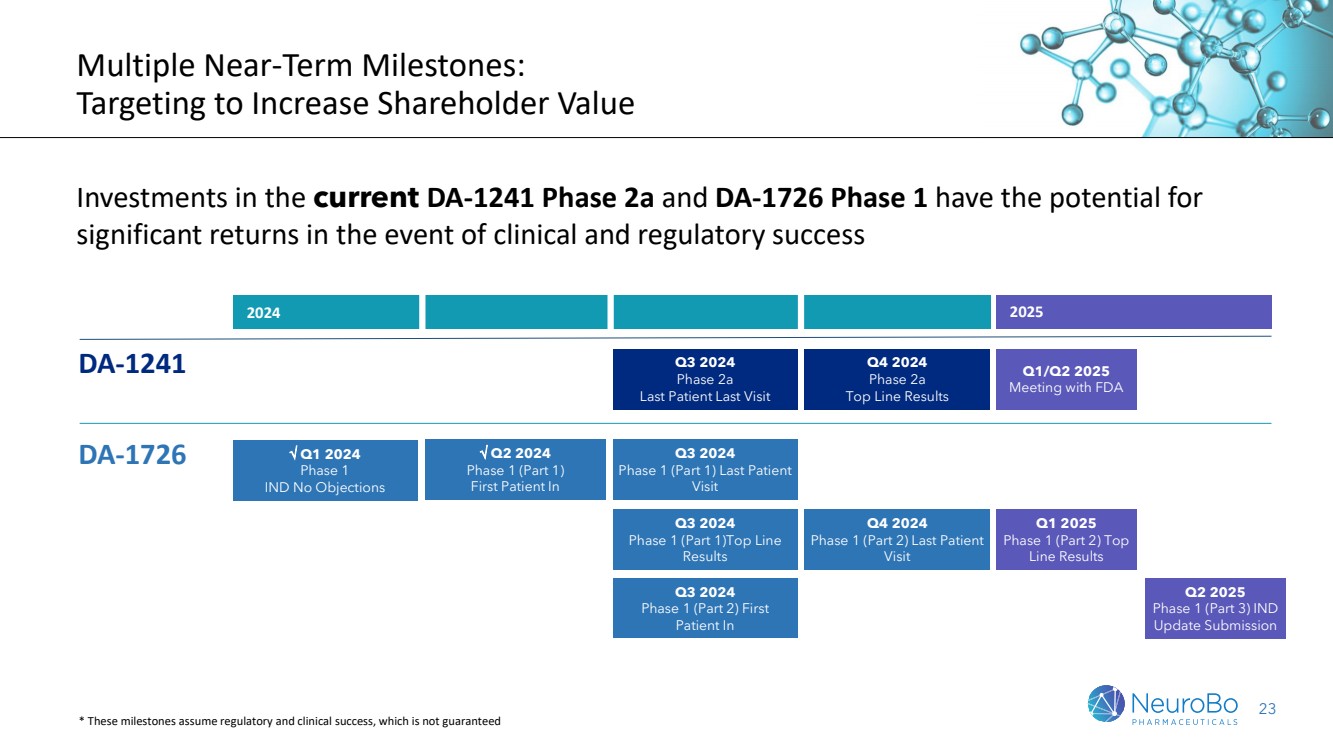
| 6 多個臨近的里程碑: 旨在增加股東價值 目前DA-1241第2a期和DA-1726第1期的投資在臨牀和監管成功的情況下有可能帶來顯著的回報 2025年第一季度/第二季度 與 FDA 的會議 2024/2025 DA-1241 第2a期 最後一個患者最後一次拜訪 2024年第四季度 第2a期 頂線結果 2024 年第一季度 第1期 IND 無異議 DA-1726 Q3 2024 第1期(第1部分) 最後一個患者拜訪 2024 年第二季度 第1期(第1部分) 第一位患者進入 第3季度2024 第1期(第2部分)首次 患者進入 第1季度2025 第1期(第1部分) 頂線結果 第4季度2024 第1期(第2部分)最後一個 患者來訪 *這些里程碑假設存在監管和臨牀成功,不能保證 第2季度2025 第1期(第3部分)IND 更新提交 |
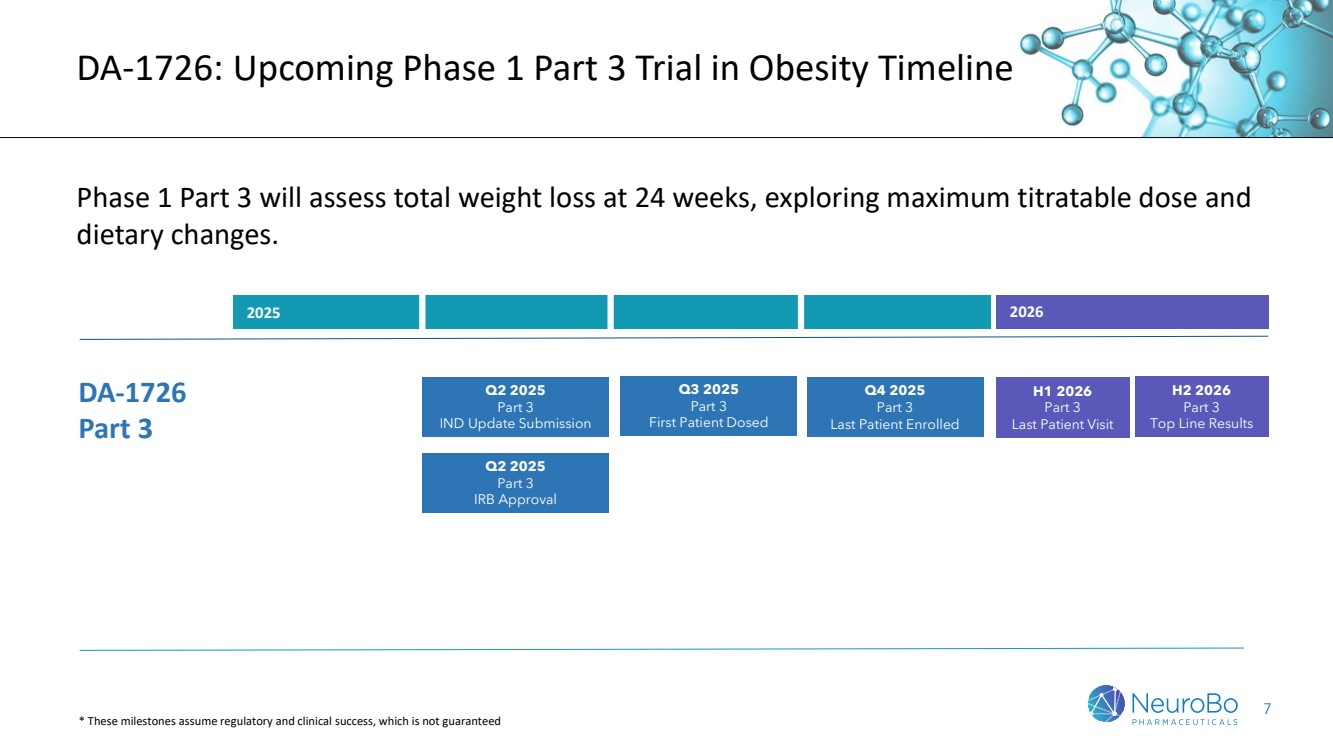
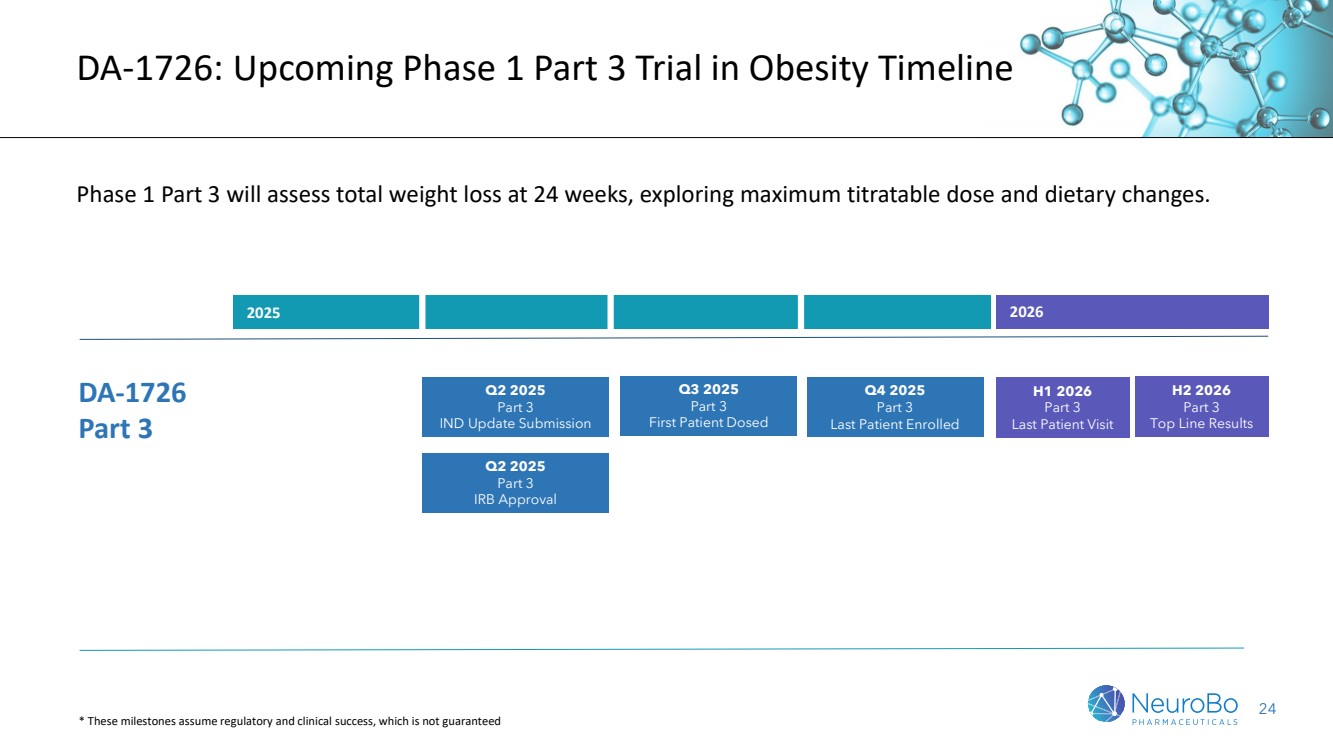
| 7 DA-1726:即將開展的針對肥胖症的第1期第3部分試驗時間表 第1期第3部分將評估24周的總減重,探索最大滴定劑量和膳食改變。 2025年至2026年 DA-1726 第3部分 第1季度和第2季度2026年 第3部分 最後一個患者訪問 第3季度2025年 第3部分 首次患者用藥 第2季度至2026年的下半年 第3部分 頂線結果 *這些里程碑假設被監管和臨牀成功存在,不能保證 2025年第2季度 第3部分 IND 更新提交 2025年第2季度 第3部分 IRb批准 2025年第4季度 第3部分 最後一個患者入組 |
| DA-1726: 第1期第3部分即將開始,以評估最大可滴定劑量 研究設計 研究概況▪ 多中心,隨機,雙盲,安慰劑對照,1期臨牀試驗,旨在評估DA-1726在肥胖且身體健康的受試者中的療效和安全性 其他終點▪生物標誌物變化(Pk、PD)▪長期安全性(即不良事件,實驗室,心電圖)研究設計▪3個階段的設計 •滴定期-最長達12周 •治療期-在個體化最大可滴定劑量下至少12周 •停藥期-最長達8周深入研究與地點▪ 美國多箇中心隨機分配約50名受試者DA-1726或安慰劑(4:1比例) 納入(預計)▪FPFV Q3 2025 ▪LPLV 1H 2026 注:FPFV(第一患者首次拜訪);LPLV(最後患者最後拜訪);Pk(藥物動力學);PD(藥理動力學)研究目標▪ 理解藥物滴定和劑量▪ 耐受最大劑量所需時間▪ 按照最大可耐受個體化劑量進行滴定 ▪ 在24周內評估總體重減輕-最大可耐受個體化劑量與治療期末基線的變化 ▪ 探索飲食改變,包括熱量攝入和組成 ▪ 探索體重減輕的類型-瘦肌肉質量與脂肪減少 ▪ 評估停藥後持續的體重減輕探索性效能終點 |
| 2023年12月。納斯達克:NRBO。DA-1726:治療肥胖症的一種新型GLP1R/GCGR雙重激動劑。 |
| DA-1726: 競爭差異 Survodutide Mazdutide DA-1726 Semaglutide Tirzepatide 開發商 Boehringer Ingelheim Innovent Biologics Lilly NeuroBo Novo Nordisk Lilly 指示 肥胖症 肥胖症 肥胖症 肥胖症 肥胖症 狀態 2期完成 3期(中國) 1期(美國) 1期 已上市(肥胖症/Wegovy®) 已上市(T2D/Ozempic®) 已上市(肥胖症/Zepbound®) 已上市(T2D/Mounjaro®) 行動 GLP-1R/GCGR 雙激動劑 GLP-1R/GCGR 雙激動劑 GLP-1R/GCGR(胰高糖素受體) 雙激動劑 GLP-1R 激動劑 GLP-1R/GIPR 雙激動劑 劑量 每週一次,注射 每週一次,注射 探索性給藥 在1期中 每週一次,注射 每週一次,注射 人體中的效力 體重減輕, 46周@16.7% 體重減輕, 24周@15.4% (中期分析) 在1期中的探索性效能 體重減輕, 68周@12.4% 體重減輕, 72周@20.1% 人類肥胖症中的安全性 噁心,嘔吐,腹瀉, 便祕, 由於不良事件而停止治療的人數:28.6% 噁心,腹瀉,嘔吐, 腹脹 在1期探索性安全 噁心,腹瀉, 嘔吐,便祕, 腹痛 噁心,腹瀉, 食慾下降,嘔吐, 便祕 差異 肥胖症的首個類成藥物,在46周內未達到高原 中期分析中未因不良事件而中斷治療 •與西格魯替單相比,體重減輕相似或更好 • 由於平衡方法而具有更好的耐受性,媲美 西格魯替單 在招募 MASH P3 參與者方面更具誘惑力 |
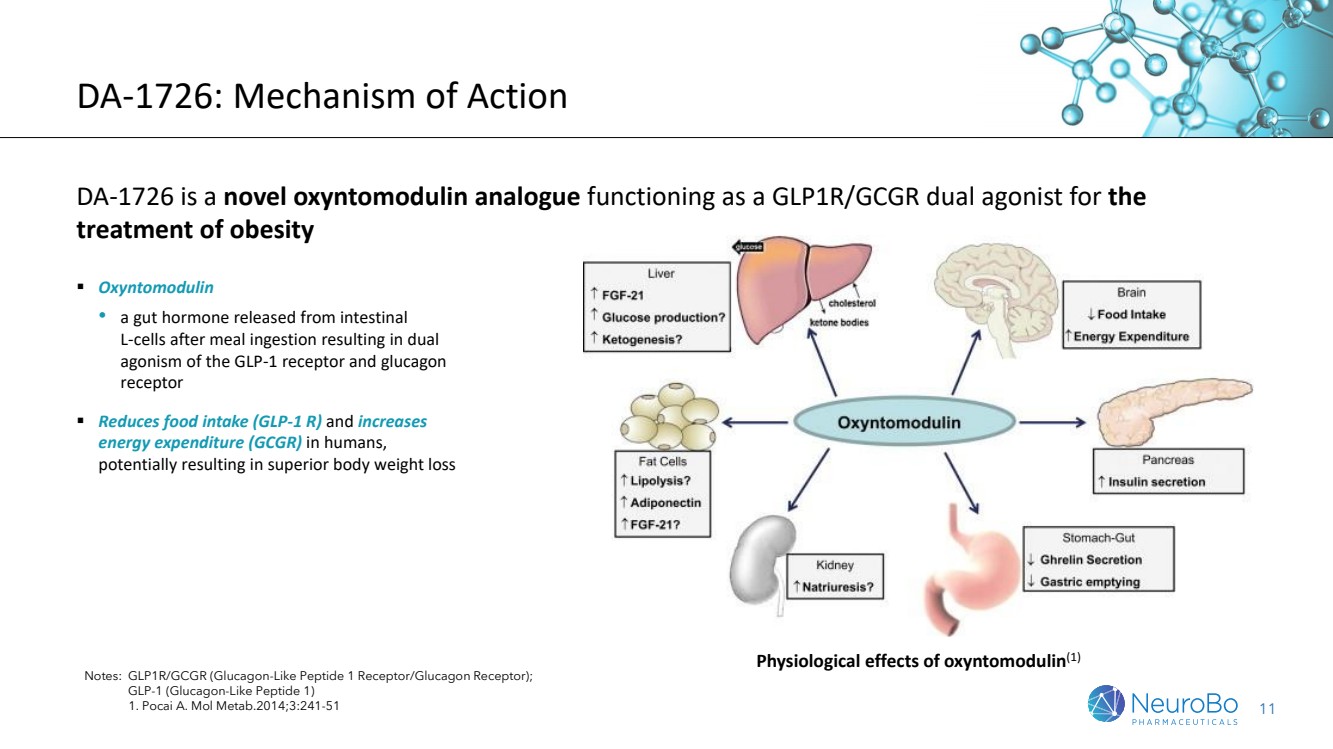
| DA-1726:作用機理 DA-1726是一種新型的促進GLP1R/GCGR的氧納調質類似物 雙重作用通路用於肥胖症的治療 注:GLP1R/GCGR(胰高糖素樣肽1受體/胰高糖素受體); GLP-1(胰高糖素樣肽1) 1. Pocai A. Mol Metab.2014;3:241-51 ▪ 氧納調質 •攝取餐後從腸道L細胞釋放的腸道激素 •對胰高糖素樣肽1受體和胰高糖素受體進行雙重激動 ▪ 減少進食(GLP-1 R)並增加 能量消耗(GCGR)在人體中 ▪ 可能導致優越的體重減輕氧納調質的生理效應(1) |
| DA-1726: 肥胖症的治療潛力(1-3)- Semaglutide比較 DA-1726在肥胖症小鼠模型中表現優秀 優於Semaglutide(WEGOVY),一種GLP-1受體激動劑 *與對照組相比有統計學意義 注:GLP1R/GCGR(胰高糖素樣肽1受體/胰高糖素受體); HF-DIO(高脂飲食誘導的肥胖); GLP-1(胰高糖素樣肽1); 1. Dong-A Study Report 104561. 所有治療均為每週兩次注射。 2. Dong-A Study Report 104455. 所有治療均為每隔3天進行一次注射。 3. Kim TH等人。美國糖尿病協會第82次年會。2022年;摘要1403-P。 從GLP1R的激動和通過GCGR增加能量消耗可以將在HF-DIO肥胖鼠中觀察到的體重減輕歸因於氧納調質 高脂飲食誘導的肥胖小鼠中的BWL DA-1726與Semaglutide(1、3)相比 減重百分比變化(基線已修正為HF對照組) -30 -25 -20 -15 -10 -5 0 0 2 4 6 8 10 12 14 16 19 21 25 27 接受治療的天數 高脂對照組 Semaglutide (250 nmol/kg)* DA-1726 (100 nmol/kg)* DA-1726 (200 nmol/kg)* (16.3%) (19.3%) (26.8%) 在HF-FATZO T2DM/肥胖小鼠中的BWL DA-1726 vs Semaglutide(2,3) 減重百分比變化(基線已校正到HF對照組) -35 -30 -25 -20 -15 -10 -5 0 0 2 4 6 8 10 12 14 16 18 20 22 25 接受治療的天數 高脂對照組 Semaglutide (250 nmol/kg)* DA-1726 (100 nmol/kg)* DA-1726 (250 nmol/kg)* (12.5%) (14.9%) (25.4%) 在HF-DIO肥胖小鼠中的累積食物攝入與DA-1726 與Semaglutide(1、3)的比較 |
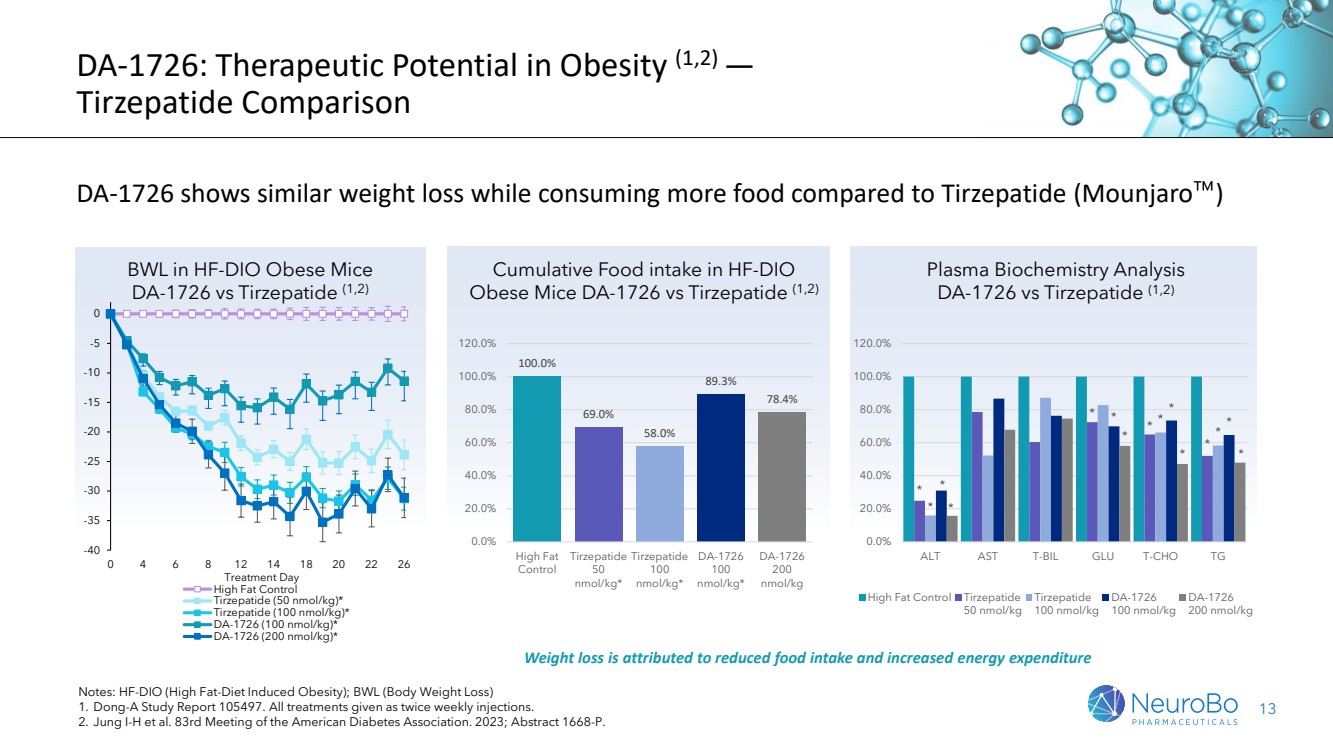
| DA-1726: 肥胖症的治療潛力(1、2)- Tirzepatide對比 與Tirzepatide(Mounjaro)相比,DA-1726消耗更多的食物,但體重減輕相似 注:HF-DIO(高脂飲食誘導的肥胖); BWL(體重下降) 1. Dong-A Study Report 105497. 所有治療均為每週兩次注射。 2. Jung I-H等人。美國糖尿病協會第83次年會。2023年,摘要1668-P。 減輕體重歸因於減少食物攝入和增加能量消耗 HF-DIO肥胖小鼠中累積食物攝入, 與DA-1726相比,Tirzepatide(1、2) Plasma生物化學分析 DA-1726與Tirzepatide(1、2)相比 -40 -35 -30 -25 -20 -15 -10 -5 0 0 4 6 8 12 14 18 20 22 26 接受治療的天數 高脂對照組 Tirzepatide(50 nmol/kg)* Tirzepatide(100 nmol/kg)* DA-1726 (100 nmol/kg)* DA-1726 (200 nmol/kg)* 100.0% 69.0% 58.0% 89.3% 78.4% 0.0% 20.0% 40.0% 60.0% 80.0% 100.0% 120.0% High Fat Control Tirzepatide 50 nmol/kg 鐵激酶 100 nmol/kg DA-1726 100 nmol/kg DA-1726 200 nmol/kg * * * * * * * * * * * * * * * 0.0% 20.0% 40.0% 60.0% 80.0% 100.0% 120.0% 在HF-DIO肥胖小鼠中的BWL DA-1726 vs Tirzepatide(1、2) |
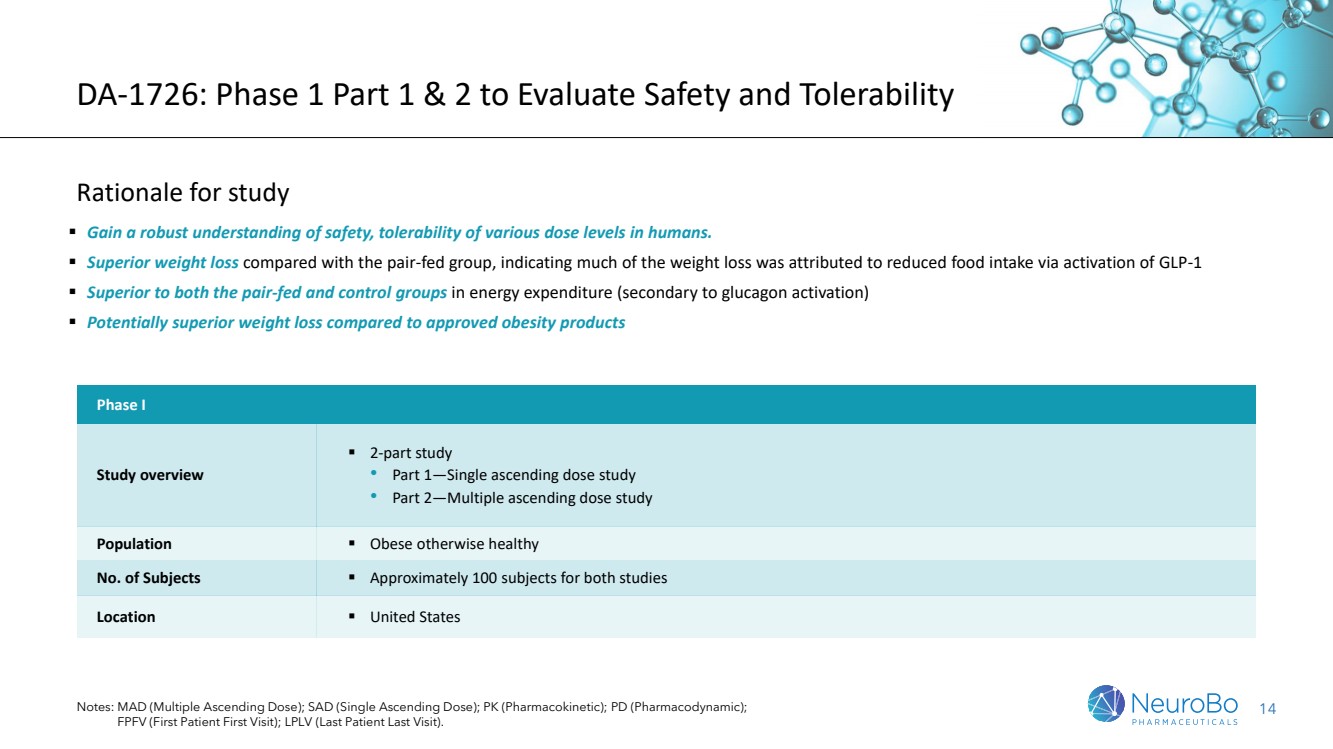
| DA-1726: 1期第1部分和第2部分,以評估安全性和耐受性 研究的理由 ▪ 充分了解人類中不同劑量水平的安全性,耐受性。 ▪ 比有對等食物的對照組在體重減輕方面表現出色,這表明減輕體重的很大部分原因是通過激活GLP-1來減少食物攝入 ▪ 在能量消耗方面優於對等食物和對照組(次要的胰高糖素激動劑) ▪ 可能優於已批准的肥胖症產品 注:MAD(多劑量上升); SAD(單劑量上升); Pk(藥代動力學); PD(藥效動力學); 第1階段 研究概述 ▪ 2部分研究 •第1部分-單次劑量研究 •第2部分-多劑量上升研究 人口 ▪ 肥胖否則健康 受試者人數 ▪ 各研究約100名受試者 地點 ▪ 美國 |
| 請使用您的moomoo賬號登錄以獲取該功能。 |
| 2023年12月 納斯達克:NRBO 16 DA-1241 口服,潛在的首個GPR119受體激動劑,用於治療MASH。 |
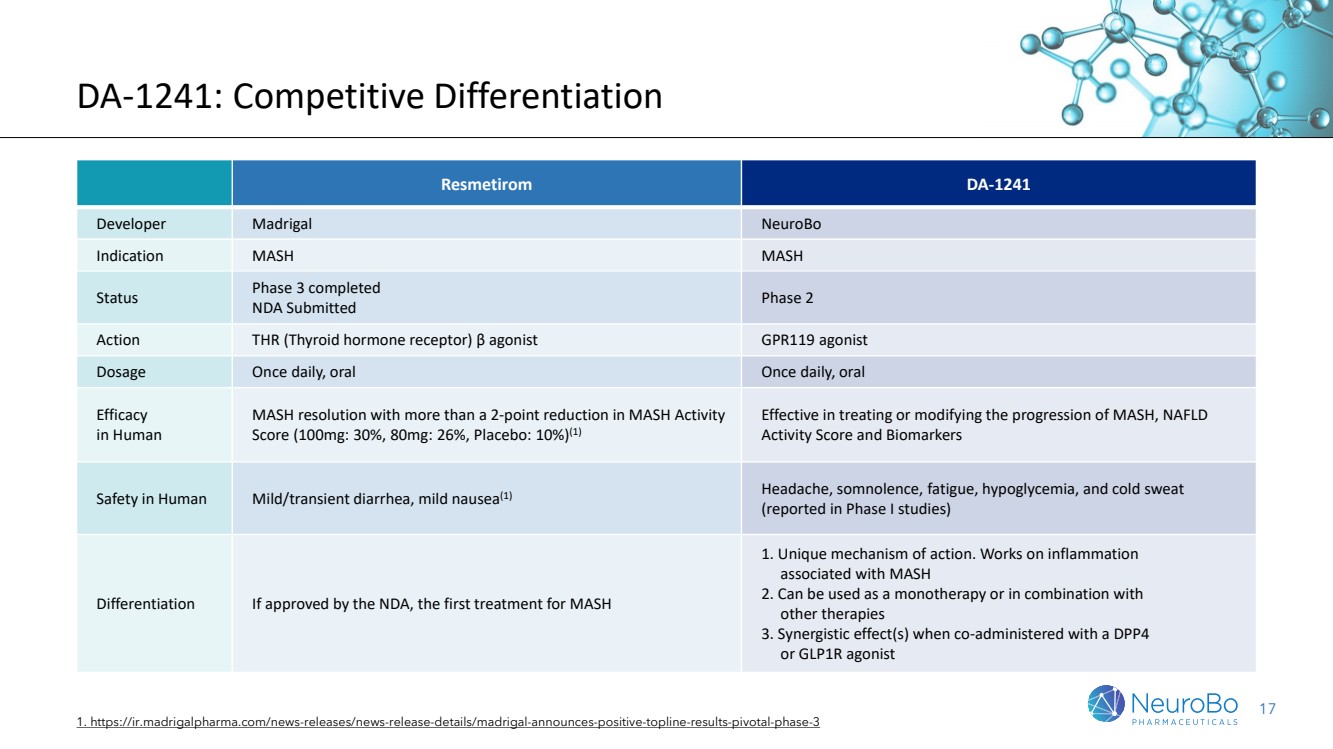
| 17 DA-1241: 競爭性差異化 1. https://ir.madrigalpharma.com/news-releases/news-release-details/madrigal-announces-positive-topline-results-pivotal-phase-3 Resmetirom DA-1241 Developer Madrigal NeuroBo Indication MASH MASH Status Phase 3 completed NDA Submitted Phase 2 Action THR (Thyroid hormone receptor) β agonist GPR119 agonist Dosage Once daily, oral Once daily, oral 人體研究中的療效 MASH活動得分減少2分或以上的MASH改善(100mg:30%,80mg:26%,安慰劑:10%)(1) 能有效治療或改變MASH、NAFLD的進展,及控制生物標誌物 人體安全性中出現輕度或短暫的腹瀉、噁心(1), 以及頭痛、嗜睡、疲勞、低血糖和出汗(Phase I研究報告) 差異化 如果被NDA批准,將成為MASH的首個治療方法。 1. 獨特的作用機制。可以用於MASH相關的炎症 2. 可以作為單藥療法或與其他治療聯合使用 3. 與DPP4或GLP1R激動劑聯合使用有協同效應。 |
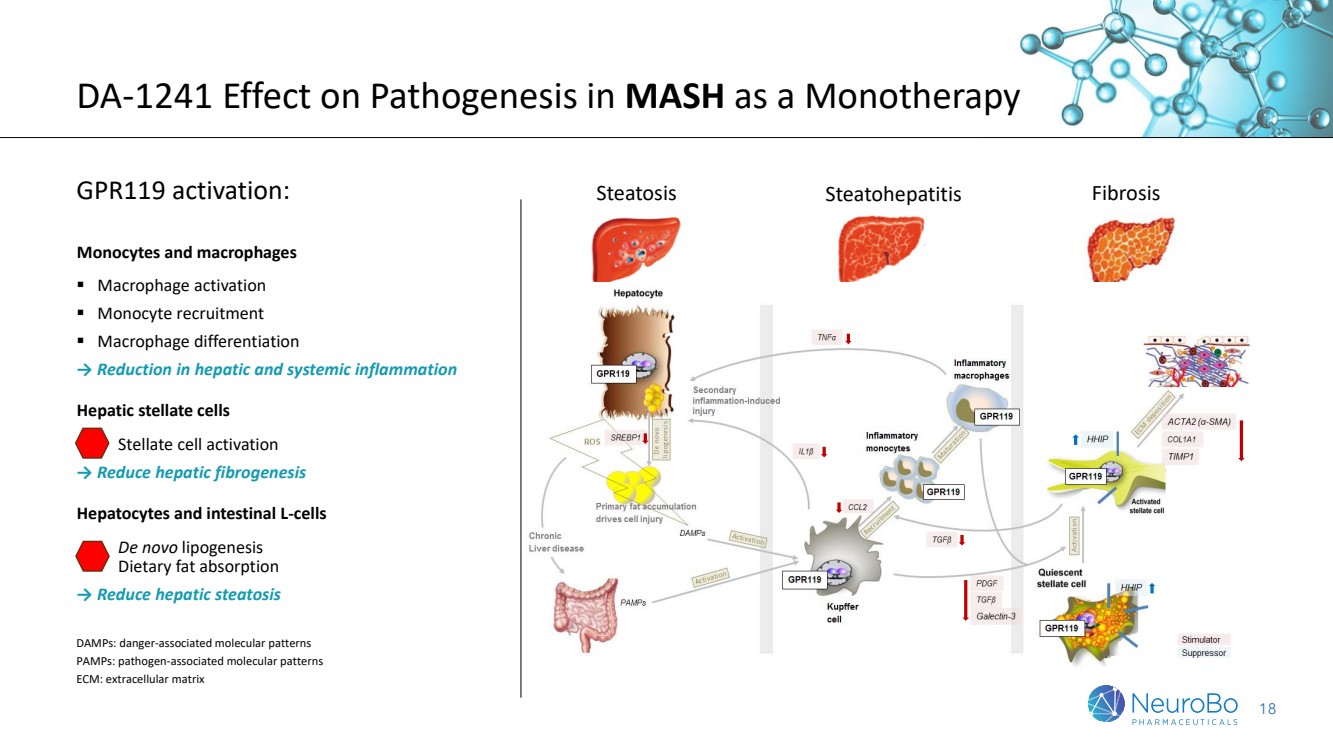
| 18 DA-1241單獨治療MASH時對病理產生的影響 GPR119激活: 單核細胞和巨噬細胞 ▪ 巨噬細胞激活 ▪ 單核細胞招募 ▪ 巨噬細胞分化 → 減少肝臟和全身炎症 肝星狀細胞 星狀細胞激活 → 減少肝纖維化 肝細胞和腸道L細胞 新的脂肪生成 膳食脂肪吸收 → 減少肝脂肪變性 脂肪變性,脂肪壞死,纖維化 DAMPs: 危險相關的分子模式 PAMPs:病原體相關分子模式 ECM:細胞外基質 |
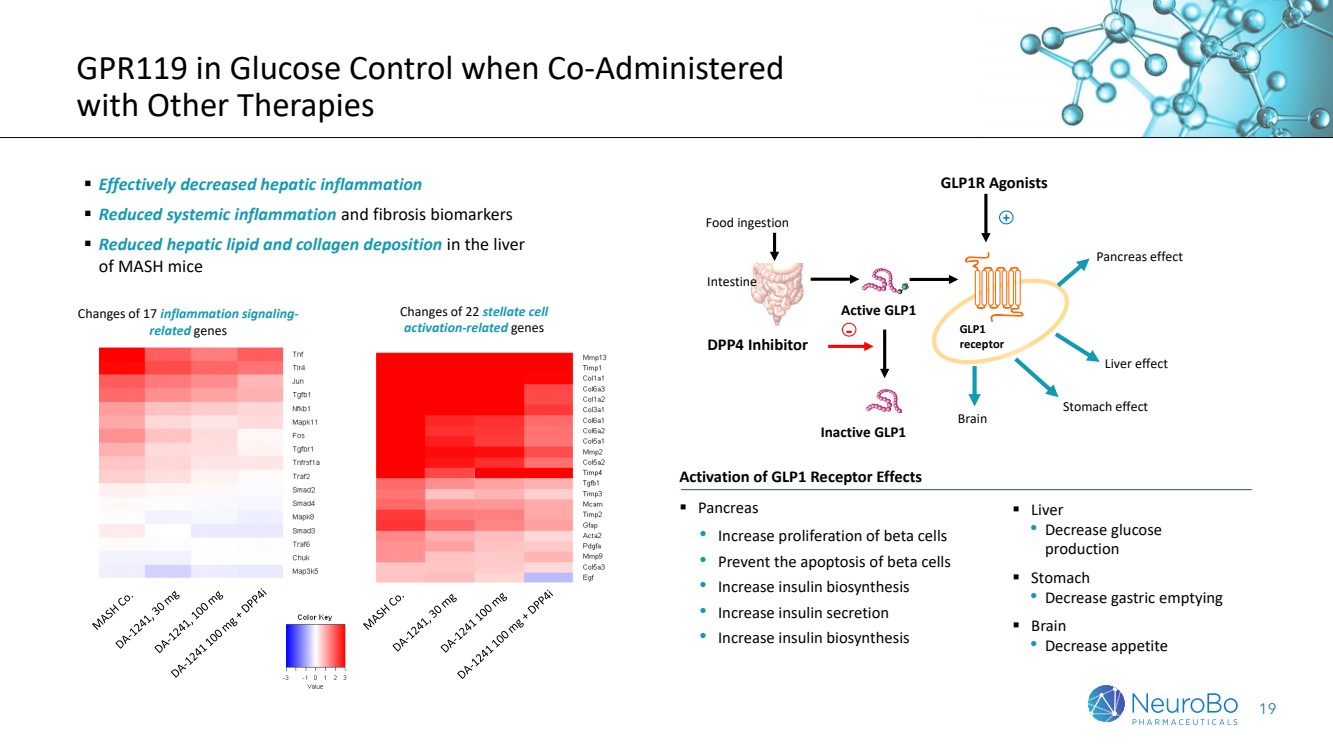
| 19 當聯合使用其他治療時GPR119對葡萄糖控制的作用 ▪ 有效減少肝臟炎症 ▪ 減少全身炎症和纖維化生物標誌物 ▪ 減少MASH小鼠肝臟中脂肪和膠原沉積 GLP1受體激動時的激活效應 ▪ 胰腺 • 增加β細胞增殖 • 防止β細胞凋亡 • 增加胰島素生物合成 • 增加胰島素分泌 • 增加胰島素生物合成 肝臟效應 胰腺效應 腸 活性GLP1 非活性GLP1 DPP4抑制劑 + - GLP1R Agonists GLP1 receptor 胃效應 大腦 進食 22星狀細胞相關基因的變化 17炎症信號傳導相關基因的變化 ▪ 肝臟 • 減少葡萄糖產生 ▪ 胃 • 減少胃排空 ▪ 大腦 • 減少食慾 |
| 20 DA-1241:MASH進行中的2a期試驗 支持單藥治療 研究設計 研究概述 ▪ 一項多中心、隨機、雙盲、安慰劑對照、平行、2a期臨牀試驗,旨在評估DA-1241在被推斷為無酒精性脂肪肝病變(NASH)患者中的療效和安全性 主要終點 ▪ 丙氨酸轉氨酶變化 研究設計 ▪ 兩部分研究 • 第1部分:DA-1241 50mg、DA-1241 100mg、安慰劑 • 第2部分:DA-1241 100mg + 瑟列格汀100mg,安慰劑 受試者人數 ▪ 大約90名被推定為患有MASH的受試者 地點 ▪ 美國的大約25箇中心 入組(計劃) ▪ 2023年9月FPI ▪ 2024年8月LPLV ▪ DA-1241修改了Ob-MASH小鼠的病變進程 ▪ 探討改善生物標誌物(CCL2、TNFa和TIMP1)、肝脂含量以及通過Fibroscan和MRI測量的硬度 探討與DPP4抑制劑的聯合使用 ▪ 識別有效減少肝臟炎症的能力 ▪ 探索減少全身炎症和纖維化生物標誌物的能力 ▪ 減少Ob-MASH小鼠肝臟中的脂質和膠原沉積 注:FPFV(第一個受試者第一個訪問);LPO(最後一個受試者最後一次訪問) |
| 2023年12月 納斯達克:NRBO 21 財務和資本化 |
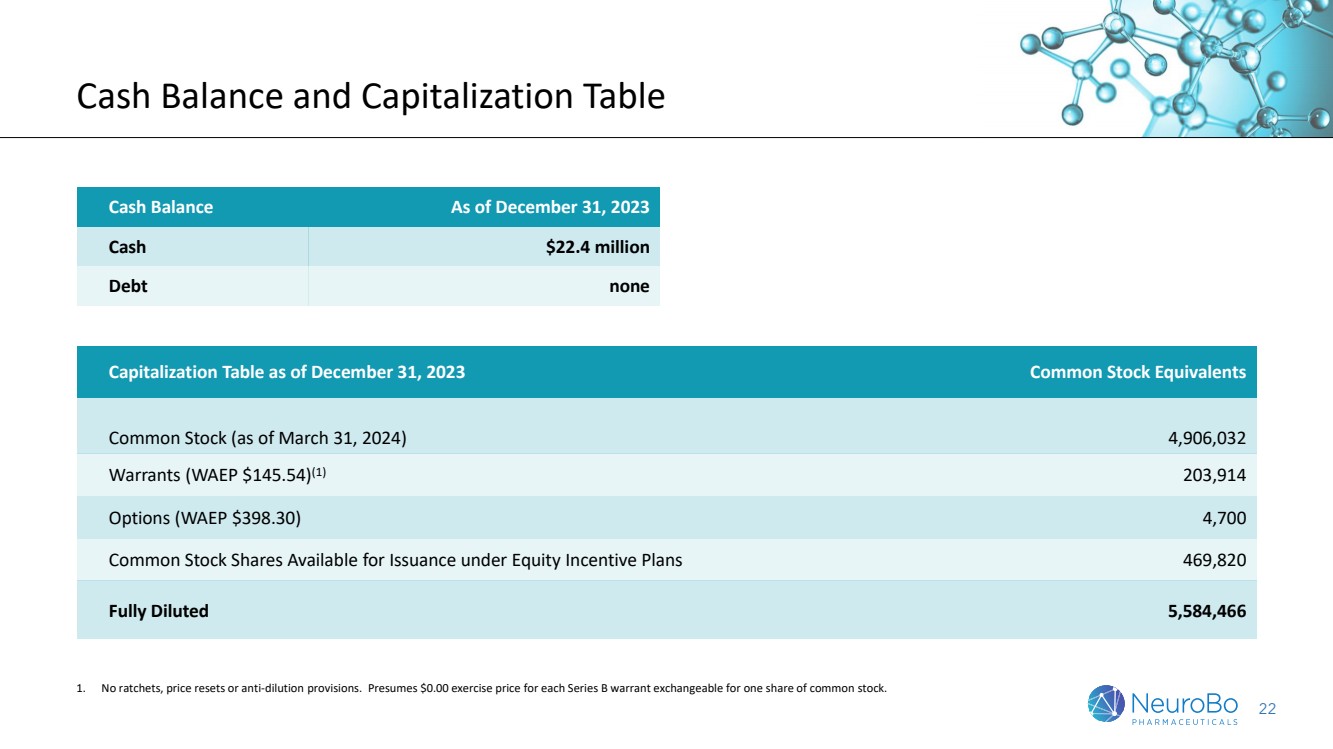
| 22 現金餘額和資本化表 截至2023年12月31日的現金餘額 現金$2240萬 債務無 截至2023年12月31日的資本化表 普通股權益 普通股(截至2024年3月31日) 4,906,032 權證(WAEP $145.54)(1) 203,914 期權(WAEP $398.30) 4,700 股票在股權激勵計劃下可供發行的股票469,820 完全稀釋5,584,466 1. 無扣款條款、定價調整或防護事項。假設每股轉換為一股普通股股票的B系列認股權的行權價格為$0.00。 |
| 23 多個近期里程碑: 旨在增加股東價值 DA-1726和DA-1241的投資如果在臨牀和監管上獲得成功,將具有潛在的巨大回報 2025年第一季度/第二季度 與FDA會面 2024年至2025年 DA-1241 2024年第三季度 2a期 最後一個受試者的最後一次訪問 2024年第四季度 2a期 最後一次頂線結果 2024年第一季度 1期 IND無異議 2024年第三季度 DA-1726 1期(第1部分)最後一位受試者 訪問 2024年第二季度 1期(第1部分) 首個受試者進入 2024年第三季度 1期(第2部分)首 個受試者進入 2024年第一季度 1期(第1部分)頂線 結果 2025年第一季度 1期(第2部分)頂 線結果 2024年第四季度 1期(第2部分)最後一個受試者 訪問 *這些里程碑假設獲得監管和臨牀上的成功,不能保證 |
| 24 DA-1726:肥胖病第1階段3試驗時間表 1階段3試驗將評估24周內的總體減重,探索最大可滴定劑量和膳食變化。 2025年到2026年 DA-1726 第3部分 2026年上半年 第3部分 最後一個受試者訪問 2025年第3季度 第3部分 首個受試者用藥 2026年下半年 第3部分 頂線結果 *這些里程碑假設獲得監管和臨牀上的成功,不能保證 2025年第2季度 第3部分 IND更新提交 |
| 2023年12月 納斯達克:NRBO 25 投資命題 |
| 26 令人信服的投資機會 通過下一代療法針對肥胖和MASH,具有具多個近期的、增值的里程碑目標,旨在提高股東價值 • DA-1726 已為肥胖症治療開放IND 正招募肥胖症1期患者並進行治療 • DA-1241 已開放磨粉劑的IND,用於MASH和2型糖尿病 正在積極招募被推斷為患有MASH的患者進入2a期 已完成健康志願者和T2D患者的SAD和MAD研究 •有戰略合作伙伴和大股東東亞製藥支持 • 資金充足,截至2023年第四季度末擁有2240萬美元現金。現金流最長可覆蓋到2024年第四季度 • 正探討將非核心資產出售授權的戰略機會 |
| 2023年12月 納斯達克:NRBO 27 謝謝! 投資者聯繫方式: Rx Communications Group Michael Miller +1 917.633.6086 mmiller@rxir.com NeuroBo Pharmaceuticals Marshall Woodworth +1 919.749.8748 marshall.woodworth@neurobopharma.com |