
附錄 99.1

1 重新定義中樞神經系統療法 NLS Pharmaceutics 2023 年 9 月

2 前瞻性陳述本演示文稿包含 1995 年《私人證券訴訟改革法》和其他美國聯邦證券法中的明示或暗示的前瞻性陳述。例如,我們在討論臨牀試驗結果、未來臨牀試驗的預期時間、收到臨牀試驗結果和獲得監管部門批准Mazindol ER時使用了前瞻性陳述;我們在2023年的戰略重點;我們針對各種適應症的候選產品線;Mazindol ER的預期開發時間表;未來可能進行的擬議試驗;以及我們的候選產品在改善患者醫療保健方面可能帶來的潛在好處。這些前瞻性陳述及其影響僅基於我們管理層當前的預期,並受許多因素和不確定性的影響,這些因素和不確定性可能導致實際業績與前瞻性陳述中描述的結果存在重大差異。除其他外,以下因素可能導致實際結果與前瞻性陳述中描述的結果存在重大差異:技術和市場要求的變化;我們在啟動和/或成功完成臨牀試驗時可能會遇到延遲或障礙;我們的產品可能未獲得監管機構的批准,我們的技術在進一步發展過程中可能無法得到驗證,其方法可能無法被科學界接受;我們可能無法留住或吸引知識至關重要的關鍵員工那個產品的開發;我們的工藝可能會出現不可預見的科學困難;我們的產品最終可能會比預期的更昂貴;實驗室的結果在實際臨牀環境中可能無法轉化為同樣好的結果;臨牀前研究的結果可能與人體臨牀試驗的結果不相關;我們的專利可能不夠;我們的產品可能會傷害接受者;立法的變化可能會對我們產生不利影響;無法及時開發和引入新技術、產品和應用;市場損失競爭造成的份額和定價壓力,這可能導致我們的實際業績或業績與此類前瞻性陳述中的設想存在重大差異。除非法律另有要求,否則我們沒有義務公開發布對這些前瞻性陳述的任何修訂,以反映本聲明發布之日之後的事件或情況或反映意外事件的發生。有關影響我們的風險和不確定性的更多詳細信息載於我們向美國證券交易委員會(SEC)提交的截至2022年12月31日的20-F表年度報告中的 “風險因素” 標題下,該報告可在美國證券交易委員會的網站www.sec.gov上查閲,也可以在我們隨後向美國證券交易委員會提交的文件中查閲。本演示文稿中以引用方式使用或納入了我們的徽標和一些商標和商品名。本演示文稿還包括屬於其他組織財產的商標、商號和服務標誌。僅為方便起見,本演示文稿中提及的商標、商品名和服務商標在出現時可能不帶有®、TM 和 SM 符號,但這些提法無意以任何方式表明我們不會根據適用法律最大限度地維護我們或適用許可方對這些商標、商品名和服務商標的權利。我們從市場研究、公開信息和行業出版物中獲得了本演示文稿中以引用方式描述的統計數據、市場數據和其他行業數據和預測。行業出版物通常表示,他們從他們認為可靠的來源獲取信息,但不保證信息的準確性和完整性。同樣,儘管我們認為統計數據、行業數據和預測以及市場研究是可靠的,但我們尚未獨立驗證這些數據,也沒有對信息的準確性做出任何陳述。

一般概述

4 業務亮點 NLS 開發用於罕見和複雜中樞神經系統 (CNS) 疾病的藥物療法 • Mazindol ER 已成功完成發作性睡病治療的 2 期試驗,包括 OLE:預計到 2027 年年市場規模將達到 45 億美元* • AMAZE 三期計劃將於 2023 年下半年啟動 • 美國和歐洲授予孤兒藥稱號 (ODD) • 一次性強知識產權保護——每日配方為止 2037 • 獨特的睡眠特許經營權(包括MNE)• 產品線不斷進展和擴大,主要市場的知識產權保護期已久 •針對發作性睡病和特發性睡眠過度失眠患者的命名患者計劃已在歐洲各地的目標市場啟動,可能還有 ROW(世界其他地區)* ResearchandMarkets.com(2022年10月)

NLS領導團隊Alex Zwyer,工商管理碩士首席執行官兼聯合創始人Alex Zwyer是公司的共同創始人,擁有豐富的C級製藥運營經驗。一位連續創業者和強有力的領導者,在 “完成交易” 方面有着良好的記錄。曾在全球專業製藥公司Viforpharma AG擔任首席運營官。還有一位退休的瑞士陸軍上尉。喬治·阿波斯托爾,醫學博士,碩士首席醫學官在製藥研發機構工作了20多年。禮來、輝瑞、雅培、諾華、夏爾和遠藤等全球研發組織在開發的早期、中期和晚期階段擁有豐富的藥物開發專業知識。獲得了傑出的研發獎項,並在美國、歐盟和日本獲得了多項監管批准。Elena Thyen——Pighin首席財務官埃裏克·科諾法爾,醫學博士,首席科學官兼合夥人——創始人一位藥物獵人和公司的聯合創始人,在臨牀和科學研究方面擁有深厚的知識和經驗。他是巴黎羅伯特德佈雷大學(APHP)小兒睡眠障礙中心的高級醫學顧問,並曾在巴黎羅伯特德佈雷大學臨牀藥理學和藥物遺傳學系擔任首席臨牀研究員。Thyen女士——Pighin女士在領導和管理職能方面擁有豐富的經驗,曾擔任多個行業的財務和人力資源主管。總部設在瑞士的Thyen-Pighin女士有着成功的往績,最值得注意的是私有和上市企業的會計記錄。

6 瑪麗安·蘭伯森,MSW 企業傳播與投資者關係主管哈維·庫什納高級生物統計顧問湯姆·庫什諾,工商管理碩士美國商業運營負責人比特·威德勒,博士質量主管埃爾韋·吉爾索,工商管理碩士業務開發與許可主管克里斯蒂娜·阿爾蓋爾美國公認會計準則財務運營經理詹妮弗·佛朗哥科學卓越主管傑夫·沙龍伯尼爾臨牀運營主管譚,工商管理碩士項目管理與戰略負責人包樂,管理碩士經驗豐富的團隊負責人安德烈亞斯Fischer 供應鏈負責人 Sam Salamone,理學碩士,工商管理碩士,RAC CMC 負責人 Jim Herman 毒理學負責人 Alex Zwyer,工商管理碩士首席執行官聯合創始人喬治·阿波斯塔爾,醫學博士,醫學博士,首席科學官 Co.——創始人 Elena Thyen-Pighin 首席財務官

NLS 管道概述支持臨牀前化合物適應症治療的第三階段 2 期研究領域在 140 多個國家擁有 100 多項專利,包括髮作性睡病、特發性睡眠過多症和克萊因萊文綜合症 • 注意力缺陷多動症 • 伴有路易體病、帕金森氏病和/或阿爾茨海默氏病的神經系統疾病治療 Mazindol ER Narcoldol's Epsy NT1 發作性睡病 NT2 特發性睡眠過度睡眠障礙 NLS-4 特發性睡眠增多症NLS-11 Kleine-Levin Syndrome NLS-4 CFS/ME Long COVID CNS/Immunology NLS-8 阿爾茨海默氏病神經退行性疾病 NLS-12 路易體病 NLS-1 多動症阿片類藥物使用障礙精神病學/成癮 NLS-3 注意力缺陷多動障礙自閉症譜系障礙藥物使用障礙
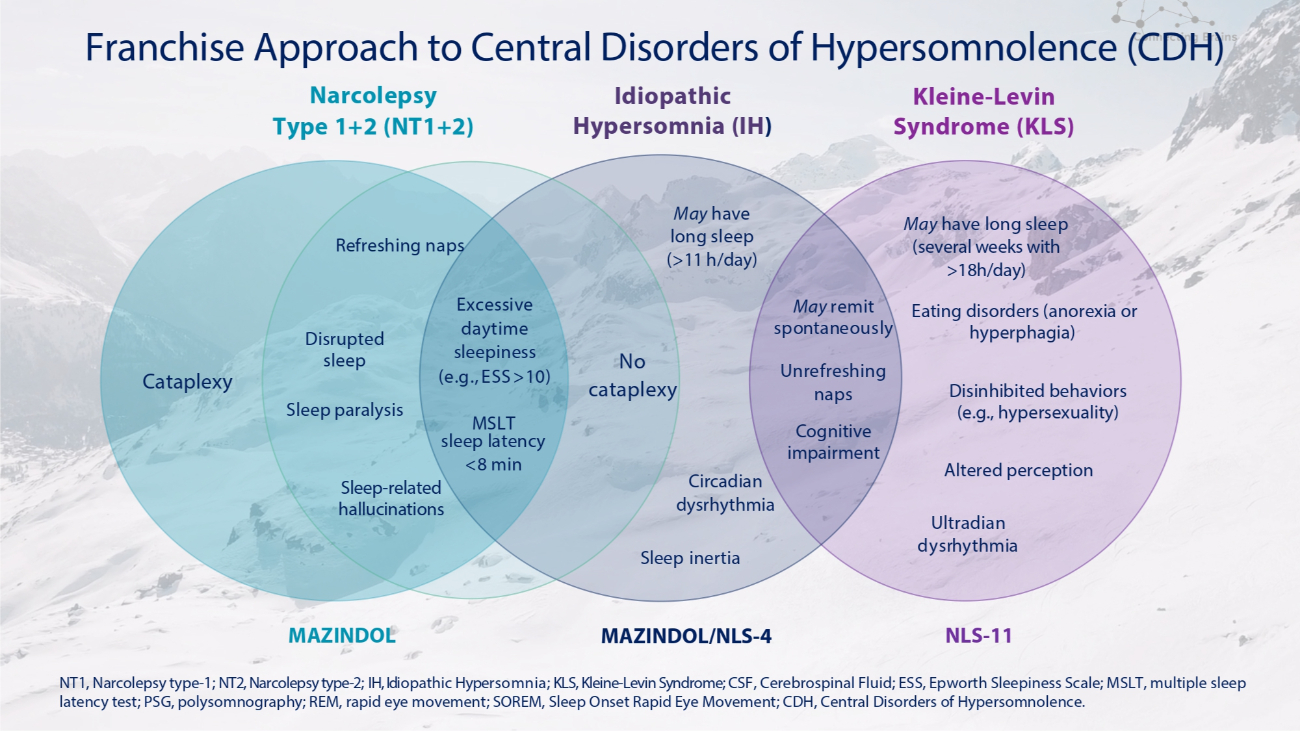
發作性睡病 1+2 型 (NT1+2) 特發性睡眠過度睡眠 (IH) 癱瘓睡眠中斷睡眠麻痺睡眠相關幻覺沒有癱瘓白天過度嗜睡(例如 ESS > 10)MSLT 睡眠潛伏期 11 小時/天)可能會自發地緩解晝夜節律失常知覺改變 Kleine-Levin 綜合症 (KLS)) 睡得不爽認知障礙 Ultradian 心律失常可能睡眠時間長(數週,每天超過 18 小時)飲食失調(厭食症或食慾亢進)抑制行為(例如性慾亢進)MAZINDOL MAZINDOL/NLS-4 NLS-11NT1,發作性睡病類型-1;NT2,發作性睡病類型-2;IH,特發性睡眠過度;KLS,Kleine-Levin 綜合症;腦脊液;ESS,愛普沃斯嗜睡量表;MSLT,多重睡眠潛伏試驗;REM,快速眼動;SOREM,睡眠發作性快速眼動;CDH,中樞性疾病過度沉迷。特許經營方法治療中樞性睡眠障礙(CDH)

發作性睡病一覽

10 1. www.ncbi.nlm.nih.gov/pmc/articles/pmc/pmc6492289/ 2.北極星市場研究(2023 年 4 月)3. 2018 年全國知情發作性睡病調查。https://knownarcolepsy.com/hcp/impact 發作性睡病使人衰弱的市場;龐大且服務不足 • 全球有 300 萬人患病 • 僅在美國有 20 萬人被確診 • 有 60-70,000 人被確診 • 17,000 人服用 SXB(2022年)來源:www.narcolepsynetwork.org • 經典發作性睡病與極低或無法檢測到的荷爾蒙攝取素水平有關大腦 1 • 預計到2032年,全球發作性睡病療法市場將達到77.5億美元(2022年:31.4億美元),複合年增長率為9.5% 2 •沒有市售的產品可以解決食慾素不足的問題;大多數患者對他們的治療仍然不滿意 3

11 12% 認為自己的發作性睡病症狀已完全或基本得到控制 93% 對目前的治療方案表示失望 94% 表示需要新的治療方案醫療需求未得到滿足的嚴重罕見病在 Xyrem® 的三期試驗中,78%-85% 的患者需要興奮劑治療來控制症狀。* 目前尚無治癒方法,許多患者報告他們的藥物無法改善症狀。資料來源:2018 年。全國知情發作性睡病調查。https://knownarcolepsy.com/hcp/impact *Xyrem 標籤和在常規臨牀實踐中長期使用羥丁酸鈉治療發作性睡病伴發作性睡病的安全性和有效性(睡眠醫學 35 (2017) 80-84)
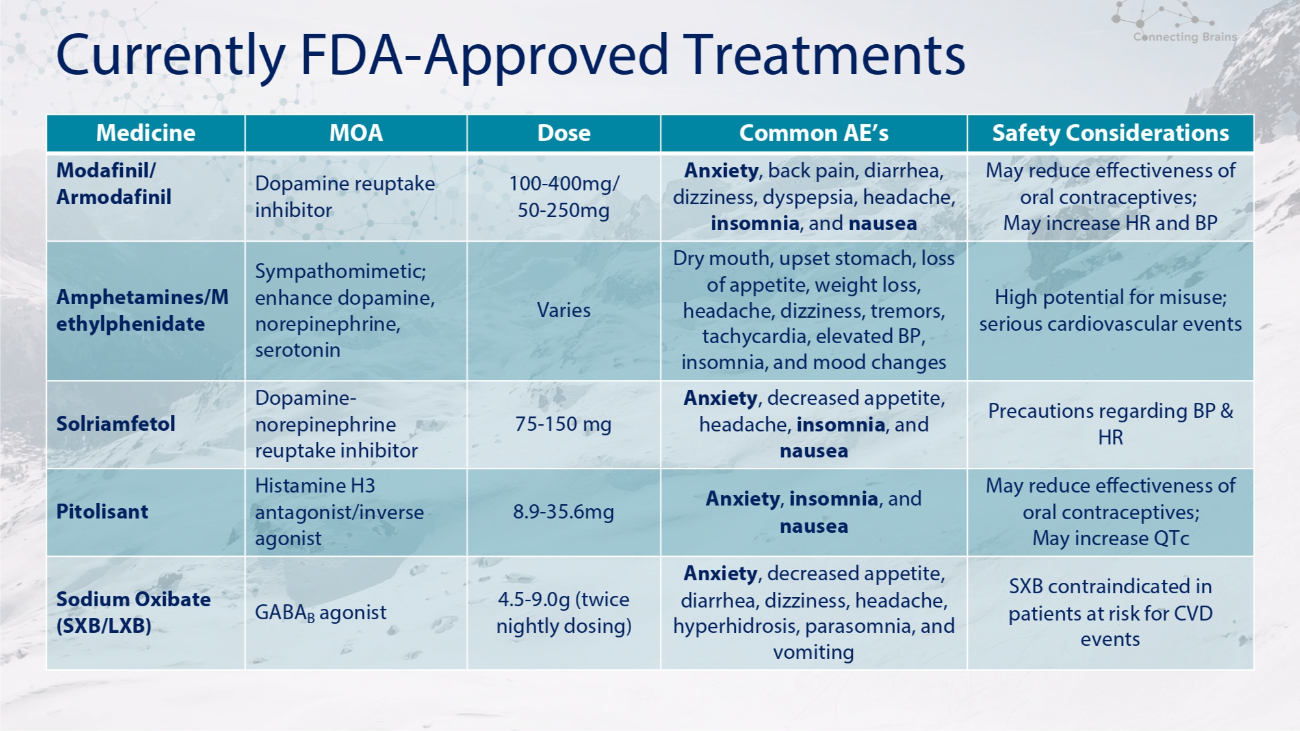
目前 FDA-批准的治療安全注意事項 AE 的常見劑量 MOA 藥物可能會降低口服避孕藥的有效性;可能會增加心率和血壓焦慮、背痛、腹瀉、頭暈、消化不良、頭痛、失眠和噁心 100-400mg/ 50-250mg 多巴胺再攝取抑制劑莫達非尼/阿莫達非尼濫用的可能性很高;嚴重的心血管事件口乾、胃部不適、食慾不振、體重減輕失落、頭痛、頭暈、震顫、心動過速、血壓升高、失眠和情緒變化各異擬交感神經藥;增強多巴胺,去甲腎上腺素、血清素苯丙胺/哌醋乙酯關於血壓和心率的預防措施焦慮、食慾下降、頭痛、失眠和噁心 75-150 mg 多巴胺-去甲腎上腺素再攝取抑制劑 Solriamfetol 可能會降低口服避孕藥的有效性;可能會增加 qTc 焦慮、失眠和噁心 8.9-35.6mg 組胺 H3 拮抗劑/輸入有心血管疾病事件風險的患者禁用逆激動劑 Pitolisant SXB 焦慮、食慾下降、腹瀉、頭暈、頭痛、多汗症、異睡症和嘔吐 4.5-9.0g(每晚給藥兩次)GABA B 激動劑氧化鈉 (SXB/LXB)
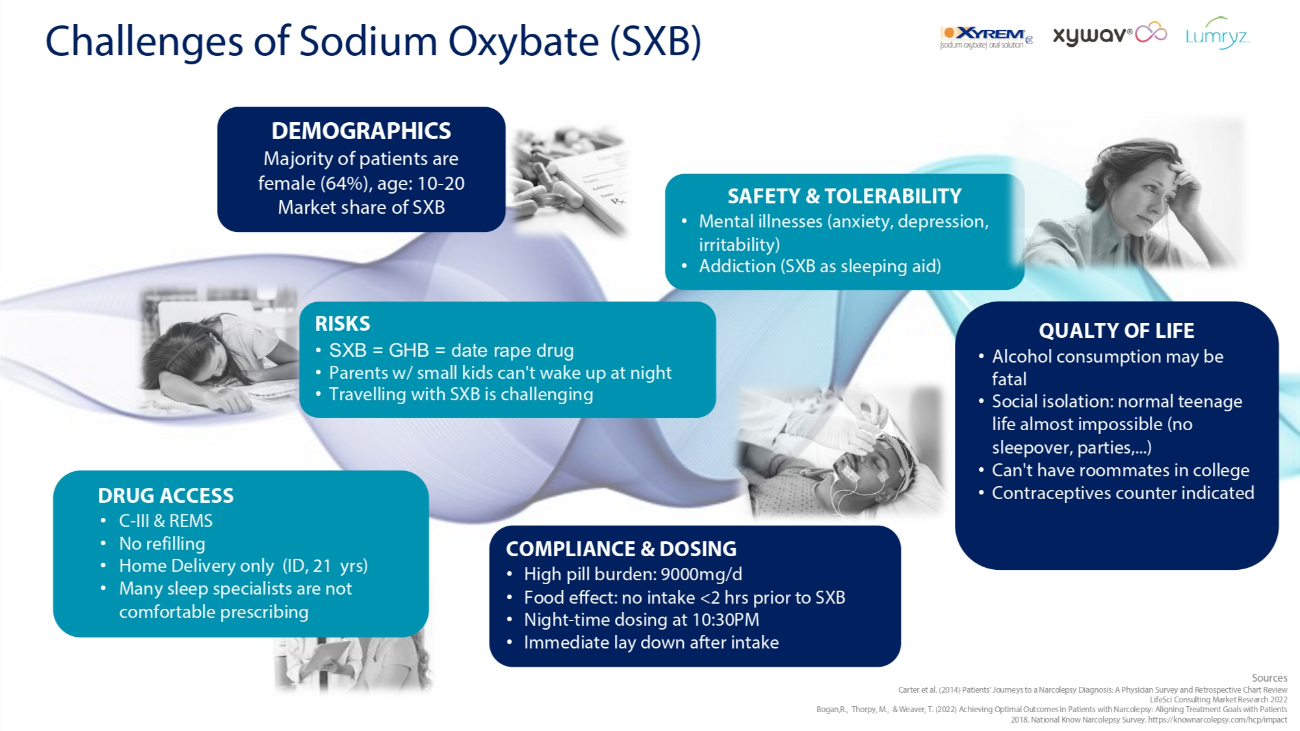
羥丁酸鈉(SXB)合規性和劑量方面的挑戰 • 高藥丸負擔:9000mg/d • 食物效應:不攝入
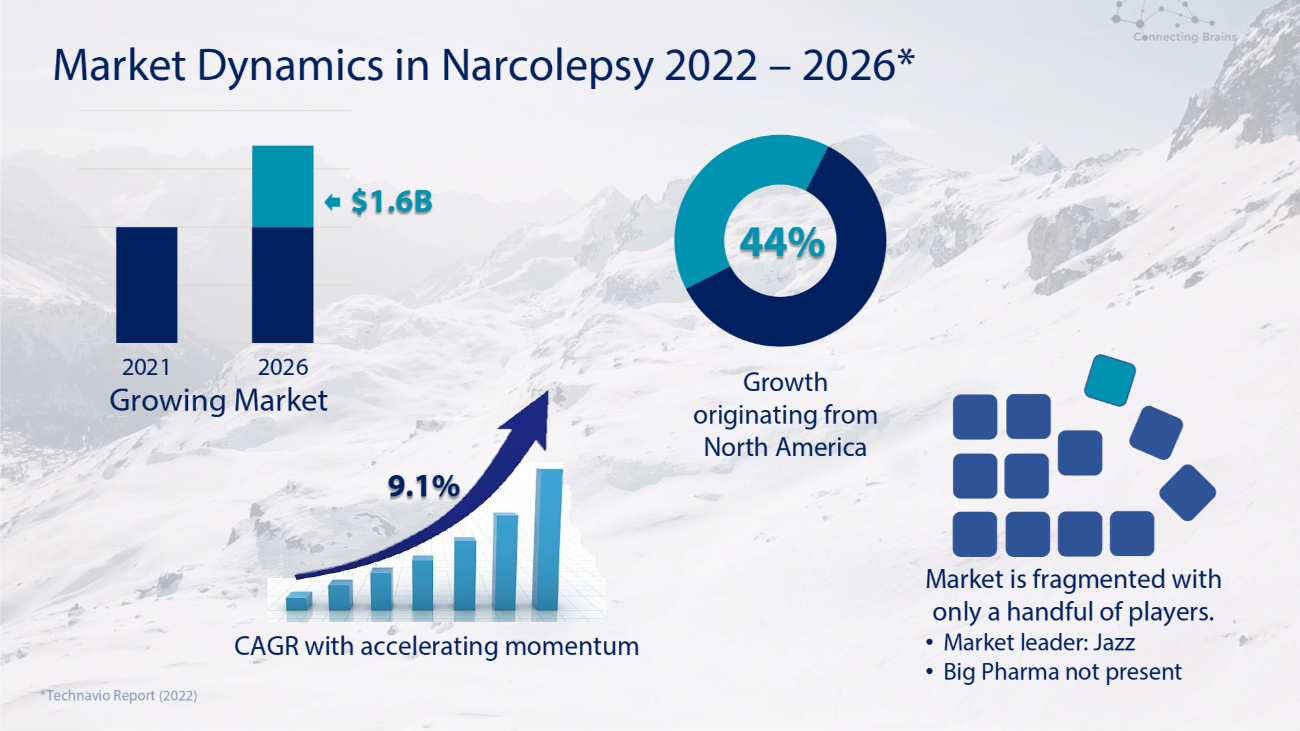
2022年至2026年發作性睡病的市場動態*增長源自北美*Technavio報告(2022年)市場分散,只有少數參與者。• 市場領導者:爵士 • 大型製藥公司未公佈2021年2026年增長的市場複合年增長率,勢頭加快 9.1% 16億美元 44%

Mazindol ER (3mg)

• 用於治療發作性睡病的活性成分(mazindol)的悠久歷史(“同情用藥” 計劃)• 部分食慾素的新型雙重作用機制——2 受體激活和三重單胺再攝取抑制 • 2 期陽性結果:符合大多數終點,具有很高的統計學意義和良好的安全性/耐受性 • 每日一次配方 • 快速起效 • 藥物相互作用潛力低 • 低濫用可能性:IV • 有可能作為發作性睡病的單一療法 Mazindol ER 雙 SNDRI/OX2R 激動劑
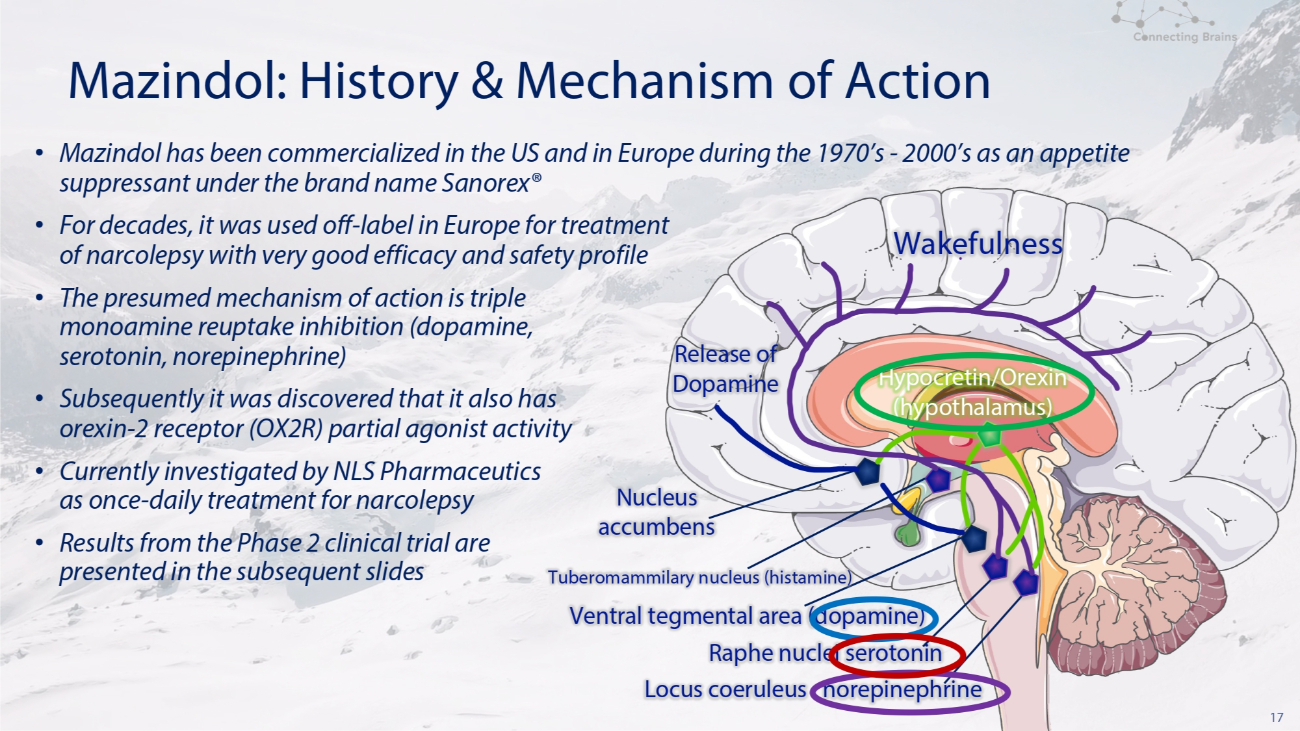
17 Mazindol:歷史和作用機制覺醒性釋放伏隔核結節乳腺核(組胺)腹側包皮區(多巴胺)Raphe 核血清素去甲腎上腺素 Locus coeruleus locus coeruleus 去甲腎上腺素 • Mazindol 在 1970 年代至 2000 年代作為食慾抑制劑在美國和歐洲商業化,品牌名稱為 Sanpenhren orex® • 幾十年來,它在歐洲一直被不合時宜地用於治療發作性睡病,具有非常好的療效和安全性 • 假定的作用機制是三重單胺再攝取抑制(多巴胺,血清素、去甲腎上腺素)• 隨後發現它還具有食慾素-2 受體(OX 2 R)部分激動劑活性 • NLS Pharmaceutics 目前正在研究一次——發作性睡病的每日治療方法 • 2 期臨牀試驗的結果見隨後的幻燈片 Hypocretin/Orexin(下丘腦)

Mazindol ER 臨牀開發計劃 POLARIS

19 POLARIS:發作性睡病的Mazindol ER開發計劃POLARIS包括兩項美國臨牀試驗 • NLS-1021 第二階段,一項為期四周的雙盲、安慰劑對照、隨機、美國多中心研究,對比安慰劑,每日一次(1:1)• NLS-1022 開放標籤延期,一項開放標籤延期(OLE)研究可供選擇完成為期四周的NLS 1021研究後的個人。這項OLE研究為參與者提供了每天早上口服一次Mazindol ER的機會,持續長達六個月。
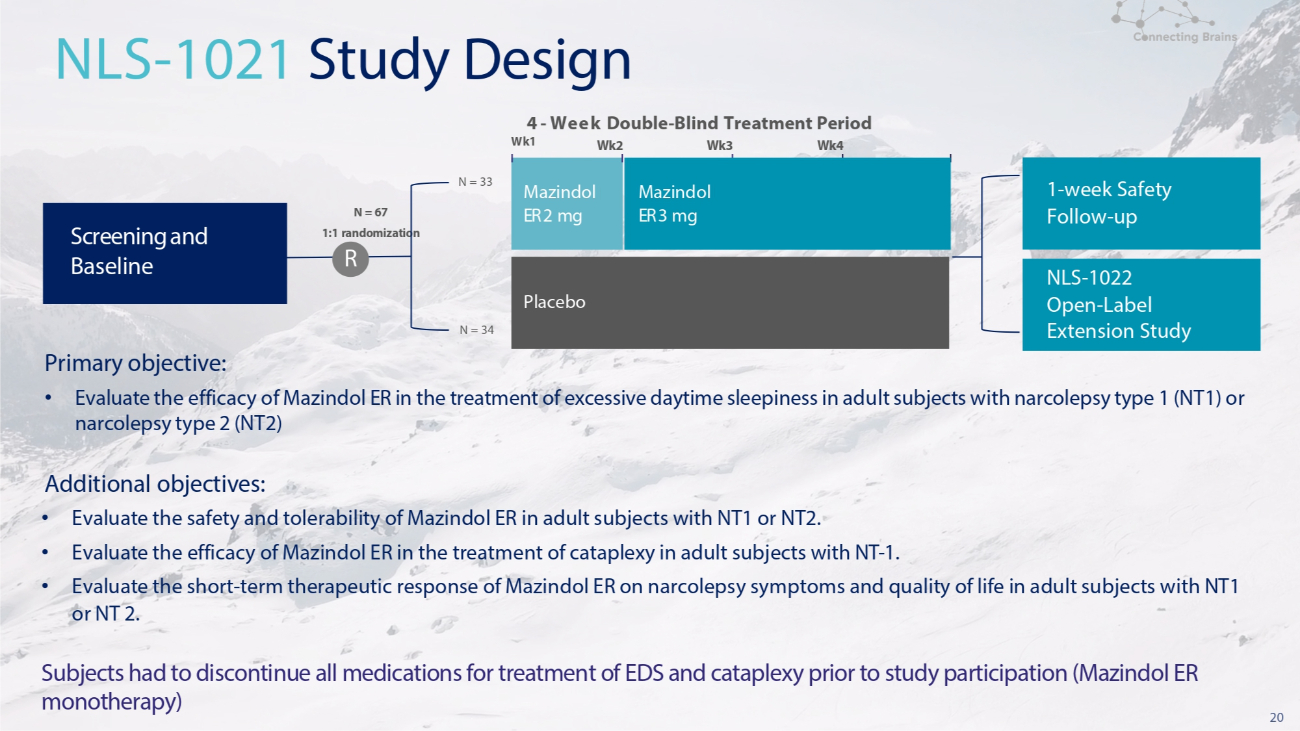
20 主要目標:• 評估 Mazindol ER 治療 1 型發作性睡病 (NT1) 或 2 型發作性睡病 (NT2) 成人受試者日間過度嗜睡的療效。其他目標:• 評估 Mazindol ER 對 NT1 或 NT2 成人受試者的安全性和耐受性。• 評估 Mazindol ER 治療成人受試者癱瘓的療效-1. • 評估 Mazindol ER 對患有 NT1 或 NT 2 的成年受試者的發作性睡病症狀和生活質量的短期治療反應。受試者在參與研究前必須停用所有用於治療急性呼吸障礙和猝倒的藥物(Mazindol ER 單一療法)N = 33 Wk1 N = 34 4-雙週——盲人治療期 Wk2 Wk3 Wk4 NLS-1021 研究設計 Mazindol ER 2 mg 安慰劑 Mazindol ER 3 mg 篩查和基線 1 周安全隨訪——向上 NLS-1022 開放——標籤延期研究 N = 67 1 隨機化 R

第 2 階段的主要功效導致白天過度嗜睡 (EDS)
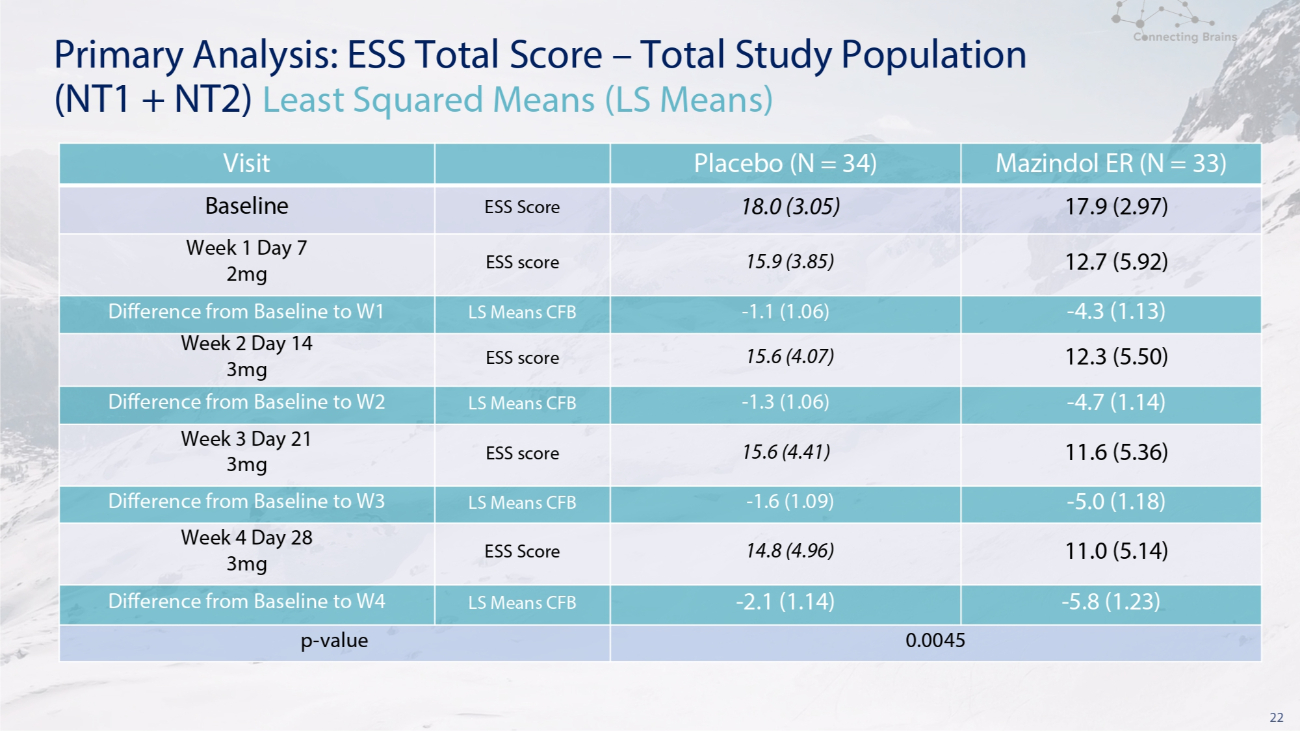
22 主要分析:ESS 總分——研究人羣總數(NT1 + NT2)最小二乘均值(LS 均值)Mazindol ER(N = 33)安慰劑(N = 34)訪問 17.9(2.97)18.0(3.05)ESS 分數基線 12.7(5.92)15.9(3.85)ESS 分數第 1 周第 7 天 2mg-4.3(1.13)-1.1(1.06)表示 LS CFB 差異從基線到第 1 季度 12.3 (5.50) 15.6 (4.07) ESS 分數第 2 周 14 天 3mg-4.7 (1.14)-1.3 (1.06) LS 表示從基線到 W2 的 CFB 差異 11.6 (5.36) 15.6 (4.41) ESS 分數第 3 周 21 天 3mg-5.0 (1.18)-1.6 (1.09) LS 表示從基線到 W3 的 CFB 差異 11.0 (5.14)14.8 (4.96) ESS 分數第 4 周第 28 天 3mg-5.8 (1.23)-2.1 (1.14) LS 表示基線與 W4 的 CFB 差異 0.0045 p-值
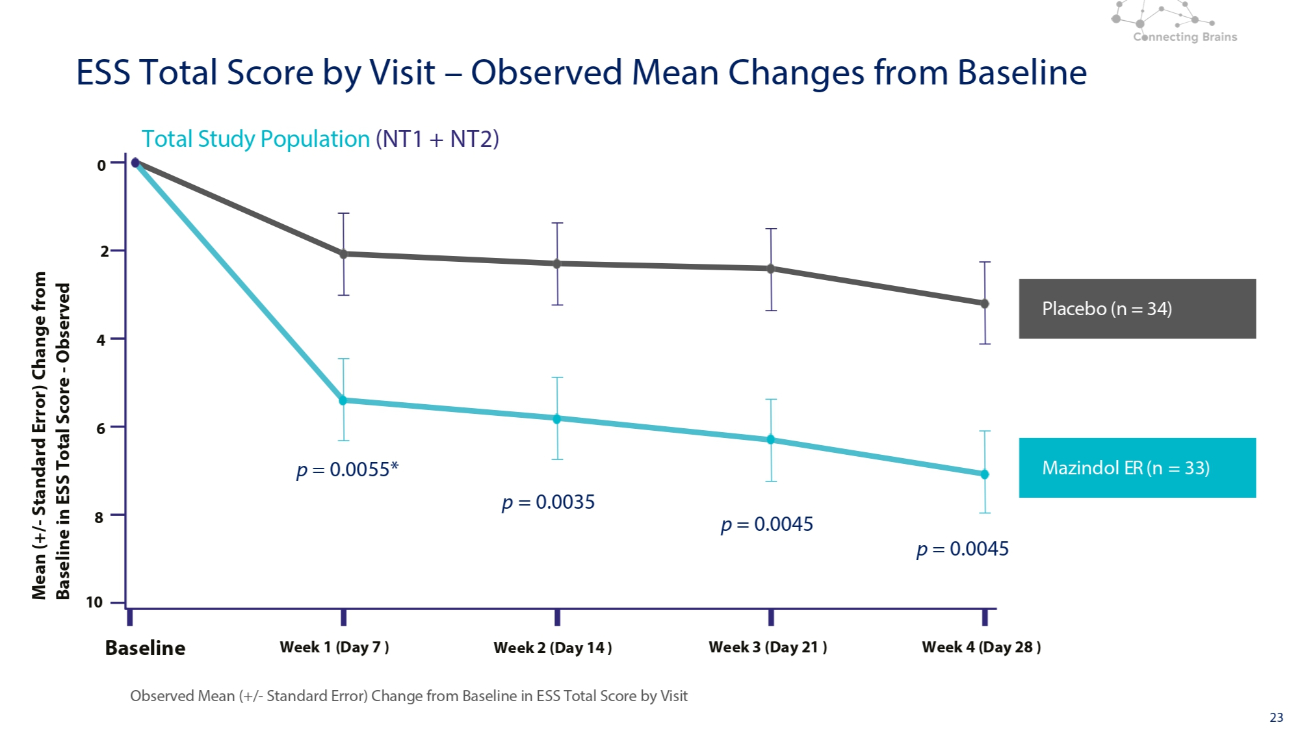
23 安慰劑(n = 34)Mazindol ER(n = 33)總研究人羣(NT1 + NT2)按訪問量觀測到的ESS總分與基線的變化情況 0 2 4 6 8 10 基準周 1(第 7 天)第 2 周(第 14 天)第 3 周(第 21 天)第 4 周(第 28 天)ESS 總分與基線的平均值(+/-標準誤差)與 ESS 總分基線相比的變化訪問分數 — 觀測到的與基線相比的平均變化 p = 0.0055* p = 0.0045 p = 0.0045 p = 0.0045 p = 0.0035

第 2 階段二級療效結果 Cataplexy
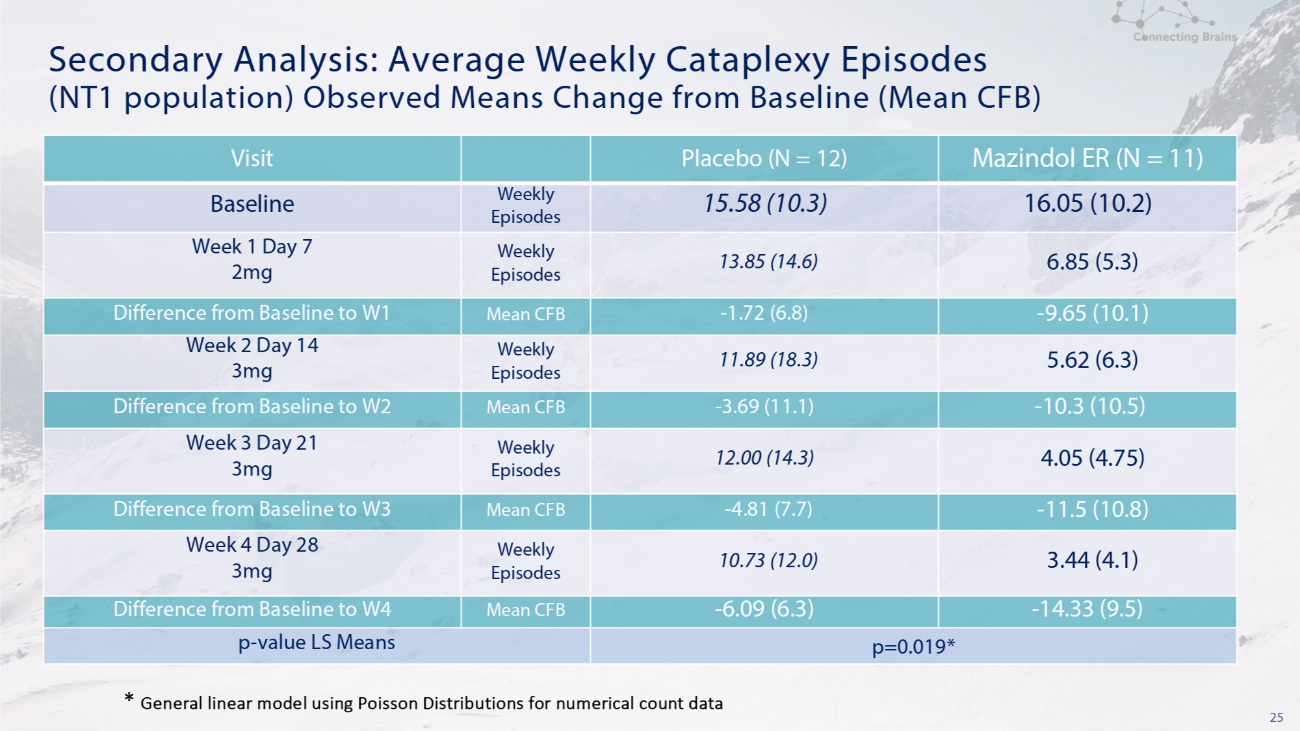
25 次要分析:觀察到的每週平均腳痛發作次數(NT1 人羣)是指與基線(平均CFB)相比的變化 Mazindol ER(N = 11)安慰劑(N = 12)訪問 16.05(10.2)15.58(10.3)每週發作基線 6.85(5.3)13.85(14.6)每週劇集第 1 天 2mg-9.65(10.1)-1.72(6.8)平均值 CFB 差異從基線到第 1 季度 5.62 (6.3) 11.89 (18.3) 每週劇集第 2 天 14 天 3mg-10.3 (10.5)-3.69 (11.1) 基線與 W2 的平均 CFB 差 4.05 (4.75) 12.00 (14.3) 每週劇集第 3 周 21 天 3mg-11.5 (10.8)-4.81 (7.7) 平均值 CFB基線與 W3 的差異 3.44 (4.1) 10.73 (12.0) 每週劇集第 4 周 28 天 3mg-14.33 (9.5)-6.09 (6.3) 與基線與 W4 的平均 CFB 差 p=0.019* p-值 LS 均值 * 使用泊松分佈作為數字計數數據的通用線性模型
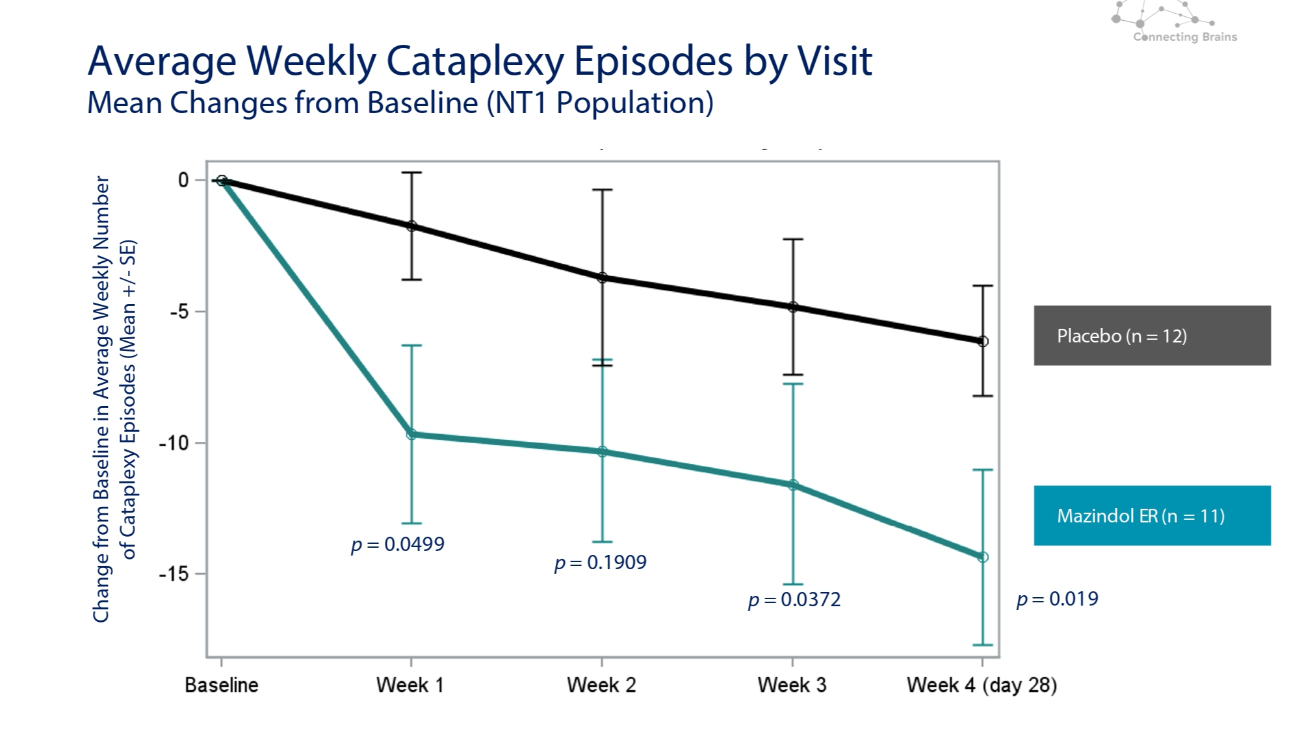
按就診次數劃分的每週平均猝倒發作次數與基線(NT1 人羣)的平均變化與基線相比的變化安慰劑(n = 12)Mazindol ER(n = 11)p = 0.0499 p = 0.1909 p = 0.0372 p = 0.0372 p = 0.019
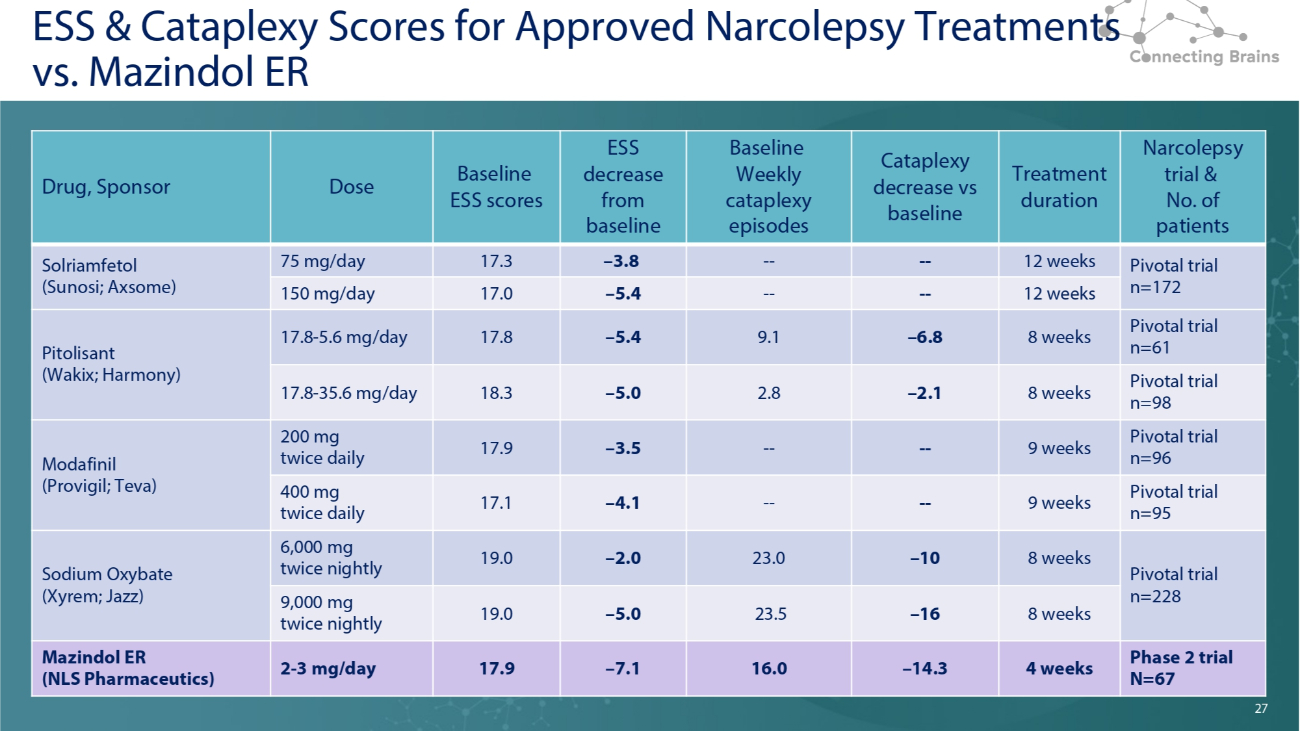
27 經批准的發作性睡病治療的ESS和Cataplexy分數與Mazindol ER發作性睡病試驗的ESS和Cataplexy分數和患者數量治療時間與基線基線相比每週猝倒發作 ESS 低於基線基線 ESS 分數劑量藥物,發起人關鍵試驗 n=172 周---— 3.8 17.3 75 mg/天 Solriamfetol(Sunosi;Axsome)12 周----5.4 17.4 17.2 周 0 150 mg/天 Pivotal 試驗 n=61 8 周 — 6.8 9.1 — 5.4 17.8 17.8-5.6 mg/天 Pitolisant(Wakix;Harmony)關鍵試驗 n=98 8 周 — 2.1 2.8 — 5.0 18.3 17.8-35.6 mg/天關鍵試驗 n=969 周----— 3.5 17.9 200 mg 每日兩次莫達非尼(Provigil;Teva)Pivotal 試驗 n=95 9 周----4.1 17.1 400 mg 每日兩次 Pivotal 試驗 n=228 周 — 10 23.0 — 2.0 19.0 6,000 mg 每晚兩次氧苯甲酸鈉(Xyrem;Jazz)8 周 — 16 23.5 — 5.0 19.0 9,000 mg 每晚兩次 2 期試驗 N=228 67 4 周 — 14.3 16.0 — 7.1 17.9 2-3 mg/天 Mazindol ER (NLS Pharmaceutics) 27

28 總結療效結果 • 與安慰劑相比,在治療4周後,睡眠和癱瘓症都有臨牀意義的改善 • 即使使用2 mg,也能快速起作用(1 周內)• 儘管樣本量很小,但任何時間點都持續改善 EDS 和猝倒症狀 • 強烈的安慰劑效應並未阻止 Mazindol ER 在評估的大多數主要和次要措施中進行有意義的分離

第 2 階段結果安全性和耐受性
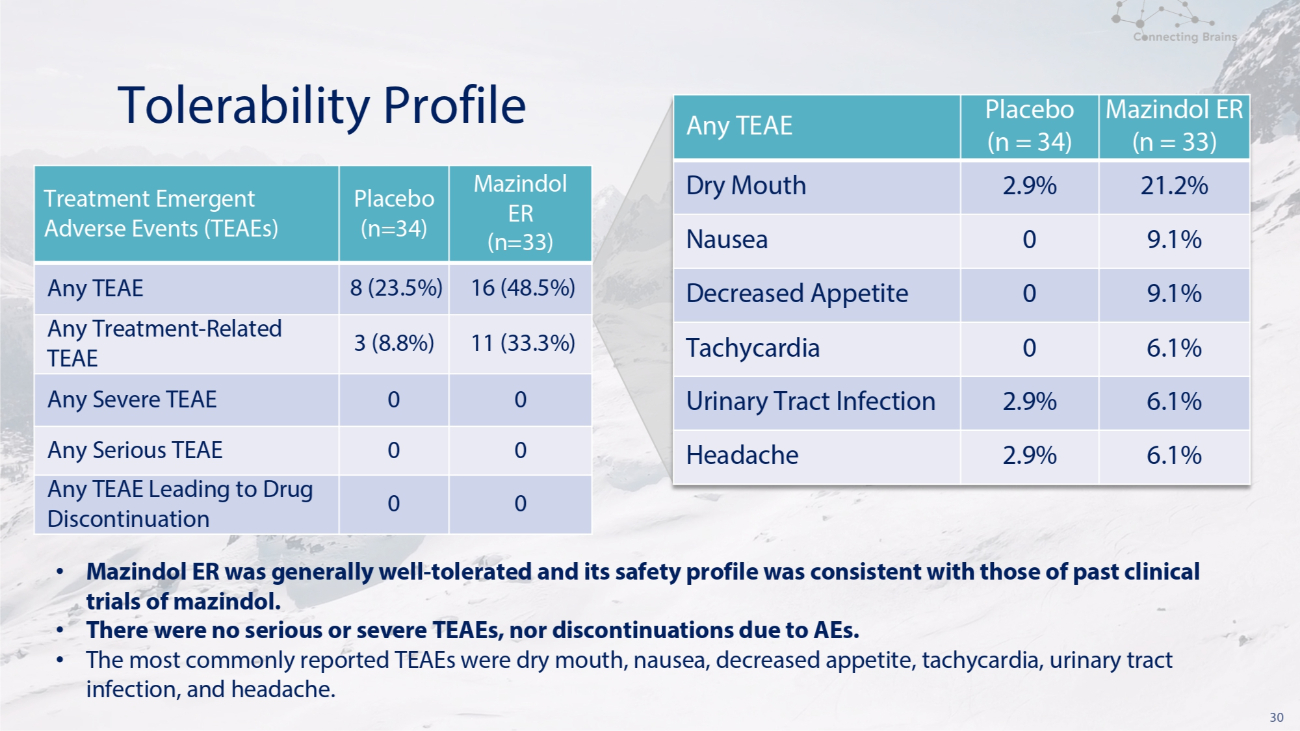
30 耐受性概況 Mazindol ER (n=33) 安慰劑 (n=34) 治療緊急不良事件 (TEAE) 16 (48.5%) 8 (23.5%) 任何 TEAE 11 (33.3%) 3 (8.8%) 任何治療-相關 TEAE 0 0 0 任何嚴重的 TEAE 0 0 任何導致停藥的 TEAE (n = 33) 安慰劑 (n = 33) 安慰劑 (n = 33) = 34) 任何 TEAE 21.2% 2.9% 口乾 9.1% 0 噁心 9.1% 0 食慾下降 6.1% 0 心動過速 6.1% 2.9% 尿路感染 6.1% 2.9% 頭痛 • Mazindol ER 總體耐受性良好,其安全性與過去的臨牀試驗一致mazindol。• 沒有嚴重或嚴重的 TEAE,也沒有因不良反應而停藥。• 最常報告的 TEAE 是口乾、噁心、食慾下降、心動過速、尿路感染和頭痛。

31 安全結果摘要 • 沒有患者因不良反應停藥 • 所有不良事件均為輕度或中度 • 所有不良事件均為輕度或中度不良事件 • 大多數不良事件自發消退(無需幹預)• Mazindol ER 耐受性良好,即使是最常見的不良反應(口乾、噁心、食慾減退)本質上也是良性的,發生在五分之一或更少的患者身上 • mazindol 沒有明顯的差異在生物化學、血液學、心電圖或生命體徵方面對比 PBO,但增幅除外心率(約 11bpm)和體重減輕(約 1.3 千克)

開放標籤擴展研究結果功效
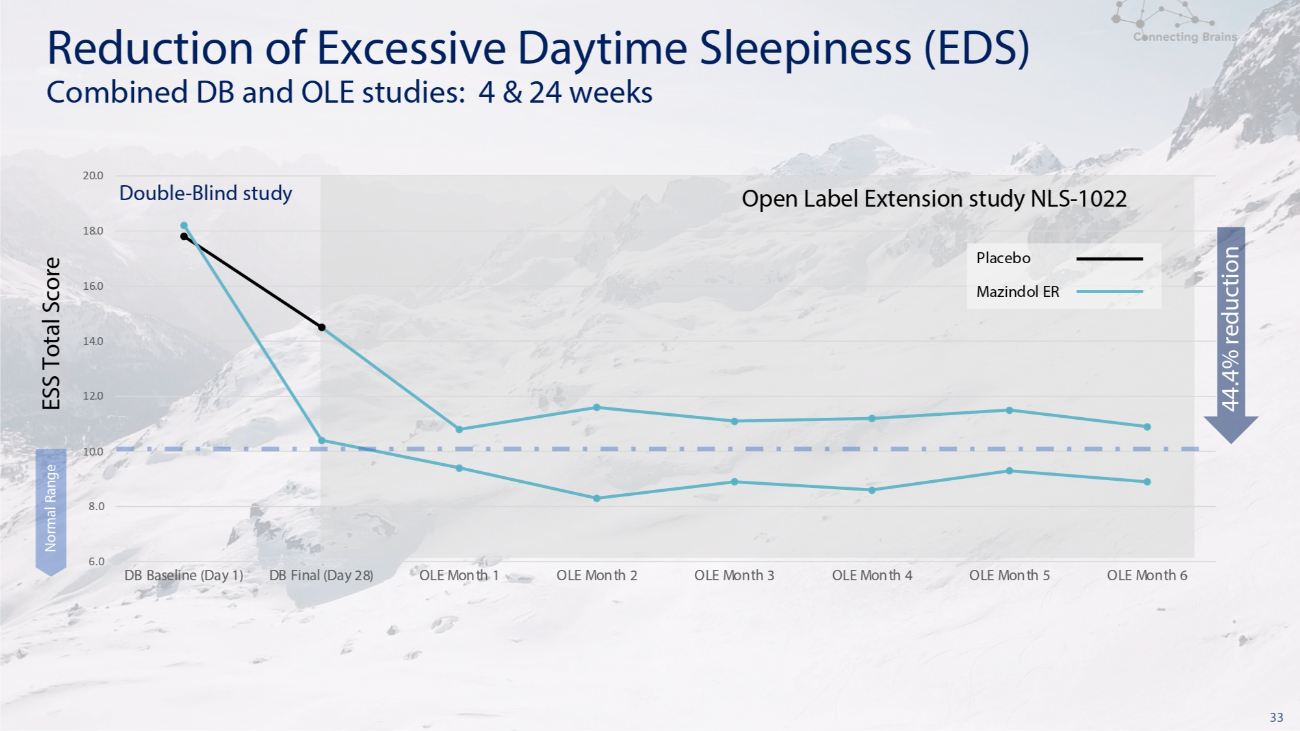
33 6.0 8.0 10.0 12.0 14.0 16.0 16.0 20.0 DB 基線(第 1 天)DB 決賽(第 28 天)OLE 第 1 個月 2 OLE 月 3 OLE 月 4 OLE 月 5 OLE 月 6 正常範圍安慰劑 Mazindol ER Double-盲目研究開放標籤擴展研究 NLS-1022 減少日間過度嗜睡 (EDS) DB 和 OLE 聯合研究:4 和 24 周 ESS 總分降低 44.4%
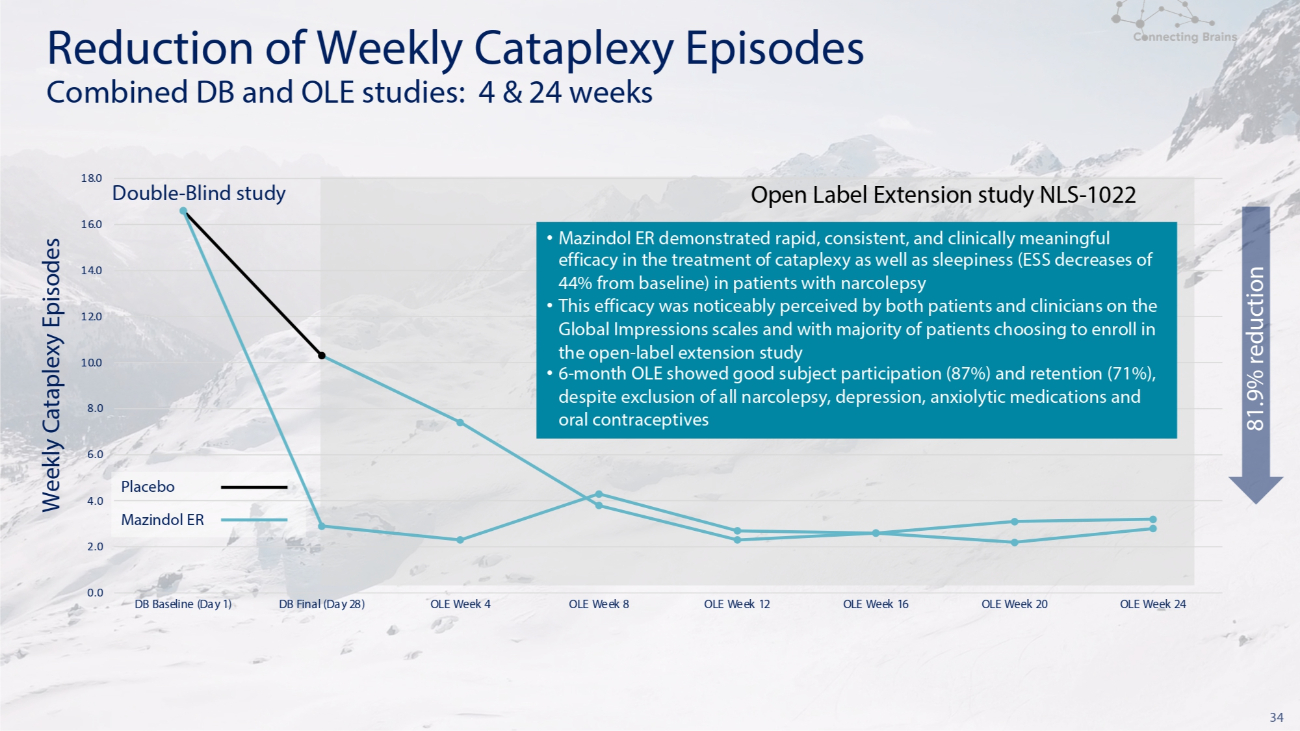
34 雙盲研究開放標籤擴展研究 NLS-1022 減少每週崩潰發作聯合研究:4 和 24 周 6.0 安慰劑 4.0 Mazindol ER 2.0 0.0 8.0 10.0 12.0 14.0 16.0 18.0 DB 基線(第 1 天)DB 決賽(第 28 天)OLE 第 8 周 OLE 周 16 OLE 周 16 OLE 周 20 OLE 周 24 每週降低 81.9% Mazindol ER 在治療發作性睡病患者的猝倒和睏倦(ESS 比基線下降了 44%)方面顯示出快速、一致且具有臨牀意義的療效 • 這個根據Global Impressions量表,患者和臨牀醫生都明顯看到了療效,大多數患者選擇參加開放標籤延期研究 • 儘管排除了所有發作性睡病、抑鬱症、抗焦慮藥物和口服避孕藥,但為期6個月的OLE顯示出良好的受試者參與度(87%)和保留率(71%)

35 18 16 14 12 10 8 6 4 2 0 DB 研究 20 DB BL DB W 1 DB W 2 DB W 4 W 1 W 2 W 3 W 4 W 5 W 6 W 7 W 8 W 9 W 10 W 11 W 12 W 13 W 14 W 15 W 16 W 17 W 18 W 19 W 21 W 22 W 23 W 24 總課題 1070-001 開放標籤擴展研究案例研究:主題 1070-001 DB 和 OLE 聯合研究 • 23 歲女性 • 1 型發作性睡病(含猝倒)• 在 DB 和 OLE 中均使用 mazindol ER 進行治療 W1 W 2 W 3 W 4 W 5 W 6 W 7 W 8 W 9 W 10 W 11 W 12 W 13 W 14 W 15 W 16 W 17 W 18 W 19 W 20 W 21 W 22 W 23 W 24 每週癱瘓對象 1070-001 DB 研究 12 開放標籤擴展研究 10 8 6 4 2 0 DB BL W 1 DB W 2 DB W 3 DB W 3 DB W 4 正常範圍

Open Label 擴展研究結果安全性與耐受性
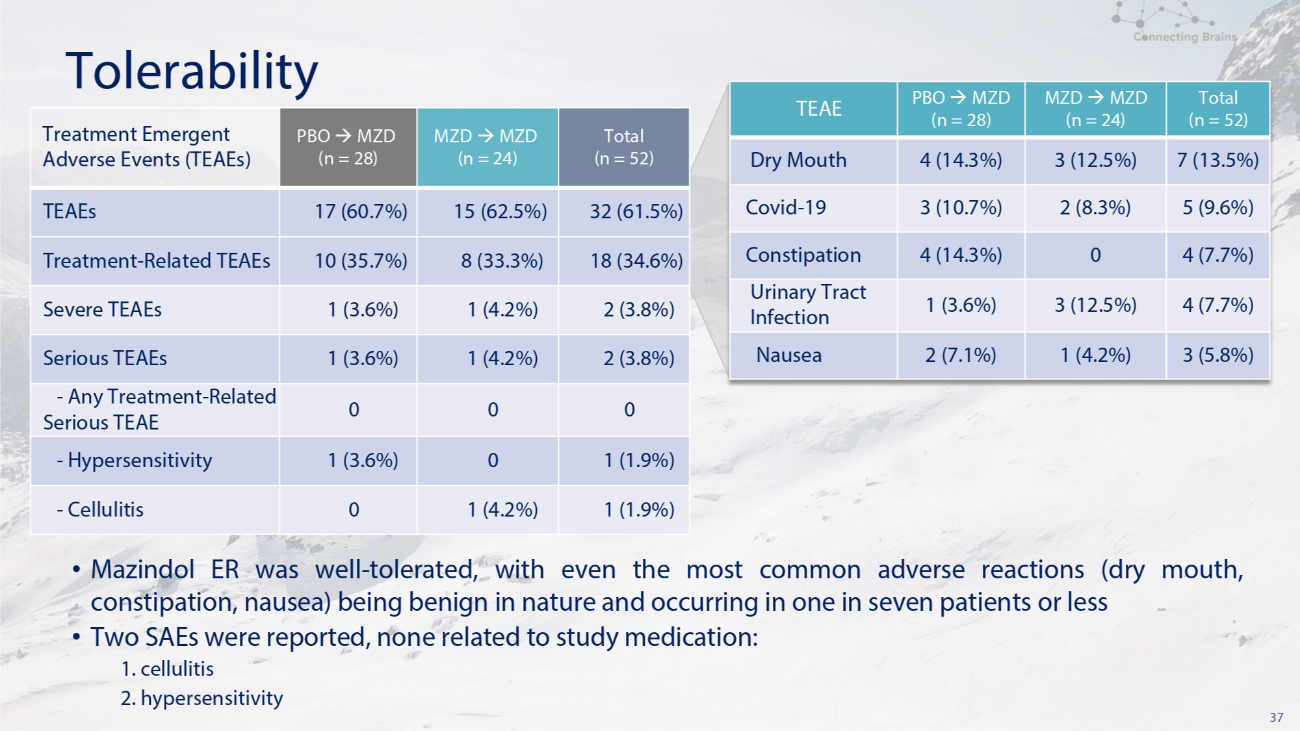
37 總耐受性 (n = 52) MZD (n = 24) PBO MZD (n = 28) TEAE 7 (13.5%) 3 (12.5%) 4 (14.3%) 4 (14.3%) 口乾 5 (9.6%) 2 (8.3%) 3 (10.7%) 3 (9.6%) 3 (3.6%) Covid-19 4 (7.7%) 0 (14.3%) 便祕 4 (7.7%) 3 (12.5%) 1 (3.6%) 尿路感染 3 (5.8%) 1 (4.2%) 2 (7.1%) 總噁心 (n = 52) MZD MZD (n = 24) PBO MZD (n = 28) 治療緊急不良事件 (TEAE) 32 (61.5%) 15 (62.5%) 17 (60.7%) 17 (60.7%) TEAES 18 (34.6%) 8 (33.3%) 10 (35.7%) 治療相關 TEAES 2 (3.7%) 8%) 1 (4.2%) 1 (3.6%) 重度 TEAE 2 (3.8%) 1 (4.2%) 1 (3.6%) 1 (3.6%) 嚴重 TEAE 0 0 0-任何治療-相關嚴重的 TEAE 1 (1.9%) 0 1 (3.6%)-超敏反應 1 (1.9%) 1 (4.2%) 0-蜂窩組織炎 • Mazindol ER 耐受性良好,即使是最常見的不良反應(口乾、便祕、噁心)本質上也是良性的,發生在七分之一的患者中 • 報告了兩例 SAE,與研究藥物無關:1. 蜂窩織炎 2. 超敏反應

38 POLARIS:OLE 結論 • 這項為期 6 個月的 OLE 發作性睡病研究顯示出良好的受試者參與度(87%)和保留率(71%),尤其是在排除任何發作性睡病/抑鬱/抗焦慮藥物的情況下 • 治療依從性高,幾乎沒有藥物下降——報告了滴定(11.5%)• 可靠的療效數據證實了中期結果:• ESS 較數據庫研究基線下降了44% • Cataplexy下降了82% 從數據庫研究基線來看 • Mazindol 的耐受性良好,61.5% 的患者報告至少有一次 AE,34.6% 的患者報告至少接受過一次治療-相關 AE • 最常見的不良反應是口乾、便祕和噁心,發生在不到七分之一的患者中 • 報告了兩例 SAE,均與研究藥物(蜂窩組織炎和超敏反應)無關 • 本研究證實了先前描述的馬辛多爾的心血管效應,其幅度與興奮劑和 SNRI 的心血管效應相似

39 第 3 階段計劃 NLS-1031,NLS-1032 和 NLS-1033

40 個 3 期發作性睡病項目兩項相同的安慰劑對照三期試驗,調查了 Mazindol ER 與安慰劑,外加一項為期 12 個月的延期研究 NLS-1033 • 開放標籤,為完成 NLS-1031 和 NLS 的參與者延長一年-1032 NLS-1032 2023 年秋季 20-25 個美國 1 型發作性睡病 (NT1) 主要參與者終點:通過電子日記輔助終端:ESS 和 PROMIS-SRI 衡量的崩潰攻擊的變化
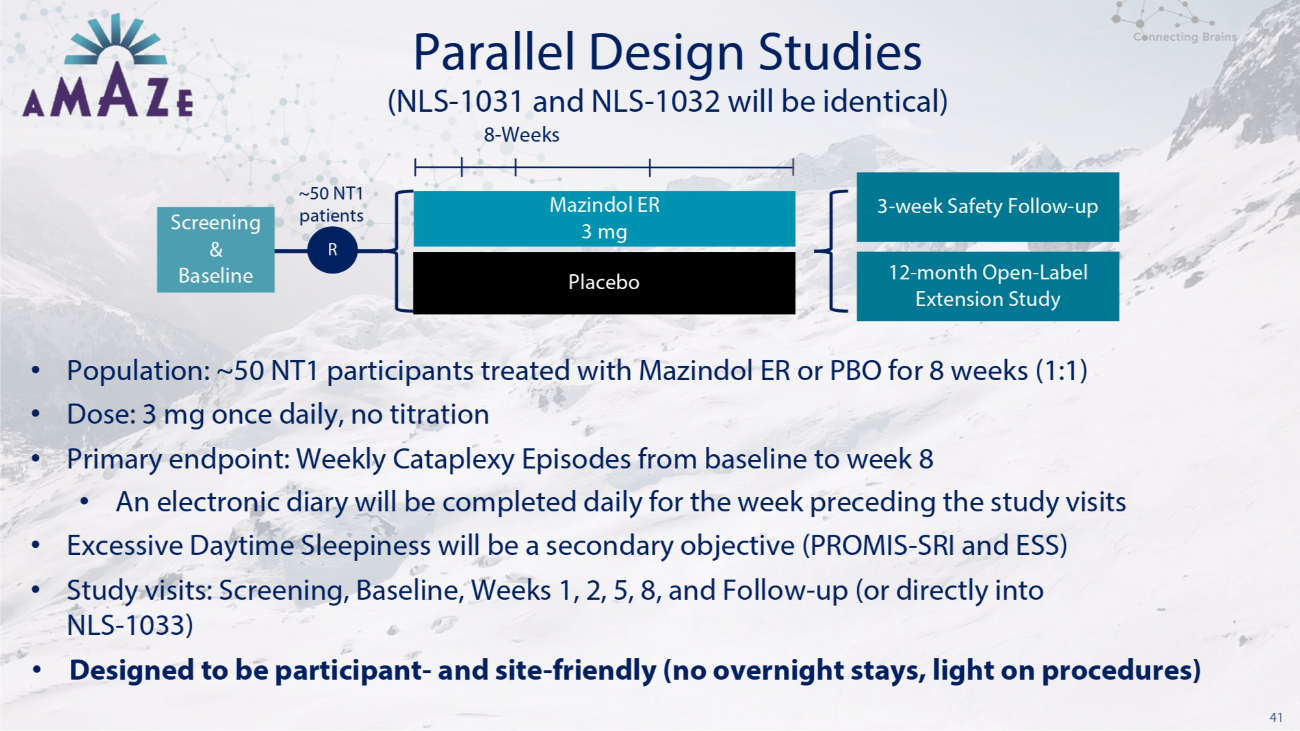
41 項平行設計研究 • 人羣:約 50 名 NT1 受試者接受了 Mazindol ER 或 PBO 治療 8 周(1:1)• 劑量:3 mg,每日一次,無需滴定 • 主要終點:從基線到第 8 周的每週一次癱瘓發作 • 研究訪問前一週將每天完成電子日記 • 白天過度嗜睡將是次要目標(PROMIS-SRI 和 ESS)• 研究訪問:篩查,基準,第 1、2、5、8 周和隨訪(或直接進入 NLS-1033)• 專為參與者和場地友好而設計(不允許過夜,光線充足)手術中)安慰劑(NLS-1031 和 NLS-1032 將相同)8 周篩查和基線 ~50 名 NT1 患者 R Mazindol ER 3 mg 3 mg 3 周安全隨訪——向上 12 個月開放——標籤延期研究

42 12 個月 OLE 研究(NLS-1033)• 研究設計:一項為期 52 周、開放標籤、多中心研究,每日一次 Mazindol ER 3 mg • 研究人羣:約 100 名參與者(研究完成者來自 NLS-1031 和 NLS-1032)• 研究中允許使用急救性發作性睡病/精神藥物 • 主要目標:Mazindol ER 的長期安全性和耐受性 • 次要目標:Mazindol ER在治療Cataplexy和EDS中的長期治療反應 • 研究訪問:基線,第2、4、12、26、40、52 周,隨訪 NLS-1032 52-每週開放-標籤治療週期 Mazindol ER 3 mg 3 周安全隨訪NLS-1031 ~100 名 NT1 患者

Mazindol ER (3mg) 競爭優勢

44 如果獲得批准,Mazindol ER 可為發作性睡病提供便捷的每日一次單一療法選擇簡單,每日一次,單一療法,早餐前 30 分鐘有效 Mazindol ER 對發作性睡病的其他症狀快速起效有利的藥物-藥物相互作用潛力(例如避孕藥)附表四:濫用、濫用和轉移的可能性低 Mazindol ER 是一種可用的研究藥物僅用於臨牀試驗。3mg QD 同類首創,雙重作用機制可解決主要發作性睡病症狀特徵明確且易於控制的安全性和耐受性概況 TMRI OX2R
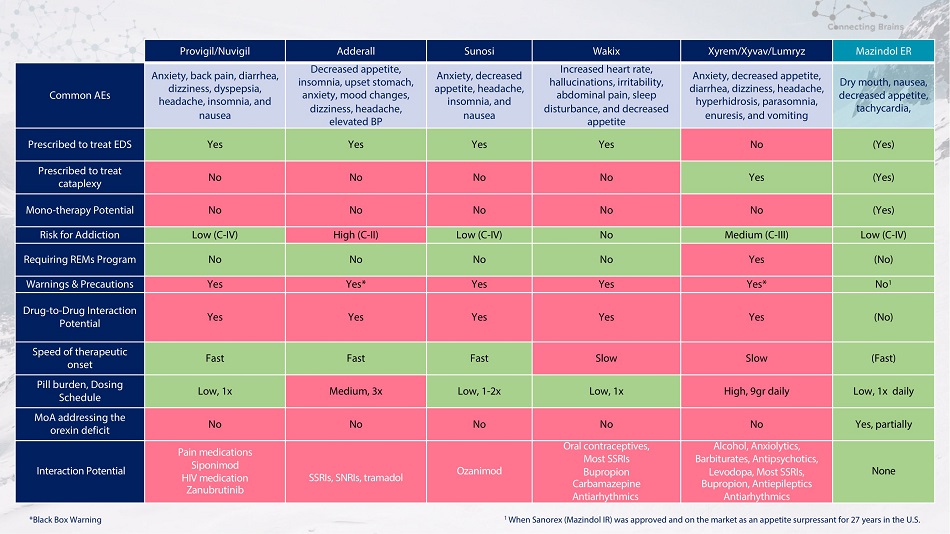
Provigil/Nuvigil Adderall Sunosi Wakix Xyrem/Xyvav/Lumryz Mazindol ER 常見病例焦慮、背痛、頭暈、消化不良、頭痛、失眠和噁心食慾下降、失眠、胃部不適、焦慮、情緒變化、頭暈、頭痛、失眠和噁心心率加快、幻覺煩躁、易怒、腹痛、睡眠障礙和食慾下降焦慮、食慾不振、腹瀉、頭暈、頭痛、多汗症、失眠、遺尿和嘔吐口乾、噁心、食慾減退、心動過速、處方用於治療 EDS 是是是否(是)處方治療猝倒性否不是(是)單一療法不不不不是(是)成癮風險低(C-IV)高(C-IV)低(C-IV)低(C-IV)不中等(C-IV)低(C-IV)需要 REMS 計劃否否不是(否)警告和注意事項是的*是的*不是 1 種藥物相互作用潛力是是是是(否)治療起效速度快快慢慢(快)藥丸負擔低,給藥時間表低,1x 中等,3x 低,1-2x 低,1x 高,9gr每日低點,針對食慾素缺乏的每日一次 MoA 不不不是,部分相互作用潛在的止痛藥西波尼莫德 HIV 藥物 Zanubrutinib SSRI、SNRI、曲馬多 Ozanimod 口服避孕藥、大多數 SSRI 安非他酮卡馬西平抗心律失常藥酒精、抗焦慮藥、巴比妥類藥物、抗精神病藥、左旋多巴、大多數 SSRI、Bupropia Pion,抗癲癇藥抗心律失常藥無 1 當Sanorex(Mazindol IR)在美國獲得批准並作為食慾抑制劑上市27年時 *黑匣子警告

時間軸

47 *時間表可能會更改。無法保證任何臨牀試驗的成功。此外,整個監管過程存在固有的風險和可變性。美國食品和藥物管理局可能不予批准,或者美國食品和藥物管理局可能要求的研究參數與提交的研究參數不同。預期開發時間表 * 2026 年 2025 年第二季度第四季度 2023 年第二季度第 2 季度於 2021 年 9 月商業保密協議提交 AMAZE 啟動中期標題發佈的 AMAZE 數據發佈已在世界第二階段試驗 (LPO) 試驗 (FPI) 第二階段試驗中完成第 3 階段關鍵北極星數據庫結果睡眠 2022 2024 2025 2026 2023 2023 年第一季度第 2 階段結束 FDA 會議 2022 年第二季度啟動搶先體驗 IH 程式
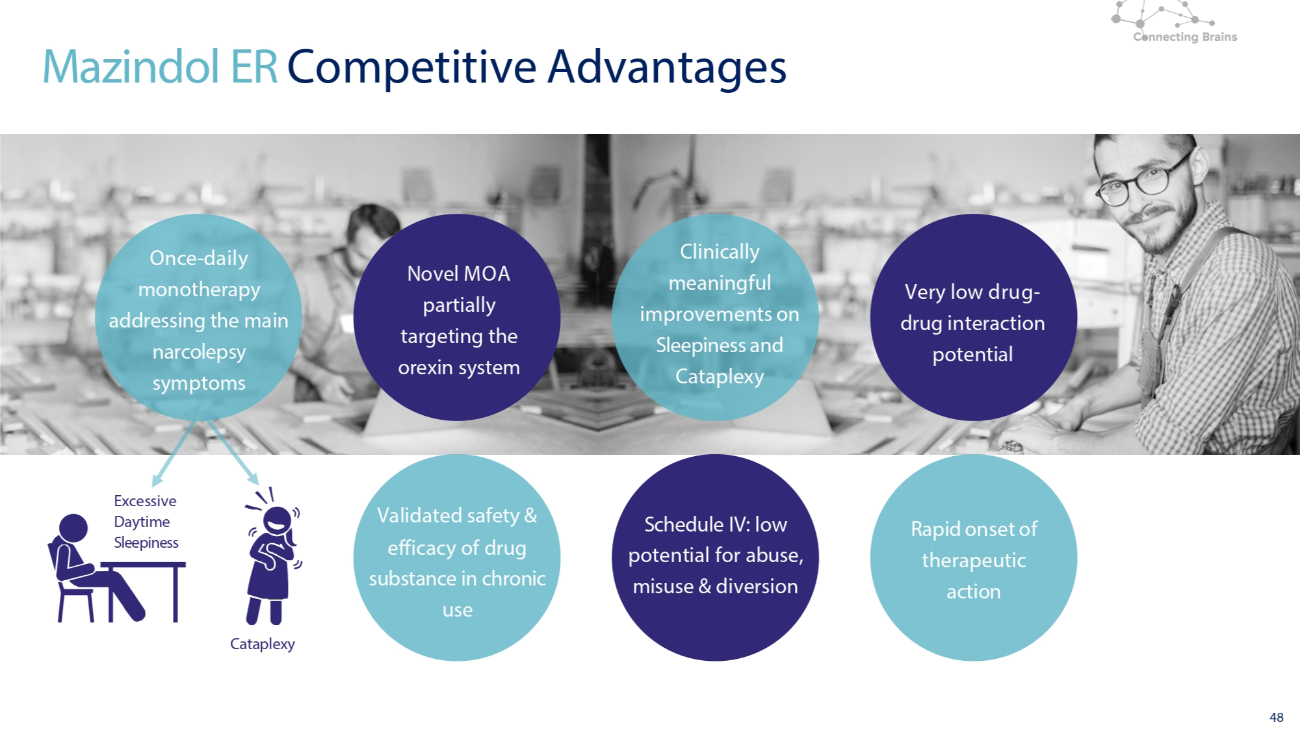
48 項新型 MOA 部分針對食慾素系統經過驗證的長期使用藥物的安全性和有效性臨牀上有意義的改善附表四:濫用、濫用和轉移的可能性極低藥物-藥物相互作用的可能性極低 Mazindol ER 競爭優勢 Cataplexy 白天過度嗜睡一次-針對主要發作性睡病症狀的單一療法

49 重新定義中樞神經系統療法