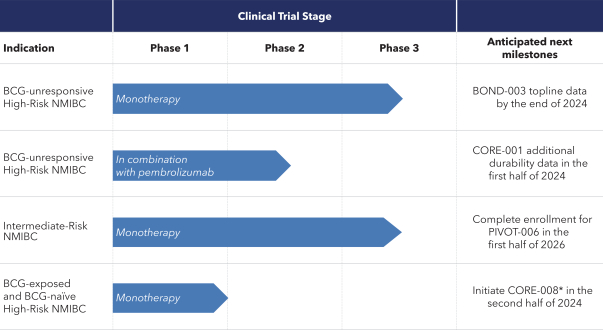
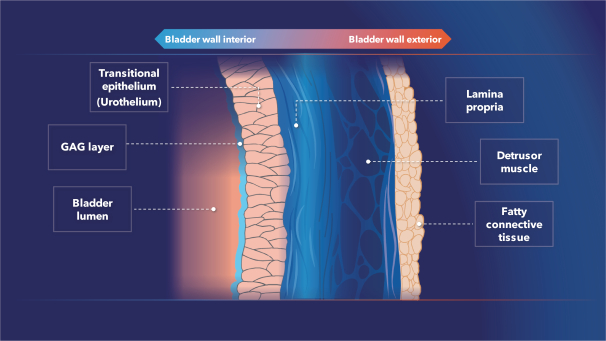
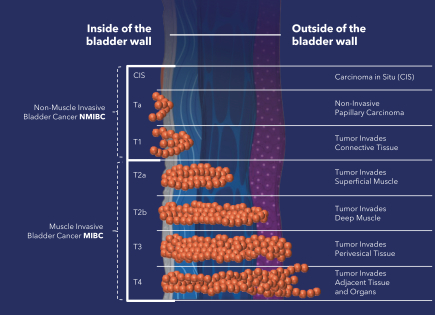
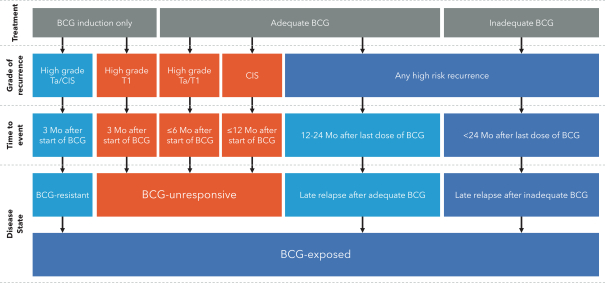
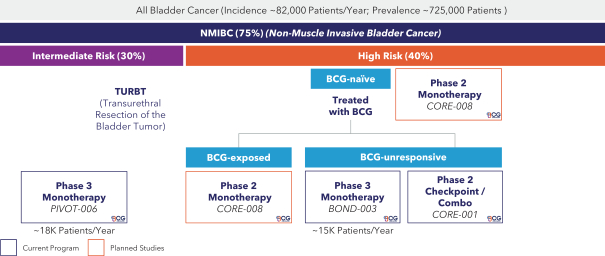
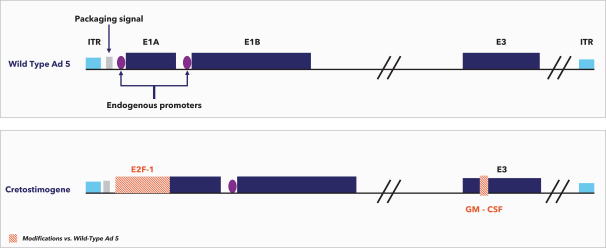
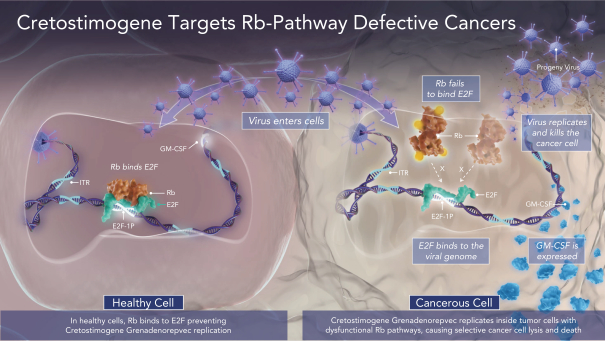
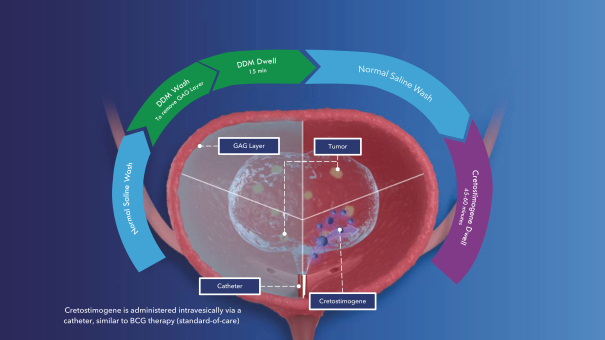
| (5) |
代表經度優質基金L.P.和經度風險投資夥伴IV,L.P.收購的證券。Brian
Liu,M.D.是經度資本管理公司的董事經理,也是我們的董事會成員。 |
二次售股
於2023年10月,本公司持股量超過5%的ORI Capital附屬公司豐裕供應環球有限公司與本公司股本的若干其他持有人訂立股份轉讓協議,據此,豐裕供應環球有限公司以每股1.2872美元的收購價出售合共27,190,800股C系列可贖回可轉換優先股,總收購價為34,999,997.84美元(亞盛環球二次發售)。在這些交易中,豐盛供應環球有限公司向我公司(德成資本環球)5%以上的股東德成資本全球生命科學基金IV,L.P.出售了3,107,520股C系列可贖回可轉換優先股
向我公司持股超過5%的德成資本全球生命科學基金IV,L.P.,向TCG Crossover Fund I,L.P.出售了3,107,520股C系列可贖回可轉換優先股,
向我公司的附屬公司經度創投夥伴公司的關聯實體經度優質基金出售了3,107,520股C系列可贖回可轉換優先股
以及向Preresite Capital關聯實體發行總計3,107,520股C系列可贖回可轉換優先股。關於ASGL二次出售,吾等與豐裕供應環球有限公司及各買方於2024年1月訂立股份轉讓協議,豐裕供應環球有限公司將其所有股份轉讓予其聯屬公司Unique Diamond Investments Limited。
於2023年8月,經緯優質與本公司股本持有人的附屬公司訂立股份轉讓協議,根據該協議,經緯優質以每股0.9073美元的收購價出售1,756,323股C系列可贖回可轉換優先股,總收購價為1,593,511.86美元(2023年8月經緯二級市場交易)。於2023年7月,經度優質與樂普控股有限公司訂立股份轉讓協議,據此,經度優質向樂普控股有限公司
購入3,512,646股C系列可贖回可轉換優先股,每股收購價0.9073美元,總收購價3,187,023.72美元(2023年7月經度二次交易)。覺普,當時的董事,在2023年7月經度
二次交易時是樂普控股有限公司的附屬公司。關於2023年8月的經度二級交易和2023年7月的經度二級交易,我們與經度Prime和各交易對手訂立了股票轉讓協議。於2023年5月,經度風險投資夥伴IV,L.P(一家附屬於經度風險投資夥伴的實體)與不同股本持有人訂立普通股轉讓協議,根據協議,經度風險投資夥伴IV,L.P.以每股0.80055美元的收購價購買了8,873,500股普通股,總收購價為7,103,680.43美元(2023年5月經度二次交易)。關於2023年5月的經度二級交易,吾等與經度創投合夥人IV,L.P.及各賣方訂立普通股轉讓協議,據此,除其他事項外,吾等放棄優先購買交易中出售的普通股股份的權利。
2023年7月,德成資本環球與樂普控股有限公司訂立股份轉讓協議,據此,德成資本環球向樂普控股有限公司購入3,512,646股C系列可贖回可轉換優先股,每股收購價0.9073美元,總收購價3,187,023.72美元(2023年7月德成
二次交易)。覺普,當時的董事,在2023年7月德成二級市場交易時是樂普控股有限公司的關聯公司。於2023年6月,德誠資本環球與本公司股本持有人訂立股份轉讓協議,據此,德誠資本環球以每股0.91美元的收購價購買2,024,725股C系列可贖回可轉換優先股,總收購價為1,842,499.75美元(2023年6月的德誠
二次交易)。關於2023年7月的德誠二級交易及2023年6月的德成二級交易,吾等與德誠資本環球及各賣方訂立股份過户協議。2023年5月,德誠資本環球與不同股本持有人訂立普通股轉讓協議,據此,德誠資本環球以每股0.80055美元的收購價購買了8,873,500股普通股,總收購價為7,103,680.44美元(2023年5月的德成二次交易)。關於2023年5月的德誠二級交易,吾等根據
與德誠資本環球及各賣方訂立普通股轉讓協議,其中包括放棄優先認購交易中出售的普通股股份的權利。
161