
推進藥品發展。解決問題。改善生活。推進藥品發展。解決問題。改善生活。2024 年第一季度收益補充材料 2024 年 5 月 7 日 1

推進藥品發展。解決問題。改善生活。2® 免責聲明本演示文稿中的某些陳述包括1995年《私人證券訴訟改革法》所指的 “前瞻性陳述”。諸如 “相信”、“預測”、“計劃”、“期望”、“估計”、“打算”、“可能”、“將” 或這些術語的否定詞等詞語以及類似的表述旨在識別前瞻性陳述。這些前瞻性陳述包括但不限於關於我們的候選產品Anaphylm(腎上腺素)通過臨牀開發和美國食品藥品監督管理局(FDA)批准的進展和相關時機的陳述,包括提交Anaphylm的支持性臨牀研究;我們有能力在向美國食品藥品監督管理局提交的Anaphylm新藥申請(NDA)中提供足夠的數據,以迴應美國食品藥品監督管理局對我們臨牀的反饋包括與Anaphylm兒科項目相關的試驗;我們的能力發展我們的製造業務;我們的現金需求、現金資金和現金消耗;短期和長期流動性以及為業務運營提供資金的能力;我們的增長和未來的財務和經營業績和財務狀況,包括與2024年財務展望相關的財務狀況;以及業務戰略、市場機會和其他非歷史事實的陳述。這些前瞻性陳述基於我們當前的預期和信念,存在許多風險和不確定性,可能導致實際業績與前瞻性陳述中描述的結果存在重大差異。此類風險和不確定性包括但不限於與我們的開發工作相關的風險,包括我們的產品開發活動、臨牀試驗和計劃(包括與Anaphylm、AQST-108 和其他候選產品相關的計劃)的時機、成本和成功的任何延遲或變更;與公司為Libervant開展分銷工作相關的風險,包括公司分銷活動的時機、成本和成功以及擴大患者市場準入的任何延遲或變化 Libervant;提起訴訟的風險第三方與克服美國食品藥品管理局批准的針對2至5歲兒童癲癇患者的產品的孤兒藥獨家經營權有關;美國食品藥品管理局延遲對Anaphylm和我們的其他候選藥物的監管進展或根本未獲得美國食品藥品管理局批准的風險;公司有能力在藥代動力學和藥效學可比性提交的供FDA批准Anaphylm的藥代動力學和藥效學可比性報告中生成足夠數據的風險;公司的風險迴應美國食品藥品管理局對公司未來臨牀試驗和其他評論的能力美國食品和藥物管理局C類會議紀要中提出的有關Anaphylm的問題,包括美國食品和藥物管理局可能需要額外的臨牀研究才能批准Anaphylm的風險;任何競爭產品的成功風險;新產品商業化固有的風險和不確定性(包括技術風險、財務風險、市場風險和實施風險以及監管限制);候選產品未來商業化所需的銷售和營銷能力發展風險;資本和現金充足的風險資源,包括有足夠的可用債務和股權融資(包括根據我們的自動櫃員機融資機制和林肯公園收購協議)以及運營收入,以滿足我們所有的短期和長期流動性和現金需求以及其他現金需求,包括為2至5歲兒科患者與Libervant相關的商業化活動提供資金,為Anaphylm和 AQST-108 的未來臨牀開發活動以及Anaphylm的商業活動提供資金和/或 AQST-108 是已獲美國食品藥品管理局批准;我們的製造能力足以支持美國和國外對Libervant及其許可產品的需求的風險;Suboxone® 的市場份額受到侵蝕的風險,以及作為佔我們當前營業收入很大一部分的日落產品的風險;任何違約風險;與政府對Indivior的索賠相關的風險,我們許可、製造和銷售Suboxone並佔我們很大一部分的Suboxone 當前的營業收入;與某些銷售外包相關的風險,向第三方推銷及其他運營和工作人員職能;Libervant 對 2 至 5 歲癲癇患者的市場接受率和程度的風險;Anaphylm、AQST-108 和我們的其他候選產品和產品以及我們在美國和國外的許可產品;任何競爭產品(包括仿製藥)的成功風險、我們產品市場規模和增長的風險;遵守所有 FDA 和其他政府和客户對我們要求的風險製造設施;與智力相關的風險與我們的產品相關的產權和侵權索賠;意外專利開發的風險;影響我們業務的立法和監管行動以及法律或法規變化的風險,包括與我們的產品和候選產品以及產品定價、報銷或准入相關的法律或法規的風險;失去重要客户的風險;與索賠和法律訴訟相關的風險,包括專利侵權、證券、商業侵權、調查、產品安全或有效性以及反壟斷訴訟事宜;產品召回風險和撤回;與我們的信息技術網絡和系統中斷相關的風險,包括網絡攻擊的影響;遠程工作安排導致網絡安全攻擊增加和數據訪問中斷的風險;影響金融服務行業的不利事態發展的風險;與通貨膨脹和利率上升相關的風險;與 COVID-19 全球疫情和其他流行病對我們業務的影響相關的風險,包括與我們的臨牀試驗、站點啟動、患者入組相關的風險以及臨牀試驗、監管申報以及對候選產品的監管審查和批准的時間和充足性、我們的產品和候選產品中使用的藥物成分和其他原材料的供應情況、我們的產品和候選產品的供應鏈、製造和分銷;與總體經濟、政治(包括烏克蘭和以色列戰爭以及其他戰爭和恐怖主義行為)、商業、行業、監管、金融和市場狀況以及其他不尋常項目相關的風險和不確定性;以及其他影響我們的不確定性,包括 “風險因素” 部分中描述的不確定性,以及公司向美國證券交易委員會提交的2023年10-K表年度報告、10-Q表季度報告以及8-K表最新報告中所述的不確定性。鑑於這些不確定性,讀者不應過分依賴這些前瞻性陳述,這些陳述僅代表截至發佈之日。本警示性陳述明確規定了隨後歸因於公司或任何代表公司行事的人的所有前瞻性陳述。除非適用法律要求,否則在本演示文稿發佈之日之後,無論是由於新信息、未來事件還是其他原因,公司均沒有義務更新前瞻性陳述、展望或指導。PharmFilm® 和 Aquestive 徽標是 Aquestive Therapeutics, Inc. 的註冊商標。AQST-109 的 “Anaphylm” 商品名稱已獲得美國食品藥品管理局的有條件批准。Anaphylm 專有名稱的最終批准取決於美國食品藥品管理局對候選產品 AQST-109 的批准。此處提及的所有其他註冊商標均為其各自所有者的財產。© 2024 Aquestive Therapeutics, Inc.的財產

推進藥品發展。解決問題。改善生活。2024年第一季度收益:關鍵信息 AnaphylmTM(腎上腺素)舌下膠片 ❖ 關鍵研究符合所有主要和次要終點 ❖ 成功完成與美國食品藥品管理局的C型會議 ❖ 有望在2024年年底之前提交新藥申請(NDA)LibervantTM(地西泮)Buccal Film ❖ 獲得美國食品藥品管理局批准 Libervant,適用於兩至五歲患者已有多年曆史了 ❖ 該產品可立即提供給非醫療補助患者 AQST-108(腎上腺素)局部凝膠 ❖ 首次人體(FIH)研究的陽性結果加強資產負債表 ❖ 2024年第一季度末,現金餘額約為9,500萬美元 ❖ 通過承銷公開發行籌集了7,750萬美元,普通股每股4.50美元 1 ➢ 提供足夠的現金為Anaphylm計劃和公司運營提供資金 ➢ 將現金流延長至2026年 1 包括於2024年4月22日結束的總配股。
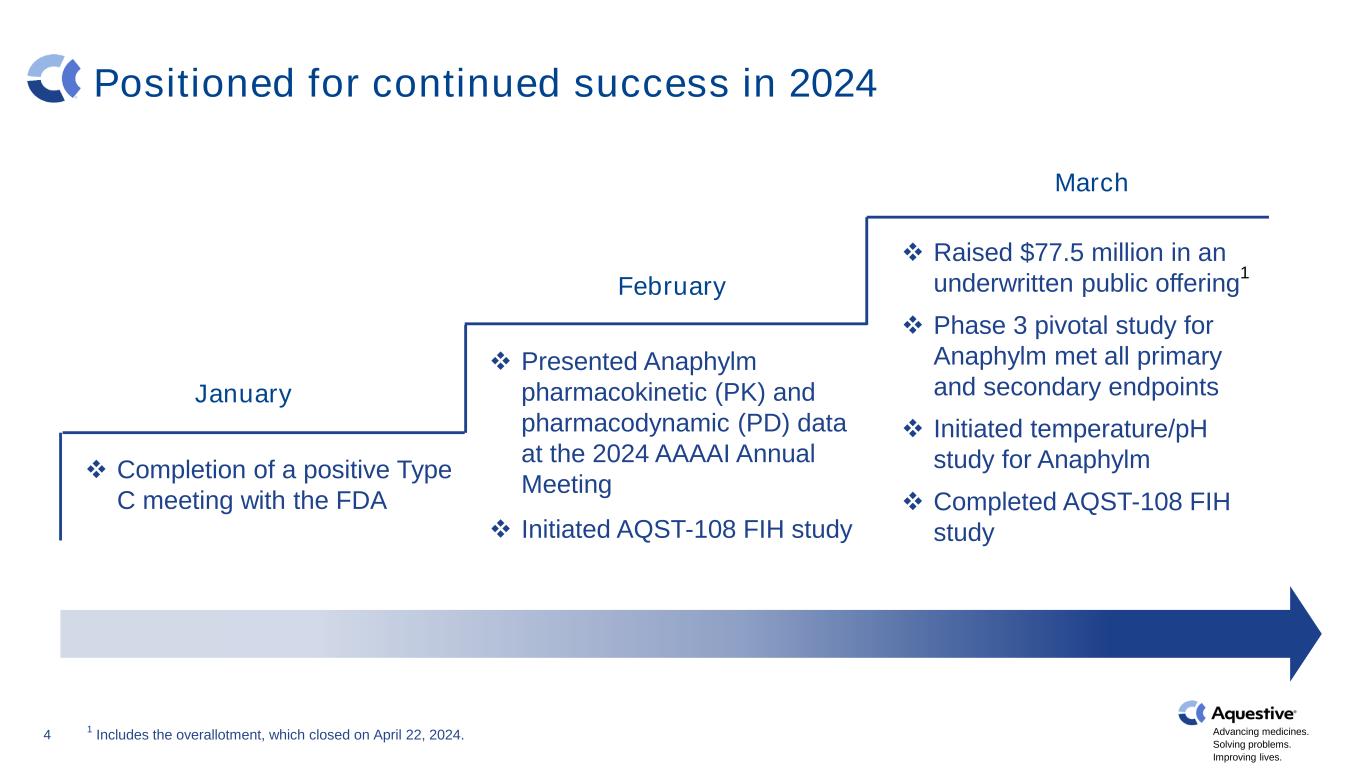
推進藥品發展。解決問題。改善生活。4 有望在 2024 年繼續取得成功 ❖ 完成與 FDA 的陽性 C 型會議 2 月 ❖ 在 2024 年 AAAAI 年會上提交了 Anaphylm 藥代動力學 (PK) 和藥效學 (PD) 數據 ❖ 1 月啟動 AQST-108 FIH 研究 ❖ 通過承保公開發行籌集了 7,750 萬美元 1 ❖ Anaphylm 的三期關鍵研究滿足所有主要和次要終點 ❖ 啟動的温度/pH 研究 Anaphylm ❖ 已於 3 月 1 日完成的 AQST-108 FIH 研究包括於 2024 年 4 月 22 日結束的總配股。

推進藥品發展。解決問題。改善生活。Anaphylm 計劃更新 5
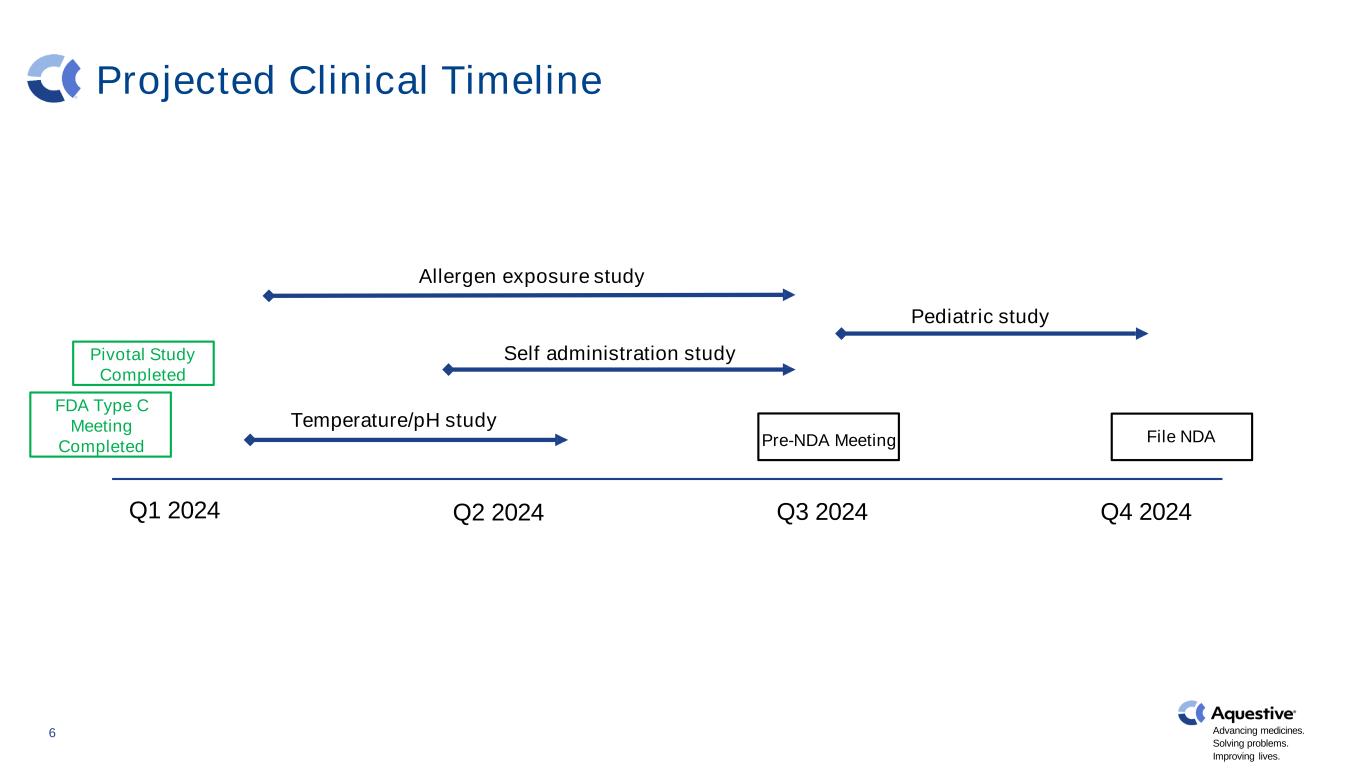
2024 年第 1 季度第 2 季度 2024 年第三季度温度/pH 值研究自我給藥研究過敏原暴露研究兒科研究文件 ndaPre-NDA 會議 6 進步藥物。解決問題。改善生活。關鍵研究已完成 FDA C 型會議已完成預計臨牀時間表
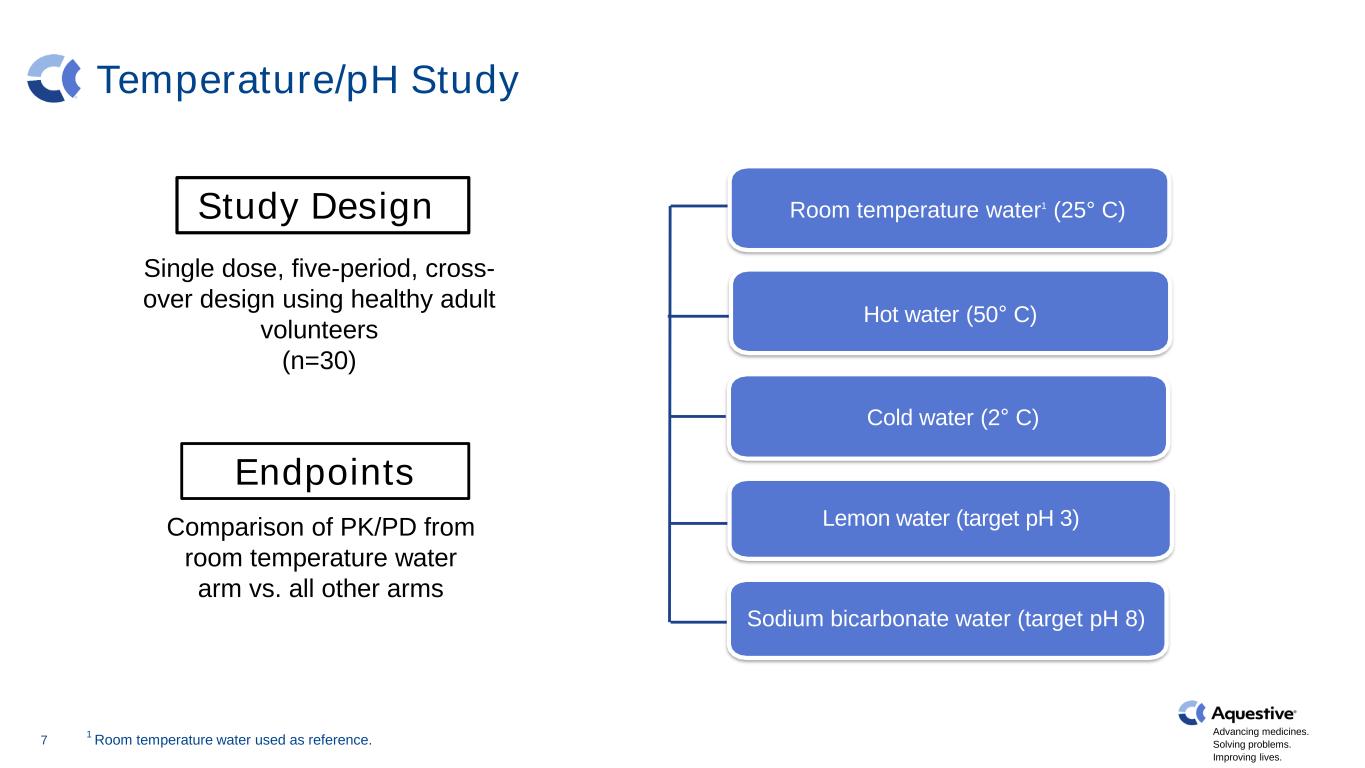
推進藥品發展。解決問題。改善生活。温度/pH 研究熱水(50° C)檸檬水(目標 pH 3)冷水(2° C)7 室温水1(25° C)碳酸氫鈉水(目標 pH 8)研究設計 1 室温水用作參考。使用健康成年志願者的單劑量、五週期、交叉設計(n=30)室温水臂的 PK/PD 與所有其他手臂的比較
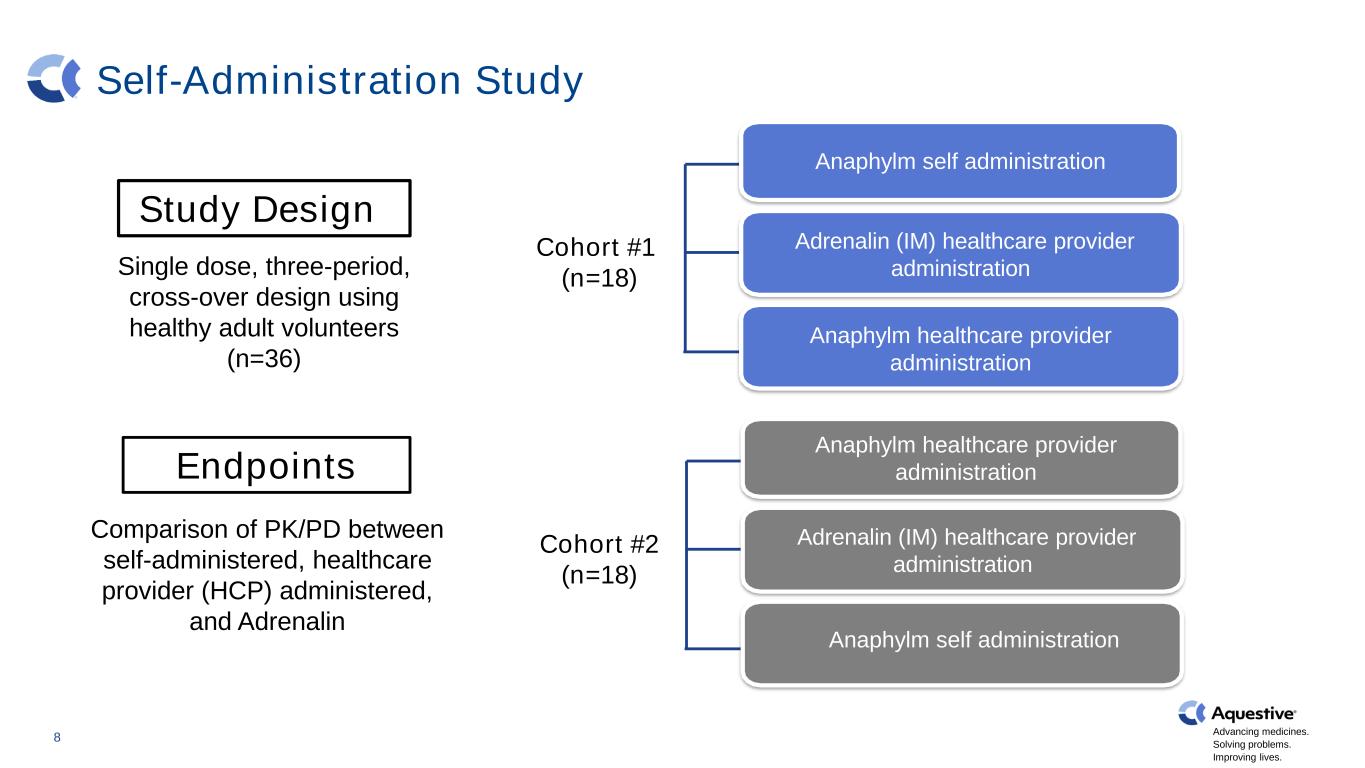
推進藥品發展。解決問題。改善生活。自我管理研究健康志願者 N=30 Adrenalin (IM) 醫療保健提供者管理 8 研究設計使用健康成人志願者的單劑量、三週期、交叉設計 (n=36) 終點自我給藥、醫療保健提供者 (HCP) 和腎上腺素 Anaphylm 自我給藥腎上腺素 (IM) 醫療保健提供者管理 Anaphylm 自我給藥隊列 #1 (n=18) 隊列 #2 (n=18) Anaphylm 醫療保健提供者管理

推進藥品發展。解決問題。改善生活。過敏原暴露研究健康志願者 N=30 (n=24) 腎上腺素 (IM) 無過敏原暴露 9 研究設計使用口服過敏原綜合徵 (“OAS”) 患者的單劑量、兩週期、部分隨機的交叉設計 (n=36) 終點過敏原暴露於腎上腺素肌肉注射 (IM) 後的 PK/PD 比較無過敏原暴露 Adrenalin (IM) 無過敏原暴露 Anaphylm 過敏原暴露後1 C hort #1 隊列 #2 (n=12) 過敏原暴露後重復給藥 Anaphylm 1 OAS 志願者將面臨暴露已知會觸發的過敏原的挑戰它們的反應(例如蘋果、櫻桃、芒果、哈密瓜、奇異果、芹菜、香蕉或胡蘿蔔)。
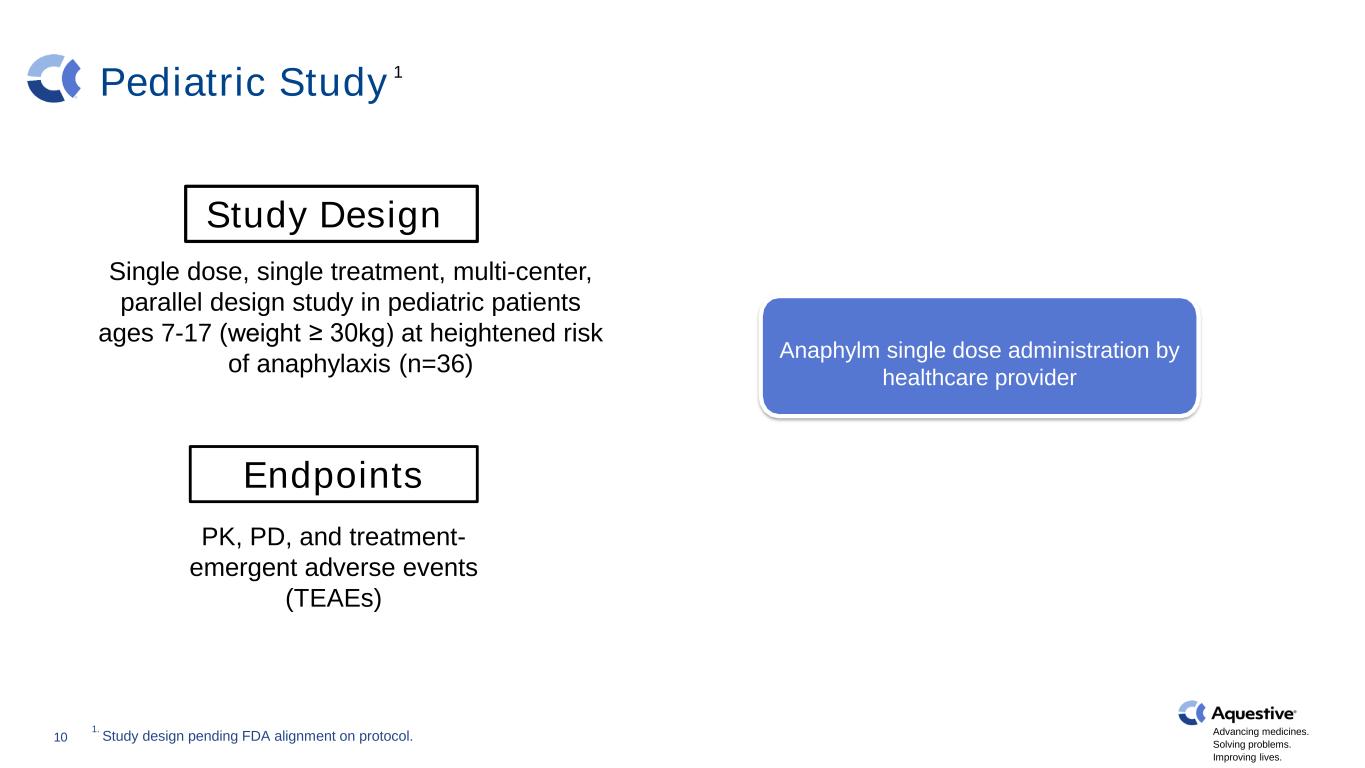
推進藥品發展。解決問題。改善生活。兒科研究健康志願者 N=30 10 研究設計單劑量、單一治療、多中心、平行設計研究,針對過敏反應風險較高的7-17歲(體重≥30kg)的兒科患者(n=36)終點 PK、PD 和治療-緊急不良事件(TEAEs)腎上腺素(IM)無過敏原暴露Anaphylm單劑量給藥由醫療保健提供者1 1.研究設計尚待FDA對協議進行調整。

推進藥品發展。解決問題。改善生活。財務業績 11
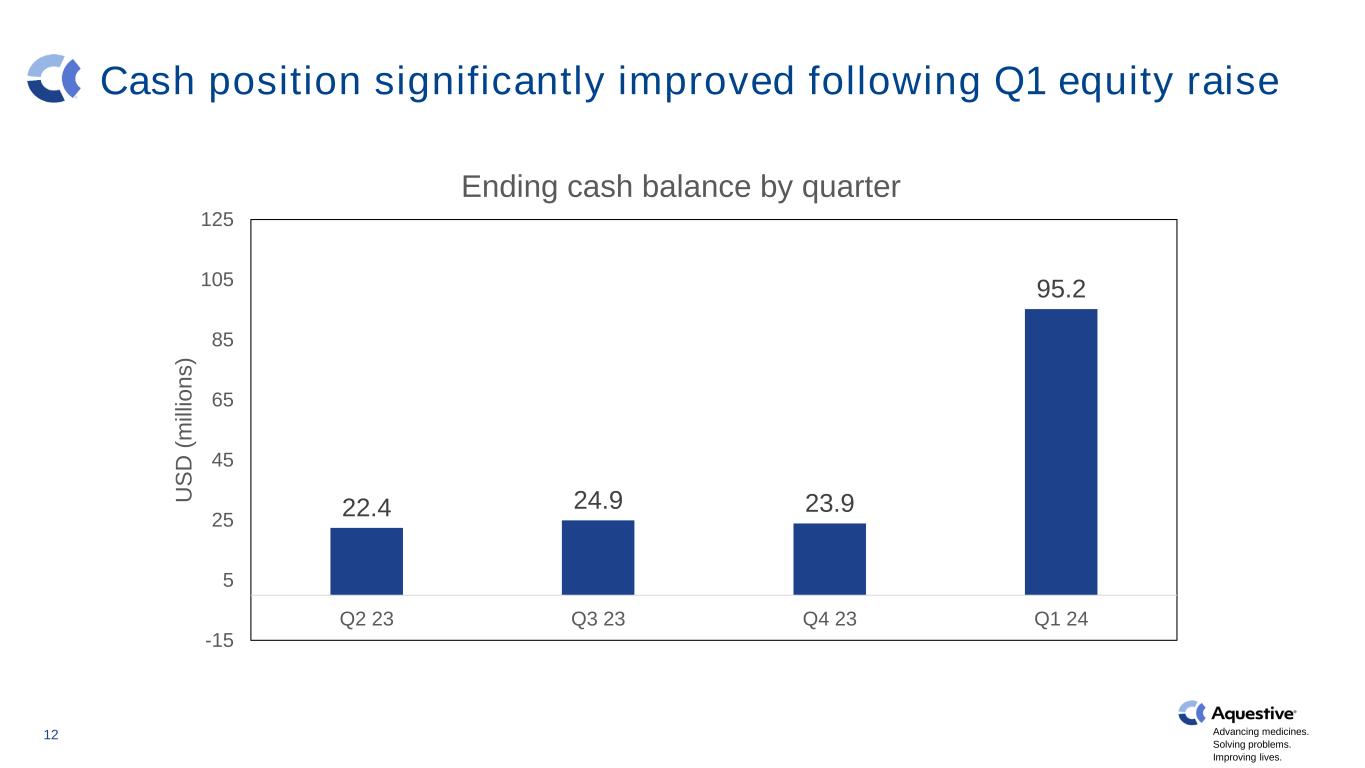
推進藥品發展。解決問題。改善生活。在第一季度股權融資之後,現金狀況顯著改善 12 22.4 24.9 23.9 95.2 -15 5 25 45 65 85 105 125 23第三季度 23 Q4 23 Q4 23 Q1 23 Q2 24 US D(m ill io n s)按季度劃分的期末現金餘額
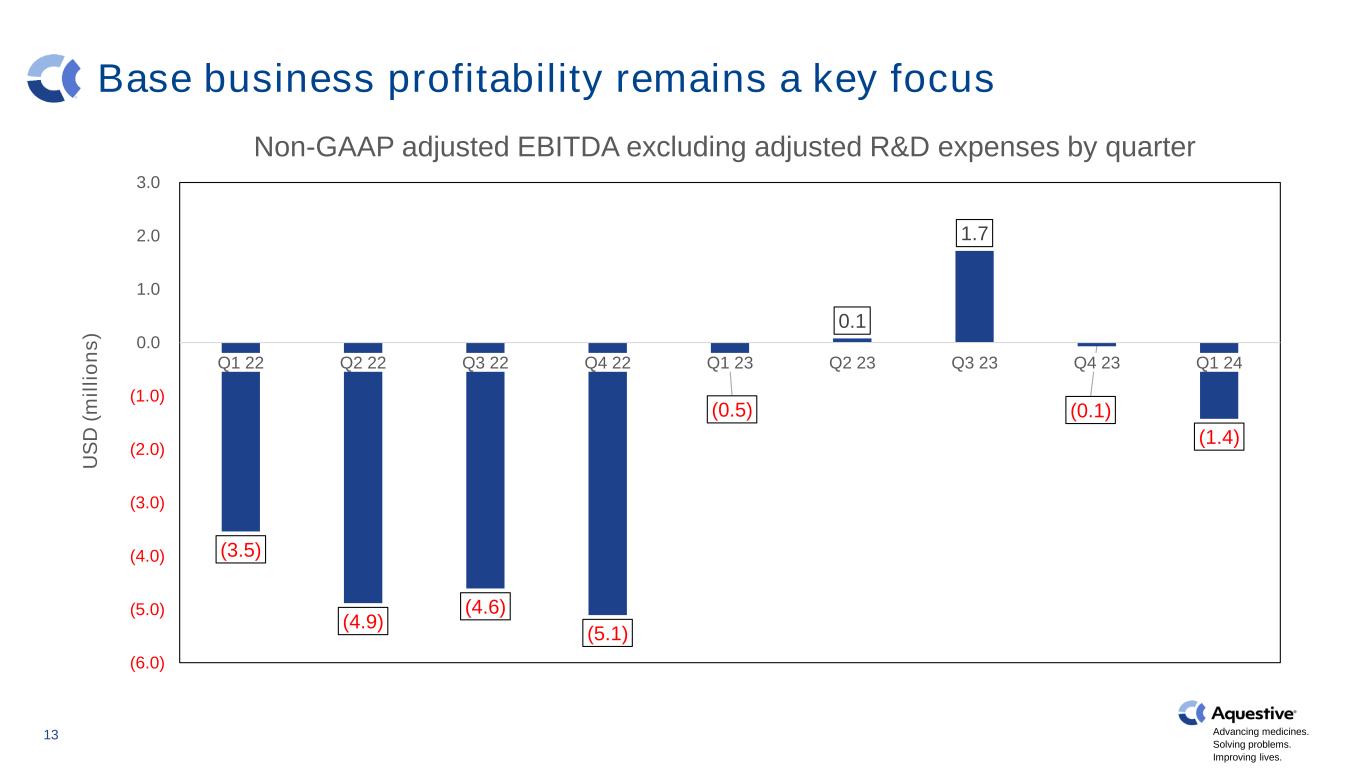
推進藥品發展。解決問題。改善生活。基礎業務盈利能力仍然是重點 13 (3.5) (4.9) (4.6) (5.1) (0.5) 0.1 1.7 (0.1) (1.4) (6.0) (5.0) (4.0) (2.0) (1.0) 0.0 1.0 2.0 3.0 22 第二季度 22 第二季度 22 Q4 23 Q3 23 Q4 23 Q4 24 US D (m il li o n s) 非公認會計準則調整後息税折舊攤銷前利潤不包括經調整的季度研發費用
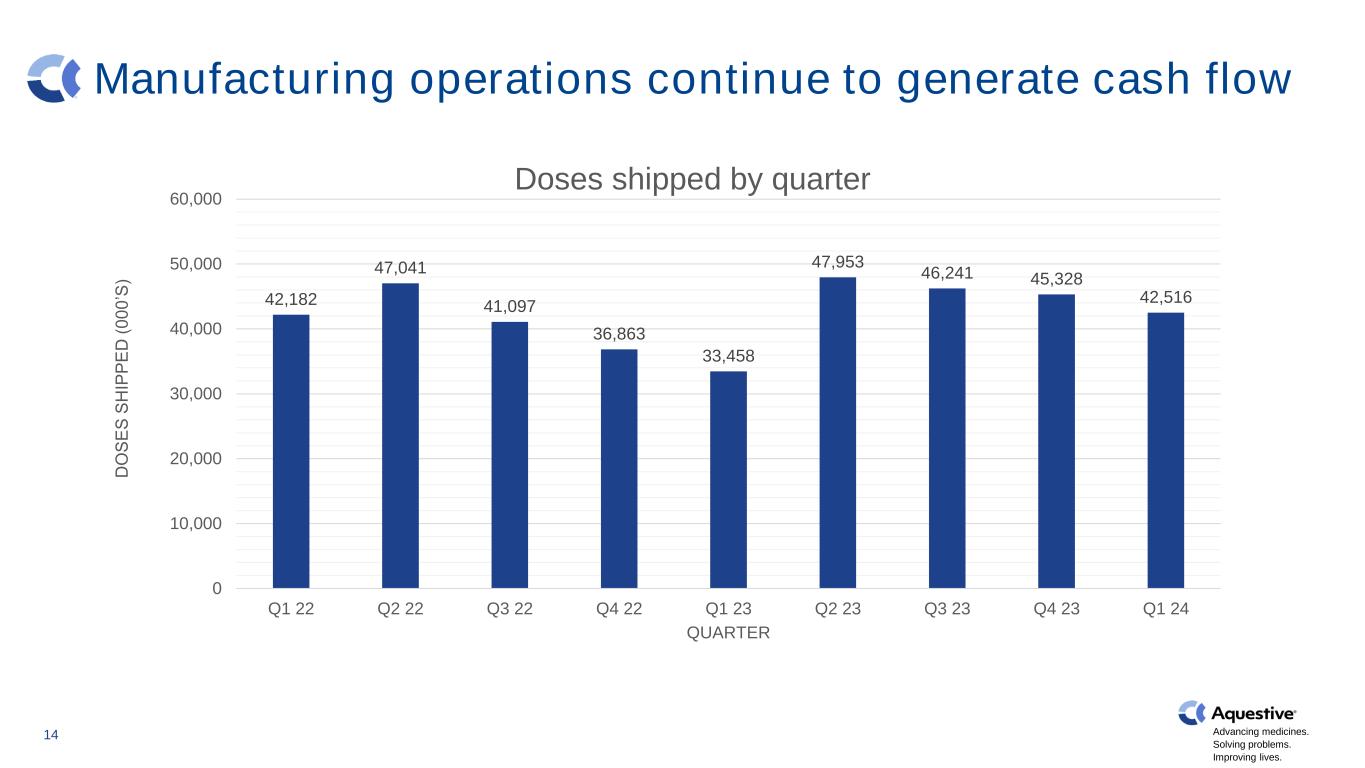
推進藥品發展。解決問題。改善生活。製造業務繼續產生現金流 14 42,182 47,041 41,097 36,863 33,458 47,453 46,241 45,328 42,516 0 10,000 30,000 000,000 60,000 000,000 000,000 000,000 第二季度 22 Q2 22 Q2 22 Q2 23 Q3 23 Q4 23 Q4 24 D O S E S H IP P E D (0 0 0'S) 第一季度出貨量

推進藥品發展。解決問題。改善生活。當前的2024年全年預期展望 • 總收入約為4,800萬至5100萬美元 • 非公認會計準則調整後的息税折舊攤銷前利潤虧損約為2,200萬美元至2600萬美元 15

推進藥品發展。解決問題。改善生活。謝謝