展品 99.1
EyePoint Pharmicals公佈2024年第一季度財務業績並重點介紹最近的公司發展
— 2024年3月31日有2.99億美元的現金和投資,現金流來自2026年DURAVYU濕式AMD的3期試驗的頭條數據 —
馬薩諸塞州沃特敦,2024年5月8日(環球新聞專線)——致力於開發和商業化改善嚴重視網膜疾病患者生活的療法的公司EyePoint製藥公司(納斯達克股票代碼:EYPT)今天公佈了截至2024年3月31日的第一季度財務業績,並重點介紹了最近的公司發展。
EyePoint Pharmicals總裁兼首席執行官傑伊·杜克醫學博士表示:“我們通過重要的里程碑繼續推進我們的產品線,包括公佈了我們在非增殖性糖尿病視網膜病變(NPDR)中對DURAVYU的2期PAVIA臨牀試驗的主要數據。”“儘管PAVIA試驗未達到預先規定的主要終點,但令我們感到鼓舞的是,DURAVYU在NPDR患者中表現出生物學效應,並且繼續顯示出良好的安全性和耐受性。因此,我們計劃在十二個月的全部研究結果出來後對其進行評估,以評估DURAVYU作為NPDR潛在治療方法的前進方向。展望未來,我們仍有望在2024年下半年啟動DURAVYU在濕性AMD中的首項關鍵性3期盧加諾非劣勢臨牀試驗,並在2025年第一季度啟動糖尿病黃斑水腫(DME)的2期VERONA試驗的主要數據。”
研發亮點和更新

截至2024年3月31日的第一季度業績回顧
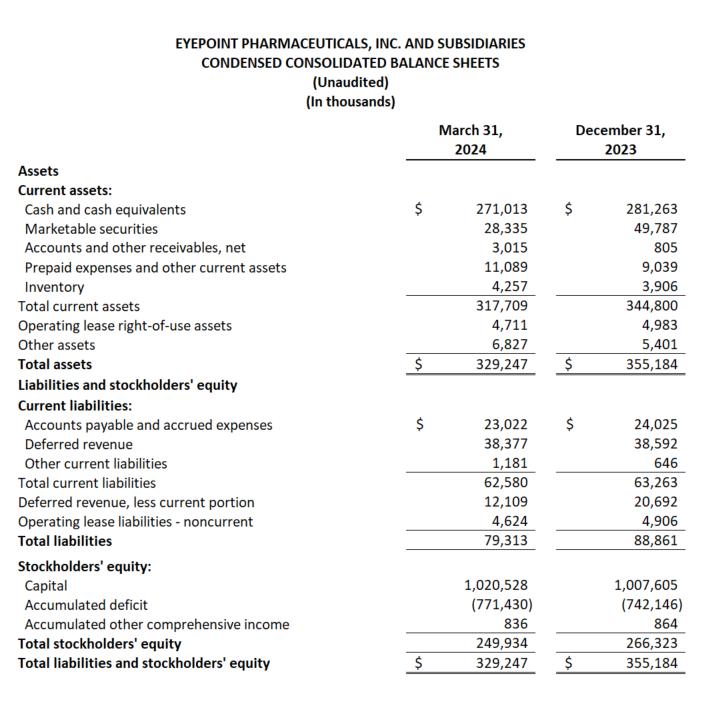
截至2024年3月31日的第一季度,總淨收入為1170萬美元,而截至2023年3月31日的季度為770萬美元。第一季度的淨產品收入為70萬美元,而截至2023年3月31日的第一季度的淨產品收入為740萬美元。淨產品收入的下降是由於 2023 年 5 月 YUTIQ 特許經營權的外包,完成了從商業公司向專注於生物製藥管道的公司的戰略轉移。
截至2024年3月31日的第一季度,特許權使用費和合作淨收入總額為1,100萬美元,而2023年同期為30萬美元。這一增長主要是由於部分確認了YUTIQ特許經營許可的遞延收入,該特許經營權始於2023年第二季度,將在2年內與YUTIQ供應單位的交付相關的確認。
截至2024年3月31日的第一季度的運營支出總額為4,500萬美元,而去年同期為2920萬美元。這一增長主要是由研發成本的顯著增長所推動的,包括DURAVYU臨牀試驗活動和人員支出,以及股票薪酬,但由於我們在2023年上半年商業業務退出而減少的銷售和營銷費用。淨營業外收入總額為400萬美元,淨虧損為2930萬美元,合每股虧損0.55美元,而去年同期的淨虧損為2,120萬美元,合每股虧損0.56美元。

截至2024年3月31日,現金和投資總額為2.993億美元,而截至2023年12月31日的現金和投資總額為3.310億美元。
財務展望
我們預計,2024年3月31日的現金、現金等價物和投資將使我們能夠通過計劃於2026年對濕性AMD進行DURAVYU的3期臨牀試驗的關鍵數據為運營提供資金。
美國食品藥品管理局有條件地接受 DURAVYU 作為 EYP-1901 的專有名稱。DURAVYU是一種研究產品;它尚未獲得美國食品藥品管理局的批准。FDA的批准和潛在批准的時間表尚不確定。
關於 EyePoint 制
EyePoint 製藥公司(納斯達克股票代碼:EYPT)是一家臨牀階段的生物製藥公司,致力於開發和商業化療法,以幫助改善嚴重視網膜疾病患者的生活。該公司的產品線利用其專有的可生物腐蝕的Durasert E技術實現持續的眼內藥物輸送。該公司的主要候選產品DURAVYU(前身為 EYP-1901)是一種研究性持續分娩療法,用於治療血管內皮生長因子介導的視網膜疾病,vorolanib(一種受專利保護的選擇性酪氨酸激酶抑制劑)與 Durasert E 結合使用。研發項目包括 EYP-2301,一種前景看好的 TIE-2 激動劑 razuprotafib,採用杜拉塞特 E 配製,有可能改善嚴重視網膜疾病的預後。成熟的 Durasert® 藥物遞送技術已通過四種美國食品藥品管理局批准的產品安全地應用於成千上萬的患者眼中。EyePoint 製藥公司總部位於馬薩諸塞州沃特敦。
Vorolanib由貝達製藥的子公司Equinox Sciences獨家授權給EyePoint,用於對中國、澳門、香港和臺灣以外的所有眼科疾病進行本地化治療。
前瞻性陳述
EYEPOINT PHARMICALS根據1995年《私人證券訴訟法》發表的安全港聲明:如果本新聞稿中的任何陳述涉及非歷史信息,則這些陳述均為1995年《私人證券訴訟改革法》下的前瞻性陳述。此類聲明包括但不限於關於將收益用於發行的聲明以及其他以 “將”、“潛在”、“可以”、“可以”、“相信”、“打算”、“繼續”、“計劃”、“期望”、“預期”、“估計”、“可能” 等詞語標識的聲明,或使用未來日期。就其性質而言,前瞻性陳述涉及不同程度的不確定性問題。不確定性和風險可能導致EyePoint的實際業績與EyePoint的前瞻性陳述中表達或暗示的業績存在重大差異。對於 EyePoint 而言,這包括通過濕性 AMD 中 EYP-1901(DURAVYU)三期臨牀試驗的頭條數據,對現有現金資源充足性的陳述;我們對包括 DURAVYU 和 EYP-2301 在內的候選產品的時機和臨牀開發的預期;DURAVYU 作為嚴重眼部疾病(包括濕性年齡相關性黃斑變性(濕性 AMD)和非增殖性糖尿病視網膜)的新型持續治療藥物的潛力病變(NPDR)和糖尿病性黃斑水腫(DME);的有效性和及時性臨牀試驗和數據的有用性;監管部門批准的及時性,包括美國食品藥品監督管理局 (FDA) 監管部門可能對 DURAVYU 和 EYP-2301 的批准;當前和未來許可協議的成功;我們對合同研究機構、共同推廣合作伙伴和其他外部供應商和服務提供商的依賴;Durasert® 作為藥物交付平臺在 FDA 批准產品中的成功;產品責任;行業整合;遵守環境法的風險;以及國際業務成本運營;股價波動;可能的

稀釋;沒有分紅;總體商業和經濟狀況的影響;保護我們的知識產權和避免知識產權侵權;留住關鍵人員;製造風險;以及我們在向美國證券交易委員會提交的文件中描述的其他因素。我們無法保證任何前瞻性陳述中表達、預期或暗示的結果和其他預期能夠實現。包括這些風險在內的各種因素可能導致我們的實際業績和其他預期與前瞻性陳述中表達、預期或暗示的預期業績或其他預期存在重大差異。如果已知或未知風險出現,或者基本假設被證明不準確,則實際結果可能與過去的業績以及前瞻性陳述中的預期、估計或預測的業績存在重大差異。在考慮任何前瞻性陳述時,應牢記這一點。我們的前瞻性陳述僅代表其發表之日。EyePoint沒有義務更新或修改任何前瞻性陳述,無論是由於新信息、未來事件還是其他原因。
投資者:
克里斯蒂娜·塔塔利亞
Stern IR
直接:212-698-8700
christina.tartaglia@sternir.com
媒體聯繫人:
艾米菲利普
綠色房間通信
直播:412-327-9499
aphillips@greenroompr.com
|
|
|
|
|

|
|
|
|
|