目錄表
概述
我們是一家生物製藥公司,擁有基於多肽的新化學實體Rusfertie和JNJ-2113,它們都來自我們專有的發現技術平臺,處於開發的高級階段3階段。我們的臨牀項目分為兩大類:(I)血液病和血液疾病,以及(Ii)炎症性和免疫調節性(I&I)疾病。
我們的產品線
蘆薈素
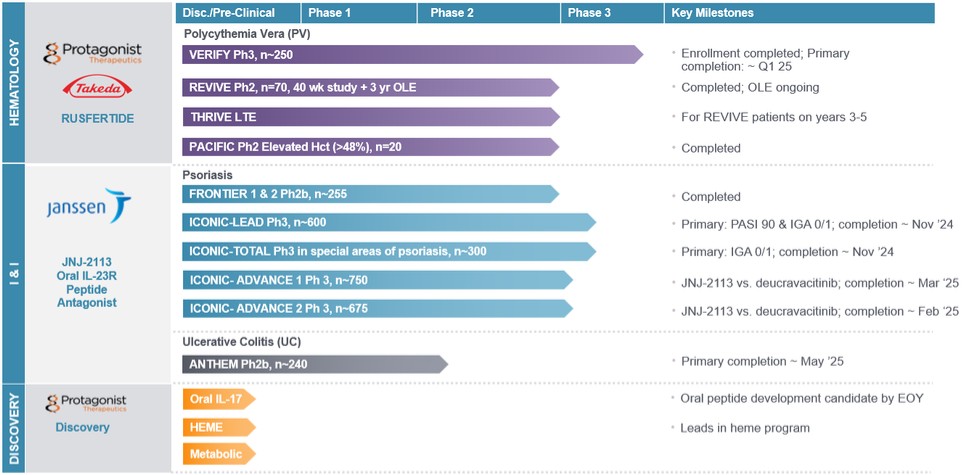
Rusfertie是我們與美國武田製藥公司(“武田”)合作的可注射海普西丁模擬物,正在開發用於治療真性紅細胞增多症(“PV”)。我們已經啟動了VERIFY(ClinicalTrials.gov IDENTIFIZER NCT05210790),這是一項全球雙盲、安慰劑對照的光伏療法3期臨牀試驗,約有250名患者參加。這項試驗評估了每週一次的自我皮下給藥的蘆薈多肽對未控制紅細胞壓積的患者的療效、症狀負擔和安全性,這些患者儘管接受了標準的護理治療,但仍依賴於靜脈採血。這項試驗招募了來自北美、南美、歐洲、亞洲和澳大利亞的患者。Verify試驗的登記工作已經完成,我們預計將在2025年第一季度末公佈該試驗32周主要療效終點的主要數據,這可能導致2025年第四季度提交新藥申請(NDA)。到2024年底,我們預計將收到正在進行的為期兩年的研究結果,該研究評估了每週給藥一次的蘆薈肽的致癌潛力。
我們的黃麴黴毒素2期臨牀試驗包括:
| ● | REVIVE為第二階段概念驗證(“POC”)試驗,已於二零一九年第四季度啟動。我們在2022年第一季度完成了患者入組,並在試驗的隨機退出部分結束時入組了70例患者,該部分於2023年第一季度完成,並繼續進行開放標籤擴展(“OLE”); |
| ● | Thrive,一項針對甦醒患者的第二階段長期延長試驗,治療三到五年;以及 |
19