附錄 99.1

2024 年 3 月公司演講

重要聲明和免責聲明本演示文稿由InflarX
N.V.(“InflarX” 或 “公司”)編寫。本演示僅供參考,不構成賣出要約或購買證券要約的邀請。
購買或出售任何證券時不得依賴本演示文稿,也不得解釋為投資建議。前瞻性陳述本新聞稿包含前瞻性陳述。除歷史事實陳述以外的所有陳述均為
前瞻性陳述,通常用 “可能”、“將”、“應該”、“期望”、“計劃”、“預期”、“可能”、“打算”、“目標”、“項目”、“估計”、“預測”、“潛在” 或 “繼續” 等術語來表示。
前瞻性陳述出現在本新聞稿的多個地方,可能包括有關我們的意圖、信念、預測、展望、分析和當前預期的陳述,除其他外,涉及 COVID-19 患者和美國醫院對 GOHIBIC(維洛貝利單抗)作為 COVID-19 治療藥物的接受程度以及醫療/保健機構和其他第三方組織的相關治療建議、我們成功商業化的能力以及 GOGO的接受程度 HIBIC(維洛貝利單抗)作為治療方法COVID-19 患者和美國醫院或我們的其他候選產品的 COVID-19;我們對患者羣體規模、市場
機會、承保範圍和報銷、GOHIBIC(維洛貝利單抗)在其批准或授權適應症或維洛貝利單抗和任何其他候選產品中的臨牀用途的預期,在 EUA
下以及未來獲準用於商業用途的情況下美國或其他地方;我們成功實施InflarX承諾計劃的能力,成功的我們未來對維洛貝利單抗治療 COVID-19 和其他
使人衰弱或危及生命的炎症適應症(包括 PG)和任何其他候選產品(包括 INF904)的臨牀試驗,以及此類臨牀結果是否會反映先前進行的臨牀前研究和臨牀
試驗的結果;我們候選產品的臨牀前研究和臨牀試驗的時機、進展和結果,以及關於啟動和完成研究或試驗及相關準備工作的時間安排、進展和結果工作,時期在
試驗結果公佈期間,此類試驗的成本和我們的總體研發計劃;我們與監管機構就臨牀試驗結果和潛在的監管機構批准
途徑進行的互動,包括我們向維洛貝利單抗提交的MAA申請和提交GOHIBIC(維洛貝利單抗)的生物製劑許可申請,以及我們獲得和維持維洛貝利單抗全面監管批准的能力或 GOHIBIC
(vilobelimab)用於任何適應症;無論是 FDA、EMA 還是任何類似的適應症外國監管機構將接受或同意我們臨牀試驗的數量、設計、規模、進行或實施,包括此類試驗的任何擬議主要終點或
次要終點;我們對維洛貝利單抗任何批准適應症範圍的期望;我們利用專有的抗C5a和C5ar技術發現和開發治療
補體介導的自身免疫和炎症性疾病療法的能力;我們保護、維持和執行我們對維洛貝利單抗和任何產品的知識產權保護其他候選產品以及此類保護的範圍;我們的製造
能力和戰略,包括我們製造方法和工藝的可擴展性和成本以及製造方法和工藝的優化,以及我們繼續依賴現有第三方
製造商的能力,以及我們聘請更多第三方製造商參與我們計劃的未來臨牀試驗、維洛貝利單抗和成品GOHIBIC(vilobelimab)的商業供應的能力;我們對開支的估計,
持續虧損、未來收入、資本要求以及我們對額外融資的需求或獲得額外融資的能力;我們對因在臨牀測試候選產品或
任何商業銷售獲得批准而產生的責任索賠進行辯護的能力;如果我們的任何候選產品獲得監管部門的批准,我們遵守和履行持續義務和持續監管概覽的能力;我們遵守尋求上市批准和商業化的
頒佈和未來立法的能力;我們的未來成長和能力競爭,這取決於我們留住關鍵人員和招聘更多合格人員;我們的競爭地位,以及我們在開發C5a和C5ar抑制劑或我們的行業方面與競爭對手相關的發展和
預測;以及我們向美國證券交易委員會提交的定期文件中 “風險因素” 標題下描述的風險、不確定性和其他因素。這些
聲明僅代表截至本新聞稿發佈之日,涉及已知和未知的風險、不確定性和其他重要因素,這些因素可能導致我們的實際業績、業績或成就與前瞻性陳述所表達或暗示的任何未來
業績、業績或成就存在重大差異。鑑於這些風險、不確定性和其他因素,您不應過分依賴這些前瞻性陳述,除非法律要求,否則即使將來有新的信息,我們也沒有
義務更新這些前瞻性陳述。

重要聲明和免責聲明信息和來源本演示文稿中包含的某些信息
涉及或基於從第三方來源獲得的研究、出版物、調查和其他數據以及InflarX自己的內部估計和研究。儘管InflarX認為截至本演示之日,這些第三方來源
是可靠的,但它尚未獨立核實,也沒有對從第三方來源獲得的任何信息的充分性、公平性、準確性或完整性做出任何陳述。此外,本演示文稿中包含的所有
市場數據都涉及許多假設和侷限性,無法保證此類假設的準確性或可靠性。此外,儘管我們認為自己的內部研究是可靠的,但
此類研究尚未得到任何獨立來源的證實。Avacopan 數據我們尚未在臨牀試驗中對 Avacopan 與 INF904 進行正面比較,但已將公佈的 Avacopan 數據與我們 INF904 1 期臨牀試驗的數據進行了比較。為了進行臨牀前研究(倉鼠中性粒細胞減少症研究),我們合成了Avacopan並進行了並排比較。儘管我們認為這種與 Avacopan 的比較是有用和恰當的,但本演示文稿中此項比較以及與 Avacopan 的其他比較的
值可能有限,因為它們並非來自正面交鋒試驗,而是來自根據不同協議在不同地點和
不同時間進行的試驗。如果沒有正面交鋒的數據,我們無法對 INF904 和 Avacopan 做出比較主張。關於InflarX InflarX GmbH(德國)和InflarX Pharmicals Inc.(美國)是InflarX N.V.
(合稱 “InflarX”)的全資子公司。InflarX(納斯達克股票代碼:IFRX)是一家生物技術公司,通過應用其專有的抗C5a和抗C5ar技術來發現、開發和商業化補體激活因子C5a及其受體C5ar的同類首創、強效的
和特異性抑制劑。C5a 是一種強大的炎症介質,參與各種炎症性疾病的進展。InflarX 的主要候選產品
vilobelimab 是一種新型的、靜脈注射的、同類首創的抗 C5a 單克隆抗體,可選擇性地與遊離 C5a 結合,並在
不同適應症的多項臨牀研究中顯示出改善疾病的臨牀活性和耐受性。InflarX成立於2007年,該集團在德國耶拿和慕尼黑以及美國密歇根州安娜堡設有辦事處和子公司。欲瞭解更多信息,請訪問 www.inflarx.com。

利用 C5a/C5AR 控制 I&I 空間中的炎症 inflarX
亮點獨特的靶向補體 c5a/C5AR,這是一種經過驗證的機制和炎症級聯的關鍵部分,包括:同類首創的高效抗 C5a 單克隆抗體(維洛貝利單抗 + 第二代 IFX-2)同類最佳
潛在口服 C5ar 抑制劑 INF904:解決上市比較物的侷限性(在I期研究中,血漿PK分佈和抑制潛力有明顯區別)藥物管道中有可能進軍多個大型市場免疫皮膚病學和更廣泛的 I&I 有針對性的開發重點是免疫皮膚病學,InflarX 可以推動更大市場的管道價值,擁有強大的核心知識產權和醫療用途知識產權覆蓋範圍 Vilobelimab 正處於 PG
的後期開發階段,由於美國或歐洲尚未獲得批准的藥物 INF904,無法在科羅拉多州立大學和美國的大型市場顯示出藥物研發潛力;預計將於 2024 年開始二期開發大幅上行空間具有合作選擇的專有藥物的I&I中可能出現其他
適應症強勁的平衡擁有足夠的現金來資助運營至少 2026 年,並推進項目以實現下一個里程碑科羅拉多州立大學
在取得臨牀和監管成功方面有良好往績的團隊 [慢性自發性蕁麻疹。HS [化膿性汗腺炎]。PG [壞疽性膿皮病]。I&I [炎症和免疫學]。第 4 頁

免疫皮膚病學領域的重大機遇第 5 頁有可能瞄準幾個
具有吸引力的、價值超過十億美元的商業市場 inflarX 已經確定了 INF904 可以有力滿足的未滿足的醫療需求。基於作用機制、臨牀前和臨牀數據,C5a/C5AR 發揮作用的有力理由確立了
終點,具有 INF904 可能獲得臨牀優勢並被證明是差異化競爭對手 INF904 是一種沒有已知安全隱患的口服藥物,潛在的廣泛治療指數作為 C5ar 拮抗劑,INF904在差異化途徑上起作用,免疫皮膚病領域目前任何其他治療方法都無法解決的 MoA 建立了專家網絡和內部試驗專業知識對某些免疫皮膚病中 c5ar 抑制的強大知識產權覆蓋率為何選擇免疫皮膚病學
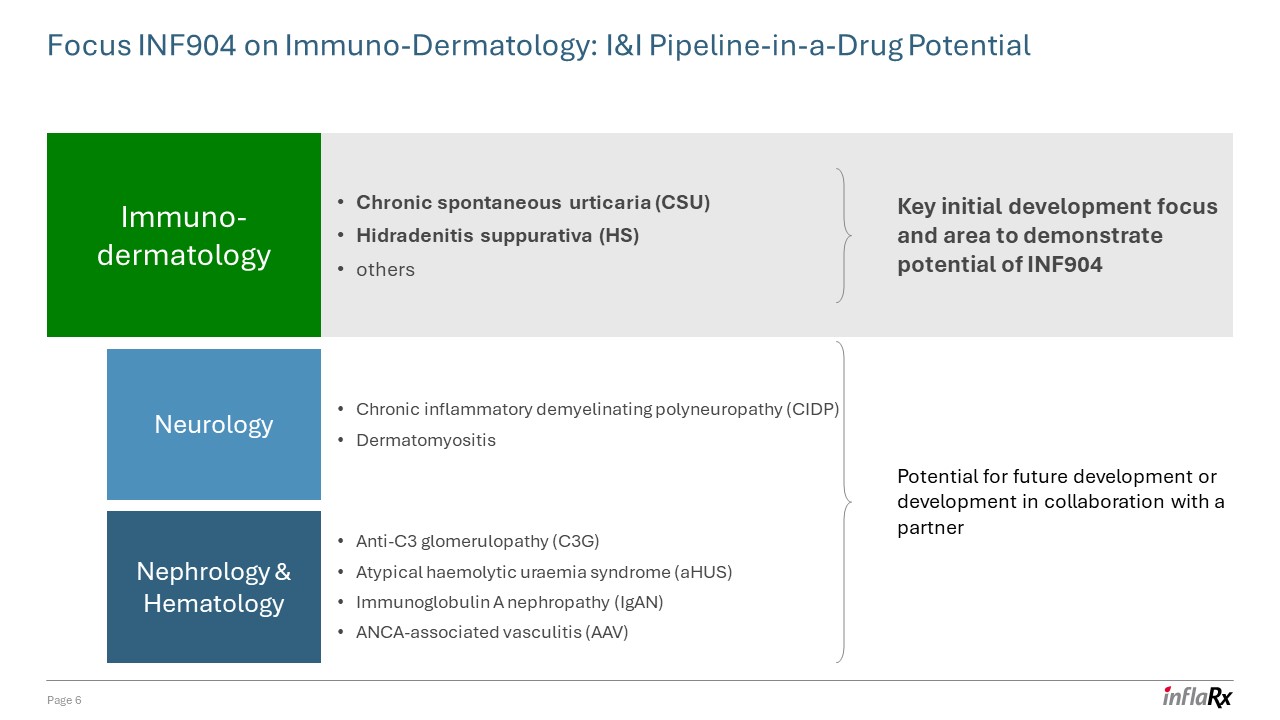
展示了
INF904 潛力的關鍵初步開發重點和領域與合作伙伴合作進行未來開發或開發的潛力免疫皮膚病學神經病學腎臟病學和血液學慢性自發性蕁麻疹 (CSU) 化膿性汗腺炎 (HS) 其他慢性
炎性脱髓鞘性多發性神經病 (CIDP) 皮膚肌炎抗 C3 腎小球病 (C3G) 非典型性溶血性尿毒血癥綜合徵 (AHU) 免疫球蛋白 A 腎病 (IGaN) ANCA 相關血管炎 (AAV) 第 6 頁關注 INF904 關注
免疫皮膚病學:I&I Pipeline-in-a-in-A-藥物潛力
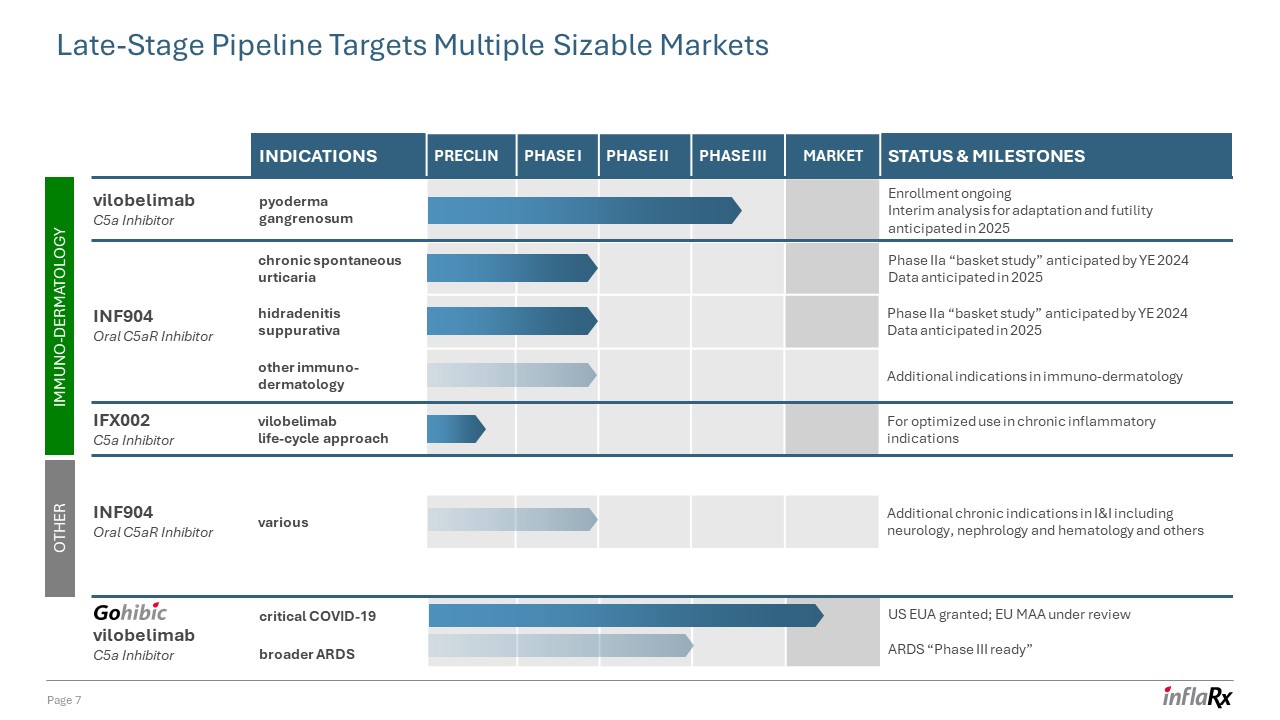
第 7 頁後期產品線瞄準多個規模龐大的市場 vilobelimab C5a
抑制劑 IFX002 C5a 抑制劑 INF904 口服 C5ar 抑制劑免疫皮膚病學 vilobelimab C5a 抑制劑其他 INF904 口服 C5ar 抑制劑慢性自發性蕁麻疹在 2024 年之前的 IIa 期 “籃子研究” 數據
預計在 2025 年適應症 preclin I 期二期三期市場現狀和里程碑壞疽性膿皮病註冊正在進行中期分析預計將在2025年對適應性和無效性進行關鍵 COVID-19 更廣泛
ARDS 美國歐盟獲得批准;歐盟 MAA 在綜述 ARDS 化膿性汗腺炎 “III 期就緒” IIa 期 “籃子研究” 預計於 2025 年發佈數據其他免疫皮膚病學其他適應症
免疫皮膚病學其他適應症 vilobelimab 生命週期方法用於優化慢性炎症適應症的各種其他慢性適應症,包括神經病學、腎臟病學和血液學等
維洛貝利單抗 [C5a 單克隆抗體]INF904 [口服 C5ar 抑制劑]c5a/c5ar:炎症級聯中的一個
戰略地位
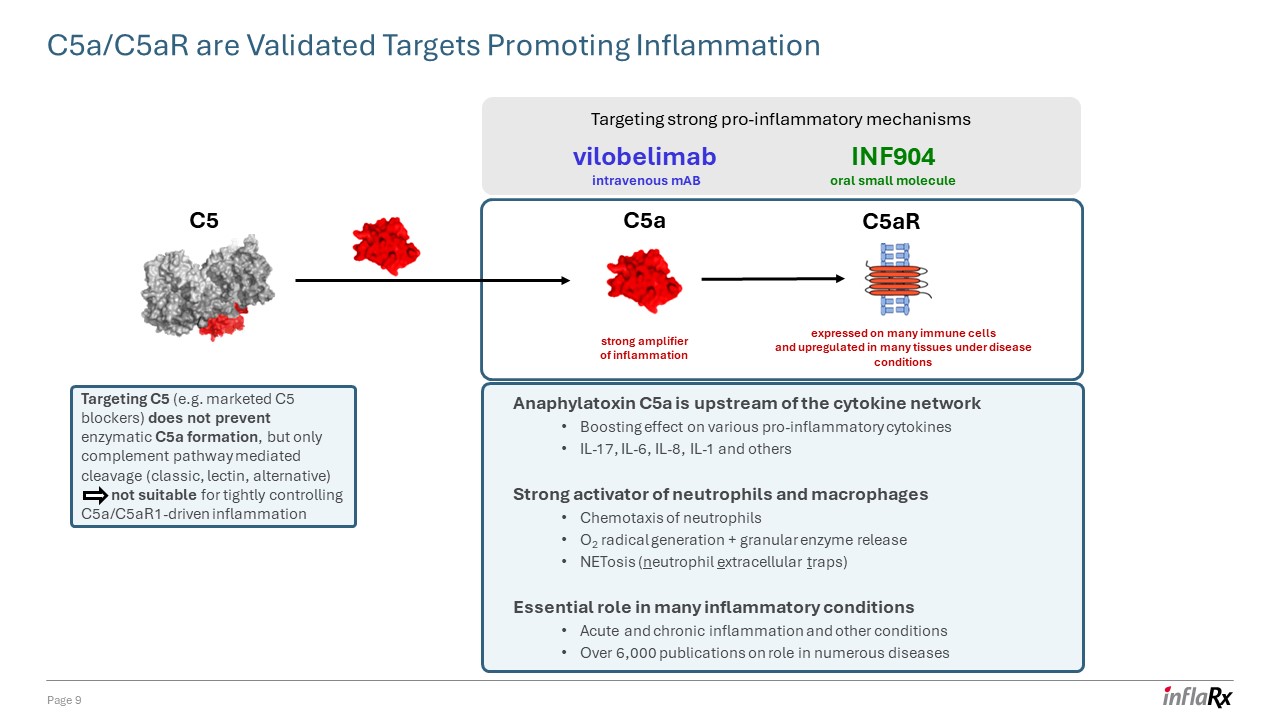
過敏毒素 C5a 是細胞因子網絡的上游對各種
促炎細胞因子 IL-17、IL-6、IL-8、IL-1 等的增強作用中性粒細胞和巨噬細胞的強效激活劑 O2 自由基生成 + 顆粒酶釋放 netosis(中性粒細胞外陷阱)在許多炎症性疾病中必不可少的
作用急性和慢性炎症和其他病症 6,000 多篇關於在多種疾病中的作用的出版物 c5a/c5ar 是經過驗證的促進炎症的靶標第 9 頁 c5a
炎症的強放大器 C5aR 在許多免疫細胞上表達,在疾病條件下在許多組織中上調。靶向強大的促炎機制 vilobelimab 靜脈注射 mAb INF904 口服小分子靶向 C5(例如上市的 C5 阻滯劑)不能阻止 C5a 的形成,只能阻斷補體途徑介導的裂解(經典、凝集素、替代品)不適合嚴格控制 C5A/C5AR1 驅動的炎症 C5

維洛貝利單抗治療潰瘍性壞疽性膿皮病 (PG)
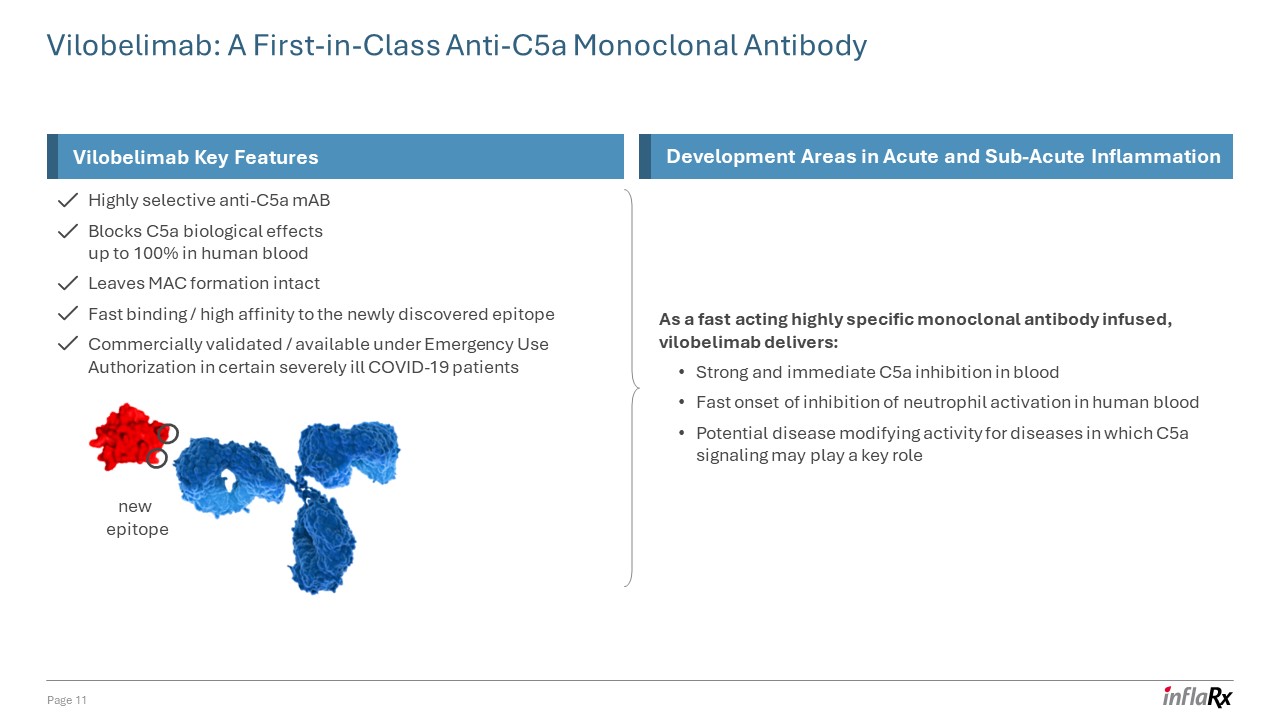
高選擇性抗 C5a 單抗可阻斷人體
血液中高達 100% 的 C5a 生物學效應 MAC 形成完好無損與新發現的表位快速結合/高度親和力經商業驗證/在緊急使用授權下可用於某些重症 COVID-19 患者 Vilobelimab:同類首創
抗 C5a 單克隆抗體第 11 頁新表位維洛貝利單抗急性和亞急性關鍵特徵開發領域炎症作為一種注入速效的高特異性單克隆抗體,維洛貝利單抗可提供:強效而即時的 C5a
血液中的抑制作用快速開始抑制人體血液中中性粒細胞的激活 C5a 信號傳導可能起關鍵作用的疾病的潛在疾病改變活性

PG:未滿足需求量高的自身免疫性疾病第 12 頁 PG 概述和未滿足的
需求臨牀特徵 PG 是一種罕見但可能危及生命的皮膚疾病,可導致慢性、難以治療的傷口患者經常患有其他自身免疫性疾病,例如潰瘍性結腸炎、類風濕關節炎
和血液系統疾病患者疼痛嚴重、癒合時間長、頻繁複發發病率和市場潛力罕見——估計美國和歐洲有多達 50,000 名患者受到影響。巨大的市場潛力
— 根據已進行的市場研究預計溢價當前的治療和醫療需求美國或歐盟目前未批准任何藥物對於不太嚴重的病例,可以使用局部或病變內治療,包括局部使用類固醇在進展迅速的病例中使用
的全身免疫抑制療效報告不一;經常出現治療持續時間長和復發情況使用維洛貝利單抗治療的有力理由:PG 與中性粒細胞皮膚有關
浸潤受影響區域和病變,可能由 C5a 觸發

PG 傷口液中的 C5a 水平與 netosis 相關 PG 的病因
被認為與免疫系統失調,特別是中性粒細胞功能改變有關。有證據表明,補體激活和 C5a 在疾病發展中起着重要作用:
PG 患者傷口液中檢測到高 C5a 水平 C5a 水平與傷口液中的彈性蛋白酶水平密切相關,a Netosis 標記 c5a/C5ar 軸激活可能是 PG C5a 中神經毒的關鍵驅動因素在控制中性粒細胞
PG 發病機制中誘發神經毒症:C5a/C5ar 軸的潛在作用 Page 13 Con c5a(20 nM;1 小時)細胞外 DNA 染色 Wang 等人 2024。J 投資 Derm. 144;TW = 創傷傷口

PG IIa 期無安全性或耐受性問題,藥物劑量依賴性
活性第 14 頁臨牀反應高劑量組的靶潰瘍閉合率和臨牀緩解率最高(86%)在治療結束時或最後一次給藥當天的 17 名患者中,有 9 名患者報告了臨牀緩解 (PGA
≤ 1) 的臨牀緩解 (PGA
≤ 1),另外 1 名患者報告的臨牀反應 (PGA ≤ 3)) 7 名患者報告略有改善 (PGA = 4) (41%) 安全性未觀察到輸液相關反應對於 2 名患者,相關的 SAE 為
報告丹毒導致住院(申辦方認為無關聯)延遲超敏反應導致皮疹觀察到的AE分佈與患者的基礎疾病相一致未檢測到劑量相關不良反應III期
已啟動基於FDA孤兒藥的反饋和快速跟蹤狀態美國食品藥品管理局孤兒藥狀態 EMA
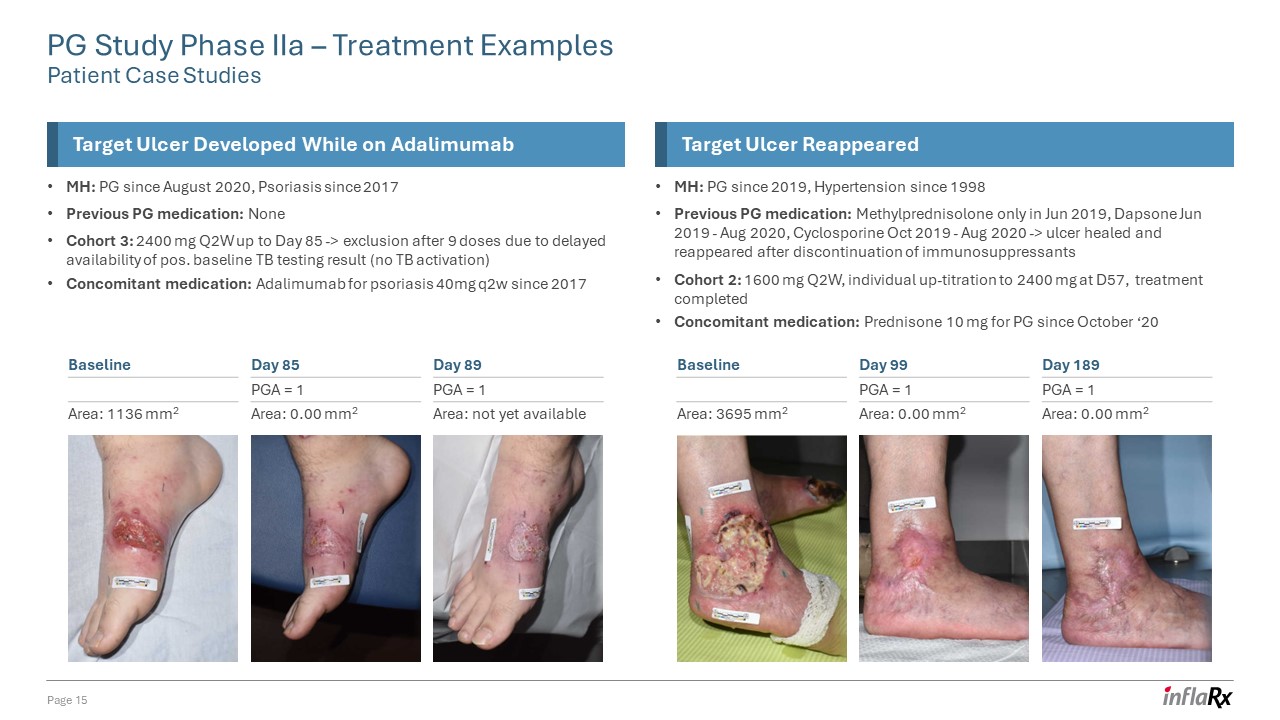
PG 研究 IIa 期 — 治療示例患者案例研究第 15 頁目標
潰瘍在服用阿達木單抗時出現的潰瘍 MH:PG 自 2020 年 8 月起,牛皮癬之前的 PG 藥物:無隊列 3:2400 mg Q2W 至第 85 天-> 由於基線結核檢測結果延遲出現
(未激活結核)伴隨藥物:阿達木單抗用於 85 天-> 由於基線結核檢測結果延遲可用,9 劑後被排除在外(未激活結核病)伴隨藥物:阿達木單抗用於銀屑病 40mg q2w 自 2017 年起目標潰瘍再次出現 MH:PG 自 2019 年起,高血壓自 1998 年起先前的 PG 藥物:甲基潑尼鬆龍僅在 2019 年 6 月,氨苯碸 2019 年 6 月至 2020 年 8 月,環孢素 2019 年 10 月至 2020 年 8 月-> 停用免疫抑制劑後潰瘍癒合並再次出現隊列 2:1600 mg Q2W,個人在 D57 時向上滴定至 2400 mg,治療完成伴隨用藥:自20年10月起用於PG的潑尼鬆 10 mg 第 89 天 PGA = 1 區域:尚未上市基準面積:1136 mm2 天 85 PGA = 1 區域:mm2 第 189 天 PGA = 1 區域:0.00 mm2 基準面積:3695 mm2 第 99 天 PGA = 1 區域:0.00 mm2

PG III 期研究設計:預計於 2025 年進行中期分析第 16 頁治療:
26 周隨訪:12 周安全隨訪潑尼鬆逐漸減少潑尼鬆逐漸減少隨機化 vilobelimab 2400 mg Q2W(13 劑量)EOT(W 26)安全隨訪患者水平停止標準進展(任何時間)或
在規定的時間點沒有改善 22 20 18 16 14 12 10 0 2 4 6 8 安慰劑 Q2W(13 劑量)24 周劑量 26 Arm 1 Arm 2 Arm 2 n 大約 = 15 n 大約 = 15 n 中期分析*設定大小調整或
徒勞的規則總數患者將在 50 — 100 之間進行調整** 主要終點:完全閉合目標潰瘍自適應設計 * 除獨立數據安全監測委員會外均為失明 /**盲中期分析篩查後
隨機分組比率調整為 2:1(Arm 1 至組 2)
INF904:具有一流潛力的口服高選擇性 C5ar 抑制劑
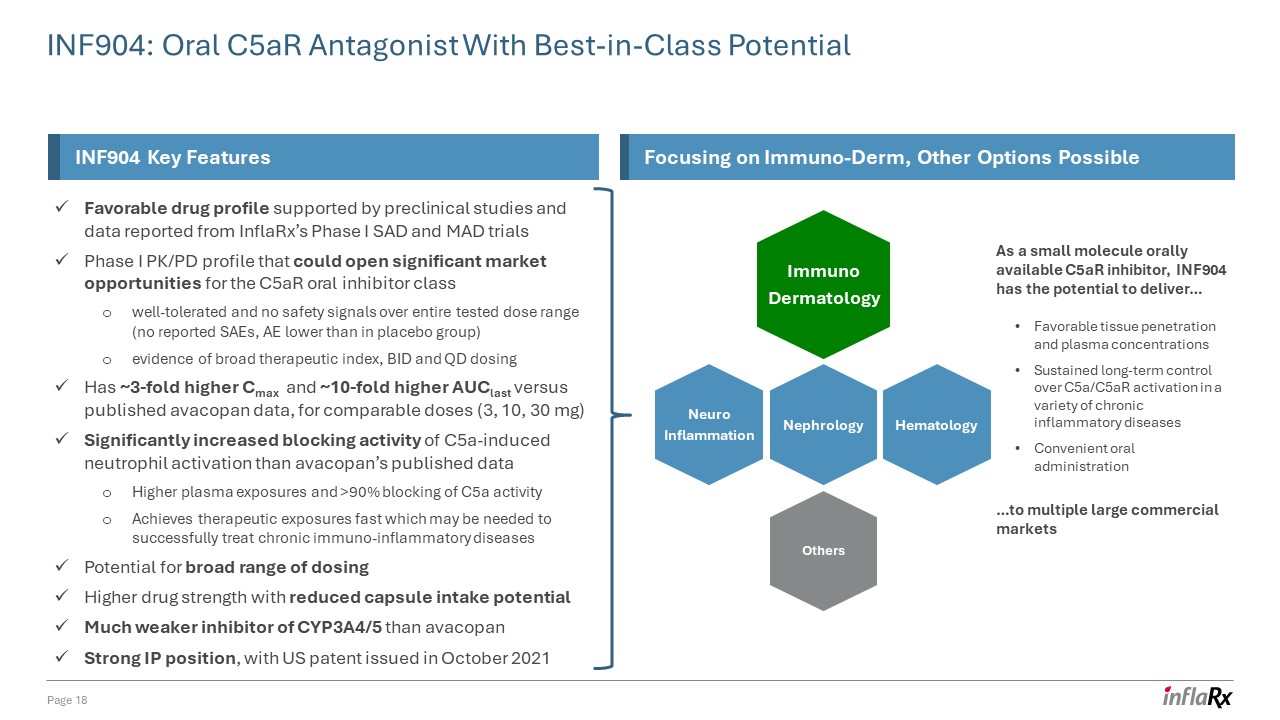
INF904:具有一流潛力的口服 C5AR 拮抗劑第 18 頁 INF904 關鍵
特徵重點關注免疫皮膚,其他選擇可能的臨牀前研究和 InflarX I 期 SAD 和 MAD 試驗 I 期 PK/PD 概況報告的數據支持了良好的藥物特徵,這可能會為耐受性良好、在整個測試劑量範圍內沒有安全信號的 C5ar 口服抑制劑類別開闢巨大的市場機會(未報告 SAE),AE 低於安慰劑組)有廣泛的治療指數、BID 和 QD 劑量高出約 3 倍
Cmax 和 ~相似劑量(3、10、30 mg),AucLast 與已公佈的 avacopan 數據相比高 10 倍,C5A 誘導的中性粒細胞激活的阻斷活性比 avacopan 公佈的數據顯著增加血漿暴露量和
> 90% 阻斷 C5a 活性快速獲得成功治療慢性免疫炎症性疾病可能需要的治療暴露範圍廣泛的可能性減少膠囊攝入量更高的藥物強度
潛在的CYP3A4/5抑制劑比avacopan強勁的知識產權地位弱得多, 美國專利於2021 年 10 月免疫皮膚科神經炎症其他腎臟病血液學作為一種小分子口服可用的 C5aR
抑制劑,INF904 有可能提供... 良好的組織穿透力和血漿濃度持續長期控制各種慢性炎性疾病中的 C5a/C5ar 激活便捷的口服給藥... 到
多個大型商業市場
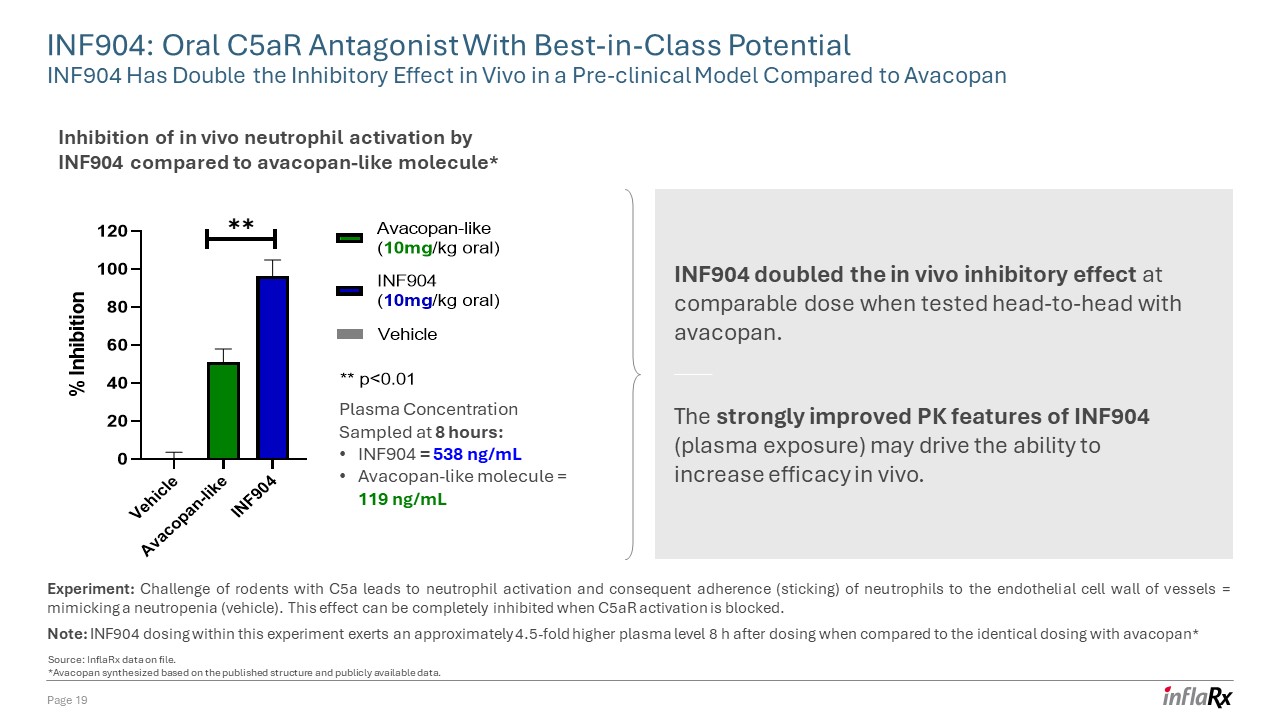
INF904:具有一流潛力的口服 C5ar 拮抗劑 INF904 在臨牀前模型中的體內抑制作用是 Avacopan 的兩倍第 19 頁與 avacopan 樣分子相比 INF904 抑制體內中性粒細胞激活* 實驗:使用 C5a 的齧齒類動物挑戰會激活中性粒細胞
,進而導致中性粒細胞粘附(粘連)到血管內皮細胞壁=模仿中性粒細胞減少症(載體)。當阻止 C5ar 激活時,此效果可以完全抑制。注意:與 8 小時採樣的相同劑量相比,本實驗中的 INF904 劑量
在給藥 8 小時後施加的血漿水平高出大約 4.5 倍* 血漿濃度:INF904 = 538 ng/mL Avacopan 樣分子 = 119 ng/mL INF904 在與阿瓦可潘正面交鋒測試時,在同等劑量下,
的體內抑制效果翻了一番。INF904(血漿暴露)PK特徵的顯著改善可能會推動提高體內療效的能力。來源:存檔的 InflarX 數據。*Avacopan
根據已發佈的結構和公開的數據合成。
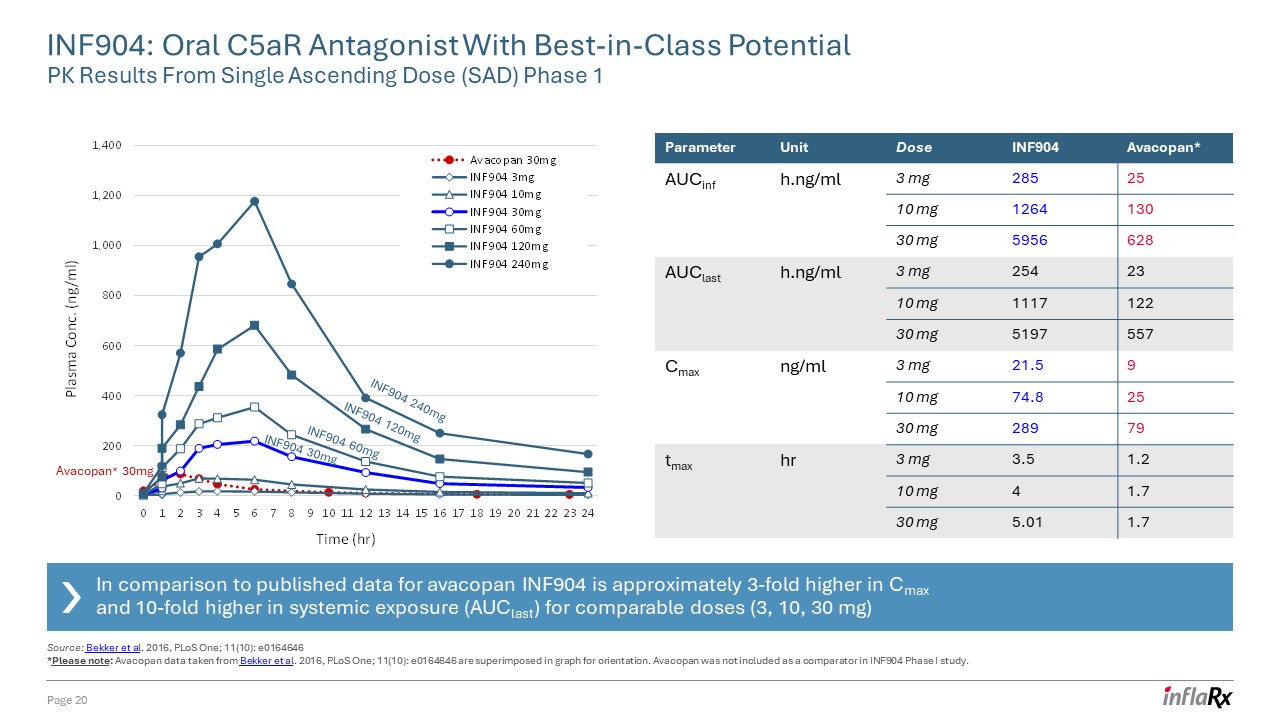
INF904:單一
升序劑量 (SAD) 第 1 階段 1 頁 20 參數單位劑量 INF904 Avacopan* aucinF h.ng/ml 3 mg 285 25 10 mg 1264 130 30 mg 5956 628 aucLast h.ng/ml 3 mg 254 23 10 mg 1117 122 30 mg 5197 557 cmax ng/ml 3 mg 5197 cmax ng/ml 3 mg 595 628 auclast h.ng/ml 3 mg 254 23 10 mg 1117 122 30 mg 5197 557 cmax ng/ml 3 mg 5197 557 cmax ng/ml 3 mg 591.5 9 10 mg 74.8 25 30 mg 289 79 tmax hr 3 mg 3.5 1.2 10 mg 4 1.7 30 mg 5.01 1.7 INF904 240mg INF904 60mg INF904 30mg INF904 120mg Avacopan* 30mg INF904 240mg INF904 60mg INF904 30mg INF904 120mg 來源:Bekker
等人 2016,PloS One;11 (10):e0164646 *請注意:Avacopan取自 Bekker 等人 2016 年,PLoS One;11 (10): e0164646 的數據疊加在圖表中以確定方向。INF904 I 期研究中未將阿瓦可潘列為比較物。
與已公佈的 avacopan 數據相比,在可比劑量(3、10、30 mg)下,INF904 的 Cmax 值高出大約 3 倍,全身暴露 (AucLast) 高出 10 倍
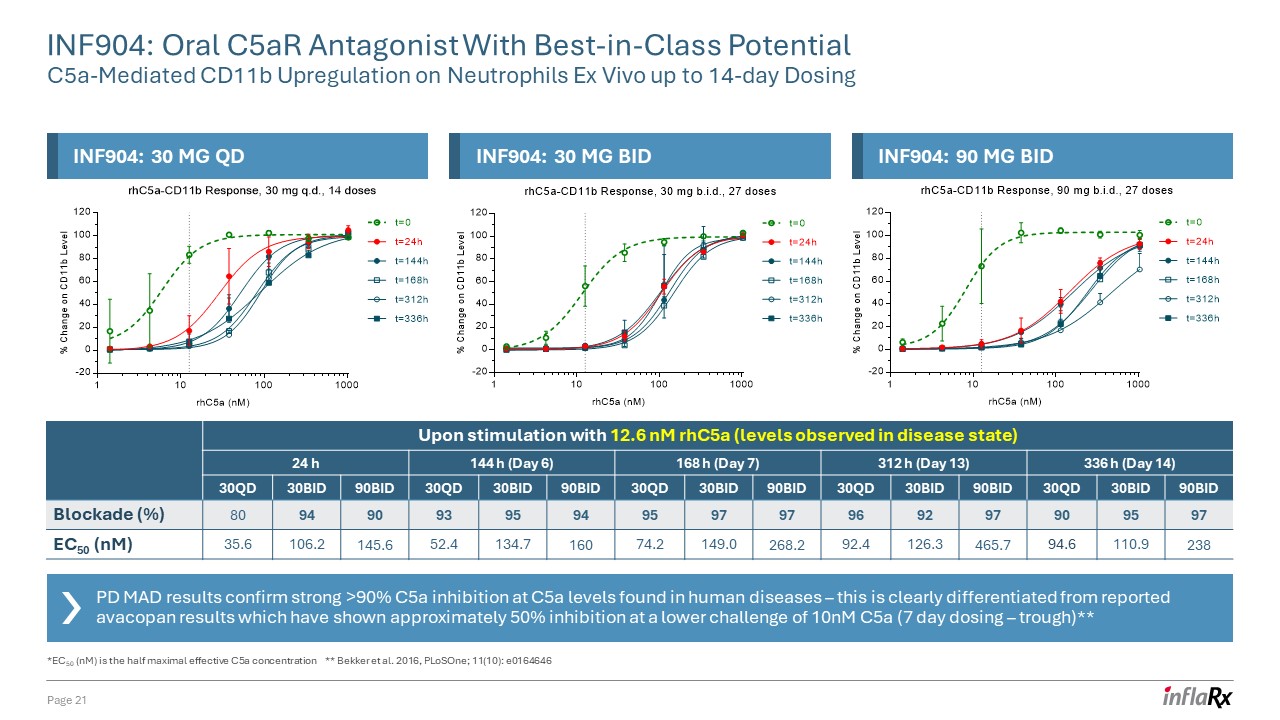
PD MAD 結果證實,在人類
疾病中發現的 C5a 水平下,C5a 的抑制力超過 90% ——這與報告的阿瓦可潘結果有明顯區別,後者顯示,在 10nM C5a(7 天給藥 — 低谷)的較低挑戰下,抑制率約為 50% ** 在使用 12.6 nM rHC5a(疾病
狀態觀察到的水平)刺激後 24 h 144 h(第 6 天)168 h (第 7 天) 312 小時(第 13 天)336 小時(第 14 天)c5a (nM) 30QD 30BID 90BID 30QD 30BID 90BID 30QD 30BID 90BID 30QD 30BID 90BID 30BID 90BID 30BID 30BID 90BID 30BID 90BID 30BID 90BID 30BID 90BID 30BID 90BID 30BID 30BID 90BID 30BID 90BID 30BID 30BID 90BID 30BID 90BID 30BID 30BID 90BID 30BID 30BID 90BID 30BID 30BID 90BID 30BID 30BID 90BID 30BID 30BID 90106.2 145.6 52.4 134.7 160 74.2 149.0 268.2 92.4 126.3 465.7 94.6 110.9 238 INF904:口服 c5ar 拮抗劑,具有一流潛力 C5A 介導的 CD11b
對體外中性粒細胞的上調劑量長達 14 天第 21 頁 *EC50 (nM) 是半最大有效 C5a 濃度 ** Bekker 等人. 2016,plosOne;11 (10):e0164646 INF904:30 mg QD INF904:30 mg BID INF904:90 mg BID:90 mg BID

第 22 頁投資 INF904 開發第 IIa 期預計將於 EOY
2024 年開始 IIa 初始階段 — 展示了 INF904 開放標籤 PK/PD “籃子研究” 的初始療效信號 CSU 和 HS 的 4 周治療期初始療效信號 CSU 和 HS 已確定
終點計劃對至少 3 種不同劑量進行安全和 PK/PD 評估預期催化劑 IIa 期將於 2024 年 EOY 階段開始預計將在2025年發佈IiA數據更大規模和更長期的IIb期研究預計將於2025年開始

用於慢性自發性蕁麻疹 (CSU) 的 INF904

在科羅拉多州立大學 C5ar 信號傳導中開發 INF904 的有力理由以獨立於 IgE 的方式參與
組胺釋放。越來越多的科學證據表明,C5ar 信號傳導以獨立於 IgE 的方式參與科羅拉多州立大學肥大細胞和嗜鹼性粒細胞的組胺釋放。這種機制可能對科羅拉多州立大學中描述的兩種內型發揮
重要作用:I 型(IgE 介導)和 IiB 型(IgG 自身抗體介導)儘管目前有抗組胺和抗 IgE 療法等治療選擇,但估計這些患者中大約 30-60% *仍無反應或無症狀。對於那些目前療法得不到充分治療的人來説,INF904 可能是一種便捷的口服治療選擇。據估計,到2032年,科羅拉多州立大學的市場潛力將超過30億美元** * Metz 等
al,Clin Rev Allerny Immunol。2020 年;59 (1):38—45。** GlobalData 和 Leerink 分析師報告第 24 頁

慢性自發性蕁麻疹 (CSU) CSU 概述和未滿足的需求臨牀
的特點是一種免疫介導的慢性炎症性皮膚病,其炎症級聯失調使患者容易出現症狀發展:蕁麻疹/輪狀體虛弱且劇烈瘙癢超過 6 周,通常
與血管性水腫相關疾病負擔很高,會影響睡眠、心理健康、生活質量和生產力學校和工作中的併發症包括特應性疾病、抑鬱症、自身免疫和甲狀腺
疾病流行病學估計患病率約為普通人羣的1%,其中20%的人羣出現症狀超過5年,20至40歲的受影響最大,女性受影響的人數是男性的2倍當前
治療和醫療需求第二代抗組胺藥等療法對大量患者無效抗Ig-E療法和免疫抑制劑等選項也不能充分為科羅拉多州立大學人羣提供服務 Page
25
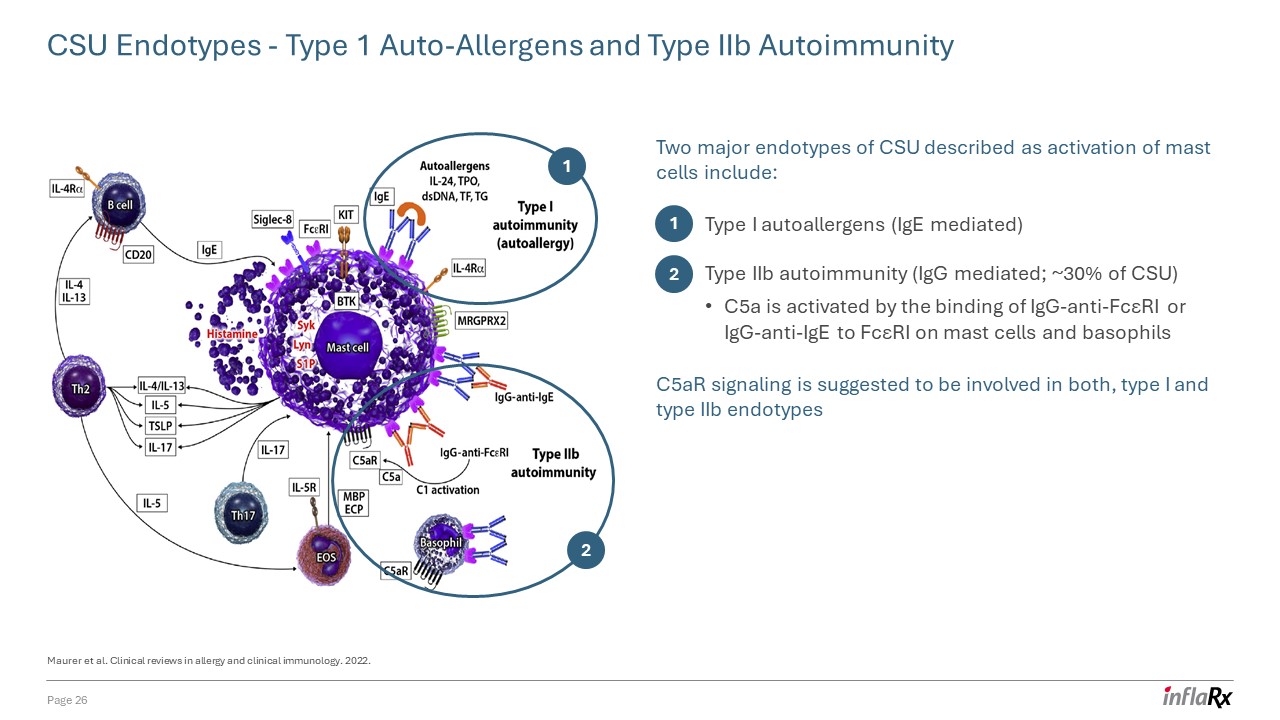
科羅拉多州立大學內型——1 型自身過敏原和 IIb 型自身免疫被描述為肥大細胞激活的科羅拉多州立大學的兩種主要
內型包括:Maurer 等人。過敏和臨牀免疫學臨牀綜述。2022. 1 2 I 型自身過敏原(IgE 介導)IiB 型自身免疫(IgG 介導;約 30% 的 CSU)C5a 被
通過肥大細胞上的 Igg-Anti-FCRe或 IgG-Anti-IgE 與 FcμRI 結合來激活,嗜鹼性粒細胞 C5ar 信號傳導同時參與 I 型和 IIb 型內型 1 2 第 26 頁
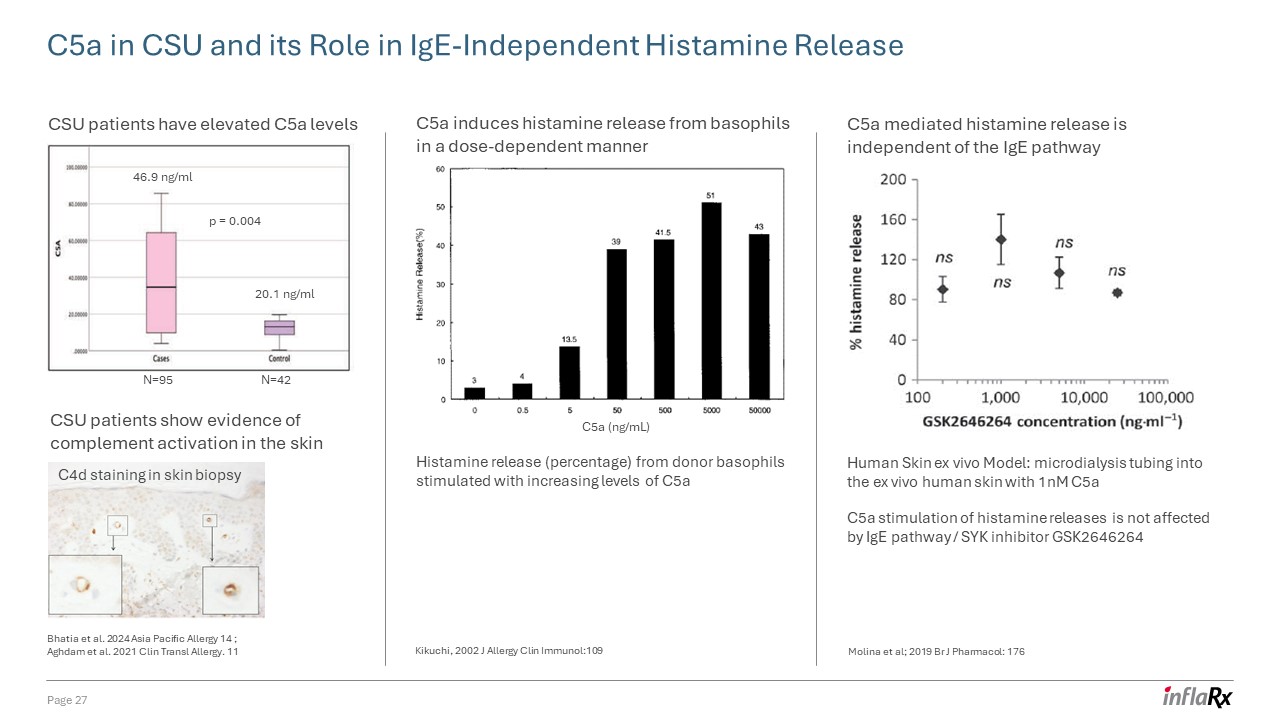
科羅拉多州立大學中的 C5a 及其在不依賴於 IgE 的組胺釋放中的作用第 27 頁科羅拉多州立大學
患者顯示出皮膚補體激活的證據 c5a 水平升高 46.9 ng/ml 20.1 ng/ml 20.1 ng/ml N=95 N=42 p = 0.004 c4d 染色皮膚活檢 C5a (ng/mL) C5a 誘導嗜鹼性粒細胞釋放組胺
劑量依賴性方式 C5a 介導的組胺釋放水平升高刺激供體嗜鹼性粒細胞的組胺釋放(百分比)與 IgE 通路無關 C5a 對組胺釋放的刺激不受 IgE
途徑/SYK抑制劑 GSK2646264 人體皮膚體外模型:使用 1nM c5a 的微透析管進入體外人體皮膚 Bhatia 等人 2024 年亞太過敏 14;Aghdam 等人。2021 年 Clin Transl 過敏。11 菊池,2002 年 J 過敏
臨牀免疫學:109 Molina 等人;2019 年 Br J Pharmacol:176

C5A 誘導的組胺釋放對兩者都很重要,IgE 依賴途徑和
IgE 獨立途徑 C5a/C5ar 以獨立於 IgE 的方式促進組胺釋放,抗 IgE 刺激後(> 20% HR)抗 IgE 刺激陰性。激活凝血通路
(組織因子)可能會放大科羅拉多州立大學中 C5a 的產生 [TF]釋放)除了從科羅拉多州立大學患者身上分離出來的自體抗體觸發嗜鹼性粒細胞外,C5a 刺激還會導致劑量依賴性組胺釋放 c5a 刺激從科羅拉多州立大學患者身上分離的嗜鹼性粒細胞 c5a 刺激導致
劑量依賴性組胺釋放 Matsubara 等人。Front Immunol 2022,13。第 28 頁

科羅拉多州立大學 INF904 的開發第 29 頁結論:C5ar 信號傳導參與科羅拉多州立大學肥大細胞/嗜鹼性粒細胞的
組胺釋放。這種 C5A 介導的組胺釋放獨立於 IgE 途徑,被認為在科羅拉多州立大學的兩種亞型中都起作用 C5ar 抑制是一種新的作用機制
(MoA),以滿足未滿足的醫療需求作為口服強效的 C5ar 抑制劑,科羅拉多州立大學的 INF904 非常適合在科羅拉多州立大學進行開發

INF904 用於化膿性汗腺炎 (HS)

需要在 HS 新機制中開發 INF904 的有力理由,需要新的
機制來更全面地解決該疾病。例如,中度至重度活性引流疾病患者目前獲得批准的治療選擇有限,這些治療方案已被證明對他們有效,而且已知在許多情況下,使用經批准的抗腫瘤壞死因子α或抗 IL17 藥物治療
的反應會隨着時間的推移而減弱 HS 患者更傾向於口服藥物而不是注射(和手術切口)。) * INF904 是一種口服 C5ar 抑制劑
,具有: 一種抑制已知 C5a 誘導的對免疫細胞中性粒細胞激活和組織積累的作用的作用機制,包括誘導 NetoSis,這些機制被認為參與 HS 進展
,特別是 HS 病變形成的臨牀證據表明,阻斷 C5a/C5ar 途徑會降低 HS 的病變數量。患者全身暴露的劑量範圍廣 HS 的市場潛力是
極具吸引力,預計到2032年市場規模將超過39億美元** * Willems,D.,EL. Hinzpeter、Van der Zee、H.H. 等。患者 16,153—164 (2023) ** GlobalData 和 Leerink /古根海姆分析師報告第 31 頁

化膿性汗腺炎(HS)HS 概述和未滿足的需求臨牀特徵一種
慢性、複發性、使人衰弱的中性粒細胞驅動的炎性疾病,其特徵是膿腫、結節和帶有化膿性或血跡分泌物的排水隧道(DT),可爆發並導致
疤痕偏向於腋下、凹槽等間部位與嚴重細菌感染、嚴重生活質量障礙和功能障礙相關的臀部和乳房下部位流行病學在美國和歐盟的流行病學流行病學流行病學流行病學流行率為估計為 0.7%-1.2% 儘管估計值差異很大,但我們估計僅在美國就有超過20萬名中度至重度HS患者當前的治療和醫療需求當前的治療包括疼痛管理、
抗生素、皮質類固醇和生物製劑當前批准的療法顯示出對大量患者的療效隨着時間的推移而減弱。此外,主動引流
疾病的受影響患者存在大量未得到滿足的醫療需求。第32頁
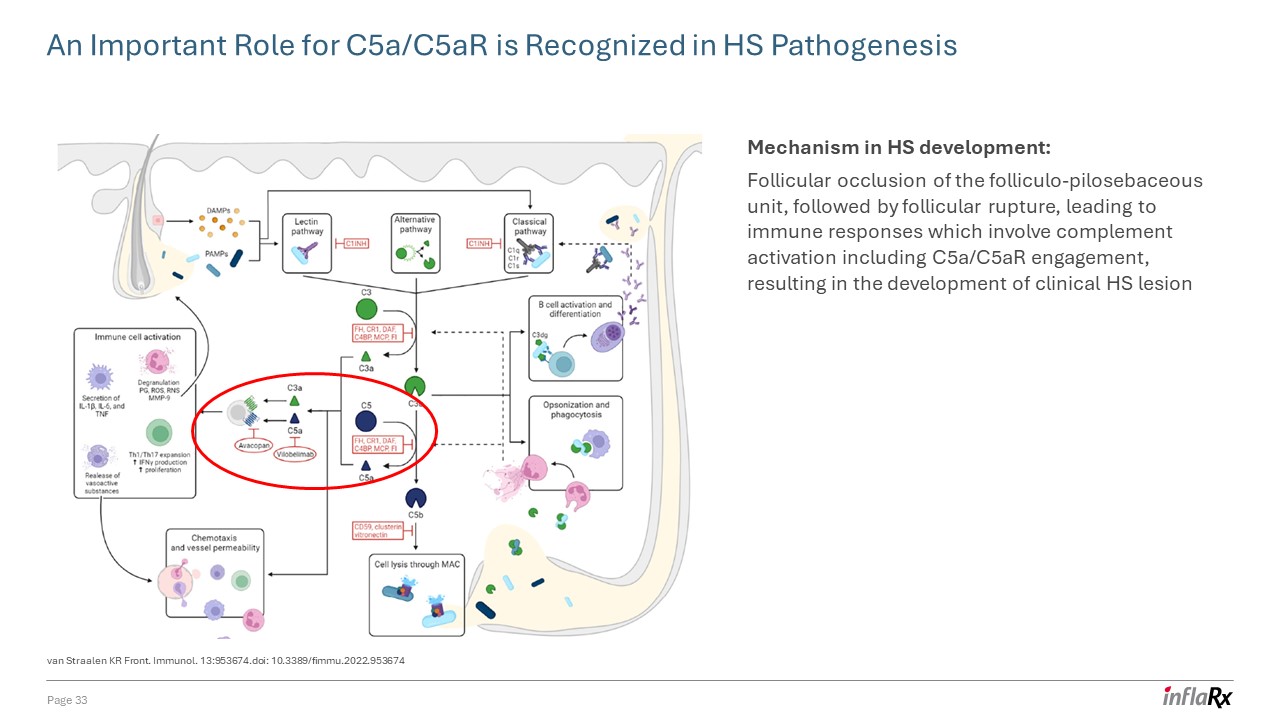
Straalen KR
Front 在 HS 發病機制中認識到 C5a/C5ar 的重要作用。Immunol. 13:953674. doi:10.3389/fimmu.2022.953674 HS 發育的機制:毛囊-毛囊皮脂腺單元的濾泡閉塞,然後是濾泡破裂,導致免疫反應,包括補體激活
,包括 C5a/C5AR 參與,導致臨牀 HS 病變的發展第 33 頁

第 34 頁在 HS HS 患者中開發抗 C5A/C5AR 的有力理由
C5a 升高,這是一種主要的中性粒細胞激活劑,可被抗 C5A/C5AR 阻斷 Kanni 等人,2018 年 HS 患者補體激活顯著,C5a 水平升高 C5a/C5ar 激活是 HS 患者
血漿的關鍵中性粒細胞激活劑 Guo 等人 2019 年 8 月美國專利號10,376,595 來源:InflarX 內部存檔數據 HS 患者血漿強烈刺激健康供體血液中的中性粒細胞激活:添加
可以完全阻斷這種作用:維洛貝利單抗(抗 C5A 抗體)和 INF904(抗 C5AR 抑制劑)14 名健康對照組和 54 名 HS 患者血漿中 C5a 的濃度。P 值表示患者與對照組之間的顯著差異。

增強所有疾病階段的 HS 患者活檢中的 C5ar 染色第
35 頁 c5ar1 染色 HF:毛囊 S:化膿性 Hurley I 期患者,伴有大量深層皮膚和皮下化膿性膿腫炎症,周圍毛囊伴有角化過度。c5ar1 染色陽性 —
中性粒細胞 T:隧道 R:隧道破裂 PEH:銀屑病表皮增生 Hurley II 期患者,隧道形成和隧道破裂區域,上皮被中性粒細胞片包圍。c5ar1 染色陽性 —
中性粒細胞 T:隧道 G:肉芽腫 F:纖維化 Hurley III 期患者,伴有隧道形成,周圍有肉芽腫性炎症,伴有異物鉅細胞。C5ar1 染色陽性 — 中性粒細胞、組織細胞和巨型
細胞 H&E 染色 Van Straalen 等人,2022年。Front Immunol 21

C5a/C5ar 信號傳導在 HS 中的作用的臨牀證據第 36 頁 Vilobelimab
(抗 C5a 單抗)SHINE IIb 期研究針對中度重度 HS 患者得出了各種療效信號,包括總體炎症病變減少 * 在 SHINE 中,嚴格控制 C5a 水平的
患者 dT 降低幅度更高 * 從中吸取的關鍵經驗教訓:需要更高劑量的維洛貝利單抗來充分控制 c5a/C5ar 信號傳導並提高減輕病變的功效 Avacopan(口服 C5ar 抑制劑)標準劑量
在 30 mg BID 中,在 HiSCR 的重度 HS 患者(Hurley III)中檢測到了 p 值陽性療效信號,第 12 周出現了與安慰劑組的明顯分離 ** 注意:在 ANCA 血管炎患者中,阿瓦科潘的穩定水平僅在 3 個月左右才報告達到 *** 30 mg BID 給藥方案可能太低了,無法進行充分的 HS 治療阿瓦可潘的延遲積累可能阻礙了療效的早期發作 *
文件中的InflarX數據 **數據來自Chemocentryx在10月28日發表的AURORA試驗結果報告2020 年:注意:總體結果尚未統計。所有中度至重度 HS 患者(主要終點)的 hiSCR 均顯著 *** 數據來自 avacopan NDA 申報的
ANCA 相關血管炎
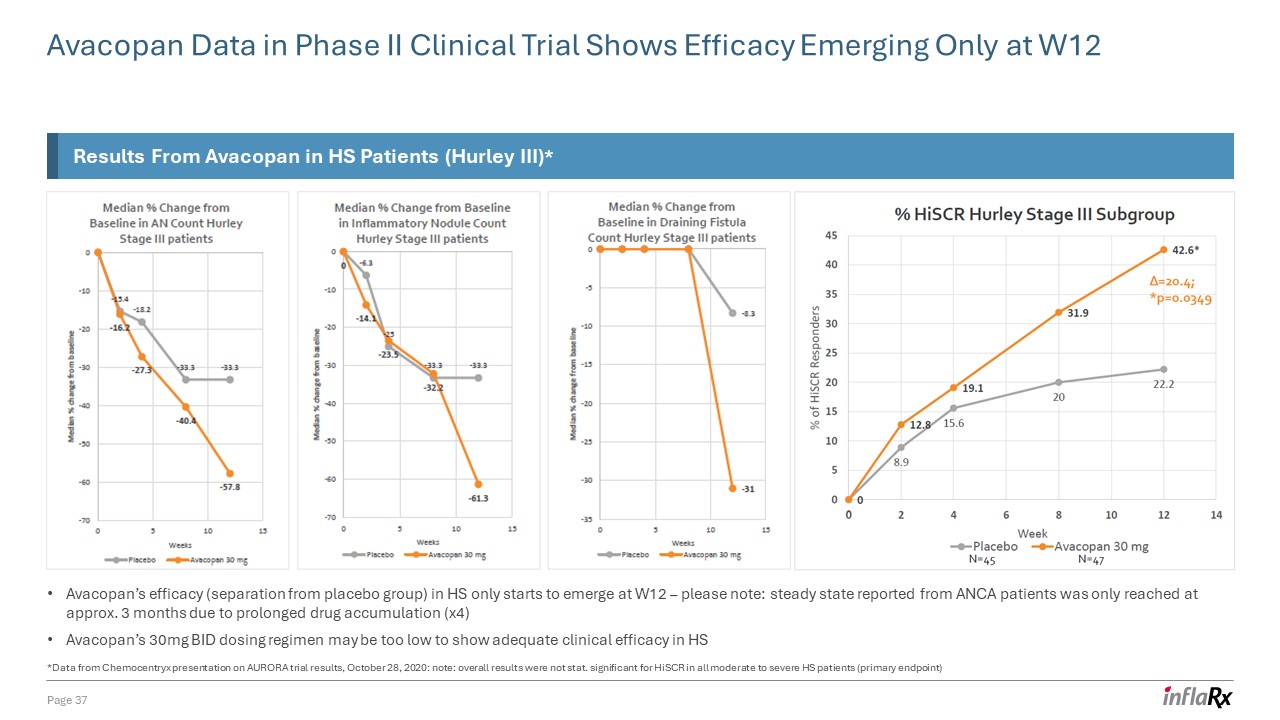
二期臨牀試驗中的 Avacopan 數據顯示,療效僅在 W12 頁出現
37 個 Avacopan 對 HS 患者的結果(Hurley III)* Avacopan 在 HS 中的療效(與安慰劑組分離)僅在 W12 開始顯現——請注意:由於
藥物積累時間延長 (x4) Avacopan 的 30mg,ANCA 患者報告的穩定狀態僅在 3 個月左右達到 BID 給藥方案可能太低,無法在 HS 中顯示出足夠的臨牀療效 *數據來自 Chemocentryx 在 AURORA 試驗結果上的報告,2020 年 10 月 28 日:注意:總體結果不是stat.
對所有中度至重度 HS 患者(主要終點)的 HisCR 意義重大
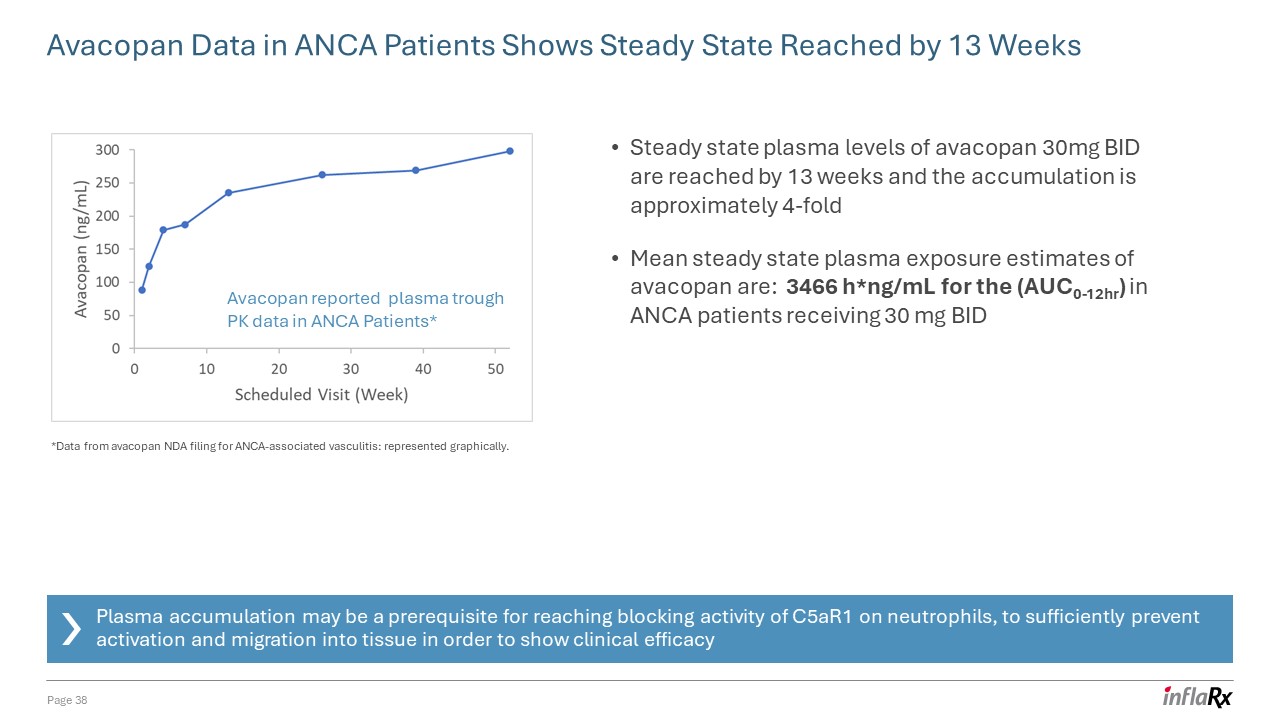
ANCA 患者的 Avacopan 數據顯示,在 13 周內達到穩定狀態第
38 頁 Avacopan 報告了 ANCA 患者的血漿槽 PK 數據* 在 13 周內達到了穩態血漿水平 BID,累積量約為 4 倍 avacopan 的平均穩定狀態血漿暴露量估計為:
3466 H*ng/mL,對於接受 30 mg 的 ANCA 患者(AUC0-12HR)BID 血漿積累可能是中性粒細胞達到 c5ar1 阻斷活性的先決條件,足以防止激活和遷移到組織中,以
顯示臨牀療效 *來自 avacopan NDA 申請的 ANCA 相關血管炎的數據:以圖形方式表示。

Vilobelimab* 和 Avacopan** 為 HS 患者的療效提供證據 page
39 結論:C5ar 在 HS c5a/C5ar 信號通路抑制中的作用已在 HS 患者中產生療效信號,需要嚴格控制 C5ar 信號傳導才能實現最佳療效 —
劑量對於 HS 很重要!INF904 作為口服 C5AR 抑制劑處於理想地位,具有優化 PK/PD 特徵,可滿足 HS 患者現有的高未滿足的醫療需求 * 來源:InflarX 存檔數據。** 來源:Chemocentryx
在 AURORA 試驗結果上發表的數據,2020 年 10 月 28 日

Gohibic (vilobelimab) 危急 COVID-19 和 ARDS

Gohibic 的緊急使用授權 (EUA) 第 41 頁 Gohibic
(vilobelimab) 尚未獲得批准,但已獲美國食品和藥物管理局根據歐盟*授權緊急使用,用於在接受 IMV 後的 48 小時內開始治療住院成人 COVID-19,或歐洲 EMA/
CHMP 正在審查 ECMO** MAA,與美國食品藥品管理局關於未來 BLA 的討論仍在進行中提交授權是根據一項針對危重病人、機械通氣的 COVID-19 患者進行的 III 期臨牀試驗結果授予的,其中 Gohibic 治療減少了
與安慰劑相比,死亡率下降了23.9%。Gohibic是第一種獲得授權的靶向C5a的治療藥物,是炎症宿主反應的潛在關鍵參與者Gohibic已由InflarX在美國根據EUA推出:組建一支經驗豐富且高度專注的商業團隊,提高不同醫療保健參與者的知名度建立強大的供應鏈,允許不間斷地向美國醫院供應戈希比奇(維洛貝利單抗)* GOHIBIC
的緊急用途僅限於在宣佈有正當理由批准緊急用途的情形的有效期內獲得授權根據該法案第 564 (b) (1) 條(21 U.S.C. §
360bbb-3 (b) (1),在 COVID-19 疫情期間的藥品和生物製品,除非聲明終止或授權提前撤銷 ** IMV = 侵入性機械通氣,***ECMO = 體外膜氧合欲瞭解更多重要的安全信息,請訪問
www.gohibic.com
電子郵件:IR@inflarx.com 電話:+49-3641-508180 傳真:
+49-3641-508181 www.inflarx.com Inflarx.com Inflarx N.V. Winzerlaer Str. 207745 德國耶拿