

將新一類抗生素推進針對 “優先病原體” 的三期試驗 David P. Luci,總裁兼首席執行官 2024 年 4 月 — 世衞組織和疾病控制與預防控制中心發佈根據第 433 條提交的免費書面招股説明書第 333 號-278028,2024 年 4 月 2 日

披露1 免費寫作招股説明書本演示文稿重點介紹了有關Acurx Pharmicals, Inc.(“公司”)及其發行的基本信息。由於該摘要僅供參考,因此不包含您在投資我們公司之前應考慮的所有信息。Exc ept 另有説明,本演示文稿僅説明截至本文發佈之日。根據任何州或司法管轄區的證券法,在任何州或司法管轄區的證券法規定此類要約、招標或出售為非法的州或司法管轄區,此類要約、招標或出售是非法的。在任何州或司法管轄區,任何人提出此類要約或招標均不構成出售要約,也不構成買入要約的邀請。美國證券交易委員會(“SEC”)和任何其他監管機構均未證實或不贊成這些證券,也沒有透露本陳述的準確性或充分性。任何與此相反的陳述均屬刑事犯罪。本演示文稿包括我們從行業出版物和期刊、第三方研究和調查、公司內部研究和調查以及其他公開信息中獲得的行業和市場數據。行業出版物和調查普遍指出,她本人所包含的信息是從據信可靠的來源獲得的。儘管我們認為截至本演示之日的行業和市場數據是可靠的,但這些信息可能會被證明是不準確的。行業和市場數據可能是錯誤的,這是因為來源獲取數據的方法,也因為由於原始數據可用性和可靠性的限制、數據收集過程的自願性質以及其他限制和不確定的主要關係,信息無法始終得到完全確切的核實。此外,我們不知道本文所依賴或引用的來源在編制預測時使用的所有假設。公司已向美國證券交易委員會提交了經修訂的S-1表格(文件編號333-278028)的註冊聲明,包括初步招股説明書。註冊聲明尚未生效。在投資之前,您應該閲讀註冊聲明中的初步招股説明書,以及與本次發行有關的最終招股説明書(如果有)。與本次發行相關的初步招股説明書的電子副本可供查閲,與本次發行有關的最終招股説明書的副本將在美國證券交易委員會的網站www.sec.gov上公佈。與本次發行相關的初步招股説明書和最終招股説明書的副本(如果有)可通過致電 (929) 833-1246 或發送電子郵件至 info@titanpartnersgroup.com 聯繫美國資本合夥人有限責任公司下屬的泰坦合夥人集團有限責任公司,紐約10007世界貿易中心4號29樓。

披露(續)前瞻性陳述本演示文稿包含1995年《私人證券訴訟改革法》中定義的前瞻性陳述,內容涉及發展計劃、監管活動、預期里程碑、候選產品優勢、競爭地位、業務戰略、管理寶石的目標、潛在的增長機會、潛在的市場規模、可能或假設的未來經營業績、預計成本和收益的使用。在某些情況下,前瞻性陳述可以通過諸如 “可能”、“將”、“應該”、“預期”、“計劃”、“目標”、“預期”、“可能”、“意圖”、“目標”、“項目”、“考慮”、“相信”、“估計”、“預測”、“潛在” 或 “繼續” 等術語來識別,或者這些術語或其他類似表述的否定詞。本演示文稿中除歷史事實陳述以外的所有陳述均為前瞻性陳述。公司實際上可能無法實現這些前瞻性陳述中披露的計劃、意圖或預期。由於各種因素,實際結果或事件可能與這些前瞻性陳述中披露的計劃、意圖和預期存在重大差異,包括:公司候選產品的臨牀前研究和臨牀試驗及臨牀開發的啟動和完成所固有的不確定性,包括我們臨牀開發過程中的不良結果;為什麼一項臨牀試驗的結果將預測未來試驗的結果,以及我們的臨牀試驗的初步數據是否會出現對此類試驗最終結果的預測;美國食品藥品監督管理局和其他監管機構就我們產品的開發和商業化做出的決定;為公司可預見和不可預見的運營費用和資本支出要求提供的資金短缺;我們獲得、維護和執行候選產品的知識產權和其他專有權利的能力;我們實施戰略計劃的能力;以及所討論的其他因素在 “風險因素” 中公司向美國證券交易委員會提交的部分文件,包括公司於2024年3月15日向美國證券交易委員會提交的截至2023年12月31日財年的10-K表年度報告。本演示文稿中包含的前瞻性陳述代表了公司截至本演示之日的觀點。該公司預計,隨後的事件和事態發展將導致其觀點發生變化。但是,儘管公司可能會選擇在未來的某個時候更新這些前瞻性陳述,但除非適用的證券法要求,否則它明確表示不承擔任何更新這些前瞻性陳述的義務。不應依賴這些前瞻性陳述來代表本公司在本文發佈之日之後的任何日期的觀點。2

3 發行摘要發行人股票交易所收益總額配股權獨家賬簿管理人Acurx Pharmicals ACXP Nasdaq 2,500萬美元 15% Titan Partners Group LLC,隸屬於美國資本合夥人有限責任公司的分支所得款項的用途:營運資金和其他一般用途,包括但不限於臨牀試驗、研發活動、收購和合作。普通股發行的證券
&UHDWHGE\% (-281 IURPWKH1RXQ3URMHFW &UHDWHGE\ (NR3XUQRPR IURPWKH1RXQ3URMHFW &UHDWHGE\ 177 IURPWKH1RXQ3URMHFW &UHDWHGE\ .LUDQ6KDVWU\ IURPWKH1RXQ3URMHFW 內容提要 4 企業(納斯達克股票代碼:ACXP)收購了 ibezapolstat(主要抗生素)——2018 年 2 月 &UHDWHGE\ NDNKLP IURP1RXQ3URMHFW 未滿足的醫療需求CDC將CDI歸類為需要新抗生素的緊急威脅發展。目前用於治療CDI的3種抗生素中有2種具有20%至40%的反覆感染,並且具有抗生素耐藥性 1,因此需要開發新的抗生素來治療CDI CMC,耐藥性強,COGS 低目標為300美元或以下,用於全程治療的DNA聚合酶IIIC抑制劑的新型作用機制管道(2)• 以前未開發的科學靶點 • Ibezapolstat 潛在的一線治療艱難梭菌感染(CDI)• ACX-375 靶向所有已知革蘭氏陽性細菌感染(MRSA、VRE、PRSP)第 3 階段成功完成第 1 階段和第 2 階段已完成 Ibezapolstat 顯示總體治癒率為 96% 在 EOT 的 Ph2 試驗(2a 和 2b)中。美國食品藥品管理局會議將於 2024 年 4 月手頭現金約 750 萬美元,截止日期為 23 年 12 月 31 日 1 安妮·岡薩雷斯-露娜,休斯敦大學藥學院,ECCMID 2023,《科學海報》,2023 年 4 月 6 日至 2000 年 2 月 &UHDWHGE\ .LQJSHWFKDUDW IURPWKH1RXQ3URMHFW

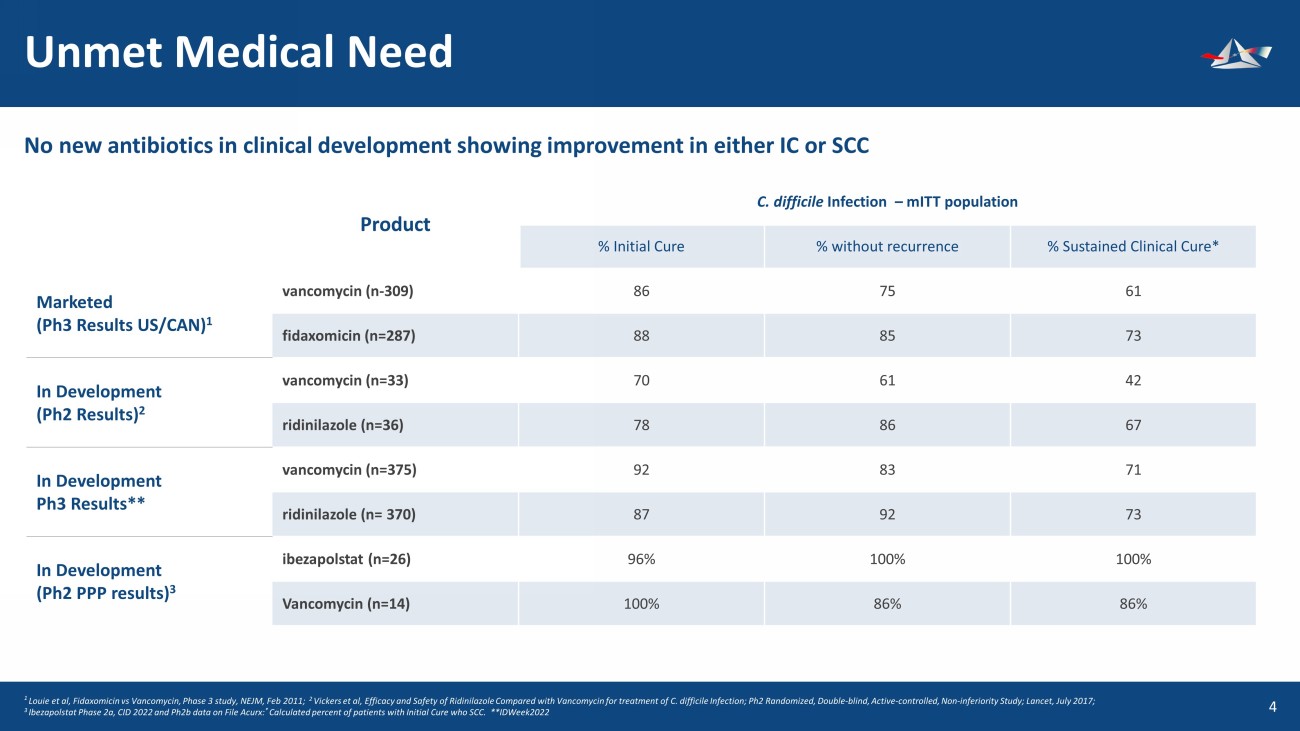
未滿足的醫療需求 5 1 Louie 等人,Fidaxomicin vs Vancomycin,3 期研究,NEJM,2011 年 2 月;2 Vickers 等人,利地尼拉唑與萬古黴素相比治療艱難梭菌感染的療效和安全性;Ph2 Rand omi zed,雙盲、主動對照、非劣勢研究;《柳葉刀》,2017年7月;3 Ibezapolstat 2a階段,CID 2022 和 File Acurx 上的 pH2b 數據:* 計算得出的初始治癒患者中有 SCC 的百分比。**IDweek2022 臨牀開發中沒有新抗生素顯示IC或SCC產品艱難梭菌感染有所改善 — MitT 人羣百分比初始治癒百分比無復發% 持續臨牀治癒* 上市(Ph3 結果美國/加拿大)1 萬古黴素(n-309)86 75 61 非達索米星(n=287)88 85 73 開發中(Ph2 結果)2 萬古黴素(n=33)70 61 42 利迪尼拉唑 (n=36) 78 86 67 正在開發中 pH3 結果** 萬古黴素 (n=375) 92 83 71 利迪尼拉唑 (n= 370) 87 92 73 正在開發中(Ph2 PPP 結果)3 ibezapolstat (n=26) 96% 100% 100% 萬古黴素 (n=14) 100% 86%86%

&UHDWHGE\ QDUHHUDWMDLNDHZ IURPWKH1RXQ3URMHFW &UHDWHGE\ 7HPSODWH IURPWKH1RXQ3URMHFW 抗生素:治療 CDI 6 抗生素的全球標準 ▪ 使用 IDSA 推薦的已上市抗生素(萬古黴素、非達佐米星)進行現有的一線和首次復發治療標準 ▪ 目前上市的抗生素可實現相對較高的初始治癒率,但會給腸道留下艱難梭菌的高負擔。再加上對腸道微生物組的明顯不利影響,導致大約20%至40%的CDI患者在治療結束後復發 ▪ 對可以有效減少復發的抗生素的需求仍有大量未得到滿足 ▪ 試驗中發現的快速殺菌作用/復發發生率低——如果獲得批准抗體,則使用依貝扎洛司特進行一線治療 • 通常只能與抗生素聯合給藥 • 只有1種獲得批准 • 安全性問題輕微;成功 • 成本高,無法用作一線治療商業吸引力有限 FMT/Microbiologics ▪ 兩種療法獲準用於複發性CDI(VOWST和Rebiotix)▪ 安全性和對微生物組的影響令人擔憂;僅建議多次復發CDI但未通過適當抗生素治療的患者;標籤上的FDA方框警告 ▪ 成本高昂和無法用作一線治療的商業吸引力有限疫苗 ▪ 輝瑞疫苗在第三階段(2022年3月)失效 ▪ Sansang Ofi 疫苗在 2017 年失效 ▪ 未獲批准;公開數據均為陰性 ▪ 需要大量患者用於試驗 1 成人和兒童艱難梭菌臨牀實踐指南:IDSA 和 SHEA 2 Johnson 等人的 2017 年更新:作為艱難梭菌相關腹瀉、抗微生物藥物和化療治療試驗終點的持續臨牀反應,2012 年 8 月 &UHDWHGE\ (XFDO\ S IURPWKH1RXQ3URMHFW
項目目標病原體發現臨牀前 Ph 1 Ph 2 Ph 3 Ibezapolstat C. diffile ACX-375C 革蘭氏陽性感染 CCP 1 多種候選產品;革蘭氏陽性感染研發管道 7 1 計算化學項目目前正在與無錫藥明泰克和萊頓大學醫學中心科學合作的計算化學建模項目中 “挖掘” 另外2至4個DNA聚合酶IIIC新化學實體。
最近和即將到來的里程碑 8 臨牀主導抗體治療CDI-最近完成的 ph2b 試驗 ▪ 23 年 12 月:持續臨牀治癒數據(EOT 後 30 天)▪ 24 年 1 月:延長的臨牀治癒數據(94 天后)▪ 24 年 1 月:微生物組與萬古黴素臨牀標準的頭對頭比較,監管全球戰略 ▪ 24 年第二季度:FDA 會議 — 最終確定第 3 階段 ▪ 任務 24年下半年:啟動國際歐盟、英國、日本和 CDN 的商業化戰略 ▪ 申請 FDA 的 ACX QIDP 認證——375 ▪ 招募第一位患者參加 Ph3 試驗 ▪ 開始 IND-啟用臨牀前毒素ACX-375 Manufacturing ▪ 擴大至 10 千克批次的 API 尚待定稿 ▪ 灌裝/表面處理的 “美國製造” 政策發佈 &UHDWHGE\ DILDQURF IURPWKH1RXQ3URMHFW x &UHDWHGE\ JO\ SK IDLVDORYHUV IURPWKH1RXQ3URMHFW
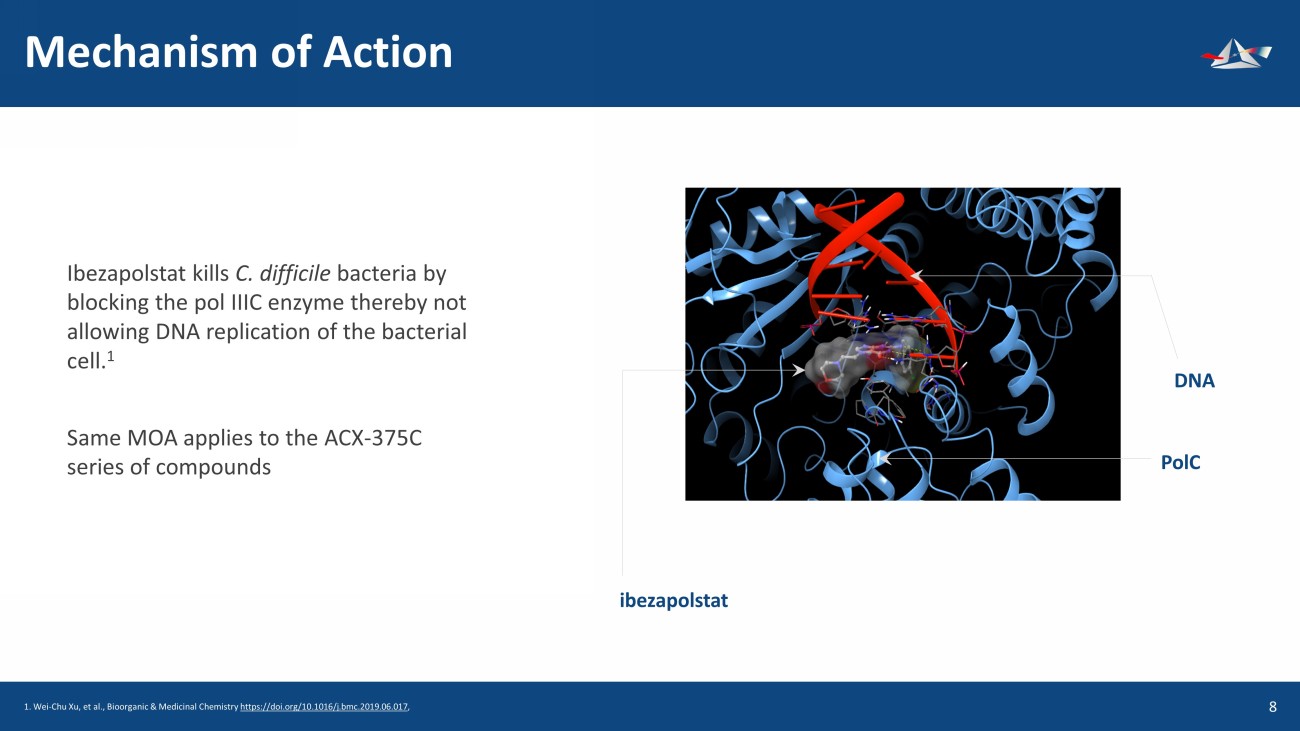
作用機制 9 Ibezapolstat 通過阻斷 pol IIIC 酶來殺死艱難梭菌細菌,從而不允許細菌細胞的 DNA 複製。1 同樣的 MOA 適用於 ACX-375C 系列化合物 ibezapolstat DNA polC 1。Wei-Chu Xu 等人,《生物有機與藥物化學》https://doi.org/10.1016/j.bmc.2019.06.017,
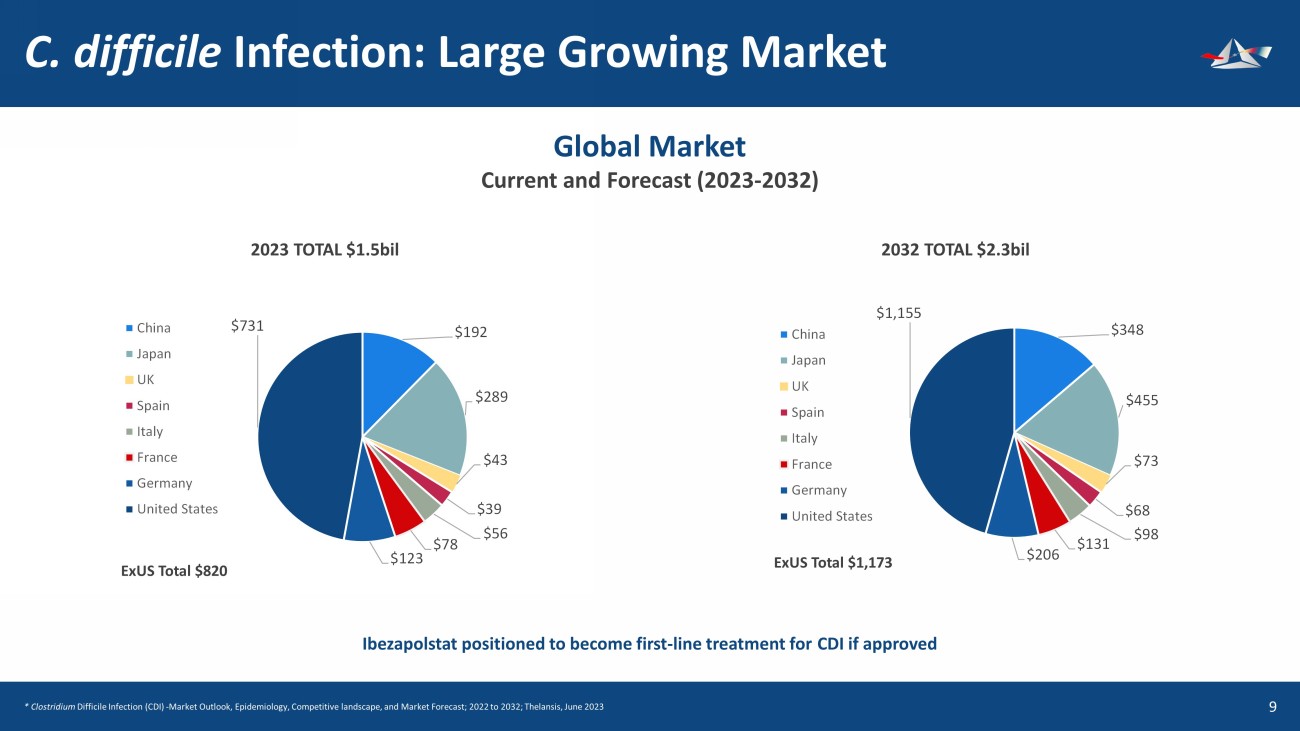
艱難梭菌感染:大型增長市場 10 192 美元 289 美元 43 美元 39 美元 56 美元 78 美元 123 731 美元中國日本英國西班牙意大利法國德國美國 348 455 美元 73 美元 98 美元 131 美元 206 美元1,155 美元中國日本英國西班牙意大利法國德國美國全球市場現狀與預測(2023-2032)2023 年總計 2.3 億美元 EXU 總計 820 美元 EXU 總計 820 美元 1,173 美元如果獲得批准,bezapolstat有望成為CDI的第一線治療藥物*艱難梭菌感染(CDI)——市場展望、流行病學、競爭格局和市場預測;2022年至2032年;Thelansis,新澤西州 2023 年 6 月

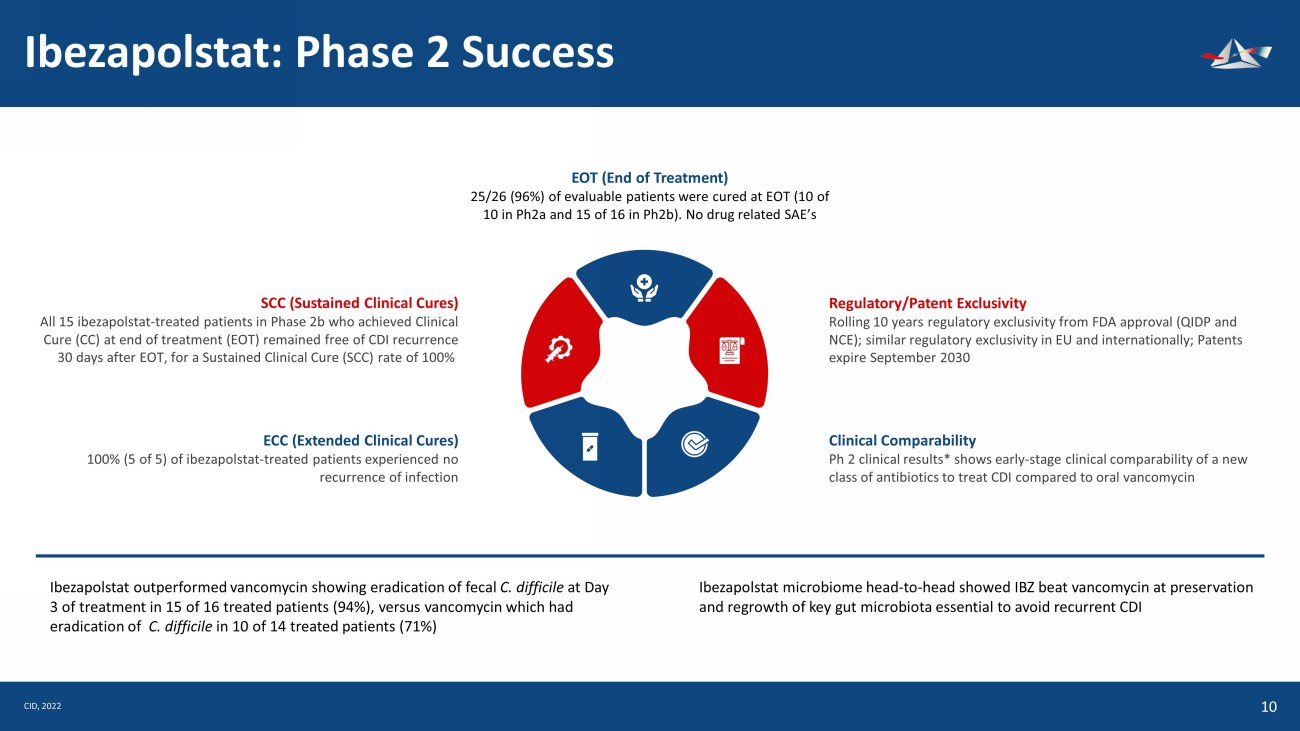
Ibezapolstat:第二階段成功11例EOT(治療結束)25/26(96%)的可評估患者在EOT中治癒(pH2a中10例中有10例,ph2b16例中有15例)。與藥物無關 SAE 的 SCC(持續臨牀療法)所有 15 名 ibezapolstat(在治療結束(EOT)時獲得臨牀治癒(CC)的 2b 期治療患者在 EOT 後 30 天均未出現CDI復發,持續臨牀治癒(SCC)率為 100% ECC(擴展臨牀治療)100%(5箇中的5個)——接受治療的患者沒有感染復發監管機構/專利排他性自美國食品藥品管理局批准之日起連續10年監管排他性(QIDP和NCE);歐盟和國際上類似的監管排他性;專利將於9月到期2030 年臨牀可比性 Ph 2 臨牀結果*顯示,與口服萬古黴素相比,用於治療 CDI 的新一類抗生素的早期臨牀可比性 Ibezapolstat 的表現優於萬古黴素,在 16 名接受治療的患者中 15 名(94%)在治療第 3 天消滅了艱難梭菌,而萬古黴素在 14 名接受治療的患者中 10 名(71%)已根除艱難梭菌(71%)Ibezapolstat microstat 生物組頭對頭顯示IBZ在保護和再生關鍵腸道菌羣方面擊敗了萬古黴素,這對於避免CDI CID的復發至關重要,2022年&UHDWHGE\DILDQURF IURPWKH1RXQ3URMHFW &UHDWHGE\ .DPLQ*LQ*LQNDHZ IURPWKH1RXQ3URMHFW &UHDWHGE\ DILDQURF IURPWKH1RXQ3URMHFW &UHDWHGE\ DILDQUF IURPWKH1RXQ3URMHFW &UHDWHGE\ DILDQUF
Ibezapolstat 保護和增強微生物組 12 Ibezapolstat 通過增強微生物組中的放線桿菌來恢復微生物組,同時抑制變形桿菌的再生;降低復發的可能性 1 PHYLUM 抗生素活性 ibezapolstat 萬古黴素(口服)放線桿菌不是 Firmicutes 選擇性的 Fusobacites No No Proteobacteria No 1 Garey,Late-Breaker 演講,Ibezapolstat 臨牀更新,第 8 屆年度 International c.diff。虛擬會議,2020 年 11 月 18 日
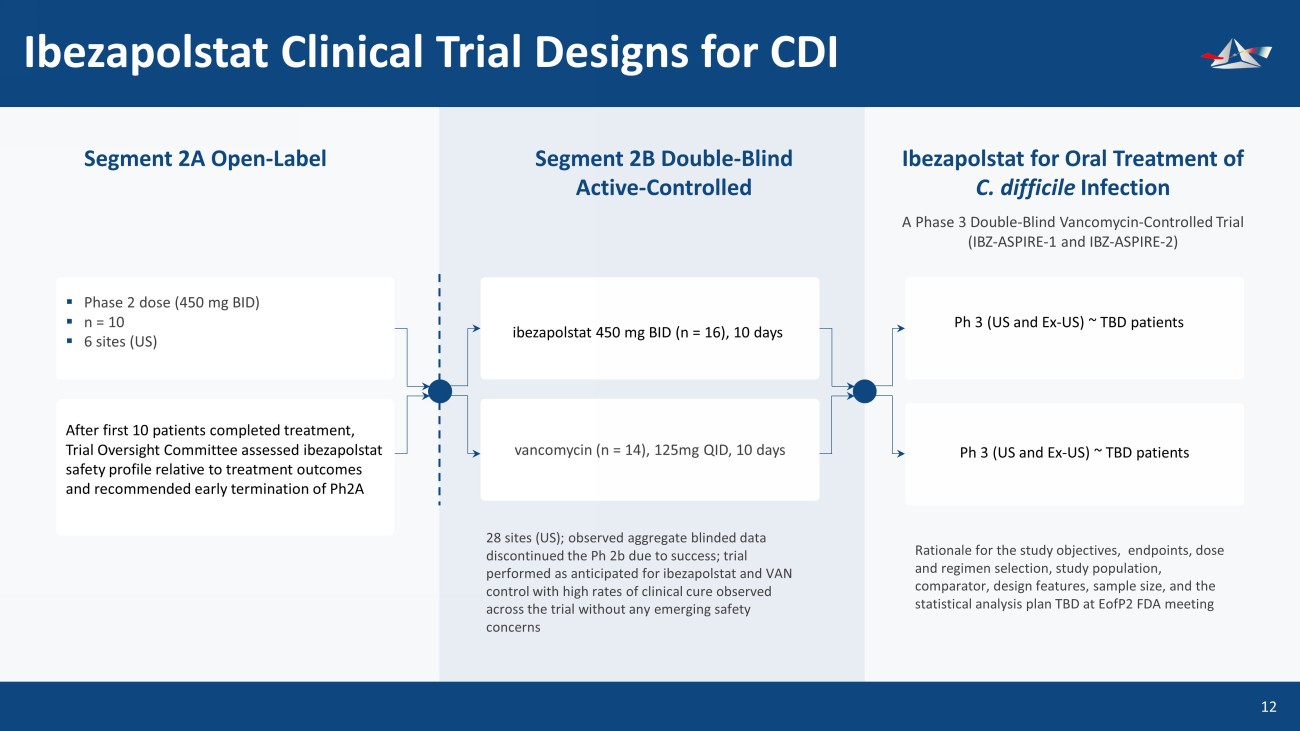
Ibezapolstat 臨牀試驗設計用於口服艱難梭菌感染 ▪ Ibezapolstat 2B 雙重——盲活性——對照試驗(IBZ-ASPIRE-1 和 IBZ-ASPIRE-2)Ibezapolstat 口服治療艱難梭菌感染 2 期劑量(450 mg BID)▪ n = 10 ▪ 6 個地點(美國)前 10 名患者完成治療後,試驗監督委員會評估了 ibezapolstat 與治療結果相關的安全概況,並建議提前終止 Ph2A ibezapolstat 450 mg BID(n = 16),為期 10 天 Ph 3(美國和前美國)~待定患者 28 個研究地點(美國);觀察到的總盲數據因成功而中止了 Ph 2b;試驗在ibezapolstat和VAN控制方面按預期進行,在整個試驗中觀察到臨牀治癒率很高,沒有任何新的安全問題研究目標、終點、劑量和方案選擇、研究人羣、比較器、設計特徵、樣本數量和統計分析計劃待定在EoFP2 FDA會議萬古黴素會議(n = 14),125mg QID,10 天 Ph 3(美國和前美國)~ 待定患者

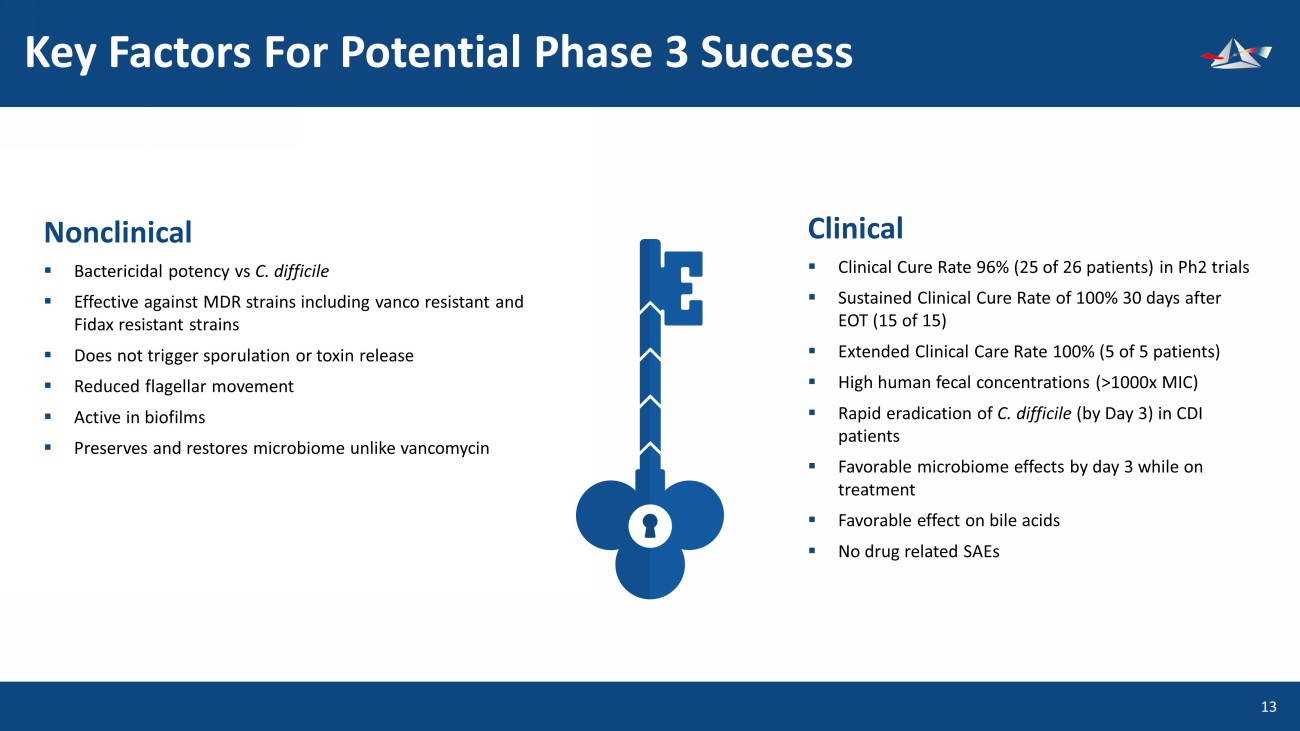
第 3 期潛在成功的關鍵因素 14 非臨牀 ▪ 殺菌效力對比艱難梭菌 ▪ 對耐藥菌株包括耐藥和耐費達克斯菌株在內的耐多藥菌株有效 ▪ 不會觸發孢子形成或毒素釋放 ▪ 減少鞭毛運動 ▪ 活性生物膜 ▪ 與萬古黴素不同於臨牀微生物組 ▪ 在 Ph2 試驗中臨牀治癒率 96%(26 名患者中的 25 名)持續臨牀治癒率 ▪ 100% 在 EOT 後 30 天(15 箇中的 15 個)▪ 延長臨牀護理率 100%(5 名患者中的 5 名)▪ 人類糞便濃度高(>1000 倍 MIC)▪ 在 CDI 患者中快速根除艱難梭菌(在第 3 天之前)▪ 在治療期間在第 3 天之前有良好的微生物組效果 ▪ 對膽汁酸有良好的效果 ▪ 無藥物相關的 SAE

ACX-375C 亮點 15 例 VRE 醫院感染人數超過耐碳青黴烯 (CR) 不動桿菌、耐藥性耐藥銅綠假單胞菌和 CR 腸桿菌科感染組合 2 第二種 DNA Pol IIIC 抑制劑 ACX-375C 口服和靜脈注射製劑靶向治療葡萄球菌、鏈球菌和腸球菌感染,包括萬古黴素-耐藥性腸球菌(VRE)、耐甲氧西林葡萄球菌(MRSA)和其他耐藥性G+細菌感染;世衞組織/疾病控制中心優先病原體清單 1 在住院患者中,金黃色葡萄球菌佔所有感染的52%,幾乎佔所有感染的52%是耐多藥革蘭氏陰性感染的兩倍 2 1.美國疾病預防控制中心抗生素耐藥性威脅,2019 年,亞特蘭大,美國衞生與公共服務部,CDC,2019 年 11 月 2.Jernigan 等人,《美國住院患者的多藥耐藥細菌感染,2012 — 2017 年,N Engl J Med 382:1309-19;(2020)1 2
ACX-375C 重點介紹了 16 種潛在臨牀適應症:(符合 QIdp/Fast Track 資格);ABSSSI(MRSA + 其他 G+)關注:社區-獲得性細菌性肺炎、醫院和/或呼吸機-相關細菌性肺炎;伴有或無傳染性心內膜炎、骨/關節感染和糖尿病足感染未滿足的醫療需求對當前使用的抗生素耐藥性;包括達託黴素和利奈唑胺-涵蓋物質成分、配方和使用方法的耐藥細菌 1,2 知識產權和法規 2 項專利於 12 月到期2039。符合QIDP、Fast Track和NCE資格(潛在的10年市場獨家經營權)。&UHDWHGE\ 1LWKQDQ7DWDK IURPWKH1RXQ3URMHFW &UHDWHGE\ DILDQURF IURPWKH1RXQ3URMHFW &UHDWHGE\ DILDQURF IURPWKH1RXQ3URMHFW &UHDWHJernigan等人,《2012年至2017年美國住院患者的多藥耐藥細菌感染》,N Engl J Med 382:1309-19;(2020)2。Wei-Chu Xu 等人,《生物有機與藥物化學》https://doi.org/10.1016/j.bmc.2019.06.017 &UHDWHGE\ 1LWKLQDQ7DWDK IURPWKH1RXQ3URMHFW

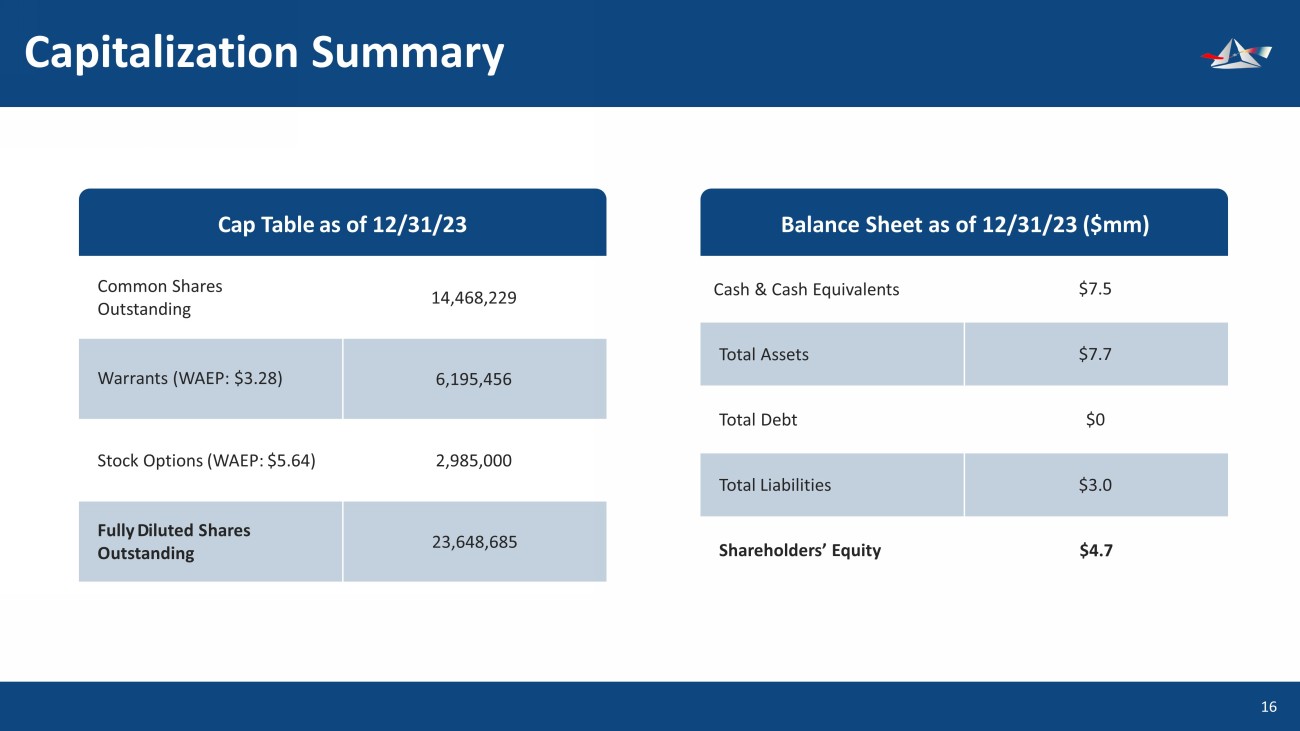
資本彙總17股普通股已發行認股權證(WAEP:3.28美元)股票期權(WAEP:5.64美元)截至23年12月31日的未償還股14,468,229 6,195,456 2,985,2,985,23,648,685美元上限表現金及現金等價物總資產負債股東權益7.5美元 7.7美元0美元4.7美元資產負債表(百萬美元)總負債3.0美元
經驗豐富的高級管理人員 18 David P. Luci,註冊會計師,Esq Co——創始人兼首席執行官羅伯特·J.DeLuccia Co——創始人兼執行董事長羅伯特·沙瓦註冊會計師——創始人兼首席財務官Dipexium Pharmicals(納斯達克股票代碼:DPRX)、Abeona Therapeutics(納斯達克股票代碼:ABEO)、MacroChem(場外交易股票代碼:MACM)和Bioenvision(納斯達克股票代碼:BIVN)的前首席執行官。在早期階段出售了他共同創立或加入的所有三家上市公司。在處置之前,精心策劃了幾筆進出許可交易。併購和企業融資律師(紐約州保羅·黑斯廷斯)兼紐約安永會計師事務所註冊會計師)Dipexium Pharmicals(納斯達克股票代碼:DPRX)前董事長;賽諾菲美國前總裁兼輝瑞高級高管;免疫醫學(納斯達克股票代碼:IMMU)和宏化學公司(場外交易所股票代碼:MACM)前首席執行官;IBEX 製藥公司(IBT-TSX)董事會首席董事 Dipexium Pharmicals(納斯達克股票代碼:DPRX)首席會計官;商業房地產公司鮑德温皮爾遜公司的前副總裁

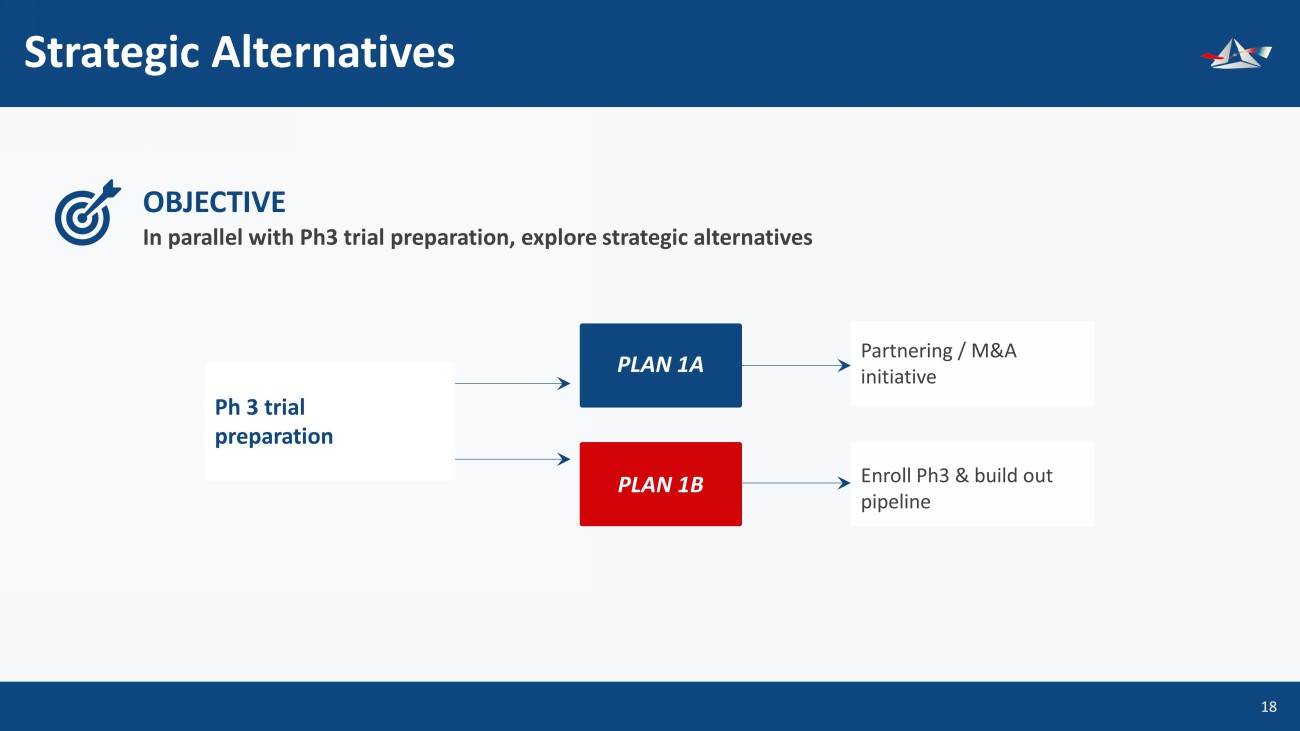
戰略備選方案 19 在準備 Ph3 試驗的同時,探索戰略備選方案 OBJECTIVE &UHDWHGE\ $OLFH'HVLJQ IURPWKH1RXQ3URMHFW Ph 3 試驗準備計劃 1A 計劃 1A 計劃 1B 合作/併購計劃註冊 Ph3 並建立管道
擬議的商業化途徑 20 當前數據庫國際 Ph3 試驗監管批准美國食品藥品監督管理局加拿大衞生部歐洲藥品管理局英國藥品和保健產品管理局日本:藥品和醫療器械管理局 + =

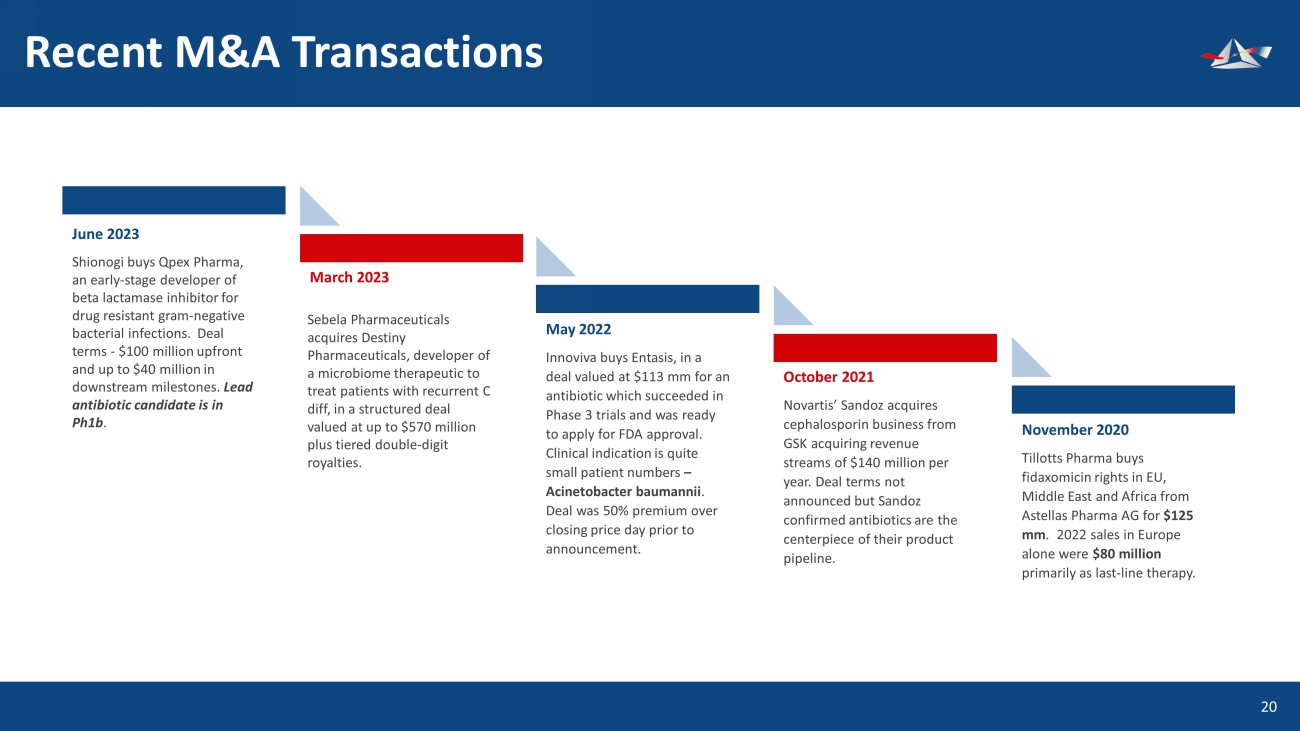
最近的併購交易 2023年6月21日鹽野義收購了Qpex Pharma,該公司是治療耐藥革蘭陰性細菌感染的β內酰胺酶抑制劑的早期開發商。交易條款-預付1億美元,下游里程碑高達4000萬美元。主要候選抗生素處於pH1b中。2023 年 3 月 2022 年 5 月 2 Innoviva以價值1.13億美元的交易收購了Entasis,購買了一種抗生素,該抗生素在三期試驗中取得了成功,並準備申請美國食品藥品管理局的批准。臨牀適應症是患者數量很少——鮑曼不動桿菌。交易價格比宣佈前一天的收盤價高出50%。2021 年 10 月諾華的山德士從葛蘭素史克收購頭孢菌素業務,每年收購1.4億美元的收入來源。交易條款尚未公佈,但山德士證實抗生素是其產品線的核心。2020年11月,Tillotts Pharma以1.25億美元的價格從安斯泰來製藥股份公司手中收購了非達索米星在歐盟、中東和非洲的版權。僅2022年在歐洲的銷售額就達到8000萬美元,主要是最後的線療法。Sebela Pharmicals以高達5.7億美元的結構性交易收購了Destiny Pharmicals,該公司開發了一種用於治療複發性C差異患者的微生物組療法,外加兩位數的分級特許權使用費。

董事會非執行成員 22 ▪ 傑克·迪恩博士,賽諾菲全球臨牀前研究前主任;亞利桑那大學(藥理學和毒理學)研究教授 ▪ 查爾斯·裏弗協會(納斯達克股票代碼:CRAI)副總裁詹姆斯·多諾休 ▪ 奧密克龍集團多元化代理服務(“DAS”)部門名譽主席託馬斯·哈里森紐約證券交易所代碼:OMC)。Omicron Group Inc. ▪ 曾任董事長兼首席執行官,賽尼奧斯健康(納斯達克股票代碼:SynH)全球客户主管副總裁。曾任Emisphere Technologies銷售和營銷副總裁 ▪ Joseph C. Scodari,Optinose(納斯達克股票代碼:OPTN)董事會主席。曾任強生製藥集團全球主席,執行委員會成員*共同撰寫了《成人和兒童艱難梭菌感染臨牀實踐指南:美國感染病協會(IDSA)和美國醫療保健流行病學會(SHEA)的2017年更新》。2018 年 4 月
將新一類抗生素推進針對 “優先病原體” 的三期試驗 David P. Luci,總裁兼首席執行官 2024 年 4 月 — 世衞組織和疾病控制中心