目錄
|
財務和其他信息的列報
|
三、
|
|
關於前瞻性陳述的警告性聲明
|
三、
|
|
法律程序文件的送達及法律責任的強制執行
|
VI
|
|
第一部分
|
1
|
|
|
第1項。
|
董事、高級管理人員和顧問的身份
|
1
|
|
A.
|
董事和高級管理人員
|
1
|
|
B.
|
顧問
|
1
|
|
C.
|
審計師
|
1
|
|
第二項。
|
報價統計數據和預期時間表
|
1
|
|
A.
|
優惠統計數據
|
1
|
|
B.
|
方法和預期時間表
|
1
|
|
第三項。
|
關鍵信息
|
1
|
|
A.
|
[已保留]
|
1
|
|
B.
|
資本化和負債化
|
1
|
|
C.
|
提供和使用收益的原因
|
1
|
|
D.
|
風險因素
|
1
|
|
第四項。
|
關於該公司的信息
|
85
|
|
項目4A。
|
未解決的員工意見
|
127
|
|
第五項。
|
經營和財務回顧與展望
|
127
|
|
A.
|
經營業績
|
128
|
|
B.
|
流動性與資本資源
|
135 |
|
C.
|
研發、專利和許可證等。
|
138
|
|
D.
|
趨勢信息
|
138
|
|
E.
|
關鍵會計估計
|
138
|
|
第六項。
|
董事、高級管理人員和員工
|
138
|
|
A.
|
董事和高級管理人員
|
138
|
|
B.
|
補償
|
140
|
|
C.
|
董事會慣例
|
142
|
|
D.
|
員工
|
144
|
|
E.
|
股份所有權
|
145
|
| F. |
披露登記人追討錯誤判給的補償的行動
|
145 |
|
第7項。
|
大股東及關聯方交易
|
145
|
|
A.
|
大股東
|
145
|
|
B.
|
關聯方交易
|
147
|
|
C.
|
專家和律師的利益
|
148
|
|
第八項。
|
財務信息
|
148
|
|
A.
|
合併報表和其他財務信息
|
148
|
|
B.
|
重大變化
|
148
|
|
第九項。
|
報價和掛牌
|
148
|
|
A.
|
優惠和上市詳情
|
148
|
|
B.
|
配送計劃
|
149
|
|
C.
|
市場
|
149
|
|
D.
|
出售股東
|
149
|
|
E.
|
稀釋
|
149
|
|
F.
|
發行債券的開支
|
149
|
|
第10項。
|
附加信息
|
149
|
|
A.
|
股本
|
149
|
|
B.
|
組織章程大綱及章程細則
|
149
|
|
C.
|
材料合同
|
149
|
|
D.
|
外匯管制
|
149
|
|
E.
|
税收
|
150
|
|
F.
|
股息和支付代理人
|
157
|
|
G.
|
專家發言
|
157
|
|
H.
|
展出的文件
|
157
|
|
I.
|
子公司信息
|
158
|
| J. |
給證券持有人的年度報告
|
158 |
i
|
第11項。
|
關於市場風險的定量和定性披露
|
158
|
|
第12項。
|
除股權證券外的其他證券説明
|
159
|
|
A.
|
債務證券
|
159
|
|
B.
|
認股權證和權利
|
159
|
|
C.
|
其他證券
|
159
|
|
D.
|
美國存托股份
|
159
|
|
第II部
|
|
159 |
|
第13項。
|
違約、拖欠股息和拖欠股息
|
159
|
|
第14項。
|
對擔保持有人的權利和收益的使用作出實質性修改
|
159
|
|
第15項。
|
控制和程序
|
159
|
|
A.
|
披露控制和程序
|
159
|
|
B.
|
管理層財務報告內部控制年度報告
|
160
|
|
C.
|
註冊會計師事務所認證報告
|
161
|
|
D.
|
財務報告內部控制的變化
|
161
|
|
第16項。
|
[已保留]
|
161
|
|
A.
|
審計委員會財務專家
|
161
|
|
B.
|
道德守則 |
161
|
|
C.
|
首席會計師費用及服務
|
161
|
|
D.
|
對審計委員會的上市標準的豁免
|
162
|
|
E.
|
發行人及關聯購買人購買股權證券
|
162
|
| F. |
更改註冊人的認證會計師
|
162 |
|
G.
|
公司治理
|
162
|
|
H.
|
煤礦安全信息披露
|
163
|
|
I.
|
關於妨礙檢查的外國司法管轄區的披露
|
163
|
|
J.
|
內幕交易政策
|
163
|
|
K.
|
網絡安全
|
163
|
|
第三部分
|
|
164
|
|
第17項。
|
財務報表
|
164
|
|
第18項。
|
財務報表
|
164
|
|
項目19.
|
展品
|
164
|
|
簽名
|
166
|
|
財務報表索引
|
F-1
|
II
目錄表
財務和其他資料的列報
除另有説明或文意另有所指外,本年度報告中提及的術語“本公司”、“本公司”、“本公司”及“本公司”均指(I)本公司重組(如本文所界定)完成前的GH Research愛爾蘭有限公司及(Ii)本公司重組完成後的GH Research PLC(及,如文意所需,指其附屬公司)。有關我們公司重組的信息,
見“項目4.公司信息--A.公司的歷史和發展”。
財務報表
我們的財務信息是以美元表示的。我們根據國際會計準則理事會(IASB)發佈的國際財務報告準則(IFRS)編制我們的綜合財務報表。術語“美元”、“美元”或“美元”指的是美元,所有提到的“歐元”都是指歐元。
在首次公開招股和相關的公司重組之前,我們通過GH Research愛爾蘭有限公司開展業務,因此某些歷史財務報表
呈現了GH Research愛爾蘭有限公司的運營結果。我們的子公司GH Research愛爾蘭有限公司歷來並將繼續保持歐元賬簿和記錄,因此,在我們首次公開募股和相關的公司重組之前的任何時期的某些歷史財務報表都提供了已兑換成美元的財務信息。對於我們首次公開募股和相關公司重組之後的任何時期,我們的財務報表都是以綜合基礎編制的,並呈現GH Research PLC和我們的子公司GH Research愛爾蘭有限公司的綜合運營結果。
市場和行業數據
本年度報告包含行業、市場和競爭地位數據,這些數據基於第三方進行的一般和行業出版物、調查和研究(其中一些可能未公開),以及我們自己的內部估計和研究。第三方出版物、調查和研究一般聲明,它們已從據信可靠的來源獲得信息,但不保證此類信息的準確性和完整性。這些數據涉及一些假設和限制,幷包含對我們經營的行業未來業績的預測和估計,這些行業受到高度不確定性的影響。我們
提醒您不要過度重視此類預測、假設或估計。
舍入
我們已對本年報所載的部分數字作出四捨五入的調整。因此,在某些表格中顯示為合計的數字可能不是其前面的數字的算術聚合。
關於前瞻性陳述的警告性聲明
本年度報告包含符合1934年《證券交易法》(修訂後)第21E節或《交易法》、《1933年證券法》(修訂後)第27A節或《證券法》含義的前瞻性表述。除本年度報告中包含的歷史事實陳述外,本年度報告中包含的所有陳述,包括關於我們未來運營結果和財務狀況、業務戰略、候選產品、交付這些候選產品所需的醫療設備、研究流水線、正在進行和計劃中的非臨牀研究和臨牀試驗、監管提交和批准及其對我們業務戰略的影響的陳述,包括我們與美國食品和藥物管理局或FDA討論的計劃和預期,以及與臨牀擱置GH001試驗性新藥申請或IND、研發成本相關的討論的結果和解決方案,現金跑道、成功的時機和可能性,以及未來業務的管理計劃和目標都是前瞻性表述。本年度報告中包含的許多前瞻性表述可以通過使用“預期”、“相信”、“可能”、“預期”、“應該”、“計劃”、“打算”、“估計”、“將”和“潛在”等前瞻性詞彙來識別。
三、
目錄表
前瞻性陳述出現在本年度報告的多個地方,包括但不限於關於我們的意圖、信念或當前預期的陳述。前瞻性
陳述基於我們管理層的信念和假設以及我們管理層目前掌握的信息。此類陳述會受到風險和不確定性的影響,由於各種因素的影響,實際結果可能與前瞻性陳述中所表達或暗示的結果大不相同,這些因素包括但不限於“第3項.關鍵信息--風險因素”中確定的那些因素。除其他因素外,這些風險和不確定因素包括:
|
•
|
我們研發計劃、非臨牀研究和臨牀試驗的開始、時間、進展和結果;
|
|
•
|
為我們的GH001、GH002和GH003候選產品以及交付這些候選產品所需的醫療設備(例如我們針對GH001的專有氣霧劑輸送設備)開發和進行臨牀試驗的時間、進度和結果,用於我們的初始和任何附加適應症;
|
|
•
|
我們努力擴展到其他司法管轄區,如美國和歐盟;
|
|
•
|
我們的期望與我們的GH001、GH002和GH003候選產品的外部製造能力的技術開發和擴展以及交付這些候選產品所需的醫療設備有關,例如我們針對GH001的專有氣霧劑輸送設備;
|
|
•
|
我們對我們的GH001、GH002和GH003候選產品成功的依賴;
|
|
•
|
FDA、歐洲藥品管理局或EMA或其他類似的外國監管機構對我們的GH001、GH002和GH003候選產品以及我們的初始和任何附加適應症進行監管申請和批准的時間、範圍或可能性;
|
|
•
|
我們的期望與FDA對我們在IND中為GH001提出的研究施加的臨牀擱置有關,包括我們對任何非臨牀項目的進展計劃和預期以及解除臨牀擱置的任何其他工作、解除此類臨牀擱置所需的時間以及與FDA的討論以及此類討論的結果和解決方案;
|
|
•
|
我們對我們的GH001、GH002和GH003候選產品的合格患者羣體大小的期望,如果被批准用於商業用途;
|
|
•
|
我們確定第三方臨牀試驗地點進行試驗的能力,以及我們確定和培訓適當合格的治療師管理我們的研究治療的能力;
|
|
•
|
流行病,如新冠肺炎大流行、流行病、傳染病爆發或類似事件對我們業務或運營的影響,包括監管審批流程的延誤
、與臨牀試驗地點簽訂合同以及從事臨牀試驗;
|
|
•
|
我們有能力實施我們的業務模式和戰略計劃,以及GH001、GH002和GH003候選產品;
|
|
•
|
我們有能力識別、開發或獲得FDA、EMA或其他類似的外國監管機構對交付我們的GH001、GH002和GH003產品所需的醫療器械的批准
,例如我們針對GH001的專有氣霧劑輸送裝置;
|
|
•
|
我們的商業化和營銷能力和戰略;
|
|
•
|
不良的臨牀試驗結果和潛在的公眾對使用美布福寧(5-甲氧基-N,N-二甲基色胺或5-甲氧基色胺)和迷幻劑的不良認知對我們產品的監管審批過程和未來發展的影響;
|
|
•
|
如果獲得批准,我們的GH001、GH002和GH003候選產品的定價、覆蓋範圍和報銷;
|
|
•
|
我們製造方法和工藝的可擴展性和商業可行性;
|
|
•
|
我們的GH001、GH002和GH003候選產品的市場接受度和臨牀實用性的速度和程度;
|
四.
目錄表
|
•
|
我們依賴第三方供應商進行我們的非臨牀研究、臨牀試驗藥物和候選產品供應,以及我們製造過程中使用的關鍵原材料;
|
|
•
|
我們建立或維持合作或戰略關係或獲得額外資金的能力;
|
|
•
|
我們對我們的GH001、GH002和GH003候選產品的潛在好處的期望以及我們的總體方法;
|
|
•
|
我們對監管發展路徑和《受控物質法》或CSA分類的期望;
|
|
•
|
我們和任何當前或未來的許可方或協作合作伙伴能夠為我們的GH001、GH002和GH003候選產品建立和維護的知識產權保護範圍
;
|
|
•
|
我們有能力在不侵犯、挪用或以其他方式侵犯第三方的知識產權和專有技術的情況下運營我們的業務;
|
|
•
|
我們保護知識產權的能力,包括執行和捍衞與知識產權有關的索賠;
|
|
•
|
根據歐盟和其他司法管轄區的法律和法規,美國的監管動態;
|
|
•
|
持續的通貨膨脹、利率和外匯匯率、全球供應鏈和勞動力市場的中斷、銀行業的波動和壓力以及政府和金融服務公司採取的應對措施,以及地緣政治風險和全球敵對行動,包括俄羅斯入侵烏克蘭、以色列和哈馬斯之間持續的軍事衝突以及由此導致的地區衝突造成的任何直接或間接經濟影響,或中國與臺灣之間緊張局勢的加劇;
|
|
•
|
與我們的競爭對手和行業相關的發展和預測;
|
|
•
|
我們在財務報告內部控制方面彌補重大弱點的能力;
|
|
•
|
我們現有的現金、現金等價物、其他金融資產和有價證券足以為我們的運營和資本支出提供資金的時間;
|
|
•
|
我們對費用、資本需求和額外融資需求的估計;
|
|
•
|
我們有效管理預期增長的能力;
|
|
•
|
我們吸引和留住合格員工和關鍵人員的能力;
|
|
•
|
本期和未來是否被歸類為被動型外商投資公司;
|
|
•
|
我們對我們將成為2012年Jumpstart Our Business Startups Act或JOBS Act下的新興成長型公司以及作為外國私人發行人的期望;
|
|
•
|
普通股的未來交易價格以及證券分析師的報告對該價格的影響;
|
|
•
|
其他風險和不確定因素,包括“項目3.關鍵信息--D.風險因素”中所列的風險和不確定性。
|
v
目錄表
這些前瞻性陳述僅代表截至本年度報告發布之日的情況,可能會受到本年度報告
題為“第3項.關鍵信息-D.風險因素”和“第5項.經營和財務回顧及展望”章節以及本年度報告其他部分所述的一系列風險、不確定性和假設的影響。由於前瞻性陳述固有地受到風險和不確定性的影響,其中一些風險和不確定性是無法預測或量化的,有些是我們無法控制的,因此您不應依賴這些前瞻性陳述作為對未來事件的預測。我們的前瞻性表述中反映的事件和情況可能無法實現或發生,實際結果可能與前瞻性表述中預測的結果大不相同。此外,我們在一個不斷髮展的環境中運營。新的風險因素和不確定因素可能會不時出現,管理層不可能預測所有的風險因素和不確定因素。除非適用法律另有要求,我們不打算公開更新或修改本文中包含的任何前瞻性陳述,無論是由於任何新信息、
未來事件、情況變化或其他原因。
此外,“我們相信”的聲明和類似的聲明反映了我們對相關主題的信念和意見。這些陳述基於截至本年度報告日期
向我們提供的信息,雖然我們認為這些信息構成了此類陳述的合理基礎,但此類信息可能是有限或不完整的,我們的陳述不應被解讀為表明我們已對所有可能獲得的相關信息進行了詳盡的查詢或審查。這些陳述本質上是不確定的,告誡投資者不要過度依賴這些陳述。
法律程序文件的送達及法律責任的強制執行
我們是根據愛爾蘭法律組織的,註冊地址在愛爾蘭都柏林。此外,我們的所有董事會成員、所有官員以及本文中提到的某些專家都居住在美國以外。因此,投資者可能很難在美國境內向我們或居住在美國以外的其他人送達法律程序文件,或在美國以外的任何訴訟(包括基於美國聯邦證券法的民事責任條款的訴訟)中執行在美國法院獲得的針對這些人的判決。此外,在美國以外司法管轄區的法院提起的原始訴訟中,投資者可能很難執行基於美國聯邦證券法的權利。
VI
目錄表
第一部分
|
第1項。
|
董事、高級管理人員和顧問的身份
|
|
A.
|
董事和高級管理人員
|
不適用。
|
B.
|
顧問
|
不適用。
|
C.
|
審計師
|
不適用。
|
第二項。
|
報價統計數據和預期時間表
|
|
A.
|
優惠統計數據
|
不適用。
|
B.
|
方法和預期時間表
|
不適用。
|
第三項。
|
關鍵信息
|
|
A.
|
[已保留]
|
|
B.
|
資本化和負債化
|
不適用。
|
C.
|
提供和使用收益的原因
|
不適用。
|
D.
|
風險因素
|
我們的業務面臨着許多風險。在決定投資或維持對我們證券的投資之前,您應仔細考慮本年度報告以及我們向美國證券交易委員會(美國證券交易委員會)提交或提供的其他文件中陳述的所有信息,包括以下風險因素。我們的業務以及我們的聲譽、財務狀況、經營結果和股價都可能受到任何這些風險以及我們目前不知道或目前不被認為是重大風險和不確定性的重大不利影響。
風險因素摘要
我們實施業務戰略的能力受到許多風險的影響,本節將對此進行更全面的描述。這些風險包括:
|
•
|
我們是一家臨牀階段的生物製藥公司,自成立以來已經發生了重大虧損。我們預計,在可預見的未來,我們將繼續蒙受重大損失;
|
|
•
|
我們將需要大量的額外資金,這些資金可能無法以可接受的條件提供,或者根本不能提供。如果我們無法在需要時籌集資金,我們可能會被迫推遲、減少或取消我們的產品發現和開發計劃或商業化努力;
|
1
目錄表
|
•
|
解決FDA對我們在IND中提出的針對GH001的研究的臨牀擱置可能需要相當長的時間和費用,並且不能保證FDA將移除
臨牀擱置,這可能對我們的臨牀開發工作產生實質性的不利影響,或者可能損害我們的業務、財務狀況、運營結果和前景;
|
|
•
|
藥物和藥物-器械組合產品開發是一項高度不確定的工作,涉及很大程度的風險;
|
|
•
|
GH001、GH002和GH003是基於新技術的研究中的美布汀(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)療法,這使得很難預測開發和隨後獲得監管批准的時間和成本。據我們所知,這種療法還沒有在美國或歐盟被批准商業化;
|
|
•
|
為GH001開發我們專有的氣霧劑輸送設備是一個成本高昂且不確定的過程,該設備的開發或製造的任何失敗或延遲都可能對我們的業務和運營結果產生重大不利影響。
|
|
•
|
臨牀開發涉及一個漫長、複雜和昂貴的過程,結果不確定。非臨牀試驗和早期臨牀試驗的結果可能不能預測後來的臨牀試驗的成功,我們目前完成的臨牀試驗(迄今僅在荷蘭進行)以及我們正在進行的和未來的臨牀試驗的結果可能不符合FDA、EMA或其他類似的外國監管機構的要求;
|
|
•
|
我們的候選產品或通過參與我們的臨牀試驗使用我們的候選產品,可能會導致不良副作用或具有其他特性,可能會推遲或阻止其監管批准,限制其商業潛力或導致重大負面後果;
|
|
•
|
GH001、GH002和GH003,以及我們可能開發的任何未來候選產品,均受產品將在市場上銷售的地區(如美國、歐盟、英國或英國)以及歐洲其他地區的受控物質法律法規以及聯合國國際藥物管制條約的約束,如果不遵守這些法律和法規,或遵守這些法律和法規的成本,可能會
對我們在臨牀開發和批准後的業務運營結果以及我們的財務狀況產生不利影響。此外,在GH001、GH002和GH003的審查過程中,在批准之前,FDA、EMA和/或其他類似的外國監管機構可能需要額外的數據,包括關於GH001、GH002或GH003是否具有濫用或誤用可能性的數據。這可能會推遲審批和任何可能的重新安排進程;
|
|
•
|
美布福寧目前在美國被歸類為I類藥物,任何含有這種物質的產品,如GH001、GH002和GH003,都必須重新安排時間才能上市。不能保證藥品監督管理局(DEA)會做出有利的時間安排決定。即使假定在聯邦一級被歸類為附表二或較低的受控物質(即,附表三、四或五),根據州法律和條例,這類物質也需要對附表作出決定;
|
|
•
|
美布替寧在美國的潛在重新分類可能會給我們的業務帶來額外的監管負擔,並對我們的業務結果產生負面影響;
|
|
•
|
我們的商業成功取決於我們的候選產品如果獲得批准,在醫生、患者、第三方付款人和醫學界其他成員中獲得顯著的市場接受度;
|
|
•
|
我們目前沒有營銷和銷售組織,作為一家公司也沒有將產品商業化的經驗,我們可能不得不投入大量資源來開發這些能力。如果我們
無法建立營銷和銷售能力,或無法與第三方簽訂協議來營銷和銷售我們的候選產品,如果獲得批准,我們可能無法產生產品收入;
|
|
•
|
我們的業務和商業化戰略取決於我們識別、鑑定、準備、認證和支持提供我們任何候選產品的第三方診所或治療中心的能力,
參閲會議過程如果我們無法做到這一點,我們的商業化前景將受到限制,我們的業務,財務狀況和經營業績將受到損害;
|
2
目錄表
|
•
|
我們依靠專利、專利申請和其他知識產權來保護我們的GH 001、GH 002和GH 003候選產品,其起訴、執行、辯護和維護可能
具有挑戰性且成本高昂。未能充分起訴、維護、執行或保護這些權利可能會損害我們的競爭能力並損害我們的業務;
|
|
•
|
我們依賴第三方協助開展非臨牀研究和臨牀試驗。如果他們的表現不令人滿意,我們可能無法啟動新的臨牀試驗,成功完成
臨牀試驗,獲得監管部門的批准或將我們的候選產品商業化,或者此類批准或商業化可能會延遲,我們的業務可能會受到實質性損害;
|
|
•
|
我們的活性藥物成分、候選產品和提供此類候選產品所需的醫療器械的開發和生產非常複雜,我們可能會遇到困難
在進一步開發或生產過程中。我們目前完全依賴第三方來開發、配製和生產我們的非臨牀研究和臨牀試驗用品。我們任何活躍的
如果這些第三方未能向我們提供足夠數量的藥物成分、候選產品和交付此類候選產品所需的醫療器械,則可能會停止、延遲或降低利潤。
藥品供應或未能以可接受的質量水平供應,包括根據嚴格執行的監管要求或合同義務,我們的運營可能因此受到損害;
|
|
•
|
我們嚴重依賴我們的執行官、首席顧問和其他人,失去他們的服務將對我們的業務造成重大損害;
|
|
•
|
就編制及審閲截至2021年、2022年及2023年12月31日止年度的財務報表而言,我們已識別財務報告內部監控的重大弱點。 及二零二三年,我們可能會發現其他重大弱點。如果我們對這些重大缺陷的補救措施無效,或者如果我們遇到其他重大缺陷,或者無法維持有效的內部
未來的控制,我們準確或及時報告我們的財務狀況或經營業績的能力可能受到不利影響;
|
|
•
|
我們認為,我們在2023納税年度是一家被動的外國投資公司,或PFIC,我們預計我們可能在2024年成為PFIC,並可能在未來幾年成為PFIC,這可能
使持有我們普通股的美國投資者承擔重大不利的美國聯邦所得税後果。
|
與我們的財務狀況和額外資本需求相關的風險
我們是一家臨牀階段的生物製藥公司,自成立以來,我們已經遭受了重大損失。我們預計,我們將繼續招致
在可預見的未來會出現重大損失。
生物製藥產品開發的投資具有高度投機性,因為它需要大量的前期資本支出和任何潛在候選產品將
未能證明足夠的效果或可接受的安全性特徵,獲得監管批准或商業上可行。我們沒有批准用於商業銷售的產品,迄今為止也沒有產生任何收入,我們將繼續
與我們的臨牀開發和持續運營相關的重大研發和其他費用。因此,我們沒有盈利,自成立以來每個時期都出現虧損。自成立以來,我們致力於
我們幾乎所有的財務資源和努力,研究和開發,包括非臨牀研究,技術開發和我們的臨牀試驗。我們的財務狀況和經營業績(包括淨虧損)可能會出現波動
從季度到季度,從年度到年度。因此,您不應依賴任何季度或年度的結果作為未來經營業績的指標。此外,淨虧損和負現金流已經導致,
並將繼續對我們的股東權益和營運資金產生不利影響。截至2023年及2022年12月31日止年度,我們的淨虧損分別為35. 6百萬元及22. 5百萬元。截至2023年12月31日,我們有累計赤字
6790萬元。在可預見的未來,我們預計將繼續遭受重大損失,並且隨着我們繼續研究和開發我們
中的候選產品並尋求監管部門的批准,我們預計這些損失還會增加。 初始和任何其他適應症以及其他候選產品。
3
目錄表
我們預計我們的費用將大幅增加,如果我們:
|
•
|
繼續為我們的GH 001、GH 002和GH 003候選產品開發和開展臨牀試驗,包括在美國等擴大的地理區域,用於我們的初始適應症和任何其他適應症
適應症;
|
|
•
|
繼續進行技術開發,擴大我們目前候選產品GH 001、GH 002和GH 003的外部製造能力,以及提供這些產品所需的醫療器械。
候選產品,例如我們專有的GH 001氣霧劑輸送裝置;
|
|
•
|
啟動並繼續研究和開發,包括任何未來候選產品的技術、非臨牀、臨牀和發現工作;
|
|
•
|
尋求確定其他候選產品;
|
|
•
|
為我們的候選產品GH 001、GH 002和GH 003尋求監管部門的批准,包括提供這些候選產品所需的醫療器械,例如我們的專有氣霧劑輸送設備,用於
GH 001或成功完成臨牀開發的任何其他候選產品;
|
|
•
|
推進任何非臨牀項目和任何其他工作,以解除FDA對我們在IND中為GH 001提出的研究實施的臨牀暫停;
|
|
•
|
增加運營、財務和管理信息系統和人員,包括支持我們的候選產品和器械開發並幫助我們履行公眾義務的人員
公司;
|
|
•
|
聘用和保留更多的人員,如臨牀、質量控制、科學、商業、銷售、市場營銷和行政人員;
|
|
•
|
繼續準備、提交、起訴、維護、保護和執行我們的知識產權和索賠;
|
|
•
|
未來建立銷售、營銷、分銷、製造、供應鏈等商業基礎設施,將我們可能獲得監管批准的各種產品商業化;
|
|
•
|
遵守已批准用於商業銷售的產品的現行法規要求;
|
|
•
|
適應全球經濟狀況的持續變化,包括但不限於持續的通貨膨脹、全球供應鏈和勞動力市場的中斷以及地緣政治風險和全球敵對行動,包括俄羅斯入侵烏克蘭、以色列和哈馬斯之間持續的軍事衝突以及由此導致的地區衝突造成的任何直接或間接經濟影響,或中國與臺灣之間緊張局勢的加劇;
|
|
•
|
收購或授權其他候選產品、醫療器械以交付我們的候選產品,以及其他技術;以及
|
|
•
|
由於作為一家上市公司運營而導致成本增加。
|
如果FDA或其他類似的外國監管機構要求我們在目前預期之外進行臨牀試驗,或者在為我們的候選產品或交付我們的候選產品所需的醫療設備建立適當的製造安排方面出現任何延誤,或者如果我們的臨牀試驗或任何候選產品或交付候選產品所需的醫療器械的開發出現任何延誤,我們的費用可能會超出我們的預期。
4
目錄表
我們將需要大量的額外資金,這些資金可能無法以可接受的條件提供,或者根本不能提供。如果我們無法在需要時籌集資金,我們可能會被迫推遲、減少或取消我們的產品發現和開發計劃或商業化努力。
我們預計將繼續花費大量資金來繼續我們當前和未來項目的技術、非臨牀和臨牀開發。如果我們能夠為我們開發的候選產品獲得市場批准,包括我們正在開發或可能開發我們的GH001、GH002和GH003候選產品的任何指示,我們可能需要額外的現金來推出和商業化這些候選產品和交付這些候選產品所需的醫療設備,前提是此類發佈和商業化不是我們未來可能與之簽訂合同的未來合作伙伴的責任。此外,在我們的開發過程中可能會產生其他
意外成本。由於我們計劃和預期的臨牀試驗的設計和結果非常不確定,我們無法合理估計成功完成我們開發的任何候選產品的開發和商業化所需的實際金額,並且不斷變化的情況,其中一些可能是我們無法控制的,例如不斷上升的通貨膨脹和利率,可能會導致我們消耗資本的速度大大快於我們目前的預期,我們可能需要比計劃更早地尋求額外資金。
我們未來的資本需求取決於許多因素,包括:
|
•
|
研究和開發我們的GH001、GH002和GH003候選產品、額外的美布替寧(5-甲氧基-N,N-二甲基色胺或5-MeO-DMT)給藥方法的範圍、進度、結果和成本,以及提供這些療法所需的醫療設備,例如我們為GH001提供的專有氣霧劑給藥裝置,用於我們的初始和任何附加適應症以及我們可能開發的其他產品候選;
|
|
•
|
為我們的GH001、GH002和GH003候選產品獲得市場批准的時間和不確定性以及涉及的成本,包括為我們的初始和任何附加適應症以及我們可能開發和追求的其他候選產品提供這些療法所需的醫療器械;
|
|
•
|
FDA對我們在IND中提出的針對GH001的研究實施臨牀擱置的持續時間,包括任何非臨牀項目的進展和相關成本,以及解除臨牀擱置所需的任何其他工作,以及與FDA的討論以及此類討論的結果和解決方案;
|
|
•
|
我們可能追求的未來候選產品的數量及其開發需求;
|
|
•
|
我們計劃尋求監管批准的司法管轄區的數量;
|
|
•
|
如果獲得批准,任何批准的適應症或獲得監管批准的任何其他候選產品的GH001、GH002和GH003的商業化活動的成本
不由任何未來的合作伙伴負責,包括建立產品銷售、營銷、分銷和製造能力的成本和時間;
|
|
•
|
在收到監管部門批准後,任何批准的適應症或任何其他候選產品的GH001、GH002和GH003及其各自的醫療器械的商業銷售所獲得的收入(如果有)。
|
|
•
|
如果獲得批准,為GH001、GH002、GH003或任何其他候選產品建立和維持承保範圍,並從第三方支付方獲得足夠的補償;
|
|
•
|
我們可以在多大程度上對其他產品、候選產品、醫療器械或技術進行許可或獲得權利;
|
|
•
|
隨着我們擴大研發、增加辦公空間和建立商業基礎設施,我們的員工增長和相關成本;
|
|
•
|
準備、提交和起訴專利申請以及維護和保護我們的知識產權的成本,包括執行和捍衞與知識產權有關的索賠;
|
5
目錄表
|
•
|
競爭產品和市場發展的影響;以及
|
|
•
|
作為上市公司的持續運營成本。
|
我們不能確定是否會在可接受的條件下提供額外資金,或者根本不能。我們沒有承諾的額外資金來源,如果我們無法以我們可以接受的條件或在
足夠的金額內籌集額外資金,我們可能不得不大幅推遲、縮減或停止我們候選產品的開發或商業化或其他研發計劃。如果我們無法履行協議項下的付款或其他義務,我們當前或未來的任何許可協議都可能被終止。
籌集額外資本可能會對我們普通股的持有者造成稀釋,限制我們的運營,或者要求我們放棄對我們的技術或候選產品的權利
。
我們預計,與我們計劃的業務相關的費用將繼續增加。在我們能夠產生可觀的產品收入之前,我們預計將通過公共或私募股權發行、債務融資、可轉換債券融資、戰略合作和許可安排的組合來滿足我們的現金需求。此外,由於有利的市場條件或戰略考慮,我們可能會尋求額外的資本,即使我們認為我們目前或未來的運營計劃有足夠的資金。
如果我們通過出售股權或可轉換債務證券來籌集額外資本,您的所有權權益可能會被稀釋,這些證券的條款可能包括
清算或其他優惠和反稀釋保護,這可能會對您作為股東的權利產生不利影響。債務融資(如果可行)可能導致固定支付義務,並可能涉及的協議包括限制
或限制我們採取特定行動的能力的契約,例如招致額外債務、進行資本支出、創建留置權、贖回股票或宣佈股息,這些可能會對我們開展業務的能力產生不利影響。此外,獲得融資可能需要我們管理層花費大量時間和精力,可能會將他們的注意力從日常活動中轉移開,這可能會對我們管理層監督候選產品開發的能力
產生不利影響。
如果我們通過與第三方的戰略合作或營銷、分銷、許可和特許權使用費安排籌集額外資金,我們可能不得不放棄對我們的知識產權或技術、未來收入流、研究計劃或候選產品的寶貴權利,或者以可能對我們不利的條款授予許可證,或者發行和出售我們的股票,這可能會導致我們的股東股權被稀釋。如果我們
無法在需要時通過股權或債務融資籌集更多資金,我們可能需要推遲、限制、減少或終止我們的產品開發或未來的商業化努力,或者授予開發和營銷我們本來更願意自己開發和營銷的候選產品的權利
。
6
目錄表
我們處於臨牀藥物開發的早期階段,運營歷史有限,沒有獲得商業銷售批准的產品,這可能會使我們很難評估我們目前的業務,並預測我們未來的成功和生存能力。由於我們的臨牀試驗中納入的患者數量較少,且隨訪時間較短,因此此類臨牀試驗的結果可能不如具有較長隨訪期的大型臨牀試驗的結果可靠,這可能會阻礙我們獲得監管部門對GH001、GH002、GH003或任何未來候選產品的批准。
我們是一家臨牀階段的生物製藥公司,運營歷史有限,專注於新療法,這些療法可能能夠在我們關注的精神和神經疾病領域內的抑鬱症患者和其他適應症患者中誘導超快和持久的緩解。我們於2018年開始運營,沒有任何產品獲準商業銷售,也沒有任何產品銷售收入。藥物開發是一項高度不確定的工作,涉及很大程度的風險。樣本量更小、隨訪時間更短的臨牀試驗的結果,例如我們在22名健康志願者中完成的GH001第一階段臨牀試驗(GH001-HV-101),我們在16名難治性抑鬱症患者中完成的GH001第一階段臨牀試驗,或TRD(GH001-TRD-102),兩者均為7天隨訪,我們在46名健康志願者中完成了GH001第一階段臨牀試驗(GH001-HV-103),並進行了30天的隨訪,或者我們正在進行的GH001的2a期概念驗證臨牀試驗,用於治療雙相II型障礙(BDII)和當前抑鬱發作(GH001-BD-202)和治療產後抑鬱症(GH001-PPD-203)患者,以及我們最近在64名健康志願者(GH002-HV-105)中完成的GH002的第一階段臨牀試驗,每個試驗都可能受到與進行小型短期臨牀試驗相關的各種偏見的不成比例影響,例如,較小的樣本量可能無法準確地描述更廣泛的患者羣體的特徵,較短的研究可能無法準確地描述長期安全性和有效性結果,這限制了結果的推廣能力,從而使臨牀試驗結果的可靠性低於患者數量較多和隨訪時間較長的臨牀試驗。因此,這種候選產品在未來的任何臨牀試驗中是否會取得統計上的顯著效果可能不太確定。如果我們對GH001或GH002進行任何未來的臨牀試驗,我們可能無法獲得統計上顯著的結果或基於我們在初始階段和1/2期臨牀試驗中觀察到的結果而預期的統計上顯著的結果或相同水平的統計學意義(如果有的話)。到目前為止,我們已完成的臨牀試驗僅在荷蘭進行,我們尚未啟動或
完成關鍵的臨牀試驗、獲得任何候選產品的上市批准、生產商業規模的產品或安排第三方代表我們這樣做,或進行成功的產品商業化所需的銷售和營銷活動。作為一家公司,我們短暫的經營歷史使我們對未來成功和生存能力的任何評估都受到重大不確定性的影響。我們將遇到早期生物製藥公司在快速發展的領域經常遇到的風險和困難,而我們還沒有展示出成功克服這些風險和困難的能力。如果我們不成功應對這些風險和困難,我們的業務將受到影響。
由於我們的計劃開發需要大量資源,並且根據我們獲得資金的能力,我們必須優先開發
某些候選產品。此外,我們可能會將有限的資源用於不能產生成功候選產品的計劃,或無法利用可能更有利可圖或成功可能性更大的候選產品或指示的計劃。
我們目前在臨牀開發中有兩個候選產品,在臨牀前開發中有一個候選產品。開發這些計劃和候選產品、提供這些候選產品所需的醫療器械以及任何潛在的未來計劃和候選產品都需要大量的資本投資。由於我們的計劃和候選產品的開發需要大量資源,我們
必須將我們的計劃和候選產品集中在特定的疾病和疾病途徑上,並決定要追求和推進哪些候選產品以及分配給每個候選產品的資源量。我們的藥物開發戰略是對我們的候選產品進行臨牀測試並尋求監管部門的批准,我們認為有最多證據表明我們將能夠有效地生成概念驗證數據。然後,我們打算擴展到臨牀測試,並尋求監管部門對其他精神和神經疾病的批准。然而,即使我們的候選產品能夠在一個適應症中獲得監管批准,也不能保證我們能夠擴展到其他適應症,我們可能會花費
大量資源尋求此類批准。
此外,我們可以基於相同的戰略方法(例如,機械原理、轉換工具的可用性、臨牀開發路徑、商業機會),將資源集中在尋求精神和神經疾病以外的適應症上,以確定我們的發現計劃重點關注哪些。我們關於將研究、開發、協作、管理和財務資源分配給特定候選產品或特定醫療設備以交付這些候選產品或治療領域的決定,可能不會導致開發任何可行的商業產品,並可能將資源從更好的
機會中轉移出去。此外,我們可能會隨時重新確定候選產品開發計劃和活動的優先順序,並延遲或終止我們確定的任何候選產品的開發。同樣,我們在某些計劃、候選產品或醫療設備方面延遲、終止或與第三方合作以交付這些候選產品的潛在決定也可能隨後被證明是次優的,並可能導致我們錯過預期的寶貴機會。如果我們對我們的任何計劃或候選產品的可行性或市場潛力做出了錯誤的判斷,或者誤讀了生物製藥行業的趨勢,特別是對於精神和神經疾病,我們的業務、財務狀況和運營結果可能會受到實質性的不利影響。因此,我們可能無法利用可行的商業產品或有利可圖的市場機會,被要求放棄或推遲與其他候選產品或其他疾病和疾病途徑的商機,這些產品或疾病可能後來被證明具有比我們選擇的產品更大的商業潛力,或者在對我們有利的情況下,通過合作、許可或其他
版税安排向這些候選產品放棄寶貴的權利。
7
目錄表
美國聯邦政府未能管理其財政事務,或未能提高或進一步暫停債務上限,可能會使我們面臨更大的財務和運營風險。
國會對美國聯邦預算和聯邦政府允許的未償債務上限(通常稱為債務上限)存在分歧,此前曾導致美國聯邦政府停擺一段時間。一般來説,如果在適用的最後期限之前沒有頒佈有效的立法來為政府運作和管理聯邦債務水平提供資金,聯邦政府可能會暫停對某些政府賬户的投資,以及其他可用的選擇,以便優先償還其債務。如果美國國會在未來任何時候都不能通過支出法案或解決債務上限問題,
將增加美國違約的風險、美國聯邦政府信用評級下調的風險以及其他經濟混亂的風險。任何此類故障也可能給公司帶來負面後果。對我們業務的潛在影響可能包括:
|
•
|
公司持有的美國政府債券投資的貶值;
|
|
•
|
無法進入資本市場,或進入資本市場的難度增加;或
|
|
•
|
政府關閉或減少FDA等機構的運作,這可能會阻礙我們推進計劃中的IND和/或其他美國業務的能力。
|
匯率波動可能會對我們的經營結果和財務狀況產生重大影響。
由於我們業務的國際化範圍,我們的資產、收益和現金流受到幾種貨幣匯率變動的影響,特別是歐元、美元和英鎊。我們的綜合財務業績是以美元表示的,而我們的子公司GH Research愛爾蘭有限公司的業績是以歐元編制的。美元和歐元之間的匯率變化將影響我們的GH Research愛爾蘭有限公司在報告綜合業績時將財務業績轉換為美元。
我們的大部分運營費用都是以歐元和英鎊支付的。未來更多的潛在收入可能來自國外,特別是來自美國。因此,我們的業務
和我們普通股的價格可能會受到歐元、美元和英鎊匯率波動的影響,這也可能對我們的經營業績和現金流產生重大影響。目前,我們沒有任何匯率對衝安排。有關匯兑風險的説明,請參閲本年度報告其他部分的綜合財務報表附註18。
此外,一個或多個歐盟成員國可能放棄歐元,可能會對我們未來的業務產生實質性影響。儘管歐盟採取了措施向某些財政困難的歐盟成員國提供資金,一些歐洲國家也採取了穩定經濟和減輕債務負擔的措施,但歐元未來可能會被採用歐元的國家放棄作為一種貨幣。這可能導致一個或多個歐盟成員國重新引入個別貨幣,或者在更極端的情況下,導致歐盟解體。潛在的歐盟解體、一個或多個歐盟成員國退出歐盟或放棄歐元作為一種貨幣對我們業務的影響是無法確切預測的,任何此類事件都可能對我們的業務、財務狀況和運營結果產生實質性的不利影響。
我們對現金、現金等價物和有價證券的使用擁有廣泛的自由裁量權,可能無法有效地使用它們。
我們的管理層擁有廣泛的自由裁量權,可以使用我們的現金、現金等價物和有價證券為我們的運營提供資金,並可以將這些資金用於不會改善我們的運營業績或提高我們普通股價值的方式。如果我們的管理層未能有效運用這些資金,可能會導致財務損失,對我們的業務產生實質性的不利影響,導致我們的普通股價格
下跌,並推遲我們候選產品的開發。在我們用來為運營提供資金之前,我們可能會以不產生收入或貶值的方式投資我們的現金、現金等價物和有價證券。
8
目錄表
與研發和生物製藥行業相關的風險
解決FDA對我們在IND中提出的針對GH001的研究提出的臨牀擱置可能需要相當長的時間和費用,並且不能保證FDA將取消臨牀擱置,這可能會對我們的臨牀開發工作產生重大不利影響,或者可能損害我們的業務、財務狀況、運營結果和前景。
2023年9月29日,我們宣佈,FDA通知我們,我們在IND中提出的針對GH001的研究已被臨牀擱置。2023年10月,我們收到了FDA的正式臨牀擱置函,要求我們提供(I)一項非齧齒動物物種的吸入毒理學研究和一項額外的大鼠吸入毒理學研究,涉及之前完成的大鼠吸入毒理學研究的呼吸道組織學結果,(Ii)額外的設備設計驗證信息和(Iii)我們的研究人員手冊的更新。我們正在努力迴應FDA的要求,包括啟動所要求的非臨牀研究。但是,這些研究和我們可能發起的任何其他工作可能需要相當長的一段時間,並且不能保證FDA會接受我們
可能提供的此類非臨牀研究或其他迴應(包括設備設計驗證信息)的結果,FDA可能會要求我們進行其他非臨牀研究或其他工作,或者有其他問題。雖然我們不相信之前完成的大鼠吸入毒理學研究的呼吸道組織學結果一定能預測其他物種或人類的呼吸道毒理學,但我們可能會在其他物種甚至人類的非臨牀研究中看到類似的發現。如果FDA不接受我們的
非臨牀研究的結果或這些研究的結論,或不同意我們可能提供的其他迴應,要求我們進行額外的試驗或研究,和/或發現我們提供的設備設計驗證信息不令人滿意,則可能還需要相當長的一段時間,目前還不確定時間長短,而且我們需要花費才能完全解決FDA的擔憂。我們打算提交的額外
非臨牀研究或設備設計驗證信息導致的任何此類延遲和/或費用增加,都可能因需要尋找或開發替代設備來提供GH001而加劇。此外,在FDA的臨牀擱置或我們可能發起的非臨牀研究或任何其他工作的推動下,類似的外國監管機構也可能有問題
或請求或可能發起相當於臨牀擱置的情況,這可能同樣需要我們花費大量的時間和費用來解決
。即使我們能夠完全迴應FDA目前的關切,FDA隨後可能會提出我們在解除臨牀擱置之前需要滿足的額外要求。我們可能無法完全解決FDA的擔憂,因此,臨牀暫停可能永遠不會解除,我們可能永遠無法在美國啟動GH001的臨牀試驗。對於我們在IND中建議的GH001臨牀試驗,也有可能解除臨牀擱置,但FDA未來的臨牀試驗將被擱置。這些問題可能會對我們的臨牀開發工作產生實質性的不利影響,或者以其他方式損害我們的業務、財務狀況、運營結果和前景。
藥物和藥物-器械組合產品的開發是一項高度不確定的工作,涉及很大程度的風險。
我們沒有獲準商業銷售的產品。為了從任何獲得批准的產品的銷售中獲得收入,而這些產品的重要性或規模足以實現盈利,我們必須單獨或與第三方合作,成功地開發、獲得監管機構批准的治療方法,並取得重大商業成功。我們創造收入和實現盈利的能力取決於許多因素,包括:
|
•
|
完成我們的候選產品和交付這些候選產品所需的醫療設備的研究和技術、非臨牀和臨牀開發,例如我們針對GH001的專有氣霧劑輸送設備;
|
|
•
|
獲得候選產品的監管批准和營銷授權,包括交付我們成功完成臨牀
開發和臨牀試驗的這些候選產品所需的醫療器械;
|
|
•
|
推進任何非臨牀項目和可能需要的任何其他工作,以解除我們在針對GH001的IND中提出的研究的臨牀擱置;
|
|
•
|
為我們的候選產品和交付這些候選產品所需的醫療器械開發可持續和可擴展的製造流程,並與能夠提供足夠的產品和服務以支持我們的候選產品和醫療器械的臨牀活動和商業需求的第三方建立和維護商業上可行的供應關係;
|
|
•
|
確定、評估、獲取和/或開發新的候選產品;
|
|
•
|
在我們可能加入的任何合作、許可或其他安排中談判有利條件;
|
9
目錄表
|
•
|
根據1970年聯邦全面藥物濫用預防和控制法(也稱為受控物質法或CSA)和類似的州法律,DEA和美國國內外其他適用的監管機構成功地重新安排了我們的候選產品;
|
|
•
|
通過與合作伙伴合作,或如果獨立推出,通過建立銷售、營銷和分銷基礎設施,推出併成功地將候選產品和交付我們獲得監管批准的這些候選產品所需的醫療器械商業化;
|
|
•
|
在我們產品商業化的國家為我們的候選產品和設備獲得並保持適當的價格;
|
|
•
|
為我們的候選產品和醫療器械從付款人那裏獲得保險和足夠的補償;
|
|
•
|
獲得市場對我們的候選產品作為可行治療方案的認可;
|
|
•
|
應對任何相互競爭的技術和市場發展;
|
|
•
|
收到任何未來合作安排下的里程碑付款和其他付款;
|
|
•
|
維護、保護、擴大和執行我們的知識產權組合,包括專利、商業祕密和專有技術;
|
|
•
|
吸引、聘用和留住合格人才;以及
|
|
•
|
遵守法律法規,包括適用於受管制物質、數據隱私和商業前活動的法律。
|
例如,我們之前完成的大鼠吸入毒性研究顯示呼吸道組織學結果,有助於我們的GH001 IND的臨牀控制,
並導致FDA要求進行非齧齒動物物種的吸入毒理學研究和額外的吸入毒理學研究。由於與藥物和藥物-設備組合產品開發相關的眾多風險和不確定性,我們無法預測我們支出的時間或金額,或者我們何時能夠產生任何有意義的收入或實現或保持盈利(如果有的話)。
GH001、GH002和GH003是基於新技術的美布替寧(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)研究藥物,這使得難以預測開發時間和成本以及隨後獲得監管部門的批准。據我們所知,這種療法在美國和歐盟都沒有被批准商業化。
我們集中精力研發GH001、GH002和GH003,用於治療精神或神經疾病,我們未來的成功取決於我們成功地開發這些候選產品。我們失敗的風險很高。我們在開發GH001、GH002和GH003時可能會遇到問題或延遲。任何此類問題或延誤都會導致意想不到的成本,任何開發問題都可能得不到解決。例如,我們或另一方可能發現與GH001、GH002和/或GH003相關的以前未知的風險,其問題可能比我們目前認為的更嚴重,這可能會延長獲得監管批准所需的觀察期,或導致無法獲得監管批准,或可能需要進行額外的臨牀測試。
10
目錄表
此外,FDA、歐盟委員會、EMA和其他監管機構的產品規格和臨牀試驗要求,以及這些監管機構用來確定候選產品安全性和有效性的標準,因候選產品的類型、複雜性、新穎性以及預期用途和市場而有很大不同。像我們這樣的候選新產品的監管審批程序尚不清楚,與其他更知名或更廣泛研究的療法相比,可能更昂貴,耗時更長。例如,由於我們的GH001、GH002和GH003候選產品含有美布替寧,它被CSA歸類為附表I
受控物質,被英國2001年《濫用藥物條例》歸類為附表1藥物,並且被大多數國家、外國政府和1971年聯合國精神藥物公約類似地歸類,因此對GH001、GH002和GH003進行監管批准的發展尤其具有挑戰性和不確定性。藥物-設備組合產品開發的高度技術複雜性進一步增加了監管部門批准我們的候選產品的風險和不確定性。這種風險和不確定性在吸入性遞送藥物成分的藥物-裝置組合產品領域尤其高,例如使用GH001。過去,由於在達到監管批准所需的嚴格技術性能規格方面面臨的技術挑戰,或者由於與吸入給藥相關的特定不良事件,藥物-器械組合產品經歷了重大延誤。我們預計,提供GH001所需的GH001和
設備將需要大量的額外開發工作才能獲得監管部門的批准。目前還不確定這項開發工作是否會成功。類似的背景和類似的風險也適用於我們的GH002和GH003候選產品。據我們所知,沒有一種美布福汀療法獲得FDA的批准,也沒有獲得歐盟委員會的上市授權。因此,很難確定在美國或歐盟獲得GH001、GH002和GH003的監管批准需要多長時間或花費多少錢。歐盟委員會的批准可能並不代表FDA可能需要批准什麼,反之亦然。
我們的業務在很大程度上依賴於我們的GH001、GH002和GH003候選產品的成功開發。如果不能成功開發出GH001和/或GH002和/或GH003,我們將無法獲得監管部門對GH001和/或GH002和/或GH003的批准,也無法將其成功商業化,我們的業務可能會受到嚴重損害。
我們目前沒有獲準銷售的產品,並將我們的大部分精力和財力投入到我們的主要候選產品GH001、GH002和GH003的開發中,用於治療精神或神經疾病。對於我們的初始和任何其他適應症,成功地繼續開發並最終獲得GH001、GH002和GH003的監管批准對我們業務的未來成功至關重要。我們將
需要為我們的GH001、GH002和GH003候選產品的臨牀開發計劃籌集足夠的資金,併成功登記和完成這些計劃,以治療TRD和潛在的其他精神和神經疾病。
在我們可以通過銷售GH001、GH002、GH003或任何其他經批准的產品獲得任何收入之前,我們必須在一個或多個司法管轄區對候選產品和交付這些候選產品所需的醫療器械進行額外的技術、非臨牀和臨牀開發、監管審查和批准。到目前為止,我們已完成的臨牀試驗僅在荷蘭進行,我們正在進行的臨牀試驗僅在歐洲進行,覆蓋七個歐洲國家。 我們計劃在更多的歐洲國家、加拿大和美國為我們的所有臨牀項目進行臨牀試驗。
我們預計我們不需要向FDA提交單獨的研究設備豁免申請或IDE或其他類似申請,用於我們用來交付候選產品的醫療設備,包括我們專有的氣霧劑輸送設備,我們還沒有這樣做,儘管不能保證未來不需要IDE或類似的申請。我們預計,我們的GH001專有氣霧劑輸送裝置將需要分別向歐盟成員國和英國主管部門申請
,我們用來交付我們候選產品的其他醫療裝置可能也需要申請。目前對美國、歐盟和英國以外的申請要求瞭解較少,可能需要單獨申請。如果FDA或其他類似的外國監管機構得出結論認為,任何此類醫療設備需要提交IDE或類似的申請,它可能會推遲或阻止我們在未來的試驗中使用此類醫療設備。即使我們提交了IDE或類似的醫療器械申請,FDA或其他類似的外國監管機構也可能不會及時或根本不批准我們要求的必要批准。此外,如果我們的一個或多個候選產品獲得批准,我們必須確保候選產品獲得足夠的商業製造能力和交付這些候選產品所需的醫療器械,並在任何商業發佈中進行重大營銷努力,以及在個別歐洲和其他國家/地區獲得定價和報銷授權。這些努力將需要
大量投資,我們可能沒有財力繼續開發我們的候選產品或將任何產品商業化。
我們可能會遇到一些挫折,這些挫折可能會延遲或阻止我們的候選產品獲得監管批准,包括提供我們的候選產品的醫療器械,例如我們的專有氣霧劑
GH 001的輸送設備,或我們將任何產品商業化的能力,包括:
11
目錄表
|
•
|
延遲或未能為我們的候選產品或醫療器械建立可接受的性能特徵、質量製造標準和製造能力,
提供我們的候選產品;
|
|
•
|
我們的非臨牀研究或臨牀試驗或其他人對與我們類似的候選產品進行的臨牀試驗的陰性或不確定結果,導致決定或要求進行
額外的非臨牀試驗或臨牀試驗或放棄計劃;
|
|
•
|
我們的臨牀試驗中的受試者或使用與我們的候選產品相似的藥物或治療方法的個人所經歷的產品或器械相關副作用;
|
|
•
|
在美國提交IND(或IDE,如適用)或類似的外國申請的延遲,或從監管機構或機構審查獲得必要批准的延遲或失敗
委員會或IRB開始臨牀試驗,包括DEA要求的附表I研究方案,或暫停或終止臨牀試驗;
|
|
•
|
如果FDA、EMA或其他類似的外國監管機構認為早期的技術、非臨牀和臨牀試驗工作不充分,那麼我們可能需要進行額外的技術
開發工作或非臨牀或臨牀試驗超出了我們以前的計劃。例如,我們之前完成的非臨牀數據和與我們的
一起提交的設備設計驗證信息 FDA認為GH 001 IND包含的信息不足以評估對人類受試者的風險,因此FDA要求 其他非臨牀毒理學研究和其他工作(包括可接受的器械設計
在FDA可能解除臨牀擱置並允許我們在美國啟動臨牀研究(例如我們在IND中為GH 001提出的研究)之前,我們需要獲得驗證信息)。任何重大的非臨牀技術進展或
臨牀試驗延遲還可能縮短我們可能擁有的候選藥物和醫療器械商業化專有權的任何時間,或允許我們的競爭對手在我們之前將產品推向市場,並損害我們的
成功商業化我們的候選藥物和醫療器械的能力,可能會損害我們的業務和經營業績;
|
|
•
|
FDA、EMA或其他類似的外國監管機構對我們臨牀試驗的範圍或設計施加的條件;
|
|
•
|
FDA、EMA或其他類似的外國監管機構可能不同意我們的臨牀試驗設計,包括在我們計劃的臨牀試驗中給予的劑量水平,或醫療
用於在臨牀試驗中交付候選產品的器械,可能會延遲或阻止我們使用最初預期的試驗設計和最初計劃的醫療器械啟動臨牀試驗;
|
|
•
|
延遲與臨牀試驗中心簽訂合同或在臨牀試驗中招募受試者,無法確定願意主持我們的臨牀試驗的臨牀試驗中心以及所需的計劃藥物DEA
我們的臨牀研究者在美國獲得並維護研究者註冊和附表I研究方案以及在其他司法管轄區獲得並維護的類似許可證;
|
|
•
|
延遲或中斷供應我們進行臨牀試驗所需的材料;
|
|
•
|
監管機構、IRB或倫理委員會不得授權我們或我們的研究者開始臨牀試驗或在預期試驗中心開展臨牀試驗;
|
|
•
|
FDA要求我們提交與臨牀暫停相關的其他數據,FDA或EMA或其他類似的外國監管機構可能在未來要求我們提交其他數據,如長期毒理學
我們候選產品或交付候選產品所需醫療器械的研究、其他器械設計驗證信息或其他數據;
|
|
•
|
延遲或未能與潛在試驗中心和潛在合同研究組織或CRO就可接受的條款達成一致,這可能需要進行廣泛的談判,
不同CRO和試驗中心之間可能存在顯著差異;
|
12
目錄表
|
•
|
任何候選產品的臨牀試驗所需的受試者數量可能比我們預期的要多,或者受試者可能退出這些臨牀試驗或未能返回接受治療後隨訪
比我們預期的要快
|
|
•
|
我們的非臨牀研究或臨牀試驗第三方承包商可能無法遵守監管要求或及時履行其對我們的合同義務,或根本無法履行,或可能偏離
臨牀試驗方案或採取可能導致臨牀試驗中心或臨牀研究者退出試驗的行動,這可能需要我們增加新的臨牀試驗中心或研究者;
|
|
•
|
由於大流行的影響,例如新冠肺炎大流行、流行病、傳染病爆發或類似事件,我們的技術開發、非臨牀研究、臨牀試驗和/或監管批准可能會遇到一些延遲和中斷,我們的製造供應鏈可能會遇到延遲或中斷,或者我們可能會在與我們依賴的第三方服務提供商就可接受的
條款達成協議方面遇到延遲或無法達成協議;
|
|
•
|
臨牀試驗成本高於預期,包括延遲或中斷,這可能會增加完成臨牀試驗的總成本,因為我們的固定成本在延遲期間並未大幅降低;
|
|
•
|
我們可能會選擇或監管機構、IRBs、數據安全監測委員會或DSMB,或倫理委員會可能會要求我們或我們的調查人員因各種原因暫停或終止臨牀研究或試驗,包括不遵守法規要求或發現參與者暴露在不可接受的健康風險中;
|
|
•
|
我們可能沒有財政資源來開始和完成計劃中的試驗,或者任何候選產品的臨牀試驗成本可能比我們預期的要高;
|
|
•
|
我們候選產品的供應或質量、交付我們候選產品所需的醫療器械或對我們候選產品進行臨牀試驗所需的其他材料的供應或質量可能不足以或不足以啟動或完成給定的臨牀試驗;
|
|
•
|
無法與其他療法競爭;
|
|
•
|
我們的候選產品在臨牀試驗期間療效不佳;
|
|
•
|
未能證明我們的候選產品具有可接受的收益/風險概況;
|
|
•
|
無法為交付我們的候選產品所需的醫療器械提供足夠的設計、測試、製造和質量信息,包括支持其使用和與我們候選產品的藥物成分的兼容性的信息;
|
|
•
|
FDA、EMA或其他類似的外國監管機構對臨牀試驗場地或製造設施的檢查和審查;
|
|
•
|
如果DEA或任何州或其他司法管轄區推遲重新安排或未能將甲氧基甲氧基N,N-二甲基色胺或5-甲氧基色胺(5-MeO-DMT)重新安排到附表II、III、IV或V,或推遲分類或
未能將我們的候選產品歸類到附表II、III、IV或V;
|
|
•
|
與任何產品批准相關的不利產品標籤以及FDA或其他司法管轄區的類似要求可能要求的風險評估和緩解策略或REMS的任何要求,以確保單個產品的好處大於其風險;
|
|
•
|
患者或醫學界或第三方付款人對我們的候選產品或臨牀試驗數據的接受程度不佳;
|
|
•
|
我們的第三方承包商或調查人員未能及時或根本不遵守監管要求或履行其合同義務;
|
13
目錄表
|
•
|
監管要求、政策和指南的延遲和變更,包括對一般的臨牀測試或針對我們的技術施加額外的監管監督。
|
|
•
|
FDA、EMA或其他類似的外國監管機構對數據的不同解釋。
|
我們無法完全控制其中許多因素,包括技術藥物產品和設備開發、非臨牀開發、臨牀開發和監管提交流程的某些方面,對我們的知識產權以及我們的製造、營銷、分銷和銷售工作或任何未來合作伙伴的潛在威脅。
GH001旨在通過將氣霧劑吸入肺部給患者提供美布替寧(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)。這種氣霧劑由特定的性質來定義,以使其在藥學上是可接受的,如其純度,並實現美布替寧在體循環中的有效吸收,如其顆粒分佈。這種美布替寧氣霧劑的產生需要具有特定性能特徵和特性的藥物產品和裝置,因此預計GH001和特定裝置將被FDA、EMA或其他類似的外國監管機構視為藥物-裝置組合產品。還預計,GH003及其各自的給藥裝置將被FDA、EMA或其他類似的外國監管機構或通知機構作為藥物-裝置組合產品進行監管。然而,對於GH002,它是我們的靜脈注射美布福汀配方,這樣的分類將取決於我們對其商業展示的最終選擇。被認為是藥物-設備組合產品的產品將需要FDA內的藥物和設備中心、或其他類似的外國監管機構或通知機構在啟動臨牀試驗和上市批准之前進行審查和協調,這可能會推遲此類試驗或上市批准。根據FDA的規定,組合產品受當前良好生產規範(CGMP)、適用於藥品和醫療器械的要求(包括質量體系或QS)以及適用於醫療器械的法規的約束。組合產品
還受醫療器械法規2017/745或MDR的約束,該法規要求藥品與器械監管法律和監管機構之間進行協調。與藥物產品或組合產品的設備組件相關的問題
候選產品可能會推遲或阻止臨牀試驗或上市審批的啟動。例如,在當前和以前的臨牀試驗中,GH001已經使用我們在市場上從單一第三方製造商Storz
&Bickel,Tuttlingen購買的設備進行了蒸發。我們與圖特林根的Storz&Bickel公司沒有商業供應協議。如果FDA、EMA或其他類似的外國監管機構拒絕接受在我們計劃的臨牀試驗中使用這種第三方設備,那麼額外的臨牀試驗的啟動可能會大大推遲或阻止。我們還沒有與任何替代供應商達成許可協議,這些設備將適合從GH001產生從藥物上可接受的氣霧劑。2021年,我們開始為GH001開發一種專有的氣霧劑輸送設備,用於我們的關鍵臨牀試驗計劃和商業用途。此開發尚未完成,如果我們無法
開發、製造、許可或獲取適用於從GH001產生藥物可接受的氣霧劑的設備,從而使美布替寧充分吸收到全身循環中,或者如果我們無法獲得足夠的第三方製造的設備或任何替代設備的供應,或者如果由於任何原因無法獲得該設備,則其他臨牀試驗的啟動或獲得上市批准可能會大大延遲或阻止。
如果第三方設備的製造商進行了修改,或者,如果我們選擇更換設備組件或許可替代設備組件,則在使用經修改或替代的設備或設備組件之前,我們需要執行驗證測試並獲得FDA或其他類似的外國監管機構或通知機構的批准。我們開發任何專有設備都需要類似的測試和驗證。如果FDA或其他類似的外國監管或通知機構未能批准使用這些改裝或替代醫療設備,或對製造商採取重大執法行動,我們將無法繼續或啟動臨牀試驗,無法獲得營銷
批准,或者我們可能不得不暫停在某些司法管轄區銷售我們的產品。
此外,在生物製藥行業大量正在開發的藥物中,只有一小部分導致向FDA、EMA或其他類似的外國監管機構提交了營銷申請,如新藥申請,或NDA,更少的藥物獲得了商業化批准。此外,即使我們確實獲得了對GH001、GH002或GH003的監管批准,包括其管理所需的醫療器械
,例如我們針對任何適應症的專有氣霧劑輸送設備,任何此類批准可能會受到我們銷售產品的適應症或用途或患者羣體的限制。
因此,即使我們能夠獲得必要的資金繼續為我們的開發計劃提供資金,我們也不能保證我們將成功開發或商業化GH001、GH002或GH003,包括其管理所需的醫療器械,以用於任何適應症。
14
目錄表
為GH001開發我們專有的氣霧劑輸送設備是一個成本高昂且不確定的過程,該設備的開發或製造的任何失敗或延遲
都可能對我們的業務和運營結果產生重大不利影響。
我們專有的GH001氣霧劑輸送裝置的開發過程並不完整。作為一家臨牀階段的生物製藥公司,我們在製造醫療設備方面沒有豐富的經驗,也沒有與合同開發和製造組織(CDMO)合作製造醫療設備的豐富經驗,因此我們可能無法開發出既能滿足我們的目的,也能獲得必要的監管批准的設備。
此外,我們用於GH001的專有氣霧劑輸送設備中的大量組件都是在中國製造的,這使我們在製造設備時面臨某些地緣政治風險和其他與供應鏈相關的風險。見
“項目3.關鍵信息--D.風險因素—與員工事務相關的風險,管理我們的業務和運營—我們的業務受到與國際業務相關的經濟、政治、監管和其他風險的影響。
由於我們設備的新穎性以及缺乏適用於我們設備的既定監管指南,與批准我們的設備相關的監管途徑非常複雜。
FDA、EMA或其他類似的外國監管機構可能不接受我們對現有指南的解釋,這可能會影響監管批准的時間表或導致我們的設備根本無法獲得監管
批准。
即使我們最終開發出一種適合產生藥學上可接受的氣霧劑的裝置,並且能夠將美布福寧(5-甲氧基-N,N-二甲基色胺或5-MeO-DMT)充分吸收到全身循環中,即使該裝置獲得FDA、EMA或其他類似的外國監管機構的批准或豁免(視具體情況而定),也不能保證我們能夠以足夠的數量或以我們可以接受的成本充分製造這種裝置,或者第三方付款人將充分補償這些裝置。以實現我們的商業前和商業目標。任何這種無法充分
製造我們的設備的情況都可能嚴重推遲我們的臨牀試驗或以其他方式對我們的業務造成實質性影響。
此外,我們未來的成功可能在一定程度上取決於我們是否有能力增強我們的專有氣霧劑輸送設備,以及開發或獲取新技術,以跟上技術發展、不斷髮展的行業標準以及對患者需求和期望變化的反應。如果未能充分開發對我們專有的氣霧劑輸送設備的增強和改進,或未能獲得能夠充分滿足不斷變化的技術和患者需求的新設備,或未能及時推出此類設備,可能會對我們的臨牀試驗、業務、財務狀況和運營結果產生重大不利影響。
臨牀開發涉及一個漫長、複雜和昂貴的過程,結果不確定。非臨牀試驗和早期臨牀試驗的結果可能不能預測後續臨牀試驗的成功,我們目前完成的臨牀試驗的結果可能無法滿足FDA、EMA或其他類似的外國監管機構的要求。
要獲得必要的監管批准以將任何候選產品和給藥所需的醫療器械商業化,我們必須通過廣泛的非臨牀研究和臨牀試驗來證明我們的候選產品在人體上是安全有效的。臨牀測試費用昂貴,可能需要數年時間才能完成,其結果本身也不確定。特別是,在美國,我們希望在未來推進我們的產品開發工作,FDA批准新藥的一般方法是使用
相關設備,在相關患者羣體中對相關藥物進行兩次充分且受控的3期臨牀試驗的數據處理。3期臨牀試驗通常涉及數百名患者,成本高昂,需要數年時間才能完成。候選產品在測試的任何階段都可能失敗,即使在早期的非臨牀研究或臨牀試驗中觀察到有希望的活性跡象後也是如此。我們候選產品的非臨牀研究和早期臨牀試驗的結果可能不能預測後期臨牀試驗的結果。樣本量較小的臨牀試驗可能會受到與進行小型臨牀試驗相關的各種偏差的不成比例的影響,使得臨牀試驗結果的可靠性低於患者數量較大的臨牀試驗。此外,臨牀試驗的初步成功可能不代表這些試驗完成後所取得的結果。通常,由於候選產品在臨牀試驗中失敗而導致的自然流失率極高。臨牀試驗後期階段的候選產品可能無法顯示出所需的安全性和有效性,儘管已通過非臨牀研究和初步臨牀試驗取得進展。生物製藥行業的許多公司由於缺乏療效或出現不可接受的安全性問題而在高級臨牀試驗中遭遇重大挫折,儘管在早期的研究和試驗中取得了令人振奮的結果。此外,一些開發藥物-器械組合產品的公司,特別是在藥物成分的吸入輸送領域,歷史上由於其組合產品中的器械組件的技術、性能或製造問題而遭受重大挫折。大多數開始臨牀
試驗的候選產品從未被批准為產品,不能保證我們未來的任何臨牀試驗最終會成功或支持GH001、GH002、GH003或任何其他候選產品的進一步臨牀開發。產品
在開發初期看起來很有前途的候選產品可能會因為幾個原因而無法投放市場,包括:
15
目錄表
|
•
|
非臨牀研究或臨牀試驗可能顯示候選產品無效或不如預期有效(例如,臨牀試驗可能無法達到其主要終點(S))或具有不可接受的副作用或毒性;
|
|
•
|
在隨後的更大患者羣體的臨牀試驗中,未能反映類似的有效活動;
|
|
•
|
未使用適用監管機構認為具有臨牀意義的臨牀終點;
|
|
•
|
無法解決的候選產品或設備的製造問題或配方問題;
|
|
•
|
未獲得必要的監管批准的;
|
|
•
|
製造問題、配方問題、定價或報銷問題或其他使候選產品或設備不經濟的因素;以及
|
|
•
|
其他人及其競爭產品和技術的知識產權和專有權,可能會阻止我們的候選產品之一商業化。
|
特別是,我們的非臨牀研究或臨牀試驗可能會顯示我們的候選產品具有不可接受的副作用或毒性。在這方面,我們的Previously
完成的大鼠吸入毒理學研究顯示了一定的呼吸道組織學結果。雖然這些發現不影響我們在歐洲正在進行的臨牀試驗的批准,但它們促使FDA要求完成額外的非臨牀研究
在FDA考慮允許我們在美國啟動臨牀研究之前。
我們使用我們設計的指標,峯值體驗,或PE來評估精神活動效應強度的跡象。我們認為PE可能與臨牀結果相關,但PE是一個主觀指標,它可能天生難以評估,其心理測量學驗證尚未完成。目前還不確定監管機構是否會接受在我們
Pivotal計劃的個性化給藥方案或IDR的背景下使用此指標來指導給藥。此外,早期臨牀試驗和後期臨牀試驗在試驗設計上的差異,使得很難將早期臨牀試驗的結果外推到後期臨牀試驗。
此外,我們在健康志願者身上完成的GH001的第一階段臨牀試驗(GH001-HV-101)、在TRD患者中進行的GH001的第1/2階段臨牀試驗(GH001-TRD-102)以及正在進行的GH001在BDII和當前抑鬱發作(GH001-BD-202)和PPD(GH001-PPD-203)中的2a期概念驗證臨牀試驗都是開放標籤研究,其中患者和研究人員都知道患者正在接受的是
產品候選還是現有的批准藥物或安慰劑。最典型的是,開放標籤臨牀試驗只測試候選產品,有時會以不同的劑量水平進行測試。開放標籤臨牀試驗受到各種限制,這些限制可能會誇大任何治療效果,因為開放標籤臨牀試驗中的患者在接受治療時是知道的。例如,先前的嚴重抑鬱障礙(MDD)研究顯示出高度的安慰劑效應。此外,
開放標籤臨牀試驗可能會受到“調查者偏見”的影響,即那些評估和審查臨牀試驗的心理和生理結果的人知道哪些患者接受了治療,並可能在瞭解這些知識的情況下更有利地解釋治療組的信息。因此,在開放標籤試驗中觀察到的積極結果可能不會在後來的安慰劑對照或積極對照試驗中重複。此外,我們正在研究的適應症的臨牀研究中可能存在的
試驗設計差異和安慰劑效應,可能會使我們很難將早期臨牀試驗的結果推斷到後來的臨牀試驗,或解釋我們任何試驗中的
臨牀數據。此外,即使在安慰劑對照或主動對照試驗中,由於美布替寧(5-甲氧基-N,N-二甲基色胺或5-MeO-DMT)的精神作用,患者和/或研究人員也有可能辨別所用劑量是我們的候選產品還是安慰劑或主動對照。因此,我們候選產品的安慰劑對照或主動對照試驗,例如我們在健康志願者中完成的GH001第一階段臨牀試驗(GH001-HV-103),我們正在進行的TRD中GH001的第二階段臨牀試驗(GH001-TRD-201),以及我們最近完成的健康志願者GH002第一階段臨牀試驗(GH002-HV-105),可能會受到與
開放標籤試驗類似的限制。最後,到目前為止,我們的臨牀試驗持續時間很短,我們的結果可能不能預測長期的安全性和有效性。
16
目錄表
FDA、EMA和其他類似的外國監管機構在監管我們時使用的標準需要判斷,而且可能會發生變化,這使得很難確定地預測它們將如何應用。雖然我們最初的重點是開發小分子藥物產品和交付這些產品所需的醫療器械,但我們可能會繼續開發其他產品,例如生物產品,
每一種產品都可能使我們受到額外的法規要求的約束。我們對來自技術開發、非臨牀和臨牀活動的數據執行的任何分析都需要得到監管機構的確認和解釋,這可能會推遲、限制或阻止臨牀研究或監管批准的啟動。我們目前完成的臨牀試驗只在荷蘭進行;我們正在進行的臨牀試驗只在歐洲進行,
我們還正在進行必要的準備工作,以潛在地進行在歐洲使用我們的專有氣霧劑輸送設備(GH001-HV-106)在健康志願者中進行的第一階段臨牀藥理學試驗。
FDA是否接受來自美國以外的臨牀試驗數據取決於某些條件。如果FDA或其他類似的外國監管機構不接受早期的技術、非臨牀或臨牀數據,我們可能需要
進行額外的技術開發、非臨牀研究或臨牀試驗。例如,我們的非臨牀數據和與我們的GH001 IND一起提交的設備設計驗證信息被FDA認為
包含的信息不足以評估對人類受試者的風險,FDA因此要求在FDA可能解除臨牀擱置並允許我們在美國啟動臨牀研究之前,進行額外的非臨牀毒理學研究和其他工作(包括可接受的設備設計驗證信息),例如我們在IND中為GH001建議的研究。
由於新的政府規定,我們還可能遇到意想不到的延誤或成本增加。此類法規的例子包括未來的立法或行政行動,或FDA、EMA或其他類似的外國監管機構在產品開發和監管審查期間改變政策。無法預測是否會頒佈立法更改,或FDA、EMA或其他類似外國監管機構的法規、指導或解釋是否會更改,或此類更改可能產生的影響(如果有的話)。特別是,在美國,我們計劃在未來開發我們的候選藥物,FDA還可能要求
一個專家小組,稱為諮詢委員會,審議安全性和有效性數據是否足以支持批准。諮詢委員會的意見雖然對FDA沒有約束力,但可能會對我們
獲得我們開發的任何候選產品的批准的能力產生重大影響。
成功完成臨牀試驗是向FDA或其他類似的外國監管機構提交每個候選產品和交付該候選產品所需的任何相關設備的營銷申請的先決條件,從而最終批准任何候選產品和醫療器械並進行商業營銷。我們可能會遇到負面或不確定的結果,或者監管機構可能不願接受在外國司法管轄區獲得的非臨牀或臨牀數據,這可能會導致我們決定或被監管機構要求進行額外的臨牀研究或試驗,或者放棄我們的部分或全部產品開發計劃,這將對我們的業務產生重大不利影響。
17
目錄表
即使我們獲得了用於TRD的GH001的監管批准,我們也可能無法完成臨牀開發或獲得監管部門對其他適應症的批准,例如雙相II型障礙和產後抑鬱症,或者我們可能被要求在我們計劃進行的試驗之外進行試驗,這可能會限制我們實現GH001的最大市場潛力的能力,或者
增加為任何其他適應症開發GH001的成本。
鑑於GH001‘S提出的重置人腦功能連接性(Fc)的機制和5-羥色胺能激動症,我們認為它代表着除TRD之外的多種精神和神經疾病的引人注目的治療選擇。通過與學術機構和CRO的合作,我們打算探索GH001在其他精神病學或神經學適應症中的好處,其中第一個是BDII和PPD。
然而,不能保證,即使我們獲得批准將GH001用於我們的初始適應症TRD,我們也將獲得對任何其他適應症的批准,包括雙相II型障礙和產後抑鬱症。獲得這些額外適應症的批准的能力將需要額外的臨牀開發。如果我們無法獲得並保持對這些額外或擴大的適應症所需的批准,或者如果監管批准被推遲,我們將無法
實現GH001的最大市場潛力。此外,FDA、EMA或其他類似的外國監管機構可能要求我們在尋求監管批准之前,進行超出我們計劃進行的臨牀試驗和/或其他測試。例如,我們認為,根據我們現有的GH001臨牀前和臨牀數據,我們可以在其他適應症上繼續進行2a期臨牀試驗,而無需首先完成第1期臨牀試驗。然而,不能保證FDA、EMA或其他類似的外國監管機構會同意這樣的評估。如果我們被要求進行額外的臨牀試驗和/或其他測試,我們為任何額外的
適應症開發GH001的成本將大幅上升,任何監管批准的時間(如果有)將大幅延長,這可能會對我們的運營結果產生不利影響。
我們可能無法提交IND或IND修正案或類似的外國申請,以在我們預期的時間期限內開始額外的臨牀試驗,
即使我們能夠這樣做,FDA、EMA或類似的外國監管機構也可能不允許我們繼續進行。
2022年11月,我們宣佈我們在幾個歐洲國家提交了多中心、隨機、雙盲、安慰劑對照的GH001 2b期臨牀試驗申請(GH001-TRD-201);2023年8月,我們向FDA提交了GH001的IND,目的是啟動一項健康志願者臨牀藥理學試驗,在該試驗中,GH001使用我們專有的氣霧劑給藥裝置
(GH001-HV-106)。然而,我們可能無法在我們預期的時間內為GH001或我們的其他候選產品提交IND或類似的外國申請。例如,我們可能會遇到啟用IND的研究的延遲。此外,我們
不能確定提交IND或類似的外國申請是否會導致FDA、EMA或類似的外國監管機構允許臨牀試驗開始,或者一旦開始,不會出現暫停或終止臨牀試驗的問題。例如,我們在2023年9月宣佈,FDA將我們對GH001的IND臨牀擱置。有關與臨牀擱置相關的某些風險的更多信息,請參閲上面的“第3項.關鍵信息-D.風險因素-可能需要相當長的時間和費用來解決FDA已將
置於我們的IND中建議的針對GH001的研究中,且不能保證FDA將移除臨牀擱置,這可能會對我們的臨牀開發工作產生重大不利影響或可能損害我們的業務、財務狀況、運營結果和前景”。此外,即使這些監管機構最終同意IND或類似的外國申請中規定的臨牀試驗的設計和實施,我們也不能保證這些監管機構未來不會改變他們的要求。這些考慮也適用於我們可能作為現有IND或新IND的修正案提交的新的臨牀試驗,或類似的現有或新的外國申請。未能在我們預期的時間內提交IND或類似的外國申請,或未能獲得監管機構對我們試驗的批准,可能會阻止我們及時完成臨牀試驗或將我們的產品商業化。
我們的候選產品或通過參與我們的臨牀試驗使用我們的候選產品,可能會導致不良副作用或具有其他
特性,這些特性可能會推遲或阻止其監管批准,限制其商業潛力或導致重大負面後果。
可能由GH001、GH002、GH003或任何未來候選產品引起的不良藥物反應,以及在之前完成的臨牀試驗中觀察到的不良藥物反應,如高血壓、心動過速、噁心、嘔吐、感覺障礙、頭痛、閃回,指的是在藥物的急性作用消失後的某個時間點重新體驗由美布替寧(5-甲氧基-N,N-二甲基色胺或5-MeO-DMT)引起的一些影響,或者根據已完成的非臨牀毒性研究中觀察到的毒性,在正在進行的或未來的研究中可能發生的不良反應如5-羥色胺綜合徵、抽搐或呼吸道不良事件,可能會
導致我們或監管機構不啟動、中斷、延遲或停止臨牀試驗,並可能導致比預期更嚴格的標籤,要求我們實施REMS以確保益處大於風險,或
延遲或拒絕FDA、EMA或類似的外國監管機構的監管批准。我們的臨牀試驗結果可能會顯示出嚴重而不可接受的副作用或意外特徵的嚴重程度和流行率,甚至死亡。即使在臨牀試驗的受控環境中,也不能保證包括死亡在內的嚴重副作用不會發生。此外,許多最初在臨牀或早期測試中顯示出希望的化合物後來被發現會導致不良或意想不到的副作用,從而阻止該化合物的進一步發展。此外,我們候選產品的構成或在非臨牀研究或臨牀試驗中獲得的信息可能會導致我們可能獲得監管部門批准的任何候選產品的禁忌症或警告,包括“方框警告”。
18
目錄表
如果在開發我們的候選產品時出現不可接受的副作用,外國監管機構,或未來FDA、EMA、IRBs、DSMBS或進行試驗的機構的獨立道德委員會可能會拒絕允許我們啟動、或暫停或終止我們的非臨牀研究或臨牀試驗,或者FDA、EMA或其他類似的外國監管機構可能會命令我們
停止非臨牀研究或臨牀試驗,或拒絕批准我們的產品候選產品的任何或所有目標適應症。
被認為與藥物相關的治療突發副作用也可能影響受試者招募或受試者完成試驗的能力或導致潛在的產品責任索賠。我們的候選產品在一個適應症的臨牀試驗中出現的不良副作用可能會對臨牀試驗的登記、監管部門的批准以及我們候選產品在其他適應症的商業化產生不利影響。此外,治療醫務人員可能沒有適當地認識到或處理這些副作用。任何這些情況都可能對我們的業務、財務狀況和前景造成重大損害。
此外,我們的候選產品的臨牀試驗是在精心定義的健康志願者和同意參加臨牀試驗的患者組中進行的。因此,我們的臨牀試驗或任何未來合作者的臨牀試驗可能無法識別不良副作用。臨牀試驗的本質是利用潛在患者羣體的樣本。由於患者數量有限,我們的候選產品罕見且嚴重的副作用可能只有在使用候選產品的患者數量顯著增加時才會被發現。如果我們的候選產品,包括用於交付此類候選產品的醫療器械,如我們的GH001專有氣霧劑輸送裝置獲得上市批准,而我們或其他人在獲得批准後發現此類候選產品(或任何其他類似產品)造成的不良副作用,可能會導致許多潛在的重大負面後果,包括:
|
•
|
監管部門可以撤回或限制對此類候選產品或醫療器械的批准;
|
|
•
|
監管當局可能要求添加標籤聲明,如“方框警告”或禁忌症;
|
|
•
|
我們可能會被要求改變這些候選產品的分發或管理方式,或者改變候選產品或醫療器械的標籤;
|
|
•
|
FDA可能要求REMS降低風險,其中可能包括用藥指南、醫生溝通計劃或確保安全使用的要素,如受限分發方法、患者登記和其他風險最小化工具,而其他司法管轄區的監管機構可能要求類似的風險緩解計劃;
|
|
•
|
我們可能會受到監管調查和政府執法行動的影響;
|
|
•
|
FDA、EMA或類似的外國監管機構可能要求我們進行額外的技術開發工作或臨牀試驗或昂貴的上市後測試和監督,以建立和監督產品的安全性和有效性;
|
|
•
|
我們可能會被起訴,並對接觸或服用我們的候選產品或操作我們的醫療器械的個人造成傷害承擔責任;以及
|
|
•
|
我們的聲譽可能會受損。
|
19
目錄表
此外,參與我們試驗的患者可能會服用抗抑鬱藥或其他治療抑鬱症和/或情緒障礙的藥物,或可能與我們的候選產品相互作用的其他藥物
,而參與我們的臨牀試驗目前要求患者在試驗期間暫停大多數此類現有藥物或治療。如果患者選擇恢復他或她的現有藥物治療,
不能保證此類藥物將產生與暫停此類藥物之前的治療效果相同的療效(如果有的話)。此外,停用和/或重新服用現有藥物的影響可能會產生不良的副作用,或導致嚴重的精神創傷。參與我們的臨牀試驗的患者的任何此類負面反應都可能降低患者參與我們試驗的意願,影響我們的臨牀試驗的時間或結果、候選產品的開發和審批過程,或者造成公眾對我們候選產品的負面印象,這反過來可能會顯著影響我們將候選產品成功商業化的能力。
這些事件中的任何一項都可能阻止我們實現或保持市場對受影響的候選產品的接受程度,可能會對我們其他候選產品的認知產生負面影響,如果獲得批准,可能會
大幅增加我們候選產品的商業化成本,並顯著影響我們成功將候選產品商業化並創造收入的能力。
如果我們在未來的臨牀試驗中遇到招募患者的困難,我們的臨牀開發活動可能會被推遲或受到其他不利影響
。
由於各種原因,我們可能會在臨牀試驗中遇到患者登記的困難。根據他們的方案及時完成臨牀試驗取決於我們是否有能力招募足夠數量的患者留在研究中,直到研究結束。
患者入選受到許多因素的影響,包括:
|
•
|
方案中規定的患者資格標準;
|
|
•
|
分析試驗的主要終點所需的患者羣體大小;
|
|
•
|
在側重於罕見疾病的臨牀試驗的情況下,患者羣體規模較小,以及患者被漏診或誤診的可能性;
|
|
•
|
患者與試驗地點的距離;
|
|
•
|
試驗的設計;
|
|
•
|
我們有能力招聘具有適當能力和經驗的臨牀試驗研究人員;
|
|
•
|
相互競爭的臨牀試驗以及臨牀醫生和患者對正在研究的候選產品相對於其他可用療法的潛在優勢和風險的看法,包括可能被批准用於我們正在研究的適應症的任何新藥;
|
|
•
|
醫生不願鼓勵患者參與臨牀試驗;
|
|
•
|
我們取得和維持病人同意的能力;以及
|
|
•
|
參加臨牀試驗的患者在完成試驗前退出試驗的風險。
|
此外,我們的臨牀試驗將與其他臨牀試驗爭奪與我們的候選產品具有相同治療領域的候選產品,包括研究N-甲基-D-天冬氨酸拮抗劑、神經類固醇和甲布替寧(5-甲氧基-N,N-二甲基色胺或5-MeO-DMT)的候選產品,以及其他5-羥色胺能迷幻劑,如裸蓋菇素和N,N-二甲基色胺。這項競爭將減少我們可以使用的患者數量和類型,因為一些可能選擇參加我們的試驗的患者可能會選擇參加由我們的競爭對手進行的試驗。由於合格臨牀研究人員的數量有限,我們預計將在我們的一些競爭對手使用的相同臨牀試驗地點進行我們的一些臨牀試驗,這將減少此類臨牀試驗地點可用於我們臨牀試驗的患者數量,或者可能導致競爭試驗之間的
招募偏差,從而可能影響這些試驗的結果。
20
目錄表
我們無法招募足夠數量的患者參加臨牀試驗,這將導致嚴重的延誤,或者可能需要我們完全放棄一項或多項臨牀試驗。
患者登記的延遲可能會導致成本增加,影響計劃的臨牀試驗、候選產品開發和審批流程的時間或結果,並危及我們尋求和獲得開始產品銷售和創造收入所需的監管批准的能力,這可能會阻止這些試驗的完成,對我們推進候選產品開發的能力產生不利影響,導致我們公司的價值下降,並限制我們在需要時獲得額外融資的能力。
我們還被要求在一定的時間範圍內註冊某些臨牀試驗,並將某些已完成的臨牀試驗的結果發佈在政府贊助的數據庫中,例如美國的www.Clinicaltrials.gov和歐盟的類似系統。不這樣做可能會導致罰款、負面宣傳以及民事和刑事制裁。
我們不時宣佈或公佈的臨牀試驗的初步、主要或中期數據可能會隨着更多數據的獲得而發生變化,並受到審計和驗證程序的約束,這些程序可能會導致最終結果發生重大變化,或者可能損害我們的業務、財務狀況、運營結果和前景。
我們可能會不時地公開披露我們臨牀試驗的初步、主要或中期數據,包括我們為當前臨牀試驗披露的數據。初步數據和主要數據基於對當時可用數據的分析,在對與特定研究或試驗相關的數據進行更全面的審查後,結果以及相關的調查結果和結論可能會發生變化。作為我們數據分析的一部分,我們還會進行
假設、估計、計算和結論,而我們可能沒有收到或沒有機會全面而仔細地評估所有數據。因此,一旦收到更多數據並進行充分評估,我們報告的初步或主要結果可能與相同研究的未來結果不同,或者不同的結論或考慮因素可能會使這些結果合格。這種差異可能更加明顯,因為我們的臨牀試驗樣本量較小且持續時間較短。初步或最重要的數據也要接受審計和核實程序,這可能會導致最終數據與我們以前報告的初步數據有很大不同。我們還可能在臨牀試驗完成之前進行計劃中的中期分析,作為臨牀試驗的一部分。我們可能完成的臨牀試驗計劃中的中期分析可能會面臨這樣的風險,即隨着患者登記的繼續和更多患者數據的出現,一個或多個臨牀結果可能會發生實質性變化。因此,在獲得最終數據之前,應謹慎看待中期分析以及初步或最重要的數據。此外,從中期分析中收到的數據可能會促使我們改變試驗設計,甚至完全停止臨牀試驗。最後,我們可能只報告某些終端的中期、初步或主要數據,而不是所有終端的數據。
中期、初步或頂線數據與最終數據之間的不利變化,或最初計劃的試驗設計與由於我們對中期、初步或頂線數據的分析而導致的試驗設計的任何後續更改元素之間的不利變化,可能會嚴重損害我們的業務和潛在客户。我們或我們的競爭對手額外披露中期、初步或頂線數據,或試驗設計的變化,可能會導致我們的普通股價格波動。
此外,包括監管機構在內的其他人可能不接受或同意我們的假設、估計、計算、結論或分析,或者可能以不同的方式解釋或權衡數據的重要性
,這可能會影響特定計劃的價值、啟動進一步臨牀研究的能力、特定候選產品的批准或商業化以及我們公司的整體。此外,我們選擇公開披露的有關特定研究或臨牀試驗的信息通常是從更廣泛的可用信息中挑選出來的。您或其他人可能不同意我們確定要在我們的披露中包含的重要信息或其他適當信息,而我們決定不披露的任何信息最終可能被認為對未來關於特定候選產品或我們業務的決策、結論、觀點、活動或其他方面具有重要意義。如果我們報告的中期、初步或頂線數據與後期、最終或實際結果不同,如果我們因分析中期、初步或頂線數據而改變試驗設計,或者如果其他人,包括FDA、EMA或其他類似的外國監管機構不同意得出的結論,我們啟動進一步臨牀研究或獲得我們候選產品的批准並將其商業化的能力可能會受到損害,這可能會損害我們的業務、財務狀況、運營結果和前景。
GH001、GH002、GH003以及我們正在開發或可能開發的任何潛在的其他候選產品、TRD或任何其他
適應症的市場可能比我們預期的要小。
根據我們的行業知識、行業出版物和第三方研究報告,我們對GH001、GH002、GH003以及我們正在開發或可能開發的任何潛在其他候選產品的潛在市場機會的估計,包括基於我們的行業知識、行業出版物和第三方研究報告的幾個關鍵假設。不能保證這些假設中的任何一個都是準確的,或者仍然是準確的。如果
GH001、GH002、GH003以及我們正在開發或可能開發的任何潛在其他候選產品(TRD或任何其他適應症)的實際市場比我們預期的要小,我們的收入(如果有)可能是有限的,
我們可能更難實現或保持盈利。
21
目錄表
我們在未來發現或發現更多候選產品的努力可能不會成功。
我們的研究計劃最初可能在確定潛在候選產品方面顯示出希望,但由於許多
原因而未能產生用於臨牀開發或商業化的候選產品,包括:
|
•
|
我們無法設計出具有我們所希望的藥理或藥代動力學特性的候選產品;或
|
|
•
|
在進一步的研究中,潛在的候選產品可能會被證明具有有害的副作用或其他特徵,表明它們不太可能是將獲得上市批准並獲得市場接受的藥物。
|
確定新產品候選產品的研究項目需要大量的技術、財力和人力資源。如果我們無法確定用於非臨牀和臨牀開發的合適化合物,我們將無法在未來期間獲得產品收入,這可能會對我們的財務狀況造成重大損害,並對我們上市普通股的市場價格造成不利影響。
我們可以在美國、歐洲或其他司法管轄區為我們的候選產品進行臨牀試驗,FDA、EMA和適用的外國監管機構可能不接受在這些司法管轄區以外進行的試驗數據。
我們可能會選擇在美國、歐洲或其他外國司法管轄區進行一項或多項臨牀試驗。接受來自在任何此類司法管轄區以外進行的非臨牀研究和臨牀試驗的研究數據可能受到某些接受條件的限制。例如,如果外國臨牀試驗的數據打算用作在美國上市批准的基礎,FDA通常不會僅根據外國數據批准申請,除非(I)數據適用於美國人羣和美國醫療實踐;以及(Ii)試驗由具有公認能力的臨牀研究人員進行,並且
符合良好臨牀實踐或GCP法規。此外,必須滿足FDA的臨牀試驗要求,包括足夠大的患者羣體和統計能力。許多外國監管機構,如EMA,
都有類似的審批要求。此外,此類外國審判將受進行審判的外國司法管轄區適用的當地法律管轄。不能保證FDA、EMA或任何適用的外國監管機構會接受在美國或適用司法管轄區以外進行的試驗數據。考慮到我們已完成和現有試驗的樣本數量有限,FDA可能最終不會接受我們的數據。例如,我們目前完成的臨牀試驗只在荷蘭進行;我們正在進行的臨牀試驗只在歐洲進行,我們也在將必要的準備工作進展到可能進行的
在歐洲使用我們的專利設備(GH001-HV-106)在健康志願者中進行的第一階段臨牀藥理學試驗。如果FDA、EMA或任何適用的外國監管機構不接受此類數據,將
導致需要額外的試驗,這將是昂貴和耗時的,並延誤我們業務計劃的各個方面,並可能導致我們的候選產品在適用的司法管轄區無法獲得商業化批准或許可
。
FDA授予的突破性療法指定或快速通道指定,即使授予我們的任何候選產品,也可能不會導致更快的開發或監管審查或審批過程,也不會增加我們的候選產品獲得上市批准的可能性。
我們目前沒有為我們的任何候選產品申請突破療法認證,但如果我們認為可以滿足此類認證的資格標準,我們可能會為我們計劃在美國開發的任何候選產品尋求突破療法認證。突破療法被定義為一種旨在單獨或與一種或多種其他藥物聯合治療嚴重或危及生命的疾病或狀況的藥物,且初步臨牀證據表明,該藥物可能在一個或多個臨牀重要終點顯示出比目前批准的療法有實質性改善的效果,例如在臨牀開發早期觀察到的實質性治療效果。對於被指定為突破性療法的藥物,FDA和試驗贊助商之間的互動和溝通可以幫助確定臨牀開發的最有效途徑,同時將無效對照方案中的患者數量降至最低。
22
目錄表
FDA有權決定突破療法的標準是否已經滿足,以及是否向候選產品授予突破療法稱號。因此,即使我們認為我們開發的候選產品符合指定為突破性療法的標準,FDA也可能不同意,並決定不進行此類指定。在任何情況下,與根據FDA傳統程序考慮批准的藥物相比,收到針對
候選產品的突破療法指定可能不會帶來更快的開發過程、審查或批准,也不能確保FDA最終批准。此外,即使在向我們的候選產品授予突破療法稱號
之後,FDA也可能會在以後決定這些藥物不再符合資格條件,並撤回該稱號。
我們目前沒有針對我們的任何候選產品在歐盟獲得快速通道指定或接受加速評估,但我們可能會為我們計劃在美國和歐盟開發的候選產品尋求此類指定,如果我們認為此類指定/評估的資格標準已經滿足的話。如果產品旨在用於治療嚴重或危及生命的疾病,並且非臨牀或臨牀數據顯示有可能滿足這種疾病未得到滿足的醫療需求,則產品贊助商可以申請快速通道認證或加速評估。FDA和EMA各自擁有廣泛的自由裁量權,以決定是否授予該認證
,因此,即使我們認為特定的候選產品有資格獲得該認證/評估,我們也不能保證FDA或EMA會決定授予該認證。即使我們確實獲得了Fast Track認證和/或加速的評估,與傳統的FDA或EMA程序相比,我們可能也不會體驗到更快的開發流程、審查或批准。如果FDA或EMA認為我們的臨牀開發計劃的數據不再支持該指定或途徑,則FDA或EMA可能會分別撤回快速通道指定或加速評估。許多獲得快速通道指定和/或加速評估的藥物未能獲得監管部門的批准。
我們可能會在美國為我們的一個或多個候選產品申請孤兒藥物稱號,但我們可能無法獲得或保持這樣的
稱號或與孤兒藥物狀態相關的好處,包括市場獨家經營權,這可能會導致我們的收入(如果有)減少。
由於我們正在考慮為我們認為罕見的適應症開發GH001、GH002和/或GH003,因此我們可能會選擇在計劃開展開發活動的司法管轄區為我們的候選人尋求適用的孤兒稱號
。
在美國,根據《孤兒藥品法》,FDA可以授予用於治療罕見疾病或疾病的藥物或生物的孤兒稱號,該疾病或疾病的定義是在美國患者人數少於200,000人或在美國患者人數超過200,000人的疾病或情況,但無法合理預期在美國開發和提供該藥物或生物藥物或生物藥物的成本將從該藥物或生物藥物或生物藥物在美國的銷售中收回。在提交新藥申請或NDA之前,孤兒藥物指定必須得到FDA的請求和批准。在美國,指定孤兒藥物使當事人有權獲得經濟激勵,如税收優惠和用户費用減免。FDA批准孤兒藥物指定後,將公開披露該藥物的仿製藥身份及其潛在的孤兒用途。指定孤兒藥物不會在監管審查和審批過程中傳遞任何優勢,也不會縮短監管審批過程的持續時間。在某些情況下,FDA也可以撤銷這種指定,例如,如果FDA發現申請人的指定請求遺漏了《孤兒藥劑法》及其實施條例所要求的材料信息。
如果具有孤兒藥物名稱的產品隨後獲得了FDA對其具有此類名稱的疾病的特定活性成分的第一次批准,則該產品有權獲得孤兒產品獨家經營權。這意味着FDA在七年內不得批准同一藥物和同一適應症的任何其他營銷申請,除非在有限的情況下,例如顯示出對具有孤兒獨家專利的產品的臨牀優勢,或者FDA發現孤兒獨家專利的持有者沒有證明它可以確保足夠數量的孤兒產品可用,以滿足疾病患者或指定藥物的
條件的患者的需求。此外,如果申請人在一段時期的孤兒藥品市場獨家銷售期間無法生產足夠的產品供應,FDA可以放棄孤兒獨家銷售。
23
目錄表
我們可能會在歐盟為我們的一個或多個候選產品申請孤兒藥物稱號,但我們可能無法獲得或保持這樣的稱號或與孤兒藥物狀態相關的
福利,包括市場獨家經營權,這可能會導致我們的收入(如果有)減少。
在歐盟,EMA可能會為以下藥物授予孤兒稱號:(I)用於治療、預防或診斷危及生命或慢性衰弱的疾病;(Ii)歐盟的流行率不超過萬分之五,或者該藥物的營銷不太可能產生足夠的回報,以證明其開發所需的投資是合理的;以及(Iii)不能授權有關疾病的診斷、預防或治療的令人滿意的方法,或者,如果存在這種方法,藥物必須對受該疾病影響的人有重大益處。
在歐盟,孤兒藥認定在監管審查和批准過程中沒有任何優勢,也不會縮短監管審查和批准過程的時間。歐盟孤兒藥認定的好處是科學性
建議,並延長市場獨佔權,或在創新產品八年市場獨佔權的基礎上再延長兩年。在某些情況下,EMA也可以撤銷此類指定,例如,如果標準不
更長時間滿足,這可能例如由於競爭對手的產品在市場上變得可用而發生。我們無法獲得或維持此類指定或與孤兒藥狀態相關的利益可能會對我們
實現或維持盈利能力。
在一個司法管轄區內獲得並保持我們的候選產品和交付此類候選產品所需的醫療器械的監管批准
並不意味着我們將成功地獲得或維持我們的候選產品和醫療器械在其他司法管轄區交付此類候選產品所需的監管批准。
在某一司法管轄區獲得並維持我們的候選產品和交付此類候選產品所需的醫療器械的監管批准並不能保證我們能夠
在任何其他司法管轄區獲得或維持監管批准,但在一個司法管轄區未能或延遲獲得監管批准可能會對其他司法管轄區的監管批准流程產生負面影響。例如,即使FDA授予
候選產品和交付該候選產品所需的器械的批准,其他司法管轄區(包括歐洲)的類似監管機構也必須批准候選產品的製造、營銷和銷售,
在這些司法管轄區交付此類候選產品所需的器械。批准程序因轄區而異,可能涉及與美國不同的要求和行政審查期限,包括額外的
非臨牀研究或臨牀試驗,因為在一個司法管轄區進行的臨牀試驗可能不被其他司法管轄區的監管機構接受。在美國以外的許多司法管轄區,候選產品和器械還必須
在該司法管轄區內批准銷售之前批准報銷。在某些情況下,我們擬對產品收取的價格也須經政府批准。
獲得外國監管機構的批准並遵守外國監管要求可能會給我們帶來重大延誤、困難和成本,並可能會延遲或阻止
我們的產品在某些國家的推廣。如果我們或與我們合作的任何合作伙伴未能遵守國際市場的監管要求或未能獲得適用的營銷批准,我們的目標市場將減少,我們的
實現我們候選產品的全部市場潛力的能力將受到損害。
即使我們或任何未來的合作者獲得了我們的候選產品和醫療器械的監管批准,
我們產品的批准條款和持續監管可能會限制我們生產和銷售產品的方式,這可能會損害我們產生收入的能力。
一旦獲得監管批准,批准的產品及其製造商和營銷商將受到持續的審查和廣泛的監管。我們以及任何未來的合作者必須
因此,遵守我們或他們獲得監管批准的任何候選產品的廣告和促銷要求。有關處方藥的促銷信息須遵守各種法律
和法規限制,並且必須與產品批准標籤中的信息一致。因此,我們和任何未來的合作者將無法推廣我們為適應症或用途開發的任何產品,而這些產品不是
參閲會議過程
24
目錄表
此外,獲批產品的製造商及其設施還必須遵守廣泛的監管要求,包括FDA當局的要求,以確保
質量控制和生產程序符合cGMP,包括與質量控制和質量保證相關的要求以及相應的記錄和文件保存和報告要求。我們我們
合約製造商、任何未來合作者及其合約製造商將接受監管機構的定期突擊檢查,以監察及確保符合cGMP。儘管我們努力檢查和驗證
監管合規,監管檢查時可能會發現我們的一家或多家第三方生產供應商不符合cGMP要求,這可能導致第三方供應商關閉或藥品失效
批次或過程。在某些情況下,可能需要或需要進行產品召回,這將嚴重影響我們供應和銷售藥品的能力。
因此,假設我們或任何未來的合作者獲得了一個或多個候選產品的監管批准,我們和任何未來的合作者以及我們和他們的合同
製造商將繼續花費時間、金錢和精力在所有符合法規的領域,包括製造、生產、產品監督和質量控制。
如果我們或任何未來的合作者無法遵守批准後監管要求,我們或任何未來的合作者可能會撤銷我們產品的監管批准
監管機構和我們或任何未來合作者的營銷任何未來產品的能力可能會受到限制,這可能會對我們實現或維持盈利能力產生不利影響。此外,符合批准後要求的成本
法規可能對我們的經營業績和財務狀況產生負面影響。
在我們的非臨牀研究和臨牀研究期間,監管要求、監管指南或監管解釋或非預期事件的變更
可能會對我們的候選產品進行試驗,這可能會導致非臨牀研究和臨牀試驗方案發生變化,或者需要進行額外的非臨牀研究和臨牀試驗,這可能會增加我們的成本,並可能
推遲我們的發展時間表。
在我們的非臨牀研究和臨牀試驗期間,監管要求、監管指南或監管解釋的變更或非預期事件可能會迫使我們修改非臨牀
研究和臨牀試驗方案或適用的監管機構可能會施加額外的非臨牀研究和臨牀試驗要求。監管要求、監管指南或監管解釋的任何變更
適用於新型候選產品(如我們的產品)的任何此類變更可能比適用於其他更知名或更廣泛研究的療法的任何此類變更更容易發生。我們臨牀試驗方案的修訂或變更通常
需要重新提交給適用的監管機構和IRB進行審查和批准,這可能對臨牀試驗的成本、時間或成功完成產生不利影響。這些決策可能會增加成本,並導致我們無法滿足
預期的時間表以及相應地,我們的業務和財務前景可能會受到不利影響。同樣,對我們的非臨牀研究進行修訂可能會對這些非臨牀研究的成本、時間或成功完成產生不利影響。
如果我們延遲完成或終止任何非臨牀研究或臨牀試驗,或者如果我們被要求進行額外的非臨牀研究或臨牀試驗,則開發途徑和最終商業化
前景,因為我們的候選產品可能會受到損害,我們從最終產品中產生產品收入的能力(如果有的話)將被推遲。
我們可能會因在臨牀試驗中使用我們的候選產品而受到產品責任訴訟,或者,如果獲得,則遵循我們的產品
市場批准和商業化。對我們或我們未來的任何合作者提起的產品責任訴訟可能會轉移我們的資源和注意力,要求我們停止臨牀試驗,導致我們承擔重大責任或
限制我們候選產品的商業化。
我們面臨着潛在的產品責任風險,這些風險存在於生物製藥產品的研究、開發、製造、營銷和使用中。目前,我們沒有
已被批准用於商業銷售的產品;但是,我們和任何合作者在臨牀試驗中使用我們的候選產品和醫療設備來交付此類候選產品可能會使我們面臨責任索賠。如果候選產品和提供此類候選產品的醫療器械獲得監管部門的批准並投入商業使用,我們將面臨更大的風險。如果我們開發的任何候選產品或醫療設備在產品測試、製造、營銷或銷售過程中據稱造成傷害或不適合人類使用,則可能會向我們、我們的供應商或我們的合作伙伴提出產品責任索賠。任何此類產品責任索賠可能
包括製造缺陷、設計缺陷、未能就產品固有的危險發出警告、疏忽、嚴格責任和違反保修的指控。也可以根據州消費者保護法提出索賠。
參與我們臨牀試驗的參與者、患者、醫療保健提供者、生物製藥公司、我們的合作者或使用、管理或銷售我們未來批准的任何產品的其他人都可以提出此類索賠。如果我們不能成功地針對任何此類索賠為自己辯護,我們可能會招致重大責任或被要求限制我們候選產品的商業化。即使是成功的防禦也需要大量的財政和管理資源。
25
目錄表
無論是非曲直或最終結果如何,產品責任索賠都可能導致:
|
•
|
對我們未來批准的任何產品的需求減少;
|
|
•
|
損害我們的聲譽;
|
|
•
|
由監管機構發起調查;
|
|
•
|
臨牀試驗參與者的退出;
|
|
•
|
終止臨牀試驗地點或整個試驗項目;
|
|
•
|
鉅額訴訟費用;
|
|
•
|
給予患者或其他索賠人鉅額金錢賠償,或與其達成代價高昂的和解;
|
|
•
|
經批准的藥品可以用於的產品召回或者適應症的變更;
|
|
•
|
收入損失;
|
|
•
|
從我們的業務運營中分流管理和科學資源;以及
|
|
•
|
無法將我們的候選產品商業化。
|
儘管臨牀試驗過程旨在識別和評估潛在的副作用,但臨牀開發並不總是完全描述新藥的安全性和有效性,而且即使在監管部門批准之後,藥物也總是有可能表現出不可預見的副作用。如果我們的候選產品在臨牀試驗期間或批准後導致不良副作用,我們可能會承擔重大責任。醫生和患者可能不遵守任何警告,以確定已知的潛在不良反應和患者誰不應該使用我們的產品候選。如果我們的任何候選產品被批准用於商業銷售,
我們將高度依賴消費者對我們的看法以及我們產品的安全和質量。如果我們受到與疾病相關的負面宣傳或因醫生或患者使用或誤用我們的產品或其他公司分銷的任何類似產品而產生的其他不良影響,我們可能會受到不利影響。
我們維持僅限於臨牀試驗責任的產品責任保險,該保險可能不完全涵蓋我們可能產生的潛在責任。任何產品責任
訴訟或其他訴訟的費用,即使解決對我們有利,也可能是巨大的。如果我們將任何獲得監管部門批准的產品商業化,我們將需要增加我們的保險覆蓋面。此外,保險覆蓋範圍也變得越來越昂貴。如果我們不能以可接受的成本維持足夠的保險範圍,或以其他方式防範潛在的產品責任索賠,可能會阻止或抑制我們候選產品的開發和商業生產和銷售,這可能會損害我們的業務、財務狀況、運營結果和前景。
我們在技術和科學快速變化的環境中面臨着激烈的競爭,我們的競爭對手有可能在我們之前獲得監管部門的批准,或者開發比我們更安全、更先進或更有效的療法,這可能會對我們成功營銷或商業化我們可能開發的任何候選產品的能力產生負面影響,並最終損害我們的財務狀況。
新藥產品的開發和商業化競爭激烈。對於我們尋求開發或商業化的任何候選產品,我們都可能面臨來自全球生物製藥公司的競爭。潛在競爭對手還包括學術機構、政府機構和其他進行研究、尋求專利保護併為研究、開發、製造和商業化建立協作安排的公共和私人研究組織。
26
目錄表
具體地説,我們面臨着來自501(C)(3)非營利性醫學研究組織的競爭,其中包括烏索納研究所。此類非營利組織可能願意以成本或免費方式提供治療,
這會破壞我們對GH001、GH002、GH003以及我們可能開發的任何其他候選產品的潛在市場。此外,一些營利性生物技術公司或機構正在專門開發美布福寧(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)或其他色胺,如裸蓋菇素和N,N-二甲基色胺,以治療包括TRD在內的精神健康疾病。這些競爭對手包括阿泰生命科學公司、貝克利精神病學公司、指南針路徑公司、Cybin公司、Mindmed公司和Viridia生命科學公司。此外,越來越多的公司正在加緊努力發現新的精神活性化合物。尋求開發精神活性產品和治療精神健康疾病(如抑鬱症)的公司數量也可能會增加。如果我們的任何競爭對手的療法在我們之前獲得保密協議,並設法獲得更廣泛適應症的批准,從而接觸到更廣泛的患者羣體,我們可能面臨來自這些潛在療法的更激烈的競爭,並在贏得市場對我們的GH001、GH002和GH003候選產品或任何未來候選產品的接受方面面臨更大的困難。所有這些風險都會增加,因為美布福寧是一種已知的自然生成物質,因此不受專利保護,可能被認為是GH001、GH002和GH003的合適替代品。
我們還面臨着來自大小製藥、生物製藥和生物技術公司的競爭,這些公司已經或正在開發治療MDD和TRD的療法,包括Axome Treeutics、Neumora Treeutics、Relmada Treeutics和Sage Treeutics,並且未來還將面臨我們可能尋求用我們的GH001、GH002和GH003候選產品治療的任何其他適應症的競爭。目前有許多公司營銷和銷售用於治療抑鬱症的產品或療法,或正在致力於產品或療法的開發,包括抗抑鬱藥,如選擇性5-羥色胺再攝取抑制劑,或SSRIs,以及5-羥色胺能去甲腎上腺素再攝取抑制劑,或SNRI,抗精神病藥物,認知行為療法,或CBT,埃斯氯胺酮和氯胺酮,重複經顱磁刺激,或rTMS,電驚厥療法,或ECT,迷走神經刺激,或VNS,腦深部刺激,或DBS,N-甲基-D-天冬氨酸拮抗劑,神經類固醇以及其他5-羥色胺能迷幻劑,如裸蓋菇素和N,N-二甲基色胺等。許多製藥、生物製藥和生物技術競爭對手已經為他們的療法建立了市場,並且比我們擁有更多的財力、技術、人力和其他資源,可能更有能力開發、製造和營銷卓越的產品或療法。此外,許多競爭對手在進行新治療物質的非臨牀研究和人體臨牀試驗以及獲得人類治療性產品的監管批准方面擁有比我們更豐富的經驗。因此,我們的競爭對手可能成功地獲得FDA、EMA或其他類似的外國監管機構對替代或優勢產品的批准。此外,許多競爭對手擁有更高的知名度和更廣泛的協作關係。規模較小和處於早期階段的公司也可能成為重要的競爭對手,特別是通過與大型老牌公司的合作安排。
如果這些競爭對手或我們其他候選產品的競爭對手在我們之前獲得FDA、EMA或其他類似的外國監管機構的批准,我們的候選產品將不會
成為市場上的第一個治療方案,我們的市場份額可能會受到限制。除了來自針對我們目標適應症的其他公司的競爭外,我們可能開發的任何產品也可能面臨來自其他類型療法的競爭。
我們當前或潛在的許多競爭對手,無論是單獨或與其戰略合作伙伴一起,都擁有:
|
•
|
比我們在產品發現、開發、製造和商業化的每個階段擁有更多的財政、技術和人力資源;
|
|
•
|
在非臨牀研究、進行臨牀試驗、獲得監管批准以及製造、營銷和銷售藥品方面擁有更豐富的經驗;
|
|
•
|
更發達的知識產權組合;
|
|
•
|
已獲批准或處於後期開發階段的產品;以及
|
|
•
|
在我們的目標市場與領先的公司和研究機構達成合作安排。
|
27
目錄表
生物製藥行業的合併和收購可能會導致更多的資源集中在我們數量較少的競爭對手身上。規模較小或處於早期階段的公司也可能成為重要的競爭對手,特別是通過與大公司和成熟公司的合作安排。這些競爭對手還在招聘和留住合格的科學和管理人員、為臨牀試驗建立臨牀試驗場地和患者註冊以及在獲取與我們的計劃互補或必要的技術方面與我們展開競爭。如果我們的競爭對手
開發和商業化比我們可能開發的任何產品更安全、更有效、副作用更少或更少、更方便或更便宜的產品,我們的商業機會可能會減少或消失。此外,目前批准的產品可能被發現
申請治療我們的目標疾病適應症或類似適應症,這可能使此類產品比我們的候選產品具有顯著的監管和市場時機優勢。我們的競爭對手還可能比我們更快地獲得FDA、EMA或其他類似的外國監管機構對其產品的批准,並可能因我們的目標而從FDA獲得孤立的產品獨家經營權,這可能會導致我們的競爭對手在我們能夠進入市場之前
建立強大的市場地位。此外,我們的競爭對手開發的產品或技術可能會使我們的潛在候選產品不經濟或過時,我們可能無法成功
營銷我們可能針對競爭對手開發的任何候選產品。
此外,我們可能面臨與我們的競爭對手的產品相關的專利的範圍、所有權、有效性和/或可執行性的訴訟或其他訴訟,我們的競爭對手可能會聲稱我們的產品侵犯、挪用或以其他方式侵犯他們的知識產權。我們競爭對手的產品供應可能會限制我們
可能開發和商業化的任何產品的需求和我們能夠收取的價格。
我們的可吸入GH001美布福寧(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)候選產品通過吸入霧化設備產生的氣霧劑來傳遞,該設備受美國和其他司法管轄區設備法規的約束。FDA、EMA或其他類似的外國監管機構可能不接受該設備進行臨牀試驗。
在目前和以前的臨牀試驗中,GH001已經使用我們從市場上從第三方購買的設備進行了蒸發。此設備曾在歐洲和美國的其他
締約方與其他產品或候選產品一起進行的試驗中使用。然而,不能保證FDA或其他類似的外國監管機構會允許它在未來的試驗中與GH001一起使用。此外,
我們可能會在未來的臨牀試驗中決定使用與我們以前使用的不同的設備,FDA或其他類似的外國監管機構也可能同樣反對對GH001使用任何此類設備。例如,在2021年,我們開始為GH001開發一種專有的氣霧劑輸送設備,用於我們的關鍵臨牀試驗計劃和商業用途。根據該專利設備的開發進度,我們於2023年8月提交了用於TRD的GH001的IND
,以便與該設備一起交付,FDA已將其置於臨牀擱置狀態,要求在啟動該設備的臨牀試驗之前提供更多的設備設計驗證信息等。無論如何,在未來的臨牀試驗中使用新設備之前,我們需要做更多的開發工作和進行更多的研究,包括橋接研究,以便將我們以前的設備與我們可能決定使用的任何新設備連接起來。由於更換醫療設備以交付我們的候選產品而造成的任何延誤都將對我們的業務產生實質性的不利影響。
我們沒有與我們目前在臨牀試驗中使用的設備的第三方製造商簽訂商業供應協議,也沒有與任何替代
供應商簽訂許可協議,提供適合從GH001產生從藥物上可接受的氣霧劑的設備。不能保證我們專有的氣霧劑輸送裝置的開發將導致在有效性或安全性方面適合我們
目的的裝置。如果FDA、EMA或其他類似的外國監管機構拒絕接受在我們計劃的臨牀試驗中使用我們的專有氣霧劑設備,並且如果我們無法開發、製造、許可或獲取適合從GH001產生從藥物上可接受的氣霧劑的替代設備,或者如果我們無法獲得當前第三方設備或任何替代設備的足夠供應,則
其他臨牀試驗或上市批准的啟動可能會顯著推遲或阻止。
28
目錄表
可能需要額外的時間才能獲得對GH001的監管批准,因為它是作為一種組合產品管理的,我們預計GH003也是如此。
GH001是通過吸入蒸發裝置產生的氣霧劑來給藥的。該設備是生產氣霧劑所必需的,因此我們預計它將作為藥物-設備組合產品受到FDA的監管,需要FDA、EMA或其他類似的外國監管機構或通知機構對其設備和藥物成分進行審查。同樣,我們預計通過鼻腔設備輸送的GH003將作為藥物-設備組合產品受到FDA的監管。然而,對於GH002,這是我們的靜脈注射美布汀(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)配方,這樣的分類將取決於我們對其商業展示的最終選擇。在美國和歐洲,含有新藥、生物製品或醫療器械組合的醫療產品可能被監管為“組合產品”。組合產品通常被定義為由來自兩個或更多監管類別(例如,藥物/裝置、裝置/生物、藥物/生物)的成分組成的產品。組合產品的每個成分都符合FDA對該類型
成分的要求,無論是新藥、生物或設備。為了促進組合產品的上市前審查,FDA指定其一箇中心根據FDA對組合產品的主要作用模式的確定,對整個產品的上市前審查和監管擁有主要管轄權。如果在單一申請下尋求批准藥物和設備,審批過程可能會因為審查過程的複雜性而延遲
。EMA對組合產品有一個平行的審查程序,其在批准和時機方面的潛在影響可能獨立地影響我們在歐洲銷售我們的組合產品的能力。
與受管制物質有關的風險
GH001、GH002和GH003,以及我們未來可能開發的任何候選產品,都必須遵守產品銷售地區的受控物質法律法規,如美國、歐盟、英國和歐洲其他地區以及聯合國國際藥物管制條約,如果不遵守這些法律和法規,或遵守這些法律和法規的成本,可能會對我們在臨牀開發和批准後的業務運營結果以及我們的財務狀況產生不利影響。此外,在GH001、GH002和GH003的審查過程中,在批准之前,FDA、EMA和/或其他類似的外國監管機構可能需要額外的數據,包括關於GH001、GH002或GH003是否具有濫用或誤用潛力的數據。這可能會推遲審批和任何潛在的重新安排進程。
在美國,美布汀(5-甲氧基-N,N-二甲基色胺,或5-甲氧基色胺,或5-甲氧基色胺)根據聯邦CSA和條例被歸類為受控物質或受管制物質,具體而言,被歸類為附表一物質。DEA將化合物作為附表I、II、III、IV或V類物質進行管理。根據定義,附表1物質有很高的濫用可能性,目前在美國沒有“公認的醫療用途”,在醫療監督下使用缺乏公認的安全性,並且不能在美國開具處方、銷售或銷售。在美國被批准用於醫療用途的藥品可能被列為附表II、III、IV或V,其中附表II被認為是濫用或依賴的可能性最高的物質,而附表V物質被認為是此類物質中濫用的相對風險最低的物質。附表一和附表二的藥品受到CSA最嚴格的管制,包括製造和採購配額、安全要求和進出口限制。此外,附表II藥物的處方和配發也受到進一步限制。例如,附表II處方必須包含書面簽名
,並且不能在沒有新處方的情況下重新灌裝。此外,美國的大多數州法律(如果不是全部的話)都將美布替寧歸類為附表I管制物質。對於任何含有美布替寧的產品要在美國進行商業營銷
,必須將美布替寧重新安排到附表II、III、IV或V中,或者DEA必須將含有美布替寧的特定劑型或產品重新安排到附表II、III、IV或V中。
各個州和司法管轄區將需要通過與計劃相關的立法或行政行動進行類似的重新安排。
將DEA的測定重新安排到授權藥物上市的附表(即附表II、III、IV或V)取決於FDA對一種物質或一種物質的特定配方的批准。因此,雖然美布替寧是附表一的受控物質,但FDA批准在美國用於醫療用途的含有美布替寧的產品將符合列入附表II或其他附表的法定標準,因為FDA的批准符合“可接受的醫療用途”的要求。如果GH001、GH002或GH003獲得FDA批准,DEA將需要做出時間表決定,並將美布替寧置於時間表I以外的時間表中,以便在美國將其開給患者。這一時間表的確定將取決於FDA的批准和FDA關於適當時間表的建議。在審查過程中,在批准之前,FDA可能會確定它需要來自非臨牀或臨牀研究的額外數據,包括關於該物質是否有可能濫用或在多大程度上可能被濫用的數據。這可能會延遲
審批和任何可能的重新安排流程。這一延遲將取決於FDA要求的額外數據量。這一時間表決定將要求DEA進行通知和評論規則制定。此類行動將受到公眾意見和行政聽證請求的影響,這可能會影響這些物質的時間和時間表。
29
目錄表
美布福寧(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)目前在美國被歸類為I類藥物,任何含有這種物質的產品,如GH001、GH002和GH003,都必須重新安排上市時間。不能保證DEA會做出有利的調度決策。即使假定在聯邦一級被歸類為附表二或較低的受控物質(即,附表三、四或五),這些物質也需要根據州法律和條例對附表作出決定。
如果獲得FDA的批准,並且如果GH001、GH002或GH003的成品劑型被DEA列為附表II、III或IV受控物質,其製造、進口、出口、國內分銷、儲存、銷售、處方和分發將繼續受到DEA的嚴格監管。此外,最終的計劃流程可能會比CSA中規定的90天截止日期長得多,特別是如果對此計劃有異議,從而推遲了我們的GH001、GH002或GH003候選產品在美國的發佈。此外,FDA、DEA或任何類似的外國監管機構可能會
要求我們生成比我們目前預期的更多的臨牀或其他數據,以確定該物質是否或在多大程度上具有濫用或誤用的可能性,這可能會增加成本和/或推遲GH001、GH002、GH003或任何含有受控物質的未來候選產品的發佈。此外,含有受控物質的候選產品應遵守與製造、儲存、分銷、處方和分配有關的法規,包括:
|
•
|
緝毒局登記和檢查設施。進行研究、製造、分發、進口或出口或分發受控物質的設施必須註冊(獲得許可)才能開展這些活動,並具有DEA所需的安全、控制、記錄保存、報告和庫存機制,以防止藥物丟失和轉移。所有這些設施必須每年更新其註冊,但配藥設施(例如藥房)除外,它們必須每三年更新一次。DEA對某些處理受管制物質的註冊機構進行定期檢查。未能獲得或
保持必要的註冊可能會導致GH001、GH002或GH003的進口、製造或分銷延遲。此外,進口受控物質還需獲得額外的許可或批准,這些許可或批准必須在每次進口之前獲得。不遵守CSA,特別是不遵守規定導致被盜、丟失或轉移,可能會導致監管行動,對我們的業務、財務狀況和運營結果產生重大不利影響。緝毒局可以尋求民事處罰,拒絕續簽必要的登記,或啟動限制、暫停或撤銷這些登記的程序。在某些情況下,違規行為可能導致
刑事訴訟。
|
|
•
|
國家管制物質法。美國個別州也制定了受控物質法律法規。雖然州管制物質法律經常反映聯邦法律,但由於各州是單獨的司法管轄區,它們將需要分別重新安排GH001、GH002或GH003。一些州根據聯邦行動自動安排或重新安排藥物,而其他州則通過制定規則或立法行動來安排藥物。州日程安排可能會推遲我們獲得聯邦監管批准的任何產品的商業銷售,而不利的日程安排將對此類產品的商業吸引力產生重大不利影響。我們或我們的合作伙伴還必須獲得單獨的州註冊、許可或許可證,以便能夠獲取、處理和分發用於臨牀試驗或商業銷售的受控物質,
未能滿足適用的監管要求可能導致除DEA或聯邦法律規定的強制執行和制裁外,各州還將強制執行和制裁。
|
|
•
|
臨牀試驗。由於我們的GH001、GH002和GH003候選產品含有美布替寧,要在獲得批准之前在美國使用GH001、GH002和GH003進行臨牀試驗,我們的每個研究站點必須向DEA提交研究方案,並獲得和維護DEA Schedule I研究員註冊,該註冊將允許這些站點處理和分配GH001、GH002和GH003,並
從我們的進口商獲得產品。如果DEA推遲或拒絕授予研究人員註冊或批准一個或多個研究地點的研究方案,臨牀試驗可能會顯著推遲,我們可能會失去臨牀試驗地點。臨牀試驗的進口商還必須獲得附表一進口商登記和每次進口的進口許可證。我們目前沒有在美國對GH001、GH002或它們的活性成分(即美布替寧)進行任何製造或重新包裝/重新標籤。
|
30
目錄表
|
•
|
審批後進口。如果GH001、GH002或GH003獲得批准並被歸類為附表II、III或IV物質,則進口商在獲得進口商登記併為每批進口貨物申請和領取進口許可證(附表II)或提交進口申報(附表III或IV)的情況下,可將其進口用於商業目的。DEA向聯合國國際麻醉品管制局提供年度評估/估計,該委員會指導DEA批准進口的受控物質的數量。未能確定進口商或獲得必要的進口授權,包括具體的數量,可能會影響GH001、GH002或GH003的供應,並對我們的業務、運營結果和財務狀況產生重大不利影響。此外,附表II進口商登記的申請必須
在《聯邦登記冊》上公佈,並有通知和評議期以接受公眾意見。不利意見總是有可能延誤進口商登記的批准。如果GH001、GH002或GH003獲得批准並被歸類為附表二管制物質,聯邦法律可能禁止將該物質進口用於商業目的。如果GH001、GH002或GH003被列為附表II物質,我們將不被允許進口用於商業目的的藥物,除非DEA確定國內供應不足或國內製造商對DEA所定義的物質沒有足夠的國內競爭。此外,附表一管制的物質,包括美布替寧,從未在藥品監督管理局登記用於商業目的的進口,僅用於科學和研究需要。因此,如果既不能進口GH001、GH002或GH003,也不能進口其藥物,則GH001、GH002和GH003必須完全在美國製造,我們需要確保有一家制造商需要為該活動獲得和維護單獨的DEA註冊。
|
|
•
|
美國的製造業。如果由於附表II(可能還有附表III)分類或自願在美國進行製造或重新包裝/重新貼標籤用於商業目的,美布替寧將受到DEA制定的年度總產量報價的約束,我們的合同製造商將受到DEA年度和
季度製造和採購配額要求的約束。此外,無論GH001、GH002或GH003的時間表如何,最終劑型中的有效成分目前是附表I受控物質,並將受到配額的限制,因為在臨牀試驗期間,該物質可能仍列在附表I上。分配給我們或我們合同製造商的GH001、GH002或GH003有效成分的年度和季度配額可能不足以完成臨牀試驗或滿足商業需求。因此,DEA在建立我們或我們的合同製造商對受控物質的採購和/或生產配額方面的任何拖延或拒絕都可能
推遲或停止我們的臨牀試驗或產品發佈,這將對我們的業務、財務狀況和運營結果產生重大不利影響。
|
|
•
|
在美國和英國的分銷。如果將GH001、GH002或GH003計劃為附表II、III、IV或V,我們還需要確定具有適當DEA註冊和授權的批發商
,以分銷GH001、GH002、GH003和任何未來的候選產品。這些分銷商將需要維護附表II、III、IV或V的分銷登記。在更廣泛地分配GH001、GH002或GH003的能力方面的這一限制可能會限制商業應用,並可能對我們的前景產生負面影響。未能獲得、延遲獲得或丟失任何這些註冊都可能導致我們的成本增加。如果GH001、GH002或GH003被歸類為第二類藥物,我們供應鏈中的參與者可能必須保持更高的安全性,包括在製造和分銷設施中特別建造保險庫
。這種額外的安全性也可能會阻止一些藥店銷售該產品。此外,GH001、GH002和/或GH003可能需要在我們的試驗地點或其他經過認證的醫療機構進行管理,這可能會限制商業應用。此外,旨在減少處方藥濫用的州和聯邦執法行動、監管要求和立法,例如通過州處方藥監測計劃跟蹤受控物質的處方和分配,可能會使醫生不太願意開出某些受控物質的處方,並使藥店不願分配某些受控物質,特別是附表II產品。同樣,英國藥品和保健品監管機構(MHRA)認為,英國2001年《濫用藥物條例》(該附表包括美布替寧)下的所有附表1藥物都沒有治療作用,只能在英國政府內政部頒發的許可證下進口、出口、生產、供應、擁有等。美布福寧可能永遠不會根據2001年的濫用藥物條例重新安排時間,或者根據英國1971年的濫用藥物法案重新分類(根據該法案,它是A類受控物質)。
|
31
目錄表
美國可能對美布福寧(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)進行重新分類,這可能會給我們的業務帶來額外的監管負擔
並對我們的業務結果產生負面影響。
如果美布替寧,而不僅僅是FDA批准的特定製劑,在CSA下被重新安排為附表II或更低的受控物質(即,附表III、IV或V),那麼對美布替寧進行研究的能力很可能會得到改善。然而,重新安排美布福寧的時間可能會實質性地改變許多聯邦和州機構的執法政策,主要是FDA和DEA。FDA根據《聯邦食品、藥物和化粧品法》(FDCA)的執法權力,負責通過對食品、藥品、補充劑和化粧品等產品的監管,確保公共健康和安全。FDA的職責包括監管成分以及州際商業銷售的藥品的營銷和標籤。由於目前根據聯邦法律,生產和銷售美布替寧是非法的,而且沒有聯邦政府承認的醫療用途,FDA歷來將與美布替寧相關的執法推遲到DEA。如果將美布替寧重新安排到聯邦控制的合法物質上,FDA可能會發揮更積極的監管作用。DEA將繼續積極監管此類物質的製造、分配和分配。多機構執行後重新安排的可能性,包括州機構,如藥房董事會,可能會威脅到我們的業務,或對我們的業務產生實質性的不利影響。
GH001、GH002和GH003含有受管制物質,其使用可能會引起公眾爭議。對於美布福汀(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)和迷幻劑的負面宣傳或公眾看法,或我們目前或未來使用美布福汀的候選產品可能會對這些療法的成功產生負面影響。
含有受控物質的療法可能會引起公眾的爭議。政治和社會壓力以及負面宣傳可能會導致我們可能開發的
GH001、GH002、GH003和任何未來候選產品的審批延遲和費用增加。這些療法的反對者可以尋求限制營銷和撤回任何監管批准。此外,這些反對者可能會試圖在説服醫學界拒絕這些療法的努力中產生負面宣傳。例如,我們可能會面臨媒體對我們臨牀開發計劃的批評。濫用美布替寧帶來的負面宣傳可能會對我們的GH001、GH002和GH003候選產品取得的商業成功或市場滲透率造成不利影響。反迷幻抗議在歷史上曾發生過,也可能發生,並引起媒體的報道。政治壓力和負面宣傳可能會導致GH001、GH002、GH003或任何未來候選產品的延遲、費用增加,並限制或限制其引入和營銷。
如果GH001、GH002、GH003或任何未來的候選產品獲準商業化銷售,我們將高度依賴消費者對我們療法的安全性和質量的看法。如果第三方治療網站、治療師和患者不願意嘗試這種新的治療方法,我們可能會面臨有限的採用。即使含有受控物質的療法被醫生和患者廣泛接受,我們的成功在很大程度上也將取決於我們是否有能力教育和培訓醫生和患者,併成功證明含有受控物質的療法的安全性、耐受性、易用性、有效性、成本效益和其他優勢。媒體對包括美布福寧在內的致幻物質有負面報道的歷史,這可能會影響公眾對我們療法的看法。此外,美布福寧會引起強烈的心理體驗,這可能會阻止患者選擇這個療程。如果我們受到負面宣傳,或者如果我們的任何療法或其他公司分銷的任何類似療法被證明或被斷言對患者有害,我們可能會受到不利影響。由於我們對消費者認知的依賴,患者使用或誤用我們的療法或其他公司分銷的任何類似療法而導致的與疾病相關的任何負面宣傳或其他不良影響都可能對我們的業務、前景、財務狀況和運營結果產生重大不利影響。
如果我們的研究重點放在抑鬱症和精神健康疾病的研究中,未來的不良事件也可能導致更嚴格的政府監管,更嚴格的標籤要求,以及我們療法測試或批准的潛在監管延遲。任何更嚴格的審查都可能推遲或增加獲得監管部門對GH001、GH002、GH003或任何未來候選產品的批准的成本。
32
目錄表
美布福寧(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)被列為美國CSA附表I受控物質,以及其他國家的類似受控物質立法和1971年聯合國精神藥物公約,如果我們遵守這些法律和法規的任何重大違規行為,或法律和法規的變化可能會導致我們的開發活動或業務連續性
中斷。
美布替寧根據CSA被歸類為附表I受控物質,根據英國2001年《濫用藥物條例》被歸類為附表1藥物,並且被大多數國家、外國政府和1971年聯合國精神藥物公約類似地歸類。即使假設GH001、GH002、GH003或任何未來在特定配方或劑型中含有美布替寧的候選產品獲得監管當局的批准和安排,以允許其商業營銷,這些候選產品中的活性藥物成分可能仍然是附表I,或者國家或國外的等價物。違反任何聯邦、州或外國法律和法規,可能會導致聯邦政府或普通公民提起的民事訴訟所產生的鉅額罰款、處罰、行政制裁、定罪或和解,或刑事指控和處罰,包括但不限於利潤返還、停止業務活動、資產剝離或監禁。這將對我們產生重大不利影響,包括我們的聲譽和開展業務的能力、我們普通股的潛在上市
、我們的財務狀況、經營業績、盈利能力或流動資金或我們普通股的市場價格。此外,我們很難估計調查
或為任何此類事件辯護或我們的最終解決方案所需的時間或資源,因為可能需要的時間和資源在一定程度上取決於相關適用當局所要求的任何信息的性質和範圍,而此類時間或資源
可能是大量的。協助或教唆這類活動,或密謀或企圖從事這類活動也是非法的。投資者對此類活動的貢獻和參與可能導致聯邦民事和/或刑事起訴,包括但不限於沒收其全部投資、罰款和/或監禁。
不同的聯邦、州、省和地方法律管轄我們在哪些司法管轄區開展業務或目前計劃在哪些司法管轄區開展業務,我們向哪些司法管轄區出口或計劃向哪些司法管轄區出口我們的產品,包括與健康和安全、我們的業務行為以及我們產品的生產、儲存、銷售和分銷有關的法律。遵守這些法律要求我們同時遵守複雜的聯邦、州、省和/或地方法律。這些法律經常變化,可能難以解釋和適用。為了確保我們遵守這些法律,我們需要投入大量的財政和管理資源。我們無法預測此類法律的成本或它們可能對我們未來運營產生的影響。不遵守這些法律可能會對我們的業務產生負面影響,損害我們的聲譽。這些法律的變化可能會對我們的競爭地位和我們經營的市場產生負面影響,而且不能保證我們經營的司法管轄區的各級政府不會通過對我們的業務產生不利影響的立法或法規。
此外,即使我們或第三方的活動符合美國州或當地法律或我們從事活動的其他國家和地區的法律,潛在的執法程序也可能涉及對我們或第三方施加重大限制,同時轉移主要高管的注意力。此類訴訟可能會對我們的業務、收入、經營業績和財務狀況以及我們的聲譽和前景產生實質性的不利影響,即使此類訴訟的結果對我們有利。在極端情況下,此類訴訟最終可能涉及對我們的主要高管提起刑事訴訟,沒收公司資產,從而導致我們無法繼續業務運營。嚴格遵守有關美布福寧的州和地方法律並不免除我們在美國聯邦法律、歐盟成員國或英國法律下的潛在責任,也不能為可能對我們提起的任何訴訟提供抗辯。對我們提起的任何此類訴訟都可能對我們的運營和財務業績產生不利影響。
儘管目前在美國將美布汀列為附表一管制物質,但根據美國某些州的法律,美布汀的地位可能會發生變化。在沒有監管監督的情況下將美布福汀合法化可能會導致診所的建立缺乏適當的治療基礎設施或充分的臨牀研究,這可能會使患者面臨風險,並給整個行業帶來聲譽和監管風險,使我們更難獲得監管批准。此外,如果我們獲得監管部門的批准,美布替寧的合法化也可能影響我們的商業銷售,因為這將降低進入門檻,並可能增加競爭。
33
目錄表
與我們的候選產品商業化相關的風險
我們獲得上市批准的任何候選產品都將受到廣泛的上市後監管要求的約束,並可能
受到上市後限制或退出市場,如果我們未能遵守監管要求,或者如果我們的產品遇到意想不到的問題,當其中任何產品獲得批准時,我們可能會受到處罰。
即使FDA或類似的外國監管機構批准了我們的任何候選產品和交付此類候選產品所需的醫療器械,我們也將受到適用司法管轄區在製造、標籤、包裝、儲存、廣告、促銷、採樣、記錄保存、進行上市後研究以及提交安全性、有效性和其他上市後信息方面的持續監管要求。
此外,對於我們在批准後進行的任何臨牀試驗,我們將繼續遵守cGMP和GCP要求。
製造商及其工廠必須遵守廣泛的監管機構要求,包括確保質量控制和製造程序符合cGMP
法規。因此,我們和我們的合同製造商將接受持續的審查和檢查,以評估遵守cGMP和遵守在任何營銷申請中做出的承諾,以及之前對檢查
觀察結果的響應。因此,我們和其他與我們合作的人必須繼續在監管合規的所有領域花費時間、金錢和精力,包括製造、生產和質量控制。
對於我們的候選產品和交付此類候選產品所需的醫療器械,我們獲得的任何監管批准都可能受到產品上市的批准指示用途的限制
或受批准條件的限制,或者包含可能代價高昂的上市後測試的要求,包括監控候選產品的安全性和有效性的第4階段臨牀試驗和監測
。在美國,FDA還可能要求將REMS作為批准我們的候選產品的條件,這可能需要對患者的長期隨訪、用藥指南、醫生溝通計劃或確保安全使用的額外
要素的要求,例如受限分發方法、患者登記和其他風險最小化工具。此外,如果FDA或類似的外國監管機構批准我們的候選產品,我們將必須遵守包括提交安全和其他上市後信息、報告和註冊在內的要求。
在美國,如果沒有遵守監管要求和標準,或者產品上市後出現問題,FDA可能會撤回批准。以後
發現我們的候選產品存在以前未知的問題,包括意外嚴重性或頻率的不良事件,或我們的第三方製造商或製造流程,或未能遵守監管
要求,可能導致修訂批准的標籤以添加新的安全信息或其他限制;實施上市後研究或臨牀試驗以評估新的安全風險;或根據REMS實施分銷限制或其他
限制。除其他外,其他潛在後果包括:
|
•
|
對我們產品的製造、經批准的製造商或製造過程的限制;
|
|
•
|
產品從市場上召回或自願召回;
|
|
•
|
要求進行上市後研究或臨牀試驗;
|
|
•
|
罰款、返還或返還利潤或收入;
|
|
•
|
FDA發出的警告信或無標題信件或來自可比外國監管機構的類似違規通知;
|
|
•
|
暫停我們正在進行的任何臨牀試驗;
|
|
•
|
FDA或其他類似的外國監管機構拒絕批准未決的申請或對我們提交的已批准申請的補充,或暫停或撤回上市批准;
|
|
•
|
扣押、扣留或拒絕允許進口或出口產品;以及
|
|
•
|
同意法令、禁令或施加民事或刑事處罰。
|
34
目錄表
監管部門嚴格監管投放市場的產品的營銷、標籤、廣告和促銷。產品只能根據批准的適應症和根據批准的標籤的規定進行促銷。然而,在美國,公司可能會分享與標籤不符的真實且不具誤導性的信息。FDA和其他類似的外國監管機構
積極執行禁止推廣標籤外用途的法律法規,被發現不當推廣標籤外用途的公司可能會承擔重大責任。違反FDCA與推廣處方藥有關的行為也可能導致調查,指控其違反了聯邦和州醫療保健欺詐和濫用法律以及州消費者保護法。因此,只要我們的一個或多個候選產品獲得市場批准,我們和我們的第三方合作伙伴將繼續在所有合規領域投入時間、金錢和精力,包括宣傳和標籤合規、製造、生產、產品監控和質量
控制。
FDA或其他類似外國監管機構的政策可能會發生變化,可能會頒佈額外的政府法規,以阻止、限制或推遲監管部門對我們候選產品的批准。我們無法預測美國或國外未來的立法或行政行動可能產生的政府監管的可能性、性質或程度。如果我們對現有要求或新要求或政策的變更反應遲緩或無法適應,或者如果我們不能保持合規性,我們可能會失去我們可能獲得的任何營銷批准,我們可能無法實現或維持盈利。
如果我們的產品獲得批准,我們的商業成功取決於我們的候選產品在醫生、患者、第三方付款人和醫學界其他成員中獲得顯著的市場接受度。
即使我們開發的任何候選產品獲得了市場批准,它們也可能無法獲得醫生、患者、第三方付款人(如美國的Medicare和Medicaid計劃和管理式護理組織)以及醫學界其他人的足夠市場接受度。此外,旨在降低醫療成本的現有和未來醫療改革措施可能會影響第三方付款人的承保範圍和報銷的充分性。如果我們開發的候選產品沒有達到足夠的接受度,我們可能不會產生顯著的產品收入,我們也可能無法盈利。
任何候選產品如果被批准用於商業銷售,市場的接受程度將取決於許多因素,包括:
|
•
|
與替代療法相比的療效和潛在優勢;
|
|
•
|
有能力提供我們的產品,如果獲得批准,以具有競爭力的價格銷售;
|
|
•
|
與替代療法相比,給藥相對方便和容易;
|
|
•
|
醫學界、醫生和患者對我們產品的安全性和有效性的看法,以及目標患者羣體嘗試新療法的意願和醫生開出這些療法的意願;
|
|
•
|
在我們獲得監管批准的地區,基於我們目標患者亞羣的大小,這類候選產品的市場規模;
|
|
•
|
適用於我們和我們的候選產品的各種科學組織發佈的指南中關於我們候選產品的建議;
|
|
•
|
有實力的銷售、營銷和分銷支持;
|
|
•
|
與其他產品批准有關的任何此類上市批准的時間;
|
|
•
|
對同時使用其他藥物的任何限制;
|
|
•
|
患者權益倡導團體的支持;
|
35
目錄表
|
•
|
媒體對致幻物質的報道;
|
|
•
|
能夠從政府和第三方付款人那裏獲得足夠的第三方保險和足夠的補償;以及
|
|
•
|
任何副作用的流行率和嚴重程度。
|
如果政府和其他第三方付款人不為我們商業化的任何產品提供保險和足夠的補償水平,市場接受度和商業成功將會降低。
我們候選產品在美國的成功商業化將在一定程度上取決於第三方付款人,包括政府機構和私人健康保險公司,在多大程度上提供保險和足夠的報銷水平,以及實施對我們候選產品有利的定價政策。如果我們的候選產品未能獲得或保持承保範圍並獲得足夠的報銷,如果獲得批准,可能會限制我們營銷這些產品的能力,並降低我們創造收入的能力。
對於我們可能獲得監管批准的任何產品的覆蓋範圍和報銷狀態,都存在很大的不確定性。在美國和其他國家/地區,為患者的病情提供醫療服務的患者通常依靠第三方付款人來報銷與其治療相關的全部或部分費用。第三方付款人(包括政府醫療保健計劃(例如,Medicare、Medicaid、TRICARE)、管理型醫療保健提供者、私人健康保險公司、健康維護組織和其他組織)對我們的產品的承保範圍和報銷的充分性是大多數患者能夠負擔得起醫療服務和生物製藥產品(如我們的候選產品)的關鍵。第三方付款人決定他們將支付哪些藥物並建立報銷水平。
在美國,有關新藥報銷的主要決定通常由醫療保險和醫療補助服務中心(CMS)做出,CMS是美國衞生與公眾服務部(HHS)內的一個機構。CMS決定我們的產品是否以及在多大程度上將在聯邦醫療保險下得到覆蓋和報銷,而私人支付者往往在很大程度上遵循CMS。付款人在確定
報銷時考慮的因素取決於產品是否:
|
•
|
在其健康計劃下有保障的福利;
|
|
•
|
安全、有效和醫學上必要的;
|
|
•
|
適用於特定的患者;
|
|
•
|
具有成本效益;以及
|
|
•
|
既不是試驗性的,也不是調查性的。
|
我們能否成功地將我們的候選產品商業化,在一定程度上將取決於我們的產品和相關治療在多大程度上可以從第三方付款人那裏獲得保險和足夠的報銷。此外,付款人決定為產品提供保險並不意味着將批准足夠的償還率。如果無法獲得保險和足夠的報銷,或僅限
個級別,我們可能無法成功地將我們的候選產品商業化。即使提供了保險,批准的報銷金額也可能不足以讓我們建立或保持足夠的定價來實現足夠的投資回報。
在美國,第三方付款人對產品的承保和報銷沒有統一的政策。因此,我們產品的承保範圍和報銷範圍因付款人而異
。確定付款人是否將為產品提供保險的過程可以與設置付款人將為產品支付的償還率的過程分開。一個付款人決定為產品提供保險並不能保證其他付款人也會為該產品提供保險和報銷。第三方付款人還可以將承保範圍限制在批准的清單或配方表上的特定產品,其中可能不包括特定適應症的所有FDA批准的產品。我們不能確定我們的候選產品是否可以獲得保險和報銷,或準確估計其潛在收入。
36
目錄表
如果第三方付款人決定不承保或不單獨報銷使用我們產品的醫療產品或治療,可能會在獲得批准後減少醫生對我們產品的使用。假設第三方付款人承保了我們的候選產品或使用我們候選產品的療法,則由此產生的報銷付款率可能不夠高,或者可能需要患者認為
高得令人無法接受的共同付款。我們不能確保我們當前或未來的候選產品或使用此類候選產品的任何程序都可以在美國獲得保險和報銷,而且可能獲得的任何報銷可能不夠充分,或者未來可能會減少或取消。
此外,美國和海外的第三方付款人加大力度限制或降低醫療成本,可能會導致此類組織限制新批准產品的承保範圍和報銷水平
,因此,它們可能無法為我們的候選產品提供保險或提供足夠的付款。為了確保任何可能被批准銷售的產品的承保範圍和報銷,我們可能需要進行昂貴的
藥物經濟學研究,以證明我們產品的醫療必要性和成本效益,以及獲得FDA、EMA或其他類似外國監管機構批准所需的成本。此外,我們可能還需要
向購買者、私人健康計劃或政府醫療計劃提供折扣。儘管如此,我們的候選產品可能不被認為是醫學上必要的或具有成本效益的。如果第三方付款人認為一種產品與其他可用的療法相比不具有成本效益,他們可能不會在批准後將該產品作為其計劃下的一項福利覆蓋,或者,如果他們認為第三方付款人認為該產品的支付水平不足以讓公司銷售其產品獲利,他們可能不會覆蓋該產品。我們
預計在潛在銷售我們的任何候選產品時,都會遇到來自第三方付款人的定價壓力。
我們的業務和商業化戰略取決於我們識別、鑑定、準備、認證和支持提供我們任何候選產品的第三方診所或治療中心的能力(如果獲得批准)。如果我們不能做到這一點,我們的商業化前景將受到限制,我們的業務、財務狀況和運營結果將受到損害。
我們在GH001、GH002、GH003或任何未來候選產品方面的商業成功(如果獲得批准)將取決於我們識別、鑑定、準備、認證和支持管理我們候選產品的第三方診所或治療中心的能力。我們預計GH001、GH002、GH003和任何未來的候選產品將由認證的醫療保健提供商在合格的第三方診所或治療中心進行管理。
由於我們打算與同意遵守我們的治療方案的第三方中心和提供商合作,可能會在美國的REMS或歐洲的風險管理計劃或RMP下使用受限的分銷方法,因此我們可能會
面臨可用於管理GH001、GH002、GH003或未來的候選產品的站點數量的限制。此外,網站可能難以滿足任何REMS或RMP的要求。對可用於管理GH001、GH002、GH003或未來候選產品的站點的任何限制都可能使一些潛在患者無法或不可能訪問我們的候選產品(如果獲得批准),這可能會限制我們潛在患者羣體的總體規模,並損害我們未來的手術結果。
如果我們無法建立或與根據適用標準(包括地區、國家、州或其他適用標準)認證的足夠的第三方診所或治療中心網絡進行合作,以管理GH001、GH002、GH003或任何未來的候選產品,包括這些第三方診所或治療中心在美國的潛在REMS或歐洲的RMP下可能需要的認證,這將對我們的業務和增長能力產生重大不利影響,並將對我們的運營和商業化努力產生不利影響。
鑑於我們治療的新穎性和預定的藥物方面,第三方診所或治療中心可能面臨額外的財務和行政負擔,以提供任何批准的
治療,包括在美國遵守RMS或在歐洲遵守RMP。第三方診所或治療中心遵守REMS的流程可能既昂貴又耗時,這可能會推遲第三方診所或治療中心管理我們的候選產品的能力,並對我們的商業化進程產生實質性的不利影響。此外,第三方診所或治療中心需要確保擁有必要的基礎設施和設備,以交付GH001、GH002、GH003或任何未來的候選產品,如足夠的輔助設備和足夠的治療室。這可能會阻止第三方診所或治療中心提供GH001、GH002、GH003或任何未來的候選產品,並降低我們擴大網絡和創造收入的能力。
37
目錄表
美國以外的政府傾向於實施嚴格的價格控制,這可能會對我們的收入產生不利影響,如果有的話。
在一些外國國家,藥品的擬議定價必須獲得批准,才能合法上市。除了政府或國家保險公司是否會為產品報銷價格外,一些國家/地區還有單獨的決策流程。各國對藥品定價的要求差別很大。例如:
|
•
|
在歐盟,成員國可以限制其國家醫療保險制度提供報銷的醫療產品的範圍,在大多數歐盟國家,供人使用的醫療產品的價格必須得到國家衞生當局的批准,才能供應;
|
|
•
|
幾乎所有歐盟成員國作出定價決定所依據的共同標準是國際參考定價(所附的方法和權重因國家而異),而在英國,國際參考定價不是定價決策正式依賴的標準;
|
|
•
|
在英國和許多歐盟成員國,品牌藥品的價格必須在產品推出前通知或批准;
|
|
•
|
歐盟/歐洲經濟區(EEA)和英國的補償決定通常基於各種形式的衞生技術評估,包括成本效益確定。從2025年起,歐盟的衞生技術評估條例(條例(EU)2021/2282)或HTA條例將開始生效,規定由歐盟/歐洲經濟區國家報銷機構
考慮對臨牀有效性的共同評估。這不會對英國產生直接影響,但實際上可能會產生影響;以及
|
|
•
|
此外,公共採購招標被廣泛用於醫院採購醫藥產品。
|
即使我們在美國或歐洲獲得了任何候選產品的批准,我們也可能永遠不會在其他國家/地區獲得批准或將此類產品商業化,這將限制我們充分發揮其市場潛力的能力。
為了在美國或歐盟銷售任何產品,我們必須建立並遵守關於安全性和有效性的眾多和不同的監管要求。在一個國家進行的臨牀試驗可能不會被其他國家的監管機構接受,一個國家的監管批准並不意味着將在任何其他國家獲得監管批准。審批程序因國家/地區而異,可能涉及額外的產品測試和驗證以及額外的行政審查期。在我們目前進行的臨牀試驗之外尋求外國監管機構的批准可能會導致我們的重大延誤、困難和成本,並可能需要額外的非臨牀研究或臨牀試驗,這將是昂貴和耗時的。監管要求可能因國家/地區而異,可能會推遲或阻止我們的產品在這些國家/地區推出。滿足這些和其他監管要求是昂貴、耗時、不確定的,而且可能會出現意想不到的延誤。此外,我們未能在任何國家/地區獲得監管批准可能會延遲或對其他國家/地區的監管批准流程產生負面影響
。我們沒有在任何司法管轄區(包括國際市場)批准銷售的任何候選產品,我們也沒有在國際市場獲得監管批准的經驗。如果我們不遵守國際市場的監管要求,或未能獲得並保持所需的批准,我們實現產品全部市場潛力的能力將受到損害。
38
目錄表
我們目前沒有營銷和銷售組織,作為一家公司也沒有將產品商業化的經驗,我們可能不得不投入大量資源來開發這些能力。如果我們無法建立營銷和銷售能力,或無法與第三方達成協議來營銷和銷售我們的候選產品,如果獲得批准,我們可能無法產生
產品收入。
我們沒有內部銷售、營銷或分銷能力,也沒有將產品商業化。如果我們的任何候選產品最終獲得監管部門的批准,我們希望
建立一個具有技術專業知識和支持分銷能力的營銷和銷售組織,以便在主要市場將每種此類產品商業化,這將是昂貴和耗時的。作為一家公司,我們以前在生物製藥產品的營銷、銷售和分銷方面沒有經驗
,建立和管理銷售組織涉及重大風險,包括我們僱用、留住和激勵合格人員、產生足夠的銷售線索、為銷售和營銷人員提供充分培訓以及有效管理分散在不同地理位置的銷售和營銷團隊的能力。如果我們的內部銷售、營銷和分銷能力發展出現任何失敗或延遲,都將對這些產品的商業化產生不利影響。我們還可以選擇與擁有直接銷售隊伍和已建立的分銷系統的第三方合作,以增強我們自己的銷售隊伍和分銷系統,或者代替我們自己的銷售隊伍和分銷系統。我們可能無法按照可接受的財務條款進行協作或聘請顧問或外部服務提供商來協助我們的銷售、營銷和分銷職能,甚至根本無法。此外,如果我們依賴第三方來實現這些功能,我們的產品收入和盈利能力(如果有的話)可能會低於我們自己開發的任何產品的營銷、銷售和分銷
。我們很可能對這樣的第三方几乎沒有控制權,他們中的任何一方都可能無法投入必要的資源和注意力來有效地銷售和營銷我們的產品。如果我們沒有成功地將我們的產品商業化,
無論是我們自己還是通過與一個或多個第三方的安排,我們可能無法在未來產生任何產品收入,我們將招致重大的額外損失。
與持續的監管和法律合規相關的風險
在我們開展業務的國家/地區,税收制度的變化和不確定性可能會對我們的財務狀況和經營業績產生重大不利影響,並減少我們股東的淨回報。
我們計劃在全球開展業務,未來可能會在多個司法管轄區提交所得税申報單。我們的綜合有效所得税率可能受到多個因素的重大不利影響,包括:税法、法規和條約的變化或對其的解釋;正在考慮的税收政策舉措和改革(例如與經濟合作與發展組織或經濟合作與發展組織、税基侵蝕和利潤轉移或BEPS、項目、經合組織的第一支柱和第二支柱以及其他舉措有關的舉措);我們所在司法管轄區税務機關的做法;税務審計或審查產生的問題的解決以及任何相關的利息或處罰。此類變動可能包括(但不限於)對營業收入、投資收入、收到的股息或(在特定的預扣税情況下)支付的股息徵税。
我們無法預測未來可能會提出或實施什麼税制改革,或這些變化將對我們的業務產生什麼影響,但如果這些變化被納入我們運營所在司法管轄區的税收
法律、法規、政策或做法,可能會增加我們迄今已支出並在資產負債表上支付或應計的估計税負,並以其他方式影響我們的財務狀況,
未來運營結果、特定時期的現金流以及我們在我們運營所在國家未來的整體有效税率,降低股東的税後回報,並增加税務合規的複雜性、負擔和成本
。2021年10月7日,愛爾蘭政府批准愛爾蘭加入OECD包容性框架下的OECD BEPS 2.0計劃,以改革國際税收規則。經濟合作與發展組織的BEPS 2.0計劃由兩個截然不同的部分組成:支柱一和支柱二。2021年12月20日,作為BEPS 2.0計劃的一部分,經合組織發佈了全球反基地侵蝕模式規則草案(支柱2),或稱全球規則,旨在確保年收入超過7.5億歐元的跨國企業或跨國公司將適用全球最低15%的有效税率。2023年12月15日,歐盟理事會通過了在歐盟實施全球規則的指令。2023年10月11日,經合組織公佈了與第一支柱A金額有關的一攬子文件,其中包括一項多邊公約。如果以目前的形式實施,第一支柱A將把大型跨國集團的某些利潤重新分配給其客户和用户所在的司法管轄區,並將適用於收入超過200億歐元、盈利能力超過10%的集團(或者,如果一個集團低於這些門檻,但其合併財務報表中披露的業務有一個特定的部門,即超過這些門檻的一個已披露的部門,則規則可能適用於該已披露的部門)。為了使本多邊公約生效,它必須得到至少30個司法管轄區的批准,包括目前預計在A金額範圍內的至少60%的跨國公司的司法管轄區總部。
39
目錄表
税務機關可能不同意我們對某些税收立場的立場和結論,或可能以不可預見的方式適用現有規則,
導致意外成本、税收或無法實現預期收益。
税務機關可能不同意我們已經採取或將採取的税收立場,這可能會導致税收負擔增加。例如,愛爾蘭税務專員辦公室或
税務局或其他税務機關可能會質疑我們未來可能通過税務管轄區進行的收入分配,以及根據未來可能的公司間安排和轉讓定價政策在潛在的未來附屬公司之間支付的金額,包括與我們的知識產權開發相關的支付金額。同樣,税務機關可以斷言,我們在我們認為沒有建立應税聯繫的司法管轄區內納税,
根據國際税務條約,通常被稱為“常設機構”,如果成功,這種斷言可能會增加我們在一個或多個司法管轄區的預期納税義務。此外,税務機關可以斷言我們是
我們認為不在的司法管轄區的税務居民。税收居住地的改變可能會使我們面臨更高的税率或離境税。
税務機關可以採取由我們支付重大税款、利息和罰款的立場,例如,在技術上違反了相對較新的、沒有經過廣泛審查或解釋的相互矛盾的法律和法規,在這種情況下,我們預計我們可能會對此類評估提出異議。知名公司可能特別容易受到激進應用
不明確要求的影響。許多公司必須與税務檢查員談判他們的税單,他們可能會要求比適用法律似乎規定的更高的税收。對這樣的評估提出異議可能會耗時很長且成本高昂,如果我們對評估提出異議失敗,其影響可能會提高我們預期的實際税率(如果適用)。
我們在確定納税申報頭寸時行使重大判斷。税務規章制度非常複雜,不能保證管理層對這些規章制度的解釋和應用
確定納税申報位置是否會被税務機關接受。如果税務機關拒絕本公司的報税立場,可能會對本公司的財務狀況和
經營業績產生重大不利影響。税務機關可能會徵收額外的應税收入或不允許在公司間交易中扣除費用,從而導致一個或多個税務管轄區的納税義務增加。
管理層的經驗是,税務機關可能會採取激進的立場,增加應納税收入和/或不允許扣除費用。如果税務機關在一個或多個司法管轄區成功增加應納税所得額和/或
不允許扣除費用,可能會導致公司經歷更高的實際税率,這可能是實質性的。管理層在設立税務申報職位時定期諮詢專業税務顧問,並相信所採取的税務申報立場符合税務法規;然而,税務機關始終存在不同意所採取的税務申報立場的風險,從而導致應繳額外税款、利息和
罰款,而該等金額可能相當可觀。
我們可能無法使用淨虧損、税收抵免結轉和某些固有虧損來減少未來的納税或受益於優惠的愛爾蘭税收立法
。
作為一家愛爾蘭註冊公司和税務居民公司,我們在全球範圍內的利潤都要繳納愛爾蘭公司税。由於我們的業務性質,我們自成立以來就產生了虧損,因此
沒有繳納任何愛爾蘭公司税。截至2023年12月31日,我們有6500萬美元的未使用淨虧損。受制於任何相關的使用準則及限制(包括可限制使用結轉虧損的準則及限制),如本公司過半普通股的所有權發生變更,以及交易性質、行為或規模發生重大改變,並受制於導致虧損可扣税的相關開支,吾等預期該等虧損
有資格結轉及用作抵扣未來營業利潤。
作為一家開展廣泛研究和開發活動的公司,我們尋求從愛爾蘭1997年税收整固法和1997年税收整固法(規定的研究和開發活動法規)中規定的愛爾蘭研發活動、廠房和機械及建築物的某些支出的愛爾蘭研發税收抵免中受益。在滿足適用條件的情況下,按允許支出的25%給予抵免。
我們未來可能會從愛爾蘭的知識發展盒制度中受益。《2022年愛爾蘭金融法》對這一制度進行了修訂,使符合條件的公司有權享受相當於其合格利潤20%的公司税減免。合格利潤是愛爾蘭公司通過開展合格研究和開發或研發活動開發的某些類型知識產權(專利、受版權保護的計算機軟件)的直接可歸因於的利潤。實際上,如果滿足該制度的條件,這些合格利潤將被徵收10%的税。救濟的可用性取決於事實,我們
將隨着我們活動的進展而考慮此救濟的適用性。
40
目錄表
當與研發税收抵免結合在一起時,我們預計愛爾蘭公司税的長期税率將低於法定税率。但是,如果愛爾蘭研發税收抵免制度或Knowledge Development Box制度出現意外的不利變化,或由於任何原因,我們無法符合此類制度的資格,或者我們無法使用淨虧損和税收抵免結轉
和某些內在虧損來減少未來的納税,則我們的業務、運營結果和財務狀況可能會受到不利影響。這可能會影響我們持續的投資需求以及需要額外投資的時間範圍。
我們可能會受到美國聯邦和州沒收法律的約束,這可能會對我們的業務運營產生負面影響。
違反任何美國聯邦法律和法規都可能導致聯邦政府或普通公民進行的民事訴訟所產生的鉅額罰款、處罰、行政制裁、定罪或和解,或刑事指控,包括但不限於扣押資產、返還利潤、停止業務活動或資產剝離。作為一家從事涉及甲氧基-N,N-二甲基色胺或5-甲氧基色胺(5-MeO-DMT)業務的實體,我們可能會受到聯邦和州沒收法律(刑事和民事)的約束,這些法律允許政府沒收犯罪活動的收益。民事沒收法可以
為聯邦政府或任何州(或地方警察部隊)提供一個替代方案,這些州或州(或地方警察部隊)希望阻止居民與Mebufotenin相關企業進行交易,但認為刑事責任太難證明
排除了合理懷疑。此外,可要求個人沒收被視為犯罪所得的財產,即使個人沒有被判有罪,而且民事沒收事項的舉證標準低於刑事案件的證明標準。根據適用的法律,無論是聯邦還是州政府,而不是必須確定排除合理懷疑的責任,聯邦政府或州,如果適用,可能需要證明所涉資金或財產是犯罪收益,只需明確和令人信服的證據或僅僅是證據的優勢。
位於美布替寧仍然非法的司法管轄區的投資者可能面臨根據共謀、協助和教唆以及洗錢法規被起訴的風險,並面臨根據沒收法規進一步損失其投資或收益的風險。許多司法管轄區仍然完全有能力採取行動,阻止甲氧西林企業的收益進入其所在的州。我們的投資者和潛在投資者在考慮是否投資我們時,應瞭解這些潛在的相關法律。
我們必須遵守反腐敗法,以及出口管制法、海關法、制裁法和其他管理我們業務的法律。如果我們不遵守這些法律,我們可能會受到民事或刑事處罰、其他補救措施和法律費用,被禁止在美國以外製造GH001、GH002和GH003以及開發和銷售GH001、GH002、GH003或任何未來的候選產品,或者被要求制定和實施代價高昂的合規計劃,這可能會對我們的業務、運營結果和財務狀況產生不利影響。我們的董事和經理也可能受到刑事處罰,包括監禁。
我們的業務受反腐敗法律約束,包括愛爾蘭《2018年刑事司法(腐敗罪行)法》,或《刑事司法法案》、《美國反海外腐敗法》或《反海外腐敗法》、
英國《2010年反賄賂法》或《英國反賄賂法》,以及適用於我們開展業務並可能在未來開展業務的國家/地區的其他反腐敗法律。《刑事司法法》、《反海外腐敗法》和其他法律一般禁止我們、我們的官員以及我們的員工和中間人賄賂、被賄賂或向政府官員或其他人支付其他被禁止的款項,以獲得或保留業務或獲得一些其他業務優勢。
《刑事司法法》、《反海外腐敗法》和其他法律一般禁止我們、我們的員工和中介機構直接或間接地授權、承諾、提供或提供財政或其他利益給政府官員或其他人士,以誘使他們不正當地履行相關職能或活動(或因此類行為獎勵他們)。
41
目錄表
根據《刑事司法法》和英國《反賄賂法》,我們還可能因未能阻止與我們有關聯的人犯下賄賂罪行而承擔責任。我們與代表我們和我們的商業合作伙伴一起在多個司法管轄區開展業務,這些司法管轄區可能存在違反《刑事司法法》或《反海外腐敗法》或《英國反賄賂法》的風險,我們還參與與第三方的合作和關係,這些第三方的腐敗或非法活動可能使我們根據《刑事司法法》、《反海外腐敗法》、《英國反賄賂法》或當地反腐敗法承擔責任,即使我們沒有明確授權或實際瞭解此類活動。此外,我們無法預測未來我們的國際業務可能受到的監管要求的性質、範圍或影響,也無法預測現有法律可能被管理或解釋的方式。
遵守《反海外腐敗法》(FCPA),尤其是遵守英國《反賄賂法》既昂貴又困難,尤其是在腐敗是公認問題的國家。此外,《反海外腐敗法》和英國《反賄賂法》對製藥業提出了特別的挑戰,因為在許多國家,醫院由政府運營,醫生和其他醫院員工被視為外國官員。向醫院支付與臨牀試驗和其他工作相關的某些款項被認為是向政府官員支付的不正當款項,並導致了《反海外腐敗法》的執法行動。
未來,我們可能會在可能違反《刑事司法法》、《反海外腐敗法》或《英國反賄賂法》的司法管轄區開展業務,我們可能會參與與第三方的合作和關係,這些第三方的行為可能會使我們承擔《刑事司法法》、《反海外腐敗法》、《英國反賄賂法》或當地反腐敗法所規定的責任。此外,我們無法預測未來監管要求的性質、範圍或效果,我們的國際業務可能受到這些要求的約束,也無法預測現有法律可能被管理或解釋的方式。如果我們擴大我們的業務,我們將需要專門的額外資源來遵守我們計劃在每個司法管轄區開展業務的眾多法律和法規。
我們還受制於管理我們國際業務的其他法律和法規,包括由英國和美國政府以及歐盟成員國當局管理的法規,包括適用的出口管制法規、對國家和人員的經濟制裁、海關要求和貨幣兑換法規(在此統稱為貿易控制法)。此外,各種法律、法規和行政命令還限制出於國家安全目的在美國境外使用和傳播機密信息,或與某些非美國國民共享機密信息,以及某些產品和與這些產品相關的技術數據。如果我們擴大國際業務,將需要我們投入更多的資源來遵守這些法律,這些法律可能會阻止我們製造GH001、GH002或GH003,並
開發和銷售GH001、GH002、GH003或英國、美國和歐盟以外的任何未來候選產品,這可能會限制我們的增長潛力並增加我們的開發成本。
不能保證我們將完全有效地確保我們遵守所有適用的反腐敗法律,包括《刑事司法法》、《反海外腐敗法》、《英國反賄賂法》或其他法律要求,包括《貿易控制法》。如果我們不遵守《刑事司法法》、《反海外腐敗法》、《英國反賄賂法》和其他反腐敗法或《貿易管制法》,我們可能會受到刑事和民事處罰,
退回和其他制裁和補救措施,以及法律費用,這將對我們的業務、財務狀況、運營結果和流動性產生不利影響。美國證券交易委員會還可能因發行人違反《反海外腐敗法》的會計規定而暫停或禁止發行人在美國交易所進行證券交易。愛爾蘭、美國或其他當局對任何潛在違反《刑事司法法》、《反海外腐敗法》、其他反腐敗法或貿易管制法的調查也可能對我們的聲譽、業務、運營結果和財務狀況產生不利影響。
我們與醫療保健提供者、醫生和第三方付款人的關係將受到適用的反回扣、欺詐和濫用以及其他醫療保健法律法規的約束,這可能使我們面臨刑事制裁、民事處罰、合同損害、聲譽損害以及利潤和未來收入的減少。
雖然我們目前沒有任何產品上市,但一旦我們的候選產品商業化,如果獲得批准,我們將受到額外的醫療保健法律和法規要求以及美國聯邦和州政府以及我們開展業務所在司法管轄區的外國政府的監督。美國和其他地區的醫療保健提供者和第三方付款人將
在推薦和處方我們獲得營銷批准的任何候選產品方面發揮主要作用。我們目前和未來與醫療保健提供者、第三方付款人、客户和其他人的安排可能會使我們面臨廣泛適用的欺詐和濫用以及其他醫療保健法律和法規。特別是,我們候選產品的研究,以及醫療保健產品和服務的推廣、銷售和營銷,以及醫療保健行業的某些業務
安排,都受到旨在防止欺詐、回扣、自我交易和其他濫用行為的廣泛法律的約束。這些法律法規可能限制或禁止廣泛的定價、折扣、營銷和促銷、結構設計和佣金(S)、某些客户激勵計劃和其他業務或財務安排。
42
目錄表
可能影響我們的運營能力的適用的聯邦、州和外國醫療保健法律和法規包括但不限於:
|
•
|
聯邦反回扣法規,除其他事項外,禁止個人和實體直接或間接、公開或隱蔽地以現金或實物直接或間接、公開或隱蔽地索要、收受、提供或支付任何報酬(包括任何回扣、賄賂或回扣),以引誘或獎勵個人,或作為交換,轉介個人,或購買、租賃、訂購、安排或推薦任何可全部或部分付款的商品、設施、物品或服務,在聯邦醫療保健計劃下,如聯邦醫療保險和醫療補助計劃。在不實際瞭解法規或沒有違反法規的具體意圖的情況下,個人或實體可能被判違反法規罪。薪酬一詞被廣泛解讀為包括任何有價值的東西。此外,法院發現,如果薪酬的“一個目的”是誘導轉介,則違反了聯邦“反回扣法令”。違規行為將被處以鉅額民事和刑事罰款,並對每一次違規行為處以最高三倍的薪酬、監禁和被排除在政府醫療保健計劃之外
。此外,就民事虛假索賠法案或FCA而言,提交支付給任何聯邦醫療保健計劃的索賠,包括因違反聯邦反回扣法規而產生的物品或服務,構成虛假或欺詐性索賠
。反回扣法規被解釋為適用於生物製藥製造商與處方者、購買者和處方經理等人之間的安排。有一些法定例外和監管避風港保護一些常見活動不受起訴,但它們的範圍很窄,涉及旨在誘導開處方、購買或推薦的薪酬的做法如果不符合例外或避風港的資格,可能會受到審查;
|
|
•
|
聯邦民事和刑事虛假報銷法,包括FCA和民事罰款法,其中禁止個人或實體在知情的情況下向聯邦醫療保險、醫療補助或其他聯邦醫療保健計劃支付或批准虛假、虛構或欺詐性索賠,或導致提交虛假、虛構或欺詐性索賠;故意製作、使用或導致製作或使用虛假記錄或報表材料,
虛假、虛構或欺詐性索賠或向聯邦政府支付或傳輸金錢或財產的義務;或故意隱瞞或明知而不正當地逃避、減少或隱瞞向聯邦政府支付資金的義務。根據FCA,包括因違反聯邦反回扣法規而產生的物品或服務的索賠構成虛假或欺詐性索賠。製造商可以根據《反海外腐敗法》承擔責任,即使他們不直接向政府付款人提交索賠(如果他們被認為是導致提交虛假或欺詐性索賠的話)。《反海外腐敗法》還允許個人充當“告密者”,代表聯邦政府提起訴訟,指控違反《反海外腐敗法》,並參與任何金錢追回或和解。當實體被確定違反了FCA時,政府可以對每個虛假索賠處以民事罰款和懲罰,外加三倍損害賠償,並將該實體排除在聯邦醫療保險、醫療補助和其他聯邦醫療保健計劃之外;
|
|
•
|
1996年的聯邦《健康保險可攜帶性和責任法案》,或HIPAA,制定了額外的聯邦刑法,禁止明知和故意執行或試圖執行的計劃,以欺詐任何醫療福利計劃,包括私人第三方付款人,或通過虛假或欺詐性的藉口、陳述或承諾,獲得任何醫療福利計劃擁有、保管或
控制的任何金錢或財產,而無論付款人(例如,公共或私人),並故意和故意偽造,以任何詭計或手段隱瞞或掩蓋重大事實或作出任何重大虛假的、
虛構或欺詐性的陳述或陳述,或作出或使用任何虛假的文字或文件,而明知其包含與提供或支付與醫療保健事宜有關的醫療福利、項目或服務的任何重大虛假的虛構或欺詐性陳述或記項。與聯邦反回扣法規類似,個人或實體可能被判違反HIPAA欺詐條款,而不實際瞭解法規或違反該法規的具體意圖;
|
43
目錄表
|
•
|
HIPAA,經2009年《健康信息技術促進經濟和臨牀健康法案》(HITECH)及其各自的實施條例修訂,其中除其他事項外,對某些承保醫療保健提供者、健康計劃和醫療保健信息交換所及其各自的業務夥伴,即創建、接收、維護、傳輸或獲取與代表承保實體及其承保分包商提供服務相關的受保護健康信息。HITECH還創建了新的民事罰款等級,修訂了HIPAA,使民事和刑事處罰直接適用於商業夥伴,並賦予州總檢察長新的
權力,可以向聯邦法院提起民事訴訟,要求損害賠償或禁制令,以執行聯邦HIPAA法律,並尋求與提起聯邦民事訴訟相關的律師費和費用。此外,可能還有其他聯邦、州和非美國法律在某些情況下管理健康和其他個人信息的隱私和安全,其中許多法律在很大程度上彼此不同,可能不會產生相同的效果,從而使
合規工作複雜化;
|
|
•
|
聯邦醫生支付陽光法案是根據《患者保護和平價醫療法案》(Patient Protection And Affordable Care Act)創建的,該法案經2010年的《醫療保健和教育和解法案》(Health Care And Education Conciliation Act)修訂,或統稱為ACA
及其實施條例,要求根據Medicare、Medicaid或兒童健康保險計劃(某些例外情況)可獲得付款的藥品、設備、生物製品和醫療用品的製造商每年向CMS報告與直接或間接付款以及向醫生(定義為包括醫生、牙醫、驗光師、足科醫生和脊椎按摩師),某些非醫生提供者,包括醫生助理、護士從業人員、臨牀護士專家、麻醉師助理、註冊註冊麻醉師和註冊助產士和教學醫院,以及醫生及其直系親屬持有的所有權和投資權益。
|
|
•
|
聯邦消費者保護法和不正當競爭法,這些法律廣泛地監管市場活動和可能損害消費者的活動;以及
|
|
•
|
類似的美國州、地方和外國法律法規,例如州反回扣和虛假索賠法律,可能適用於涉及任何第三方付款人(包括私人保險公司)報銷的醫療項目或服務的銷售或營銷安排和索賠,並且可能比其聯邦對等法律範圍更廣;州和外國法律要求生物製藥公司遵守生物製藥行業的自願合規指南和聯邦政府頒佈的其他相關合規指南,或以其他方式限制向醫療保健提供者和其他潛在轉介來源支付款項;州和外國法律,要求藥品製造商報告與向醫生和其他醫療保健提供者支付和其他價值轉移、營銷支出或藥品定價有關的信息;州和地方法律,要求生物製藥銷售代表註冊;以及管理健康和其他個人信息的隱私和安全的國家和外國法律,其中一些法律可能比美國的法律更嚴格(例如,歐盟於2018年5月生效的一般數據保護條例(條例(EU)2016/679)或GDPR,或英國的一般數據保護條例,或英國GDPR),在某些情況下,它們可能在重大方面存在差異,並且通常不會被HIPAA搶佔,從而使合規工作複雜化。
|
生物製藥產品的分銷受到其他要求和法規的約束,包括旨在防止未經授權銷售生物製藥產品的廣泛記錄保存、許可、存儲和安全要求。
如果FDA、EMA或類似的外國監管機構批准我們的任何候選產品,我們將受到更多此類法律法規的約束,並需要花費
資源來制定和實施政策和流程,以促進持續合規。這些法律的範圍和執行都是不確定的,並受到當前醫療改革環境的快速變化的影響,特別是在缺乏適用的先例和法規的情況下。確保業務安排符合適用的醫保法,以及對政府當局可能進行的調查做出迴應,可能會耗費時間和資源,並可能分散
公司對業務的注意力。
44
目錄表
政府和執法當局可能會得出結論,我們的業務做法,包括我們與醫生和其他醫療保健提供者的安排,其中一些人可能
獲得股票期權作為所提供服務的補償,可能不符合解釋適用欺詐和濫用或其他醫療保健法律和法規的當前或未來法規、法規或判例法。如果我們的業務被發現違反了上述任何法律或適用於我們的任何其他政府法規,我們可能會受到重大制裁,包括民事、刑事和行政處罰、損害賠償、罰款、返還、監禁、
聲譽損害、被排除在聯邦和州政府資助的醫療保健計劃之外、合同損害和對我們業務的削減或限制,以及如果我們
受到公司誠信協議或其他協議的約束,以解決有關不遵守這些法律的指控,則我們將面臨額外的報告義務和監督。此外,如果我們預期與之有業務往來的任何醫生或其他醫療保健提供者或實體被發現不遵守適用法律,他們可能會受到類似的處罰。任何違反這些法律的行為,即使成功辯護,也可能導致我們產生鉅額法律費用,並轉移管理層對業務運營的注意力
。此外,我們在美國以外開發的任何候選產品的批准和商業化也可能使我們受到上述醫療保健法和其他外國法律的外國等價物的約束。
所有這些都可能損害我們的業務運營能力和財務業績。
確保我們與第三方的業務安排符合適用的醫療法律和法規的努力將涉及大量成本。任何因違反這些法律而對我們採取的行動,即使我們成功地進行了辯護,也可能導致我們產生鉅額法律費用,並轉移我們管理層對業務運營的注意力。不斷變化的合規環境以及構建和維護強健且可擴展的系統以符合具有不同合規或報告要求的多個司法管轄區的需要,增加了醫療保健公司可能會與一項或多項要求發生衝突的可能性。
我們實際或認為未能遵守適用的健康信息和數據保護法律法規、標準和其他要求可能會導致政府執法行動,包括民事或刑事處罰、私人訴訟和負面宣傳,並可能對我們的經營業績和業務產生負面影響。
我們和任何潛在的合作者可能受到涉及隱私和數據安全的美國和外國聯邦、州和當地法律和法規的約束。在美國,許多聯邦和州法律法規,包括州數據泄露通知法、州健康和個人信息隱私法以及聯邦和州消費者保護法,管理與健康相關的個人信息和其他個人信息的收集、使用、處理、存儲、傳輸、披露、銷燬和保護。此外,我們可能會從第三方獲取健康信息,包括我們從其獲取臨牀試驗數據的研究機構,這些機構受HIPAA(經HITECH修訂)的隱私和安全要求的約束。就我們作為業務夥伴的行為而言,我們也可能受到HIPAA(經HITECH修訂)的隱私和安全條款的約束,該條款限制使用和披露患者可識別的健康信息,強制採用與患者可識別的健康信息的隱私和安全相關的某些標準,並要求就此類信息向醫療保健提供商
客户報告某些安全漏洞。此外,許多州也頒佈了類似的法律,可能會對我們這樣的實體施加更嚴格的要求。根據事實和情況,如果我們以未經HIPAA授權或允許的方式獲取、使用或披露由HIPAA覆蓋的實體維護的可單獨識別的健康信息,我們可能會受到重大的民事、刑事和行政處罰。
45
目錄表
Additionally, in June 2018, the State of California enacted the California Consumer Privacy Act of 2018, or CCPA, which came into effect on January 1, 2020, and provides new data privacy rights for
California consumers (as that term is defined in the legislation) and new operational requirements for companies that process information of California residents, which may increase our compliance costs and potential liability. The CCPA gives
California residents expanded rights to access and delete their personal information, opt out of certain personal information sharing, and receive detailed information about how their personal information is used. The CCPA provides for civil
penalties for violations, as well as a private right of action and statutory damages for data breaches that is expected to increase data breach litigation. While there is currently an exception under the CCPA for protected health information that is
subject to HIPAA and clinical trial regulations, as currently written, the CCPA may nevertheless impact certain of our business activities depending on how the CCPA will be interpreted, and exemplifies the vulnerability of our business to the
evolving regulatory environment related to personal information. In addition, the California Privacy Rights Act of 2020, or CPRA, which went into effect on January 1, 2023, imposes additional obligations on companies covered by the legislation and
significantly modifies the CCPA, including by expanding consumers’ rights with respect to certain sensitive personal information. The CPRA also creates a new state agency that is vested with authority to implement and enforce the CCPA and CPRA. Some
observers have noted that the CCPA and CPRA could mark the beginning of a trend toward more stringent state privacy legislation in the United States, which could increase our potential liability and adversely affect our business. Other states, such
as Nevada, New Hampshire, Washington, Illinois and Nebraska, and the U.S. federal government are considering comprehensive privacy laws, and on January 1, 2023, the Virginia Consumer Data Protection Act, or CDPA, became effective. The CDPA contains
provisions that require businesses subject to the legislation to conduct data protection assessments in certain circumstances and that require opt-in consent from Virginia consumers to process certain sensitive personal information. In addition,
Colorado enacted the Colorado Privacy Act, or the CoPA, and Connecticut enacted the Connecticut Data Privacy Act, each of which took effect on July 1, 2023, and Utah enacted the Consumer Privacy Act, which became effective on December 31, 2023.
Several other states have also enacted privacy laws that are set to take effect in 2024 or 2025. The CDPA, CoPA and such other proposed legislation, if enacted, may add additional complexity, variation in requirements, restrictions and potential
legal risk, require additional investment of resources in compliance programs, impact strategies and the availability of previously useful data and could result in increased compliance costs and/or changes in business practices and policies.
收集、使用、存儲、披露、傳輸或以其他方式處理有關EEA中歐盟數據主體的個人數據(包括在臨牀試驗背景下處理的健康數據)
和/或在我們在任何歐洲經濟區成員國成立的背景下進行的活動,受GDPR以及不時修訂、擴展、合併、重新制定或取代GDPR的任何立法的約束。
GDPR範圍廣泛,並對處理居住在歐洲的個人的個人數據的公司提出了許多額外要求,包括
關於健康和其他敏感數據的處理,要求在某些情況下獲得與個人數據相關的個人的同意,要求就數據處理向個人進行額外披露
活動,要求實施適當的保護措施以保護個人數據的安全性和機密性,在某些情況下創建強制性數據泄露通知要求,並要求採取某些措施
(包括合同要求)在僱用第三方數據處理者時到位。GDPR允許數據保護機構對違反GDPR的行為處以高額罰款,包括可能高達2000萬歐元或
全球年收入的4%,以較高者為準,如果不符合英國GDPR,則最高可達1750萬英鎊或全球年收入的4%,以較高者為準。GDPR和英國GDPR還為個人提供
尊重其個人資料,包括查閲、刪除、可攜性、更正、限制和反對的權利,並賦予資料當事人和消費者協會向監管機構提出投訴的私人行動權
當局,尋求司法補救措施,並獲得因違反GDPR和英國GDPR而造成的損害賠償。GDPR和英國GDPR要求不僅適用於第三方交易,也適用於我們之間的信息傳輸
以及我們的子公司,包括員工信息。
GDPR和2018年愛爾蘭數據保護法也對將個人數據轉移到歐洲經濟區以外的國家(包括美國)實施了嚴格的規則,除非轉移各方已實施保障措施來保護轉移的個人信息。歐盟法院最近對歐盟委員會的標準合同條款是否符合GDPR提出了質疑。標準合同條款是公司從歐洲進口個人信息的主要機制之一。雖然CJEU支持標準合同條款的有效性,但CJEU裁定,基本數據傳輸必須由數據控制員根據個案進行評估,以確定個人信息是否得到充分保護。此外,歐盟委員會最近建議對標準合同條款進行更新。目前,幾乎沒有可行的替代標準合同條款,如何確保從歐洲向美國的個人信息轉移可能得到充分保護,以遵守GDPR,也存在不確定性。因此,我們或我們的供應商從歐洲轉移個人信息可能不符合歐洲數據保護法,並可能增加我們面臨GDPR因違反其跨境數據轉移限制而受到的嚴厲制裁。我們失去從歐洲經濟區傳輸個人信息的能力,也可能需要我們以高昂的費用提高在這些司法管轄區的數據處理能力。
46
目錄表
此外,英國於2020年1月31日退出歐盟和歐洲經濟區,給英國的數據保護監管帶來了不確定性。自2021年1月1日起,我們還受英國《GDPR》和《2018年英國數據保護法》的約束,該法案將GDPR保留在英國的國家法律中。特別是,收集、使用、存儲、披露、轉移或其他處理有關英國數據對象的個人數據(包括在
臨牀試驗中處理的健康數據)和/或在我們在英國的機構活動中進行的個人數據的收集、使用、存儲、披露、傳輸或其他處理,均受英國GDPR和2018年英國數據保護法的約束。關於從歐洲經濟區轉移個人數據,歐盟委員會於2021年6月28日發佈了一項關於英國數據保護框架的充分性決定,允許從歐盟成員國向英國的數據轉移繼續進行,而無需要求組織實施
合同或其他措施來合法地在領土之間轉移個人數據。雖然這一充分性決定將於2025年6月27日自動到期(除非在此之前得到歐盟委員會的續簽),但歐盟委員會可能會在任何時候單方面撤銷充分性決定,如果發生這種情況,可能會導致額外的成本並增加我們的總體風險敞口。其他國家也已經通過或正在考慮通過法律,要求當地數據居留或限制數據的國際轉移。
此外,歐洲和其他外國司法管轄區制定了與臨牀試驗數據隱私相關的法律、法規、標準和常見做法,包括作為批准臨牀試驗的條件。這些要求是不斷變化和不確定的,它們可能會導致我們啟動臨牀試驗的能力延遲或限制我們可能進行臨牀試驗的司法管轄區。
GDPR和英國GDPR可能會增加我們對我們處理的個人數據的責任和義務,其中此類處理受GDPR和英國GDPR的約束。雖然我們已經採取了步驟
遵守GDPR和英國GDPR以及適用的歐洲經濟區成員國的實施立法,包括尋求為我們作為控制者或聯合控制者開展的各種處理活動建立適當的法律基礎,
審查我們的安全程序以及我們的供應商和合作者的安全程序,並與相關供應商和合作者簽訂數據處理協議,我們無法確定我們為實現和保持合規所做的努力,
並且/或者將繼續取得圓滿成功。
美國和國外的數據隱私和安全問題監管框架正在迅速發展,在可預見的未來可能仍然不確定。符合適用的
隱私和數據保護法律法規是一個嚴格且耗時的過程,可能要求我們在合同中承擔更繁重的義務,限制我們收集、使用和披露某些數據的能力,或者在某些情況下,
影響我們在某些司法管轄區的運營能力。儘管我們努力使我們的做法符合這些法律法規,但由於內部或外部因素,我們可能無法成功實現合規,
例如資源分配限制或缺乏供應商合作。此外,由於隱私和數據保護法的解釋和應用仍不確定,這些法律和其他實際或據稱的法律
義務,例如合同或自我監管義務,可能會以與我們的數據管理實踐不一致的方式進行解釋和應用。我們未能或被認為未能遵守這些法律、法規和義務可能
導致政府調查、訴訟和執法行動(可能包括民事、刑事和行政處罰),政府實體、私人團體、消費者權益團體或其他人針對我們的公開聲明,
私人訴訟、合同處罰、金錢損失和/或負面宣傳,並可能對我們的經營業績和業務產生負面影響。此外,臨牀試驗受試者、員工和我們或我們的潛在
合作者獲取個人信息,以及與我們分享這些信息的提供商,可能會限制我們收集,使用和披露信息的能力。聲稱我們侵犯了個人隱私權,但未能遵守
違反數據保護法,或違反我們的合同義務,即使我們不承擔責任,也可能是昂貴和耗時的辯護,並可能導致不利的宣傳,可能會損害我們的業務。
正在進行的醫療立法和監管改革措施可能會對我們的業務和運營結果產生實質性的不利影響。
美國和外國法規、法令或對現有法規的解釋的變更可能會影響我們未來的業務,例如:(i)我們的製造變更
安排;(ii)增加或修改產品標籤;(iii)召回或停產我們的產品;(iv)額外的記錄保存要求;或(v)我們的產品的折扣或其他降價。如果任何此類更改
這些措施可能會對我們的業務運作產生不利影響。
47
目錄表
在美國和一些外國司法管轄區,已經有並可能繼續有許多關於醫療保健系統的立法計劃和法規變更
旨在擴大醫療保健的可用性,提高醫療保健的質量,並控制或降低醫療保健的成本。例如,2010年3月頒佈了《患者保護和平價醫療法案》,
這大大改變了政府和私人保險公司為醫療保健提供資金的方式,並對美國生物製藥行業產生了重大影響。
雖然《反腐敗法》的某些方面受到了許多司法、行政、執法和立法方面的挑戰,但《反腐敗法》仍然有效。ACA可能會受到
更多的挑戰。目前尚不清楚任何此類挑戰將如何影響ACA和我們的業務。此外,2021年1月28日,拜登總統發佈了一項行政命令,啟動一個特殊的登記期,以獲得健康
通過ACA市場的保險覆蓋。該行政命令還指示某些政府機構審查和重新考慮其限制獲得醫療保健的現有政策和規則,包括重新審查醫療補助
包括工作要求的示範項目和豁免計劃,以及通過Medicaid或ACA獲得醫療保險覆蓋面造成不必要障礙的政策。
此外,自《反腐敗法》頒佈以來,美國還提出並通過了其他立法修改。例如,2011年8月2日,《2011年預算控制法》規定,
在某些臨時暫停期間,從2013年4月1日開始的每個財政年度,醫療保險支付給提供者的費用將減少2%,並且由於隨後對法規的立法修正案,將一直有效到2031年,除非額外
國會採取行動。2020年12月,CMS發佈了一項最終規則,根據醫療補助藥物回扣計劃實施重大製造商價格報告變更,包括產品線擴展的替代回扣計算,即
與原研藥價格上漲掛鈎,最優價格報告與某些基於價值的採購安排有關。根據2024年1月1日生效的《2021年美國救援計劃法案》,醫療補助藥物回扣的法定上限
製造商支付給州醫療補助計劃的計劃回扣被取消。在某些情況下,取消這一上限可能要求製藥商支付比銷售產品所得更多的回扣。
此外,支付方法可能會受到醫療保健立法和監管舉措的影響。例如,CMS可能會開發新的支付和交付模式,如捆綁支付
模型政府加強了對製造商為其產品定價的方式的審查,這導致了幾項總統行政命令、國會調查以及提議和頒佈的聯邦和
州立法旨在提高產品定價的透明度,審查定價與製造商患者計劃之間的關係,降低醫療保險下的藥物成本,以及改革政府計劃
藥品的報銷方法。例如,FDA於2020年9月發佈了一項最終規則,為各州制定和提交來自加拿大的藥物進口計劃提供指導,FDA於
年批准了第一個此類計劃。 佛羅裏達州,2024年1月。
Recently, several healthcare reform initiatives culminated in the enactment of the Inflation Reduction Act, or the IRA, in August 2022, which will, among other things, allow HHS to directly negotiate
the selling price of a statutorily specified number of drugs and biologics each year that CMS reimburses under Medicare Part B and Part D. Only high-expenditure single-source drugs that have been approved for at least 7 years (11 years for
single-source biologics) can qualify for negotiation, with the negotiated price taking effect two years after the selection year. Negotiations for Medicare Part D products begin in 2024 with the negotiated price taking effect in 2026, and
negotiations for Medicare Part B products begin in 2026 with the negotiated price taking effect in 2028. In August 2023, HHS announced the ten Medicare Part D drugs and biologics that it selected for negotiations. HHS will announce the negotiated
maximum fair prices by September 1, 2024, and this price cap, which cannot exceed a statutory ceiling price, will come into effect on January 1, 2026. A drug or biological product that has an orphan drug designation for only one rare disease or
condition will be excluded from the IRA’s price negotiation requirements, but will lose that exclusion if it has designations for more than one rare disease or condition, or if is approved for an indication that is not within that single designated
rare disease or condition, unless such additional designation or such disqualifying approvals are withdrawn by the time CMS evaluates the drug for selection for negotiation. The IRA also imposes Medicare Part D and Part B drugs whose prices have
increased at a rate greater than the rate of inflation. The IRA will also eliminate, beginning in 2025, the coverage gap under Medicare Part D by significantly lowering the enrollee maximum out-of-pocket cost and requiring manufacturers to subsidize,
through a newly established manufacturer discount program, 10% of Part D enrollees’ prescription costs for brand drugs below the out-of-pocket maximum, and 20% once the out-of-pocket maximum has been reached. The IRA permits the Secretary of HHS to
implement many of these provisions through guidance, as opposed to regulation, for the initial years. Manufacturers that fail to comply with the IRA may be subject to various penalties, some significant, including civil monetary penalties. The IRA
also extends enhanced subsidies for individuals purchasing health insurance coverage in ACA marketplaces through plan year 2025. These provisions may be subject to legal challenges. For example, the provisions related to the negotiation of selling
prices of high-expenditure single-source drugs and biologics have been challenged in multiple lawsuits brought by pharmaceutical manufacturers. Thus, while it is unclear how the IRA will be implemented, it will likely have a significant impact on the
biopharmaceutical industry and the pricing of our products and product candidates.
48
目錄表
在美國的州一級,立法機構越來越多地頒佈法律和實施旨在控制藥品和生物製品定價的法規,包括價格或
患者報銷限制、折扣、對某些產品准入的限制以及營銷成本披露和透明度措施,在某些情況下,旨在鼓勵從其他國家進口和大宗採購。法律上
對第三方付款人付款金額的強制性價格控制或對覆蓋範圍或訪問的其他限制可能會損害我們的業務、經營業績、財務狀況和前景。此外,區域醫療保健機構和
各個醫院越來越多地使用招標程序來確定哪些藥品和哪些供應商將被包括在它們的處方藥和其它保健計劃中。這可能會降低對我們
我們成功商業化的候選產品或對我們的產品定價施加壓力。
在歐盟,類似的政治、經濟和監管發展可能會影響我們將候選產品(如果獲得批准)商業化的能力。除了持續的價格壓力之外
和成本控制措施,歐盟或成員國層面的立法發展可能會導致顯著的額外要求或障礙,這可能會增加我們的運營成本。在歐盟提供醫療保健,包括
衞生服務的建立和運作以及藥品的定價和報銷幾乎完全是國家而不是歐盟法律和政策的問題。各國政府和衞生服務提供者的優先事項不同
以及在此背景下提供醫療保健以及產品定價和報銷的方法。然而,一般而言,大多數歐盟成員國的醫療預算限制導致了對定價和
相關醫療服務提供者報銷藥品費用。再加上希望開發和銷售產品的歐盟和國家監管負擔不斷增加,這可能會阻止或延遲我們候選產品的上市批准,
限制或監管批准後活動,並影響我們將獲得上市批准的任何產品商業化的能力。在國際市場上,報銷和醫療支付系統因國家而異,許多
各國對特定產品和療法規定了價格上限。2023年4月,歐盟委員會提出一攬子立法方案,修訂歐盟藥品立法。該提案包括指令和法規,
將必須通過歐盟立法程序,但如果通過,可能會改變適用於歐洲數據獨佔的期限,從而可能減少公司在歐洲的數據獨佔期限。
立法變更也可能影響我們對候選產品和醫療器械進行技術、非臨牀和臨牀開發所依據的法律要求,
提供此類候選產品,它們可能會影響FDA、EMA和類似的外國監管機構審查和批准新藥品、藥械組合產品或醫療器械的方式。例如,2017年4月5日,歐洲
議會通過了MDR,廢除並取代了歐盟醫療器械指令和有源植入式醫療器械指令。指令必須在歐洲經濟區成員國的國家法律中實施,與指令不同,條例
將直接適用,即,無需在所有歐洲經濟區成員國通過歐洲經濟區成員國法律實施,旨在消除歐洲經濟區成員國之間醫療器械監管的現有差異。該
MDR旨在為整個歐洲經濟區的醫療器械建立統一、透明、可預測和可持續的監管框架,並在支持創新的同時確保高水平的安全和健康。
MDR在經過三年過渡期後於2021年5月26日完全適用。該條例除其他外:
|
•
|
加強有關醫療儀器投放市場的規則,並在儀器面世後加強監察;
|
|
•
|
明確規定製造商須負責跟進投放市場的醫療儀器的質量、性能和安全;
|
49
目錄表
|
•
|
通過唯一的識別號提高整個供應鏈中醫療器械對最終用户或患者的可追溯性;
|
|
•
|
建立中央數據庫,為患者、醫療保健專業人員和公眾提供有關歐盟現有產品的全面信息;以及
|
|
•
|
加強對某些高風險醫療器械(如植入物)的評估規則,這些器械在投放市場之前可能需要經過專家的額外檢查。
|
這些修改可能會對我們開發候選產品的方式以及交付此類候選產品所需的醫療設備產生重大影響,並可能顯著推遲我們的開發
。
2023年3月20日,(歐盟)2023/607號條例生效,該條例將《千年發展報告》的過渡性條款擴展如下:
|
•
|
2026,適用於III類定製設備;
|
|
•
|
2027年用於III類和IIb類可植入裝置;
|
|
•
|
2028其他IIb類、IIa類和IS類IM設備;以及
|
|
•
|
2028年適用於I類UP機密設備。
|
過渡條款允許指令下標記的設備CE有時間過渡,併成為MDR下標記的CE。
在英國,醫療器械目前繼續受到相當於MDR之前的歐盟指令的法律監管。英國政府計劃引入新的英國醫療器械法規,儘管這些法規不太可能在2025年前成為法律。與此同時,其醫療設備具有CE標誌的製造商將能夠繼續將其設備投放到英國市場,直到2028年6月30日或2030年6月30日,具體取決於設備分類和適用的法律。新的英國醫療器械法規一旦頒佈,可能會對我們打算
在英國銷售的任何產品施加額外的監管負擔,而我們預計北愛爾蘭仍將受到MDR的約束。
此外,歐盟於2014年4月通過了臨牀試驗條例,或條例536/2014,或CTR,該條例於2022年1月31日生效。CTR直接適用於所有歐盟成員國,並廢除了《臨牀試驗指令》。CTR概述了一個過渡時間表:
|
•
|
自2022年1月31日起至2023年1月31日止,所有臨牀試驗申請均可根據《臨牀試驗指令》或《臨牀試驗規則》提出;
|
|
•
|
自2023年1月31日起,所有初步臨牀試驗申請必須僅根據CTR提交;以及
|
|
•
|
從2023年1月31日到2025年1月31日,根據臨牀試驗指令授權的正在進行的臨牀試驗可以保持在臨牀試驗指令下,也可以過渡到CTR。然而,截至2023年1月31日,根據臨牀試驗指令2001/20/EC,不能提交新的國家臨牀試驗申請。因此,如果贊助商選擇在2023年1月31日結束的一年過渡期內根據臨牀試驗指令
提交臨牀試驗申請,則只有在整個臨牀試驗移交給CTIS後,才能在2023年1月31日之後向臨牀試驗添加新的歐盟成員國。此外,在2025年1月31日之前,允許對根據臨牀試驗指令授權的試驗進行重大修改;到2025年1月31日,所有正在進行的臨牀試驗將被要求過渡到CTR。
|
CTR通過臨牀試驗信息系統協調整個歐盟的臨牀試驗評估和監督流程,該系統將特別包含一個集中的歐盟門户網站和數據庫。
50
目錄表
我們無法預測美國或任何其他司法管轄區未來的立法或行政行動可能產生的政府監管的可能性、性質或程度。如果我們或我們可能接觸的任何第三方緩慢或無法適應現有要求的變化或新要求或政策的採用,或者如果我們或此類第三方無法保持合規性,我們的候選產品
可能會失去可能已獲得的任何監管批准,我們可能無法實現或保持盈利。
在美國,FDA和其他政府機構的資金不足可能會阻礙他們聘用和保留關鍵領導層和其他人員的能力,阻止新產品和服務的及時開發或商業化,或者以其他方式阻止這些機構履行我們業務運營可能依賴的正常業務職能,這可能會
對我們的業務產生負面影響。
FDA審查和批准新產品的能力可能受到各種因素的影響,包括政府預算和資金水平、僱用和留住關鍵人員以及接受用户費用支付的能力,以及法律、法規和政策變化。此外,政府對美國證券交易委員會和我們運營可能依賴的其他政府機構的資助,包括那些為研發活動提供資金的機構,
受到政治進程的影響,而政治進程本身就是不穩定和不可預測的。
FDA和其他機構的中斷也可能會減緩新藥被必要的政府機構審查或批准所需的時間,這將對我們的業務產生不利影響。例如,在過去的幾年裏,美國聯邦政府已經關閉了幾次,某些監管機構,如FDA,不得不讓關鍵員工休假,並停止關鍵活動。如果政府長期停擺,或者FDA因資金不足而受阻,可能會嚴重影響FDA及時審查和處理我們提交的監管文件的能力,這可能會對我們的業務產生實質性的不利影響。此外,在我們作為一家上市公司的運營中,未來政府關閉或類似的融資問題可能會影響我們進入公開市場並獲得必要資本的能力,以便適當地資本化和繼續我們的運營。
歐盟藥品營銷和報銷法規可能會對我們在歐盟成員國的產品營銷和承保能力產生重大影響。
我們最終打算尋求批准,在美國和選定的外國司法管轄區銷售我們的候選產品。如果我們的產品候選產品在一個或多個外國司法管轄區獲得批准,我們將受到這些司法管轄區的規章制度的約束。在一些外國國家,特別是歐盟國家,藥品的定價受到政府控制和其他市場監管,這可能會給我們候選產品的定價和使用帶來壓力。在這些國家,在獲得候選產品的市場批准後,與政府當局進行定價談判可能需要相當長的時間。此外,我們候選產品的市場接受度和銷售將在很大程度上取決於我們候選產品是否有足夠的承保範圍和第三方付款人的報銷,並可能受到現有和未來醫療改革措施的影響。
就像美國聯邦反回扣法令禁止的那樣,向醫生提供福利或優勢以誘導或鼓勵開處方、推薦、背書、購買、供應、訂購或使用醫療產品在歐盟也是被禁止的。向醫生提供福利或利益受歐盟成員國的國家反賄賂法律管轄,就英國而言(
不再是歐盟成員國),英國2010年《反賄賂法》。違反這些法律可能會導致鉅額罰款和監禁。
在某些歐盟成員國,支付給醫生的費用必須公開披露。此外,與醫生達成的協議通常必須事先通知醫生,並得到醫生的僱主、其主管專業組織和/或歐盟成員國監管機構的批准。這些要求在適用於歐盟成員國的國家法律、行業規範或專業行為準則中作出規定。不遵守這些要求可能會導致聲譽風險、公開譴責、行政處罰、罰款或監禁。
51
目錄表
此外,在大多數外國國家,包括歐盟、英國和歐洲經濟區,藥物的擬議定價必須獲得批准,才能合法上市。管理藥品定價和報銷的要求因國家/地區而異。例如,歐盟為其成員國提供了選項,以限制其國家醫療保險制度提供報銷的醫療產品的範圍,並控制供人使用的醫療產品的價格。歐盟各成員國採用的參考定價和平行分配,或在低價和高價成員國之間進行套利,可以進一步降低價格。成員國可以批准醫藥產品的具體價格,也可以對將醫藥產品投放市場的公司的盈利能力採取直接或間接控制制度。在某些國家/地區,我們可能需要進行臨牀
研究或其他研究,將我們任何候選產品的成本效益與其他可用的療法進行比較,以便獲得或維持報銷或定價審批。不能保證對生物製藥產品實行價格管制或報銷限制的任何國家/地區將允許對我們的任何產品進行優惠的報銷和定價安排。從歷史上看,在歐盟推出的產品並不遵循美國的價格結構
,通常價格往往會低得多。第三方付款人或主管當局公佈折扣可能會對公佈國和其他國家的價格或補償水平造成進一步的壓力。如果定價設置在不令人滿意的水平,或者如果我們的產品無法報銷或在範圍或金額上受到限制,我們的銷售收入以及我們任何候選產品在這些國家/地區的潛在盈利能力都將受到負面影響。
如果我們或與我們合作的任何第三方(5-甲氧基-N,N-二甲基色胺或5-MeO-DMT)未能遵守環境、健康和安全法律法規,我們可能會受到罰款或處罰,或產生可能損害我們業務的費用。
我們和代表我們工作的第三方受眾多環境、健康和安全法律法規的約束,包括管理實驗室程序以及危險材料和廢物的處理、使用、儲存、處理和處置的法律法規。我們的運營和代表我們運營的第三方的運營可能不時涉及使用危險和易燃材料,包括化學品和生物材料,還可能產生危險廢物產品。即使我們與第三方簽訂了處置這些材料和廢品的合同,我們也不能完全消除這些材料造成污染或傷害的風險
。特別是,關於美布替寧的毒理學數據有限,由於我們和代表我們工作的第三方以其霧化形式使用美布替寧,因此污染和傷害的風險更高。如果因使用或處置我們的危險材料而造成污染或傷害,我們可能要對由此造成的任何損害負責,並且任何責任都可能超出我們的資源範圍。我們還可能招致與
民事或刑事罰款以及不遵守此類法律法規的懲罰相關的鉅額成本。
我們保留僱主責任保險,以支付我們因員工受傷而可能產生的成本和費用,但該保險可能無法為潛在的
責任提供足夠的保險。然而,我們不為可能對我們提出的環境責任或有毒侵權索賠提供保險。
此外,為了遵守當前或未來的環境、健康和安全法律法規,我們可能會產生鉅額成本。環境法律法規可能會損害我們的研究、開發或生產努力。此外,不遵守這些法律法規可能會導致鉅額罰款、處罰或其他制裁。
有關知識產權的風險
我們依靠專利、專利申請和其他知識產權來保護我們的GH001、GH002和GH003候選產品,這些產品的起訴、執行、辯護和維護可能具有挑戰性和成本。如果不能充分起訴、維護、執行或保護這些權利,可能會損害我們的競爭能力,並損害我們的業務。
我們的商業成功在一定程度上取決於獲得和維護與GH001、GH002、GH003和任何未來候選產品、用於製造潛在治療物質、組合物和方法的專利和其他形式的知識產權,以及使用這些物質和療法治療患者的方法,以及用於提供此類物質和療法的醫療器械,或從第三方獲得此類權利的許可
。如果不能獲得、維護、保護、強制執行或延長足夠的專利和其他知識產權,可能會對我們開發和營銷GH001、GH002、GH003和任何未來候選產品以及交付此類候選產品的醫療器械的能力產生重大不利影響。我們還依靠商業祕密和專有技術來發展和維護我們的專有和知識產權地位。任何未能保護我們的商業祕密和專有技術的行為都可能同樣對我們的運營和前景產生不利影響。
52
目錄表
我們不能確定是否會就我們或我們未來許可人的待決和未來專利申請頒發或授予專利,也不能確定我們或我們未來許可人的任何已頒發或已授予專利在以後不會被發現是無效或不可強制執行的。像我們這樣的公司的專利地位通常是不確定的,因為它涉及複雜的法律和事實考慮,而且近年來一直是許多訴訟的主題。因此,我們的專利權的頒發、範圍、有效性、可執行性和商業價值都具有高度的不確定性。歐洲專利局、美國專利商標局、美國專利商標局和外國專利局在授予專利時採用的標準並不總是統一或可預測的。例如,關於可申請專利的主題或製藥專利中允許的權利要求的範圍,沒有全球統一的政策。因此,我們的未決專利申請可能不會頒發專利,即使他們確實頒發了專利,這些專利的頒發形式也不會有效地阻止其他人開發競爭療法或將其商業化。因此,我們不知道我們的專有療法未來將獲得多大程度的保護。考慮到美布替寧(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)是一種已知的天然存在物質,因此不受專利保護,對於我們的GH001、GH002和GH003候選產品而言,這種風險進一步增加。
專利起訴過程昂貴、複雜且耗時,我們和我們的任何第三方許可方、被許可方或協作合作伙伴可能無法以合理的成本或及時地準備、提交和起訴所有必要或理想的專利申請。我們或我們的許可方、被許可方或合作伙伴也有可能無法確定在研究、開發或商業化活動過程中作出的發明的可專利方面,否則將無法對其進行專利保護,為時已晚。此外,儘管我們與有權訪問我們研發成果的機密或可專利方面的各方(如我們的員工、公司合作者、外部科學合作者、合同製造商、顧問、顧問和其他第三方)簽訂了保密和保密協議,但這些各方中的任何一方都可能違反這些協議並在提交專利申請之前披露此類成果,從而危及我們尋求專利保護的能力。此外,科學文獻中的發現發表往往落後於實際發現,美國和其他司法管轄區的專利申請通常在提交後18個月才發表,或者在某些情況下直到批准才發表。因此,我們不能確定我們是第一個發明在我們的專利或未決專利申請中聲稱的發明,或者我們是第一個為此類發明申請專利保護的公司。同樣,對於任何授權中的專利或未決專利申請,我們也不能確定被點名的申請人(S)是第一個提出此類專利或未決專利申請中要求保護的發明的人,或者被點名的申請人(S)是第一個為此類發明申請專利保護的人。
此外,在某些情況下,我們可能無權控制專利和專利申請的準備、提交、起訴、維護、執行和辯護,這些專利和專利申請涵蓋我們從第三方許可或許可給第三方的技術
,並且可能依賴我們的許可方、被許可方或協作合作伙伴來做到這一點。因此,這些專利和申請不得以符合我們業務最佳利益的方式進行準備、提交、起訴、維護、強制執行或辯護。如果我們當前或未來的任何許可方、被許可方或協作合作伙伴未能建立、維護或保護此類專利和其他知識產權,則此類權利可能會
減少或取消。如果我們的任何許可人、被許可人或合作伙伴在起訴、維護或強制執行任何專利和其他知識產權方面不完全合作或不同意我們的意見,此類權利可能會受到損害,我們開發和商業化受此類許可權約束的候選產品的權利可能會受到不利影響。
專利審查過程還可能要求我們或我們的許可人、被許可人或合作伙伴縮小我們或我們的許可人、被許可人或合作伙伴的未決和未來專利申請的權利要求範圍,這可能會限制可能獲得的專利保護範圍。我們不能向您保證已找到與我們或我們的任何許可方、被許可方或合作伙伴的專利和專利申請有關的所有可能相關的現有技術。如果存在這樣的現有技術,它可以使專利無效或阻止專利從未決的專利申請中頒發。
專利的頒發對於其發明性、範圍、有效性或可執行性並不是決定性的,我們或我們的任何許可人、被許可人或合作伙伴的專利可能會在美國和國外的法院或專利局受到挑戰。即使專利確實成功頒發,即使此類專利涵蓋GH001、GH002、GH003和任何未來的候選產品,第三方也可能在法庭或專利局發起反對、幹擾、複審、授權後複審、各方間複審、廢止或派生程序,或類似的程序,質疑此類專利的有效性、可執行性或範圍,這可能會導致失去排他性,或導致專利主張縮小、無效或不可執行,這可能會限制我們阻止其他人使用或商業化類似或相同技術和療法的能力,或限制我們候選技術和產品的專利保護期限
。
53
目錄表
我們和我們的許可人、被許可人或合作伙伴的專利申請不能針對實踐此類申請中所要求的技術的第三方強制執行,除非且直到
此類申請頒發專利,並且僅限於所發佈的權利要求涵蓋該技術的範圍。此外,如果包括我們的競爭對手在內的第三方圍繞我們受保護的技術、GH001、GH002、GH003或任何未來候選產品或醫療器械進行設計,以交付此類候選產品,則專利和其他知識產權不會保護我們的技術、GH001、GH002、GH003或任何未來候選產品或醫療器械
不侵犯、盜用或以其他方式侵犯我們擁有的或授權內的專利或其他知識產權。此外,我們的一些專利和專利申請未來可能會與第三方共同擁有。如果我們無法獲得任何此類第三方共同所有人在此類專利或專利申請中的獨家許可,則這些共同所有人可以將其權利許可給包括我們的競爭對手在內的其他第三方,而我們的競爭對手
可以銷售競爭對手的療法和技術。此外,我們可能需要我們專利的任何此類共同所有人的合作,以便針對第三方強制執行此類專利,而此類合作可能不會提供給我們。上述任何情況都可能對我們的競爭地位、業務、財務狀況、經營結果和前景產生重大不利影響。
由於專利申請在提交後的一段時間內是保密的,有些專利申請在發佈之前仍是保密的,因此我們不能確定我們或我們的許可人、被許可人或合作者
是或將是第一個提交與候選產品相關的專利申請的公司。此外,如果第三方的專利申請的有效提交日期在2013年3月16日之前,則此類第三方可以啟動幹預程序,以確定誰最先發明瞭我們申請的專利權利要求所涵蓋的任何主題。如果第三方的專利申請的有效申請日期為2013年3月16日或之後,此類第三方可以
啟動派生程序,以確定我們的發明是否源自他們的發明。即使在我們擁有有效且可強制執行的專利的情況下,如果對方能夠證明他們在我們的申請日期之前將發明用於商業,或者對方受益於強制許可,我們也不能排除其他人實踐我們的發明。此外,我們可能會因獨家擁有我們的知識產權而受到第三方的挑戰。如果第三方
成功挑戰了我們對任何知識產權的獨家所有權,我們可能會失去使用此類知識產權的權利,該第三方可能會將此類知識產權許可給其他第三方,包括我們的競爭對手,而我們的競爭對手可能會銷售與之競爭的療法和技術。上述任何一項都可能對我們的競爭地位、業務、財務狀況、經營結果和前景產生重大不利影響。
此外,我們擁有的和許可中的專利可能會受到一個或多個第三方的權利保留。例如,我們可能開發、收購或許可通過使用美國政府資金而產生的知識產權
。因此,美國政府可能對這些專利權和技術擁有一定的權利,或者説是進行權。當在美國政府資助下開發新技術時,
美國政府通常會獲得產生的任何專利的某些權利,包括授權美國政府將發明用於非商業目的的非排他性、世界性、不可撤銷的許可。這些權利可能允許
政府向第三方披露我們的機密信息,並行使使用或允許第三方使用我們的技術的先行權。如果美國政府認為有必要採取行動
,因為我們未能實現政府資助的技術的實際應用,因為必須採取行動來緩解健康或安全需求,滿足聯邦法規的要求,或優先考慮美國工業,則美國政府可以行使其遊行權利。如果獲獎者未能向政府披露發明或未能在規定的期限內提交知識產權登記申請,美國政府也有權獲得這些發明的所有權。此外,我們對此類發明的權利可能會受到在美國製造包含此類發明的產品的某些要求的約束。政府對此類權利的任何行使都可能損害我們的競爭地位、業務、財務狀況、經營結果和前景。
54
目錄表
我們可能會捲入訴訟或行政訴訟,以保護或強制執行我們的專利或其他知識產權,並頒發涵蓋我們的一個或多個候選產品的專利,如果在法庭上提出質疑,可能會被認定為無效或不可執行。
競爭對手或其他第三方可能侵犯、挪用或以其他方式侵犯我們的專利、許可人的專利或我們的其他知識產權。為了保護我們的競爭地位,我們可能需要不時訴諸訴訟,以強制執行或捍衞我們擁有或授權給我們的任何專利或其他知識產權,或確定或質疑第三方專利或其他知識產權的範圍或有效性。知識產權的執行是困難、不可預測和昂貴的,我們或我們的許可方或協作合作伙伴的許多對手在這些訴訟中可能有能力
投入更多的資源來起訴這些法律訴訟,並比我們或我們的許可方或協作合作伙伴更好地維持此類訴訟的成本。因此,儘管我們或我們的許可人或合作伙伴做出了
努力,我們或我們的許可人或合作伙伴可能無法阻止第三方侵犯、挪用或以其他方式侵犯我們擁有或控制的知識產權,特別是在法律可能無法像英國、歐盟和美國那樣完全保護這些權利的國家/地區。我們也可能未能執行我們的權利,在這種情況下,我們的競爭對手和其他第三方可能被允許使用我們的療法或其他技術,而不向我們付費。
此外,涉及我們專利的訴訟有可能使我們的一項或多項專利範圍縮小、失效(全部或部分,逐一索賠)或無法執行。
這種不利的法院裁決可能允許第三方將我們的療法或其他技術商業化,然後直接與我們競爭,而不向我們付款。
如果我們對第三方提起法律訴訟,以強制執行涵蓋我們候選產品之一的專利,被告可以反訴我們的專利無效或
不可強制執行。在美國或歐洲的專利訴訟中,被告聲稱無效或不可執行的反訴很常見。對有效性質疑的索賠可能是基於未能滿足幾個法定要求中的任何一個,例如,缺乏新穎性、明顯或未啟用。不可執行性主張的理由可能是,與專利起訴有關的人向歐洲專利局或美國專利商標局隱瞞了相關信息,或在起訴期間發表了誤導性聲明。第三方也可以在美國或國外的行政機構,甚至在訴訟範圍之外,對我們的專利主張的有效性提出質疑。
此類機制包括重新審查、授權後審查、當事各方審查、幹擾訴訟、派生訴訟和外國司法管轄區的同等訴訟程序(即異議訴訟)。此類訴訟可能導致我們的專利被撤銷、取消或修改,使其不再涵蓋GH001、GH002、GH003或任何未來的候選產品或交付此類候選產品的醫療設備。在專利訴訟或其他訴訟過程中,法律斷言
無效和不可執行後的結果是不可預測的。例如,關於有效性問題,我們不能確定沒有我們和專利審查員在起訴期間不知道的無效的先前技術。如果被告或第三方以無效或不可強制執行的法律主張勝訴,我們將失去對GH001、GH002、GH003或一個或多個未來候選產品或交付此類候選產品的醫療器械的至少部分甚至全部專利保護。這種專利保護的喪失可能會對我們的業務財務狀況、運營結果和前景產生實質性的不利影響。此外,訴訟
可能導致鉅額成本和管理資源的轉移,無論結果如何,這可能會損害我們的業務和財務業績。
我們還可能面臨對我們的專利和其他知識產權的發明權或所有權提出質疑的索賠。我們有可能沒有完善我們對所有專利、專利申請和其他知識產權的所有權。這種可能性包括我們無法識別所有發明人或識別不正確的發明人的風險,這可能會導致前員工或其他第三方對我們的專利、專利申請
和其他知識產權的清單或所有權產生爭議。還有一個風險是,我們無法建立從發明家到我們的不間斷的所有權鏈條。庫存或所有權方面的錯誤有時也會影響優先權申請。
如果我們失去了對某些專利申請申請優先權的能力,介入的ART或其他事件可能會阻止我們頒發專利。可能有必要提起訴訟,以對抗這些和其他挑戰庫存或所有權的索賠。如果我們不能為任何此類索賠辯護,除了金錢損失外,我們還可能失去寶貴的知識產權。這樣的結果可能會嚴重損害我們的業務和財務業績。
55
目錄表
獲得和維護專利保護有賴於遵守政府專利機構提出的各種程序、文件提交、費用支付和其他要求,如果不符合這些要求,我們的專利保護可能會減少或取消。
任何已頒發或申請的專利的定期維護、續期、年金和各種其他政府費用應在專利有效期內分幾個階段支付給歐洲專利局、美國專利商標局和外國專利代理機構。歐洲專利局、美國專利商標局和各種外國政府專利機構也要求在專利申請過程中遵守一些程序、文件、費用支付和其他類似條款。在某些情況下,我們可能會依賴我們的合作伙伴、律師事務所或其他專業人員向美國專利商標局和類似的外國專利代理機構支付這些費用,並採取必要的行動來遵守有關我們知識產權的此類要求。雖然在許多情況下,不遵守規定的情況可以通過支付滯納金或通過適用規則的其他方式予以糾正,但在
中,不遵守規定的情況可能會導致專利或專利申請被放棄或失效,從而導致相關司法管轄區的專利權部分或全部喪失。可能導致專利或專利申請被放棄或失效的不合規事件包括未能在規定的期限內對官方行動做出迴應、未支付費用以及未能適當地使專利或專利申請合法化並提交正式文件。如果我們或我們的服務提供商、許可方或合作伙伴未能維護涵蓋我們候選產品的專利和專利申請,我們的專利保護可能會減少或取消,包括我們的競爭對手在內的第三方可能能夠以類似或
相同的療法或技術進入市場,這將對我們的業務、財務狀況、運營結果和前景產生重大不利影響。此外,如果我們因此類不遵守規定而未能申請或以其他方式無法獲得適用的專利期限延長或調整,我們將有更有限的時間來執行我們已授予的專利權。此外,如果我們負責專利訴訟和維護授權給我們的專利權
,上述任何行為都可能使我們對適用的專利所有者承擔責任。
如果我們沒有根據《哈奇-瓦克斯曼法案》和類似的外國立法獲得保護,以延長涵蓋我們每個候選產品的專利有效期
,我們的業務可能會受到實質性損害。
在美國,如果按時支付所有維護費,專利的自然失效時間通常是自其在美國最早的非臨時申請日期起20年。可能有各種延期,但不能保證會獲得任何此類延期,專利的有效期及其提供的保護也是有限的。即使獲得了涵蓋我們候選產品、其製造或使用的專利,一旦專利有效期過期,我們可能會面臨來自競爭對手療法或技術的競爭。考慮到新產品候選產品的開發、測試和監管審查所需的時間,保護這些候選產品和伴隨療法的專利可能會在這些候選產品和伴隨療法商業化之前或之後不久到期。因此,我們擁有和授權的專利組合可能不會為我們提供足夠的權利來排除其他人
將與我們類似或相同的療法商業化。
根據FDA批准GH001、GH002、GH003以及我們未來的任何候選產品和醫療器械交付此類候選產品的時間、持續時間和條件,我們未來可能擁有或許可的一項或多項美國專利可能有資格根據1984年的《藥品價格競爭和專利期限恢復法》或《哈奇-瓦克斯曼法案》獲得有限的專利期延長。《哈奇-瓦克斯曼法案》(Hatch-Waxman Act)允許將涵蓋經批准產品的專利在正常到期後延長最多五年,作為對產品開發和FDA監管審查過程中有效專利期損失的補償。專利期
延期不得超過自產品批准之日起的14年,僅限於批准的適應症(或在延長期內批准的任何其他適應症),每種批准的藥物只能延長一項專利,並且只能延長涉及批准的藥物、其使用方法或製造方法的權利要求。在監管機構批准我們開發的任何候選產品後,還可以在某些外國司法管轄區(包括歐盟)延長專利期限。但是,我們可能因為在測試階段或監管審查過程中未進行盡職調查、未能在
適用期限內提出申請、未能在相關專利到期前提出申請或未能滿足適用要求等原因而無法獲得延期。此外,延期的長度可能比我們要求的要短。如果我們無法獲得專利期
延長,或者任何此類延長的期限比我們要求的短,我們可以對該產品行使專利權的期限不會延長,包括我們的競爭對手在內的第三方可能會比我們預期的更早獲得上市
競爭療法的批准。因此,我們來自適用療法的收入可能會大幅減少,我們的業務、財務狀況、運營結果和前景可能會受到實質性的損害。
知識產權不一定能解決我們的業務和競爭優勢面臨的所有潛在威脅。
我們的知識產權提供的未來保護程度是不確定的,因為知識產權具有侷限性,可能無法充分保護我們的業務或使我們能夠保持競爭優勢。例如:
56
目錄表
|
•
|
其他人可能能夠製造與GH001、GH002、GH003相同或相似的組合物,以及任何未來的產品候選組合物,或者能夠製造醫療器械來提供我們擁有或許可的專利權利要求未涵蓋的
組合物;
|
|
•
|
第三方的專利可能會對我們的業務產生不利影響;
|
|
•
|
我們或我們的許可人或合作伙伴可能不是第一個構思或減少實施我們擁有或許可的已發佈專利或未決專利申請所涵蓋的發明的人;
|
|
•
|
我們或我們的許可方或合作伙伴可能不是第一個提交涵蓋我們或他們的某些發明的專利申請;
|
|
•
|
其他人可以獨立開發類似或替代技術或複製我們的任何技術,而不侵犯、挪用或以其他方式侵犯我們的知識產權;
|
|
•
|
我們目前和未來的未決專利申請或許可中的專利申請可能不會導致已頒發的專利;
|
|
•
|
我們擁有或許可的已頒發專利可能不會為我們提供任何競爭優勢,或者可能會因第三方的法律挑戰而被認定為無效或不可執行;
|
|
•
|
我們擁有或許可的已頒發專利可能沒有足夠的期限或地理範圍來提供有意義的保護;
|
|
•
|
我們的競爭對手可能會在為某些研發活動提供專利侵權避風港的國家或我們沒有專利權的國家進行研發活動,然後利用從此類活動中學到的信息來開發在我們的主要商業市場銷售的有競爭力的療法;
|
|
•
|
使用我們的療法或技術為我們進行製造或測試的第三方可以在沒有獲得適當許可的情況下使用他人的知識產權;
|
|
•
|
我們不能開發其他可申請專利的技術;以及
|
|
•
|
為了保護某些商業祕密或專有技術,我們可能選擇不申請專利,而第三方隨後可能會提交涵蓋此類知識產權的專利,或以其他方式開發類似的專有技術。
|
如果這些事件中的任何一個發生,都可能對我們的業務、財務狀況、運營結果和前景產生實質性的不利影響。
我們可能會受到第三方的索賠,聲稱我們或我們的員工、顧問或顧問挪用了他們的知識產權,包括商業機密,或者要求我們認為是我們自己的知識產權的所有權。
我們的許多顧問、顧問和員工,包括我們的高級管理層,都曾受僱於其他生物技術或製藥公司,包括我們的競爭對手和潛在的競爭對手。其中一些人簽署了與以前的工作有關的專有權、保密和競業禁止協議。儘管我們希望我們的顧問、顧問和員工在為我們工作時不使用其前僱主的專有信息或專有技術,但我們或這些個人可能會被要求使用或披露任何此類個人的前僱主的機密信息或知識產權,包括商業祕密或其他專有
信息。為了對這些索賠進行辯護,可能有必要提起訴訟,無論其是非曲直,我們也無法預測我們是否會在任何此類訴訟中獲勝。如果我們未能起訴或辯護任何此類索賠,除了支付金錢損害賠償外,我們還可能失去寶貴的知識產權或人員或遭受損害,我們的開發和商業化努力可能會受阻或延遲,我們可能需要從該第三方獲得許可證才能將我們的療法或其他技術商業化。這樣的許可可能不會以商業上合理的條款或根本不存在。即使我們成功地起訴或抗辯此類索賠,訴訟也可能導致鉅額成本,分散我們管理層對其日常活動的注意力,並可能導致負面宣傳。
57
目錄表
此外,我們的現任或前任員工或承包商可能會因代表我們進行的工作而主張對我們知識產權的所有權。雖然我們的政策是要求可能參與知識產權概念或開發的員工和承包商執行將此類知識產權轉讓給我們的協議,但我們可能無法與實際上構思或開發我們視為自己的知識產權的每一方執行此類協議,並且我們不能確定我們與此類各方的協議在面臨潛在挑戰時是否會得到維護。知識產權轉讓可能不是自動執行的,或者轉讓協議可能被違反,我們可能沒有足夠的補救措施,我們可能被迫向第三方提出索賠,或他們
可能對我們提出的索賠進行抗辯,以確定我們視為我們的知識產權的所有權。此類索賠可能會對我們的業務、財務狀況、運營結果和前景產生實質性的不利影響。
第三方的知識產權可能會對我們競爭或將我們的候選產品商業化的能力產生不利影響。第三方可能會指控我們侵犯、挪用或以其他方式侵犯他們的知識產權,以致我們可能被要求提起訴訟或從第三方獲得許可,以開發或營銷我們的候選產品,這可能會
成本高昂,並對我們的業務成功產生負面影響。
我們的商業成功在一定程度上取決於我們的能力以及我們當前和未來的合作伙伴開發、製造、營銷和銷售任何候選產品和設備的能力,以便我們能夠開發和使用我們的專有技術,而不會侵犯、挪用或以其他方式侵犯第三方的知識產權和專有權利。我們
計劃經營的各個市場都面臨着頻繁而廣泛的專利和其他知識產權訴訟。未來,我們可能會參與或威脅與GH001、GH002、GH003或任何未來候選產品或醫療器械有關的知識產權訴訟或訴訟,以交付此類候選產品。如果任何此類訴訟或訴訟的結果對我們不利,可能會影響我們有效競爭的能力
。
此外,如果向第三方頒發的專利或其他第三方知識產權涵蓋我們的療法或其元素、我們的製造或使用與我們的開發計劃相關、GH001、GH002、GH003或任何未來候選產品的目標、或用於交付此類候選產品的醫療設備、或GH001、GH002、GH003或任何未來候選產品的其他屬性,則我們的競爭地位可能會受到影響。在此類
案例中,我們可能無法開發或商業化此類候選產品或設備來交付此類候選產品,除非我們成功提起訴訟以使相關第三方知識產權無效或無效,或者與知識產權持有人簽訂許可協議,而這些許可協議可能無法以商業合理的條款或根本無法獲得。如果在批准該產品時專利尚未過期
候選產品(S)和專利權人將對我們提起侵權訴訟,我們可能不得不爭辯説,我們的候選產品或用於交付該候選產品的潛在治療物質或設備的製造或使用
不侵犯相關專利的有效主張。或者,如果我們要在法庭上挑戰任何已頒發的美國專利的有效性,我們將需要克服附在每一項美國專利上的法定有效性推定。這意味着
為了勝訴,我們需要就專利權利要求的無效性提出明確和令人信服的證據。這同樣適用於某些其他司法管轄區。即使我們認為第三方知識產權主張沒有價值,也不能保證法院會在侵權、有效性、可執行性或優先權問題上做出有利於我們的裁決。如果第三方成功向我們主張其專利,導致該第三方的專利被認定為有效且可強制執行,並且被我們的候選產品侵犯,除非我們獲得該專利的許可,根據該許可,我們很可能被要求支付各種費用、里程碑、版税或其他金額,並且可能無法以商業合理的條款獲得,或者根本無法獲得,我們可能被阻止繼續開發或商業化我們的候選產品。
我們有可能失敗了,未來也可能失敗,無法識別可能對我們不利的相關專利或申請。例如,在2000年11月29日之後提交的某些美國專利申請可以保密,直到或除非作為專利發佈,前提是申請中披露的發明沒有也不會成為在美國境外提交的相應申請的主題。一般來説,美國和其他地方的專利申請在要求優先權的最早申請後大約18個月公佈,這個最早的申請日期通常被稱為優先權日期。因此,涉及我們療法的專利申請可能是在我們不知情的情況下由他人提交的。此外,我們在一個競爭激烈的領域運營,考慮到我們有限的資源,監控我們活躍的領域的所有專利申請是不合理的。此外,已經公佈的未決專利申請可以在受到某些限制的情況下,在以後進行修改,以涵蓋我們的療法或我們療法的使用。
58
目錄表
第三方知識產權持有者,包括我們的競爭對手,可能會根據現有或未來的知識產權
主動向我們提出侵權、挪用或侵權索賠,無論其是非曲直。我們可能無法成功解決或以其他方式解決此類侵權索賠。如果我們不能以我們可以接受的條款成功解決未來的索賠,我們可能被要求進行或
繼續昂貴、不可預測和耗時的訴訟,並可能被阻止或在營銷我們的療法方面遇到重大延誤。此外,我們可能會面臨非執業實體的專利侵權索賠,這些實體沒有相關的藥品收入,因此我們自己的專利組合可能對他們沒有威懾作用。
如果我們未能成功對任何此類索賠進行辯護,除了被迫支付賠償金外,我們或我們的被許可人可能會暫時或永久禁止將我們的任何
被認定侵權的候選產品或交付此類候選產品的設備。如果可能,我們可能被迫重新設計GH 001、GH 002、GH 003或任何未來的候選產品或醫療器械,以交付此類候選產品
以便我們不再侵犯第三方的知識產權,或者我們可能被要求為我們被發現侵權的任何此類技術尋求許可,該許可可能無法以商業上合理的條款或在
所有.即使我們或我們的許可方或合作伙伴獲得了許可,該許可也可能是非排他性的,從而使我們的競爭對手能夠獲得許可給我們或我們的許可方或合作伙伴的相同技術,這可能要求我們
支付大量的許可和版税。此外,如果我們被發現故意侵犯專利或其他知識產權,我們可能要承擔重大的經濟損失,包括三倍賠償和律師費
對的我們也可能被要求賠償合作者或承包商對此類索賠。聲稱我們盜用第三方的機密信息或商業祕密可能會對我們的
業務、財務狀況、經營業績和前景。即使我們最終獲勝,這些事件中的任何一個都可能要求我們轉移大量的財務和管理資源,否則我們將能夠投入
我們的業務
此外,如果我們或我們的許可方或合作伙伴的專利和專利申請所提供的保護的廣度或強度受到威脅,可能會阻止公司
與我們合作,許可、開發或商業化當前或未來的候選產品。此外,由於知識產權訴訟需要大量的發現,
我們的機密信息可能會因為在這類訴訟中披露而受到損害。
知識產權訴訟可能導致我們花費大量資源,分散員工的正常職責,損害我們的
我們的聲譽和業務運營。
即使以有利於我們的方式解決,與知識產權索賠相關的訴訟或其他法律程序也可能導致我們產生大量費用,並可能分散我們的技術和
管理人員的正常職責。此外,與訴訟相關的不確定性可能會影響我們籌集繼續臨牀試驗、繼續內部研究項目或
許可證所需的技術。還可以公開宣佈聽證會、動議或其他臨時程序或進展的結果,如果證券分析師或投資者認為這些結果是負面的,則可以
對我們的普通股價格產生重大不利影響。該等訴訟或法律程序可能大幅增加我們的經營虧損,並減少我們可用於開發及商業化活動的資源。我們可能沒有
有足夠的財務或其他資源來充分進行此類訴訟或程序。我們的一些競爭對手可能能夠比我們更有效地承受此類訴訟或程序的成本,因為他們的實質性
更多的財政資源。此外,由於在知識產權訴訟中需要大量的發現,我們的一些機密信息可能會因
這種訴訟。因專利訴訟或其他知識產權訴訟的啟動和持續而導致的不公平可能對我們在市場上的競爭能力產生重大不利影響。
59
目錄表
我們可能無法成功獲得或維護GH 001、GH 002、GH 003或任何未來候選產品或任何醫療器械的必要權利,
通過收購和許可提供此類候選產品。
將來,我們的計劃可能需要使用第三方持有的知識產權或專有權利,我們業務的增長可能部分取決於我們
獲取、許可、維護和使用這些知識產權和專有權利。
對於我們的GH001吸入型產品候選產品,對於所有已完成和正在進行的臨牀試驗,我們從第三方獲得用於製造吸入性氣霧劑的設備。設備及其使用
可能受向該第三方或其他第三方頒發的一項或多項專利或該第三方或其他第三方的其他知識產權的保護。我們目前沒有與該第三方簽訂商業供應協議,
我們也沒有與任何其他合適設備的供應商簽訂許可協議。2021年,我們開始為GH001開發一種專有的氣霧劑輸送設備,用於我們的關鍵臨牀試驗計劃和商業用途。然而,儘管我們努力主動識別任何此類第三方權利,此專有設備及其使用仍可能受到向第三方頒發的一項或多項專利或第三方的其他知識產權的保護。
如果第三方成功地向我們主張其知識產權,除非我們獲得此類知識產權的許可證,否則我們很可能被要求支付各種類型的費用、里程碑、版税或其他金額,並且可能無法以商業合理的條款或根本無法獲得,我們可能會被阻止繼續開發或商業化我們針對GH001的專有氣霧劑輸送設備。此外,對於GH002和GH003以及任何未來包括使用設備的交付平臺,我們計劃許可或從第三方購買所需的交付設備,或與CDMO合作開發此類設備並建立此類設備的製造能力。但是,我們可能無法獲得相關技術的許可,無法獲得所需的交付設備或開發專有的交付設備,如果我們無法獲得必要的商業供應,我們的競爭地位可能會受到影響。
我們無法與第三方達成協議、許可證或開發協議。
此外,對於我們可能與第三方共同擁有的任何專利,我們可能需要許可這些共同所有人在此類專利中的權益。
我們可能無法從第三方獲得我們認為對GH001、GH002、GH003或任何未來候選產品或醫療器械來説是必要的任何成分、使用方法、工藝或其他第三方知識產權,以便以商業合理的條款或根本不交付此類候選產品。例如,我們可以與美國和外國學術機構合作,根據與這些機構達成的書面協議,加快我們的非臨牀研究或開發。通常,這些機構為我們提供了一個選項,可以通過談判獲得該機構在合作中獲得的任何技術權利的許可證。無論
此類選項如何,我們可能無法在指定的時間範圍內或在我們可接受的條款下協商許可證。如果我們無法做到這一點,機構可能會將知識產權提供給其他方,這可能會阻止我們進行適用的研究療法或計劃。
第三方知識產權的許可和收購是一個競爭領域,一些更成熟的公司可能會採取我們認為有吸引力或必要的第三方知識產權許可或收購戰略。這些老牌公司可能比我們更具競爭優勢,因為它們的規模、現金資源以及更強的臨牀開發和商業化能力。此外,將我們視為競爭對手的公司可能不願將權利轉讓或許可給我們。如果我們無法成功獲取或獲得開發研究療法或項目所需的第三方知識產權許可,或無法保持我們現有的知識產權,我們可能不得不放棄該研究療法或項目的開發,這可能會對我們的業務、財務狀況、運營結果和前景產生重大不利影響。此外,即使我們能夠獲得許可,它也可能是非獨家的,從而使我們的競爭對手和其他第三方能夠訪問向我們許可的相同技術,並且可能要求我們支付大量許可和版税。
60
目錄表
專利法或專利法的變化可能會降低專利的整體價值或阻止我們獲得足夠的專利保護,
從而削弱我們保護我們候選產品的能力。
與我們行業中的其他公司一樣,我們的成功在很大程度上依賴於獲得、維護、保護和執行我們的知識產權,特別是專利。
在製藥行業獲得和執行專利權涉及技術和法律複雜性,成本高、耗時長,而且本質上不確定。美國或其他司法管轄區專利法或專利法解釋的變化可能會增加圍繞專利申請的起訴以及已頒發專利的執行或辯護的不確定性和成本。例如,美國2012年和2013年頒佈的《美國發明法》(AIA)導致了美國專利制度的重大變化。
在《美國專利法》頒佈之前,假設滿足其他可專利性要求,最先發明所要求保護的發明的人享有專利,而在美國以外的國家,第一個提交專利申請的人享有專利。2013年3月16日之後,根據《美國投資促進法》,美國過渡到了一種“先申請”制度,即當主張同一發明的不同當事人提交了兩項或更多專利申請時,決定哪一方應被授予專利,而不管第三方是否最先發明瞭該發明。根據這一制度,在我們之前向美國專利商標局提交專利申請的第三方可以
被授予涵蓋我們的發明的專利,即使我們在第三方之前做出了發明。AIA要求我們瞭解從發明到提交專利申請的時間,但情況可能會阻止我們
就我們的發明迅速提交專利申請。
AIA引入的其他一些重大變化包括限制專利權人提起專利侵權訴訟的範圍,併為第三方提供更多機會
在美國專利商標局挑戰任何未決的專利申請或已發佈的專利。這種機會包括在專利訴訟期間允許第三方向美國專利商標局提交先前技術,以及通過美國專利商標局管理的授權後程序(包括授權後審查、當事各方之間的審查和派生程序)來攻擊專利有效性的額外程序。由於USPTO訴訟中的證據標準低於美國聯邦法院宣佈專利主張無效所需的證據標準,因此第三方可能會在USPTO訴訟中提供足以使USPTO在我們未來的任何美國專利中的權利主張無效的證據,即使相同的證據如果首先在地區法院訴訟中提交也不足以使權利要求無效
。因此,第三方可以嘗試使用美國專利商標局的程序來宣告專利權利要求無效,如果第三方首先作為被告在地區法院訴訟中提出質疑的話,這些權利要求就不會無效。AIA及其實施可能會增加圍繞我們未來任何美國專利申請的起訴以及此類專利申請可能頒發的任何專利的執行或保護
的不確定性和成本。
此外,美國最高法院近年來對幾起專利案件做出了裁決,要麼縮小了某些情況下的專利保護範圍,要麼在某些情況下削弱了專利所有者的權利。除了關於我們未來獲得專利的能力的不確定性增加之外,這種事件的結合也造成了關於一旦獲得專利的價值的不確定性。根據美國國會、聯邦法院和USPTO或外國司法管轄區類似機構未來的行動,管理專利的法律和法規可能會以不可預測的方式發生變化,可能會削弱我們獲得新專利或強制執行我們未來可能獲得的專利的能力。特別是,歐洲新的統一專利法院(UPC)可能會給我們執行現有專利申請和未來可能獲得的任何專利的能力帶來不確定性。這一新法院於2023年6月1日生效,雖然它旨在為專利持有者帶來重大利益,包括提高UPC簽署國專利執法的效率和確定性,但它也為各方提供了一種集中撤銷歐洲專利的新方法。由於它是一個新的法院,沒有既定的判例法體系,根據UPC向專利權人提供的專利權利和補救措施的全部範圍在幾年內還不會變得明確。我們將有能力在該系統存在的頭七年選擇將我們的專利排除在該系統之外,但這樣做可能會使我們無法利用這一司法管轄區所提供的優勢。
61
目錄表
如果我們未能履行我們向第三方或從第三方許可知識產權的協議下的義務,或者我們與許可方、被許可方或協作者的業務關係因其他原因而中斷,我們可能會失去對我們的業務至關重要的知識產權權利,並失去繼續開發和/或
商業化我們的候選產品的能力。
我們是與CDMO簽訂的發展協議的締約方,根據該協議,我們授予該CDMO非排他性權利,以便在該CDMO履行其在該等協議下的義務時使用我們的某些知識產權,並且根據該協議,我們被授予在必要時使用該CDMO的某些知識產權的非排他性權利,以使用和利用該等協議下該CDMO的交付成果。我們預計,未來我們可能需要
簽訂對我們的業務可能很重要的其他許可或協作協議。我們預計,未來的許可協議可能會向我們施加各種財務和其他義務,其中包括基於實現某些里程碑的治療開發以及支付版税和費用。此外,根據未來的許可協議,我們可能被禁止開發和商業化與此類協議許可的療法競爭的療法。如果我們未能履行我們在這些協議下的義務,我們的許可方或合作伙伴可能有權終止協議,包括此類協議中包含的任何許可,並且我們
可能因違反此類協議而面臨其他責任。
終止任何許可或合作協議或未能充分保護我們或我們的合作者在此類許可或合作協議下的權利,可能會阻止我們
進一步開發或商業化GH001、GH002、GH003或任何未來的候選產品或醫療設備,以交付該協議或其下許可的知識產權所涵蓋的候選產品。例如,我們可能依賴
許可協議,該協議授予我們與我們的療法開發相關的某些知識產權和專有材料的權利。如果此類協議終止,我們可能無法以商業上合理的條款或根本無法從其他來源及時許可類似的知識產權和專有材料,並可能需要對GH001、GH002、GH003或任何未來的候選產品或醫療設備進行額外的銜接研究,以交付此類候選產品或重新設計我們的候選產品、或醫療器械或其製造方法,這可能會推遲或以其他方式對GH001、GH002、GH003或任何未來候選產品或醫療器械的開發和商業化產生重大不利影響。
我們現有的和未來的許可協議也可能包含來自第三方的從屬許可,這些第三方不是所涉知識產權的原始許可方。根據這些協議,我們必須
依賴我們的許可方履行其在主要許可協議下的義務,根據該協議,該第三方獲得適用知識產權的權利,而我們可能與該權利的原始許可方沒有任何關係。如果我們的許可方未能履行其在這些上游許可協議下的義務,原始第三方許可方可能有權終止原始許可,這可能會終止再許可。如果發生這種情況,
我們將不再擁有適用知識產權的權利,如果我們不能從相關權利的所有者那裏獲得我們自己的直接許可,我們可能無法以合理的成本或合理的條款
做到這一點,這可能會對我們繼續開發和商業化GH001、GH002、GH003或任何未來的候選產品或醫療設備以交付包含相關知識產權的此類候選產品的能力造成不利影響。
根據許可或合作協議,可能會發生有關知識產權的糾紛,其中包括:
|
•
|
根據協議授予的權利範圍和其他與解釋有關的問題;
|
|
•
|
我們的技術和流程是否侵犯、挪用或以其他方式侵犯不受協議約束的許可方或合作伙伴的知識產權,以及侵犯的程度;
|
|
•
|
在任何當前或未來的合作關係下對專利和其他權利進行再許可;
|
|
•
|
我們根據協議承擔的勤勉義務,以及哪些活動滿足這些勤勉義務;
|
|
•
|
我們轉讓或轉讓協議的權利;
|
|
•
|
由我們的許可人和我們以及我們的合作伙伴共同創造或使用知識產權而產生的發明和專有技術的發明和所有權;以及
|
|
•
|
專利技術發明的優先權。
|
此外,第三方許可和協作協議很複雜,此類協議中的某些條款可能會受到多種解釋的影響。解決可能出現的任何合同
解釋分歧可能會縮小我們認為是我們對相關知識產權或技術的權利的範圍,或增加我們認為是相關
協議下我們的財務或其他義務,這兩種情況中的任何一種都可能對我們的業務、財務狀況、運營結果和前景產生重大不利影響。此外,如果圍繞我們許可的知識產權的糾紛妨礙或削弱我們以商業上可接受的條款維持當前許可安排的能力,我們可能無法成功開發受影響的候選產品並將其商業化,這可能會對我們的業務、財務狀況、
運營結果和前景產生重大不利影響。
62
目錄表
與員工和其他人簽訂的保密協議可能不足以防止泄露我們的商業祕密並保護其他專有信息。
我們認為我們的商業祕密和專有的保密和非專利技術對我們的業務很重要。我們依靠商業祕密和機密技術來保護我們的專有技術,特別是在專利保護被認為價值有限的情況下。然而,商業祕密和技術訣竅很難保密,我們有時可能不得不與第三方共享我們的商業祕密和機密技術訣竅,我們與這些第三方合作開發、製造或商業化我們當前或未來的候選產品或聯合研發計劃。
為了保護此類信息不被第三方和我們的競爭對手披露或盜用,我們的政策是要求我們的員工、顧問、承包商和顧問與我們簽訂保密協議。然而,我們不能保證我們已經與可能或曾經接觸到我們的商業祕密或機密技術的每一方達成了此類協議。此外,現任或前任員工、
顧問、承包商和顧問可能會無意或故意向我們的競爭對手和其他第三方泄露我們的商業祕密和機密技術,或違反此類協議,而我們可能無法針對此類違規行為獲得足夠的補救措施。監控未經授權的使用和披露是困難的,執行第三方非法獲取和使用我們的商業祕密或機密技術的聲明是困難、昂貴、耗時和不可預測的。
保密協議的可執行性可能因司法管轄區而異,美國以外的法院有時不太願意保護商業祕密。此外,如果競爭對手或其他第三方合法獲取或獨立開發了我們的任何商業祕密或機密專有技術,我們將無權阻止該競爭對手或其他第三方使用該技術或信息與我們競爭,這可能會損害我們的競爭地位。此外,如果為保護我們的商業祕密而採取的措施被認為是不充分的,我們可能沒有足夠的追索權來對抗第三方挪用此類商業祕密。如果我們的任何商業祕密被泄露給競爭對手或其他第三方,或者我們失去了對我們的商業祕密的保護,這些信息的價值可能會大大降低,我們的競爭地位將受到實質性和不利的損害。
如果不能獲得或維持商業祕密保護,可能會對我們的競爭地位產生不利影響。此外,我們的競爭對手可以獨立開發基本上等同的專有信息,甚至可以申請專利保護。如果成功獲得這種專利保護,我們的競爭對手可能會限制我們使用我們的商業祕密或機密技術。
如果我們的商標和商號沒有得到充分的保護,那麼我們可能無法在我們感興趣的市場上建立知名度,我們的業務可能會受到不利影響。
我們希望在未來依靠商標作為一種手段,將我們獲準上市的候選產品與我們競爭對手的產品區分開來。我們尚未為我們的候選產品選擇商標,也尚未開始申請註冊GH001、GH002、GH003或任何未來候選產品的商標。一旦我們選擇商標並申請註冊,我們的商標申請可能
不會獲得批准。我們的註冊或未註冊商標或商號可能會受到挑戰、侵犯、規避或宣佈為通用商標,或被確定為侵犯了其他商標,在這種情況下,我們可能會被迫重新塑造我們的產品品牌,這可能會導致品牌認知度的喪失,並可能需要我們投入資源來廣告和營銷新品牌。因此,我們可能無法充分保護我們對這些商標和商品名稱的權利,我們需要這些權利來在我們感興趣的市場中建立
潛在合作伙伴或客户的知名度。如果我們無法根據我們的商標和商號建立名稱認可,那麼我們可能無法有效競爭,我們的業務可能會受到不利影響
。如果其他實體在不同的司法管轄區使用與我們的商標類似的商標,或者對我們的商標擁有優先權利,可能會干擾我們在世界各地使用我們的商標。
63
目錄表
我們可能無法在世界各地保護我們的知識產權,並可能在某些司法管轄區面臨困難,這可能會降低這些司法管轄區的知識產權價值,並對我們的業務產生負面影響。
如果獲得批准,我們或我們的許可方不會在我們可能銷售產品的每個國家或地區為我們的候選產品尋求或維護專利保護,未來也可能不會這樣做。在全世界所有國家和司法管轄區申請、起訴和保護候選產品專利的費用將高得令人望而卻步,而且我們許可人或合作伙伴在歐洲專利公約成員國和美國以外的一些國家的知識產權
可能沒有歐洲專利公約成員國和美國的知識產權廣泛。因此,我們可能無法阻止第三方在所有國家實施我們的發明,或者銷售使用我們的發明製作的療法或將使用我們的發明製成的治療組合物進口到例如《歐洲專利公約》成員國和美國,或其他司法管轄區。此外,我們可能會決定在授予之前放棄國家和地區的專利申請。此外,每項國家/地區專利的授予程序是一個獨立的程序,這可能導致在某些法域中,申請可能被相關專利局拒絕,而由其他法域批准的情況。同樣常見的情況是,根據國家/地區的不同,同一候選產品或技術的專利保護範圍可能會有所不同。
競爭對手可以在我們未獲得專利保護的司法管轄區使用我們和我們的許可方或協作合作伙伴的技術來開發他們自己的療法,此外,可能會將其他侵權療法出口到我們和我們的許可方或協作合作伙伴擁有專利保護但執行力度不如其他司法管轄區的地區。這些療法可能會與GH001、GH002、GH003或任何未來的候選產品競爭,我們和我們的許可方或合作伙伴的專利或其他知識產權可能不能有效或不足以阻止它們如此競爭。
有些法域的法律對知識產權的保護程度不如《歐洲專利公約》成員國和美國的法律,因此公司在保護和捍衞這些法域的知識產權方面遇到了很大的困難。如果我們或我們的許可人在保護知識產權方面遇到困難,或因其他原因無法有效保護對我們在這些司法管轄區的業務非常重要的知識產權,這些權利的價值可能會降低,我們可能會面臨來自這些司法管轄區其他知識產權的額外競爭。
一些國家有強制許可法,根據這些法律,專利權人可能會被強制向第三方授予許可。此外,一些國家限制專利對政府機構或政府承包商的可執行性。在這些國家,專利權人的補救措施可能是有限的,這可能會大大降低這種專利的價值。如果我們或我們的任何許可方或協作合作伙伴被迫向第三方授予與我們業務相關的任何專利的許可,我們的競爭地位可能會受到損害,我們的業務和運營結果可能會受到不利影響。
在外國司法管轄區強制執行我們和我們的許可人或協作合作伙伴的專利權的訴訟程序可能會導致鉅額成本,並將我們和我們的許可人或協作合作伙伴的努力和注意力從我們業務的其他方面轉移出去,無論我們或我們的許可人或協作合作伙伴是否成功,並可能使我們和我們的許可人或協作合作伙伴的專利面臨被宣佈無效或被狹隘解釋的風險。此外,此類訴訟可能會使我們和我們的許可人或協作合作伙伴的專利申請面臨無法頒發的風險,並可能引發第三方對我們或我們的許可人或協作合作伙伴提出索賠。我們或我們的許可人或協作合作伙伴可能不會在我們或我們的許可人或協作合作伙伴發起的任何訴訟中勝訴,所判給的損害賠償或其他補救措施(如果有)可能沒有商業意義。
上述任何一項都可能對我們的業務、財務狀況、運營結果和前景產生實質性的不利影響。
64
目錄表
與我們對第三方的依賴相關的風險
我們依賴第三方來協助進行我們的非臨牀研究和臨牀試驗。如果他們的表現不令人滿意,我們可能無法啟動新的臨牀試驗、成功完成臨牀試驗、獲得監管部門的批准或將我們的候選產品商業化,或者此類批准或商業化可能會推遲,我們的業務可能會受到實質性損害。
我們一直依賴並計劃繼續依賴第三方,如實驗室、CRO、臨牀數據管理組織、醫療機構、臨牀研究人員和顧問,
組織、支持或進行我們的非臨牀研究和臨牀試驗,並預計依賴這些第三方對我們開發的任何其他候選產品進行非臨牀研究和臨牀試驗。在某些情況下,這些第三方中的任何一方都可以
終止與我們的合同。我們可能無法達成替代安排,或以商業上合理的條款這樣做。此外,當新的CRO開始工作時,有一個自然的過渡期。因此,可能會出現延遲,這可能會對我們滿足預期臨牀開發時間表的能力產生負面影響,並損害我們的業務、財務狀況和前景。例如,在2023年11月,我們宣佈管理我們的一個臨牀試驗站點的CRO已通知我們,由於業務原因,該站點將關閉,導致此類試驗延遲
。
儘管我們對這些第三方的非臨牀和臨牀開發活動的依賴限制了我們對這些活動的控制,但我們仍然有責任確保我們的每項非臨牀研究和臨牀試驗按照適用的方案、法律和法規要求以及科學標準進行。此外,人類臨牀研究必須遵守進行、記錄和報告臨牀試驗結果的GCP,以確保數據和報告的結果是可信和準確的,並保護試驗參與者的權利、完整性和機密性。監管機構通過對試驗贊助商、主要研究人員、臨牀試驗地點和IRBs進行定期檢查來執行這些GCP。如果我們或我們的第三方承包商未能遵守適用的GCP,在我們的臨牀試驗中生成的臨牀數據可能被認為是不可靠的,
監管機構可能會要求我們在批准我們的候選產品之前進行額外的臨牀試驗,這將推遲監管部門的審批過程。我們不能確定,在檢查後,監管機構是否會確定我們的臨牀試驗是否符合GCP。
代表我們進行非臨牀研究和臨牀試驗的第三方不是我們的員工,除了根據我們與這些承包商的協議我們可以獲得的補救措施外,我們無法
控制他們是否將足夠的時間、技能和資源投入到我們正在進行的開發計劃中。這些外部承包商可能不會像我們自己開展此類項目那樣優先考慮我們的項目,也不會像我們那樣勤奮地追求這些項目。這些承包商還可能與其他商業實體有關係,包括我們的競爭對手,他們可能還在為這些實體進行臨牀試驗或其他藥物開發活動,這可能會阻礙他們將適當的時間投入我們的臨牀項目的能力。如果這些第三方,包括臨牀研究人員,沒有按照監管要求或我們規定的規程成功履行合同職責、在預期期限內完成或進行我們的臨牀試驗,我們可能無法獲得或延遲獲得我們候選產品的監管批准。如果發生這種情況,我們將無法或可能會推遲將我們的候選產品成功商業化的努力。在這種情況下,我們的財務業績和我們尋求開發的任何候選產品的商業前景可能會受到損害,我們的成本可能會增加,我們產生收入的能力可能會被推遲、受損或喪失抵押品贖回權。
如果我們與進行研究的任何第三方的關係終止,我們可能無法以商業上合理的條款與替代第三方達成安排,或完全無法。更換或增加第三方來進行我們的研究涉及大量成本,需要大量的管理時間和精力。此外,當新的第三方開始工作時,有一個自然的過渡期。因此,會出現延遲
,這可能會對我們滿足所需的非臨牀和臨牀開發時間表的能力產生重大影響。儘管我們謹慎地處理與進行研究的第三方的關係,但我們不能保證我們在未來不會遇到類似的挑戰或延誤,或者這些延誤或挑戰不會對我們的業務、財務狀況和運營結果產生實質性的不利影響。
我們還依賴其他第三方為我們的臨牀試驗儲存和分發藥品供應。我們分銷商的任何業績失誤都可能延誤臨牀開發或
監管部門對我們候選產品的批准或任何由此產生的產品的商業化,從而造成額外損失並剝奪我們潛在的產品收入。
65
目錄表
我們的活性藥物成分、候選產品和提供此類候選產品所需的醫療器械的開發和製造非常複雜,我們在進一步開發或生產過程中可能會遇到困難。我們目前完全依賴第三方來開發、制定和製造我們的非臨牀研究和臨牀試驗用品。如果第三方未能向我們提供足夠數量的此類藥品供應,或未能以可接受的質量水平(包括嚴格執行的法規要求或合同義務)提供此類藥品,則交付此類候選產品所需的任何我們的有效藥物成分、候選產品和醫療器械的開發和商業化可能會被停止、推遲或利潤下降,我們的運營可能會因此受到損害。
開發和製造我們的藥物物質、候選產品和提供此類候選產品所需的醫療器械的過程複雜、昂貴、受到嚴格監管
並面臨多種風險。此外,由於交付此類候選產品所需的藥物物質、候選產品和醫療器械是通過非臨牀研究開發的,從早期臨牀試驗到後期臨牀試驗
直至批准和商業化,因此通常會更改交付此類候選產品所需的藥品物質、候選產品和醫療器械的各個方面,如技術規格、設計、特性和製造方法,以努力優化性能、工藝和結果,並滿足法規要求,這些要求對後期臨牀試驗和商業化生產比早期試驗更嚴格。我們目前正在實施此類更改,這會帶來無法實現預期目標或可能導致延遲的風險,其中任何更改都可能需要進行銜接研究,並可能導致我們的候選產品
表現不同,並影響計劃中的臨牀試驗或其他未來臨牀試驗的結果。此外,我們目前生產藥物物質和候選產品以及交付此類候選產品所需的醫療器械的方式可能無法滿足後期臨牀試驗和商業使用的法規要求,並且不能保證我們能夠以及時或根本不符合法規要求的方式生產我們的藥品和候選產品。我們在藥物配方或製造方面的經驗有限。目前,我們依賴廣泛的顧問和合同製造商網絡,在某些情況下還依賴獨家供應商來生產我們的藥物物質、候選產品和醫療器械,這些產品是為當前和計劃中的臨牀試驗交付此類候選產品所需的。
為了對我們的候選產品進行臨牀試驗,或提供商業產品,如果獲得批准,我們將需要大量生產這些產品和我們候選產品中包含的藥物物質
。我們的CDMO可能無法及時或具有成本效益地成功提高我們的藥物物質和我們的任何候選產品的製造能力,或者根本無法。此外,在
擴展活動期間可能會出現質量問題。如果我們的CDMO無法以足夠的質量和數量成功擴大我們的候選藥物或產品的生產規模,候選產品的開發、測試和臨牀試驗可能會
推遲或變得不可行,任何最終產品的監管批准或商業推出可能會推遲或無法獲得,這可能會嚴重損害我們的業務。如果我們決定在未來建立內部製造能力,同樣的風險也將適用於我們的內部製造設施。此外,建設內部製造能力將帶來重大風險,因為它無法規劃、設計和執行一個複雜的項目,以便以及時和具有成本效益的方式建造製造設施,而與確保此類製造設施持續合規相關的資源將是巨大的。
此外,我們可能開發的任何產品的製造過程都要接受FDA、EMA和類似的外國監管機構的審批程序和持續監督,我們
將需要與能夠滿足所有適用的FDA、EMA和外國監管機構要求的製造商簽訂合同,包括持續遵守cGMP。儘管我們與CDMO簽訂的協議要求他們執行某些cGMP要求,例如與質量控制、質量保證和合格人員相關的要求,但我們無法控制我們CDMO執行和維持這些標準的能力。如果我們或我們的第三方製造商無法
可靠地生產符合FDA、EMA或其他類似外國監管機構可接受的規格的產品,或保持FDA、EMA或其他類似外國監管機構可接受的合規狀態,我們可能無法
獲得或維持我們將此類產品商業化所需的批准。即使我們的任何候選產品獲得了監管機構的批准,也不能保證我們或我們的CDMO能夠按照FDA、EMA或其他類似的外國監管機構可以接受的
規格生產批准的產品,以足夠的數量生產它,以滿足產品可能推出的要求,或滿足未來的潛在需求。這些
任何挑戰都可能推遲臨牀試驗的完成,需要過渡臨牀試驗或重複一項或多項臨牀試驗,增加臨牀試驗成本,推遲我們候選產品的批准,損害商業化努力,
增加我們的商品成本,並對我們的業務、財務狀況、運營結果和前景產生不利影響。
66
目錄表
如果我們候選產品的任何第三方製造商無法擴大我們候選產品的生產規模,和/或提高其製造的
產品良率,則我們製造產品的成本可能會增加,商業化可能會推遲。
為了生產足夠數量的產品以滿足臨牀試驗的需求,如果獲得批准,我們可能開發的候選產品隨後將實現商業化,我們的第三方製造商將被要求在保持產品質量的同時增加產量和優化製造工藝。向更大規模生產的過渡可能會被證明是困難的。此外,如果我們的第三方製造商無法優化其製造流程以提高我們候選產品的產品良率,或者如果他們無法在保持產品質量的同時增加我們候選產品的產量,則我們可能無法滿足臨牀試驗的需求或市場需求,這可能會降低我們的盈利能力,並對我們的業務和運營結果產生實質性的不利影響。
我們依賴第三方供應商提供我們製造過程中使用的關鍵原材料,以及用於管理GH001的汽化設備,我們預計將依賴第三方供應商提供管理GH002和GH003所需的設備,其中一些是我們唯一的供應來源,失去這些第三方供應商或他們無法向我們供應足夠的原材料或醫療設備可能會損害我們的業務。
我們依賴我們的CDMO從第三方供應商那裏購買必要的材料,以生產我們的臨牀試驗候選產品。我們沒有,也不希望就這些原材料的商業生產達成任何
協議,我們也不希望對我們的CDMO獲取生產我們的候選產品所需的原材料的過程或時間有任何控制。此外,雖然我們已經開始為GH001開發專有的氣霧劑輸送設備,但我們目前從圖特林根的單一第三方製造商Storz&Bickel購買了用於管理GH001的蒸發設備。我們與這樣的第三方製造商沒有
商業供應協議。由於製造商需要更換第三方原材料或醫療器械供應商,候選產品、其原材料組件或管理我們的產品進行持續臨牀試驗所需的任何設備的供應出現重大延誤,都可能會大大推遲我們臨牀試驗、產品測試以及潛在的監管部門對我們候選產品的批准。此外,如果我們未來的製造商或我們無法購買這些原材料來商業化生產獲得監管批准的任何候選產品,或者如果我們無法購買或製造用於管理任何候選產品的醫療器械,我們候選產品的商業發佈將被推遲或出現供應短缺,這將削弱我們從銷售候選產品中獲得收入的能力。
此外,對於那些作為我們某些材料的唯一供應來源的第三方供應商,如果我們現有的任何供應商因任何原因停止運營,我們可能沒有安排多餘或第二來源供應任何此類
材料或醫療器械。如果需要,為我們的候選產品中使用的原材料或用於管理我們候選產品的醫療器械建立額外的或替換的供應商可能不會很快完成。如果我們能夠找到替代供應商,則該替代供應商將需要合格,並可能需要額外的監管檢查或批准,這可能會導致
進一步延遲。
我們希望依靠與第三方的合作,對我們可能開發的某些候選產品進行研究、開發和商業化。如果任何這樣的合作都不成功,我們可能無法實現這些候選產品的市場潛力。
我們目前正在尋找第三方合作伙伴,並可能繼續為我們可能開發的某些候選產品的研究、開發和商業化尋找合作伙伴。我們可能的合作伙伴包括大中型製藥公司、地區性和全國性製藥公司、生物技術公司和學術機構。如果我們與任何第三方達成任何此類安排,我們可能會
共享或有限地控制我們的合作者用於開發或潛在商業化我們可能尋求與其開發的任何候選產品的資源的數量和時間。我們能否從與商業實體的這些
協議中獲得收入,將取決於我們的合作者成功履行這些協議中分配給他們的職能的能力。我們無法預測我們參與的任何合作的成功與否。
67
目錄表
涉及我們的研究計劃或我們可能開發的任何候選產品的合作,會給我們帶來以下風險:
|
•
|
合作者通常在決定他們將應用於這些合作的努力和資源的數量和時間方面有很大的自由裁量權;
|
|
•
|
合作者可能無法正確獲取、維護、強制執行或捍衞與我們的候選產品或研究計劃相關的知識產權或專有權利,或者可能使用我們的專有信息以使我們面臨潛在的訴訟或其他與知識產權相關的訴訟,包括挑戰我們知識產權的範圍、所有權、有效性和可執行性的訴訟;
|
|
•
|
合作者可能擁有或共同擁有涵蓋我們與其合作產生的產品候選或研究計劃的知識產權,在這種情況下,我們可能沒有將此類知識產權或此類產品候選或研究計劃商業化的專有權。
|
|
•
|
我們可能需要我們的合作者的合作,以強制或保護我們貢獻的或從我們的合作中產生的任何知識產權,而這些知識產權可能不會提供給我們;
|
|
•
|
合作者可能會控制與監管機構的某些交互,這可能會影響我們獲得和維護監管部門對我們候選產品的批准的能力;
|
|
•
|
合作者和我們之間可能發生糾紛,導致我們的候選產品或研究計劃的研究、開發或商業化的延遲或終止,或者導致
昂貴的訴訟或仲裁,分散管理層的注意力和資源;
|
|
•
|
合作伙伴可以根據臨牀試驗結果、合作伙伴戰略重點的變化或可用資金或外部因素(例如轉移資源或創建競爭優先級的收購),決定不對我們開發的任何候選產品進行開發和商業化,也可以選擇不繼續或續訂開發或商業化計劃;
|
|
•
|
合作者可以推遲臨牀試驗,為臨牀試驗計劃提供資金不足,停止臨牀試驗或放棄候選產品,重複或進行新的臨牀試驗,或要求新的候選產品配方進行臨牀測試;
|
|
•
|
如果合作者認為
有競爭力的產品更有可能成功開發,或者可以以比我們的更具經濟吸引力的條款進行商業化,則合作者可以獨立開發或與第三方開發直接或間接與我們的候選產品或研究計劃競爭的產品;
|
|
•
|
合作者可能會在沒有他們參與的情況下限制我們研究、開發或商業化某些產品或技術;
|
|
•
|
擁有一個或多個候選產品的營銷和分發權的合作者可能沒有投入足夠的資源來營銷和分銷這些候選產品;
|
|
•
|
在我們的合作中發現的情況下,我們可能會失去某些有價值的權利,包括如果我們經歷控制權的變更;
|
|
•
|
協作者可能向我們的技術或產品候選授予再許可,或進行控制權變更,而再被許可人或新所有者可能決定將合作引向不符合我們最佳利益的方向;
|
68
目錄表
|
•
|
合作者可能會破產,這可能會大大推遲我們的研究或開發計劃,或者可能導致我們失去與我們的產品、候選產品或研究計劃有關的
合作者的寶貴技術、訣竅或知識產權;
|
|
•
|
我們合作者的關鍵人員可能會離開,這可能會對我們與合作者高效合作的能力產生負面影響;
|
|
•
|
合作可能需要我們產生短期和長期支出,發行稀釋我們股東權益或擾亂我們管理和業務的證券;
|
|
•
|
如果我們的合作者沒有履行我們與他們協議下的義務,或者如果他們終止了我們與他們的合作,我們可能無法按計劃開發候選產品或將其商業化。
|
|
•
|
協作可能需要我們根據我們無法完全控制的預算分擔開發和商業化成本,而我們未能分擔此類成本可能會對協作或我們分享協作產生的收入的能力產生不利影響;
|
|
•
|
合作可全部終止或與某些候選產品或技術有關,如果終止,可能會導致需要額外資金以進一步開發或商業化適用的候選產品或技術;以及
|
|
•
|
協作協議可能不會以最有效的方式或根本不會導致候選產品的開發或商業化。如果我們現在或未來的合作伙伴參與
業務合併,在此類合作下繼續追求和重視我們的開發或商業化計劃可能會被推遲、減少或終止。
|
在尋求適當的合作方面,我們可能會面臨激烈的競爭。最近生物技術和製藥公司之間的業務合併導致潛在合作者的數量減少。此外,談判過程既耗時又複雜,我們可能無法及時、以可接受的條件談判合作,甚至根本無法談判。如果我們無法做到這一點,我們可能不得不縮減我們尋求合作的候選產品的開發
,減少或推遲其開發計劃或我們的一個或多個其他開發計劃,推遲其潛在的商業化或縮小任何銷售或營銷活動的範圍,或者增加我們的支出並自費進行開發或商業化活動。如果我們選擇增加我們的支出來為我們自己的開發或商業化活動提供資金,我們可能需要獲得
額外的資本,這些資本可能無法以可接受的條款提供給我們,或者根本無法獲得。如果我們沒有足夠的資金,我們可能無法進一步開發候選產品或將它們推向市場併產生產品收入。
如果我們進行合作以開發任何候選產品並可能將其商業化,如果我們或我們的協作者選擇不行使根據協議授予的權利,或者如果我們或我們的協作者無法將候選產品成功集成到現有運營和公司文化中,則我們可能無法實現此類交易的好處。未能根據我們與當前或未來合作伙伴的協議開發候選產品並將其商業化,可能會阻止我們收到此類協議下的未來付款,這可能會對我們的收入產生負面影響。此外,如果我們與任何協作者的協議終止,我們對該協作者授權給我們的技術和知識產權的訪問可能會受到限制或完全終止,這可能會推遲我們利用協作者的技術或知識產權繼續開發我們的候選產品
,或者要求我們完全停止開發這些候選產品。我們還可能發現更難找到合適的替代合作伙伴或吸引新的合作伙伴,我們的發展計劃可能會被推遲,或者我們在商業和金融界的形象可能會受到不利影響。本“第3項.關鍵信息-D風險因素”部分中描述的與產品開發、監管審批和商業化相關的許多風險也適用於我們的合作者的活動,對我們的合作者的任何負面影響都可能對我們產生不利影響。
69
目錄表
我們未來可能會收購企業或產品,或者結成戰略聯盟,但我們可能沒有意識到這種收購或聯盟的好處。
我們可能會收購更多的業務或產品,與第三方結成戰略聯盟或建立合資企業,我們認為這些將補充或擴大我們現有的業務。如果我們收購市場或技術前景看好的企業,如果我們不能成功地將它們與我們現有的運營和公司文化相結合,我們可能無法實現收購這些企業的好處。我們在開發、製造和營銷因戰略聯盟或收購而產生的任何新產品時,可能會遇到許多困難,延遲或阻止我們實現預期收益或增強我們的業務。我們不能保證,在任何此類收購之後,我們將實現預期的協同效應,從而證明交易是合理的。
與員工事務相關的風險,管理我們的業務和運營
我們嚴重依賴我們的執行官、首席顧問和其他人,失去他們的服務將對我們的業務造成重大損害。
我們的成功取決於,而且很可能繼續取決於我們是否有能力聘用和留住現任行政人員、主要顧問和其他人員。失去他們的服務
可能會阻礙我們實現研發和商業化目標。我們不為我們的任何高管或其他員工提供“關鍵人物”保險。
我們在生物技術和製藥行業的競爭力取決於我們能否吸引和留住高素質的管理、科學和醫療人員。我們行業
近年來管理人員流失率很高。更換高管或其他關鍵員工可能很困難,而且可能需要較長的時間,因為我們行業中擁有成功開發、獲得監管批准並將產品商業化所需的技能和經驗的個人數量有限
。
從這個有限的人才庫中招聘的競爭非常激烈,考慮到眾多製藥和生物技術公司之間對類似人員的競爭,我們可能無法以可接受的條件招聘、培訓、留住或激勵這些額外的關鍵員工。我們還面臨着從大學和研究機構招聘科學和臨牀人員的競爭。
我們依靠顧問和顧問,包括科學和臨牀顧問,幫助我們制定我們的研發和商業化戰略。我們的顧問和
顧問可能受僱於其他實體,並可能根據與這些實體簽訂的諮詢或諮詢合同作出承諾,這可能會限制他們對我們的可用性。如果我們無法繼續吸引和留住高素質人才,我們開發和商業化候選產品的能力將受到限制。
我們只有有限的員工來管理和運營我們的業務。如果我們無法招聘或保留足夠的人員,則我們可能無法
實現我們的運營目標。
截至2023年12月31日,我們有49名員工,我們的大部分開發工作仍外包給顧問、CMO和CRO,旨在優化現金利用並以高效的方式管理和運營我們的業務。我們不能確保我們能夠僱傭和/或保留足夠的人員來開發GH001、GH002和GH003或其他潛在的候選產品,或運營我們的業務和/或實現我們原本尋求實現的所有目標。
我們的員工、獨立承包商、顧問、合作者和CRO可能從事不當行為或其他不當活動,包括不遵守監管標準和要求,這可能會給我們造成重大責任並損害我們的聲譽。
我們面臨員工、獨立承包商、顧問、合作者和CRO可能從事欺詐行為或其他非法活動的風險。這些當事人的不當行為
可能包括故意、魯莽和/或疏忽的行為或向我們披露違反以下規定的未經授權的活動:
70
目錄表
|
•
|
監管機構,包括要求向監管機構報告真實、完整和準確信息的法律;
|
|
•
|
製造標準;
|
|
•
|
由類似的外國監管機構制定和執行的聯邦和州醫療欺詐和濫用法律法規以及類似的法律法規;以及
|
|
•
|
要求準確報告財務信息或數據的法律。
|
受這些法律約束的活動還包括不當使用或歪曲在臨牀試驗過程中獲得的信息,在我們的非臨牀研究或臨牀試驗中製造欺詐性數據,或非法挪用產品材料,這可能導致監管制裁和嚴重損害我們的聲譽。並非總是能夠識別和阻止不當行為,我們為發現和防止此類活動而採取的預防措施可能無法有效控制未知或未管理的風險或損失,或保護我們免受因未能遵守此類法律、標準或法規而引起的政府調查或其他行動或訴訟。此外,我們還面臨這樣的風險,即某人或政府可能會指控此類欺詐或其他不當行為,即使沒有發生。如果對我們提起任何此類訴訟,而我們未能成功為自己辯護或維護我們的權利,這些訴訟可能會對我們的業務和運營結果產生重大影響,包括施加民事、刑事和行政處罰、損害賠償、罰款、交還、誠信
監督和報告義務、可能被排除在美國參與Medicare、Medicaid和其他聯邦醫療保健計劃、合同損害、聲譽損害、利潤減少和未來收益以及
削減我們的業務。其中任何一項都可能對我們的業務運營能力和我們的運營結果產生實質性的不利影響。
我們希望擴大我們的組織,因此,我們可能會在管理我們的增長方面遇到困難,這可能會擾亂我們的運營。
我們預計我們的員工數量和業務範圍將大幅增長,特別是在監管事務和銷售、營銷和分銷領域,
並支持我們的上市公司運營。為了管理這些增長活動,我們必須繼續實施和改進我們的管理、運營和財務系統,擴大我們的設施,並繼續招聘和培訓更多合格的人員。我們的管理層可能需要投入大量精力來管理這些增長活動。此外,我們預期的增長可能需要我們搬遷到愛爾蘭的另一個地理區域。由於我們的管理團隊在管理具有如此預期增長的公司方面的經驗有限,我們可能無法有效地管理我們業務的擴張或搬遷、留住關鍵員工或確定、招聘和培訓更多合格的
人員。我們無法有效地管理我們業務的擴展或搬遷,可能會導致我們的基礎設施薄弱,導致操作錯誤、失去業務機會、員工流失以及剩餘員工的生產率下降
。我們的預期增長還可能需要大量的資本支出,並可能將財政資源從其他項目中轉移出來,例如開發現有的和更多的候選產品。如果我們不能
有效地管理我們的預期增長,我們的支出可能會比預期增加得更多,我們的創收能力可能會降低,我們可能無法實施我們的業務戰略,包括我們的
候選產品的成功商業化。
我們的業務受到與國際業務相關的經濟、政治、監管和其他風險的影響。
我們的業務受到與開展國際業務相關的風險的影響。因此,我們未來的業績可能會受到各種因素的影響,包括:
|
•
|
經濟疲軟,包括通貨膨脹,或政治不穩定,特別是在外國經濟和市場;
|
|
•
|
不同和不斷變化的監管要求、價格控制和補償制度;
|
|
•
|
可能會減少對我們知識產權的保護;
|
71
目錄表
|
•
|
難以遵守多個法域的不同、複雜和不斷變化的法律、條例和法院系統,以及難以遵守各種外國法律、條約和條例;
|
|
•
|
法規和海關、關税和貿易壁壘的變化;
|
|
•
|
貨幣匯率和貨幣管制的變化;
|
|
•
|
特定國家或者地區政治、經濟環境的變化;
|
|
•
|
貿易保護措施、進出口許可要求或政府採取的其他限制行動;
|
|
•
|
税法變化的負面後果,包括對税法的解釋;
|
|
•
|
在國外居住或旅行的員工遵守税收、就業、移民和勞動法;
|
|
•
|
在勞工騷亂比美國和歐洲經濟區更普遍的國家,勞動力的不確定性;
|
|
•
|
與人員配置和管理國際業務有關的困難,包括不同的勞資關係;
|
|
•
|
因地緣政治行動造成的業務中斷,包括戰爭和恐怖主義,地震、颱風、洪水和火災等自然災害,或新冠肺炎大流行、流行病、傳染病爆發或類似事件等大流行病;以及
|
|
•
|
網絡攻擊在頻率、複雜性和強度上都在增長,而且越來越難以發現。
|
如果在愛爾蘭或世界各地發生大流行、流行病、傳染病爆發或類似事件,我們的業務可能會受到不利影響。由於醫院資源對疫情或其他因素的優先順序,此類事件可能會推遲我們的臨牀試驗的登記,如果隔離阻礙患者流動或
中斷醫療服務,一些患者可能不願登記參加我們的試驗或無法遵守臨牀試驗方案,這將推遲我們進行臨牀試驗或發佈臨牀試驗結果的能力,並可能推遲我們獲得監管批准和將我們的候選產品商業化的能力。此外,這種
疫情可能會影響主要政府機構的運作,如FDA、EMA或其他類似的外國監管機構,這可能會推遲我們任何或所有候選產品的開發或審批過程。
大流行、流行病、傳染病爆發或類似事件的傳播也可能導致我們的供應商無法及時或根本無法交付零部件或原材料。此外,醫院可能會減少人員配備,減少或推遲某些治療,以應對疫情。此類事件可能導致一段時間的業務中斷和運營減少,或者醫生和醫療提供者可能不願參與我們的臨牀試驗,其中任何一項都可能對我們的業務、財務狀況和運營結果產生重大影響。最後,這種性質的持續爆發還可能導致與本文以及我們其他公開申報文件中描述的我們的行業和業務相關的風險變得更加重大。嚴重的大流行、流行病、傳染病爆發或類似事件也可能導致廣泛的健康危機,可能對全球經濟和金融市場造成不利影響,導致經濟低迷,可能影響我們的業務、財務狀況和運營結果。
此外,在2021年底和2023年,隨着俄羅斯在烏克蘭-俄羅斯邊境集結了大量軍事地面部隊和支持人員,以及2022年2月俄羅斯入侵烏克蘭,歐洲與俄羅斯和美國與俄羅斯之間的緊張局勢升級。作為迴應,北大西洋公約組織(NATO)向東歐,包括立陶宛,部署了更多的軍事力量,拜登政府宣佈了對俄羅斯的某些制裁。入侵烏克蘭,以及美國、北約、歐盟、英國和其他國家和組織對俄羅斯或烏克蘭的官員、個人、地區和行業已經採取或未來可能採取的報復措施,包括實施新的更嚴厲的制裁,造成了全球安全擔憂,可能導致地區衝突,否則將對地區和全球經濟產生持久影響,任何或所有這些措施都可能擾亂我們的供應鏈,對我們的候選產品進行正在進行和未來的臨牀試驗的能力產生不利影響。對我們在受這些發展影響的任何地區將我們的產品商業化的能力造成不利影響
(有待監管部門批准),並對我們以有利條件或根本不能籌集資金的能力產生不利影響。此外,以色列和哈馬斯之間持續不斷的軍事衝突自2023年10月以來不斷升級
,加劇了全球安全擔憂,對本公司也有類似的潛在影響。
72
目錄表
2022年8月,美國眾議院議長南希·佩洛西不顧中國政府的反對,訪問了臺灣。隨後,中國政府在該地區進行了軍事演習,並對臺灣實施了某些進出口禁令。我們用於GH001的專有氣霧劑輸送裝置中的大量組件都是在中國生產的,如果中國與臺灣的關係繼續惡化,這可能會擾亂我們的供應鏈,對我們正在進行的和未來對我們的候選產品進行臨牀試驗的能力產生不利影響,和/或對我們的產品商業化能力產生不利影響
(有待監管部門批准)。
與我們計劃的國際業務相關的這些風險和其他風險可能會對我們實現盈利業務的能力產生重大不利影響。
我們的電信或IT系統或我們的合作者、CRO、第三方物流或其他服務提供商、分銷商、供應商或其他承包商或顧問的網絡攻擊或其他故障可能會導致信息被盜、數據損壞以及我們的業務運營嚴重中斷或不可用。
我們、我們的合作者、我們的CRO、第三方物流和服務提供商、分銷商、供應商以及其他承包商和顧問利用IT系統和網絡來處理、傳輸和存儲與我們的業務活動相關的電子信息。如果我們的隱私、數據保護或信息安全措施(或處理我們敏感信息的任何第三方的隱私、數據保護或信息安全措施)不足或因第三方行為、員工或承包商的錯誤、瀆職、惡意軟件、系統錯誤、軟件錯誤或我們產品中的缺陷、欺詐、流程故障或其他原因而被破壞,第三方使用被盜或
推斷的憑據訪問員工帳户、計算機惡意軟件、病毒、垃圾郵件、網絡釣魚攻擊或其他手段,以及故意攻擊和嘗試未經授權訪問計算機系統和網絡,或者
有人未經授權訪問敏感信息,包括個人身份信息或受保護的健康信息,或者如果我們遭受勒索軟件或高級持續威脅攻擊,或者如果報告或
認為發生了上述任何情況,我們的聲譽和業務可能會受到損害,我們可能會產生與補救和實施額外安全措施相關的鉅額成本,我們可能會招致重大責任和經濟損失,並且
將受到監管審查、調查、訴訟、訴訟和處罰。雖然我們到目前為止還不知道有任何此類系統故障、事故或安全漏洞,但如果發生此類事件並導致我們的運營中斷,
可能會導致我們的藥物開發計劃發生實質性中斷。這些威脅對我們、我們的合作伙伴和我們的CRO、第三方物流和服務提供商、分銷商、供應商和其他承包商和顧問的系統和網絡的安全,以及我們數據的機密性、可用性和完整性構成了風險。不能保證我們將成功地防止網絡攻擊或成功地減輕其影響。同樣,
不能保證我們的合作者、CRO、第三方物流提供商、分銷商以及其他承包商和顧問將成功保護我們存儲在其系統上的臨牀和其他數據。任何網絡攻擊、數據泄露、無法訪問或數據破壞或丟失都可能導致違反適用的美國和國際隱私、數據保護和其他法律,並使我們面臨美國聯邦、州和地方監管實體以及國際監管實體的訴訟和政府調查以及
訴訟,從而面臨重大的民事和/或刑事責任。此外,我們的一般責任保險和公司風險
計劃可能不涵蓋我們面臨的所有潛在索賠,並且可能不足以賠償我們可能施加的所有責任;並可能對我們的業務和前景產生實質性的不利影響。例如,我們的任何候選產品的已完成、正在進行或計劃中的臨牀試驗中的臨牀試驗數據丟失
可能會導致我們的開發和監管審批工作的延遲,並顯著增加我們恢復或複製數據的成本。
此外,由於網絡攻擊或其他數據安全漏洞,我們可能會遭受聲譽損害或面臨訴訟或不利的監管行動,並可能產生實施進一步數據保護措施的重大額外費用。
73
目錄表
與我們普通股所有權相關的風險
我們普通股的交易市場流動性相對較差,這可能會限制您出售股票的能力。
自我們首次公開募股以來,我們普通股的交易市場一直相對缺乏流動性。具有深度、流動性和有序性的理想特徵的公開交易市場依賴於任何給定時間有意願的買家和賣家的存在,這種存在取決於買家和賣家的個人決定,而我們或任何做市商都無法控制這種決定。如果一個活躍和流動性強的交易市場不能發展和持續下去,可能會對我們普通股的價格產生重大不利影響。不活躍的市場還可能削弱我們籌集資本以繼續通過未來股票發行為運營提供資金的能力,並可能削弱我們在任何此類交易中以我們的股票作為對價收購其他公司或技術的能力。
我們普通股的市場價格在歷史上一直是波動的,未來可能會繼續波動,可能會因為我們
控制之外的因素而波動,您可能會失去全部或部分投資。
上市的新興製藥和藥物發現和開發公司的證券價格一直波動很大,未來可能會保持很高的波動。在過去,我們的普通股價格曾經歷過這樣的波動。我們普通股的市場價格可能會因許多風險因素而出現大幅波動,其中一些因素是我們無法控制的,包括以下
:
|
•
|
我們、戰略合作伙伴或競爭對手的測試和臨牀試驗的陽性或陰性結果;
|
|
•
|
未能解除或重大延遲解除我們在IND中提出的針對GH001的研究的臨牀擱置,或與監管部門批准我們的候選產品相關的其他不利發展;
|
|
•
|
延遲與我們的GH001、GH002和GH003候選產品或任何未來候選產品的開發或商業化相關的戰略合作關係;
|
|
•
|
以不被認為對我們有利的條款進入戰略關係;
|
|
•
|
競爭對手的技術創新或商業治療引進;
|
|
•
|
政府法規和醫療保健支付制度的變化;
|
|
•
|
關於專有權的發展,包括專利和訴訟事項;
|
|
•
|
公眾對我們的任何GH001、GH002和GH003候選產品或任何未來候選產品的商業價值或安全性的關注;
|
|
•
|
使用美布福寧(5-甲氧基-N,N-二甲基色胺,或5-甲氧基二甲基-DMT)作為醫療手段的負面宣傳或公眾認知;
|
|
•
|
融資或其他公司交易,或未能獲得融資或進行其他公司交易;
|
|
•
|
證券或行業分析師發表研究報告或評論;
|
|
•
|
我公司普通股在納斯達克全球市場(以下簡稱納斯達克)的交易量;
|
|
•
|
我們、我們的高級管理人員和董事或我們的股東出售我們的普通股,或者預期未來可能發生這種出售;
|
|
•
|
製藥行業或整個經濟的一般市場狀況;
|
|
•
|
美國、英國或歐盟因大流行或類似事件而出現的一般經濟、政治和市場狀況以及整體市場波動;以及
|
|
•
|
其他事件和因素,其中許多是我們無法控制的。
|
74
目錄表
這些以及其他市場和行業因素可能會導致市場價格和對我們證券的需求大幅波動,無論我們的實際經營業績如何,這可能會限制或
阻止投資者隨時出售其普通股,否則可能會對我們普通股的流動性產生負面影響。此外,製藥公司經歷了極端的價格和數量波動,這些波動往往與這些公司的經營業績無關或不成比例,包括新冠肺炎疫情的結果。
我們的高管、董事和某些重要股東將繼續擁有我們大量的普通股,因此,
可能能夠對我們行使控制權,包括股東投票的結果。我們的某些董事和高級管理人員持有其中一名股東的權益,這些股東可能與我們或您的權益不同。
截至2023年12月31日,我們的高級管理人員、董事、5%的持有人及其關聯公司總共實益擁有我們全部已發行普通股的約89.6%,其中包括我們董事會主席弗洛裏安·舍恩哈廷持有的28.5%。因此,這些各方可能能夠決定所有需要股東批准的事項。例如,這些股東可能能夠對我們的業務施加控制,包括重大的公司行動,如合併、安排計劃、出售我們幾乎所有的資產,以及選舉、連任和罷免董事。這可能會阻止或阻止主動收購我們的普通股的提議或要約,或您可能認為符合您最佳利益的其他此類控制權變更。這羣股東的利益可能並不總是與您的利益或其他股東的利益一致
,他們的行為可能會促進他們的最佳利益,而不一定是那些在未來購買普通股的人,包括為他們的普通股尋求溢價,並可能影響我們的
普通股的現行市場價格。
欲瞭解有關我們的主要股東及其關聯實體的更多信息,請參閲“項目7.大股東和關聯方交易--A大股東”。
我們從來沒有支付過現金股利,也沒有預期支付任何現金股利,我們支付股息、回購或贖回普通股的能力,
受到法律的限制。
我們從未宣佈或支付我們普通股的現金股息,也不預期在可預見的未來支付任何普通股股息。未來是否派發股息
將由我們的董事會在考慮我們的財務狀況、經營結果、資本要求、合同限制、一般商業條件和我們的董事會認為相關的其他因素後自行決定,並遵守適用的法律,包括2014年愛爾蘭公司法(修訂後)(本文稱為愛爾蘭公司法),其中要求愛爾蘭公司的可分配準備金等於或
高於建議股息的金額。可分配準備金是指以前未用於分配或資本化的公司累計已實現利潤減去之前未在資本減少或重組中註銷的累計已實現虧損。此外,我們不能支付任何股息,除非我們的淨資產不少於我們的催繳股本加上不可分配準備金的總和,並且股息不會使我們的淨資產低於該總和。不可分配準備金包括本公司的未命名資本(實際上是其股票溢價和資本贖回準備金)和本公司累計未實現利潤(如以前未被任何資本化使用)超過本公司累計未實現虧損(如先前未在資本減少或重組中註銷)的金額。
除非本公司從其業務活動中創造足夠的可分配儲備,否則創建該等可分配儲備將涉及減少公司的股票溢價賬户或其他未命名資本賬户,這將需要(I)出席股東大會並在股東大會上投票的75%股東的批准,以及(Ii)愛爾蘭高等法院的批准。如果我們不承諾減少資本以創造可分配儲備,根據愛爾蘭法律,在公司從其業務活動中創建足夠的可分配儲備之前,將不允許以股息、股票回購或其他方式進行分配。有關本公司是否有足夠的可分配儲備支付股息的決定,必須參考本公司的“相關賬目”。“相關賬目”是根據愛爾蘭公司法編制的最後一套未綜合年度經審計財務報表或未經審計財務報表,該等財務報表根據愛爾蘭公認的會計慣例“真實而公平地反映”公司的未綜合財務狀況。
75
目錄表
我們打算保留收益,用於我們的業務,在可預見的未來不會支付任何現金股息。因此,在可預見的未來,我們普通股的資本增值(如果有的話)將成為投資者唯一的收益來源。我們董事會的任何派息建議都將取決於許多因素,包括我們的財務狀況(包括結轉虧損)、
運營結果、法律要求和其他因素。在可預見的未來,我們不太可能支付股息或其他分配。
支付的股息可能需要繳納愛爾蘭股息預扣税。
在某些情況下,作為愛爾蘭税務居民公司,我們將被要求從支付給股東的股息中扣除愛爾蘭股息預扣税(目前為25%)。
居住在美國、歐盟國家(愛爾蘭除外)或與愛爾蘭簽署税收協定的其他國家(無論該協定是否已批准)的股東一般不應享受愛爾蘭股息
預扣税,只要股東已提供其經紀人,以便轉發給我們的合格中介或其他指定代理(如果是實益持有的股份),或我們或我們的轉讓代理(如果是持有的股份
直接),並在支付股息前的適當到期日前提交所有必要文件。
如果證券或行業分析師不繼續發佈關於我們業務的研究,或發佈不準確或不利的研究,我們
普通股和交易量可能會下降。
我們普通股的交易市場部分取決於證券或行業分析師發佈的關於我們或我們業務的研究和報告。如果
如果我們下調我們的普通股評級,或發佈有關我們業務的不準確或不利的研究報告,我們的普通股價格可能會下跌。此外,如果我們的經營業績未能達到分析師的預測,
我們的普通股可能會下跌如果這些分析師中的一位或多位停止對我們公司的報道或未能定期發佈有關我們的報告,對我們普通股的需求可能會減少,這可能會導致我們普通股的價格和
交易量下降。
現有股東未來出售我們的證券可能會壓低我們普通股的市場價格。
未來出售大量普通股,或認為將發生此類出售,可能導致普通股的市場價格下跌。截至2023年12月31日, 我們有52,028,145股流通在外的普通股。
我們已向美國證券交易委員會提交了S-8表格的註冊聲明,其中包括根據我們的股權激勵計劃可供未來發行的普通股。當這種註冊聲明仍然存在時
根據該等計劃發行的任何普通股將有資格在公開市場出售,但須遵守證券法第144條(如適用)。我們簽訂了一份註冊權協議,根據該協議,我們
授予我們現有股東的即期、簡式和附帶登記權。公開出售根據這些計劃或現有股東根據登記權協議發行的大量普通股
市場可能對我們普通股的市場價格產生不利影響。這些銷售也可能使我們在未來以我們認為合適的時間和價格發行或出售股票或股票相關證券變得更加困難。如果
如果這些普通股在公開市場上出售,或者如果認為它們將在公開市場上出售,我們普通股的交易價格可能會大幅下跌。有關我們的股權激勵計劃和註冊權的更多信息
見“第六條”。董事、高級管理人員及僱員-B。薪酬-股權激勵計劃”和表4 - 1。
76
目錄表
倘我們因不適用法定優先購買權而增加已發行股本,股東日後可能會被攤薄。另外,
在包括美國在內的某些司法管轄區,股東可能無法行使其優先購買權,即使這些權利尚未被取消。
根據愛爾蘭法律,我們普通股的持有人對於以現金代價發行我們的普通股或授予以現金代價認購我們普通股的權利享有優先購買權,除非該優先購買權在我們的章程(其副本通過引用併入本年度報告作為證物)或我們的
股東在股東大會上的決議或其他方式中全部或部分不適用。在愛爾蘭公司法允許的情況下,我們選擇不在憲法中享有這些優先購買權(自我國憲法通過之日起五年內)。因此,我們的董事會將被允許在憲法通過之日起五年內的任何階段,以非優先股的方式發行最多所有我們的授權但未發行的股本作為現金對價。此外,即使憲法中包含的優先購買權失效(股東在股東大會上沒有續期)或在股東大會上被我們的股東終止,但由於愛爾蘭以外的某些司法管轄區的法律和法規,這些司法管轄區的股東可能無法行使他們的優先購買權,除非我們採取行動登記或以其他方式限定根據該司法管轄區的法律提供的權利。例如,在美國,我們普通股的美國持有者可能無法行使優先購買權,除非證券法下的註冊聲明對行使此類權利後可發行的我們普通股有效,或者
可以豁免美國註冊要求。如果這些司法管轄區的股東無法行使他們的優先購買權,他們的所有權權益將被稀釋。未來發行任何可轉換為沒有優先購買權或不包括優先購買權的股份或債務工具,將導致現有股東的股權被稀釋並減少每股收益,從而可能對股票價格產生重大不利影響。
我們可能面臨更大的證券集體訴訟風險。
從歷史上看,證券集體訴訟通常是在一家公司的證券市場價格下跌後對其提起的。這一風險與我們尤其相關,因為製藥和生物製藥公司近年來經歷了顯著的股價波動。如果我們被起訴,可能會導致鉅額成本和管理層注意力和資源的轉移,這可能會損害我們普通股的交易價格。
未來普通股的轉讓(通過轉讓DTC的賬面權益實現的轉讓除外)可能需要繳納愛爾蘭印花税。
通過轉讓存管信託公司(DTC)的賬面權益實現的普通股轉讓不應繳納愛爾蘭印花税,其中普通股
通過DTC直接或通過代表客户通過DTC持有此類股票的經紀人進行交易。但是,如果您持有的是記錄在案的普通股,而不是通過DTC受益的普通股,則任何普通股轉讓都可能
須繳納愛爾蘭印花税(目前的税率為支付的價格或所收購股份的市場價值中較高者的1%)。支付愛爾蘭印花税通常是受讓人的法律義務。印花税可能會上升
可能會對我們的普通股價格產生不利影響有關更多信息,請參見“第10項。附加信息-E.税務-材料愛爾蘭税務後果-印花税。
我們的憲法規定,愛爾蘭法院將是解決除投訴以外的所有股東投訴的唯一論壇
主張根據《證券法》和《交易法》產生的訴因,並且美國聯邦地區法院將是解決任何主張根據
《證券法》和《交易法》。
我們的《憲法》規定,愛爾蘭法院將是解決所有股東投訴的專屬論壇,但根據
《證券法》和《1934年證券交易法》(經修訂)或《交易法》,並且美國聯邦地區法院將是解決任何股東投訴的專屬論壇,該投訴主張根據
《證券法》和《交易法》。這種法院選擇規定可能會限制股東在其認為有利於解決與我們或我們的董事、管理人員或其他員工之間的爭議的司法法院提起索賠的能力,這可能
阻止此類訴訟。其他公司的類似排他性法院規定(包括針對主張《證券法》下訴因的訴訟、起訴或程序的排他性聯邦法院規定)的可撤銷性
組織文件在法律訴訟中受到質疑,法院是否會執行我國《憲法》中的專屬法院規定也存在不確定性。此外,我們的股東不能放棄遵守聯邦
證券法及其規定。如果法院發現我們的《憲法》中包含的法院選擇條款在訴訟中不適用或不可執行,我們可能會產生與解決相關的額外費用
在其他司法管轄區的此類行動,這可能會對我們的經營業績和財務狀況產生不利影響。
77
目錄表
對美國民事責任的索賠可能無法對我們強制執行。
我們在愛爾蘭註冊成立,並在愛爾蘭註冊辦事處,目前根據愛爾蘭法律存在。此外,我們董事會和高級管理層的某些成員
非美國居民,我們的全部或大部分資產以及這些人的資產位於美國境外。因此,可能無法在美國向此類人員或我們送達法律程序
或執行美國法院根據美國證券法的民事責任規定對他們或我們作出的判決。因此,投資者可能無法在美國
美國法院對該等人士作出的判決,或執行美國法院對該等人士或我們作出的判決,包括根據美國聯邦證券法的民事責任規定作出的判決。
美國和愛爾蘭目前沒有一項條約規定承認和執行民事和商事判決(仲裁裁決除外)。因此,A
美國法院作出的最終付款判決,無論是否僅依據美國證券法,都不會在愛爾蘭自動得到承認或執行。此外,愛爾蘭法院是否
將受理根據美國或美國任何州的證券法在愛爾蘭對我們或我們的董事或高級管理人員提起的原始訴訟。任何最終和決定性的貨幣判斷,為一個明確的
在美國法院針對我們獲得的金額將被愛爾蘭法院視為訴訟本身的原因,並根據普通法作為債務提起訴訟,因此,只要滿足某些要求,就不需要重審這些問題。是否
根據美國證券法的民事責任條款作出的判決符合這些要求,包括根據此類法律作出的金錢賠償是否構成處罰,這是一個由
法院做出這樣的決定。如果愛爾蘭法院就根據美國判決應支付的金額作出判決,則愛爾蘭判決將通過為此目的通常可用的方法強制執行。這些方法通常允許愛爾蘭法院
規定強制執行方式的裁量權。
因此,美國投資者可能無法針對我們或我們的高級管理層、董事會或本文中提到的居住在愛爾蘭或美國以外國家/地區的某些專家執行在美國法院獲得的任何民商事判決,包括根據美國聯邦證券法作出的判決。
我們認為,我們在2023納税年度是PFIC,我們預計我們可能在2024年和未來幾年也是PFIC,這可能會使我們普通股的美國投資者面臨嚴重的不利美國聯邦所得税後果。
根據修訂後的1986年《國內收入法》或該法規,我們將在任何課税年度成為PFIC,在對我們的子公司應用某些前瞻性規則後,(1)我們總收入的75%或更多由“被動收入”組成,或(2)我們資產的平均季度價值的50%或更多由產生或為產生“被動收入”而持有的資產組成。被動收入
通常包括股息、利息、某些非主動租金和特許權使用費以及資本收益。根據我們目前的業務、收入、資產以及某些估計和預測,包括我們資產的相對價值,包括基於我們普通股價格的商譽,我們認為,由於我們確認的利息收入(根據PFIC規則,這是被動收入),我們在2023納税年度是PFIC。此外,我們預計將在2024年確認利息收入,因此,我們預計我們很可能在2023年成為PFIC,並可能在未來納税年度成為PFIC。然而,由於我們的PFIC地位是一個實際的年度決定,只有在相關納税年度結束後才能做出決定,因此我們2024年或任何未來納税年度的PFIC地位是不確定的。潛在投資者只有在願意承擔與投資PFIC相關的美國聯邦所得税後果的情況下,才應投資於我們的普通股。
如果我們是美國投資者持有普通股的任何課税年度的PFIC,在美國投資者持有普通股的後續
年中,我們通常會繼續被視為該美國投資者的PFIC,即使我們不再符合PFIC身份的門檻要求。這樣的美國投資者通常將受到不利的美國聯邦所得税後果的影響,包括(1)將出售普通股所獲得的全部或部分收益視為普通收入;(2)對此類收益應用遞延利息費用並收取某些股息;以及(3)某些報告要求。
如果我們的普通股定期在合格的交易所進行交易,可能會進行“按市值計價”的選舉,這將改變PFIC地位的後果。有關進一步討論,請參閲“第10項.附加信息-E.税收-材料美國
聯邦所得税對美國持有者的影響。”
78
目錄表
我們是一家“新興成長型公司”,正在利用降低適用於新興成長型公司的披露要求,這可能會降低我們的普通股對投資者的吸引力。
我們是JOBS法案中定義的“新興成長型公司”,我們打算繼續利用適用於其他非“新興成長型公司”的上市公司的各種報告要求的某些豁免,包括不需要遵守美國2002年薩班斯-奧克斯利法案第404(B)條或薩班斯-奧克斯利法案的審計師認證要求,以及豁免就高管薪酬和股東批准之前未獲批准的任何金降落傘付款進行非約束性諮詢投票的要求。我們可能會利用這些報告豁免,直到我們不再是一家新興的成長型公司。我們將一直是一家新興的成長型公司,直到下列情況中最早的一天:(1)財政年度的最後一天,我們的年度總收入為12.35億美元;(Ii)在我們首次公開募股(IPO)完成五週年之後的財政年度結束;或(Iii)我們被視為“大型加速申報公司”,這要求截至前一年
6月30日,我們由非關聯公司持有的普通股的市值超過7億美元。這是,以及(2)我們在前三年期間發行了超過10億美元的不可轉換債券的日期。投資者可能會發現我們的普通股不那麼有吸引力,因為我們可能會依賴這些豁免。如果一些投資者因此發現我們的普通股吸引力下降,我們的普通股交易市場可能會不那麼活躍,我們普通股的價格可能會更加波動。
作為一家外國私人發行人,我們被允許在公司治理事宜上採用某些與納斯達克公司治理上市標準有很大不同的母國要求。與我們完全遵守公司治理上市標準時相比,這些做法為股東提供的保護可能會更少。
作為一家外國私人發行人,我們被允許遵循某些母國公司治理要求,而不是納斯達克要求國內
美國發行人。遵循我們所在國家的管治常規,使我們能夠在若干企業管治事宜方面遵循愛爾蘭公司法及愛爾蘭公司法,而非適用於美國的要求。
在納斯達克上市的公司為我們的股東提供的保護可能比適用於美國國內發行人的納斯達克規則給予投資者的保護要少。
作為一家外國私人發行人,我們不受《交易法》有關代理聲明的提供和內容的規則和規定的約束。我們的高級職員、董事和校長
股東也不受《交易法》第16條所載的報告和短期利潤回收規定的約束。此外,根據《交易法》,我們無需向SEC提交報告和財務報表,
與根據《交易法》註冊證券的美國國內公司一樣頻繁或及時地披露,根據《交易法》,我們免於向SEC提交季度報告。此外,我們無需遵守法規
儘管我們已自願成立由若干高級職員組成的披露委員會,以監察及審閲本公司作出的披露,但我們仍遵守財務條例,限制選擇性披露重大資料。這些豁免和
寬大處理將減少您可能有資格獲得與美國國內發行人有關的信息和保護的頻率和範圍。
我們打算繼續遵循,或可能在未來選擇遵循(視情況而定)愛爾蘭公司治理要求,以取代納斯達克在以下方面的公司治理要求:
|
•
|
董事上市規則下的多數獨立納斯達克要求;
|
|
•
|
納斯達克上市規則要求,由完全由獨立董事組成的薪酬委員會監督高管薪酬,該委員會受薪酬委員會章程管轄;
|
|
•
|
納斯達克上市規則要求董事被提名人必須由過半數獨立董事或僅由獨立董事組成的提名委員會遴選或推薦;
|
|
•
|
納斯達克上市規則要求法定人數必須至少為33人1/3上市公司普通股流通股的百分比;以及
|
79
目錄表
|
•
|
納斯達克上市規則規定,獨立董事必須定期安排僅有獨立董事出席的會議。
|
此外,納斯達克的公司治理規則要求美國上市公司實施某些股權薪酬計劃和發行普通股時必須徵得股東批准,作為外國私人發行人,我們不需要遵循這些規則。因此,與適用於美國國內發行人的公司治理上市標準相比,我們的股東可能獲得的保護較少。詳情見“項目16G--公司治理”。
我們未來可能會失去外國私人發行人的地位,這可能會導致大量的額外成本和支出。
雖然我們目前符合外國私人發行人的資格,但外國私人發行人身份的確定每年在發行人最近完成的第二個財政季度的最後一個工作日進行,因此,將在2024年6月30日對我們進行下一次確定。
在未來,如果我們未能達到在相關確定日期保持我們的外國私人發行人地位所需的要求,我們將失去外國私人發行人身份。例如,如果我們50%以上的證券由美國居民持有,超過50%的高管或董事會成員是美國居民或公民,我們可能會失去外國私人發行人的身份。
根據美國證券法,我們作為美國國內發行人的監管和合規成本可能遠遠高於我們作為外國私人發行人的成本。如果我們不是外國私人發行人,我們將被要求向美國證券交易委員會提交美國國內發行人表格的定期報告和註冊聲明,這些表格在某些方面比外國私人發行人提供的表格更詳細和廣泛。此外,我們可能無法依賴美國證券交易所向外國私人發行人提供的某些公司治理要求的豁免,例如上述豁免,以及與徵集委託書相關的程序性要求的豁免。
作為一家上市公司,我們已經並將在未來產生顯著的額外成本,我們的管理層將需要投入大量的時間和精力來履行我們的公開報告義務。
作為一家上市公司,我們已經產生並將在未來產生與我們作為私人公司時相比的顯著額外的法律、會計和其他費用。此外,
與公司治理和公開披露相關的新的和不斷變化的法律、法規和標準,包括《多德-弗蘭克華爾街改革和消費者保護法》及其頒佈和即將頒佈的規則和法規,以及根據薩班斯-奧克斯利法案、就業法案和美國證券交易委員會和納斯達克的規則和法規,給上市公司帶來了不確定性,增加了我們的董事會和管理層必須
致力於遵守這些規則和法規的成本和時間。我們已經並打算繼續投資資源,以遵守不斷變化的法律、法規和標準,這項投資已經並可能繼續增加法律和財務合規成本,並已經並可能繼續轉移管理層的時間和注意力,使其不再專注於創收活動。
愛爾蘭法律與美國現行法律不同,對我們證券持有人的保護可能較少。
在美國以外司法管轄區提起的訴訟中,您可能難以執行根據美國證券法在美國法院獲得的判決。尤其是,
如果您希望根據美國證券法在愛爾蘭提起訴訟,愛爾蘭法院可能會考慮:
|
•
|
它沒有管轄權;
|
|
•
|
這不是進行這類訴訟的適當場所;
|
|
•
|
適用愛爾蘭法律衝突規則,美國法律(包括美國證券法)不適用於您與我們或我們的董事和高級管理人員之間的關係;或
|
80
目錄表
|
•
|
美國證券法是刑法性質的,違反了愛爾蘭的公共政策,不應由愛爾蘭法院執行。
|
根據美國聯邦或州證券法的民事責任條款,可能無法在愛爾蘭執行在美國獲得的對我們不利的法院判決。此外,愛爾蘭法院是否會承認或執行美國法院根據美國聯邦或州證券法的民事責任條款對我們或我們的董事或高級管理人員做出的判決還存在一些不確定性。我們獲悉,美國目前與愛爾蘭沒有就相互承認和執行民商事判決作出規定的條約。因此,任何美國聯邦或州法院基於民事責任支付款項的最終判決,無論是否僅基於美國聯邦或州證券法,都不會自動在愛爾蘭強制執行。
只有在滿足以下一般要求的情況下,愛爾蘭法院才會執行對我們不利的判決:
|
•
|
根據愛爾蘭法律衝突規則,美國法院必須對特定被告擁有管轄權(被告接受管轄權將滿足本規則);和
|
|
•
|
判決必須是最終的和決定性的,判決必須是最終的和不可更改的,在宣佈它的法院。
|
即使判決受到上訴或上訴待決,判決也可以是終局和決定性的。但是,如果根據適用法律提出上訴的效果是暫停執行判決,則在此期間判決可能不能在愛爾蘭提起訴訟。在缺席的情況下作出的最終判決是否是最終和決定性的,還有待確定。愛爾蘭法院也可以出於下列原因之一拒絕執行符合上述要求的美國法院的判決:
|
•
|
判決不是為了一筆確定的錢;
|
|
•
|
這一判決是由Fragacy;獲得的
|
|
•
|
在愛爾蘭執行判決將違反自然或憲法正義;
|
|
•
|
這一判決違反了愛爾蘭的公共政策,或涉及某些美國法律,而這些法律將不會在愛爾蘭執行;或
|
|
•
|
根據《愛爾蘭高級法院規則》第11號命令,愛爾蘭法院不能通過在愛爾蘭或愛爾蘭境外以面交送達的方式獲得對執行程序中的判定債務人的管轄權。
|
作為一家愛爾蘭公司,我們受愛爾蘭公司法管轄,該法案在某些實質性方面不同於一般適用於美國公司和股東的法律,其中包括與董事相關的高管和高管交易以及股東訴訟方面的差異。同樣,愛爾蘭公司的董事和高級管理人員的責任通常只對公司負責。愛爾蘭公司的股東一般沒有針對公司董事或高級管理人員提起個人訴訟的權利,只有在有限的情況下才可以代表公司行使這種訴訟權利。因此,我們證券的持有者可能比在美國司法管轄區註冊的公司的證券持有者更難保護他們的利益。
你還應該知道,愛爾蘭法律不允許任何形式的法律程序,直接等同於美國的集體訴訟。有關您作為股東的權利的更多信息,請參見“第10項.其他信息--B.組織章程”。
81
目錄表
作為一家愛爾蘭上市有限公司,某些資本結構決策需要股東批准,這可能會限制我們管理資本結構的靈活性。
根據愛爾蘭法律,我們的法定股本可以通過我們股東的普通決議增加,一旦我們的憲法授權或我們股東的普通決議授權,董事可以發行最高金額等於
授權但未發行股本的新普通股,而無需股東批准。此外,除特別規定的例外情況外,愛爾蘭法律授予以現金對價發行股票的現有股東法定優先購買權,但允許股東在我們的憲法中或通過特別決議取消此類法定優先購買權。這種豁免既可以是普遍適用的,也可以是針對特定股份配售的。因此,在愛爾蘭公司法允許的情況下,我們的憲法包含授權董事會發行新股和取消法定優先購買權的條款。
董事發行股票的授權和法定優先購買權的取消都必須至少每五年由股東續簽一次,我們不能保證這些授權總是得到批准,這可能會限制我們發行股票的能力,從而對我們的證券持有人產生不利影響。
我們憲法的條款可能會推遲或阻止第三方收購我們的努力。
我們的章程可以延遲、推遲或阻止第三方收購我們,即使這樣的交易對普通股持有人有利,或者可能對普通股價格產生不利影響。例如,我國憲法的某些規定:
|
•
|
對將在年度股東大會上審議的股東提案和董事提名設定提前通知要求;以及
|
|
•
|
需要我們有權在股東大會上投票的股份的75%投票權的批准,才能修改或廢除我們憲法的任何條款。
|
我們相信,如果這些條款按照適用法律實施,可能會為普通股持有人提供一些保護,使其免受強制或其他不公平收購策略的影響。這些
條款並不是為了讓我們免受收購。然而,即使一些普通股持有人認為要約是有益的,並可能推遲或阻止我們董事會確定符合普通股持有人最佳利益的收購,它們也將適用。其中某些條款還可能阻止或阻止罷免和更換現任董事的嘗試。
此外,愛爾蘭法律的強制性條款可能會阻止或推遲第三方對本公司的收購。例如,愛爾蘭法律不允許愛爾蘭公共有限公司的股東在未經一致同意的情況下以書面同意採取行動。此外,收購我們的努力可能受制於愛爾蘭法律中關於強制出價、自願出價、提出現金要約的要求和最低價格要求的各種條款,以及要求在某些情況下披露普通股權益的實質性收購規則和規則。
愛爾蘭法律與美國現行法律在捍衞不受歡迎的收購提議方面存在差異,可能會使我們的董事會無法
控制與敵意要約人的談判。
在獲得在納斯達克交易普通股的授權後,我們必須遵守1997年愛爾蘭收購委員會法案、2022年愛爾蘭收購規則或愛爾蘭收購規則。根據愛爾蘭收購規則,在我們的董事會收到可能導致要約的要約或有理由相信要約即將發出的情況下,我們的董事會不得采取任何可能挫敗對我們普通股的要約的行動,但某些例外情況除外。在要約過程中或在董事會有理由相信要約即將或可能即將要約的任何較早時間,禁止(I)發行股票、期權、受限股份單位或可轉換證券,(Ii)公司贖回或回購證券
(Iii)重大收購或處置,(Iv)簽訂非正常業務過程中的合同,或(V)尋求替代要約以外的任何可能導致要約受挫的行動。與在美國司法管轄區註冊的公司相比,這些條款可能會使我們的董事會無法控制與敵意要約人的談判
。
82
目錄表
愛爾蘭收購規則的實施可能會影響某些方收購我們普通股的能力。
根據愛爾蘭收購規則,如果收購普通股是為了增加收購方及其協議方對普通股的總持有量,而普通股佔公司投票權的30%或更多,則收購方及其協議方在某些情況下將被要求(除非得到愛爾蘭收購小組的同意)以不低於收購方或其協議方在過去12個月中為普通股支付的最高價格的價格對已發行普通股提出要約。這一要求也將由持有(連同其協議方)
普通股的人收購普通股觸發,如果收購的效果是在12個月內使該人的投票權百分比增加0.05%,則該普通股佔公司投票權的30%至50%。在獲得授權在納斯達克上交易我們的普通股之後,根據愛爾蘭收購規則,某些單獨的演唱會派對被推定為一致行動。我們的董事會及其相關家族成員、相關信託基金和“受控公司”被推定為與持有我們20%或以上股份的任何公司股東一致行動。這一推定的應用可能導致任何協奏方和/或我們的董事會成員獲得更多我們的證券的能力受到限制,包括根據任何高管激勵安排的條款。我們可以就這一推定的適用性和對在不要求提出強制性要約收購我們所有股票的情況下獲得更多證券的能力的限制與愛爾蘭收購委員會進行磋商,儘管我們無法提供任何保證,愛爾蘭收購委員會是否會推翻這一推定。關於適用於我們的某些收購條款的説明,見“第10項.補充信息--B.組織備忘錄和章程--愛爾蘭法律的反收購條款--愛爾蘭收購規則和實質性收購規則”。因此,愛爾蘭收購規則的適用可能會限制我們的某些股東和董事收購我們的普通股的能力。
愛爾蘭《2023年第三國交易篩選法》的實施可能會影響某些方收購我們的普通股或
收購我們的某些資產的能力
愛爾蘭《2023年第三國交易篩選法》或《外國直接投資法》在愛爾蘭引入了外國直接投資篩選制度,預計將於2024年第二季度生效。《外國直接投資法》將要求涉及以下方面的某些收購和/或投資交易的當事方:(1)愛爾蘭公司和一系列部門(包括關鍵的衞生基礎設施)的商業機構;以及(2)收購/投資在歐洲經濟區和瑞士以外的國家或第三國設立的各方,必須將此類交易通知愛爾蘭企業、貿易和就業部部長,以便事先獲得批准。然後,部長將確定相關交易是否對愛爾蘭的安全或公共秩序構成風險,並可在認為適當的情況下阻止交易完成或以其他方式對交易施加條件。如果部長有合理理由相信某項交易對愛爾蘭的安全或公共秩序構成風險,則部長也可以審查他/她沒有收到通知的交易,無論這種交易是否已經完成。《外國直接投資法》還將根據《歐盟投資審查條例》(條例(EU)2019/452),加強與歐盟其他成員國的信息共享和合作。因此,《外國直接投資法》的適用可能會推遲或限制歐洲經濟區和瑞士以外的某些第三方收購我們的普通股或我們的某些資產的能力。
與我們對財務報告的控制相關的風險
未能對財務報告保持適當和有效的內部控制可能會阻礙我們準確報告財務結果或防止欺詐的能力。因此,股東可能會對我們的財務和其他公開報告失去信心,這將損害我們的業務和我們普通股的交易價格。
確保我們有足夠的內部財務和會計控制程序,以便我們能夠及時編制準確的財務報表,這是一項昂貴且耗時的工作,需要經常重新評估。我們對財務報告的內部控制是一個旨在為財務報告的可靠性和根據公認會計原則編制財務報表提供合理保證的過程。根據《薩班斯-奧克斯利法案》第404條,我們必須維持對財務報告的內部控制,並評估和報告這些控制的有效性。這項評估包括披露管理層在財務報告內部控制方面發現的任何重大弱點。我們管理層的結論是,由於存在重大弱點,截至2023年12月31日的年度,我們對財務報告的內部控制是並將繼續有效的。更多信息見“項目15.控制和程序--B.管理層財務報告內部控制年度報告”。
83
目錄表
對我們的內部控制實施任何適當的更改可能會分散我們的官員和員工對日常業務運營的注意力,需要花費大量成本來修改我們現有的流程,
並且需要大量時間才能完成。然而,這些變化可能無法有效補救已發現的重大弱點或維持我們內部控制的充分性,而任何未能補救已發現的重大弱點、未能維持足夠或因此而無法及時編制準確財務報表的情況,都可能增加我們的運營成本並損害我們的業務。此外,投資者認為我們的內部控制不足,或我們無法及時編制準確的財務報表,這可能會損害我們普通股的價格。
我們在編制和審核截至2021年、2021年、2022年和2023年的財務報表時,發現了財務報告的內部控制存在重大缺陷,我們可能還會發現其他重大缺陷。如果我們對這些重大弱點的補救措施沒有效果,或者如果我們經歷了更多的重大弱點,或者我們在未來未能保持有效的內部控制系統,我們準確或及時報告我們的財務狀況或運營結果的能力可能會受到不利影響。
我們的管理層負責建立和維護對財務報告的充分內部控制。財務報告內部控制是一個旨在根據國際財務報告準則(IFRS)對財務報告的可靠性和財務報表的編制提供合理保證的過程。根據《薩班斯-奧克斯利法案》第404條,我們必須每年提交一份由我們的管理層提交的報告,其中包括從我們首次公開募股的註冊聲明生效日期起的第一個完整會計年度開始,我們對財務報告的內部控制的有效性。這項評估必須包括披露我們管理層在財務報告內部控制方面發現的任何重大弱點。“重大缺陷”是指財務報告的內部控制存在缺陷或缺陷的組合,使得我們的年度財務報表的重大錯報有合理的可能性無法得到及時防止或發現。
在編制和審查我們截至2021年、2022年和2023年12月31日的年度財務報表時,我們發現了我們對財務報告的內部控制存在重大弱點。我們認定,我們缺乏足夠數量的訓練有素、具有適當會計知識、培訓和經驗的專業人員來:
|
•
|
設計和維護正式的會計政策、程序和對財務報表公允列報的控制;以及
|
|
•
|
設計和維護對賬户對賬、日記帳分錄和財務報表的編制和審查的控制,包括對信息技術系統保持適當的職責分工和控制。
|
這些控制缺陷並未導致年度或中期財務報表出現重大錯報。然而,這些控制缺陷中的每一個都可能導致我們的
賬目或披露的錯誤陳述,這將導致我們的年度或中期財務報表的重大錯誤陳述,這是無法防止或檢測到的,因此,我們確定這些控制缺陷構成重大弱點。
我們預計會產生額外的成本來彌補這些缺陷,主要是人員成本、信息技術成本和外部諮詢費。我們不能向您保證,我們迄今採取的任何措施以及未來可能採取的行動都足以彌補導致我們財務報告內部控制中這些重大缺陷的控制缺陷,也不能防止或避免未來潛在的重大缺陷
。我們不能向您保證,我們現有的所有重大弱點都已確定,或我們未來不會確定其他重大弱點。
如果我們未能成功建立適當的會計和財務報告基礎設施,我們可能無法及時編制和披露我們的財務報表和其他
要求披露的信息,或無法遵守現有或新的報告要求。任何未能準確及時報告我們的財務業績都可能導致制裁、訴訟、我們的股票從納斯達克退市或其他不利的
後果,這些都可能對我們的業務造成實質性損害。如果我們不能提供可靠的財務報告或防止欺詐,我們的業務和運營結果可能會受到損害,投資者可能會對我們報告的財務信息失去信心。
如果發生上述任何情況,都可能對公眾對我們公司的看法產生負面影響,這可能會對我們的股價產生負面影響。此外,我們可能需要在改進我們的內部控制系統和僱用更多人員方面產生額外成本。
84
目錄表
|
第四項。
|
關於該公司的信息
|
|
A.
|
公司的歷史與發展
|
GH Research PLC於2021年3月29日根據愛爾蘭法律註冊為公共有限公司,成為GH Research愛爾蘭有限公司的控股公司。GH Research愛爾蘭有限公司最初於2018年10月16日根據愛爾蘭法律註冊為GH Research Limited。GH Research Limited於2021年3月29日重新註冊為GH Research愛爾蘭有限公司。我們的主要營業地點位於愛爾蘭都柏林道森街2號D02 RY95的Joshua Dawson House,我們的電話號碼是+353 1 437 8334。我們的網站地址是www.ghres.com。我們不會將我們網站上的信息或通過我們網站訪問的信息合併到本年度報告中,您不應
將我們網站上的任何信息或可以通過我們網站訪問的任何信息作為本年度報告的一部分。我們需要向美國證券交易委員會或美國證券交易委員會提交報告和其他信息,包括
Form 20-F年度報告和Form 6-K報告。美國證券交易委員會有一個互聯網站:Www.sec.gov其中包含我們以電子方式提交給美國證券交易委員會的報告、委託書和信息聲明以及其他信息。
自2021年1月1日以來,我們的主要支出一直是我們的研發費用,本年度報告的其他部分對此進行了更全面的描述。
根據日期為2021年5月27日的換股協議的條款,GH Research愛爾蘭有限公司的所有股東將其持有的每股股份交換為GH Research PLC的普通股,其股東權利與他們持有的GH Research愛爾蘭有限公司的股份相同,因此,GH Research愛爾蘭有限公司成為GH Research PLC的全資子公司(本文稱為
公司重組)。
根據GH Research PLC於2021年6月24日的股東決議案,我們完成(A)將(I)5,923,079股每股面值0.01美元的A系列優先股轉換為5,923,079股每股面值0.01美元的普通股;(Ii)將25,379,047股B系列優先股每股面值0.01美元轉換為25,379,047股每股面值0.01美元的普通股;及(B)將現有普通股按每股面值0.01美元合併為每股面值0.025美元的普通股,因此,緊接美國證券交易委員會宣佈首次公開發售的註冊聲明生效後,本公司的法定股本為1,000,000,000美元,分為40,000,000,000股面值0.025美元的普通股(在此統稱為股份合併)。
|
B.
|
業務概述
|
我們是一家臨牀階段的生物製藥公司,致力於改變精神和神經疾病的治療方法。我們最初的重點是開發我們的小説和專有產品 美布替寧(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)治療難治性抑鬱症患者,或TRD。美布福寧被世界衞生組織(WHO)國際藥典和藥物製劑專家諮詢小組選為5-MeO-DMT的國際非專利名稱(INN)。
我們的產品組合目前包括我們專有的吸入型美布福汀候選產品GH001,我們專有的靜脈注射美布福汀候選產品GH002,以及我們專有的鼻腔用美布福汀候選產品GH003。雖然GH001目前是通過第三方生產的蒸發設備交付的,但我們正在開發一種專有的氣霧劑交付設備。我們已經完成了GH001的兩個第一階段健康志願者臨牀試驗(GH001-HV-101和GH001-HV-103),在這些試驗中,觀察到通過吸入給予GH001在所調查的單劑量水平和IDR中耐受性良好,受試者內劑量在一天內增加。我們還完成了針對TRD患者的1/2期臨牀試驗(GH001-TRD-102)。根據在臨牀試驗第一階段觀察到的臨牀活動,我們認為,根據蒙哥馬利-奧斯伯格抑鬱評定量表(MADRS)的測量,在某些患者中,由超快的精神活動效應(通常在幾秒鐘內)和強烈而短暫的精神活動體驗(通常為5至30分鐘)
驅動,單次注射GH001有可能誘導超快速的
緩解。根據在試驗第二階段觀察到的臨牀活動,我們認為,與單劑GH001相比,在受試者內劑量增加的IDR中使用GH001可以進一步提高MADRS緩解率
。
85
目錄表
患有嚴重抑鬱障礙或MDD的患者,如果對治療沒有足夠的反應,顯然會有更難治療的抑鬱症,通常被稱為TRD。TRD沒有一致的定義,但在臨牀試驗的背景下,使用了至少一種藥物療法、一種藥物療法和一種心理療法或兩種藥物療法的失敗,後一組被監管機構稱為TRD患者
。由美國國家精神衞生研究所資助的一項名為STAR*D的合作研究顯示,大約37%的MDD患者儘管採取了兩個治療步驟,但仍未達到緩解抑鬱的效果
。根據這一結果,我們估計在美國和歐洲大約有900萬TRD患者將接受治療。TRD比非TRD MDD具有更大的經濟和社會成本。
例如,TRD患者的直接醫療成本大約是非TRD MDD患者的兩到三倍。
儘管TRD有大量未得到滿足的醫療需求和大量的患者,但在美國只有兩種專門批准用於TRD的藥物療法:埃斯氯胺酮,以及奧氮平和氟西汀的組合,分別是一種抗精神病和抗抑鬱藥物,這兩種藥物在臨牀試驗中都顯示出混合的療效,並與潛在的副作用有關。除藥物療法外,精神療法也用於治療TRD,但涉及的時間較長,而且在可獲得性、管理和有效性方面存在很大差異。多種形式的軀體幹預,如經顱磁刺激(RTMS)、電休克治療(ECT)、迷走神經刺激(VNS)和腦深部刺激(DBS)是TRD的另一種常見治療方法,儘管這些治療通常被認為是侵入性的和/或繁瑣的,而且支持長期治療益處的數據有限。儘管TRD的治療方法很多,但仍有大量未得到滿足的醫療需求,需要新的治療方法使更多的患者得到快速和持久的緩解,並減輕相關的社會和經濟負擔。
美布替寧是一種5-羥色胺能迷幻藥,是一類精神活性藥物,主要通過對5-羥色胺或5-羥色胺受體的激動劑作用,導致意識狀態改變。來自學術研究的體內和體外研究表明,美蟾素在5-HT1A和5-HT2A受體上都有活性,這兩種受體在中樞神經系統不同區域的神經元中都有表達。與其他色胺相比,美布替寧對5-HT1A受體亞型具有更高的親和力,並且在各種神經遞質受體類型中的分佈模式更具選擇性,例如裸子菌素和N,N-二甲基色胺,或DMT,這兩種色胺對5-HT2A受體亞型具有更強的親和力,而受體結合譜選擇性較低。
我們的目標是為TRD患者開發併成功商業化新的專有美布福汀療法,這些療法高效、起效快、耐受性好、給藥方便。我們相信,我們的美布福寧候選產品的各種不同特點,包括我們的主要候選產品GH001,將使我們能夠實現這些目標。
首先,我們認為GH001有很高的誘發強烈精神活動效應或高峯體驗或PE的傾向,我們認為這可能與TRD患者超快誘導持久緩解有關。其次,我們認為,即使在很短的時間間隔內,例如1小時內重新給藥,臨牀上也不會對美布替寧產生耐受性,因此,精神活性作用不會減弱。再加上精神活動效應的超快起效和持續時間短,這一方面允許在IDR中重新給藥GH001,其中可以在一天內多次給藥。在我們針對TRD患者的1/2期試驗(GH001-TRD-102)的第二階段試驗中,我們調查了與單次給藥相比,這種IDR是否能夠增加TRD患者的PES發生率,以及這是否會導致超快速緩解率的增加,同時避免不必要的高劑量。第三,我們認為,與其他研究的用於治療精神障礙的5-羥色胺能精神活性藥物相比,精神活性藥物的超快速起效和持續時間短可能賦予其顯著的便利性和可行性優勢,在這些藥物中,最初的精神活性效應起效較慢,可以持續幾個小時。我們進一步相信,這些功能和由GH001引起的精神活性
效應允許使用GH001劑量,而不需要在治療前進行漫長而複雜的患者準備,在體驗期間只需要有限的醫療保健提供者的支持,並且不需要在體驗之後進行頻繁的心理整合工作。預計GH002、GH003和潛在的其他候選產品將遵循類似的治療範例。
86
目錄表
我們的管道
我們正在開發我們的甲氧基-N,N-二甲基色胺(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)候選產品GH001、GH002和GH003,用於我們的精神和神經疾病重點領域。
With our lead product candidate GH001, we have completed two Phase 1 clinical trials in healthy volunteers (GH001-HV-101 and GH001-HV-103) and a Phase 1/2 trial in TRD (GH001-TRD-102). We are
currently recruiting a multi-center, randomized, double-blind, placebo-controlled Phase 2b trial (GH001-TRD-201) in TRD. We expect to recruit approximately 80 patients for this trial across approximately 20 sites in seven European countries. The
primary objective is to determine the efficacy of our single-day IDR of GH001 compared with placebo in improving depressive symptoms as assessed by the mean change from baseline in MADRS at the end of the 7-day double-blind phase. The double-blind
phase is followed by a 6-month open-label extension phase where all patients can receive treatment with the GH001 IDR as-needed, based on the patient’s clinical status. We expect completion of the double-blind phase of this trial in the third quarter
of 2024, with availability of top-line data from that phase expected in the third or the fourth quarter of 2024. We are also currently recruiting Phase 2a proof-of-concept clinical trials of GH001 for the treatment of patients with BDII and a current
depressive episode (GH001-BD-202) and for the treatment of patients with PPD (GH001-PPD-203). As announced in November 2023, both trials have been recruiting slower than previously projected, in part due to the closure, for business reasons, of one
of the two sites activated in each trial. Subsequently, we have implemented measures to support recruitment of both trials, including the addition of further clinical trial sites. Based on the effect of these measures, we now expect completion of the
PPD trial (GH001-PPD-203) and availability of top-line data in the third quarter of 2024. In the BDII and a current depressive episode trial (GH001-BD-202), we need to further assess the impact of these measures on recruitment before we can provide
an updated timeline. We currently purchase the vaporization device with which we administer GH001 from a third-party manufacturer, and are using this device in our Phase 2b trial in TRD (GH001-TRD-201) and in our Phase 2a trials in BDII and a current
depressive episode (GH001-BD-202) and PPD (GH001-PPD-203), which are all performed in Europe. In 2021, we, with a contract development and manufacturing organization, or CDMO, initiated the development of a proprietary aerosol delivery device for
GH001 for use in our pivotal clinical trial program and for commercial use. Based on our development progress, we submitted an investigational new drug application, or IND, for GH001, delivered with this proprietary device, to the U.S. Food and Drug
Administration, or FDA, in August of 2023. The IND-opening study was expected to be a Phase 1 clinical pharmacology trial in healthy volunteers (GH001-HV-106), designed to support bridging to the clinical data generated with the third-party device we
currently use in our clinical trials. 2023年9月,在30天法定IND審查期結束時,FDA通知我們,它已將我們的IND置於臨牀暫停狀態,並於2023年10月正式
臨牀暫停函,FDA要求我們提供(i)一項非齧齒類動物吸入毒理學研究和一項大鼠吸入毒理學研究,與先前完成的呼吸道組織學結果相關
大鼠吸入毒理學研究,(ii)額外的器械設計驗證信息和(iii)我們的研究者手冊更新。我們正在努力響應FDA的要求,包括啟動所要求的非臨牀
問題研究此外,我們已要求與FDA舉行會議,討論FDA在臨牀暫停函中反饋的某些方面。我們計劃在2024年第二季度提供關於IND回覆提交的更新。在
並行,以減輕對 GH 001計劃, 我們還在進行準備工作,以便有可能在
開展1期健康志願者臨牀藥理學試驗(GH 001-HV-106) 歐洲
GH 002是我們的第二個mebufotenin候選產品,通過專有的靜脈注射方法配製給藥。我們最近完成了一項隨機、雙盲、
在健康志願者中進行的安慰劑對照、劑量範圍探索臨牀藥理學試驗(GH 002-HV-105)。
GH 003是我們的第三種mebufotenin候選產品,通過專有的鼻內給藥方法配製給藥。GH 003目前處於臨牀前開發階段。
我們預計在我們的精神和神經系統疾病的重點領域開發GH 002和GH 003。
我們的戰略
我們的使命是開發新的專利mebufotenin(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)療法,以誘導精神病患者的超快速和持久緩解,
神經系統疾病為了實現這一使命,我們戰略的關鍵要素包括:
87
目錄表
|
•
|
推進GH 001,我們的可吸入mebufotenin產品候選人,通過臨牀開發,監管批准和商業化,如果批准,用於治療TRD;
|
|
•
|
在BDII和當前抑鬱發作和PPD的概念驗證試驗中研究GH 001;
|
|
•
|
評估GH 001在TRD、BDII和PPD以外的精神疾病和神經系統疾病中的其他機會;
|
|
•
|
通過臨牀開發推進我們的靜脈注射mebufotenin候選產品GH 002;
|
|
•
|
推進我們的鼻腔用美布福汀候選產品GH003進入臨牀開發;
|
|
•
|
研究美布替寧的其他給藥系統和給藥途徑;
|
|
•
|
圍繞美布汀擴大我們的知識產權組合;以及
|
|
•
|
通過建立內部商業化基礎設施和建立有選擇的合作伙伴關係,使我們的產品組合價值最大化。
|
我們的市場機遇
我們正在開發我們的Mebufotenin(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)候選產品,用於治療一系列精神和神經疾病,最初的重點是存在大量未得到滿足的醫療需求的TRD。我們的目標是開發併成功地將起效快、高效、耐受性好和使用方便的新療法商業化。
MDD和TRD概述
MDD是一種嚴重的心理健康狀況,其特徵是反覆發作,一天中的大部分時間,幾乎每一天都會出現悲傷、失去興趣和其他加劇的負面情緒。MDD與嚴重的發病率、生活質量下降和預期壽命縮短有關。世界衞生組織(WHO)估計,截至2015年,全球有超過3.2億人患有MDD,並得出結論認為,MDD是全球殘疾的最大貢獻者,佔所有殘疾人口的7.5%。
不幸的是,現有的抗抑鬱治療的療效受到起效緩慢的限制,而且很大一部分患者即使在進行了多種治療後也沒有充分的反應。STAR*D研究是由美國國家精神衞生研究所資助的一項合作研究,旨在評估四種不同治療步驟的有效性,其中包括藥物治療和心理治療
方法,在可推廣的抑鬱症患者羣體中進行。約翰·拉什和合著者在《美國精神病學雜誌》上發表的一篇關於STAR*D研究的報告總結了所有四個連續治療步驟的急性和長期結果。這項研究報告了緩解率和應答率,緩解率定義為16項臨牀醫生評定的抑鬱症症狀快速調查表(QDS-C16)的得分等於或小於5,應答率定義為在進入治療步驟後QDS-C16至少減少50%。這項STAR*D研究發現,第一、第二、第三和第四治療步驟的緩解率分別約為37%、31%、14%和13%,而那些在所有治療步驟中確實緩解的患者的平均緩解時間延長至約5至7周。在STAR*D研究中,大約33%的患者儘管接受了四個治療步驟,但沒有得到緩解。
88
目錄表
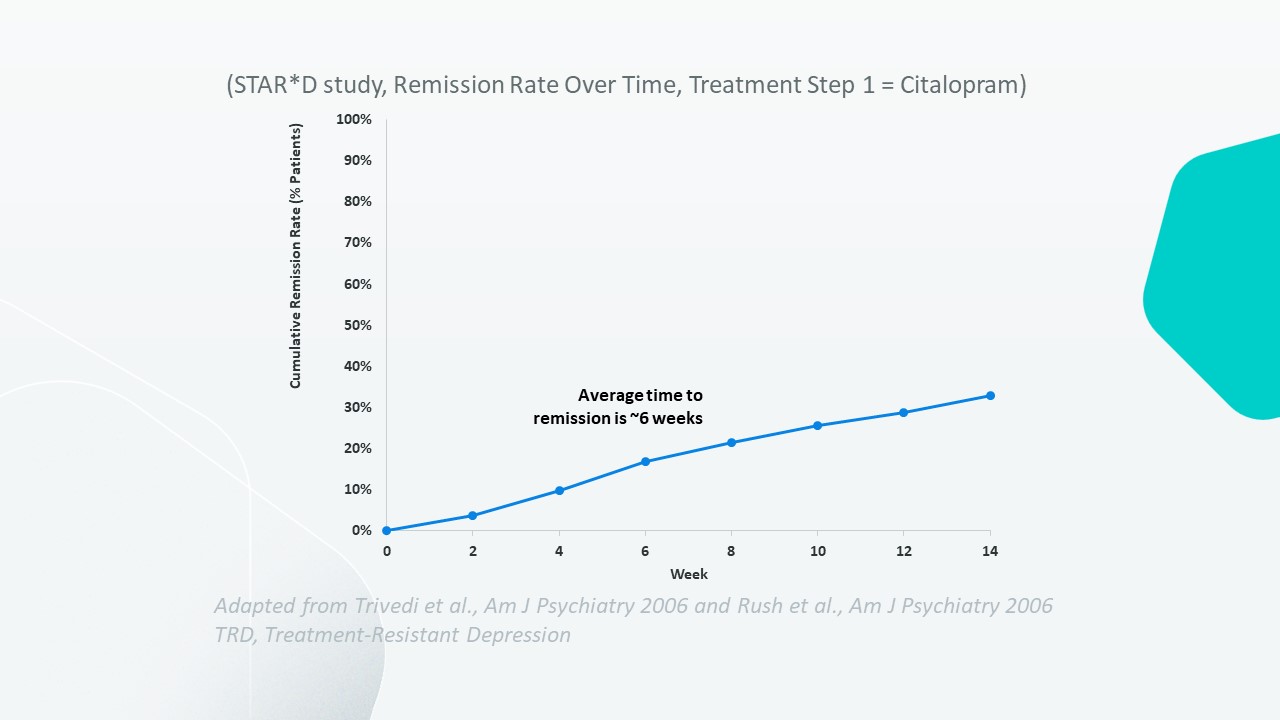
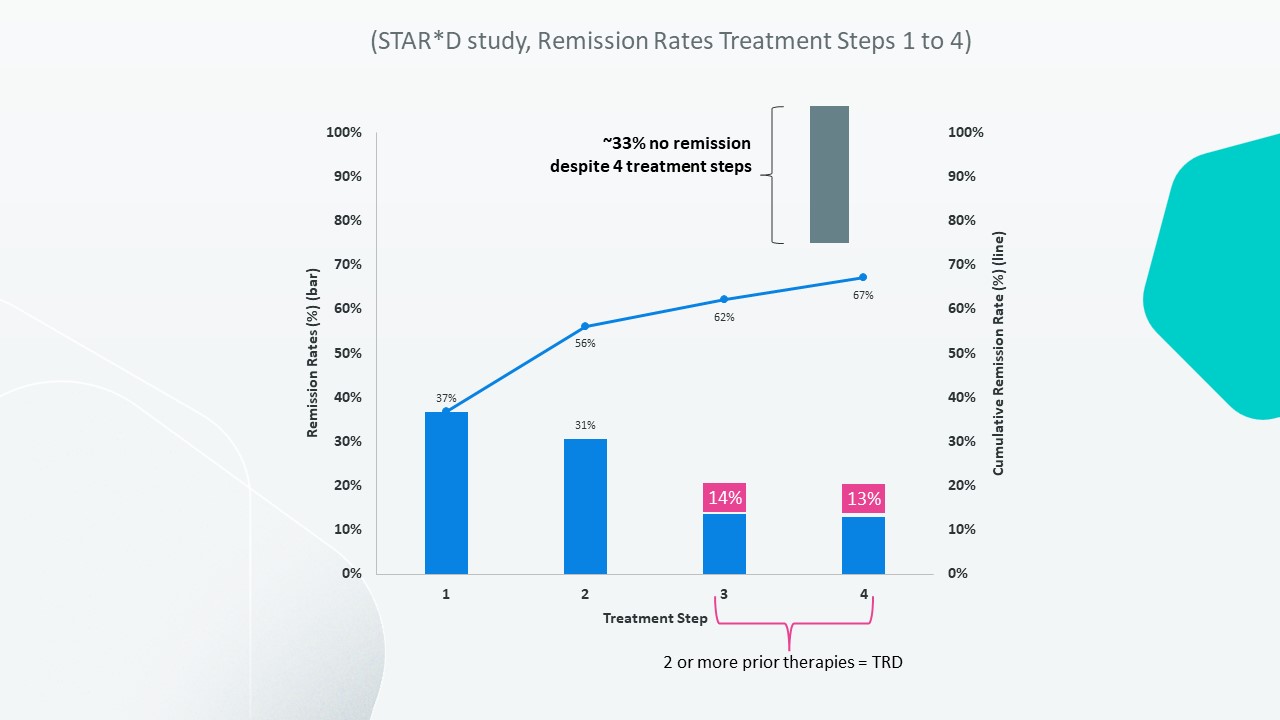
89
目錄表
對適當治療沒有充分反應的MDD患者顯然有更難治療的抑鬱症,通常被稱為TRD。TRD沒有達成共識的定義,但在臨牀試驗的背景下,使用了至少一種藥物療法、一種藥物療法和一種心理療法或兩種藥物療法的失敗,後者被監管當局稱為TRD患者。STAR*D
研究表明,大約37%的MDD患者儘管採取了兩個治療步驟,但仍無反應。根據這一結果,以及根據美國國家精神衞生研究所估計的美國和歐洲約4,800萬MDD患者的數量和發表在歐洲神經精神藥理學上的一篇文章,根據國家精神衞生研究所的數據,約50%的MDD患者接受藥物治療或藥物治療和心理治療,我們估計美國和歐洲約有900萬TRD患者將接受治療。
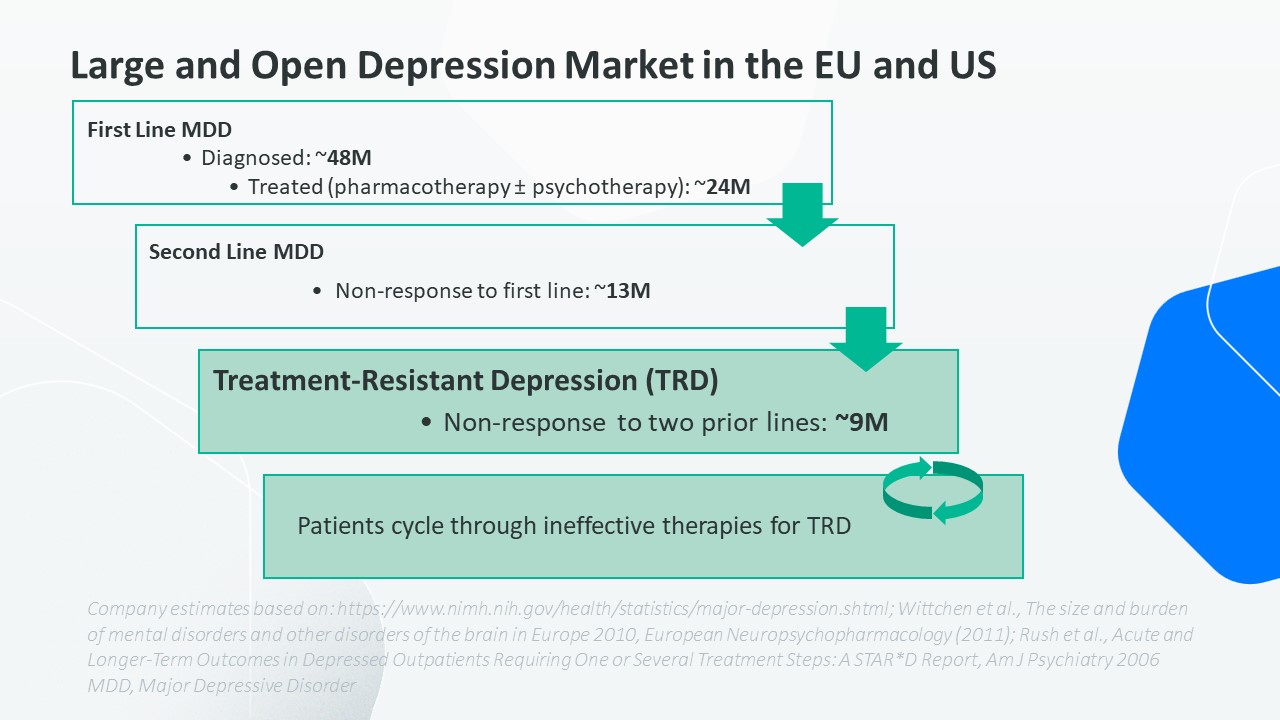
儘管患者人數眾多,但在美國只有兩種藥物療法被專門批准用於治療TRD:埃斯氯胺酮和奧氮平與氟西汀的組合,後者分別是一種抗精神病和抗抑鬱藥物。
經濟和社會負擔
根據世界經濟論壇和哈佛大學公共衞生學院的一份報告,2010年,全球與精神疾病相關的成本,包括與診斷、治療和護理相關的直接成本,以及與生產力和收入損失相關的間接成本,估計為2.5萬億美元,預計到2030年,成本將飆升至6萬億美元,其中約三分之二的總成本來自間接成本。
根據發表在《臨牀精神病學雜誌》上的一篇文章,截至2010年,僅MDD一項的經濟負擔估計就超過2000億美元。其中約47%可歸因於直接成本,
2005至2010年間,MDD的總經濟負擔增加了約22%。
對於每個患者,TRD比非TRD MDD有更大的經濟和社會成本。TRD患者往往無法完成日常工作,工作效率較低,失業率較高。
他們也更有可能獲得殘疾或福利福利,據報道,他們有更高的共生率,包括糖尿病、貧血和高血壓。2018年進行並發表在《情感障礙雜誌》上的研究表明,TRD患者一生中至少有一次試圖自殺的比例可能高達30%。
90
目錄表
根據發表在《情感障礙雜誌》上的一份報告,與非TRD MDD患者相比,TRD患者的直接醫療費用大約高出兩到三倍。TRD患者
的處方費用更高,需要看更多的醫生,住院率也更高。根據發表在《臨牀精神病學雜誌》上的一篇文章,他們的住院次數平均是非TRD MDD患者的兩倍,他們的住院時間平均延長了約36%。
抑鬱症的現有治療方法
由於抑鬱症有一系列不同的生物、社會、心理、環境、遺傳和壓力相關的決定因素,其中許多是共同發生的,治療選擇是廣泛的,而且往往是組合在一起的。目前的藥物和非藥物治療僅對部分MDD患者有效,許多患者沒有反應或復發。臨牀醫生缺乏高質量的證據來證明某些療法是否適用於某些患者,並且經常依賴於宂長的反覆試驗方法,即在患者復發或出現困難的副作用時進行糾正。
藥物療法
目前有五大類抗抑鬱藥可供選擇。它們是:
|
1.
|
選擇性5-羥色胺再攝取抑制劑或SSRIs;
|
|
2.
|
5-羥色胺-去甲腎上腺素再攝取抑制劑或SNRIs;
|
|
3.
|
非典型抗抑鬱藥;
|
|
4.
|
單胺氧化酶抑制劑,或MAOIs;以及
|
|
5.
|
三環類抗抑鬱藥,或TCA。
|
抗抑鬱藥經常用於抑鬱症的一線和二線治療,在這一點之後也可以使用。正如STAR*D研究中觀察到的那樣,只有大約37%的患者在最初的抗抑鬱藥物治療後獲得緩解。隨後的治療方案的失敗率大幅增加。例如,根據STAR*D研究,一旦患者之前的兩種治療失敗,只有大約14%的患者在第三次抗抑鬱治療中獲得緩解,只有不到5%的患者保持緩解一年。
目前主要類別的抗抑鬱藥都有顯著的附加限制,包括起效慢、治療依從率低和各種副作用。根據STAR*D的研究,對於最常使用的抗抑鬱藥物來説,緩解者的平均緩解時間延長到大約五到七週。依從性水平很低,在初級和精神科護理中,只有不到50%的人在三個月後沒有堅持他們開出的抗抑鬱藥物。
在一線抗抑鬱藥物無反應或部分反應後,有效指導臨牀決策的證據有限。推薦的治療方法包括優化當前抗抑鬱藥的劑量或改用其他抗抑鬱藥。建議通過聯合不同藥理類別的抗抑鬱藥或輔以替代藥物來解決部分反應或無反應,主要使用非典型抗精神病藥物,但也包括情緒穩定劑、抗驚厥藥、甲狀腺激素和興奮劑。
抗精神病藥物,如奧氮平、奎硫平和阿立哌唑,通常在抗抑鬱藥缺乏顯著療效時用作輔助治療。儘管奧氮平和氟西汀被批准聯合治療TRD,每天給藥一次,但研究表明,聯合使用抗抑鬱藥和抗精神病藥物可能會產生嚴重的副作用,如體重增加、其他代謝併發症、鎮靜、錐體外系副作用(藥物引起的運動障礙)和QT間期延長(這意味着心臟在兩次搏動之間需要比平時更長的時間進行充電)。
氯胺酮是一種N-甲基-D-天冬氨酸或N-甲基-D-天冬氨酸受體拮抗劑,幾十年來一直用於鎮靜、麻醉和慢性疼痛,目前正被用作TRD的非標籤治療。
氯胺酮的S對映體埃斯氯胺酮通過鼻腔噴霧給藥,並於2019年被FDA批准用於治療TRD。雖然氯胺酮和埃斯氯胺酮治療通常需要頻繁給藥(例如,埃斯氯胺酮每週給藥兩次,然後每週給藥,每次都在醫療監督的受控環境中),雖然這種給藥對付款人來説代價高昂,對患者來説相對負擔較大,但最近患者准入方面的改善和大量未得到滿足的需求現在支持了更廣泛的臨牀採用。
91
目錄表
右美沙芬是另一種NMDA受體拮抗劑,也是sigma-1受體激動劑,與氨基酮和CYP4502D6抑制劑安非他酮聯合口服片劑,於2022年被FDA批准用於治療MDD。
心理治療
心理療法是談話療法的一種形式,通常是輕度MDD患者首選的一線治療方法。心理療法也與藥物療法結合使用,或作為藥物療法的替代品,用於更嚴重的MDD患者或後期治療,包括TRD患者。治療抑鬱症的兩種常用心理療法是認知行為療法(CBT)和人際療法(IPT)。CBT專注於改變消極的思維和行為模式。IPT也評估消極的想法和行為,但僅當它們適用於人際關係和社會功能時。心理治療方法可能對某些人有效,但需要患者投入大量時間,而且在可獲得性、交付和有效性方面存在差異。
軀體療法
接受多個療程治療的嚴重TRD患者通常採用資源密集型軀體療法,如電驚厥治療(ECT)、重複經顱磁刺激(RTMS)、迷走神經刺激(VNS)或腦深部刺激(DBS)。這些療法通常在住院環境中進行。這些治療通常是為對其他治療沒有充分反應的患者保留的,並且被描述為高成本的治療選項,報銷有限。
摘要
MDD是一種嚴重的精神健康問題,發病率很高,生活質量下降,預期壽命縮短,並造成嚴重的經濟和社會負擔。所有這些問題在TRD患者中都更加突出。儘管美國有兩種專門用於治療TRD的藥物療法,但我們認為,目前可用的選擇不足以滿足患有TRD的患者的需求,因此迫切需要一種新的治療方法,以使更多患者快速、持久地緩解。
我們相信,開發一種安全、有效和方便的治療TRD的方法是醫療保健領域最大的未得到滿足的需求和挑戰之一,我們的美布福寧候選產品GH001、GH002和GH003有潛力滿足這一未得到滿足的需求。
雙相情感障礙(BD)
BD是一種以情緒狀態和能量波動為特徵的反覆發作的慢性情感障礙,根據美國國家心理健康研究所的估計和發表在歐洲神經精神藥理學上的一篇文章,在美國和歐洲有超過1000萬人受到影響。將BD與其他情感障礙區分開來的主要特徵是存在反覆發作的躁狂或輕度躁狂發作,這些發作可能與抑鬱發作交替出現。雖然症狀來來去去,但BD通常需要終身治療。
雙相I型障礙,或BDI,定義為出現明顯的躁狂發作,具有一系列表現,包括過度自信、浮誇、健談、極端去抑制、易怒、睡眠需求減少和高度興奮的情緒。雙相II型障礙,或BDII,主要以抑鬱發作為特徵,但交替出現輕躁狂,這是BDI明顯躁狂的一種較温和的形式。根據《精神疾病診斷和統計手冊》(DSM-5)第5版的定義,診斷BDI需要終生出現至少一次躁狂發作,診斷BDII需要至少出現一次躁狂發作,診斷BDII需要出現一次嚴重抑鬱發作。
92
目錄表
雖然輕躁狂症是一種較温和的躁狂形式,但BDII通常不被認為是一種較温和的BDI形式。發表在《普通精神病學檔案》上的關於BD自然病程的研究發現,BDII患者在53.9%的隨訪周內出現症狀,抑鬱症狀出現在50.3%的隨訪周,而BDI患者在47.3%的隨訪周出現症狀,抑鬱症狀出現在31.9%的隨訪周。很明顯,抑鬱症狀在兩種類型的BD中都佔主導地位,但在BDII中最明顯。證據還表明,有相當大比例的BD患者試圖自殺,在有抑鬱症狀的階段和BDII患者中,自殺風險最高。
儘管BDII中抑鬱症狀的疾病負擔很大,但很少有研究關注BDII中抑鬱症的治療,而且只有兩種藥物被FDA特別批准用於這一適應症,即魯米替培酮和奎硫平。然而,這些治療可能會伴隨着明顯的副作用,如嗜睡、頭暈和口乾,它們經常表現出延遲的反應,這可能需要幾周的時間,而且它們總體上有中等的療效。雖然其他治療BDII抑鬱症的方法也在使用,如奧氮平與氟西汀、拉莫三嗪或鋰聯合使用,但它們也存在類似的侷限性。SSRIs的使用也很頻繁,然而同樣只有有限的療效,而且還描述了誘發治療後出現躁狂症或輕躁狂症的額外風險。
總而言之,抑鬱症是BDII患者痛苦的主要原因,目前缺乏安全、有效和快速的藥物來治療這種情況。我們相信,我們的美布汀候選產品GH001、GH002和GH003有潛力滿足這一未得到滿足的需求。
產後抑鬱症(PPD)
根據2018年發表在《精神病學前沿》上的一篇文章,儘管超過50%的女性在分娩後經歷某種形式的情緒低落,但超過15%的女性患有產後抑鬱症,或簡稱PPD,DSM-5定義的一種衰弱障礙是發生在懷孕期間或分娩後4周內的一種主要抑鬱發作。
除了經歷通常與嚴重抑鬱症相關的症狀外,產後抑鬱可能會給受影響的母親、她的嬰兒(S)和她的家人帶來廣泛的負面後果。例如,患有產後抑鬱的女性可能會產生自我傷害或傷害孩子的想法,她們自殺的風險也會增加。
根據2010年發表在《嬰兒行為與發展》上的一篇文章,產後抑鬱可能會進一步導致母親和孩子之間的互動中斷,例如母親和孩子之間更高的脱離行為比率和更低的視覺和語音交流比率。根據2003年發表在《婦女心理健康檔案》上的一篇文章,證據還表明產後抑鬱與兒童發育之間存在關聯,患有產後抑鬱患者的孩子的認知發育受損的風險更大。
產後抑鬱主要通過心理療法或藥物療法進行治療,但由於懷孕和哺乳期間風險-收益比的變化,開始藥物療法的門檻比MDD更高,母乳餵養的母親可能出於一系列擔憂而不願開始藥物治療。
此外,就像在MDD中一樣,SSRIs的療效受到起效緩慢和緩解率低的限制,而且可能會出現顯著的副作用。只有兩種藥理療法是FDA專門批准用於PPD的,Brexanolone和Zuranolone,Brexanolone需要住院並由醫療保健提供者持續監測,需要60小時的輸液,Zuranolone會警告由於中樞神經系統(CNS)抑鬱效應而可能導致的駕駛障礙。
因此,從多個角度來看,PPD的負擔是巨大的,而且缺乏安全、有效、快速和方便的藥物來治療這種情況。我們相信,我們的美布汀
候選產品GH001、GH002和GH003有潛力滿足這一未得到滿足的需求。
我們的解決方案-GH001、GH002和GH003
我們正在開發三種甲氧基-N,N-二甲基色胺或5-甲氧基色胺(5-MeO-DMT)候選產品:GH001、GH002和GH003。我們的主要候選產品GH001是通過專有吸入方法為美布替寧
管理配製的。我們已經調查了單劑量誘導方案和IDR中的GH001給藥情況,在IDR中,同一天最多給出三個遞增劑量的GH001。
93
目錄表
有了GH001,我們已經完成了兩個第一階段的健康志願者臨牀試驗(GH001-HV-101和GH001-HV-103),其中通過吸入給藥觀察到在所調查的單次劑量水平和IDR中耐受性良好。我們還完成了一項針對TRD患者的開放標籤、單臂1/2期臨牀試驗。在這項試驗的第一階段,沒有觀察到嚴重的不良反應或SAE,所有藥物的不良反應或ADRs都是輕微的,並自發消失。根據我們觀察到的臨牀活動,我們還認為,單次服用GH001有可能在某些患者中誘導超快的MADRS緩解。根據在試驗第二階段觀察到的臨牀活動,我們認為,與單劑GH001相比,受試者內劑量在一天內增加的IDR可以進一步提高MADRS緩解率。
我們目前正在招募一項多中心、隨機、雙盲、安慰劑對照的2b期試驗(GH001-TRD-201)。我們預計該試驗的雙盲階段將於2024年第三季度完成,該階段的主要數據預計將於2024年第三季度或第四季度提供。我們目前還在招募GH001的2a期概念驗證臨牀試驗,用於治療患有BDII和當前抑鬱發作的患者(GH001-BD-202)和治療PPD患者(GH001-PPD-203)。正如2023年11月宣佈的那樣,這兩個審判的招聘速度都慢於先前的預測,部分原因是每次審判中激活的兩個網站中的一個因業務原因而關閉。隨後,我們實施了支持招募這兩項試驗的措施,包括增加更多的臨牀試驗地點。根據這些措施的效果,我們現在預計PPD試驗(GH001-PPD-203)
將於2024年第三季度完成並提供主要數據。在BDII和目前的抑鬱發作試驗(GH001-BD-202)中,我們需要進一步評估這些措施對招募的影響,然後才能提供最新的時間表。我們目前從第三方製造商購買了用於管理GH001的蒸發設備,並在TRD(GH001-TRD-201)的2b階段試驗和BDII的2a階段試驗中使用該設備,目前的抑鬱發作(GH001-BD-202)和PPD(GH001-PPD-203)都在歐洲進行。2021年,我們與CDMO合作,啟動了針對GH001的專有氣霧劑輸送設備的開發,用於我們關鍵的臨牀試驗計劃和商業用途。根據我們的開發進度,我們於2023年8月提交了GH001的IND,與該專有設備一起交付。IND開放研究預計將是在
名健康志願者(GH001-HV-106)中進行的一期臨牀藥理學試驗,旨在支持與我們目前臨牀試驗中使用的第三方設備產生的臨牀數據的橋樑。2023年9月,在為期30天的法定IND審查期結束時,FDA通知我們,它已將我們的IND置於臨牀擱置狀態,並在2023年10月,在正式的臨牀擱置函中,FDA要求我們提供(I)一項非齧齒動物物種的吸入毒理學研究,以及
一項額外的大鼠吸入毒理學研究,與之前完成的大鼠吸入毒理學研究的呼吸道組織學結果有關,(Ii)額外的設備設計驗證信息,以及(Iii)更新我們的
調查員手冊。我們正在努力響應FDA的要求,並已啟動了所要求的非臨牀研究。此外,我們已經要求與FDA會面,討論FDA在臨牀擱置信中反饋的某些方面。我們打算在2024年第二季度提供關於IND答覆提交的最新情況。同時,為了減輕對GH 001計劃, 我們還在進行準備工作,有可能在歐洲進行第一階段的健康志願者臨牀藥理學試驗(GH001-HV-106)。
有了我們的第二個候選產品美布福汀GH002,通過專有的靜脈注射方法給藥,我們最近完成了一項針對健康志願者的雙盲、安慰劑對照、隨機、劑量範圍的臨牀藥理學試驗(GH002-HV-105)。在這項試驗中,觀察到GH002耐受性良好,沒有嚴重或嚴重的不良反應。用精神活性效應強度評價的藥效學效應(PD)起效快、持續時間短,且無明顯不良反應。藥代動力學(PK)曲線與精神活性效應(PSE)的超快速曲線相關。
GH 003是我們的第三種mebufotenin候選產品,通過專有的鼻內給藥方法配製給藥。GH 003目前處於臨牀前開發階段。
我們預計在我們的精神和神經系統疾病的重點領域開發GH 002和GH 003。
94
目錄表
我們的Mebufotenin候選產品
吸入型美布福寧候選產品--GH001
摘要
我們的美布福寧鉛(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)候選產品GH001是通過專有吸入方法配製的。對於GH001,我們使用根據當前良好製造規範或cGMP標準生產的合成
開發的藥用級美布替寧自由基料。我們目前正在研究將GH001作為單劑誘導方案和IDR給藥,在IDR中,每天通過吸入給藥多達三個遞增劑量的GH001。我們已經完成了GH001的兩個第一階段健康志願者臨牀試驗(GH001-HV-101和GH001-HV-103),在這些試驗中,通過吸入給藥的GH001在所研究的單劑量水平和IDR中被觀察到耐受性良好。我們還完成了針對TRD患者的開放標籤、單臂1/2期試驗(GH001-TRD-102)。在完成的第一階段中,沒有觀察到SAE,所有ADR都很輕微,都是自發消退的。根據我們觀察到的臨牀活動,我們還認為,單次服用GH001有可能在某些患者中誘導超快的MADRS緩解。根據在試驗第二階段觀察到的臨牀活動,我們相信,與單劑GH001相比,我們的IDR在單日內增加受試者內劑量可以進一步提高MADRS緩解率。作為GH001在TRD中的下一項試驗,我們目前正在招募一項多中心、隨機、雙盲、安慰劑對照的2b期試驗(GH001-TRD-201)。我們目前還在招募2a期概念驗證試驗,在BDII和目前的抑鬱發作
(GH001-BD-202)和PPD(GH001-PPD-203)中使用GH001。
GH001的優勢
TRD是我們開發GH001的領先指標。我們相信,如果獲得批准,GH001可能會為TRD患者的治療提供顯著的好處。我們的目標是實現以下
目標:
|
•
|
最大限度地實現超快和持久的減刑;
|
|
•
|
一次就診初步治療,無需額外強制就診進行心理治療或心理支持;以及
|
|
•
|
再次治療方便且不常見。
|
我們相信,GH001的以下功能將使我們能夠實現這些目標:
|
•
|
誘發巔峯體驗的高傾向:我們認為,GH001具有很高的誘發PE的傾向。這一點很重要,因為我們認為PES
的發生可能與TRD患者超快速誘導持久緩解有關,因此我們認為它可能作為治療效果的一個標記。
|
|
•
|
個體化給藥方案:我們認為,當在很短的時間間隔內(例如1小時)重新給藥時,不會出現臨牀上與美布替寧相關的耐受性發展,因此精神活動效應不會減弱。再加上精神活動效應的超快速起效和持續時間短,這一方面允許在IDR中重新給藥GH001,其中可以在一天內多次給藥,例如,在最多2小時內最多給藥三次。我們目前正在研究這種IDR是否可以在避免不必要的高劑量使用的同時,在TRD患者中導致高PES率和高超快緩解率。我們認為,在同一天內優化治療非常重要,這不僅是因為患者直接受益,還因為可以及早發現反應不足的患者,而不需要宂長的反覆試驗方法,在此期間,患者經常面臨無效治療的潛在副作用。
|
|
•
|
治療方案:我們認為,與其他被研究用於治療精神障礙的5-羥色胺能精神活性藥物相比,超快速起效和持續時間短的精神活性藥物可能會賦予顯著的便利性和可行性優勢
,後者最初的精神活性效應起效較慢,可以持續幾個小時。我們進一步相信,這些特徵和由GH001引起的精神活性效應的類型允許在治療前不需要漫長而複雜的患者準備的情況下給藥,在體驗期間只需要有限的醫療保健提供者的支持,並且不需要在體驗之後進行頻繁的心理整合工作。這種避免結構化心理治療或強制心理支持的做法減少了對醫療保健提供者的培訓要求,總體上創造了一種方便和
有效的潛在治療範例。
|
95
目錄表
基於這些特點,我們相信,GH001有可能為治療TRD提供一種有吸引力的替代方案,取代目前可用的療法和其他正在開發的療法。
已完成的GH001臨牀試驗
第一階段:GH001在健康志願者中的臨牀試驗(GH001-HV-101,NCT04640831)
我們已經在荷蘭的健康志願者身上完成了GH001的第一階段臨牀試驗,這是我們的可吸入性美布汀(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)候選產品。
試行設計
試驗分為兩部分,描述如下:A部分是一項開放標籤的單臂單劑量試驗,有4個劑量水平(2 mg、6 mg、12 mg、18 mg)的GH001正在研究中;B部分是一項開放的單臂受試者內劑量遞增試驗,其中IDR在單日服用,最多增加三個劑量的GH001(第一劑6毫克、第二劑12毫克和第三劑18毫克)。第二劑和第三劑僅在受試者在之前給藥的劑量下沒有達到PE的情況下才給予,根據我們專有的PE量表進行評估。GH001在給藥前或給藥後只接受一次訪問,沒有額外的強制訪問以進行心理治療或心理支持。
這項試驗的主要終點是評估GH001在健康志願者中的安全性及其與劑量相關的精神活性效應。參與者在服藥當天接受監測,並在服藥後第一天和第七天進行額外的隨訪。建立了一個研究安全小組,或SSG,其中包括外部專家,以評估每次訪問時所有參與者的安全和精神影響數據。
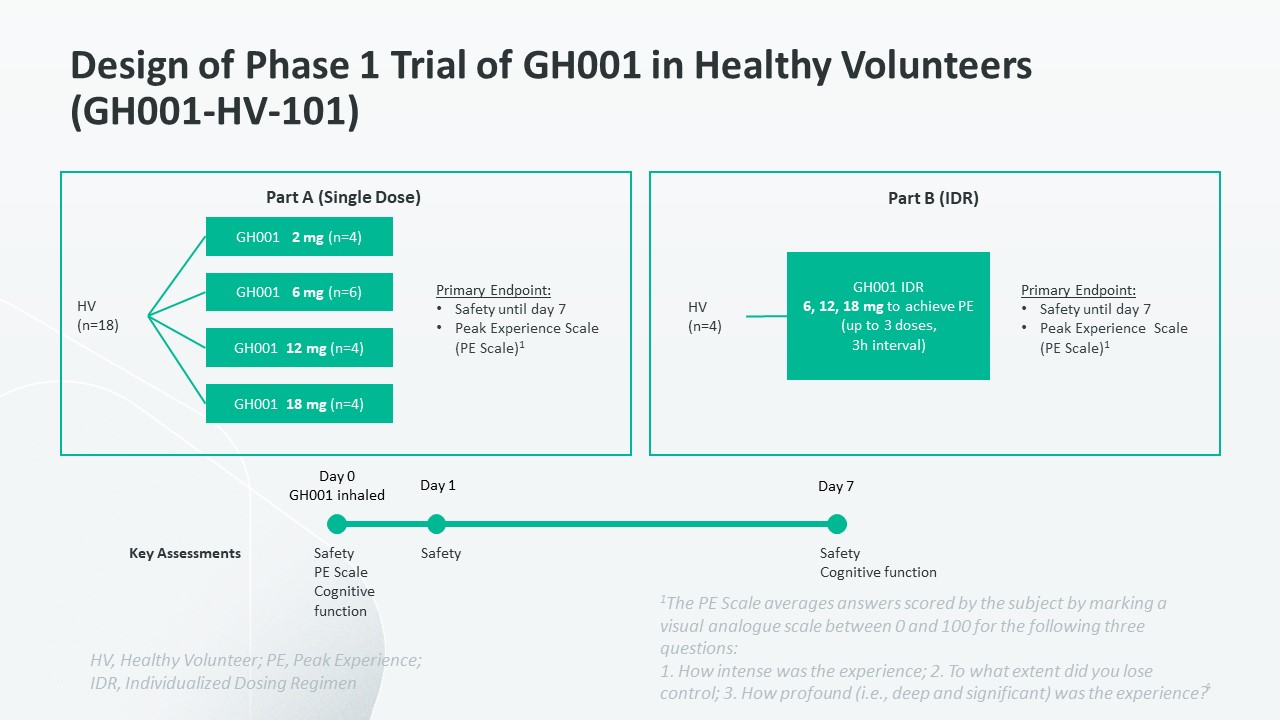
96
目錄表
基線特徵
18名受試者(2 mg(n=4)、6 mg(n=6)、12 mg(n=4)、18 mg(n=4))被分為A組和B組,A組中位年齡27歲,B組中位年齡30歲。
結果
所有參與者都完成了所有計劃的訪問。沒有SAE的報告。A組18名受試者中12名(66.67%)和B組4名受試者中3名(75%)至少發生過一次ADR。所有的不良反應都是輕微的,除了A部分在12 mg劑量水平上的“心率增加”的ADR和在B部分的一個受試者的“疲勞”的ADR(在接受了6 mg和12 mg劑量後)是中等強度的。所有不良反應均自行解決。在A部分,報告的不良反應為:噁心(4名)、頭痛(3名)、焦慮(2名)、笨拙、感覺熱、視力模糊、心率增快、聽覺亢進、精神疲勞、閃回、幻覺、異常做夢、失眠、疲勞、興奮情緒和困惑狀態(各1名參與者)。在B部分,報告的不良反應是:噁心(2名參與者)、疲勞、頭部不適和頭痛(各1名參與者)。在安全實驗室分析、精神症狀量表或認知功能的任何測量中沒有觀察到臨牀相關的變化。除了在服用GH001後不久心率和血壓出現暫時的、非臨牀相關的增加外,生命參數沒有發生明顯的變化。在A部分從2 mg到18 mg的所有單次劑量中,SSG沒有觀察到意想不到的、沒有嚴重的和持久的不良反應,並且B部分的劑量從6 mg增加到12 mg,然後增加到18 mg。
就A部分中的PE量表所測量的精神活動效應的強度而言,2 mg劑量(PE總分9.0,4名PE參與者中的0)、6 mg劑量(PE總分43.8,6名PE參與者之一)和12 mg劑量(PE總分65.5,4名PE參與者中的2名)的平均PE總分和達到PE的患者比例存在劑量相關性趨勢。這種劑量相關的趨勢在18毫克劑量下沒有持續(PE總分為59.2,是PE的四名參與者之一)。
在B部分中,觀察到所有參與者的精神活動效應的強度隨着劑量的增加而增加。此外,所有參與者都能夠在其最大個人劑量水平上實現PE,即一名參與者的初始劑量為6毫克,兩名參與者的第二劑量為12毫克,一名參與者的最終劑量為18毫克。在這一最大個人劑量水平上,平均PE總分(PE總分89.3)高於A部分的所有劑量組。
1/2期:GH001在TRD患者中的臨牀試驗(GH001-TRD-102,NCT04698603)
我們已經完成了GH001的1/2期臨牀試驗,在荷蘭的TRD患者中,他們在目前的抑鬱發作中,沒有通過至少兩個適當的藥物治療療程或一個適當的藥物治療療程和至少一個基於證據的心理治療療程,根據抗抑鬱藥物治療歷史表-短表,或ATHF-SF進行評估。
試行設計
試驗設計分為兩個部分,如下所示:A部分(n=8),這是一項開放標籤、單臂、單劑量的第一階段試驗,正在研究兩個劑量水平(12 mg、18 mg)的GH001
和B部分(n=8),這是一項開放標籤、單臂第二階段試驗,將我們的IDR應用於患者內劑量遞增的GH001。在B部分,患者在一天內接受至少一劑至最多三劑GH001;應用的三劑步驟分別為6毫克、12毫克和18毫克。較高劑量水平的給藥是通過評估患者在先前給藥劑量下是否達到PE來指導的。18至64歲(含)的患者參加了
試驗。GH001在服藥前或服藥後一次性接受治療,沒有額外的強制心理治療或心理支持。
第一階段A部分的主要終點是評估單次劑量的GH001在TRD患者中的安全性和耐受性。第二階段B部分的主要終點是評估我們的IDR對抑鬱症嚴重程度的影響,根據給藥後第七天緩解患者的比例進行評估,定義為MADRS總分小於或等於10。MADRS是廣泛接受的抑鬱症評分
,從0到60,已被用作其他抑鬱症治療關鍵試驗的主要終點。參與者在服藥當天接受監測,並在服藥後第一天和第七天進行額外的隨訪。在完成A部分的每個劑量水平和完成B部分之後,建立了一個包括外部專家的SSG來評估來自所有患者的安全性和有效性數據。
97
目錄表
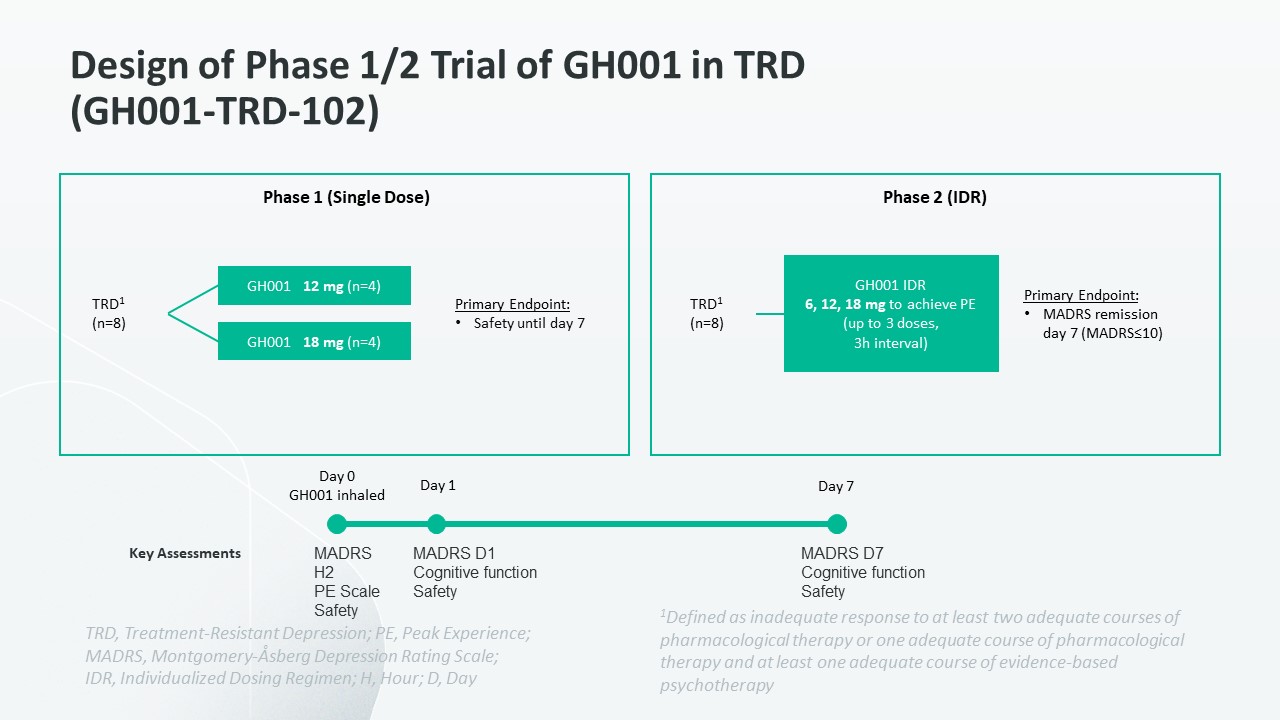
第一階段A部分患者的基線特徵
8名患者被納入第一階段A部分,中位年齡為29歲。MADRS的抑鬱症嚴重程度基線中位數為33。4名患者接受了12 mg的治療,4名患者接受了18 mg的GH001治療。
第一階段的結果A部分:安全
所有患者均完成所有計劃就診。沒有SAE的報告。服用12毫克組的4名患者中有3名(75%)和服用18毫克組的4名患者中有3名(75%)至少經歷過一次ADR。所有的不良反應都是輕微的,而且是自發緩解的。不良反應包括:頭痛(3例)、感覺異常、閃回(各2例)、頭暈、肌肉痙攣(各1例)。根據A部分的現有數據,SSG得出結論,在A部分中,在安全實驗室分析、精神安全評估或認知功能測量中沒有觀察到任何意外或嚴重的不良反應,也沒有觀察到任何臨牀上的重大變化。除了在服用GH001後不久心率和血壓出現暫時的、非臨牀相關的增加外,生命參數沒有發生明顯的變化。此外,SSG得出的結論是,基於對哥倫比亞自殺嚴重程度評定量表(C-SSRS)和MADRS分項“自殺念頭”的審查,沒有觀察到與自殺意念或自殺行為有關的安全信號。
第一階段的結果A部分:療效
作為A部分的次要目標,我們還評估了臨牀活動,包括MADRS緩解,定義為MADRS總分小於或等於10,以及MADRS臨牀反應,定義為MADRS總分較基線減少50%或更多。A部分12 mg組的4例患者中有2例(50%)和A部分的18 mg組中的1例(25%)在給藥後第7天出現MADRS緩解,並出現MADRS臨牀反應,18 mg組有1例(25%)在給藥後第7天出現MADRS臨牀反應。與基線相比,其他4名患者在第7天的MADRS評分基礎上也有改善,但沒有達到MADRS緩解或MADRS臨牀反應。在第七天緩解的三名患者中,所有人都從第一天開始緩解,其中兩人最早在服藥後兩小時就緩解了。第7天,12毫克組的平均MADRS變化為-21.0(-65%),18毫克組為-12.5(-40%)。平均體育總分:12 mg組為58.2分,18 mg組為59.1分。在12 mg組中,4名患者中有2名患者發生了PE,這兩名患者的MADRS都得到了緩解。
98
目錄表
第二階段B部分
這項臨牀試驗的第二階段B部分包括在同一給藥日最多服用三劑GH001的可能性,如果第一次或第二次給藥不符合PE的要求。與單劑GH001相比,該IDR的目標是提高TRD患者的PES發生率和臨牀緩解率。三個劑量階梯分別為6 mg、12 mg和18 mg。較高劑量水平的給藥是根據患者在先前給藥劑量下是否達到PE的評估來指導的。
第二階段患者的基線特徵B部分
8名患者被納入B部分,中位年齡34歲。MADRS的抑鬱症嚴重程度基線中位數為32。根據PE引導的IDR,6名患者接受6 mg,然後是12 mg的GH001,2名患者接受6 mg,然後是12 mg,然後是18 mg的GH001。
第二階段的結果B部分:安全
所有患者均完成所有計劃就診。沒有SAE的報告。8名患者中有7名(87.5%)至少經歷過一次ADR。除2例噁心不良反應和1例抑鬱症狀不良反應強度中等外,其餘均為輕度不良反應。所有不良反應均自行解決。不良反應包括:頭痛、感覺障礙(各3例)、焦慮、閃回、噁心(各2例)、腹部不適、肌肉不適、感覺異常和抑鬱症狀(各1例)。
根據B部分的現有數據,SSG得出結論,在B部分,在任何安全實驗室分析、精神安全評估或認知功能測量中都沒有觀察到任何意外或嚴重的不良反應,也沒有臨牀上顯著的變化。除了在服用GH001後不久心率和血壓出現暫時的、非臨牀相關的增加外,重要參數沒有發生顯著的變化。此外,SSG的結論是,基於對C-SSRS和MADRS分項“自殺念頭”的審查,沒有觀察到與自殺意念或自殺行為有關的安全信號。
第二階段B部分的結果:療效
第二階段B部分的主要終點被定義為服藥後第七天緩解的患者比例,定義為MADRS總分小於或等於10。這一主要終點在第七天達到了8名患者中的7名(87.5%)(p
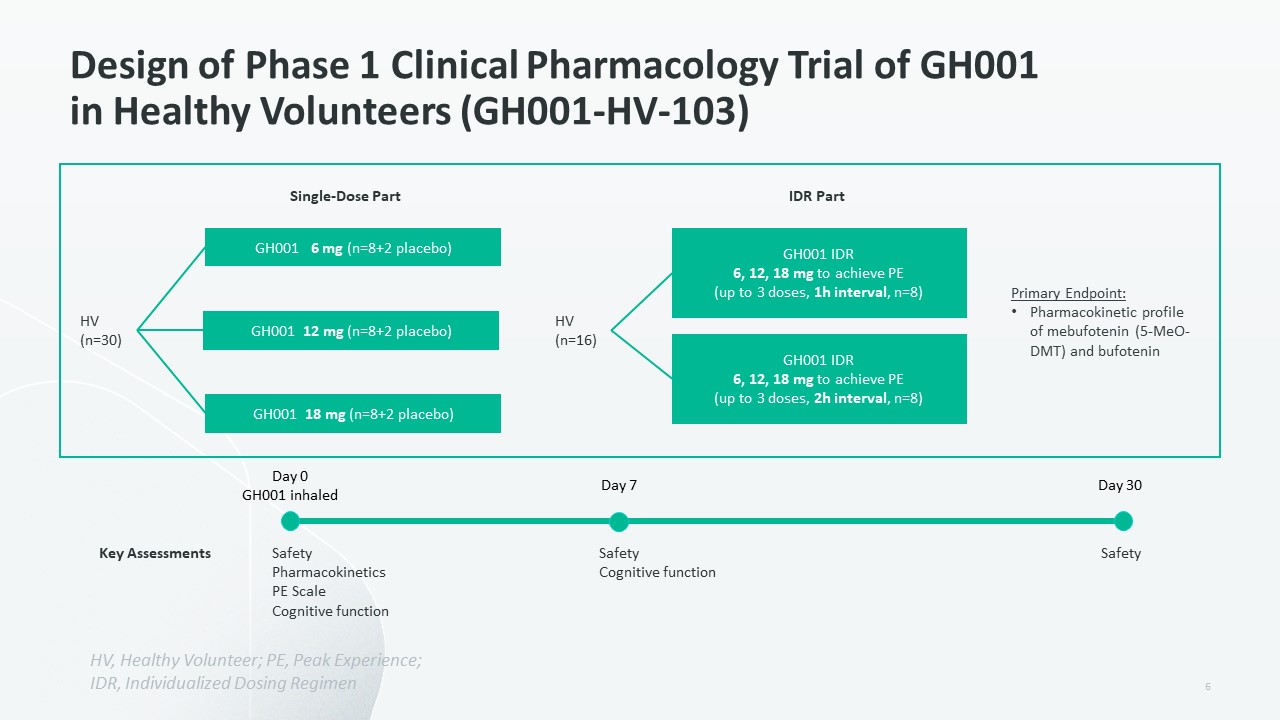
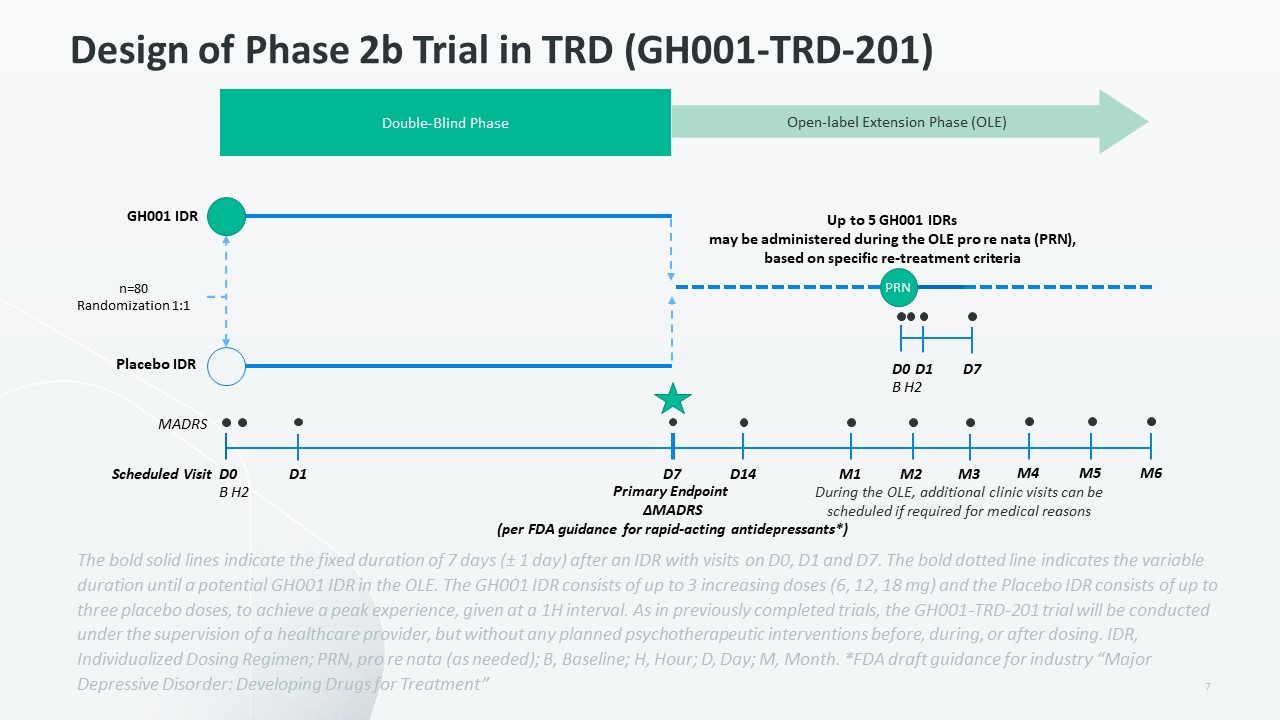
在第二階段的B部分中,觀察到所有患者的精神活動效應的強度隨着劑量的增加而增加。此外,8名患者中有7名能夠在他們的最大個人劑量水平上達到PE,這是6名患者的第二劑12毫克和2名患者的最終劑量18毫克。在這一最大個人劑量水平下,平均PE總分高於第一階段A部分的單劑量組(PE總分為90.4分)
,7名PE患者中有6名獲得了MADRS緩解,其中1名接受了所有三種劑量水平但未達到PE的患者額外獲得了1次MADRS緩解。
結論
根據在GH001-TRD-102試驗中觀察到的臨牀活動,我們認為,服用GH001有可能在某些TRD患者中誘導超快的MADRS緩解。與單次服用GH001相比,在一天內使用我們的IDR並增加受試者內劑量,可以增加TRD患者的臨牀緩解率、平均MADRS減少和PES的發生率。
99
目錄表
第一階段:GH001在健康志願者中的臨牀藥理試驗(GH001-HV-103,NCT05163691)
我們已經完成了在荷蘭進行的GH001在健康志願者中的第一階段臨牀藥理學試驗。
試行設計
試驗設計分為兩部分:單劑部分,採用雙盲、安慰劑對照、隨機、平行分組設計,10名受試者的3個劑量組(6 mg、12 mg、18 mg)單次吸入GH001或安慰劑,每劑量組8名受試者服用GH001,每劑量組2名受試者服用安慰劑;和多劑量部分,在開放標籤,非隨機設計中,我們的IDR在一天內給予最多三個遞增劑量的GH001(6毫克為第一劑,12毫克為第二劑,18毫克為第三劑),其中第二和第三劑僅在受試者在之前的
給藥劑量沒有達到PE的情況下給予,根據我們專有的PE量表進行評估,並且在8名受試者中分別測試了兩種不同的預定劑量間隔(1小時,2小時)。GH001在服藥前或服藥後一次就診,沒有額外的心理治療或心理支持強制就診。

該試驗的主要終點是評估美布替寧和其代謝物--蟾酥寧的藥代動力學特徵。參與者在服藥當天接受監測,並在服藥後第7天和第30天進行額外的隨訪。
基線特徵
30名受試者(6 mg(n=8 GH001,n=2安慰劑),12 mg(n=8 GH001,n=2安慰劑),18 mg(n=8 GH001,n=2安慰劑)被招募到單次給藥部分,16名受試者(n=16 GH001)
被招募到多次給藥部分,以評估兩種不同給藥間隔(1小時和2小時間隔組,n=8 GH001)的日內IDR。單劑部分的中位年齡為28歲,多劑部分的中位年齡為27歲。在多次劑量部分,根據體育引導的IDR,1名參與者接受6毫克的GH001(在1小時間隔組),6名參與者接受6毫克然後12毫克的GH001(3名參與者在1小時間隔組,3名參與者在2小時間隔組),9名參與者接受6毫克,然後12毫克,然後18毫克的GH001(4名參與者在1小時間隔組和5名參與者在2小時間隔組)。
100
目錄表
結果
所有參與者都完成了所有計劃的訪問。沒有SAE的報告。單劑服用GH001的24名受試者中有11名(45.8%)出現了至少一種不良反應,而在單劑服用安慰劑的6名受試者中,有0名(0%)出現了至少一種不良反應。在多劑量部分,接受GH001治療的16名受試者中有7名(43.8%)至少經歷了一次ADR。所有ADR均為輕度不良反應。所有不良反應均自行解決。在單次給藥部分,報告的不良反應為:頭痛(4名參與者)、心動過速、哭泣(各2名參與者)、胸部不適、頭暈、口乾、運動障礙、疲勞、口腔感覺減退、乾澀、嗜睡和震顫(各1名參與者)。在多次給藥部分,報告的不良反應為:疲勞(三名參與者)、頭痛、哭泣(兩名參與者各一名)、夢異常、口腔感覺異常和緊張(一名參與者各一名)。除了在服用GH001後不久心率和血壓出現暫時的、非臨牀相關的增加外,生命參數沒有發生明顯的變化。同樣,在給藥後的最大呼氣流速、安全實驗室分析、心電圖和包括C-SSRS在內的精神症狀量表上也沒有觀察到臨牀上相關的變化。
來自單劑量和多劑量部分的藥代動力學分析結果與觀察到的精神活性效應的超快速起效和持續時間短是一致的。認知功能測試的結果以及基於我們專有的PE量表的精神活動效果評估的結果與之前的試驗結果一致。
結論
觀察到,在調查的單次劑量水平下,通過吸入給藥GH001的耐受性很好,在IDR中,受試者內部劑量增加,在一天內計劃兩次劑量間隔
(1小時,2小時),並進行30天的隨訪。試驗的全部結果支持,在未來的臨牀試驗中使用IDR的每個劑量之間的間隔降至一小時是可行的。
GH001啟動臨牀試驗
階段2b:隨機、雙盲、安慰劑對照臨牀試驗,GH001在TRD患者中的開放標籤延伸(GH001-TRD-201,NCT05800860)
我們目前正在歐洲招募一項多中心、隨機、雙盲、安慰劑對照的2b期臨牀試驗,對目前抑鬱發作的TRD患者進行GH001臨牀試驗,根據馬薩諸塞州總醫院抗抑鬱藥物治療反應問卷(MGH-ATRQ)的評估,這些患者至少未能通過兩個適當的藥物治療療程。
試行設計
試驗包括兩個部分,如下所示:第一部分,為期7天的隨機、雙盲、安慰劑對照階段;第二部分,為期6個月的開放標籤延長階段,或稱OLE階段。預計在第一部分中將隨機抽取大約80名患者的總樣本量,所有患者將在第一部分的第七天直接過渡到第二部分。
在這兩個部分中,GH001作為IDR給藥,包括最多3個遞增劑量的GH001(6毫克、12毫克和18毫克),按計劃間隔1小時給予,其中只有在患者在先前給藥的劑量沒有達到PE的情況下才給予第二和第三劑。
|
•
|
在雙盲第1部分,患者接受單一的GH001 IDR或安慰劑IDR,遵循與GH001 IDR相同的劑量間隔和劑量遞增標準。
|
|
•
|
在OLE第2部分,根據具體的再治療標準,患者可以在6個月內根據需要獲得最多5個GH001 IDR。再治療標準包括抑鬱症的嚴重程度和有效性、耐受性和既往IDR的數量。
|
101
目錄表
18歲至64歲(含)的患者可參加試驗。GH001將在服藥前或服藥後不進行額外的強制心理治療或心理支持。
主要終點是評估對抑鬱嚴重程度的影響,通過在雙盲期結束時給藥後從基線到第七天的MADRS的平均變化來評估。MADRS是一種被廣泛接受的抑鬱症分級標準,範圍從0到60,已被用作其他抑鬱症治療的關鍵試驗的主要終點。美國食品和藥物管理局行業指南草案“重大抑鬱障礙:開發治療藥物”重點指出,對於速效抗抑鬱藥,速效抗抑鬱藥一般應在1周內證明有效。
我們預計這一試驗的雙盲階段將於2024年第三季度完成,該階段的主要數據預計將於2024年第三季度或第四季度提供。

2a期:GH001在雙相II型障礙和當前的嚴重抑鬱發作患者中的臨牀試驗(GH001-BD-202,NCT05839509)
我們目前正在招募一項在歐洲進行的2a期臨牀試驗,使用GH001治療患有BDII和目前抑鬱發作的患者。
試行設計
這項試驗是一項開放標籤、非隨機、單臂試驗,我們的IDR將在一天內給予最多3個遞增劑量的GH001(6毫克、12毫克、18毫克),其中第二和第三劑僅在受試者在之前給予的劑量沒有達到PE時才給予,根據我們專有的PE量表進行評估。GH001將在服藥前或服藥後不進行額外的心理治療或心理支持的強制就診。這項研究預計將招募15名患者。
主要終點是評估對抑鬱嚴重程度的影響,通過給藥後從基線到第七天的MADRS的平均變化來評估。
102
目錄表
2a期:GH001用於女性產後抑鬱症患者的臨牀試驗(GH001-PPD-203,NCT05804708)
我們目前還在歐洲招募一項在女性產後抑鬱症患者中使用GH001的2a期臨牀試驗。
試行設計
這項試驗是一項開放標籤、非隨機、單臂試驗,我們的IDR將在一天內給予最多3個遞增劑量的GH001(6毫克、12毫克、18毫克),其中第二和第三劑僅在受試者在之前給予的劑量沒有達到PE時才給予,根據我們專有的PE量表進行評估。GH001將在服藥前或服藥後不進行額外的心理治療或心理支持的強制就診。這項研究預計將招募15名患者。
主要終點是評估對抑鬱嚴重程度的影響,通過給藥後從基線到第七天的MADRS的平均變化來評估。我們預計將於2024年第三季度完成試驗並提供主要數據。
監管相互作用
2022年5月,我們宣佈了與FDA的IND前會議的積極結果,為我們準備了預期的GH001 IND提交,使用第三方吸入設備以氣霧劑的形式提交,預計不晚於2023年第一季度提交,並計劃在TRD患者中以第一階段成像研究的形式進行IND開放研究,旨在進一步闡明GH001(GH001-TRD-104)的作用機制。
然而,根據我們專有的GH001氣霧劑輸送裝置的開發進展,我們在2023年第一季度宣佈,我們計劃在2023年第三季度向FDA提交與該專有氣霧劑輸送裝置一起交付的GH001的IND。IND開放研究預計將是在健康志願者(GH001-HV-106)中進行的第一階段臨牀藥理學試驗,旨在支持與我們目前臨牀試驗中使用的第三方設備生成的臨牀數據的橋接。2023年5月,我們與FDA舉行了一次C型會議,以進一步討論這一計劃中的提交。隨後,在2023年8月,我們提交了
IND。正如之前宣佈的那樣,我2023年9月,在為期30天的法定IND審查期結束時,FDA通知我們,它已將我們的IND置於臨牀擱置狀態,並在2023年10月正式發出臨牀擱置函,FDA要求我們提供(I)非齧齒動物物種的吸入毒理學研究和額外的大鼠吸入毒理學研究,與之前完成的大鼠吸入毒理學研究的呼吸道組織學結果有關,(Ii)額外的器械設計驗證信息和(Iii)對我們的調查員手冊的更新。我們正在努力迴應FDA的要求,包括通過啟動所要求的非臨牀研究。
此外,我們還要求與FDA會面,討論FDA在臨牀暫緩函中反饋的某些方面。我們打算在2024年第二季度提供關於IND答覆提交的最新情況。同時,要
緩解對GH 001計劃, 我們還在推進必要的準備工作,以便有可能在歐洲進行第一階段的健康志願者臨牀藥理學試驗(GH001-HV-106)。
計劃中的GH001臨牀試驗
我們目前計劃對GH001進行以下額外的試驗:
|
•
|
使用我們專有的氣霧劑輸送設備(IND-OPENING研究)在健康志願者中進行的一期臨牀藥理學試驗,旨在支持與我們目前臨牀試驗中使用的第三方設備(GH001-HV-106)產生的臨牀數據的橋接。
|
這項試驗的結果,以及正在進行的TRD(GH001-TRD-201)2b期試驗和BDII正在進行的2a期試驗以及目前的抑鬱發作(GH001-BD-202)和PPD(GH001-PPD-203)的結果,將有助於我們未來的臨牀開發計劃。在完成臨牀開發後,我們計劃在美國和歐洲尋求GH001的監管批准。
103
目錄表
GH001的指示擴展機會
鑑於GH001‘S提出的重置FC和5-羥色胺能激動症的機制,我們認為它代表了除TRD之外的多種精神和神經疾病的引人注目的治療選擇。通過與學術機構和CRO的合作,我們打算探索GH001在其他精神病學或神經學適應症方面的好處,其中第一種是雙相II型障礙和產後抑鬱症。
靜脈注射美布替寧候選產品-GH002
GH002是我們的第二個美布替寧(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)候選產品,通過專有的靜脈注射方法配製給藥。對於GH002,我們使用
根據當前cGMP標準生產的合成開發的藥用級美布汀鹽。我們相信,GH002有可能成為一種有吸引力的治療選擇,例如,在患有潛在呼吸道或肺部疾病的患者中,或者在難以確保充分進行GH001吸入的情況下,例如在患者可能無法使用吸入器的急性精神急救情況下。
已完成的GH002臨牀試驗
第一階段:GH002在健康志願者中的臨牀藥理試驗(GH002-HV-105,NCT05753956)
我們最近在荷蘭完成了在健康志願者身上進行的GH002的第一階段臨牀藥理學試驗,目前已有頂級結果。
試行設計
試驗分為兩部分:單劑部分,隨機、雙盲、安慰劑對照,7個劑量組(0.25 mg、1 mg、2 mg、4 mg、6 mg、8 mg和10 mg)的單次靜脈注射GH002或安慰劑,其中每劑量組6名受試者服用GH002,每劑量組2名受試者服用安慰劑;和多劑量部分,在開放標籤,非隨機設計中,IDR在
單日給8名受試者,最多3次遞增劑量的GH002(2毫克為第一劑,4毫克為第二劑,6毫克為第三劑),兩劑之間的預定間隔為1小時,其中第二和第三劑僅在
受試者在之前給藥的劑量下未能達到PE,根據我們專有的PE量表進行評估。GH002在服藥前或服藥後沒有額外的強制心理支持探視。
這項試驗的主要終點是評估GH002的安全性和耐受性以及藥代動力學特徵。參與者在服藥當天接受監測,並在服藥後第七天進行額外的隨訪。
基線特徵
在試驗的單劑量部分,56名受試者接受了單次劑量的GH002 0.25 mg、1 mg、2 mg、4 mg、6 mg、8 mg和10 mg(每劑量組6)或安慰劑(每劑量組2),而8名受試者在一天中接受了最多3次遞增劑量的GH002(2 mg、4 mg、6 mg)的IDR,按計劃劑量之間的間隔為1小時。單劑部分的中位年齡為23歲,多劑部分的中位年齡為26.5歲。
在多劑部分,根據PE引導的IDR,4名參與者接受了2毫克的GH002,2名參與者接受了2 mg,然後是4 mg,2名參與者接受了2 mg,然後是4 mg,然後是6 mg。
結果
所有參與者都完成了所有計劃的訪問。沒有SAE的報告。在接受GH002治療的42名受試者中,有18人(42.9%)觀察到不良反應,在接受單劑安慰劑治療的14名受試者中,有1人(7.1%)觀察到不良反應,在IDR部分接受GH002治療的8名受試者中,有4人(50%)觀察到不良反應。輕度不良反應佔97.7%,中度不良反應佔2.3%。在單劑部分,服用GH002的受試者報告的不良反應為:疲倦和噁心(5名受試者各有5名)、頭暈(4名受試者)、嘔吐(3名受試者)、情緒困擾、頭部不適、四肢疼痛、肌肉痙攣和咕嚕聲(各2名受試者)、頭痛、胸部不適、體温升高、冷汗、頸部疼痛、睡眠質量差、睡眠障礙、肌肉抽搐和異常夢境(各1名受試者)。在IDR部分,報告的不良反應為:頭痛(2名參與者)、呼吸困難、頭部不適、噁心和嘔吐(各1名參與者)。
104
目錄表
在安全性實驗室分析和心電圖中未觀察到臨牀相關變化。除了在服用GH002後不久心率和血壓出現暫時的、非臨牀相關的增加外,生命參數沒有發生明顯的變化。除了與情緒困擾和睡眠質量差的不良反應相關的變化外,精神症狀量表沒有發生臨牀上相關的變化
。
通過精神活性效應(PSE)強度評估的有效PD效應在單劑量水平和IDR中觀察到,PSE發生得超快,精神活性體驗持續時間較短(通常為5至30分鐘)。GH002的PK曲線一般呈劑量線性關係,並與PSE的超快曲線相關。對PK/PD關係和其他次級終點的分析正在進行中,並等待着為GH002的進一步臨牀開發戰略提供信息。
結論
靜脈注射GH002如果在服藥前後沒有額外的心理支持,在調查的單次劑量水平和受試者內部劑量遞增的IDR中觀察到耐受性良好,兩次劑量之間計劃的劑量間隔為1小時,並觀察到通過PSE強度評估的潛在和超快速PD效應。
美布福汀鼻腔候選產品--GH003
GH003是我們的第三個候選產品,通過專有的鼻腔給藥方法配製用於給藥。對於GH003,我們使用根據當前cGMP標準生產的合成開發的醫藥級美布福汀鹽。GH003目前處於臨牀前開發階段。
我們預計將在我們的精神和神經障礙重點領域開發GH003。
非臨牀經驗
美布福寧(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)的體外和體內數據允許我們的臨牀試驗GH001-HV-101、GH001-HV-103和GH001-TRD-102的啟動。我們推進了非臨牀研究計劃,進行了額外的體外和體內毒理學研究以及安全藥理學研究,包括評估我們高純度活性藥物成分(API)的遺傳毒性和心臟毒性的研究,以及大鼠吸入毒理學研究和非人類靈長類動物靜脈毒理學研究。這些研究的結果,加上已發表的學術文獻中的數據,支持了我們在BDII和當前抑鬱發作(GH001-BD-202)和PPD(GH001-PPD-203)中啟動GH001的2a期臨牀試驗,我們在TRD中進行的GH001(GH001-TRD-201)的2b期臨牀試驗,以及我們在健康志願者中進行的GH002的第一階段臨牀試驗
(GH002-HV-105),也可能形成支持我們的鼻腔內美布汀候選產品GH003的臨牀計劃的基礎。為了迴應FDA關於臨牀暫停我們最近提交的GH001 IND的請求,我們最近啟動了
一項非齧齒動物物種的吸入毒理學研究和一項額外的大鼠吸入毒理學研究。隨着我們的開發進展,預計將進行更多的非臨牀研究。
美布福寧的給藥系統和給藥途徑
我們正在努力優化現有的給藥系統,並研究更多的給藥系統和甲氧基甲氧基色胺(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)的給藥途徑,我們相信這將擴大我們的候選產品可能受益的患者羣體。
目前,我們的可吸入美布福汀候選產品GH001已經使用從第三方購買的吸入器進行了蒸發,該吸入器在歐盟是CE標誌的醫療設備,在加拿大和澳大利亞獲得了醫療設備的許可。我們繼續在TRD患者(GH001-TRD-201)的2b期試驗中以及最近啟動的雙相II型障礙(GH001-BD-202)和產後抑鬱症(GH001-PDD-203)的2a期試驗中使用該設備。我們正在與CDMO合作,為GH001開發一種專有的遞送設備。我們的專有設備將包括在健康志願者(GH001-HV-106)的第一階段臨牀藥理學試驗中,旨在支持與我們目前在臨牀試驗中使用的第三方設備生成的臨牀數據的橋接,之後我們打算在關鍵臨牀試驗計劃中使用我們的專有設備並用於商業供應。在我們的關鍵計劃之前,
我們打算在我們的臨牀封存得到解決後,使用我們的專有遞送設備開設IND。
105
目錄表
我們的靜脈注射美布福汀候選產品GH002目前使用的是標準的非處方藥注射器。對於未來的臨牀研究,我們可能會授權或從第三方購買特定的交付設備,或者與CDMO合作開發此類設備並建立此類設備的製造能力。
對於我們的鼻腔候選產品美布福汀GH003,我們計劃從第三方獲得許可或購買所需的遞送設備,或與CDMO合作開發此類設備並建立此類設備的製造能力。
我們預計,GH001和GH003以及相關設備將作為藥物-設備組合產品受到FDA的監管。但是,對於GH002,此分類將取決於我們對其商業演示的最終選擇。
製造和供應
我們不擁有或經營,目前也沒有計劃建立任何生產設施。我們依靠CDMO進一步開發和合成我們的GH 001、GH 002和
GH 003候選產品,並進一步開發和製造我們的候選產品。對生產工藝進行了承包,以確保相關API和候選產品生產步驟符合cGxP。我們希望繼續
依賴第三方開發和生產我們可能使用的所有臨牀供應API和製劑。我們還使用合同製造商來填充,標籤,包裝,存儲和分發我們的候選產品。我們目前依靠兩個
我們的API供應商和我們的GH 001候選產品的單一供應商,並且由於我們僅維持有限的API和GH 001候選產品供應,我們可能無法避免在需要更換一個或
更多供應商對於我們在TRD患者中進行的2b期試驗(GH 001-TRD-201)以及在BDII和當前抑鬱發作(GH 001-BD-202)和PPD(GH 001-PDD-203)中進行的2a期試驗,我們目前從第三方獲得了汽化器械
用於從我們的GH 001候選產品中產生吸入氣霧劑。我們沒有與該第三方簽訂商業供應協議,也沒有與任何合適的汽化設備的替代供應商簽訂許可協議。我們
然而,我們正在與CDMO合作,為GH 001開發一種專有的輸送裝置,用於我們的關鍵臨牀試驗項目和商業用途。
商業化
如果我們的GH001、GH002和GH003候選產品獲得批准,我們計劃使用我們自己的銷售和營銷能力,瞄準美國和主要歐洲市場的公共和私人醫療保健提供商和診所網絡
以及第三方付款人。但是,根據情況,我們可能會與具有互補商業能力的第三方簽訂商業化合作、合作或許可協議。
競爭
我們行業的特點是有許多新興和創新的技術,競爭激烈,非常重視自主產品權利。雖然我們認為我們的GH001、GH002和GH003候選產品代表着相對於市場上和正在開發的其他TRD治療方法的治療範式的根本性轉變,但我們面臨着來自許多不同來源的潛在競爭,包括主要製藥公司、專業製藥和生物技術公司、學術機構、非營利組織、政府機構和醫學研究組織。我們成功開發和商業化的任何候選產品,包括我們的GH001、GH002和GH003候選產品,都將與未來可能推出的護理標準和新的藥理學和軀體療法展開競爭。
106
目錄表
根據目前對監管機構的理解,TRD包括那些沒有得到兩種或更多MDD藥物療法幫助的患者。目前,美國只批准了兩種針對TRD的藥物療法:由NMDA受體拮抗劑Janssen銷售的Spravato(埃斯氯胺酮),以及通用的奧氮平和鹽酸氟西汀膠囊。正因為如此,用於MDD的抗抑鬱藥
經常被開出處方、與第二種藥物聯合或與第二種藥物一起使用來治療TRD患者。幾家生物製藥公司擁有包括其他迷幻化合物在內的治療方法,正在或計劃用於精神疾病的臨牀前和臨牀開發評估,包括對TRD患者的治療,包括ATAI生命科學公司、Axome Treeutics公司、Beckley心理技術公司、Compass Path公司、Cybin、Mindmed、Neumora治療公司、感知神經科學公司、Relmada治療公司、Sage治療公司、Seelos治療公司和Viridia生命科學公司。在使用其他迷幻劑化合物的計劃中,最先進的是Compass Path公司的研究療法COMP360,同時提供心理支持,TRD的2b階段試驗結果已經報告,並啟動了第3階段計劃。
我們可能與之競爭的許多製藥、生物製藥和生物技術公司已經為其療法建立了市場,並且比我們擁有更多的財政、技術、人力和其他資源,可能更有能力開發、製造和營銷更好和/或更便宜的產品或療法。此外,許多潛在競爭對手在進行新治療物質的非臨牀研究和人體臨牀試驗以及獲得人類治療產品的監管批准方面擁有比我們
更豐富的經驗。因此,我們的競爭對手可能會成功獲得FDA或EMA對替代或高級產品的批准。此外,許多競爭對手擁有更高的知名度和更廣泛的合作關係。規模較小且處於早期階段的公司也可能成為重要的競爭對手,尤其是通過與大型成熟公司的協作安排。越來越多的公司正在加大力度發現新的迷幻化合物。
知識產權
專利戰略
我們的商業成功在一定程度上與獲得、維護和執行歐盟、美國、英國和其他司法管轄區的專利、商業祕密和其他專有權利的知識產權保護有關。我們計劃繼續通過並行的知識產權戰略從戰略上保護我們的創新,將專利保護與監管和市場排他性結合起來。我們還可以依靠與我們的專有技術有關的商業祕密和技術訣竅、持續創新和未來的許可內機會來發展、加強和保持我們的競爭地位。
已批專利和待批專利申請
我們已經提交了超過25項國際專利申請,涉及美布汀的新用途(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT),包括使用美布汀治療吸入或經鼻、口腔、舌下、靜脈、肌肉或皮下給藥時的各種疾病,美布汀物質的新氣霧劑成分,製備和純化美布汀的新制造方法,高純度美布汀,新的鹽形式的美布汀以及與給藥裝置相關的新方面。我們致力於通過持續的研究和開發來探索美布福寧的更多機會,並將繼續為我們的所有創新尋求專利保護。
我們的專利申請WO2020169850和WO2020169851共同涵蓋了美布替寧在各種疾病中的新用途,包括通過吸入或通過鼻腔、口腔、舌下、靜脈、肌肉內或皮下給藥使用美布替寧治療TRD,申請於2020年2月24日提交,優先日期為2019年2月22日。對於這兩項申請,國家階段申請已向美國專利商標局(USPTO)、歐洲專利局(EPO)和其他幾個國家專利局提交。我們最近收到歐洲專利局的通知,它已批准WO2020169850的歐洲國家階段申請。這項新授予的專利EP3927337涵蓋了5-甲氧基-N,N-二甲基色胺(5-MeO-DMT)及其在藥學上可接受的鹽,用於根據公認的醫療實踐治療由註冊專業人員診斷為嚴重抑鬱障礙的患者。
107
目錄表
另一項專利申請WO2020254584於2020年6月19日提交,該申請涵蓋了用於純化美布福寧和高純度美布福寧的新制造方法,優先日期為2019年6月19日。對於這項申請,國家階段申請也已在許多專利局提交,包括美國專利商標局和歐洲專利局。我們最近收到歐洲專利局的通知,它已經批准了歐洲國家階段申請對手。這項新授予的專利EP3986864涵蓋了一種提純5-甲氧基-N,N-二甲基色胺(5-MeO-DMT)的具體方法。
另一項專利申請WO2021170614於2021年2月24日提交,其優先權日期為2020年2月24日,該申請涵蓋美布替寧物質的新型氣霧劑組合物,包括為給藥GH001而產生的氣霧劑。對於這項申請,國家階段申請也已在許多專利局提交,包括美國專利商標局和歐洲專利局。
另一項專利申請WO2023002005於2022年7月22日提交,該申請涵蓋製備美布福寧的新制造方法,優先日期為2023年7月22日。對於這項申請,國家階段申請也已在多個專利局提交,包括美國專利商標局和歐洲專利局。
另外19項國際專利申請-也稱為專利合作條約或PCT專利申請-於2023年3月27日提交,最早的優先日期為2022年3月27日。這些應用涵蓋了美布福寧在治療方面的應用,包括美布福寧在各種疾病中的新用途和新的鹽形式的美布福寧。PCT申請在我們尋求專利保護的國家/地區在PCT申請的優先日期後30至32個月內提交一項或多項國家階段專利申請(視國家而定)後,才有資格成為已頒發的專利。對於這些PCT申請,我們
尚未提交所有相關的國家階段申請。如果我們不及時提交國家階段專利申請,我們可能會失去對本專利申請中披露的發明獲得專利保護的能力。雖然我們打算
及時提交與這些PCT專利申請相關的國家階段專利申請,但我們無法預測任何此類專利申請是否會導致頒發為我們提供任何競爭優勢的專利。然而,我們
最近收到歐洲專利局的通知,它已經批准了這19個PCT申請中的一個的歐洲國家階段申請,WO2023186834。這項新授予的專利EP4313945很早就進入了歐洲國家階段,涵蓋了5-甲氧基-N,N-二甲基色胺的結晶氫溴酸鹽(5-MeO-DMT)。
我們還提交了更多的設計和實用專利申請,這些申請還沒有公佈,涉及在治療背景下使用美布福寧的其他方面。公用事業申請
未來可以作為PCT申請的優先申請,可以在自最初提交日期起一年內提交。
政府監管
美國聯邦、州和地方各級以及其他國家和司法管轄區的政府當局對研究、開發、
測試、生產、質量控制、批准、包裝、儲存、記錄保存、標籤、廣告、促銷、分銷、營銷、批准後監測和報告以及藥品的進出口。
的流程 在美國和其他國家和司法管轄區獲得監管批准,以及隨後遵守適用的法規和條例以及其他監管機構,需要花費大量時間
和財政資源。
FDA審批流程
在美國,藥品受到FDA的廣泛監管。《聯邦食品、藥品和化粧品法案》(FDCA)以及其他聯邦和州法規和條例,
管理
的研究、開發、測試、製造、儲存、記錄保存、批准、標籤、推廣和營銷、銷售和分銷、批准後監測和報告、抽樣以及進出口等 藥品和醫療器械。如果未能遵守適用的美國要求,公司可能會受到各種行政或司法制裁,例如臨牀暫停、FDA拒絕批准待審新藥
申請或NDA、警告或無標題信函、產品召回、產品扣押、全部或部分暫停生產或分銷、禁令、罰款、民事處罰和刑事起訴。
在美國,新產品(包括藥械組合產品)的藥品開發通常涉及非臨牀實驗室和動物試驗,提交
IND的FDA批准(IND必須在臨牀試驗開始前生效),以及充分和良好對照的臨牀試驗,以確定藥物對尋求FDA批准的每種適應症的安全性和有效性。
滿足FDA上市前批准要求通常需要多年時間,實際所需時間可能因產品或疾病的類型、複雜性和新穎性而有很大差異。
108
目錄表
非臨牀試驗包括產品化學、配方和毒性的實驗室評價,以及評估
特性和潛在安全性和有效性的動物試驗。 產品非臨牀試驗的實施必須符合聯邦法規和要求,包括藥物非臨牀研究質量管理規範。非臨牀試驗的結果作為IND的一部分與其他信息一起提交給FDA,
包括有關產品化學、生產和控制或產品CMC的信息,有關藥械組合產品器械組件的信息和擬定的臨牀試驗方案。如果臨牀結果可從
在美國境外進行的研究,該信息也必須包括在IND中。長期非臨牀試驗,如生殖毒性和致癌性的動物試驗,可在IND提交後繼續進行。IND
FDA收到後30天自動生效,除非在此之前FDA對一項或多項擬議的臨牀試驗提出了擔憂或疑問,並將試驗置於臨牀暫停狀態。在這種情況下,IND申辦者和
FDA必須在臨牀試驗開始之前解決任何懸而未決的問題。FDA還可以將IND置於部分臨牀擱置狀態,在此期間,申請的部分臨牀工作可以繼續進行,但其他部分將被延遲或暫停,直到
林業發展局的未決關切得到解決。
臨牀試驗涉及在合格研究者的監督下向健康志願者或患者給予IND。臨牀試驗必須(i)按照
聯邦法規;(ii)符合《藥物臨牀試驗質量管理規範》(GCP),該規範是旨在保護患者權利和健康以及界定臨牀試驗申辦者、管理者和監查員角色的標準;以及(iii)
根據詳細説明試驗目的、用於監測安全性的參數和待評價的有效性標準的方案。涉及對美國患者進行檢測的每個方案以及後續方案修訂必須
作為IND的一部分提交給FDA。
如果FDA認為臨牀試驗未在
符合FDA要求或對臨牀試驗患者造成不可接受的風險。臨牀試驗中患者的研究方案和知情同意信息還必須提交給機構審查委員會或IRB,以
批准IRB也可以要求臨牀試驗機構暫時或永久停止不符合IRB要求的臨牀試驗,或施加其他條件。
支持新諾明獲得上市批准的臨牀試驗通常分三個連續階段進行,但這些階段可能是組合的或重疊的。第一階段包括將該藥物初步引入健康人體受試者或患者,測試該藥物以評估新陳代謝、藥代動力學、藥理作用、與增加劑量相關的副作用,以及如果可能的話,評估有效性的早期證據。第二階段通常涉及在有限的患者羣體中進行試驗,以確定該藥物在特定適應症、劑量耐受性和最佳劑量下的有效性,並確定常見的不良反應和安全風險。如果化合物在第二階段評估中證明瞭有效性和可接受的安全性,則進行第三階段試驗,以獲得有關更多患者的臨牀療效和安全性的額外信息,通常是在地理上分散的
臨牀試驗地點,以允許FDA評估藥物的總體效益-風險關係,併為藥物的標籤提供足夠的信息。在大多數情況下,FDA需要兩個充分和良好控制的3期臨牀試驗來證明該藥物的療效。在少數情況下,單一的3期試驗可能就足夠了,包括(I)該研究是一項大型多中心試驗,證明瞭內部一致性,並且在統計學上非常有説服力的發現:
對死亡率、不可逆轉的發病率或疾病的預防具有臨牀意義的影響,並具有潛在的嚴重後果,並且在第二次試驗中確認結果實際上或在倫理上是不可能的,或(Ii)與其他確認性證據相結合。
對嚴重或危及生命的疾病進行2期或3期臨牀試驗的研究藥物的製造商必須提供,例如通過在其網站上發佈其關於
評估和迴應擴大准入請求的政策。
在完成所需的臨牀測試後,將準備一份NDA並提交給FDA。在該產品開始在美國上市之前,需要FDA批准NDA。保密協議必須包括所有非臨牀、臨牀和其他測試的結果,以及與產品的藥理、化學、製造和控制相關的數據彙編。對於藥物-器械組合產品,保密協議還必須
包括支持器械成分的設計、測試、製造和質量信息,包括支持其使用和與藥物成分配伍的信息。準備和提交保密協議的成本是巨大的。大多數新開發計劃的提交還需繳納高額的申請使用費,已批准的新開發協議下的申請人還需繳納計劃年費。這些費用通常每年都會增加。
109
目錄表
FDA自收到NDA之日起有60天的時間來確定是否將根據FDA的門檻確定申請是否足夠完整,以允許進行實質性審查。一旦提交了文件,FDA就開始進行深入的審查。FDA已同意在對NDA的審查中設定某些績效目標。大多數作為新分子實體或NME的標準審查藥物產品的申請在FDA提交NDA之日起10個月內審查;大多數屬於NME的優先審查藥物的申請在FDA提交NDA之日起6個月內審查。優先審查可以應用於FDA確定在治療方面取得重大進展或提供不存在適當治療方法的治療的藥物。FDA可以將標準審查和優先審查的審查程序再延長三個月,以考慮某些遲交的信息或旨在澄清提交中已提供的信息的信息。
FDA還可以將新藥產品的申請,或提出安全性或有效性難題的藥物產品的申請,提交給諮詢委員會--通常是一個包括臨牀醫生和其他專家的小組--進行審查、評估,並就是否應該批准申請提出建議。FDA不受諮詢委員會建議的約束,但它通常遵循這樣的建議。
在批准NDA之前,FDA通常會檢查一個或多個臨牀試驗地點,以確保符合GCP。此外,FDA通常將檢查生產藥物的一個或多個設施,如果是藥物-設備組合產品,則檢查設備成分。FDA將不會批准該產品,除非符合cGMPs令人滿意,並且NDA包含的數據證明藥物
在所研究的適應症中是安全有效的。
在FDA對NDA和製造設施進行評估後,它會發布一份批准信或一份完整的回覆信。一封完整的回覆信通常概述了提交文件中的不足之處,可能需要大量的額外測試或信息,以便FDA重新考慮申請。如果或何時,在重新提交NDA時,這些缺陷已得到FDA滿意的解決,FDA
將簽發批准信。FDA已承諾在兩個月或六個月內審查此類重新提交的申請,具體取決於所包括的信息類型。
批准函授權該藥物的商業營銷,並提供特定適應症的具體處方信息。作為NDA批准的一個條件,FDA可能要求進行風險評估和緩解戰略,或REMS,以幫助確保藥物的好處大於潛在風險。REMS可以包括藥物指南、醫療保健專業人員的溝通計劃和確保安全使用的要素,或ETASU。ETASU可以包括但不限於處方或配藥的特殊培訓或認證、僅在特定情況下的配藥、特殊監測和患者登記簿的使用。對REMS的要求可能會對該藥物的潛在市場和盈利能力產生重大影響。此外,產品批准可能需要大量的批准後測試和監測,以監測藥物的安全性或有效性。一旦獲得批准,如果沒有遵守監管標準或在初始營銷後發現問題,產品審批可能會被撤回。
更改已批准申請中確定的某些條件,包括適應症、標籤或生產工藝或設施的更改,需要提交和FDA批准新的保密協議或保密協議附錄,然後才能實施更改。新適應症的NDA補充劑通常需要與原始申請中類似的臨牀數據,FDA在審查NDA補充劑時使用與審查NDA相同的程序和行動。
組合產品
組合產品是指由兩個或兩個以上受管制的成分組成的產品,即藥物裝置、生物裝置、藥物/生物或藥物裝置/生物,它們以物理、化學或其他方式組合或混合,作為一個單一實體生產;(Ii)兩個或兩個以上單獨包裝在一起或作為一個單元包裝在一起的產品,包括藥物和裝置產品、裝置和生物製品或生物和藥物產品;(3)單獨包裝的藥物、裝置或生物製品,根據其研究計劃或擬議的標籤,僅擬與經批准的個別指定的藥物、裝置或生物製品一起使用,而這兩種藥物、裝置或生物製品都需要達到預期用途、適應症或效果,並且在擬議產品獲得批准後,核準產品的標籤將需要改變,例如,以反映預期用途、劑型、濃度、給藥途徑的改變或劑量的重大改變;或(Iv)單獨包裝的任何研究用藥物、裝置或生物製品,根據其建議的標籤,只能與另一種單獨指定的研究用藥、裝置或生物製品一起使用,而這兩種藥物、裝置或生物製品都需要達到預期的用途、適應症或效果。
110
目錄表
FDA根據產品類型分為不同的分支機構或中心。不同的中心通常審查藥物、生物或設備的申請。為了審查組合產品的申請,FDA必須決定由哪個中心負責審查。FDA的法規要求FDA確定組合產品的主要作用模式,即提供組合產品最重要治療作用的組合產品的單一模式。負責管理該部分產品的中心將成為主要評估者。在評估申請時,牽頭中心可以諮詢其他中心,但仍保留完整的審查權
,或者它可以與另一箇中心合作,由該中心將申請的特定部分的審查分配給另一箇中心,並將其對該部分的審查權委派給另一箇中心。通常,申請者向被選為首席評估師的中心提交一份營銷申請
,但可能會向適用的中心提交針對每個組成部分的單獨申請。提交多個評估的一個原因是,如果申請人希望獲得僅在特定類型的申請下獲得批准的
福利,如新藥產品獨家經營權。如果提交了多個申請,則每個申請都可能由不同的銷售線索中心進行評估。
在藥物-設備組合產品中,設備組件是預填充的藥物輸送設備,主要作用模式通常是以藥物評價和研究中心(CDER)為主導中心的藥物作用模式。CDER將在與設備和放射健康中心就設備特定問題進行磋商的情況下審查NDA。對於聯合包裝或單一實體組合產品,如預填充的藥物輸送裝置,有兩種方法可以滿足cGMP要求。製造商可以(I)證明符合適用於組合產品中每個組成部分的所有cGMP法規,或(Ii)在藥品-器械組合產品的情況下,證明符合藥品cGMP法規或設備質量體系要求或設備QSR,還可以證明遵守組合產品法規中規定的這兩套cGMP要求中另一套的附加條款。
不遵守適用的法規要求可能會導致FDA採取執法行動,其中可能包括以下任何制裁:警告或無標題信函、罰款、禁令、民事或刑事處罰、召回或扣押當前或未來的產品、運營限制、部分暫停或完全停產、拒絕或拒絕提交新產品或撤銷審批、
授權或批准。
加快藥品開發和審查計劃
FDA維持了幾個項目,旨在促進和加快新藥的開發和審查,以滿足嚴重或危及生命的疾病或疾病治療中未得到滿足的醫療需求。這些計劃包括快速通道指定、突破性治療指定、優先審查和加速批准,這些計劃的目的是加快重要新藥的開發或審查。
如果一種藥物旨在治療嚴重或危及生命的疾病或狀況,並顯示出滿足此類
疾病或狀況未得到滿足的醫療需求的潛力,則有資格獲得快速通道指定。快速通道指定為贊助商在非臨牀和臨牀開發期間與FDA互動提供了更多機會,並有可能對營銷申請進行滾動審查。滾動審查
意味着機構可以在贊助商提交完整的申請之前審查營銷申請的部分內容,但審查時間要等到申請的所有部分都提交後才開始。
此外,如果一種藥物旨在治療嚴重或危及生命的疾病或狀況,並且初步臨牀證據表明,該藥物可能在一個或多個臨牀重要終點表現出比現有療法顯著的改善,例如在臨牀開發早期觀察到的顯著治療效果,則該藥物可能有資格獲得突破性治療指定。突破性療法指定除了提供高效藥物開發計劃的密集指導和FDA加快開發的組織承諾外,還提供快速通道指定的所有
功能,包括在適當的情況下讓高級經理和經驗豐富的審查人員參與
跨學科審查。
任何提交FDA審批的產品,包括具有快速通道或突破性療法稱號的產品,也可能有資格獲得FDA旨在加快審查和審批流程的其他計劃,包括優先審查指定和加速審批。提交保密協議後,如果作為營銷申請對象的藥物在治療、診斷或預防嚴重疾病或狀況方面具有顯著的安全性或有效性,則該產品有資格獲得優先審查指定。如果FDA批准優先審查,FDA對營銷申請採取行動的目標日期為6個月,而標準審查為10個月。
111
目錄表
如果可以證明產品對替代終點有影響,而該替代終點有合理可能預測臨牀獲益,或對中間終點有影響,則該產品符合加速審批條件
可以在對不可逆發病率或死亡率的影響之前測量的臨牀終點,考慮到嚴重程度,該終點合理地可能預測對不可逆發病率或死亡率的影響或其他臨牀獲益,
罕見或患病率的條件和可用性或缺乏替代治療。加速批准取決於申辦者是否同意進行額外的批准後研究,以驗證和描述產品的臨牀
效益這些驗證性試驗必須經過盡職調查才能完成,並且在大多數情況下,FDA可能要求在批准前設計、啟動和/或完全入組試驗。未能進行所需的批准後研究,或
如果在上市後研究期間證實了臨牀獲益,將允許FDA加速從市場上撤回該產品。此外,作為加速批准的條件,FDA通常要求所有廣告和
用於傳播或出版的宣傳材料應提交給FDA進行審查。
即使產品符合一項或多項此類計劃的資格,FDA也可能在以後決定該產品不再符合資格條件或FDA審查或批准的期限
不能縮短。此外,快速通道認定、突破性療法認定、優先審評和加速批准不會改變批准的科學或醫學標準,也不會改變支持
批准,儘管它們可能會加快開發或審查過程。
孤兒藥物
根據《孤兒藥法》,FDA可將孤兒藥認定授予旨在治療罕見疾病或病症的產品,罕見疾病或病症通常是影響少於
在美國有200,000人或在美國有200,000人以上,但沒有合理的預期可以收回開發和生產用於此類疾病或病症的產品的成本
在美國的產品銷售。
在提交NDA之前,必須申請孤兒藥認定。在FDA授予孤兒藥認定後,
FDA.孤兒藥的認定並不意味着在監管審查和批准過程中有任何優勢,也不會縮短監管審查和批准過程的時間。
第一個獲得FDA批准用於治療罕見疾病的特定活性成分的NDA申請人有權在
美國用於該產品,用於該適應症。在七年的獨佔期內,FDA可能不會批准任何其他申請,以銷售用於相同疾病的相同藥物,除非在有限的情況下,例如顯示臨牀
通過更高的有效性、更高的安全性或為患者護理提供重大貢獻,或在藥品供應問題的情況下,優於具有孤兒藥排他性的產品。孤兒藥排他性並不妨礙FDA
批准用於相同疾病或病症的不同藥物或用於不同疾病或病症的相同藥物。孤兒藥認定的其他好處包括某些研究的税收抵免和免除NDA申請費。
臨牀試驗信息的披露
FDA監管產品(包括藥物)臨牀試驗的申辦者必須在ClinicalTrials.gov上註冊並披露某些臨牀試驗信息。
產品、患者人羣、研究階段、研究地點和研究人員以及臨牀試驗的其他方面隨後作為註冊的一部分被公開。申辦者也有義務討論其臨牀試驗的結果
建成後在某些情況下,這些審判結果的披露可推遲至審判結束之日後最多兩年。競爭對手可以使用這些公開信息來了解
發展計劃的進展。
112
目錄表
兒科信息
根據《兒科研究公平法》,新藥或新藥補充劑必須包含數據,以評估藥物在所有相關兒科亞羣中聲稱的適應症的安全性和有效性,並支持對藥物安全有效的每個兒科亞羣的劑量和給藥。FDA可以給予提交數據的全部或部分豁免或延期。
兒童最佳藥品法案,或BPCA,為NDA持有者提供了六個月的延長,如果滿足某些條件,任何藥物的排他性-專利或非專利-。排他性條件包括FDA確定與在兒科人羣中使用新藥有關的信息可能對該人羣的健康產生益處,FDA提出兒科研究的書面請求,以及申請人
同意在法定時間範圍內進行並報告所要求的研究。根據BPCA提出的申請將被視為優先申請。
審批後要求
一旦保密協議獲得批准,產品將受到某些批准後要求的約束。例如,FDA密切監管藥品的審批後營銷和促銷,包括直接面向消費者的廣告、標籤外促銷、行業贊助的科學和教育活動以及涉及互聯網的促銷活動的標準和法規。根據批准的標籤的規定,藥品只能針對批准的適應症和
銷售。
FDA批准NDA後,需要提交不良事件報告和定期報告。FDA還可能要求上市後測試,即所謂的第四階段測試、REMS和監督,以監控批准的產品的效果,或者FDA可能會在批准時附加條件,限制該產品的分銷或使用。此外,質量控制、藥品製造、包裝和標籤程序
必須在批准後繼續符合cGMP。藥品製造商和他們的某些分包商被要求向FDA和某些州機構登記他們的工廠。FDA的註冊要求實體接受FDA的定期突擊檢查,在此期間,FDA檢查製造設施,以評估對cGMP的遵守情況。因此,製造商必須繼續在生產和質量控制領域花費時間、金錢和精力,以
保持符合cGMP。如果一家公司未能遵守監管標準,如果該公司在初始營銷後遇到問題,或者如果後來發現了以前未意識到的問題,監管機構可以撤銷產品批准或要求產品召回。
FDA嚴格監管上市藥品的營銷、標籤、廣告和促銷活動。藥品的廣告和促銷必須符合FDCA及其實施條例,並且僅限於批准的適應症,並且以與批准的標籤一致的方式進行。FDA和其他機構積極執行禁止推廣標籤外用途的法律和法規,被發現以不正當方式推廣標籤外用途的公司可能面臨重大責任,包括聯邦和州當局的調查。
《哈奇-瓦克斯曼法案》
橙色圖書清單
在通過保密協議尋求藥物批准時,申請人被要求向FDA列出其權利要求涵蓋申請人產品的每一項專利。在一種藥物獲得批准後,該藥物申請中列出的每一項專利都將在FDA批准的具有治療等效性評估的藥物產品中公佈,通常被稱為橙皮書。反過來,橙色手冊中列出的藥物可以被潛在的仿製藥競爭對手引用,以支持簡化新藥申請或ANDA的批准。ANDA規定銷售的藥物產品具有與所列藥物相同強度和劑型的相同活性成分,並已通過生物等效性測試證明在治療上與所列藥物相同。除了生物等效性測試的要求外,ANDA申請者不需要進行或提交非臨牀或臨牀測試的結果,以證明其藥物產品的安全性或有效性。以這種方式批准的藥物通常被稱為上市藥物的“仿製等價物”,通常可以由藥劑師根據為原始上市藥物開出的處方進行替代。
113
目錄表
ANDA申請者必須向FDA證明FDA批准的產品在FDA的橙皮書中列出的任何專利。具體地説,申請人必須證明:(I)尚未提交所需的專利信息;(Ii)所列專利已到期;(Iii)所列專利尚未到期,但將在特定日期到期,並在專利到期後尋求批准;或(Iv)所列專利無效或不會
受到新產品的侵犯。ANDA申請人也可以選擇提交一份聲明,證明其建議的ANDA標籤不包含(或雕刻)任何關於專利使用方法的語言,而不是證明列出的使用方法專利。如果申請人沒有挑戰所列專利,ANDA申請將在所有要求參考產品的所列專利到期之前不會獲得批准。新產品不會侵犯已獲批准產品的上市專利或此類專利無效的認證稱為第四款認證。如果ANDA申請人已經向FDA提供了第四段認證,一旦FDA接受ANDA備案,申請人還必須向NDA和專利持有人發送關於第四段認證的通知。然後,NDA和專利持有人可以針對第四款認證的通知提起專利侵權訴訟。在收到第四款認證後45天內提起專利侵權訴訟會自動阻止FDA批准ANDA,直到專利到期、訴訟和解或在侵權案件中做出對ANDA申請人有利的裁決,以較早的30個月為準。
ANDA申請也將在橙皮書中列出的引用產品的任何適用的非專利排他性到期之前不會獲得批准。
如果第505(B)(2)條的申請人依賴FDA先前對已獲批准產品的安全性或有效性的調查結果,則申請人必須向FDA
證明橙色手冊中所列獲批准產品的任何專利,其程度與ANDA申請人相同。因此,505(B)(2)保密協議的批准可以被擱置,直到要求參考產品的所有列出的專利已經過期,
直到橙皮書中列出的引用產品的任何非專利專有權,例如獲得新化學實體的批准的排他性已經過期,在第四段認證和隨後的專利侵權訴訟的情況下,直到較早的30個月,訴訟和解或侵權案件中對第505(B)(2)條申請人有利的裁決。
排他性
一旦NDA批准了新的化學實體,即不包含FDA在任何其他NDA中批准的活性部分的藥物,該藥物將獲得五年的市場排他性
在此期間FDA不能收到任何尋求批准該藥物仿製版本的ANDA。如果提交了第四款認證,ANDA可在新的化學品實體排他性到期前一年提交。如果Orange Book中沒有列出的專利
,則可能沒有第四款認證,因此,在排他期到期之前,不能提交ANDA。如果申請包含贊助商進行或贊助的對批准申請至關重要的新的臨牀研究(生物利用度研究除外)的報告,則藥物的某些變化,如在包裝插入中增加新的適應症,可能是三年排他期的主題。FDA
不能批准在排他期內包含更改的仿製藥的ANDA。
如果申請人進行或贊助的新的臨牀研究(生物利用度研究除外)被FDA認為對批准申請至關重要,例如現有藥物的新適應症、劑量或強度,則FDCA可為NDA或現有NDA的補充劑提供三年的市場排他性。這一為期三年的排他性僅包括根據新的臨牀研究批准的藥物的修改,並不禁止FDA批准ANDA或505(B)(2)NDA,用於含有原適應症或使用條件的活性成分的藥物。五年和
三年的獨家授權不會延遲提交或批准完整的保密協議。然而,提交完整的保密協議的申請者將被要求進行或獲得參考所有非臨牀研究和充分和良好控制的臨牀試驗的權利,以證明安全性和有效性。
114
目錄表
專利期延長
在NDA批准後,相關藥物專利的所有者可以申請最長五年的專利延期。允許的專利期延長按藥物測試階段(IND申請和NDA提交之間的時間)和所有審查階段(NDA提交和批准之間的時間)的一半計算,最長為五年。除其他事項外,如果FDA確定申請人
沒有進行盡職調查尋求批准,則可以縮短延長期。續展後的專利總期限不得超過14年,且只能續展一項專利。對於在申請階段可能到期的專利,專利所有者可以請求臨時
專利延期。臨時專利延期將專利期限延長一年,最多可續展四次。每批准一次臨時專利延期,批准後的專利延期將減少一年。要獲得臨時專利延期,美國專利商標局的董事必須確定申請專利延期的專利所涵蓋的藥物有可能獲得批准。對於尚未提交保密協議的藥物,
不提供臨時專利延期。
受管制物質
聯邦受控物質法或CSA及其實施條例建立了一個製造和分銷受控物質的“封閉系統”。CSA和美國禁毒署(DEA)頒佈的法規對處理受控物質的個人和其他實體提出了登記、安全、記錄保存和報告、儲存和其他要求。DEA是負責監管受控物質的聯邦機構,要求生產、進口、出口、分銷、研究或分發受控物質的個人或實體遵守監管要求,以防止將受控物質轉移到非法商業渠道。
DEA根據依賴和濫用的相對可能性,將受控物質歸類為五個附表之一--附表I、II、III、IV或V。根據定義,附表一物質
最有可能被濫用,目前在美國沒有被接受的醫療用途,並且在醫療監督下使用缺乏公認的安全性。在可上市的受控物質中,附表II、III、IV或V被認為具有最高的濫用和身體或心理依賴的可能性,而附表V的物質被認為具有最高的濫用和依賴的相對可能性。
美布福寧(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)目前被歸類為附表I藥物,如果在美國獲準上市,則需要由DEA將其從附表I重新安排到附表II-V,然後才能商業上市、分銷和銷售。重新安排取決於FDA的批准,FDA必須就適當的安排向DEA提出建議。DEA必須進行通知和評論規則制定,以重新安排任何受控物質的時間。此類行動將受到公眾意見的影響,並可能要求舉行行政聽證會,反對或支持任何此類行動。此外,由於每個州都有自己的與受控物質相關的法規和法規要求,每個州或司法管轄區還必須採取適當的行政或立法行動,根據聯邦重新安排在該州重新安排受控物質的時間。
製造商、進口商、出口商和分銷商必須每年向DEA註冊才能處理受管制物質。藥房和醫生必須每三年註冊一次。DEA
登記特定於每個設施(即,物理位置)以及在每個地點處理的活動和受控物質時間表(S)。
在簽發受控物質登記之前,DEA檢查所有制造、進口和分銷設施,以審查安全、記錄保存、報告和處理。具體的安全要求因業務活動的類型以及處理的受控物質的時間表和數量而異。最嚴格的要求適用於附表一和附表二物質的製造商、進口商和分銷商。
所要求的安全措施包括通過儲存在經批准的金庫、保險箱和籠子中以及通過使用警報系統和監視攝像機對受控物質進行限制訪問和實物控制。註冊後,製造設施必須保存記錄所有受控物質的製造、接收、庫存和分配的記錄。製造商必須定期向禁毒署提交關於附表一和附表二管制物質、附表三麻醉物質和其他指定物質分配情況的報告。所有DEA註冊者(包括製造商、進口商和分銷商)必須遵守安全、記錄保存和報告要求,例如報告任何受控物質盜竊或重大損失,並遵循銷燬或處置受控物質的適當程序。為商業目的進口附表一和附表二管制物質一般限於尚未從國內供應商處獲得的物質或國內供應商之間沒有充分競爭的物質。除進口商或出口商登記外,進口商和出口商每次進口或出口附表一和表二物質或表三、表四和表五麻醉藥品都必須獲得許可證,並提交表三、表四和表五非麻醉品的進出口申報單。在某些情況下,如有必要,附表三非麻醉物質可受進出口許可要求的約束,以確保美國遵守國際藥物管制條約規定的義務。
115
目錄表
對於在美國製造的藥品,DEA根據DEA對滿足合法醫療、科學、研究和工業需求所需數量的估計,每年為附表一和表二中可能在美國製造或生產的物質的數量建立一個總配額。每個製造商必須申請單獨的生產配額(例如,生產原料藥)或採購配額(例如,
生產劑型或包裝),代表每個工廠在給定季度或一年中可以生產的數量。DEA目前已經修訂了其規定,要求每季度申請配額。配額同樣適用於有效藥物成分的生產和劑型的生產。DEA每年可能會調整幾次總生產配額。DEA還可以根據
製造商的請求調整單個製造或採購配額。DEA在是否對個別公司進行此類調整方面擁有相當大的自由裁量權。
美國不同的州也制定了單獨的受控物質法律和法規,包括許可、記錄保存、安全、分配和分配要求。
州當局,包括藥房委員會,在每個州管理受控物質的使用。
未能遵守適用的要求,特別是受管制物質的損失或轉移,可能會導致執法行動,可能對我們的業務、運營和財務狀況產生重大不利影響。緝毒局可以尋求民事處罰,拒絕續簽必要的登記,或啟動程序撤銷這些登記。在某些情況下,違規行為可能導致
刑事起訴。
美國和大多數國家是聯合國國際藥物管制條約的簽署國,這些條約規定了涉及受控物質的某些時間表、許可證、限制和其他要求
。由於根據《聯合國精神藥物公約》,美布替寧被列為附表一管制物質,1971大多數國家維持的法律和法規與美國關於甲布替寧和其他受控物質的法律和法規不相上下。
歐盟藥品批准管理法規和程序
為了在美國境外營銷任何產品,公司還必須遵守其他國家/地區和司法管轄區在質量、安全性和有效性以及對產品的臨牀試驗、營銷授權、商業銷售和分銷等方面的眾多不同監管要求。無論是否獲得FDA對產品的批准,申請者都需要獲得類似外國監管機構的必要批准,然後才能在這些國家或司法管轄區啟動該產品的臨牀試驗或營銷。具體地説,歐盟的醫療產品審批流程通常遵循與美國類似的流程,儘管在美國批准一種醫療產品並不能保證同一產品在歐盟獲得批准,或者在與美國批准的時間範圍相同的時間範圍內獲得批准。它需要令人滿意地完成藥物開發、非臨牀研究以及充分和良好控制的臨牀試驗,以確定藥物對每個擬議適應症的安全性和有效性。在歐盟或其成員國(以及冰島、挪威和列支敦士登)銷售和銷售產品之前,它
還要求向相關主管當局提交臨牀試驗授權,以批准營銷授權申請或MAA,並由這些當局授予營銷授權。如果我們未能遵守適用的要求,我們可能會受到罰款、暫停臨牀試驗、暫停或撤回監管批准、產品召回、產品扣押、運營限制和刑事起訴等處罰。
116
目錄表
臨牀試驗批准
在歐盟,申請臨牀試驗授權的申請人必須事先獲得進行臨牀試驗的歐盟成員國國家主管當局的批准。此外,只有在相關的獨立倫理委員會對臨牀試驗發表了積極的意見後,申請人才能在特定的研究地點開始臨牀試驗。2014年4月,歐盟通過了新的臨牀試驗(EU)條例(歐盟)第536/2014號,取代了以前的臨牀試驗指令2001/20/EC。它重塑了歐盟臨牀試驗的審批制度。具體地説,這項直接適用於所有歐盟成員國的新立法(意味着不需要在每個歐盟成員國實施國家立法)旨在簡化和簡化歐盟臨牀試驗的審批。例如,新的《臨牀試驗條例》規定了通過單一切入點--臨牀試驗信息系統(CTI)簡化申請程序,並嚴格規定了臨牀試驗申請評估的截止日期。新的臨牀試驗法規(歐盟)第536/2014號於2022年1月31日生效。新的臨牀試驗條例的暫時性條款允許贊助商選擇是否根據臨牀試驗指令2001/20/EC或臨牀試驗條例(歐盟)第536/2014號提交新的臨牀試驗申請,如果臨牀試驗的授權請求是在新的臨牀試驗條例生效後的一年內提交的。如果贊助商選擇根據臨牀試驗指令
2001/20/EC提交,則臨牀試驗將繼續受臨牀試驗指令2001/20/EC管轄,直到新的臨牀試驗法規(歐盟)第536/2014號生效三年後。如果臨牀試驗在《臨牀試驗條例》(EU)第536/2014號生效後持續超過三年
,屆時《臨牀試驗條例》(EU)第536/2014號將開始適用於該臨牀試驗,並且必須在2025年1月31日之前移交給CTIS,如果在過渡期結束前仍在進行的話
。然而,在2023年1月31日之後,不能根據臨牀試驗指令2001/20/EC提交新的國家臨牀試驗申請。因此,如果贊助商選擇在截至2023年1月31日的一年過渡期內根據《臨牀試驗指令》提交臨牀試驗申請,則只有在將整個臨牀試驗
移交給CTIS後,才能在2023年1月31日之後將新的歐盟成員國添加到臨牀試驗中。
營銷授權
要獲得歐盟監管制度下的產品營銷授權,申請者必須提交MAA,要麼是根據EMA管理的中央程序,要麼是由歐盟成員國主管當局管理的程序之一(分散程序、國家程序或互認程序)。營銷授權只能授予在歐盟設立的申請人。
集中程序規定由歐盟委員會授予對所有歐盟成員國(以及冰島、挪威和列支敦士登)有效的單一銷售授權。
根據(EC)第726/2004號條例,集中程序對特定產品是強制性的,包括含有用於治療某些疾病的新活性物質的產品,包括治療TRD的產品。對於那些不強制使用集中程序的產品,如果該產品含有用於治療其他疾病的新活性物質,或者申請人可以證明該產品構成了一項重大的治療、科學或技術創新,或者該產品的集中程序符合歐盟一級患者的利益,則申請人可以選擇使用集中程序。
根據中央程序,在EMA設立的人用藥品委員會,或CHMP,是EMA負責人類藥物的委員會,負責評估一種藥物是否符合要求的質量、安全性和有效性要求,以及該產品是否具有積極的風險/益處/風險概況。根據中央程序,對重大影響評估進行評估的最長時限為自收到有效重大影響評估之日起210天,不包括申請人在答覆《氣候變化框架公約》問題時提供補充資料或書面或口頭解釋的時間。停止計時可能會將評估MAA的時間範圍延長到210天以上。如果CHMP給出了肯定的意見,它會將意見和支持文件一起提供給歐盟委員會,後者將做出授予營銷授權的最終決定
。在特殊情況下,當從公共衞生的角度,特別是從治療創新的角度來看,一種醫藥產品具有重大意義時,CHMP可以批准加速評估。如果CHMP
接受這樣的請求,210天的評估時限將減少到150天(不包括時鐘停止),但如果CHMP確定
申請不再適合進行加速評估,它可能會恢復到集中程序的標準期限。
117
目錄表
優質方案
EMA提供了一項計劃,旨在加強與EMA的早期對話和EMA的監管支持,以刺激創新、優化發展並加快對優先藥物或Prime的評估。它的目的是建立在環境管理協會提供的科學建議計劃和加速評估程序的基礎上。該計劃是自願的,必須滿足資格標準才能獲得Prime的資格。
Prime計劃對正在開發中的藥品開放,申請人打算通過集中程序申請初步上市授權申請。合格的
產品必須針對未滿足醫療需求的條件(歐盟沒有令人滿意的診斷、預防或治療方法,或者,如果有,新藥將帶來主要的治療優勢),並且它們必須
展示通過引入新方法或療法或改進現有方法來滿足未滿足的醫療需求的潛力。申請者通常處於開發的探索性臨牀試驗階段,並將在患者中獲得初步的臨牀證據,以證明該藥物有希望的活性及其在很大程度上解決未得到滿足的醫療需求的潛力。在特殊情況下,學術部門或中小企業(中小型企業)的申請者可以在開發的早期階段提交資格申請,前提是相關模型中令人信服的非臨牀數據提供了有前景的活動的早期證據,並且首先在人體研究中表明有足夠的暴露於所需的藥物治療效果和耐受性。
如果為Prime方案選擇了一種藥物,EMA:
|
•
|
從CHMP或高級治療委員會(CAT)任命一名報告員,在提交上市授權申請之前提供持續支持並積累藥物知識。
|
|
•
|
發佈對申請人整體發展計劃和監管戰略的指導意見;
|
|
•
|
與報告員和環境管理協會相關委員會和工作組的專家一起組織啟動會議;
|
|
•
|
提供專職EMA聯絡人;以及
|
|
•
|
在關鍵的發展里程碑上提供科學建議,必要時讓更多的利益攸關方參與,如衞生技術評估機構和患者。
|
被選入Prime計劃的藥品預計也將受益於EMA在申請上市授權時的加速評估程序。在研發過程中,如果一種藥物不再符合資格標準,Prime計劃下的支持可能會被撤回。
兒科發展
在歐盟,開發新醫藥產品的公司必須與EMA就兒科調查計劃或PIP達成一致,並必須根據該PIP進行兒科臨牀試驗,
除非適用豁免(即,因為相關疾病或狀況僅發生在成人中)。產品的營銷授權申請必須包括根據PIP進行的兒科臨牀試驗的結果
,除非申請豁免或已批准延期,在這種情況下,兒科臨牀試驗必須在晚些時候完成。根據根據PIP進行的兒科臨牀試驗獲得上市授權的產品,有資格根據補充保護證書(如果在批准時有效)將保護延長六個月,或者如果是孤兒藥品,則有資格將孤兒市場專有權延長兩年。這一兒科獎勵受到特定條件的制約,在開發和提交符合PIP的數據時不會自動獲得。
歐盟的監管數據保護
在歐盟,根據修訂的(EC)第726/2004號法規和修訂的2001/83/EC指令,根據完整的獨立數據包批准的新化學實體有資格獲得八年的數據獨佔和額外兩年的市場獨家。數據排他性使歐盟的監管機構在八年內不能參考創新者的數據來評估通用(縮寫)
應用。在額外的兩年市場專營期內,可以提交仿製藥上市授權申請,並可以參考創新者的數據,但在市場專營期屆滿之前,任何仿製藥都不能
銷售。如果在10年的前8年中,營銷授權持有人獲得了一個或多個新的治療適應症的授權,則整個10年的有效期將延長至最多11年。在授權前的科學評估中,該新的治療適應症被認為與現有療法相比具有顯著的臨牀益處。即使一種化合物被認為是一種新的化學實體,因此創新者獲得了規定的數據獨佔期,如果另一家公司獲得了基於MAA的營銷授權,該公司擁有
藥物測試、非臨牀測試和臨牀試驗的完整獨立數據包,則該公司也可以銷售該產品的另一個版本。
118
目錄表
授權期和續期
原則上,上市許可有效期為5年,5年後可根據EMA或主管
授權成員國的權力。為此,上市許可持有人必須向EMA或主管部門提供關於質量、安全性和有效性的文件的合併版本,包括所有變更
自上市許可授予之日起,上市許可失效前至少9個月。一旦更新,上市許可的有效期不受限制,除非歐盟委員會或
主管部門基於與藥物警戒相關的合理理由,決定再進行一次為期五年的更新。任何未在歐盟市場上投放產品的授權(如果
集中程序)或在授權成員國的市場上,在授權失效後三年內。
管制藥物分類
在愛爾蘭,根據經修訂的2017年藥物濫用條例,mebufotenin被視為附表1藥物。《2017年藥物濫用條例》附表1列出了那些藥物, 限制性管制適用於:它們被認為沒有合法或藥用用途,只能在愛爾蘭衞生產品監管局(HPRA)代表
頒發的許可證下進口、出口、生產、供應等。 衞生部。歐盟成員國的立場並不一致。成員國已將相關聯合國公約(《1961年麻醉品單一公約》和《1971年精神藥物公約》)實施到
這導致了歐盟不同國家對受控物質的監管方式存在差異。因此,在國家一級確定某種物質是否受到管制並遵守
適用的法律要求。如果我們成功地在歐盟主要成員國獲得上市許可,很可能還需要重新安排mebufotenin的時間,以便能夠開處方。無法保證此類
重新安排將是成功的。
在英國,我們的部分生產過程發生在英國,根據1971年藥物濫用法(經修訂),美布福汀被視為A類藥物,並根據
2001年修訂的《藥品管理條例》。A類藥物被認為是最具潛在危害性的藥物,根據1971年《濫用藥物法》,A類藥物受到最高級別的控制。同樣,《濫用藥物規例》附表1
2001年的《藥物管制法》列出了受最嚴格管制的藥物:這些藥物被認為沒有合法用途或藥用價值,只能在聯合王國政府內政部頒發的許可證下進口、出口、生產和供應。如果
而當該藥物獲英國藥品及藥物管理局批准在英國上市時,該藥物仍會列為附表1藥物,直至英國內政部重新安排其上市日期為止。除非和直到根據濫用
2001年藥品法規,除非在獲得英國上市許可後和重新安排之前通過了GH 001、GH 002或GH 003的法定豁免,否則英國的任何處方醫生都需要內政部許可證,
處方GH 001、GH 002或GH 003,同樣,任何處方GH 001、GH 002或GH 003的患者都需要內政部許可證才能擁有GH 001、GH 002或GH 003。無法保證會授予此類家庭辦公室許可證
或者重新安排會成功。
營銷授權後的監管要求
批准後,營銷授權持有人必須遵守適用於醫藥產品的製造、營銷、推廣和銷售的一系列要求。
這些措施包括遵守歐盟嚴格的藥物警戒或安全報告規則,根據這些規則,可以實施授權後研究和額外的監測義務。上市許可持有人必須建立和維護藥物警戒系統,並指定一名有資格的個人擔任藥物警戒人員,負責監督該系統。主要義務包括迅速報告疑似嚴重不良反應,並定期提交安全更新報告。
119
目錄表
此外,所有新的MAA必須包括風險管理計劃或RMP,該計劃描述了公司將實施的風險管理系統,並記錄了防止或最大限度減少與產品相關的風險的措施。監管部門也可以規定特定的義務作為上市授權的條件。此類風險最小化措施或授權後義務可能包括額外的安全監測、更頻繁地提交PSURs或進行額外的臨牀試驗或授權後安全性研究。RMP和PSURs通常可供請求訪問的第三方使用,但需要進行有限的編輯。
此外,授權產品的製造還必須嚴格遵守EMA的cGMP要求和歐盟其他監管機構的類似要求,這些要求要求在產品的製造、加工和包裝中使用的方法、設施和控制措施,以確保產品的安全和身份。
最後,授權產品的營銷和推廣,包括行業贊助的繼續醫學教育和針對產品處方者的廣告,在歐盟受到修訂後的2001/83/EC指令的嚴格監管。歐盟不允許向普通公眾投放僅限處方藥的廣告。雖然藥品廣告和促銷的一般要求是根據修訂後的歐盟指令2001/83/EC確定的,但細節和執行受每個歐盟成員國(以及冰島、挪威和列支敦士登)的法規管轄,並且各國有所不同。
承保範圍、定價和報銷
對於我們獲得監管部門批准的任何候選產品的覆蓋範圍和報銷狀態,存在重大不確定性。在美國和其他國家/地區的市場上,我們獲得監管部門批准用於商業銷售的任何美布福汀療法的銷售,在一定程度上將取決於第三方付款人對我們產品的承保範圍和報銷情況,例如政府醫療保健計劃、聯邦醫療保險和醫療補助、管理式醫療保健提供者、私人健康保險公司、健康維護組織和其他組織。這些第三方付款人決定他們將支付哪些藥物,並將建立報銷水平。政府和其他第三方付款人提供的保險範圍和報銷範圍對於大多數患者能夠負擔得起新療法等治療至關重要。在美國,有關新藥報銷的主要決定通常由醫療保險和醫療補助服務中心(CMS)做出。CMS決定我們的產品是否以及在多大程度上將在Medicare下覆蓋和報銷,而私人付款人往往會在很大程度上遵循CMS的做法。付款人在確定報銷時考慮的因素基於產品是否為:
|
•
|
在其健康計劃下有保障的福利;
|
|
•
|
安全、有效和醫學上必要的;
|
|
•
|
適用於特定的患者;
|
|
•
|
具有成本效益;以及
|
|
•
|
既不是試驗性的,也不是調查性的。
|
我們能否成功地將我們的候選產品商業化,無論是作為單一藥物還是聯合療法,在一定程度上將取決於我們的產品和相關治療在多大程度上可以從第三方付款人那裏獲得保險和足夠的報銷。此外,付款人決定為產品提供保險並不意味着將批准足夠的償還率。即使提供了保險,
批准的報銷金額也可能不足以讓我們建立或維持足以實現產品開發投資適當回報的價格水平。
在美國,第三方付款人對產品的承保和報銷沒有統一的政策。因此,我們產品的承保範圍和報銷範圍因付款人而異。確定付款人是否將為產品提供保險的過程可以與設置付款人將為產品支付的償還率的過程分開。一個付款人決定為醫療產品或服務提供保險
並不能確保其他付款人也將為該醫療產品或服務提供保險,或將以適當的報銷率提供保險。第三方付款人還可以將承保範圍限制在批准的清單或配方表上的特定
產品,其中可能不包括特定適應症的FDA批准的所有產品。
120
目錄表
第三方付款人決定不為使用我們產品的醫療產品或治療單獨報銷或不單獨報銷,可能會降低醫生對我們產品的使用率
,並對我們的銷售、運營結果和財務狀況產生重大不利影響。如果第三方付款人承保了我們的候選產品或使用我們候選產品的療法,則由此產生的報銷付款率
可能不夠高,或者可能需要患者認為不可接受的高共付率。我們不能確保我們當前或未來的候選產品或使用此類候選產品的任何程序在美國的承保範圍和報銷範圍是否可用
,並且可能獲得的任何報銷可能不夠充分,或可能在未來減少或取消。此外,如果我們或我們的合作者開發用於我們的候選產品的療法,我們或我們的
合作者將被要求獲得這些療法的單獨承保和報銷,並且一旦獲得批准,除了我們為我們的候選產品尋求的承保和報銷之外。
此外,第三方付款人除了安全性和有效性外,還越來越多地挑戰價格,檢查醫療產品和服務的醫療必要性和成本效益。為了確保任何可能被批准銷售的候選產品的承保範圍和報銷,我們可能需要進行昂貴的藥物經濟學研究,以證明此類產品的醫療必要性和成本效益,以及獲得FDA或類似監管批准所需的成本。此外,我們可能需要向購買者、私人健康計劃或政府醫療計劃提供折扣。儘管如此,我們的候選產品可能不會被認為是醫學上必要的或具有成本效益的。如果第三方付款人認為某個產品與其他可用療法相比不具有成本效益,則在獲得批准後,他們可能不會將該產品作為其
計劃下的一項福利覆蓋,或者,如果他們認為第三方付款人認為該產品與其他可用療法相比不具有成本效益,則其支付水平可能不足以使公司銷售其產品以盈利。一旦產品獲得批准,第三方付款人決定不承保可能會減少醫生的使用率,並對銷售、我們的運營和財務狀況產生重大不利影響。我們預計,在潛在銷售我們的任何候選產品時,都會遇到來自第三方付款人的定價壓力。
最後,在一些外國國家,藥品的擬議定價和報銷狀態必須獲得批准,才能合法上市。各國對藥品定價的要求千差萬別。例如:
|
•
|
在歐盟,成員國可以限制其國家醫療保險制度提供報銷的醫療產品的範圍,在大多數歐盟國家,供人使用的醫療產品的價格必須得到國家衞生當局的批准,才能供應;
|
|
•
|
幾乎所有歐盟成員國作出定價決定所依據的共同標準是國際參考定價(所附的方法和權重因國家而異),而在英國,國際參考定價不是定價決策正式依賴的標準;
|
|
•
|
歐盟/歐洲經濟區和英國的補償決定通常基於各種形式的衞生技術評估,包括成本效益確定。從2025年開始,歐盟的衞生技術評估條例(條例(EU)2021/2282)或HTA條例將開始生效,規定歐盟/歐洲經濟區各國報銷當局將考慮對臨牀有效性的共同評估。這將不會在英國產生直接影響,但實際上可能會產生影響;以及
|
|
•
|
額外的公共採購招標被廣泛用於醫院採購醫藥產品。
|
總體上,醫療成本,特別是處方藥的下行壓力變得很大。因此,對新產品的進入設置越來越高的壁壘。
政治、經濟和監管發展可能會使定價談判進一步複雜化,在獲得補償後,定價談判可能會繼續進行。歐盟各成員國使用的參考定價和平行貿易(低價和高價成員國之間的套利
)可以進一步降低價格。接受任何醫療產品的報銷可能會伴隨着成本、用途以及通常的數量限制,這些限制同樣可能因國家而異。此外,可能適用基於結果的
報銷規則。
121
目錄表
儘管有上述任何情況,作為CSA下的附表I物質,美布替寧目前被認為沒有被接受的醫療用途,使用美布替寧的療法目前在美國被禁止報銷。
其他醫療保健法律和合規性要求
醫療保健提供者和第三方付款人將在我們獲得營銷批准的任何產品的推薦和處方中發揮主要作用。我們的業務運營以及目前或未來與第三方付款人、醫療保健提供者和醫生的任何安排可能會使我們面臨廣泛適用的聯邦和州欺詐和濫用法律,以及其他醫療保健法律和法規。這些法律可能會影響我們的業務或財務安排以及我們用於研究、營銷、銷售和分銷我們獲得批准的候選產品的業務或財務安排和關係。此外,我們可能受到聯邦政府和我們開展業務所在的美國的健康信息隱私法規的約束。在美國,可能影響我們運營能力的法律包括:
|
•
|
聯邦反回扣法規,除其他事項外,禁止個人和實體直接或間接、公開或隱蔽地以現金或實物直接或間接、公開或隱蔽地索要、收受、提供或支付任何報酬(包括任何回扣、賄賂或回扣),以誘使或作為交換,轉介個人,或購買、租賃、訂購、安排或推薦任何商品、設施、物品或服務,以根據聯邦醫療保健計劃進行全部或部分付款。比如聯邦醫療保險和醫療補助。“報酬”一詞被廣泛解釋為包括任何有價值的東西。此外,法院還發現,如果薪酬的“一個目的”是誘導轉診,則違反了聯邦“反回扣法規”。聯邦反回扣法規被解釋為適用於製造商與處方者、購買者和處方經理之間的安排。個人或實體不需要實際瞭解聯邦反回扣法規,也不需要有違反該法規的具體意圖即可實施違規。反回扣法規被解釋為適用於生物製藥製造商與處方者、購買者和處方經理等人之間的安排。有一些法定例外和監管安全港保護一些常見活動不受起訴,但例外和安全港的範圍很窄,需要嚴格遵守才能提供保護,涉及旨在誘導
開處方、購買或推薦的報酬的做法如果不符合例外或安全港的資格,可能會受到審查;
|
|
•
|
聯邦民事和刑事虛假申報法,如《聯邦醫療保險法》,除其他事項外,禁止個人或實體故意提出或導致提交虛假、虛構或欺詐性的聯邦醫療保險、醫療補助或其他第三方付款人的付款或批准索賠;不得故意作出、使用或導致作出或使用虛假陳述或記錄材料,以虛假或欺詐性索賠或向聯邦政府支付或轉移財產的義務;或故意隱瞞或故意不正當地逃避或減少向聯邦政府支付資金的義務。如果索賠包括因違反聯邦反回扣法規而產生的物品或服務,則構成FCA下的虛假或欺詐性索賠。根據FCA,製造商即使沒有直接向政府付款人提交索賠,也可能被追究責任,如果他們被認為“導致”提交虛假或欺詐性索賠的話。《反海外腐敗法》還允許個人充當“告密者”,代表聯邦政府提起訴訟,指控違反了《反海外腐敗法》,並在任何貨幣追回中分享。當實體被確定違反了FCA時,政府可以對每個虛假索賠處以民事罰款和懲罰,外加三倍的損害賠償,並將該實體排除在聯邦醫療保險、醫療補助和其他聯邦醫療保健計劃之外;
|
|
•
|
聯邦民事罰款法,除其他事項外,對提供或轉讓報酬處以民事罰款,其中包括但不限於向聯邦醫療保險或醫療補助受益人免費或以低於公平市場價值(有限的例外情況)的任何物品或服務轉讓,此人知道或應該知道這可能會影響受益人對可由聯邦或州醫療保健計劃報銷的特定提供者、從業者或
供應商的選擇;
|
122
目錄表
|
•
|
1996年的聯邦《健康保險攜帶和責任法案》,或HIPAA,規定了額外的聯邦刑事責任,即故意和故意執行或試圖執行計劃,以欺詐任何醫療福利計劃,包括公共和私人第三方付款人,或通過虛假或欺詐性的藉口、陳述或承諾,獲得任何醫療福利計劃擁有的或在其監管或控制下的任何金錢或財產,而無論付款人(即公共或私人),並故意和故意偽造,以任何詭計或手段隱瞞或掩蓋重大事實,或作出任何重大虛假、虛構或欺詐性陳述或陳述,或作出或使用任何虛假文字或文件,而明知其包含任何重大虛假、虛構或欺詐性陳述或記項,與提供或支付與醫療保健事宜有關的醫療福利、項目或服務有關。與聯邦反回扣法規類似,個人或實體不需要實際瞭解法規或違反法規的具體意圖
即可實施違規;
|
|
•
|
HIPAA,經2009年《健康信息技術促進經濟和臨牀健康法案》(HITECH)及其各自的實施條例修訂,除其他事項外,對承保實體,包括某些承保醫療保健提供者、健康計劃和醫療保健信息交換所及其各自的業務夥伴,提出了與個人可識別健康信息及其承保分包商的隱私、安全和傳輸有關的某些
要求。除其他事項外,HITECH使HIPAA的隱私和安全標準直接適用於商業夥伴,即代表覆蓋實體創建、接收、維護、傳輸或獲取受保護健康信息的商業夥伴、獨立承包商或代理。HITECH還增加了對覆蓋實體、商業夥伴和可能的其他人施加的民事和刑事處罰,並賦予州總檢察長新的權力,可以向聯邦法院提起民事訴訟,要求損害賠償或禁制令,以執行聯邦HIPAA法律,並尋求與提起聯邦民事訴訟相關的律師費和費用;
|
|
•
|
聯邦醫生支付陽光法案是根據經《醫療保健和教育和解法案》修訂的《患者保護和平價醫療法案》創建的,統稱為《平價醫療法案》或ACA,它要求根據Medicare、Medicaid或兒童健康保險計劃可獲得付款的適用藥品、設備、生物製品和醫療用品製造商每年向美國衞生與公眾服務部(HHS)報告與向醫生(定義為包括醫生、牙醫、視光師、足科醫生和脊椎按摩師)、某些非醫生提供者,包括醫生助理、執業護士、臨牀護士專家、麻醉師助理、註冊護士麻醉師、註冊護士助產士和教學醫院,以及上述醫生及其直系親屬持有的所有權和投資權益;
|
|
•
|
聯邦政府價格報告法,它要求我們準確和及時地計算和報告複雜的定價指標給政府項目;
|
|
•
|
聯邦消費者保護法和不正當競爭法,這些法律廣泛地監管市場活動和可能損害消費者的活動;以及
|
|
•
|
與上述每個醫療保健法律和法規類似的州和外國等價物,如反回扣和虛假索賠法律,可能適用於任何第三方付款人(包括商業保險公司或患者)報銷的項目或服務;適用於製造商的州和地方營銷和/或透明度法律,其範圍可能比聯邦要求更廣泛;要求製藥公司遵守制藥業自願合規指南和聯邦政府頒佈的其他相關合規指南的州法律,例如2003年4月的《藥品製造商總督察合規計劃指南》和/或《美國藥品研究和製造商與醫療保健專業人員互動準則》;州法律要求報告與藥品定價有關的信息;
州法律要求藥品製造商報告與向醫生和其他醫療保健提供者支付或以其他方式轉移價值有關的信息,或營銷支出和定價信息;州和地方法律要求藥品銷售代表獲得執照和/或註冊;以及管理健康信息隱私和安全的州和外國法律,這些法律可能比美國的法律(如採用GDPR的歐盟或採用英國GDPR的英國)更為嚴格,其中許多法律在很大程度上彼此不同,而且往往沒有被HIPAA搶先一步,從而使合規工作複雜化。
|
123
目錄表
醫藥產品的分銷還需遵守其他要求和法規,包括廣泛的記錄保存、許可、儲存和安全要求,以防止
未經授權銷售藥品。
這些法律的全部範圍和執行都是不確定的,並受到當前醫療改革環境的快速變化的影響。聯邦和州執法機構繼續
加強對醫療保健公司和醫療保健提供者之間互動的審查,這導致了醫療保健行業的一些重大調查,起訴,定罪和和解。有可能
政府機構將得出結論,我們的商業行為不符合當前或未來涉及適用欺詐和濫用的法規、法規或判例法,或其他醫療保健法律和法規。如果我們的業務,包括我們的
與醫生和其他醫療保健提供者和實體(如我們的卓越中心或治療師)的安排被發現違反適用於我們的任何此類法律或任何其他政府法規,我們可能會受到
重大處罰,包括但不限於行政、民事和刑事處罰、損害賠償、罰款、上繳利潤、合同損害賠償、聲譽損害、利潤和未來收入減少、我們
如果我們受到公司誠信協議或類似協議的約束,則不得參與聯邦和州醫療保健計劃(如Medicare和Medicaid)、監禁以及額外的監督和報告義務
和解,以解決不遵守這些法律的指控以及我們業務的縮減或重組,其中任何一項都可能對我們經營業務的能力和財務業績產生不利影響。如果任何醫生或
如果我們預期與之開展業務的其他醫療保健提供者或實體(包括我們的卓越中心和治療師)被發現不遵守適用法律,他們可能會受到類似的行動、處罰和制裁。
確保我們目前和未來與第三方的業務安排以及我們的業務總體上符合適用的醫療保健法律法規,並應對可能的
政府當局的調查可能耗費時間和資源,並可能轉移公司對其業務的注意力。
美國境外的其他醫療保健法律和合規要求
除美國外,個別國家實施了各種反腐敗法律,其中最值得注意的是英國2010年《反賄賂法》,因為它具有明顯的域外效力。
內 在歐盟,我們的業務將受到大多數成員國反腐敗法律的約束。在許多歐洲和其他國家/地區,FCPA的應用和國家法律都存在更高的風險,因為他們的許多醫療保健
專業人士被歸類為政府官員。這些法律將對我們的業務施加各種限制,這些限制既耗時又昂貴,包括限制與醫療保健專業人員的合作,要求獲得
促銷活動事先得到僱主和/或政府或行業機構的授權,並要求提供有關互動的透明度信息。如果不遵守這些法律,可能會造成非常高昂的成本,
可能導致聲譽受損、罰款、處罰和監禁,以及對我們的業務活動進行調查和額外監督。
關於個人信息的使用、處理和跨境轉移的規定
如果我們決定在歐洲、美國或其他司法管轄區進行未來的臨牀試驗,我們可能會受到額外的隱私和數據保護要求以及
限制。收集、使用、存儲、披露、傳輸或以其他方式處理歐洲經濟區中個人的個人數據,包括個人健康數據,受歐盟和國家層面的數據保護和隱私法的約束,其中最引人注目的是於2018年5月25日生效的GDPR。GDPR的範圍很廣,並對處理個人數據的實體提出了許多要求,包括與處理健康和其他敏感數據有關的要求、在某些情況下徵得與個人數據有關的個人的同意、向個人提供有關數據處理活動的信息、實施保障措施以保護個人數據的安全和機密性、就數據違規行為提供通知,以及在聘用將可訪問個人數據的第三方處理器時採取某些措施。GDPR還對將個人數據轉移到歐洲經濟區以外的國家(包括美國)實施了嚴格的規則。不遵守GDPR要求的實體可能會受到非常嚴重的處罰,包括最高可達2,000萬歐元或全球年收入4%的罰款,以及如果不遵守英國GDPR,最高可達1,750萬英鎊或全球年收入4%的罰款。GDPR增加了我們在處理受GDPR約束的個人數據方面的責任和責任,我們可能需要建立額外的機制來確保遵守GDPR,包括個別國家實施的機制。英國擁有相當於GDPR的立法,雖然歐盟委員會於2021年6月28日發佈了一項充分性
決定,允許從歐盟成員國向英國的數據傳輸繼續進行,而無需要求組織實施合同或其他措施來合法地在領土之間傳輸個人數據,但
仍不清楚從長遠來看,如何對進出英國的數據傳輸進行監管。遵守GDPR和英國GDPR是一個嚴格、昂貴和時間密集的過程,這將增加我們的業務成本或要求我們改變業務做法,儘管我們做出了這些努力,但我們可能面臨與我們的歐洲個人數據處理活動相關的罰款和處罰、訴訟和聲譽損害的風險。
124
目錄表
In the United States, numerous federal and state laws and regulations, including state data breach notification laws, state health and personal information privacy laws, and federal and state
consumer protection laws, govern the collection, use, processing, storage, transmission, disclosure, destruction and protection of health-related and other personal information. For example, the California Consumer Privacy Act of 2018, or CCPA,
became effective on January 1, 2020 and creates new individual privacy rights for California consumers and places increased privacy and security obligations on entities handling certain personal data of California consumers. The CCPA requires
companies subject to the legislation to provide new disclosure to consumers about such companies’ data collection, use and sharing practices and provide such consumers new ways to opt-out of certain sales or transfers of personal information. The
CCPA provides for civil penalties as well as a private right of action for certain data breaches that result in the loss of personal information. This private right of action may increase the likelihood of, and risks associated with, data breach
litigation. In addition, the California Privacy Rights Act of 2020, or CPRA, went into effect on January 1, 2023. The CPRA, among other things, gives California residents the ability to limit the use of their personal information, further restricts
the use of cross-contextual advertising, establishes restrictions on the retention of personal information, expands the types of data breaches subject to the CCPA’s private right of action and establishes a new California Privacy Protection Agency to
implement and enforce the CCPA and CPRA. Other states, such as Nevada, New Hampshire, Washington, Illinois and Nebraska, and the U.S. federal government are considering comprehensive privacy laws, and on January 1, 2023, the Virginia Consumer Data
Protection Act, or CDPA, became effective. The CDPA contains provisions that require businesses subject to the legislation to conduct data protection assessments in certain circumstances and that require opt-in consent from Virginia consumers to
process certain sensitive personal information. In addition, Colorado enacted the Colorado Privacy Act, or the CoPA, and Connecticut enacted the Connecticut Data Privacy Act, each of which took effect on July 1, 2023, and Utah enacted the Consumer
Privacy Act, which became effective on December 31, 2023. Several other states have also enacted privacy laws that are set to take effect in 2024 or 2025. Moreover, laws in all 50 U.S. states require businesses to provide notice to consumers whose
personal information has been disclosed as a result of a data breach. The CDPA, CoPA, the Connecticut and Utah laws, and such other proposed legislation, if enacted, may add additional complexity, variation in requirements, restrictions and potential
legal risk, require additional investment of resources in compliance programs, impact strategies and the availability of previously useful data and could result in increased compliance costs and/or changes in business practices and policies.
美國和國外的數據隱私和安全問題監管框架正在迅速發展,在可預見的未來可能仍然不確定。符合適用的
美國和外國的隱私和數據保護法律法規是一個嚴格且耗時的過程,可能要求我們在合同中承擔更繁重的義務,限制我們收集、使用和披露某些數據的能力,或者
在某些情況下,影響我們在某些司法管轄區的運營能力。
醫療改革
美國政府、州立法機構和外國政府對實施成本控制計劃以限制政府支付的醫療成本的增長表現出極大的興趣。
藥品成本。這導致了幾項總統行政命令、國會調查,並提出並頒佈了聯邦和州立法,旨在提高產品定價的透明度,審查定價與製造商患者計劃之間的關係,控制藥品成本,包括在Medicare和Medicaid下,限制報銷,要求用仿製藥替代品牌處方藥,並改革
政府計劃藥品報銷方法。2020年12月,CMS發佈了一項最終規則,實施了醫療補助藥品返點計劃下的重大製造商價格報告變化,包括與原始藥物價格上漲掛鈎的產品線擴展的替代返點
計算,以及與某些基於價值的採購安排相關的最佳價格報告。此外,根據2021年1月1日生效的《2021年美國救援計劃法案》,取消了製造商向州醫療補助計劃支付的醫療補助藥品退税計劃退税的法定上限。在某些情況下,取消這一上限可能會要求製藥商支付的回扣比他們在銷售產品時獲得的回扣更多。此外,基礎設施投資和就業法案增加了一項從2023年1月1日起生效的要求,要求某些單一來源藥物(包括生物製品和生物仿製藥)的製造商在聯邦醫療保險(Medicare)B部分下單獨支付至少18個月並以單劑容器或包裝(稱為可退還單劑容器或一次性包裝藥物)銷售的製造商,如果未使用或丟棄的部分超過法規或法規定義的適用百分比,則必須為分配的藥物中未使用和丟棄的任何部分提供年度退款。製造商將接受定期審計,未對其可退還的單劑容器或一次性包裝藥品支付退款的將受到民事罰款。在美國聯邦和州一級也有並將繼續有許多其他舉措尋求降低醫療成本,包括《預算控制法案》,該法案
在某些臨時暫停期的限制下,從2013年4月1日開始的每一財年向提供者支付的醫療保險金額將減少2%,並且由於對該法規的後續立法修訂,該法案將一直有效到2031年,除非
採取額外的國會行動。已經實施並可能在未來實施的醫療改革可能會導致藥品報銷範圍和報銷水平進一步降低,根據美國政府返點計劃支付的返點
增加,以及藥品價格進一步下降的壓力。
125
目錄表
Several healthcare reform proposals recently culminated in the enactment of Inflation Reduction Act, or IRA, which allows HHS to, among other things, directly negotiate the selling price of a
statutorily specified number of drugs and biologics each year that CMS reimburses under Medicare Part B and Part D. Only high-expenditure single-source drugs that have been approved for at least 7 years (11 years for single-source biologics) are
eligible for selection by CMS for negotiation, with the negotiated price taking effect two years after the selection year. Negotiations for Medicare Part D products begin in 2024 with the negotiated price taking effect in 2026, and negotiations for
Medicare Part B products will begin in 2026 with the negotiated price taking effect in 2028. In August 2023, HHS announced the ten Medicare Part D drugs and biologics that it selected for negotiations. HHS will announce the negotiated maximum fair
prices by September 1, 2024, and this price cap, which cannot exceed a statutory ceiling price, will come into effect on January 1, 2026. A drug or biological product that has an orphan drug designation for only one rare disease or condition will be
excluded from the IRA’s price negotiation requirements, but will lose that exclusion if it receives designations for more than one rare disease or condition, or if is approved for an indication that is not within that single designated rare disease
or condition, unless such additional designation or such disqualifying approvals are withdrawn by the time CMS evaluates the drug for selection for negotiation. The IRA also imposes rebates on Medicare Part D and Part B drugs whose prices have
increased at a rate greater than the rate of inflation. The IRA will also eliminate, beginning in 2025, the coverage gap under Medicare Part D by significantly lowering the enrollee maximum out-of-pocket cost and requiring manufacturers to subsidize,
through a newly established manufacturer discount program, 10% of Part D enrollees’ prescription costs for brand drugs below the out-of-pocket maximum, and 20% once the out-of-pocket maximum has been reached. Manufacturers that fail to comply with
the IRA may be subject to various penalties, including significant civil monetary penalties. The IRA also extends enhanced subsidies for individuals purchasing health insurance coverage in ACA marketplaces through plan year 2025. These provisions may
be subject to legal challenges. For example, the provisions related to the negotiation of selling prices of high-expenditure single-source drugs and biologics have been challenged in multiple lawsuits brought by pharmaceutical manufacturers. Thus,
while it is unclear how the IRA will be implemented, it will likely have a significant impact on the biopharmaceutical industry and the pricing of our products and product candidates. It is unclear to what extent other statutory, regulatory, and
administrative initiatives will be enacted and implemented in the future.
在美國的州一級,立法機構越來越多地制定法律和實施法規,以控制藥品和生物製品的定價,包括價格
限制、對某些產品准入的限制、對價格上漲的報告和採用高成本藥物。在一些州,已頒佈法律,鼓勵從其他國家進口成本較低的藥物和批量購買。
例如,FDA於2020年9月發佈了一項最終規則,為各州制定和提交加拿大藥品進口計劃提供指導,FDA於2024年1月在佛羅裏達州批准了第一個此類計劃。此外,區域
衞生保健當局和各個醫院越來越多地使用招標程序來確定哪些藥品和哪些供應商將被包括在他們的處方藥和其他衞生保健計劃中。這可以減少
我們成功商業化的候選產品的最終需求或對我們的產品定價施加壓力。對第三方付款人付款金額的法律強制性價格控制或對承保範圍或訪問權限的其他限制可能會
對我們的業務、營運及財務狀況造成重大不利影響。
126
目錄表
員工
截至2023年12月31日,我們有49名員工。在我們的員工隊伍中,34名員工從事研發活動,其餘員工提供行政、業務和
業務支持。
我們的員工沒有工會代表,也沒有集體談判協議。我們沒有遇到任何員工訴訟或索賠,並認為我們的員工關係
要乖。
|
C.
|
組織結構
|
截至2023年12月31日,我們只有一家子公司。下表列出了我們的主要子公司、註冊國家以及我們持有的所有權百分比和有投票權的權益。
|
公司
|
國家/地區
參入
|
百分比
所有權和
有表決權的權益
|
主要活動
|
|||
|
GH Research愛爾蘭有限公司
|
愛爾蘭
|
100%
|
臨牀運營和研發
|
|
D.
|
財產、廠房和設備
|
設施
我們租賃了一個106平方米的辦公空間設施,位於愛爾蘭都柏林2號巴格特街下部28號,以及一個391平方米的辦公空間設施,位於愛爾蘭都柏林2號道森街的Joshua Dawson House。我們相信,我們的設施足以滿足我們目前的需求,包括我們的短期需求,如果需要,都柏林將提供適當的額外或替代空間。
我們沒有意識到任何環境問題或其他限制會對我們設施的預期用途產生重大影響。
|
項目4A。
|
未解決的員工意見
|
沒有。
|
第五項。
|
經營和財務回顧與展望
|
您應該閲讀以下對我們的財務狀況和經營結果的討論和分析,以及我們審計後的綜合財務報表,包括本年度報告中包含的附註
。
我們經審計的綜合財務報表是根據國際財務報告準則編制的。我們的財務報表都不是按照美國公認會計準則編制的。本討論和分析中包含的一些信息,包括有關我們業務的計劃和戰略的信息,以及我們對流動性和資本資源的預期,包括前瞻性陳述。這些前瞻性陳述
會受到許多風險和不確定性的影響,包括但不限於“關於前瞻性陳述的警示聲明”、“關鍵信息-D.風險因素”以及本年度報告中其他部分所描述的風險和不確定性。
2021年3月29日,GH Research PLC根據愛爾蘭法律註冊成立,根據公司重組,成為GH Research愛爾蘭有限公司的最終控股公司。在我們首次公開募股之前,GH Research PLC只從事與其成立、公司重組和我們的首次公開募股相關的活動。在GH Research PLC成立之前提供的財務信息僅與GH Research愛爾蘭有限公司有關。
127
目錄表
|
A.
|
經營業績
|
概述
我們是一家臨牀階段的生物製藥公司,致力於改變精神和神經疾病的治療方法。我們最初的重點是開發我們的新型專利美布福汀(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)療法,用於治療難治性抑鬱症(TRD)患者。Mebufotenin被世界衞生組織(WHO)國際藥典和藥物製劑專家諮詢小組選為5-MeO-DMT的國際非專利名稱(INN)。
我們的產品組合目前包括我們專有的吸入型美布福汀候選產品GH001,我們專有的靜脈注射美布福汀候選產品GH002,以及我們專有的鼻腔用美布福汀候選產品GH003。雖然GH001目前是通過第三方生產的蒸發設備交付的,但我們正在開發一種專有的氣霧劑交付設備。我們已經完成了GH001的兩個第一階段健康志願者臨牀試驗(GH001-HV-101和GH001-HV-103),在這些試驗中,觀察到通過吸入給藥在所研究的單劑量水平和個體化給藥方案(IDR)下耐受性良好,受試者內劑量在一天內增加
。我們還完成了針對TRD患者的1/2期臨牀試驗(GH001-TRD-102)。根據在臨牀試驗第一階段觀察到的臨牀活動,我們認為,根據蒙哥馬利-奧斯伯格抑鬱評定量表(MADRS)的測量,在某些患者中,由超快的精神活動效應(通常在幾秒鐘內)和強烈而短暫的精神活動體驗(通常為5至30分鐘)驅動,單劑量服用GH001具有
誘導某些患者超快速緩解的潛力。根據在試驗第二階段觀察到的臨牀活動,我們認為,與單劑GH001相比,在IDR中使用GH001並在一天內增加受試者內劑量可以
進一步提高MADRS緩解率。
我們自成立以來已出現虧損,其中截至2023年12月31日、2022年12月31日和2021年12月31日的淨虧損分別為3560萬美元、2250萬美元和920萬美元。截至2023年12月31日,我們的累計赤字為6790萬美元,而截至2022年12月31日的累計赤字為3250萬美元。隨着我們擴大研究和開發活動,我們預計在可預見的未來將產生鉅額費用和運營虧損。此外,我們的運營虧損可能會在季度間和年度間大幅波動,這取決於我們臨牀試驗的時間、我們在其他研發活動上的支出以及基於外幣換算差異的
。我們預計,我們與持續活動相關的費用將大幅增加,因為我們:
|
•
|
繼續為我們的GH 001、GH 002和GH 003候選產品開發和開展臨牀試驗,包括在美國等擴大的地理區域,用於我們的初始適應症和任何其他適應症
適應症;
|
|
•
|
繼續進行技術開發,擴大我們目前候選產品GH 001、GH 002和GH 003的外部製造能力,以及提供這些產品所需的醫療器械。
候選產品,例如我們專有的GH 001氣霧劑輸送裝置;
|
|
•
|
啟動並繼續研究和開發,包括任何未來候選產品的技術、非臨牀、臨牀和發現工作;
|
|
•
|
尋求確定其他候選產品;
|
|
•
|
為我們的候選產品GH 001、GH 002和GH 003尋求監管部門的批准,包括提供這些候選產品所需的醫療器械,例如我們的專有氣霧劑輸送設備,用於
GH 001或成功完成臨牀開發的任何其他候選產品;
|
128
目錄表
|
•
|
推進任何非臨牀項目和可能需要的任何其他工作,以解除我們在針對GH001的IND中提出的研究的臨牀擱置;
|
|
•
|
增加運營、財務和管理信息系統和人員,包括支持我們的候選產品和器械開發並幫助我們履行公眾義務的人員
公司;
|
|
•
|
聘用和保留更多的人員,如臨牀、質量控制、科學、商業、銷售、市場營銷和行政人員;
|
|
•
|
繼續準備、提交、起訴、維護、保護和執行我們的知識產權和索賠;
|
|
•
|
未來建立銷售、營銷、分銷、製造、供應鏈等商業基礎設施,將我們可能獲得監管批准的各種產品商業化;
|
|
•
|
遵守已批准用於商業銷售的產品的現行法規要求;
|
|
•
|
收購或授權其他候選產品、醫療器械以交付我們的候選產品,以及其他技術;以及
|
|
•
|
由於作為一家上市公司運營而導致成本增加。
|
此外,隨着我們對任何候選產品進行市場審批,我們還預計會產生與產品製造、營銷、銷售和分銷相關的鉅額商業化費用。
因此,我們將需要大量額外資金來支持我們的持續運營和實施我們的增長戰略。在我們能夠從產品銷售中獲得可觀的收入之前,我們預計將通過出售股權、債務融資或其他資本來源(包括與其他公司的潛在合作或其他戰略交易)為我們的運營提供資金。我們無法確定是否會以可接受的條款提供額外的
資金,或者根本不能。如果我們未能在需要時籌集資金或達成此類協議,我們可能不得不大幅推遲、縮減或停止我們的一個或多個候選產品或其他研發計劃的開發和商業化,這可能會對我們的業務、運營結果和財務狀況產生重大不利影響。我們需要創造可觀的收入才能實現盈利,而且我們可能永遠不會這樣做。
我們面臨着許多與其他類似公司類似的風險,包括對關鍵個人的依賴;需要開發具有所需的安全性和
功效概況並支持監管批准並具有商業可行性的候選產品;來自其他公司的競爭,其中許多公司規模更大、資本更好;以及需要獲得足夠的額外融資來為我們的
候選產品的開發提供資金。
截至2023年12月31日,我們擁有2.227億美元的現金、現金等價物、其他金融資產和有價證券,而截至2022年12月31日的現金、現金等價物和有價證券為2.517億美元。我們相信,我們現有的現金、現金等價物、其他金融資產和有價證券將足以支付至少未來12個月的運營費用和資本支出需求。我們基於可能被證明是錯誤的假設做出了這一估計,我們可能會比預期更早耗盡可用的資本資源。見下文“-B.流動資金和資本資源”。
財務運營概述
收入
自成立以來,我們沒有產生任何收入,也不希望在幾年內從產品銷售中產生任何收入,如果有的話。如果我們針對當前或
未來候選產品的開發工作取得成功,並獲得監管部門的批准或與第三方的協作或許可協議,我們未來可能會通過與第三方簽訂的產品銷售或合作或許可協議的付款或合作
協議來獲得收入。由於與產品開發、監管批准和市場接受度相關的許多風險和不確定性,我們無法預測產品收入的數額或時間。
129
目錄表
運營費用
研究和開發費用
研究和開發費用主要是指我們在以下方面發生的成本:
|
•
|
開發成本,包括與進行我們的非臨牀研究和臨牀試驗以及其他科學開發服務的第三方(如顧問、研究地點和CRO)達成協議而發生的費用;
|
|
•
|
開發我們製造技術和基礎設施的成本,包括第三方CMO獲取、開發和製造用於非臨牀研究和臨牀試驗的藥物物質、藥物產品和輸送裝置材料的成本
;
|
|
•
|
為維持遵守監管規定而產生的成本;以及
|
|
•
|
其他費用,包括外部諮詢費、保險費和其他業務費用。
|
我們按所發生的費用來支付研究和開發費用。我們根據供應商和臨牀研究站點向我們提供的信息對完成特定任務的進度進行評估來確認外部開發成本。這些活動的付款基於個別協議的條款,這些條款可能與發生的成本模式不同,並在我們的財務報表中作為其他流動資產或其他流動負債反映。
研發活動是我們商業模式的核心。處於臨牀開發後期的候選產品通常比處於臨牀開發早期階段的候選產品具有更高的開發成本
,這主要是由於後期臨牀試驗的規模和持續時間增加以及相關的產品製造費用。因此,我們預計我們的研究和開發費用在未來幾年將繼續增加,因為我們:(I)推進用於TRD的GH001的臨牀開發;(Ii)推進用於BDII和目前的抑鬱發作和PPD的GH001的臨牀開發;(Iii)將GH002、GH003和任何潛在的未來候選產品
推進臨牀開發;以及(Iv)建立我們的第三方或內部流程開發、分析、製造和相關能力,增加人員成本,併為與我們的潛在或未來候選產品相關的監管備案做準備。
我們還預計,隨着我們提交更多的專利申請和起訴我們的知識產權,以保護我們的研發活動產生的創新,我們還將產生與知識產權相關的額外費用。
GH001、GH002、GH003以及任何潛在的未來候選產品的成功開發和商業化都是高度不確定的。這是由於與開發和商業化相關的許多風險和不確定性,包括:
|
•
|
成功登記並完成臨牀試驗;
|
|
•
|
順利完成非臨牀研究;
|
|
•
|
我們有足夠的財政和其他資源來完成必要的技術開發工作、非臨牀研究和臨牀試驗;
|
|
•
|
獲得監管機構的批准或許可,以進行我們計劃的臨牀試驗或未來的臨牀試驗,包括關於我們在IND中為GH001建議的研究的臨牀擱置;
|
|
•
|
從我們的臨牀試驗中獲得積極的數據,這些數據支持GH001、GH002、GH003以及目標人羣中任何未來候選產品的可接受風險-收益概況;
|
|
•
|
接收和維護來自相關監管機構的監管和營銷批准;
|
130
目錄表
|
•
|
如果任何候選產品獲得批准,通過第三方製造商建立和擴大為我們的臨牀試驗和商業製造提供臨牀供應的製造能力;
|
|
•
|
參與合作,以進一步開發GH001、GH002、GH003和任何未來的候選產品,包括任何必要的醫療器械;
|
|
•
|
獲得並維護對GH001、GH002、GH003和任何未來候選產品的專利和商業祕密保護或法規排他性;
|
|
•
|
成功啟動GH001、GH002、GH003和任何未來候選產品的商業銷售(如果獲得批准);
|
|
•
|
如果患者、醫學界和第三方付款人批准,接受我們當前和未來的候選產品的好處和用途;以及
|
|
•
|
保持GH001、GH002、GH003和我們未來的候選產品在批准後的持續可接受的安全狀況。
|
在我們的非臨牀和臨牀開發候選產品的開發方面,這些變量中的任何一個的結果的變化都可能意味着與它們的開發相關的成本和時間的重大變化。例如,如果FDA或其他類似的外國監管機構要求我們在我們目前預期的基礎上進行臨牀試驗,或者在為我們的候選產品或交付我們的候選產品所需的醫療器械建立適當的製造安排方面存在任何延誤,或者如果在完成我們的臨牀試驗或開發我們的任何
候選產品或交付候選產品所需的醫療器械方面存在任何延誤。
根據我們研發活動的時間安排,我們的研發費用在不同時期可能會有很大差異,包括啟動臨牀試驗的時間和患者參加臨牀試驗的時間。隨着我們推進我們的吸入型美布福汀(5-甲氧基-N,N-二甲基色胺或5-MeO-DMT)候選產品GH001的臨牀開發,並進一步推進我們的靜脈注射候選產品GH002、鼻腔候選產品GH003以及任何未來的候選產品的研發,研發費用預計將增加。我們產品的成功開發
候選產品具有很高的不確定性。
一般和行政費用
一般和行政費用主要包括:
|
•
|
專業費用,包括諮詢、會計、法律、税務和審計服務;
|
|
•
|
人事開支,包括薪金及有關開支;及
|
|
•
|
其他費用,包括設施租金和維修費、保險費和其他經營費用。
|
我們預計,隨着我們繼續增加員工人數以支持研發活動的預期增長和候選產品的潛在商業化,未來我們的一般和管理費用將會增加。此外,我們已經並預計將繼續產生與上市公司相關的費用增加,包括會計、審計、法律、與維護交易所上市和美國證券交易委員會要求相關的監管和税務相關服務的成本增加,董事和高管保險成本,投資者和公關成本,以及與其他行政和專業服務相關的成本。
131
目錄表
財務淨收入
淨財務收入包括:
|
•
|
現金及現金等價物、其他金融資產和有價證券的利息收入;
|
|
•
|
利息支出;
|
|
•
|
通過損益按公允價值分類的現金等價物的淨收益或淨虧損;以及
|
|
•
|
與有價證券投資有關的預期信貸損失。
|
匯兑損益
匯兑損益包括外幣交易產生的匯兑影響。
税收
我們在愛爾蘭需要繳納公司税。由於我們的業務性質,我們自成立以來就產生了虧損,因此沒有繳納愛爾蘭公司税。
未使用的税收損失可以無限期地結轉到未來的交易收入中。由於不能確定我們將產生足夠的應税利潤以能夠全額利用這些税收虧損
,我們已得出結論,不確認2023年12月31日或2022年12月31日的任何遞延税項資產。
經營成果
截至二零二三年及二零二二年十二月三十一日止年度之比較
下表彙總了截至2023年12月31日和2022年12月31日的年度經營結果:
|
截至十二月三十一日止的年度:
|
||||||||||||
|
2023
|
2022
|
變化
|
||||||||||
|
(單位:千美元)
|
||||||||||||
|
運營費用:
|
||||||||||||
|
研發
|
(29,821
|
)
|
(20,484
|
)
|
(9,337
|
)
|
||||||
|
一般和行政
|
(11,401
|
)
|
(10,070
|
)
|
(1,331
|
)
|
||||||
|
運營虧損
|
(41,222
|
)
|
(30,554
|
)
|
(10,668
|
)
|
||||||
|
財務淨收入(1)
|
8,256
|
922
|
7,334
|
|||||||||
|
外匯(虧損)/收益
|
(2,621
|
)
|
7,176
|
(9,797
|
)
|
|||||||
|
本年度虧損
|
(35,587
|
)
|
(22,456
|
)
|
(13,131
|
)
|
||||||
(1) 截至2023年12月31日和2022年12月31日止年度的淨財務收入包括財務收入、財務費用和預期信貸損失
。
132
目錄表
研究和開發費用
下表彙總了截至2023年12月31日和2022年12月31日的年度研發費用:
|
截至十二月三十一日止的年度:
|
||||||||||||
|
2023
|
2022
|
變化
|
||||||||||
|
(單位:千美元)
|
||||||||||||
|
外部研發費用
|
(22,777
|
)
|
(16,019
|
)
|
(6,758
|
)
|
||||||
|
員工開支(1)
|
(6,771
|
)
|
(4,119
|
)
|
(2,652
|
)
|
||||||
|
折舊
|
(35
|
)
|
(33
|
)
|
(2
|
)
|
||||||
|
其他費用
|
(238
|
)
|
(313
|
)
|
75
|
|||||||
|
研發
|
(29,821
|
)
|
(20,484
|
)
|
(9,337
|
)
|
||||||
(1) 包括截至2023年12月31日的年度的基於股份的薪酬支出140萬美元和截至2022年12月31日的年度的100萬美元。
下表彙總了我們的候選產品在截至2023年12月31日和2022年12月31日的年度內的研發費用:
|
截至十二月三十一日止的年度:
|
||||||||||||
|
2023
|
2022
|
變化
|
||||||||||
|
(單位:千美元)
|
||||||||||||
|
GH001
|
(17,602
|
)
|
(12,013
|
)
|
(5,589
|
)
|
||||||
|
GH002
|
(2,413
|
)
|
(1,538
|
)
|
(875
|
)
|
||||||
|
GH003
|
(179
|
)
|
(43
|
)
|
(136
|
)
|
||||||
|
與多個候選產品(GH001、GH002和GH003)相關,以及未來潛在產品候選的探索性工作(1)
|
(9,627
|
)
|
(6,890
|
)
|
(2,737
|
)
|
||||||
|
研發
|
(29,821
|
)
|
(20,484
|
)
|
(9,337
|
)
|
||||||
(1) 包括與GH001、GH002和/或GH003的任意組合以及未來潛在候選人的勘探工作相關的費用。
在截至2023年12月31日的一年中,研發費用增加了930萬美元,從截至2022年12月31日的2050萬美元增加到2980萬美元。這一增長主要是由於臨牀試驗費用的增加以及與我們的技術開發相關的費用的增加,包括設備開發、活性藥物成分和藥品開發和製造。這些增長已被與非臨牀和合規活動相關的費用減少所部分抵消。員工支出增加了270萬美元,主要是因為招聘人員來支持我們的研發活動。
我們候選產品的研發費用將每年波動,主要原因是與每個候選產品的不同生命週期階段相關的性質和時間安排。
在截至2023年12月31日的一年中,與GH001相關的研究和開發費用增加了560萬美元,這主要是由於包括設備開發、活性藥物成分和藥物產品開發和製造在內的技術開發增加,以及臨牀試驗費用的增加。與非臨牀和法規遵從性活動相關的費用減少已部分抵消了這些增加。
在截至2023年12月31日的一年中,與GH002有關的研究和開發費用增加了90萬美元,這主要是由於臨牀試驗費用的增加。這一增長被與技術開發相關的成本下降所部分抵消,包括活性藥物成分和藥物產品的開發和製造。
133
目錄表
在截至2023年12月31日的一年中,與多種候選產品相關的研發費用增加了270萬美元,這主要是由於招聘人員支持我們的研發活動,以及包括活性藥物成分和藥品開發和製造在內的技術開發活動的增加。這些增加被與支持每個候選產品的非臨牀活動相關的費用的減少
部分抵消。
一般和行政費用
下表彙總了截至2023年12月31日和2022年12月31日的年度的一般和行政費用:
|
截至十二月三十一日止的年度:
|
||||||||||||
|
2023
|
2022
|
變化
|
||||||||||
|
(單位:千美元)
|
||||||||||||
|
外部成本
|
(7,692
|
)
|
(7,785
|
)
|
93
|
|||||||
|
員工開支(1)
|
(3,429
|
)
|
(2,271
|
)
|
(1,158
|
)
|
||||||
|
折舊
|
(280
|
)
|
(14
|
)
|
(266
|
)
|
||||||
|
一般和行政
|
(11,401
|
)
|
(10,070
|
)
|
(1,331
|
)
|
||||||
(1)包括截至2023年12月31日的年度的基於股份的薪酬支出90萬美元和截至2022年12月31日的年度的70萬美元。
在截至2023年12月31日的一年中,一般和行政費用增加了130萬美元,從截至2022年12月31日的1010萬美元增加到1140萬美元。外部成本下降
主要是由於保險成本的下降,部分被較高的專業費用、通信和IT成本以及設施費用所抵消。員工支出增加,原因是我們的一般和行政職能增加了員工人數,以支持我們的增長計劃。
財務淨收入
在截至2023年12月31日的一年中,我們的淨財務收入增加了730萬美元,從截至2022年12月31日的90萬美元增加到830萬美元。增加的主要原因是與我們的有價證券相關的利息收入410萬美元,與現金、現金等價物和其他金融資產相關的財務收入190萬美元,以及與我們的現金等價物和其他金融資產相關的公允價值收益300萬美元。這些增長已被與我們投資有關的財務費用部分抵消。
外匯(虧損)/收益
截至2023年12月31日的一年,外匯損失為260萬美元,比截至2022年12月31日的一年的收益720萬美元減少了980萬美元。這一變動主要是由於我們子公司賬户中的美元現金和其他金融資產餘額轉換為其功能貨幣(即歐元)的結果。在截至2023年12月31日的一年中,美元相對於歐元走弱,導致外匯損失。
2022年和2021年12月31日終了年度比較
關於我們截至2022年12月31日和2021年12月31日的年度運營報表的討論,請參閲我們截至2022年12月31日的年度報告Form 20-F中的“項目5.運營和財務回顧及展望-A.運營業績-運營業績-截至2022年12月31日和2021年12月31日的年度比較”一節。
134
目錄表
|
B.
|
流動性與資本資源
|
流動資金來源
我們自成立以來就出現了運營虧損,我們沒有從任何產品銷售或任何其他來源獲得任何收入。我們還沒有將我們的任何候選產品商業化,
這些產品處於技術和臨牀開發的不同階段,我們預計在幾年內不會從任何產品的銷售中獲得收入,如果有的話。在我們能夠從產品銷售中獲得可觀的收入之前,
我們預計將通過出售股權、債務融資或其他資本來源,包括與其他公司的潛在合作或其他戰略交易,為我們的運營提供資金。到目前為止,我們主要通過股權融資為我們的運營提供資金,包括我們的首次公開募股。
|
•
|
2021年4月,我們從發行B系列優先股中獲得1.188億美元的現金淨收益。
|
|
•
|
2021年6月,我們完成了首次公開募股,通過發行普通股獲得了1.676億美元的淨收益。
|
|
•
|
截至2023年12月31日,我們擁有2.227億美元的現金、現金等價物、其他金融資產和有價證券,而截至2022年12月31日的現金、現金等價物和有價證券為2.517億美元。
|
我們計劃繼續通過出售額外股權或其他形式的融資來滿足我們的運營和資本融資需求。我們還可以考慮尋求臨牀
我們的候選產品的開發和商業化。出售額外股權將對我們的股東造成額外攤薄。
有關我們截至2021年12月31日止年度流動資金來源的討論,請參閲“第5項”一節。經營及財務回顧及展望-B。流動性和資本來源-
流動性”載於我們截至2022年12月31日止年度的20-F表格年報。
現金流
截至二零二三年及二零二二年十二月三十一日止年度之比較
下表彙總了截至2023年12月31日和2022年12月31日的年度現金流:
|
截至十二月三十一日止的年度:
|
||||||||||||
|
2023
|
2022
|
變化
|
||||||||||
|
(單位:千美元)
|
||||||||||||
|
所用現金淨額:
|
||||||||||||
|
用於經營活動的現金流量淨額
|
(33,336
|
)
|
(26,199
|
)
|
(7,137
|
)
|
||||||
|
用於投資活動的現金流量淨額
|
(54,100
|
)
|
(84,688
|
)
|
30,588
|
|||||||
|
用於籌資活動的現金流量淨額
|
(204
|
)
|
—
|
(204
|
)
|
|||||||
|
現金和現金等價物淨減少
|
(87,640
|
)
|
(110,887
|
)
|
23,247
|
|||||||
經營活動中使用的現金流量淨額
經營活動所用現金流量淨額由截至2022年12月31日止年度的2620萬美元增加至截至2023年12月31日止年度的3330萬美元,原因是
這一年的增長被流動資金的增加所抵消。
用於投資活動的現金流量淨額
投資活動所用現金流量淨額由截至2022年12月31日止年度的84. 7百萬元減少至截至2023年12月31日止年度的54. 1百萬元。下降是由於
於截至2022年12月31日止年度,本集團於有價證券的投資為8,460萬元,於本年度並無重複。這一減少額被與貨幣市場投資有關的5400萬美元增加額部分抵消
於截至2023年12月31日止年度,本基金。
135
目錄表
用於融資活動的淨現金流量
融資活動的現金流量淨額由截至2022年12月31日止年度的零元增加至截至2023年12月31日止年度的20萬元。增加主要是由於支付
於二零二三年一月訂立的新辦公室租賃的租賃負債。
2022年和2021年12月31日終了年度比較
關於截至2022年12月31日和2021年12月31日的年度現金流量的討論,請參閲截至2022年12月31日的年度報告Form 20-F中的“第5項.經營和財務回顧及展望-B.流動性和資本資源-現金流量-截至2022年12月31日和2021年12月31日的年度比較”一節。
資金需求
我們預計,與我們正在進行的研發活動相關的費用將繼續大幅增加,特別是隨着我們推進候選產品的技術開發工作、非臨牀
研究和臨牀試驗以及交付此類候選產品所需的醫療器械。此外,如果我們的任何候選產品獲得監管部門的批准,我們預計將產生與銷售、營銷、製造和分銷相關的鉅額
商業化費用。此外,作為一家上市公司,我們已經並預計將繼續產生與運營相關的額外成本。我們預計在以下情況下,我們的費用將大幅增加:
|
•
|
繼續為我們的GH 001、GH 002和GH 003候選產品開發和開展臨牀試驗,包括在美國等擴大的地理區域,用於我們的初始適應症和任何其他適應症
適應症;
|
|
•
|
繼續進行技術開發,擴大我們目前候選產品GH 001、GH 002和GH 003的外部製造能力,以及提供這些產品所需的醫療器械。
候選產品,例如我們專有的GH 001氣霧劑輸送裝置;
|
|
•
|
啟動並繼續研究和開發,包括任何未來候選產品的技術、非臨牀、臨牀和發現工作;
|
|
•
|
尋求確定其他候選產品;
|
|
•
|
為我們的候選產品GH 001、GH 002和GH 003尋求監管部門的批准,包括提供這些候選產品所需的醫療器械,例如我們的專有氣霧劑輸送設備,用於
GH 001或成功完成臨牀開發的任何其他候選產品;
|
|
•
|
推進任何非臨牀項目和可能需要的任何其他工作,以解除我們在針對GH001的IND中提出的研究的臨牀擱置;
|
|
•
|
增加運營、財務和管理信息系統和人員,包括支持我們的候選產品和器械開發並幫助我們履行公眾義務的人員
公司;
|
|
•
|
聘用和保留更多的人員,如臨牀、質量控制、科學、商業、銷售、市場營銷和行政人員;
|
|
•
|
繼續準備、提交、起訴、維護、保護和執行我們的知識產權和索賠;
|
|
•
|
未來建立銷售、營銷、分銷、製造、供應鏈等商業基礎設施,將我們可能獲得監管批准的各種產品商業化;
|
|
•
|
遵守已批准用於商業銷售的產品的現行法規要求;
|
136
目錄表
|
•
|
收購或授權其他候選產品、醫療器械以交付我們的候選產品,以及其他技術;以及
|
|
•
|
由於作為一家上市公司運營而導致成本增加。
|
截至2023年12月31日,我們擁有2.227億美元的現金、現金等價物、其他金融資產和有價證券,而截至2022年12月31日的現金、現金等價物和有價證券為2.517億美元。我們相信,我們現有的現金、現金等價物、其他金融資產和有價證券將足以支付至少未來12個月的運營費用和資本支出需求。然而,我們的這一估計是基於可能被證明是錯誤的假設,我們可能會比預期更早耗盡我們的資本資源。由於與產品開發相關的眾多風險和不確定性,我們可能會
錯誤地估計與完成我們的候選產品的研究和開發相關的資本支出和運營費用增加的時間和金額。我們目前和未來的資金需求以及近期和長期運營支出的時間和金額取決於許多因素,包括但不限於:
|
•
|
研究和開發我們的GH001、GH002和GH003候選產品的範圍、進度、結果和成本,以及為我們的初始和任何附加適應症以及我們可能開發的其他候選產品提供這些療法所需的其他美布福寧給藥方法和醫療器械;
|
|
•
|
為我們的GH001、GH002和GH003候選產品獲得市場批准的時間和不確定性以及涉及的成本,包括為我們的初始和任何附加適應症以及我們可能開發和追求的其他候選產品提供這些療法所需的醫療器械;
|
|
•
|
我們在針對GH001的IND中建議的研究的臨牀擱置持續時間,包括任何非臨牀項目的進展和相關成本,以及解除臨牀擱置所需的任何其他工作,以及與FDA的討論以及此類討論的結果和解決方案;
|
|
•
|
我們可能追求的未來候選產品的數量及其開發需求;
|
|
•
|
我們計劃尋求監管批准的司法管轄區的數量;
|
|
•
|
如果獲得批准,任何批准的適應症或獲得監管批准的任何其他候選產品的GH001、GH002和GH003的商業化活動的成本
不由任何未來的合作伙伴負責,包括建立產品銷售、營銷、分銷和製造能力的成本和時間;
|
|
•
|
在收到監管部門批准後,任何批准的適應症或任何其他候選產品的GH001、GH002和GH003及其各自的醫療器械的商業銷售所獲得的收入(如果有)。
|
|
•
|
我們可以在多大程度上對其他產品、候選產品、醫療器械或技術進行許可或獲得權利;
|
|
•
|
隨着我們擴大研發、增加辦公空間和建立商業基礎設施,我們的員工增長和相關成本;
|
|
•
|
準備、提交和起訴專利申請以及維護和保護我們的知識產權的成本,包括執行和捍衞與知識產權有關的索賠;
|
|
•
|
競爭產品和市場發展的影響;以及
|
|
•
|
作為上市公司的持續運營成本。
|
在此之前,如果我們能夠產生可觀的產品收入,我們預計將通過公共或私募股權發行、債務融資、可轉換債券融資、戰略合作和許可安排的組合來滿足我們的現金需求。在我們通過出售股權或可轉換債務證券籌集額外資本的範圍內,我們現有股東的所有權權益可能會被稀釋,這些證券的條款可能包括清算或其他對該等現有股東的權利產生不利影響的優惠。債務融資(如果可行)可能導致固定支付義務,並可能涉及協議
,其中包括限制或限制我們採取特定行動的能力的契約,例如招致額外債務、進行資本支出或宣佈股息。
137
目錄表
如果我們通過與第三方的合作或營銷、分銷、許可和特許權使用費安排籌集資金,我們可能不得不放棄對我們的知識產權或技術、未來收入流、研究計劃或候選產品的寶貴權利,或者以可能對我們不利的條款授予許可證,或者發行和出售我們的股票,這可能會導致我們的股東股權被稀釋。如果我們無法在需要時通過股權或債務融資籌集更多資金,我們可能需要推遲、限制、減少或終止我們的產品開發或未來的商業化努力,或者授予開發和營銷我們原本更願意自己開發和營銷的候選產品的權利。
有關與我們未來資金需求相關的風險的更多信息,請參閲“項目3.關鍵信息--D.風險因素”。
|
C.
|
研發、專利和許可證等。
|
見“項目4.公司信息--B.業務概述”和“項目5.經營和財務回顧及展望--A.經營結果--財務業務概述”。
|
D.
|
趨勢信息
|
見“項目5.經營和財務回顧及展望--A.經營成果”。
|
E.
|
關鍵會計估計
|
有關重要會計估計的説明,請參閲本年度報告其他部分的綜合財務報表附註2。
|
第六項。
|
董事、高級管理人員和員工
|
|
A.
|
董事和高級管理人員
|
下表提供了有關我們現任高管和董事的信息。我們每名董事的任期為一年,因此,將於2024年舉行的年度股東大會
中屆滿。年齡截至2024年3月1日。
|
名字
|
職位
|
年齡
|
||
|
行政人員
|
||||
|
Theis Terwey
|
首席執行官
|
48
|
||
|
馬格努斯·哈雷
|
管理董事,愛爾蘭
|
27
|
||
|
朱莉·瑞安
|
總裁副財長
|
38
|
||
|
亞倫·卡梅倫
|
首席運營官
|
39
|
||
|
維爾奇卡·瓦爾切娃
|
首席醫療官
|
49
|
||
|
非執行董事
|
||||
|
弗洛裏安·舍恩哈廷
|
董事會主席
|
55
|
||
|
邁克爾·福爾
|
董事會副主席
|
58
|
||
|
德莫特·漢利
|
董事
|
59
|
||
|
鄧肯·摩爾
|
董事
|
65
|
除非另有説明,否則我們執行董事和非執行董事目前的業務地址是GH Research PLC,Joshua Dawson House,Dawson Street,Dublin 2,D02 RY95,愛爾蘭。
138
目錄表
行政人員
Theis Terwey警局的Med醫生自2021年5月以來一直擔任我們的首席執行官。特維博士是我們的聯合創始人之一,從2018年我們成立到2020年,他一直是董事的一員。在此之前,Terwey博士是NB Capital APS的合夥人(他在2015年至2020年擔任該職位),並在NB Capital Research GmbH擔任過各種職務,於2012年至2015年管理董事,
並於2009年至2012年擔任醫療顧問。特威博士還曾擔任Forward Pharma A/S的高級顧問,他在2015年至2023年擔任該職位。特維博士擁有醫學博士學位。在柏林Charité大學醫學院,他還在那裏完成了內科專業學位。
馬格努斯·哈雷,自2020年11月起擔任我們在愛爾蘭的管理董事,是我們的聯合創始人之一,並從2018年成立到2020年擔任我們的顧問
。此前,哈勒曾擔任NB Capital APS的分析師,他在2018年至2021年擔任該職位。此外,從2019年起,他擔任NB Capital APS的洗錢報告官。在此之前,從2016年到2018年,他在NB Capital APS擔任弗洛裏安·舍恩哈廷的個人助理。哈雷先生擁有哥本哈根商學院經濟學和工商管理學士學位。
朱莉·瑞安,FCA,自2021年1月起擔任我行副財長總裁。在此之前,Ryan女士曾擔任過多個高級財務職務,包括Ardagh Group plc(2018年至2020年擔任集團報告經理)、Sherry Fitzgerald(2018年擔任商業業務合夥人)、ICON plc(2015年至2018年擔任商業/金融業務合作伙伴助理經理)和Bramble Ltd(2013年至2015年擔任財務經理)。Ryan女士是普華永道會計師事務所的特許會計師,擁有都柏林大學學院的通信學士學位和都柏林大學學院Michael SMurfit研究生院的MACC學位。
亞倫·卡梅倫 有 自2024年1月起擔任我們的首席運營官。在此之前,他從2021年8月起擔任我們的副總裁,技術開發,直到2022年12月擔任總裁副技術開發和運營規劃。此前,卡梅倫先生曾擔任過多個高級技術、供應鏈和項目管理職位,包括2020至2021年間擔任設備項目管理主管的Viatris以及2016至2021年間擔任供應鏈和物流副總裁以及董事藥品開發和製造部門副總裁的Iterum Treeutics。從2013年到2016年,卡梅倫先生在Mylan的研發部門擔任過各種職務,在2006年至2012年期間,他在MSD的研發、商業化和製造部門擔任過各種職務。卡梅倫擁有理科學士學位。都柏林城市大學化學和藥學碩士。都柏林皇家外科學院工業藥學專業,布拉德福德大學工商管理碩士學位。
Velichka(Villy)Valcheva,醫學博士,碩士,他自2024年2月以來一直擔任我們的首席醫療官。在此之前,她自2023年8月起擔任我們的副
總裁,負責臨牀研究和醫療事務。瓦爾切瓦博士在各種領導職位上擁有20多年的經驗,在製藥和生物技術公司擁有全球經驗。從2020年到2023年,Valcheva博士擔任Albireo國際醫療事務副總裁和負責人,並從2022年起擔任FIH研究和臨牀開發的醫學領導/監測。在此之前,Valcheva博士於2018年至2020年擔任董事腫瘤學-肝細胞癌方面的全球高級醫學專家。瓦爾切瓦博士擁有醫學博士學位。她擁有保加利亞普羅夫迪夫醫科大學的醫學碩士學位,以及愛爾蘭都柏林三一學院的藥學碩士學位,同時也是該學院藥學研究生課程的講師。
非執行董事
弗洛裏安·舍恩哈廷,自2018年以來擔任我們的董事會主席。Schönharting先生是我們的聯合創始人之一。舍恩哈廷先生也是Forward Pharma A/S的聯合創始人,自2005年以來一直擔任該公司董事會成員,並自2011年以來一直擔任該公司董事會主席。他還創立或聯合創立了其他幾家生物製藥公司,包括Genmab A/S、Veloxis A/S(f/k/a Life Cycle Pharma A/S)、新西蘭製藥A/S和阿卡迪亞製藥公司。Schönharting先生在涉及生物製藥行業的公共和私募股權基金中擁有超過25年的投資管理經驗。我們相信,Schönharting先生有資格在我們的董事會任職,因為他的經驗、特點和技能,包括他豐富的製藥和行政經驗。
139
目錄表
邁克爾·福爾,自2022年3月以來擔任我們的董事會副主席,並自2020年12月以來擔任我們的董事會成員。Forer先生在2011年是ADC Treateutics SA的聯合創始人,並於2011年至2015年擔任其首任首席執行官,於2015年至2023年擔任副董事長,於2015年至2020年擔任紐約證券交易所首次公開募股的首席財務官,於2015年至2022年擔任執行副總裁總裁,並於2020年至2022年擔任總法律顧問。在此之前,Forer先生在2008年至2013年期間擔任Spigen Sarl的董事會成員兼首席執行官董事,領導該公司於2013年被阿斯利康以4.4億美元收購。作為生物技術領域的專業投資者,Forer先生擁有豐富的經驗,包括從2008年到2015年在Auven Treateutics Holdings L.P.
領導對Spigen和ADC治療的投資,從2001年到現在作為Rosetta Capital Limited的聯合創始人和合夥人,以及從1998年到2001年作為羅斯柴爾德資產管理公司的投資經理。Forer先生擁有西安大略大學經濟學學士學位和不列顛哥倫比亞大學法學學士學位。我們相信,Forer先生有資格在我們的董事會任職,因為他的經驗、特點和技能,包括他豐富的製藥經驗。
德莫特·漢利,自2021年9月以來一直擔任我們的董事會成員。韓磊是經驗豐富的獨立非執行董事(Sequoia Capital)非執行董事和投資銀行家。他目前是眾多私募股權支持的公司和受監管的金融投資基金的非執行董事會成員。其中包括分別自2018年9月和2023年1月起的Killiney Sea I和II的幾家集團公司,自2020年2月以來的Larix Opportunities Master ICAV,自2020年10月以來的Varagon Capital Credit Strategy ICAV。此外,他自2021年1月以來一直擔任4010 Royalty Fund ICAV的主席,自2021年5月以來擔任信用價值基金(歐洲)V GP Limited的主席,自2023年5月以來擔任4010 Royalty Investments ICAV的主席,自2023年7月以來擔任4010 Royalty Investments GP,LLC的主席。他於2012年創立了努斯利。在此之前,Hanley先生是巴克萊銀行愛爾蘭業務的聯席主管,在包括Claret Capital、JP Morgan、德意志銀行和花旗銀行在內的大型全球公司的國際投資銀行和資本市場工作了16年。他是公司治理研究所治理諮詢委員會的成員,也是愛爾蘭商業和僱主聯合會財政和經濟委員會(EcoTax)的長期成員。他畢業於都柏林大學學院(BSC)和貝爾法斯特女王大學(MBA)
,並持有公司治理研究所/格拉斯哥喀裏多尼亞大學的公司治理文憑。我們相信,Hanley先生有資格在我們的董事會任職,因為他的經驗、特質和技能,包括他豐富的行政經驗。
鄧肯·摩爾,博士,自2021年9月以來一直擔任我們的董事會成員。摩爾博士自2008年5月以來一直是East West Capital
Partners的合夥人。在此之前,穆爾博士於1991年至2008年擔任摩根士丹利製藥公司的頂級分析師,並於1997年至2008年擔任董事董事總經理,領導該公司的全球醫療保健股票研究團隊。在劍橋大學期間,他與兩名同事共同創立了一家醫療診斷公司Ultra Clone,這讓他開始了在醫療保健資本市場分析領域長達20年的職業生涯。1986年,他參與了BankInvest生物技術基金的建立,並加入了該基金的科學顧問委員會。摩爾博士在愛丁堡接受教育,在利茲大學學習生物化學和微生物學。他有一個M.Phil。劍橋大學博士,同時也是該校的博士後研究員。目前,他是生物醫藥公司的積極投資者,他在Forward Pharma A/S、Cycle Pharma和ASP Isotopes擔任董事職務。他也是蘇格蘭生命科學協會的主席,並擔任愛丁堡麥奇斯頓城堡學校和深圳人民Republic of China國際學校的董事會成員。我們相信,摩爾博士有資格在我們的董事會任職,因為他擁有豐富的經驗、特質和技能,包括豐富的製藥和行政經驗。
|
B.
|
補償
|
董事及行政人員的薪酬
在截至2023年12月31日的年度內,支付給董事會成員和高管的所有職位服務的總薪酬為200萬美元,包括退休和類似福利。
2023年4月27日,我們向某些高管(不包括特威博士)授予了購買52,500股普通股的選擇權。這些股票期權的行使價為每股0.025美元,
自授予之日起七年到期。2023年8月22日,我們向瓦爾切瓦博士授予了購買5萬股普通股的選擇權。這些股票期權的行權價為每股10.83美元,自授予之日起有效期為8年。2023年9月26日,我們向董事會成員授予了購買19899股普通股的選擇權。該等購股權於授出日期歸屬,但須受兩年服務條件規限,行使價為每股0.025美元,自授出日期起計滿七年。
140
目錄表
股權激勵計劃
股票期權計劃
我們已採納購股權計劃(在此稱為購股權計劃),根據該計劃,向合資格的參與者授予購股權。股票期權計劃的目的是吸引、留住和激勵員工和董事提供有競爭力的薪酬機會,鼓勵長期服務,表彰個人貢獻和獎勵業績目標的實現,並促進為股東創造長期價值。截至2023年12月31日,根據購股權計劃,共有790,720股普通股的未行使期權,加權平均行權價為每股10.35美元。
計劃管理:股票期權計劃由我們的薪酬委員會管理,並受薪酬委員會的酌情決定權
授權給我們的董事會其他成員或我們的高級管理人員或經理。
符合條件的參與者:根據購股權計劃,任何董事(包括本公司或本集團任何其他成員公司的董事及並非本公司或本集團成員公司的任何其他公司的董事)或本集團成員公司或主要顧問公司的僱員(在此稱為合資格人士)均有資格獲我們的薪酬委員會提名以獲得
期權。薪酬委員會保留決定是否提名合資格人士參與購股權計劃的絕對酌情權。任何人士均無權參與購股權計劃。
獎項:根據購股權計劃可授出購股權的普通股數目,與根據緊接前10年期間授出的購股權而已發行或仍將發行或購買的普通股數目相加,將不會超過1,202,734股普通股,直至股東大會另行決議為止。根據股票期權計劃,股權將以期權的形式授予。期權的行權價將由薪酬委員會確定,但(除非另有決定)不會低於授予日期前一天
普通股的市值。每個選項的期限將由薪酬委員會決定,但不會超過自授予之日起八年。
對參與的限制:根據購股權計劃,自購股權計劃通過之日起10年內不得授予任何購股權。
參與:參與股票期權計劃的條件,包括行使期權的時間,將由薪酬委員會確定,並在適用的期權計劃文件中闡述。除非另有説明,否則期權將是參與者個人的,如果參與者聲稱轉讓、轉讓、出售、抵押、質押或
阻礙期權,期權將失效。
服務終止和控制權變更:如果參與者終止僱傭或服務,(1)截至終止日期尚未授予的期權的任何部分將立即失效,以及(2)在終止日期已授予的期權的任何部分將在終止日期後30天內完全失效,但在該日期之前仍未行使。
如果參與者死亡,薪酬委員會可以確定,該參與者在其死亡之日持有的任何期權的全部或特定百分比將能夠授予、或由其法定遺產代理人行使或以其他方式轉讓給其合法遺產代理人。
在參與者被視為良好離職者的情況下,如果該參與者被終止僱傭關係,薪酬委員會可絕對酌情決定可授予或行使選擇權的程度。
141
目錄表
如果發生涉及合併、出售公司全部或幾乎所有資產、或接管或其他重組的控制權變更,薪酬委員會將有權酌情(1)加快全部或特定部分期權的授予,(2)同意由尚存公司或其母公司採用或替換與根據計劃最初授予的期權等同但與尚存公司或其母公司的股票有關的期權。(3)安排繼續行使尚未行使的購股權;(4)向參與者支付相當於根據合併或收購協議須支付的每股股份金額的現金和解款項;或(5)按委員會決定的條款更改尚未行使的購股權。
終止及修訂:除非本公司或董事會提前決議終止,否則購股權計劃將持續10年。我們的薪酬委員會可根據適用法律或證券交易所規則的要求,隨時通過決議修訂或撤銷購股權計劃的任何條款,但須經股東批准。但是,除非參與者同意,否則此類行動不得對任何期權參與者的權利產生實質性不利影響。
僱傭協議
我們已經與我們的某些執行官員簽訂了僱傭協議。這些協議中的每一項都規定了初始工資,通常要求提前通知終止,通常為六個月。我們的一些高管已經同意,在受僱期間和解聘後長達12個月的時間內,不會與我們競爭或招攬我們的員工或客户。
|
C.
|
董事會慣例
|
董事的董事會組成
我們的董事會由四名成員組成。我們的現任董事會成員在2023年的年度股東大會上再次當選,並將任職到我們2024年的下一次年度股東大會。
我們的董事會已經決定,邁克爾·福爾、德莫特·漢利和鄧肯·摩爾都有資格成為適用董事標準意義上的獨立納斯達克。
我們的任何董事與我們或我們的子公司之間沒有任何服務合同,該合同規定在終止僱傭時提供任何福利。
我們是美國證券交易委員會規則下的外國私人發行人。因此,根據納斯達克的上市要求,我們將繼續依賴母國治理要求及其下的某些豁免,而不是證券交易所的公司治理要求。我們的任何董事或高管之間都沒有家族關係。關於我們的公司治理原則的概述,請參閲“項目10.
其他信息-B.組織備忘錄和章程”和“項目16G-公司治理”。
多樣性
我們並沒有納斯達克規則第5605(F)條所界定的“多元化”董事會。我們是一家有四名董事的臨牀期公司,因此被視為納斯達克規則5605(F)(2)(D)中定義的
“董事會規模較小的公司”。由於是一家臨牀階段的公司,目前還沒有機會考慮“多樣化”的候選人。話雖如此,我們相信擁有多元化的員工隊伍,並將在機會出現時考慮“多元化”的董事候選人
。我們的提名和公司治理委員會在其職權範圍內,有責任將多樣性作為整個董事遴選和提名流程的一部分來考慮,並將確定不同候選人作為搜索標準。下面的矩陣概述了截至2023年3月9日和2024年3月7日我們董事會的多樣性:
142
目錄表
|
主要執行機構所在國家:愛爾蘭
|
||||||||
|
外國私人發行商:是的。
|
||||||||
|
母國法律禁止披露:否
|
||||||||
|
董事總數:4人
|
||||||||
|
女性
|
男性
|
非二進制
|
沒有透露
|
|||||
|
第一部分:性別認同
|
0
|
4
|
0
|
0
|
||||
|
第二部分:人口統計背景
|
||||||||
|
在母國司法管轄區任職人數不足的個人
|
0
|
|||||||
|
LGBTQ+
|
0
|
|||||||
|
沒有透露
|
0
|
董事會各委員會
我們的董事會設立了獨立的審計委員會、提名和公司治理委員會以及薪酬委員會。
審計委員會
審計委員會由德莫特·漢利(主席)、邁克爾·福爾和鄧肯·摩爾組成,協助我們的董事會監督我們的會計和財務報告流程,以及對我們財務報表的審計。此外,審計委員會直接負責對我們的獨立註冊會計師事務所的工作進行薪酬、保留和監督,我們的股東選舉該事務所為我們的外部審計師。審計委員會完全由精通財務的董事會成員組成,德莫特·漢利、邁克爾·福爾和鄧肯·摩爾均被視為美國證券交易委員會所定義的“審計委員會財務專家”。
我們的董事會認定,德莫特·漢利、邁克爾·福爾和鄧肯·摩爾均符合1934年證券交易法(經修訂)第10A-3條規定的“獨立性”要求。
審計委員會受一份章程管轄,該章程遵守適用於我們的《納斯達克》規則。除其他事項外,審計委員會有責任:
|
•
|
向股東推薦任命獨立審計師,供股東大會批准;
|
|
•
|
為編制或發佈審計報告或執行其他審計服務而聘用、補償、保留和監督任何會計師事務所;
|
|
•
|
在聘請獨立審計師提供審計服務和非審計服務之前,預先批准該審計師提供的審計服務和非審計服務;
|
|
•
|
評估獨立審計師的資格、業績和獨立性,並至少每年向董事會全體成員提交結論;
|
|
•
|
與管理層和我們的獨立註冊會計師事務所審查和討論我們的財務報表和財務報告程序;以及
|
143
目錄表
|
•
|
審查、批准或批准任何關聯方交易。
|
提名和公司治理委員會
提名和公司治理委員會由弗洛裏安·舍恩哈廷(主席)和邁克爾·福雷爾組成,協助我們的董事會尋找有資格成為董事會成員的個人,並向董事會推薦董事提名的人蔘加下一屆年度股東大會或填補董事會現有或新設的空缺。
提名和公司治理委員會的職責包括:
|
•
|
制定董事的遴選標準和任命程序;
|
|
•
|
評估董事會個別成員和高管的運作情況,並向董事會報告評估結果;
|
|
•
|
建立董事董事會候選人,包括股東推薦的提名人選的識別和評估程序;
|
|
•
|
審查我們董事會的組成,以確保它由具有適當技能和專業知識的成員組成,以便向我們提供建議;
|
|
•
|
向本公司董事會推薦擬提名的董事人選和各董事會委員會成員;
|
|
•
|
制定一套商業行為和道德守則以及一套企業管治指引,並向董事局建議;以及
|
|
•
|
監督董事會和管理層的評估工作。
|
薪酬委員會
薪酬委員會由Michael Forer(主席)和Florian Schönharting組成,協助我們的董事會制定董事會、公司高管和董事會指定的其他高級管理人員的薪酬。
除其他事項外,薪酬委員會有責任:
|
•
|
確定、審查和提出與董事和高管的薪酬和福利相關的政策;
|
|
•
|
根據這些政策評估高級管理層的表現,並向董事會報告;以及
|
|
•
|
監督和管理我們不時實施的員工股票期權計劃或股權激勵計劃。
|
|
D.
|
員工
|
截至2023年12月31日,我們有49名員工。34名員工從事研發活動,其餘員工提供行政、商業和運營支持。
我們的員工沒有工會代表,也沒有集體談判協議。我們沒有遇到任何員工訴訟或索賠,並認為我們的員工關係
要乖。
144
目錄表
|
E.
|
股份所有權
|
見“項目7.大股東和關聯方交易--A.大股東”。
|
F.
|
披露登記人追討錯誤判給的補償的行動
|
不適用。
|
第7項。
|
大股東及關聯方交易
|
|
A.
|
大股東
|
下表列出了截至2023年12月31日我們普通股的實益所有權相關信息:
|
•
|
我們所知的實益擁有我們已發行普通股5%或以上的每一個人或一組關聯人;
|
|
•
|
我們的每一位行政人員和董事;以及
|
|
•
|
所有行政官員和董事作為一個團體。
|
受益所有權是根據美國證券交易委員會的規則確定的,一般包括對證券的投票權或投資權。根據這些規則,受益所有權
包括個人或實體擁有單獨或共享投票權或投資權的任何股份。除非另有説明,並在適用的社區財產法的規限下,根據向吾等提供的資料,吾等相信,下表所列個人及實體對其實益擁有的所有普通股擁有獨家投票權及投資權。
下表中的實益所有權百分比是基於截至2023年12月31日的52,028,145股已發行普通股。可在60天內行使的購買股份的期權
被視為由持有該等期權的人士實益擁有,以計算該人士的所有權百分比,但就計算任何其他人士的所有權百分比而言,則不被視為未償還股份。
據我們所知,截至2023年12月31日,4名美國紀錄保持者持有我們已發行和已發行普通股的約78.2%。實際股東人數超過記錄持有人的這一數字,包括作為實益所有者但其股票由經紀人和其他被提名者以街頭名義持有的股東。這一數量的登記持有人也不包括其股票可能以信託形式持有或由
其他實體持有的股東。
145
目錄表
除下表另有説明外,董事、行政人員及指定實益擁有人的地址由GH Research PLC保管,地址為都柏林道森街Joshua Dawson House,D02 RY95,愛爾蘭。
|
主要股東
|
數量
普通
股票
有益的
擁有
|
百分比
普通
股票
有益的
擁有
|
||||||
|
5%或更大的股東
|
||||||||
|
BVF(1)
|
10,400,158
|
20.0
|
%
|
|||||
|
Ra Capital(2)
|
5,587,333
|
10.7
|
%
|
|||||
|
RTW Investments LP(3)
|
3,327,129
|
6.4
|
%
|
|||||
|
FMR有限責任公司(4)
|
3,136,869
|
6.0
|
%
|
|||||
|
Lynx1 Capital Management LP(5)
|
2,994,059
|
5.8
|
%
|
|||||
|
行政人員及董事
|
||||||||
|
Theis Terwey
|
6,188,070
|
11.9
|
%
|
|||||
|
馬格努斯·哈雷
|
*
|
*
|
||||||
|
朱莉·瑞安
|
*
|
*
|
||||||
|
亞倫·卡梅倫
|
*
|
*
|
||||||
|
維爾奇卡·瓦爾切娃
|
*
|
*
|
||||||
|
弗洛裏安·舍恩哈廷
|
14,824,419
|
28.5
|
%
|
|||||
|
邁克爾·福爾
|
*
|
*
|
||||||
|
德莫特·漢利
|
*
|
*
|
||||||
|
鄧肯·摩爾
|
*
|
*
|
||||||
|
全體執行幹事和董事(9人)
|
21,248,095
|
40.8
|
%
|
|||||
| * |
代表實益擁有我們全部已發行普通股不到1%的股份。
|
| (1) |
僅根據BVF Inc.於2024年2月14日提交給美國證券交易委員會的13F表控股報告,其中包括由Biotech Value Fund,L.P.(“BVF”)持有的普通股,包括由Biotech Value Fund II,L.P.(“BVF2”)和Biotech Value Trading Fund OS L.P.(“Trading Fund OS”)持有的普通股。BVF(“BVF GP”)作為BVF的普通合夥人,可被視為實益擁有BVF實益擁有的股份。BVF II GP L.L.C.(“BVF2 GP”)作為BVF2的普通合夥人,可被視為實益擁有BVF2實益擁有的股份。BVF Partners OS Ltd.(“Partners OS”)作為Trading Fund OS的普通合夥人,可被視為實益擁有由Trading Fund OS實益擁有的股份。BVF GP Holdings L.L.C.(“BVF GPH”)作為BVF GP及BVF2 GP各自的唯一成員,可被視為實益擁有由BVF及BVF2合共實益擁有的股份。BVF Partners L.P.(“Partners”)作為BVF的普通合夥人和BVF2(Partners OS的唯一成員)以及Trading Fund OS的投資管理人,可被視為實益擁有由BVF、BVF2和Trading Fund OS實益擁有的股份。BVF Inc.作為合夥人的普通合夥人,可被視為實益擁有合夥人實益擁有的股份。馬克·蘭伯特作為董事的董事和BVF Inc.的高級管理人員,可能被視為實益擁有BVF Inc.實益擁有的股份。上述人士和實體的地址是加州舊金山蒙哥馬利街44號40樓,郵編:94104。
|
| (2) |
僅根據RA Capital Management,L.P.(“RA Capital”)於2024年2月14日提交予美國證券交易委員會的附表13G/A,包括由RA Capital Healthcare Fund,L.P.(“該基金”)及RA Capital Nexus Fund II(“Nexus Fund II”)持有的普通股。RA Capital Healthcare Fund GP,LLC是該基金的普通合夥人,RA Capital Nexus Fund II GP,LLC是Nexus Fund II的普通合夥人。RA Capital的普通合夥人是RA Capital Management GP,
Kolchinsky博士和Mr.Shah是其中的控制人。RA Capital擔任本基金及Nexus Fund II的投資顧問,並可被視為基金及Nexus Fund II所持任何證券的實益擁有人(就交易所法案第13(D)節而言)。本基金及Nexus Fund II已向RA Capital授予唯一投票權及處置基金及Nexus Fund II投資組合中持有的所有證券的唯一權力,包括本公司的普通股。就交易法第13(D)節而言,作為RA Capital的經理,Kolchinsky博士及Mr.Shah可被視為RA Capital實益擁有的任何證券的實益擁有人。RA Capital的地址是伯克利街200號,18號這是 郵編:02116,郵編:波士頓。
|
146
目錄表
| (3) |
根據RTW Investments,LP於2024年2月14日提交予美國證券交易委員會的附表13G,由RTW Investments擔任投資顧問的若干基金(“RTW基金”)直接持有的普通股組成。因此,RTW Investments可被視為RTW基金直接持有的普通股的實益擁有人。Wong博士擔任RTW Investments的管理合夥人兼首席投資官,因此也可能被視為RTW基金直接持有的任何證券的實益擁有人。上述個人和實體的營業所地址為40 10這是紐約大道7層,郵編:10014。
|
| (4) |
僅基於FMR LLC於2024年2月9日提交給美國證券交易委員會的13G/A,由FMR LLC或其某些子公司和聯營公司持有的普通股組成。阿比蓋爾·P·約翰遜是董事的一員,也是FMR LLC的董事長兼首席執行官。約翰遜家族成員,包括阿比蓋爾·P·約翰遜,直接或通過信託是FMR LLC B系列有表決權普通股的主要所有者,代表FMR LLC 49%的投票權。
Johnson家族集團和所有B系列股東已達成股東投票協議,根據該協議,所有B系列有表決權普通股將根據B系列有表決權普通股的多數票進行表決。
因此,通過他們對有表決權普通股的所有權和股東投票協議的執行,根據1940年《投資公司法》,約翰遜家族成員可被視為與FMR LLC有關的控股集團。FMR LLC的地址是薩默街245號,波士頓,馬薩諸塞州02210。
|
| (5) |
僅根據Lynx1 Capital Management LP(“投資管理人”)於2024年2月16日向美國證券交易委員會提交的第13G/A號文件,由Lynx1 Master Fund LP(“LUNX1基金”)持有的普通股組成。就Lynx1基金直接持有的普通股而言,投資經理的普通合夥人、Lynx1 Capital Management GP LLC的唯一成員Weston Nichols先生可被視為實益擁有人。
投資經理的地址是:151Calle de San Francisco,Suite200,PM 1237,San Juan,PR 00901-1607;Weston Nichols的地址是c/o Lynx1 Capital Management LP,151 Calle de San Franciso,Suite 200,PMB 1237,San Juan,PR 00901-1607年。
|
|
B.
|
關聯方交易
|
以下是我們自2023年1月1日以來與任何董事會成員、我們的高管以及持有我們超過5%的普通股的持有人達成的關聯方交易的説明,但“第6項.董事、高級管理人員和員工”中描述的薪酬安排除外。
除非提及於本公司首次公開招股後進行的交易或另有明文規定,否則以下“-主要股東及關聯方交易”一節所載的股份及每股數字不會使股份合併生效。
賠償
*我們的憲法要求我們在愛爾蘭法律允許的最大程度上對在公司特定方向服務的董事和高管、員工和其他官員進行賠償。有關更多信息,請參閲本年度報告附件2.1。
關聯人交易政策
我們採取了關聯人交易政策,規定任何關聯人交易都必須得到我們的董事會或董事會指定的委員會的批准或批准。在決定是否批准或批准與關聯人的交易時,我們的董事會或指定委員會將考慮所有相關事實和情況,包括但不限於條款的商業合理性、對我們的利益和預期利益或缺乏利益、替代交易的機會成本、關聯人直接或間接利益的重要性和性質以及
關聯人的實際或表面利益衝突。本公司董事會或指定委員會不會批准或批准關聯人交易,除非其在考慮所有相關信息後確定該交易符合或不符合我們的最佳利益和我們股東的最佳利益。
147
目錄表
|
C.
|
專家和律師的利益
|
不適用。
|
第八項。
|
財務信息
|
|
A.
|
合併報表和其他財務信息
|
財務報表
見“項目18.財務報表”,其中載有我們根據國際財務報告準則編制的財務報表。
法律訴訟
有時,我們可能是訴訟的一方,或在正常業務過程中受到索賠的影響。雖然訴訟和索賠的結果不能確切地預測,但我們目前相信這些普通過程的最終結果不會對我們的運營結果、現金流和財務狀況產生實質性的不利影響。無論結果如何,由於辯護和和解成本、管理資源轉移等因素,訴訟可能會對我們產生不利影響。截至2023年12月31日,我們沒有參與任何重大訴訟,也沒有為任何債務建立重大應急準備金。
股利與股利政策
我們從未宣佈或支付過我們股本的現金股息。我們打算保留所有可用資金和任何未來收益(如果有),為我們業務的發展和擴張提供資金,
我們預計在可預見的未來不會支付任何現金股息。未來與股息政策有關的任何決定將由我們的董事會酌情決定,並將取決於我們的運營結果、財務狀況、資本要求、合同限制、業務前景和董事會認為相關的其他因素。
根據愛爾蘭法律,只有在我們有足夠的可分配準備金(在非合併的基礎上)的情況下,我們才可以支付股息,這些準備金是我們以前沒有分配或資本化的累積已實現利潤減去我們累積的已實現虧損,只要這些損失以前沒有在資本減少或重組中註銷。此外,如果我們的淨資產不是,或者如果進行此類分配或派息將導致我們的淨資產不等於、等於或超過我們的已催繳股本加上不可分配準備金的總和,則不得進行任何分配或派息。
由於我們是一家愛爾蘭公司,愛爾蘭股息預扣税或DWT目前的税率為25%,除非適用豁免
,否則將對我們股東的股息或其他分配徵收愛爾蘭股息預扣税。美國持有者可以獲得豁免(如“第10項.附加信息-E税務”所定義);這些股東應諮詢他們各自的税務顧問。如果出現DWT,我們負責在源頭扣除DWT
,並向愛爾蘭税務專員説明相關金額。見“項目10.補充資料--B.組織備忘錄和章程”。
|
B.
|
重大變化
|
有關我們業務的重大變化的討論可在“項目4.公司信息-A.公司的歷史和發展”和“項目4.公司信息-B.
業務概述”中找到。
|
第九項。
|
報價和掛牌
|
|
A.
|
優惠和上市詳情
|
請參閲下面的“-C.市場”。
148
目錄表
|
B.
|
配送計劃
|
不適用。
|
C.
|
市場
|
我們的普通股在納斯達克上市,代碼為“GHRS”。有關本公司普通股的説明,請參閲“第10項.補充資料--B.組織備忘錄及章程細則”。
|
D.
|
出售股東
|
不適用。
|
E.
|
稀釋
|
不適用。
|
F.
|
發行債券的開支
|
不適用。
|
第10項。
|
附加信息
|
|
A.
|
股本
|
不適用。
|
B.
|
組織章程大綱及章程細則
|
本年度報告附件2.1載有對本公司普通股及其章程的描述,現將其併入本報告。
|
C.
|
材料合同
|
除本年報(包括展品)另有披露外,除在正常業務過程中訂立的合同外,吾等目前及過去兩年並無訂立任何重大合同。
|
D.
|
外匯管制
|
根據愛爾蘭法律,除下文所述外,目前沒有對資本進出口的限制,包括外匯管制或影響向非居民普通股持有人支付股息、利息或其他付款的限制。新的限制預計將於2024年第二季度生效,詳情如下。
1992年《財政轉移法案》授權愛爾蘭財政部長對愛爾蘭與其他國家和個人之間的財政轉移作出限制。財政轉移的定義很廣泛,包括歐洲共同體條約所指的資本流動或支付的所有轉移。收購或處置愛爾蘭註冊公司發行的股票和相關付款可能屬於這一定義。此外,贖回或購買股票的股息或付款以及愛爾蘭註冊公司清算時的付款也屬於這一定義。
1992年《財政轉移法》禁止涉及若干個人、實體和團體的財政轉移,目前包括但不限於:白俄羅斯、波斯尼亞和黑塞哥維那、布隆迪、蘇丹、南蘇丹、中非共和國、利比亞、利比裏亞、黎巴嫩、馬裏、朝鮮民主主義人民共和國、緬甸/緬甸、突尼斯、津巴布韋、科特迪瓦、委內瑞拉、阿拉伯敍利亞共和國、幾內亞比紹、尼加拉瓜的某些個人、實體、團體和活動。剛果民主共和國、伊朗、烏克蘭、俄羅斯或與阿富汗塔利班有關聯的某些個人、實體和機構。伊斯蘭國(達伊什)和基地組織;土耳其未經授權在東地中海的鑽探活動以及某些已知的恐怖分子和恐怖團體以及窩藏某些恐怖團體的國家,未經愛爾蘭中央銀行事先許可。
149
目錄表
愛爾蘭《2023年第三國交易篩選法》或《外國直接投資法》在愛爾蘭引入了外國直接投資篩選制度,預計將於2024年第二季度生效。《外國直接投資法》將要求涉及以下方面的某些收購和/或投資交易的當事方:(1)愛爾蘭公司和一系列部門(包括關鍵的衞生基礎設施)的商業機構;以及(2)收購/投資在歐洲經濟區和瑞士以外的國家或第三國設立的各方,必須事先通知愛爾蘭企業、貿易和就業部部長,以便事先獲得批准。然後,部長將確定相關交易是否對愛爾蘭的安全或公共秩序構成風險,並可在認為適當的情況下阻止交易完成或以其他方式對交易施加條件。如果部長有合理理由相信某項交易對愛爾蘭的安全或公共秩序構成風險,則部長也可以審查他/她沒有收到通知的交易,無論這種交易是否已經完成。《外國直接投資法》還將根據《歐盟投資審查條例》(條例(EU)2019/452),加強與歐盟其他成員國的信息共享和合作。
|
E.
|
税收
|
以下討論基於美國和愛爾蘭在本協議生效之日生效的税收法律、法規和監管做法,這些法律、法規和監管做法可能會發生變化(或受
解釋變化的影響),可能具有追溯效力。
建議現有股東和潛在股東根據他們的具體情況諮詢他們自己的税務顧問,以瞭解美國或愛爾蘭的税收法律、法規和監管做法
,這些法律、法規和監管做法可能與他們擁有、出售或以其他方式處置我們的普通股並獲得我們普通股的股息和類似的現金或實物分配(包括清算收益的股息
和股票股息)或基於從出資中支付的資本減少或準備金的普通股分配以及税法規定的後果相關。美國或愛爾蘭的法規和監管實踐。
美國聯邦所得税對美國持有者的重大影響
以下是對持有和處置我們普通股對美國持有者的重大聯邦所得税後果的描述,定義如下。它沒有描述可能與特定個人收購普通股決定相關的所有税收
後果。
本討論僅適用於出於美國聯邦所得税目的而持有普通股作為資本資產的美國持有者(通常是為投資而持有的財產)。此外,它不描述除美國聯邦所得税後果以外的任何税收後果,包括州和地方税後果以及遺產税後果,也沒有描述根據美國持有人的特殊情況可能相關的所有美國聯邦所得税後果,包括替代最低税收後果、被稱為聯邦醫療保險繳費税的法規條款的潛在應用、法規第451(B)節下的特殊税務會計規則、和適用於美國持有者的税收後果,但須遵守特別規則,例如:
|
•
|
某些銀行、保險公司和其他金融機構;
|
|
•
|
採用按市值計價的税務會計方法的經紀商、交易商或者證券交易商;
|
|
•
|
作為跨境、洗牌出售、轉換交易或其他綜合交易的一部分持有普通股的人,或者就普通股訂立推定出售協議的人;
|
|
•
|
美國聯邦所得税的本位幣不是美元的人;
|
|
•
|
按美國聯邦所得税規定歸類為合夥企業或S公司的實體或安排(及其投資者);
|
|
•
|
免税實體,包括“個人退休賬户”或“Roth IRA”,或政府實體;
|
150
目錄表
|
•
|
房地產投資信託或受監管的投資公司;
|
|
•
|
前美國公民或在美國的長期居民;
|
|
•
|
擁有或被視為擁有我們股份投票權或價值10%或以上的人;或
|
|
•
|
與在美國境外進行的貿易或業務有關或與在美國境外的常設機構或其他固定營業地點有關而持有普通股的人。
|
如果按照美國聯邦所得税的目的被歸類為合夥企業的實體或安排持有普通股,則合夥企業的美國聯邦所得税待遇通常取決於合夥人的地位和合夥企業的活動。持有普通股的合夥企業和此類合夥企業的合夥人應諮詢他們的税務顧問,瞭解在他們的情況下擁有和處置普通股的特殊美國聯邦所得税後果。
本討論的基礎是《法典》、行政聲明、司法裁決、最終的、臨時的和擬議的美國財政部條例,以及愛爾蘭和美國之間的所得税條約,或條約,所有這些都可能發生變化或有不同的解釋,可能具有追溯效力。
“美國持有者”是指就美國聯邦所得税而言,是普通股的實益所有人、有資格享受本條約利益的持有者,並且:
|
•
|
在美國居住的公民或個人;
|
|
•
|
在美國、美國任何州或哥倫比亞特區的法律下設立或組織的公司或其他應作為公司徵税的實體;或
|
|
•
|
其收入應繳納美國聯邦所得税的財產或信託,無論其來源如何。
|
適用於自2021年12月28日或之後開始的納税年度的美國財政部法規或《外國税收抵免條例》可能在某些情況下禁止美國人就某些根據適用的所得税條約不可抵免的非美國税收申請外國税收抵免。美國國税局最近發佈的通知表明,美國財政部和國税局正在考慮修訂《外國税收抵免條例》,並提供某些條款的臨時救濟,直到國税局發佈隨後的通知或其他指導,撤回或修改臨時減免
(或相關通知或指導中指定的任何較晚日期)。此
討論不適用於這種特殊情況下的投資者。
被動型外國投資公司規則
根據該守則,在任何課税年度,在對我們的子公司實施某些“透視”規則後,如果(I)我們的總收入的75%或更多由“被動收入”組成,或(Ii)我們的資產的平均季度價值的50%或更多由產生或為產生“被動收入”而持有的資產組成,則我們將成為PFIC。就上述計算而言,吾等將被視為持有吾等直接或間接擁有該等公司至少25%股份(按價值計)的任何其他公司的資產比例,並直接收取其收入的比例份額。被動收入
通常包括股息、利息、租金、某些非主動特許權使用費和資本收益。根據我們目前的業務、收入、資產以及某些估計和預測,包括我們資產的相對價值,包括基於我們普通股價格的商譽,我們認為,由於我們確認的利息收入(根據PFIC規則,這是被動收入)以及我們沒有產生
其他主動收入,我們認為我們在2023納税年度是PFIC。此外,我們預計將在2024年確認利息收入,因此,我們預計我們很可能在2024年成為PFIC,並可能在未來的納税年度成為PFIC。然而,由於我們的PFIC地位是實際的年度確定,只有在相關納税年度結束後才能做出決定,因此我們在2024年或任何未來納税年度的PFIC地位是不確定的。如果我們是美國持有人持有普通股的任何年度的PFIC,我們通常會在該持有人持有普通股的後續所有年份中繼續被視為PFIC,即使我們不再符合PFIC地位的門檻要求,除非美國持有人作出“視為出售”
選擇,這將允許美國持有人在某些情況下取消持續的PFIC地位,但要求美國持有人確認根據下文所述的一般PFIC規則徵税的收益。潛在投資者只有在願意承擔與投資PFIC相關的美國聯邦所得税後果的情況下,才應投資於我們的普通股。
151
目錄表
如果我們在任何課税年度是PFIC,而我們擁有或被視為擁有股權的任何子公司或其他公司也是PFIC(任何此類實體在此被稱為“低級PFIC”),美國持有者將被視為擁有每個低級PFIC按比例的股份(按價值計算),並將根據關於
(I)低級PFIC的某些分配的後續段落中描述的規則繳納美國聯邦所得税;以及(2)處置較低級別的私募股權投資公司的股份,在每一種情況下,視為該持有人直接持有此類股份,即使該持有人不會收到這些分配或處置的收益。
如果我們是任何納税年度的PFIC,在任何納税年度內,美國持有者持有我們的任何普通股,該持有者通常將受到不利的税收後果。通常,在我們普通股的處置(在某些情況下,包括質押)時確認的收益將在美國持有者持有普通股的期間按比例分配。分配到應納税處置年度和我們成為PFIC之前的年份的金額將作為普通收入徵税。分配給其他課税年度的金額將按該課税年度對個人或公司(視情況而定)的最高税率徵税,並將對該金額徵收利息
費用。此外,如果美國持有人於應課税年度收到的任何普通股分派超過該等股份於前三年或該持有人持有期(以較短者為準)的年度分派平均值的125%,則該等分派將按與收益相同的方式課税。
或者,如果我們是PFIC,並且普通股在“合格交易所”“定期交易”,如果美國持有者在持有我們普通股的第一個納税年度結束時就普通股做出按市值計價的選擇,則該美國持有者可以避免上文討論的一般PFIC税收後果。普通股的上市地納斯達克就是達到這一目的的合格交易所
。一旦做出選擇,未經美國國税局同意,不得撤銷選擇,除非普通股停止流通。
如果美國持有人就我們是PFIC的第一個納税年度進行了按市值計價的選擇,並且美國持有人持有我們的普通股,則在我們是PFIC的每個納税年度結束時,該持有人一般會將該持有人普通股公平市值的任何超額部分確認為普通收入。並將於該課税年度結束時,就普通股經調整的
計税基準超出其公平市值的任何超額部分(但僅限於先前因按市值計價而計入的收入淨額)確認普通虧損。美國持有者在其普通股中的計税基礎將進行調整,以反映這些收益或虧損金額。在我們是PFIC的一年內,在出售或以其他方式處置普通股時確認的任何收益將被視為普通收入,任何虧損將被視為普通虧損(但僅限於之前因按市值計價選舉而計入的收入淨額)。在我們不是PFIC的一年內,在出售或以其他方式處置普通股時確認的任何收益或損失將
一般按以下“-出售或以其他方式處置普通股”中描述的方式徵税。此次選舉不適用於我們的任何非美國子公司。因此,儘管普通股按市值計價,美國持股人仍可根據PFIC超額分派制度就任何較低級別的PFIC繳納税款
。
此外,如果我們在支付股息的任何課税年度或上一納税年度是PFIC,則下面討論的有關支付給
某些非公司美國持有人的股息的優惠股息率將不適用。
如果一家作為PFIC的公司向美國持有人提供了某些信息,那麼美國持有人可以通過在該公司被視為相對於美國持有人的PFIC的第一個納税年度中的“合格選舉基金”(“QEF
選舉”)來避免上述某些不利的税收後果。美國持有人必須在美國持有人及時提交的美國聯邦所得税申報單上附上一份正確填寫的每個PFIC的獨立IRS表格8621,從而為每個PFIC進行QEF選舉。
152
目錄表
我們將努力為美國持有人在2023課税年度就我們進行QEF選舉提供必要的信息,如果我們認為我們在接下來的任何一年
是PFIC,我們目前打算在該年度提供這些信息,但不能保證我們會及時提供這些信息。此外,即使我們及時提供關於我們和任何全資子公司的這些信息,我們也可能
無法提供關於非全資較低級別PFIC的信息(如果有)。也不能保證我們將來會及時瞭解我們作為PFIC的身份,或者知道美國持有者為了做出有效的選擇而需要提供的信息。
如果美國持有人就一個PFIC進行QEF選舉,美國持有人將就該實體為PFIC的每個課税年度的普通收益和淨資本利得(分別按普通收入和資本利得率)按比例徵税。如果美國持有人就我們進行QEF選舉,我們從我們的收入和利潤中支付的任何分配,以前包括在美國持有人在QEF選舉下的
收入中,將不向美國持有人徵税。美國持有者將在其普通股中增加相當於QEF選舉中包括的任何收入的税基,並將在普通股上分配的不包括在美國持有者的收入中的任何金額
減去其計税基礎。此外,美國持股人將確認出售普通股的資本收益或虧損,其金額等於以美元確定的普通股變現金額與美國持有者調整後的普通股計税基礎之間的差額。美國持有人應注意,如果他們就我們或任何較低級別的PFIC選擇QEF,他們可能被要求在任何納税年度就其普通股支付美國聯邦所得税
,大大超過該納税年度普通股的現金分配。美國持有者應就在他們的特殊情況下進行QEF選舉諮詢他們的税務顧問。
美國持有者應就我們是否為PFIC以及可能適用PFIC規則的問題諮詢他們的税務顧問。
如果美國持有人在我們是PFIC的任何一年或在較低級別的PFIC中持有直接或間接股權的任何年度內擁有普通股,美國持有人通常必須就每個此類PFIC提交
IRS Form 8621年度報告,其中包含美國財政部可能要求的信息,通常包括美國持有人相關年度的美國聯邦所得税申報單。如果美國持有人未能提交年度報告,則該美國持有人的美國聯邦所得税申報單的訴訟時效將保持開放狀態,直至美國持有人提交年度報告後的三年為止。在此期間,美國持有人的整個美國聯邦所得税申報單的訴訟時效將保持開放狀態。
潛在的美國持有者應就我們的PFIC身份對普通股投資的後果諮詢他們的税務顧問。
分派的課税
以下內容以上文“被動型外國投資公司規則”下的討論為準。正如上文在“第8項.財務信息-A.合併報表和其他財務信息--股利和股利政策”中所討論的,我們目前預計不會對我們的普通股進行分配。如果我們確實分配了現金或其他財產,普通股支付的分配,除按比例分配普通股外,通常將被視為從我們當前或累積的收益和利潤(根據美國聯邦所得税原則確定)中支付的股息。由於我們不根據美國聯邦所得税原則對我們的收入和利潤進行
計算,因此我們預計分配通常將作為股息報告給美國持有者。然而,根據上文“被動外國投資公司”
中的討論,非公司的美國持有者應該預料到,如果有股息,很可能沒有資格享受優惠税率。
股息的數額將包括我們在愛爾蘭所得税方面預扣的任何金額。股息金額將被視為美國持有者的外國股息收入,根據該準則,
將沒有資格享受美國公司通常可獲得的股息扣減。紅利將在美國持有者收到紅利之日計入美國持有者的收入。以歐元支付的任何股息收入的金額將是參考實際收到或推定收到之日生效的匯率計算的美元金額,無論當時支付是否實際上已兑換成美元。
如果股息在收到之日轉換為美元,則美國持有者不應被要求確認股息收入的外幣收益或損失。如果股息在收到之日後兑換成美元,美國持有者可能會有外幣收益或損失。
153
目錄表
根據適用的限制(其中一些限制因美國持有者的特殊情況而異),從普通股股息中預扣的愛爾蘭所得税(税率不超過條約規定的税率)將抵免美國持有者的美國聯邦所得税義務。管理外國税收抵免的規則很複雜,美國持有者應諮詢他們的税務顧問,瞭解在他們特定情況下外國税收的抵免能力。美國持有者在計算其應納税所得額時,可以在選擇時扣除外國税,包括任何愛爾蘭所得税,而不是申請外國税收抵免,但受美國法律普遍適用的
限制。選擇扣除外國税款而不是申請外國税收抵免適用於在該納税年度內支付或應計的所有外國税款。
出售或以其他方式處置普通股
以下內容以上文“被動型外國投資公司規則”下的討論為準。
美國持有者在出售或以其他方式處置普通股時實現的收益或損失將是資本收益或損失,如果美國持有者在出售或其他處置之日對該普通股的持有期
超過一年,則將是長期資本收益或損失。收益或損失的金額將等於美國持有者在出售的普通股中的納税基礎與處置的變現金額之間的差額,兩者均以美元確定。非公司美國持有者確認的長期資本收益適用於美國聯邦所得税,税率低於適用於普通收入和短期資本收益的税率,而短期資本收益適用於普通收入的税率適用於美國聯邦所得税。然而,根據上文“被動型外國投資公司”的討論,美國持有者應預期,出售普通股或其他應税處置所確認的任何收益很可能不會被視為長期資本收益。對於外國税收抵免而言,這種收益或損失通常是來自美國的收益或損失。資本損失的扣除額受到各種限制。
信息報告和備份扣繳
在美國境內或通過某些與美國相關的金融中介支付的股息和銷售收益通常需要進行信息報告,並可能
受到備用扣繳的約束,除非(I)美國持有人是公司或其他豁免收款人,或(Ii)在備用扣繳的情況下,美國持有人提供正確的納税人識別號碼並證明其不受備用扣繳的
約束。
向美國持有人支付的任何備用預扣金額將被允許作為美國持有人的美國聯邦所得税債務的抵免,並有權獲得退款,前提是
及時向IRS提供所需信息。
關於外國金融資產的信息
美國持股人應諮詢他們的税務顧問,瞭解本立法對其普通股的所有權和處置的影響(如果有)。
愛爾蘭物質税收後果
以下是愛爾蘭對普通股某些實益持有人的重大税收後果的摘要。本摘要以愛爾蘭税法和愛爾蘭税務專員在本年度報告發布之日起生效的做法以及與愛爾蘭税務專員的通信為依據。法律和/或行政慣例的改變可能會導致下列税務考慮因素的改變,
可能具有追溯力。
154
目錄表
摘要不構成税務建議,僅作為一般指南。摘要並不詳盡,普通股持有者應就與普通股收購、所有權和處置相關的愛爾蘭税收後果(以及其他相關司法管轄區法律下的税收後果)諮詢他們自己的税務顧問。摘要僅適用於將擁有普通股作為資本資產的股東
,不適用於其他類別的股東,例如證券交易商、受託人、保險公司、集體投資計劃以及已經或被視為通過愛爾蘭辦事處或就業(在愛爾蘭執行或經營)獲得普通股的股東。
應課税或應課税收益
愛爾蘭現行的應課税收益税率(如果適用)為33%。
非愛爾蘭居民或通常居住於愛爾蘭的股東出售我們的普通股,不會就出售該等普通股而獲得的任何應課税收益產生愛爾蘭税,除非該等普通股用於該股東在愛爾蘭通過分支機構或代理機構進行的交易或為該分支機構或代理機構的使用或目的而使用、持有或收購,或該等股票的大部分價值來自愛爾蘭土地。
持有我們普通股的個人且暫時不在愛爾蘭居住,根據愛爾蘭反避税法律,在該個人為非居民期間出售我們普通股所實現的任何應課税收益可能需要繳納愛爾蘭税。
印花税
將GH Research PLC的股份從實益持有股份的賣方(即通過DTC)轉讓給通過DTC持有所收購股份的買方將不需要繳納愛爾蘭印花税
(除非轉讓涉及作為轉讓股份的記錄持有人的代名人的變更)。
由直接持有股份的賣方將GH Research PLC的股份轉讓給任何買方,或由以實益方式持有股份的賣方將股份轉讓給直接持有所收購股份的買方,可
繳納愛爾蘭印花税(目前的税率為所支付價格或所收購股份市值的1%,如果更高)。印花税一般由買方或受讓人承擔。直接持有GH Research PLC股票的股東可以將這些股票轉移到他或她自己的經紀人賬户中(反之亦然),而不會因轉讓而產生愛爾蘭印花税,前提是轉讓不會導致股票的最終實益所有權發生變化,而且轉讓
不考慮出售股票。為了從這項豁免印花税中獲益,賣方必須向GH Research PLC的轉讓代理確認,轉讓股份的最終實益所有權沒有因轉讓而改變,而且轉讓並不是在考慮出售股份。
由於轉讓GH Research PLC的股份可能會徵收愛爾蘭印花税,任何希望收購GH Research PLC股份的人都應考慮通過DTC收購該等股份。
股息預提税金
我們預計在可預見的未來不會有紅利。就我們支付股息(或為愛爾蘭税收目的而被視為“分配”的其他股東回報)而言,應注意的是,如果我們作出的此類分配沒有許多豁免中的一項,我們將被徵收愛爾蘭股息預扣税,在本年報中稱為DWT,目前税率為25%。
就DWT而言,分配包括我們可能向股東進行的任何分配,包括現金股息、非現金股息和代替現金股息的額外股票
。如果豁免不適用於向特定股東進行的分配,我們有責任在進行此類分配之前扣留DWT。
一般豁免
以下是對我們可能在不扣除DWT的情況下支付股息的總體概述。
155
目錄表
愛爾蘭國內法律規定,非愛爾蘭居民股東如果從我們收到的股息中受益且符合以下任一條件,則無需繳納分紅税:
|
•
|
為納税目的在相關地區(包括美國)居住,但既不是愛爾蘭居民也不是通常居民的個人(目前的有關地區名單為:阿爾巴尼亞、亞美尼亞、澳大利亞、奧地利、巴林、白俄羅斯、比利時、波斯尼亞和黑塞哥維那、博茨瓦納、保加利亞、加拿大、智利、中國、克羅地亞、塞浦路斯、捷克共和國、丹麥、埃及、愛沙尼亞、埃塞俄比亞、芬蘭、法國、格魯吉亞、德國、加納、希臘、香港、匈牙利、冰島、印度、以色列、意大利、日本、哈薩克斯坦、肯尼亞、韓國、科索沃、科威特、拉脱維亞、立陶宛、盧森堡、馬其頓、馬來西亞、馬耳他、墨西哥、摩爾多瓦、黑山、摩洛哥、荷蘭、新西蘭、挪威、巴基斯坦、巴拿馬、波蘭、葡萄牙、卡塔爾、羅馬尼亞、俄羅斯、沙特阿拉伯、塞爾維亞、新加坡、斯洛伐克共和國、斯洛文尼亞、南非、西班牙、瑞典、瑞士、泰國、土耳其共和國、烏克蘭、阿拉伯聯合酋長國、英國、美國、烏茲別克斯坦、越南和贊比亞);
|
|
•
|
為納税目的不在愛爾蘭居住,但為納税目的在有關領土居住的公司,只要該公司不受居住在愛爾蘭或正在居住於愛爾蘭的人的直接或間接控制;
|
|
•
|
不是愛爾蘭居民的公司,由有關領土居民直接或間接控制,並且(視情況而定)直接或不受非有關領土居民控制。
|
|
•
|
不是愛爾蘭居民的公司,其主要類別的股票(或其75%的直接或間接母公司的股票)在愛爾蘭的證券交易所、相關領土的公認證券交易所或愛爾蘭財政部長批准的其他證券交易所進行大量和定期的交易;或
|
|
•
|
不是愛爾蘭居民的公司,由兩家或兩家以上公司直接或間接全資擁有,其中每家公司的主要股票類別在愛爾蘭的證券交易所、相關領土的公認證券交易所或愛爾蘭財政部長批准的其他證券交易所進行實質性和定期交易,
|
並在上述所有情況下,吾等已於有需要時收到股東於派發股息前的有關繳費表格(S),而該等繳費表格(S)仍然有效。
對於不能享受愛爾蘭國內法豁免的非愛爾蘭居民股東,這些股東可能會依靠愛爾蘭加入的雙重税收條約的條款來降低DWT税率。
然而,我們的股東如果不屬於上述任何類別,則可能屬於DWT的其他豁免範圍(如果需要履行某些行政義務,則受約束)。如果任何股東獲得免税,但獲得受免税限制的股息,該等股東可向愛爾蘭税務專員申請退還該等免税。
普通股支付股息的所得税
某些人從愛爾蘭居民公司獲得的股息可能會產生愛爾蘭所得税。如果股東不是愛爾蘭居民,或者在個人情況下,通常居住在愛爾蘭,並且有權獲得免税,則通常不需要繳納愛爾蘭所得税或從我們那裏獲得的股息的普遍社會費用。這一立場的例外情況可能適用於該股東通過愛爾蘭的分支機構或代理機構持有我們的普通股的情況,通過該分支機構或機構進行交易。
如果股東不是愛爾蘭居民或通常居住在愛爾蘭,並且沒有資格獲得免徵遺產税,則一般不會承擔額外的愛爾蘭所得税責任,也不需要繳納一般社會費用。我們扣除的DWT免除了繳納所得税的義務。這一情況的例外情況可能適用於股東通過愛爾蘭的分支機構或機構持有我們的普通股,通過該分支或機構進行交易。
156
目錄表
資本購置税
愛爾蘭資本收購税,或CAT,主要包括贈與税和遺產税。CAT可以適用於我們普通股的贈與或繼承,而無論當事人的居住地、通常住所或住所。這是因為我們的普通股就愛爾蘭貓而言被視為位於愛爾蘭的財產,因為我們的股票登記必須在愛爾蘭持有。接受禮物或遺產的人對CAT負有
主要責任。
CAT的税率比某些免税門檻高出33%。適當的免税門檻取決於(1)捐贈人和受贈人之間的關係,以及(2)受贈人從同一組門檻內的人那裏收到的以前的應税贈與和應税遺產的價值的總和。同一婚姻的配偶或同一民事合夥關係的民事伴侶之間的贈與和繼承不受《禁止酷刑法》的約束。子女從父母那裏獲得的應税禮物或遺產的免税門檻為335,000歐元。我們的股東應該諮詢他們自己的税務顧問,在計算任何國內納税義務時,CAT是否可抵扣或可抵扣。
CAT還有一項“小額禮物豁免”,即受贈人在每個日曆年度從任何捐贈者那裏獲得的所有應税禮物的前3,000歐元免税,而且也不包括在未來的任何彙總中。這項豁免不適用於繼承。
以上概述的愛爾蘭税務考慮因素僅供一般參考。我們普通股的持有者應向他們的税務顧問諮詢愛爾蘭的税務後果,包括與我們普通股的收購、所有權和處置有關的問題。
|
F.
|
股息和支付代理人
|
不適用。
|
G.
|
專家發言
|
不適用。
|
H.
|
展出的文件
|
我們必須遵守《交易法》的信息要求。因此,我們被要求向美國證券交易委員會提交報告和其他信息,包括Form 20-F的年度報告和Form 6-K的報告。美國證券交易委員會有一個網站www.sec.gov,其中包含我們以電子方式提交給美國證券交易委員會的報告、委託書和信息聲明以及其他信息。作為一家外國私人發行人,根據《交易所法案》,我們不受有關委託書的提供和內容的規則的約束,我們的高管、董事和主要股東也不受《交易所法案》第16節所載的報告和短期週轉利潤回收條款的約束。此外,根據交易法,我們不需要像其證券根據交易法註冊的美國公司那樣頻繁或及時地向美國證券交易委員會提交定期報告和財務報表。
此外,根據愛爾蘭法律,本年度報告的副本和任何已經或可能通過引用納入本年度報告的信息,應在任何合理時間免費提供給
任何登記在冊的股東在我們位於都柏林道森街2號Joshua Dawson House,D02 RY95,愛爾蘭的主要營業地點查閲。
我們還在我們的網站上免費提供我們的年報和Form 6-K報告的文本,包括對這些報告的任何修改,以及某些其他美國證券交易委員會備案文件,在它們以電子方式提交給美國證券交易委員會或提交給美國證券交易委員會後,在合理的可行範圍內儘快
。我們的網站地址是www.ghres.com。對本網站的引用僅為非活動文本參考,其中包含的信息或與其相關的信息不會納入本年度報告。
157
目錄表
|
I.
|
子公司信息
|
有關我們子公司的信息,請參閲本年度報告的“第四項--公司-C組織結構信息”和附件8.1。
|
J.
|
給證券持有人的年度報告
|
如果我們被要求根據Form 6-K的要求向證券持有人提供年度報告,我們將按照《埃德加文件手冊》以電子格式向證券持有人提交年度報告。
|
第11項。
|
關於市場風險的定量和定性披露
|
外匯風險
我們在國際上開展業務,面臨各種貨幣風險帶來的外匯風險,主要涉及美元、歐元和英鎊。
產生交易風險的原因是,以外幣計價的交易中支付或收到的當地貨幣金額可能因匯率變化而有所不同。外匯風險
產生於:
|
•
|
以實體本位幣以外的貨幣計價的預測費用;以及
|
|
•
|
確認的資產和負債以實體的本位幣以外的貨幣計價。
|
我們的現金和現金等價物、其他金融資產和有價證券主要以美元維持,我們的子公司面臨外匯風險,因為其功能貨幣是歐元。我們的子公司持有大量現金存款和其他以美元計價的金融資產。因此,未來歐元和美元匯率的變化將使本集團面臨貨幣收益或虧損,這將影響報告的收入和支出金額,影響可能是重大的。
在截至2023年12月31日的一年中,我們確認了260萬美元的匯兑損失,而截至2022年12月31日的一年的外匯收益為720萬美元。匯兑損失主要是由於本年度美元兑歐元走弱,導致子公司持有的美元現金和其他金融資產的折算虧損。外匯匯率的變動可能會對我們產生積極或消極的影響,影響可能是實質性的。
我們認為,目前沒有必要簽訂具體的合同,以減少外匯匯率變化的風險,例如通過簽訂期權或遠期合同。我們未來可能會考慮使用期權或遠期合約來管理貨幣交易風險。
截至2023年12月31日,如果在所有其他變量保持不變的情況下,美元兑歐元貶值/升值10%,本年度的税前虧損將比2022年12月31日的850萬美元高/低640萬美元
,這主要是由於我們的子公司GH Research愛爾蘭有限公司以美元持有的現金和其他金融資產以美元換算,其功能貨幣為歐元。
信用風險
信用風險是指交易對手不履行金融工具或客户合同規定的義務,導致財務損失的風險。我們主要面臨現金和現金等價物、其他金融資產和有價證券的信用風險。我們的現金餘額由久負盛名、評級較高的金融機構維持。截至2023年12月31日,現金餘額存放在S最低信用評級為A-的三家銀行。截至2023年12月31日,我們持有投資級債券和貨幣市場基金(“投資組合”)的投資。如果交易對手違約,這些投資將面臨信用風險。我們不會
投資於股票工具或衍生品,而且所有債券都不會超過投資組合價值的3%。
158
目錄表
利率風險
利率風險是指金融工具的價格因利率波動而發生變化,從而導致財務損失的風險。我們的
有價證券面臨利率風險。如果另類投資的利率上升,我們的有價證券的價值將在短期內下降。
截至2023年12月31日,在所有其他變量保持不變的情況下,如果利率上升/下降50個基點,由於集團有價證券的公允價值變動,集團的總綜合虧損將高/低70萬美元(2022年:高/低110萬美元)。
流動性風險
流動性風險是指我們可能無法產生足夠的現金資源來全額償還到期債務的風險,或者只能以具有重大不利條件的條款這樣做的風險。謹慎的流動性風險管理意味着保持足夠的現金來滿足營運資本要求。現金由管理層監控。
我們的董事會和管理層定期審查資金和流動性風險。我們通過籌集資金來滿足我們的資本需求。
|
第12項。
|
除股權證券外的其他證券説明
|
|
A.
|
債務證券
|
不適用。
|
B.
|
認股權證和權利
|
不適用。
|
C.
|
其他證券
|
不適用。
|
D.
|
美國存托股份
|
不適用。
第II部
|
第13項。
|
違約、拖欠股息和拖欠股息
|
不適用。
|
第14項。
|
對擔保持有人的權利和收益的使用作出實質性修改
|
不適用。
|
第15項。
|
控制和程序
|
|
A.
|
披露控制和程序
|
在公司首席執行官和財務副總裁的參與下,公司管理層已對公司披露控制的有效性進行了評估,
程序(如交易法規則13 a-15(e)所定義),截至2023年12月31日。根據這些評估,我們的首席執行官和財務副總裁得出結論,這些披露控制和程序在
本年度報告所涵蓋的期間結束時。任何披露控制和程序系統的有效性都存在固有的侷限性,包括人為錯誤以及規避或推翻控制的可能性
和程序因此,即使是有效的披露控制和程序也只能為實現其控制目標提供合理的保證。
159
目錄表
|
B.
|
管理層財務報告內部控制年度報告
|
我們的管理層負責建立和維護對財務報告的充分內部控制,如交易法第13 a-15(f)和15 d-15(f)條所定義。此規則
將財務報告內部控制定義為由公司主要執行官和主要財務官設計或監督,並由董事會、管理層和其他人員實施的過程,
根據國際會計準則理事會('IASB')發佈的IFRS,為財務報告的可靠性和為外部目的編制財務報表提供合理保證,包括
這些政策和程序,(1)有關維護記錄,以合理的細節,準確和公正地反映交易和處置的公司的資產;(2)提供合理的保證,交易
根據國際財務報告準則編制財務報表所必需的記錄,並且公司的收入和支出僅根據公司管理層和董事的授權進行;以及
(3)提供合理的保證,防止或及時發現未經授權的收購,使用或處置公司的資產,可能會對財務報表產生重大影響。
我們的管理層評估了截至2023年12月31日財務報告內部控制的有效性。此評估是在我們的主管的指導和監督下進行的
執行官和我們的財務副總裁,並根據特雷德韋委員會贊助組織委員會(COSO)發佈的內部控制綜合框架(2013年)中制定的標準。
根據該評估,管理層(包括首席執行官和財務副總裁)得出結論,由於我們對財務的內部控制存在重大缺陷,
由於下文所述的財務報告,我們對財務報告的內部控制於2023年12月31日尚未生效。
在編制和審閲截至2023年12月31日止年度的財務報表時,我們發現了財務內部控制的重大缺陷
報告.我們確定,我們缺乏足夠數量的訓練有素的專業人員,他們具有適當的會計知識、培訓和經驗:
|
•
|
設計和維護正式的會計政策、程序和對財務報表公允列報的控制;以及
|
|
•
|
設計和維護對賬户對賬、日記帳分錄和財務報表的編制和審查的控制,包括對信息技術系統保持適當的職責分工和控制。
|
該等監控缺陷並未導致我們的年度或中期財務報表出現重大錯誤陳述。然而,這些控制缺陷中的每一個都可能導致我們的
因此,我們確定這些控制缺陷構成重大缺陷。
補救工作
我們致力於補救導致重大缺陷的監控缺陷。我們採取了措施來彌補之前披露的重大缺陷,實施了
公司範圍內的控制計劃,並繼續採取措施,以加強我們的內部控制。於截至二零二三年十二月三十一日止年度,我們已採取多項措施解決重大弱點,包括以下各項:
|
•
|
聘請了更多的專業人員,以提高我們會計和財務團隊的深度和能力,並加強了與職責分離有關的整體監督和審查程序,
財務報告、財務流程和程序以及總體內部控制程序;
|
|
•
|
對所有重要賬户實施業務流程級控制;以及
|
|
•
|
實施信息技術系統,以支持我們對財務報告流程和程序的內部控制,包括職責分工。
|
160
目錄表
儘管我們在整個年度取得了實質性進展,但在解決年度評估中發現的控制缺陷方面,直到補救過程完成並完成所需的
儘管財務報告的內部控制已得到充分實施並運行了足夠長的時間,從而能夠得出控制有效的結論,但上述重大缺陷將繼續存在。
儘管存在上述重大缺陷,但我們相信,本年度報告中的綜合財務報表在所有重大方面均公允地反映了我們的
財務狀況、經營成果和現金流量,按照國際財務報告準則的規定,在報告日期和報告期間內。
|
C.
|
註冊會計師事務所認證報告
|
本年度報告不包括本公司註冊會計師事務所的認證報告,因為根據《就業法案》,我們是一家新興成長型公司。
|
D.
|
財務報告內部控制的變化
|
在截至2023年12月31日的年度內,對財務報告的內部控制(如交易法規則13a-15(F)的定義)沒有發生任何變化,這將對或很可能對我們的財務報告內部控制產生重大影響。
|
第16項。
|
[已保留]
|
|
A.
|
審計委員會財務專家
|
我們的董事會已經決定,德莫特·漢利、邁克爾·福爾和鄧肯·摩爾都被視為美國證券交易委員會所定義的“審計委員會財務專家”。我們的董事會已確定德莫特·漢利、邁克爾·福爾和鄧肯·摩爾均符合《交易法》規則10A-3所規定的“獨立性”要求。
|
B.
|
道德守則
|
我們已經通過了適用於我們所有員工、高管和董事的商業行為和道德準則。道德準則可在我們的
網站www.ghres.com上找到。我們董事會的審計委員會負責監督道德準則,並需要批准員工、高管和董事對道德準則的任何豁免。我們預計對道德守則的任何實質性修訂將在我們的網站上披露,我們還將在豁免後四個工作日內在我們的網站上公開披露對高管或董事的任何豁免要求。在截至2023年12月31日的年度內,我們沒有為高管或董事批准任何豁免《道德守則》的條款。
|
C.
|
首席會計師費用及服務
|
在截至2023年12月31日和2022年12月31日的年度內,普華永道國際有限公司的愛爾蘭成員事務所普華永道擔任我們的獨立註冊公共會計師事務所。
“普華永道實體”是指本公司的審計機構普華永道會計師事務所,以及屬於普華永道單個公司網絡的所有外國實體。
161
目錄表
下表彙總了截至2023年12月31日和2022年12月31日的年度普華永道實體提供服務的大致費用:
|
在過去幾年裏
|
||||||||
|
十二月三十一日,
|
||||||||
|
2023
|
2022
|
|||||||
|
(單位:千美元)
|
||||||||
|
審計費
|
767
|
547
|
||||||
|
總費用
|
767
|
547
|
||||||
審計費用包括每個財政年度為允許審計師對我們的合併財務報表發表意見和就我們的本地法定財務報表發佈報告而進行的標準審計工作。審計費還包括只能由外部審計師提供的服務,例如審查季度財務結果、同意書和慰問函,以及美國證券交易委員會或其他監管備案文件所需的任何其他審計服務。
審批前的政策和程序
根據薩班斯-奧克斯利法案的要求和美國證券交易委員會發布的規則,我們的審計委員會審查和預先批准我們的
獨立註冊會計師事務所提供的所有審計和允許的非審計服務。該程序要求我們的獨立註冊會計師事務所未來所有擬議的審計和允許的非審計工作在開始任何此類服務之前提交給我們的審計委員會批准。根據這一政策,普華永道實體在首次公開募股後提供的所有服務以及支付給該實體的所有費用都是在我們的審計委員會成立後批准的。
|
D.
|
對審計委員會的上市標準的豁免
|
沒有。
|
E.
|
發行人及關聯購買人購買股權證券
|
於截至2023年12月31日止年度,GH Research PLC或任何聯營買家並無或以其名義購買我們的股權證券。
| F. |
更改註冊人的認證會計師
|
沒有。
|
G.
|
公司治理
|
作為美國證券交易委員會定義的“外國私人發行人”,我們被允許遵循納斯達克證券市場規則第5615(A)(3)條,遵循母國的公司治理實踐,而不是納斯達克要求的美國公司的某些公司治理標準。因此,我們遵循愛爾蘭公司治理規則,而不是納斯達克的某些公司治理要求。選擇遵循本國做法而不是任何此類納斯達克要求的外國私人發行人必須提前向納斯達克提交發行人所在國家的獨立律師的書面聲明,證明發行人的做法不受本國法律的禁止。我們向納斯達克提供了這樣一份關於以下內容的不合規函:
|
•
|
要求保持獨立董事過半數的規則(規則5605(B)(1))。雖然我們目前保留了大多數獨立董事,但我們未來可能會遵循愛爾蘭的法律和做法,根據這一點,我們不需要任命大多數獨立董事。
|
|
•
|
要求我們的獨立董事定期安排只有獨立董事出席的會議的規則(規則5605(B)(2))。相反,我們遵循愛爾蘭法律,根據該法律,獨立董事不需要舉行執行會議。
|
162
目錄表
|
•
|
《關於董事獨立監督董事董事提名過程的規則》(第5605(E)條)。相反,我們遵循愛爾蘭法律和慣例,根據該法律和慣例,我們的董事會推薦
名董事供我們的股東選舉/連任。
|
|
•
|
設立或修訂某些基於股權的薪酬計劃必須獲得股東批准(規則5635(C)),將導致公司控制權變更的發行(規則5635(B)),涉及發行公司20%或更多權益的公開發行以外的某些交易(規則5635(D)),以及收購另一公司的股票或資產(規則5635(A))。相反,我們
遵循愛爾蘭法律和慣例批准這類程序,根據這一程序,董事會的批准在某些情況下可能就足夠了,這取決於根據我們的
憲法規定,現有發行股票的一般當局的到位程度。
|
|
•
|
要求薪酬委員會至少由兩名獨立董事組成的規則(第5605(D)(2)條)。我們有一個薪酬委員會,我們稱之為薪酬委員會,為了保持更大的靈活性,我們可以任命誰進入薪酬委員會,我們轉而遵循愛爾蘭法律,該法律不要求我們有一個獨立的薪酬委員會。
|
|
•
|
法定人數為33人的規則1/3%於任何股東大會(第5620(C)條)。相反,我們遵循我們
憲法中要求25%的法定人數的規定。
|
詳情見“項目6.董事、高級管理人員和僱員”和“項目10.補充資料--B.組織備忘錄和章程”。
|
H.
|
煤礦安全信息披露
|
不適用。
|
I.
|
關於妨礙檢查的外國司法管轄區的披露
|
不適用。
|
J.
|
內幕交易政策
|
不適用。
|
K.
|
網絡安全
|
網絡安全風險管理是我們整體企業風險管理戰略的組成部分。作為一家年輕且快速發展的公司,鑑於網絡安全風險不斷變化的本質,我們定期審查並尋求改進我們應對網絡安全風險和威脅的戰略。我們的網絡安全風險管理方法涉及識別、監控、評估和響應網絡安全威脅和事件,促進公司不同部門之間的協調,並酌情將管理層內部和董事會的問題上報。
我們聘請第三方IT服務提供商幫助我們實施和運行旨在識別、評估、管理和緩解網絡安全風險的技術控制
。這包括管理終端、補丁程序、用户訪問和事件,以及IT變更管理。還持續向員工提供網絡安全意識培訓。我們還制定了相應的流程來監督和識別與我們使用第三方供應商和服務提供商相關的網絡安全威脅帶來的風險。
管理層負責持續識別、評估和管理重大網絡安全風險。網絡安全風險管理由我們愛爾蘭董事的聯合創始人兼管理人員
負責,自公司成立以來一直負責IT和網絡安全。我們的財務團隊、我們不定期聘用的專業IT顧問以及我們的第三方IT服務提供商將協助他履行這一職責。管理層定期從我們的第三方IT服務提供商接收有關網絡安全問題的最新信息和報告。管理層每季度向審計委員會提供有關IT、網絡安全風險和應對這些風險的緩解策略的最新信息。
163
目錄表
我們的董事會對企業風險管理負有最終監督責任,包括網絡安全風險管理,並將網絡安全風險管理監督委託給審計委員會。審計委員會每季度召開一次會議,負責審查公司在風險評估和管理方面的方法和做法,包括網絡安全
風險。管理層至少每年向董事會提供有關網絡安全風險的最新情況。此外,如果管理層發現新出現的風險或重大問題,將遵循基於風險的上報流程,在
定期更新週期之外通知審計委員會和董事會。作為這一進程的一部分,任何重大網絡安全事件都將由管理層上報董事會。
儘管我們作出了努力,但我們不能消除網絡安全威脅的所有風險。我們不能保證我們沒有發生未被發現的網絡安全事件,我們也不能保證我們的信息技術系統包含足夠的控制措施,以防止未來發生網絡安全事件。有關這些風險及其對我們公司的影響的更多信息,請參閲:第3項。關鍵信息-D.
風險因素-與員工事務、我們的業務和運營管理相關的風險-網絡攻擊或我們的電信或IT系統中的其他故障,或我們的合作者、CRO、第三方物流或其他服務提供商、
經銷商、供應商或其他承包商或顧問的風險可能導致信息被盜、數據損壞以及我們的業務運營嚴重中斷或不可用“。
第三部分
|
第17項。
|
財務報表
|
我們已經對項目18作出了迴應,而不是這個項目。
|
第18項。
|
財務報表
|
財務報表作為本年度報告的一部分提交,從F-1頁開始。
|
項目19.
|
展品
|
以下文件作為本年度報告的一部分提交。
164
目錄表
展品索引
|
以引用方式成立為法團
|
|
證物編號:
|
*説明
|
表格
|
文件編號
|
證物編號:
|
提交日期
|
|||||
|
1.1
|
生長激素研究PLC的組成
|
20-F
|
001-40530
|
1.1
|
2023年3月9日
|
|||||
|
2.1*
|
證券説明
|
|||||||||
|
4.1
|
GH Research PLC與其中所列股東之間的登記權協議格式
|
F-1/A
|
333-256796
|
10.1
|
2021年6月21日
|
|||||
|
4.2§
|
GH Research PLC股票期權計劃
|
S-8
|
333-270422
|
99
|
2023年3月9日
|
|||||
|
8.1
|
附屬公司名單
|
F-1
|
333-256796
|
21.1
|
2021年6月4日
|
|||||
|
12.1*
|
依照依照2002年《薩班斯-奧克斯利法案》第302節通過的1934年《證券交易法》第13a-14(A)和15d-14(A)條頒發的首席執行官證書
|
|||||||||
|
12.2*
|
根據依照2002年《薩班斯-奧克斯利法案》第302節通過的1934年《證券交易法》第13a-14(A)和15d-14(A)條對首席財務官的證明
|
|||||||||
|
13.1*
|
依據2002年《薩班斯-奧克斯利法案》第906條通過的《美國法典》第18編第1350條對主要行政官員的證明
|
|||||||||
|
13.2*
|
根據2002年《薩班斯-奧克斯利法案》第906條通過的《美國法典》第18編第1350條對首席財務官的證明
|
|||||||||
|
15.1*
|
獨立註冊會計師事務所普華永道同意
|
|||||||||
|
97.1*
|
追回錯誤判給的賠償的政策
|
|||||||||
|
101.INS
|
內聯XBRL實例文檔
|
|||||||||
|
101.SCH
|
內聯XBRL分類擴展架構文檔
|
|||||||||
|
101.CAL
|
內聯XBRL分類擴展計算鏈接庫文檔
|
|||||||||
|
101.DEF
|
內聯XBRL分類擴展定義Linkbase文檔
|
|||||||||
|
101.LAB
|
內聯XBRL分類擴展標籤Linkbase文檔
|
|||||||||
|
101.PRE
|
內聯XBRL分類擴展演示文稿Linkbase文檔
|
|||||||||
|
104
|
封面交互數據文件(嵌入內聯XBRL文檔中)
|
| * |
現提交本局。
|
| § |
管理合同、補償計劃或安排。
|
165
目錄表
簽名
註冊人特此證明,它符合提交20-F表格的所有要求,並已正式安排並授權以下籤署人代表其簽署本年度報告。
|
GH Research PLC
|
|||||
|
日期:
|
2024年3月7日
|
發信人:
|
/S/泰斯·特維
|
||
|
姓名:
|
Theis Terwey
|
||||
|
標題:
|
首席執行官
|
||||
|
發信人:
|
撰稿S/朱莉·瑞安
|
||||
|
姓名:
|
朱莉·瑞安
|
||||
|
標題:
|
總裁副財長
|
||||
166
目錄表
財務報表索引
|
獨立註冊會計師事務所報告(PCAOB ID:)
|
F-2
|
|
截至2023年、2022年和2021年12月31日止年度的綜合全面收益表
|
F-3
|
|
截至2023年和2022年12月31日的合併財務狀況表
|
F-4
|
|
截至2023年12月31日、2022年12月31日和2021年12月31日的綜合權益變動表
|
F-5
|
|
截至2023年、2022年和2021年12月31日的合併現金流量表
|
F-6
|
|
合併財務報表附註
|
F-7
|
F-1
目錄表
獨立註冊會計師事務所報告
致GH Research PLC董事會和股東
對財務報表的幾點看法
本公司已審核所附GH Research PLC及其附屬公司(“貴公司”)截至2023年12月31日、2023年及2022年的綜合財務狀況表,以及截至2023年12月31日止三個年度各年度的相關綜合全面收益表、權益變動表及現金流量表,包括相關附註(統稱為“綜合財務報表”)。我們認為,綜合財務報表在所有重大方面均屬公平呈列。公司截至2023年12月31日和2022年12月31日的財務狀況,以及截至2023年12月31日的三個年度的經營業績和現金流量,符合國際會計準則委員會發布的國際財務報告準則。
意見基礎
這些合併財務報表是公司管理層的責任。我們的責任是根據我們的審計對公司的最新合併財務報表發表意見。我們是一家在美國上市公司會計監督委員會(PCAOB)註冊的公共會計師事務所,根據美國聯邦證券法以及美國證券交易委員會和PCAOB的適用規則和法規,我們必須與公司保持獨立。
我們已經按照PCAOB的標準對這些合併財務報表進行了審計。這些準則要求我們
計劃和執行審計,以獲得關於合併財務報表是否沒有重大錯報的合理保證,無論是由於錯誤還是舞弊。本公司不需要,也沒有聘請我們對其財務報告內部控制進行審計。作為我們審計的一部分,我們被要求瞭解財務報告內部控制,但不是為了對本公司財務報告內部控制的有效性發表意見。因此,我們不發表此類意見。
我們的審計包括執行評估合併財務報表重大錯報風險的程序,無論是由於錯誤還是欺詐,以及執行應對這些風險的程序。這些程序包括在測試基礎上檢查與合併財務報表中的金額和披露有關的證據。我們的審計還包括評估管理層使用的會計原則和重大估計。以及評估綜合財務報表的整體列報情況。我們相信,我們的審計為我們的意見提供了合理的基礎。
/s/普華永道
2024年3月7日
自2021年以來,我們一直擔任公司的審計師。
F-2
目錄表
|
GH研究PLC
|
綜合全面收益表
|
截至的年度
十二月三十一日,
|
||||||||||||||||
|
2023
|
2022
|
2021
|
||||||||||||||
|
注意事項
|
$’000
|
$’000
|
$’000
|
|||||||||||||
|
運營費用
|
||||||||||||||||
|
研發
|
3
|
(
|
)
|
(
|
)
|
(
|
)
|
|||||||||
|
一般事務及行政事務
|
3
|
(
|
)
|
(
|
)
|
(
|
)
|
|||||||||
|
運營虧損
|
(
|
)
|
(
|
)
|
(
|
)
|
||||||||||
|
財政收入
|
5 |
|||||||||||||||
|
財務費用
|
5 |
( |
) | ( |
) | ( |
) | |||||||||
|
預期信貸損失變動情況
|
10 |
( |
) | |||||||||||||
|
外匯(虧損)/收益
|
18
|
(
|
)
|
|
|
|||||||||||
|
其他收入合計
|
||||||||||||||||
|
税前虧損
|
(
|
)
|
(
|
)
|
(
|
)
|
||||||||||
|
税費/(抵免)
|
6
|
|
|
|
||||||||||||
|
本年度虧損
|
(
|
)
|
(
|
)
|
(
|
)
|
||||||||||
|
其他綜合(費用)/收入
|
||||||||||||||||
|
可重新分類為損益的項目
|
||||||||||||||||
|
有價證券的公允價值變動
|
10 | ( |
) | |||||||||||||
|
貨幣換算調整
|
|
(
|
)
|
(
|
)
|
|||||||||||
|
本年度綜合虧損總額
|
(
|
)
|
(
|
)
|
(
|
)
|
||||||||||
|
可歸因於業主:
|
||||||||||||||||
|
本年度虧損
|
(
|
)
|
(
|
)
|
(
|
)
|
||||||||||
|
本年度綜合虧損總額
|
(
|
)
|
(
|
)
|
(
|
)
|
||||||||||
|
每股虧損
|
||||||||||||||||
|
每股基本及攤薄虧損(美元)
|
20 |
(
|
)
|
(
|
)
|
(
|
)
|
|||||||||
合併財務報表的附註是這些合併財務報表的組成部分。
F-3
目錄表
|
GH研究PLC
|
財務狀況合併報表
|
12月31日,
|
||||||||||||
|
2023
|
2022
|
|||||||||||
|
注意事項
|
$’000
|
$’000
|
||||||||||
|
資產
|
||||||||||||
|
流動資產
|
||||||||||||
|
現金和現金等價物
|
8
|
|
|
|||||||||
|
其他金融資產
|
8 |
|||||||||||
|
有價證券
|
10 | |||||||||||
|
其他流動資產
|
9
|
|
|
|||||||||
|
流動資產總額
|
|
|
||||||||||
|
非流動資產
|
||||||||||||
|
有價證券
|
10 | |||||||||||
|
財產、廠房和設備
|
11
|
|
|
|||||||||
|
非流動資產總額
|
|
|
||||||||||
|
總資產
|
|
|
||||||||||
|
負債和權益
|
||||||||||||
|
流動負債
|
||||||||||||
|
貿易應付款
|
12
|
|
|
|||||||||
|
租賃責任
|
14 |
|||||||||||
|
其他流動負債
|
13
|
|
|
|||||||||
|
流動負債總額
|
|
|
||||||||||
| 非流動負債 |
||||||||||||
|
租賃責任
|
14 |
|||||||||||
| 非流動負債總額 |
||||||||||||
|
總負債
|
|
|
||||||||||
|
所有者應佔權益
|
||||||||||||
|
股本
|
15
|
|
|
|||||||||
|
額外實收資本
|
15
|
|
|
|||||||||
|
其他儲備
|
15
|
|
|
|||||||||
|
外幣折算儲備
|
15
|
(
|
)
|
(
|
)
|
|||||||
|
累計赤字
|
(
|
)
|
(
|
)
|
||||||||
|
總股本
|
|
|
||||||||||
|
負債和權益總額
|
|
|
||||||||||
合併財務報表附註是合併財務報表的組成部分
報表
F-4
目錄表
|
GH研究PLC
|
的合併報表 權益變動
|
可歸因於業主
|
||||||||||||||||||||||||
|
股本
|
其他內容
實收資本
|
其他
儲量
|
外國
貨幣
翻譯
保留
|
累計
赤字
|
總計
|
|||||||||||||||||||
|
$’000
|
$’000
|
$’000
|
$’000
|
$’000
|
$’000
|
|||||||||||||||||||
|
注15
|
注15
|
注15
|
注15
|
|||||||||||||||||||||
|
2021年1月1日
|
|
|
|
|
(
|
)
|
|
|||||||||||||||||
|
本年度虧損
|
|
|
|
|
(
|
)
|
(
|
)
|
||||||||||||||||
|
翻譯調整
|
|
|
|
(
|
)
|
|
(
|
)
|
||||||||||||||||
|
本年度綜合虧損總額
|
|
|
|
(
|
)
|
(
|
)
|
(
|
)
|
|||||||||||||||
|
基於股份的薪酬費用
|
||||||||||||||||||||||||
|
企業重組
|
( |
) | ||||||||||||||||||||||
|
發行股本
|
|
|
|
|
|
|
||||||||||||||||||
|
與所有者的交易總額
|
|
|
|
|
|
|
||||||||||||||||||
|
2021年12月31日
|
|
|
|
(
|
)
|
(
|
)
|
|
||||||||||||||||
|
2022年1月1日
|
|
|
|
(
|
)
|
(
|
)
|
|
||||||||||||||||
|
本年度虧損
|
|
|
|
(
|
)
|
(
|
)
|
|||||||||||||||||
|
其他綜合收益/(虧損)
|
( |
) | ( |
) | ||||||||||||||||||||
|
本年度綜合收益/(虧損)總額
|
|
|
|
(
|
)
|
(
|
)
|
(
|
)
|
|||||||||||||||
|
基於股份的薪酬費用
|
|
|
|
|
|
|
||||||||||||||||||
|
與所有者的交易總額
|
|
|
|
|
|
|
||||||||||||||||||
|
2022年12月31日
|
|
|
|
(
|
)
|
(
|
)
|
|
||||||||||||||||
| 2023年1月1日 | ( |
) | ( |
) | ||||||||||||||||||||
|
本年度虧損
|
( |
) | ( |
) | ||||||||||||||||||||
|
其他綜合(虧損)/收入
|
( |
) | ||||||||||||||||||||||
|
本年度綜合(虧損)/收入合計
|
( |
) | ( |
) | ( |
) | ||||||||||||||||||
|
基於股份的薪酬費用
|
||||||||||||||||||||||||
|
行使股票認購權
|
( |
) | ||||||||||||||||||||||
|
與所有者的交易總額
|
||||||||||||||||||||||||
| 2023年12月31日 | ( |
) | ( |
) | ||||||||||||||||||||
合併財務報表附註是合併財務報表的組成部分
報表
F-5
目錄表
|
GH研究PLC
|
合併現金流量表
|
截至的年度
十二月三十一日,
|
||||||||||||||||
|
2023
|
2022
|
2021
|
||||||||||||||
| 注意事項 |
$’000
|
$’000
|
$’000
|
|||||||||||||
|
經營活動的現金流
|
||||||||||||||||
|
本年度虧損
|
(
|
)
|
(
|
)
|
(
|
)
|
||||||||||
|
折舊
|
11
|
|
|
|
||||||||||||
|
基於股份的薪酬費用
|
17
|
|
|
|
||||||||||||
|
財政收入
|
5 |
( |
) | ( |
) | |||||||||||
|
財務費用
|
5 |
|||||||||||||||
|
預期信貸損失變動情況
|
10 | ( |
) | |||||||||||||
|
外匯損失/(收益)
|
18
|
|
(
|
)
|
(
|
)
|
||||||||||
|
營運資金的流動
|
|
|
(
|
)
|
||||||||||||
|
經營活動中使用的現金流量
|
(
|
)
|
(
|
)
|
(
|
)
|
||||||||||
|
已支付財務費用
|
(
|
)
|
(
|
)
|
(
|
)
|
||||||||||
|
收到的財務收入
|
||||||||||||||||
|
用於經營活動的現金淨額
|
(
|
)
|
(
|
)
|
(
|
)
|
||||||||||
|
用於投資活動的現金流
|
||||||||||||||||
|
購置房產、廠房和設備
|
11
|
(
|
)
|
(
|
)
|
(
|
)
|
|||||||||
|
購買有價證券
|
10 | ( |
) | |||||||||||||
|
購買其他金融資產
|
8 |
( |
) | |||||||||||||
| 用於投資活動的現金流 |
( |
) | ( |
) | ( |
) | ||||||||||
|
(用於融資活動)/來自融資活動的現金流
|
||||||||||||||||
|
支付租賃債務
|
14 |
( |
) | |||||||||||||
|
發行股票所得款項
|
15
|
|
|
|
||||||||||||
|
股票發行的交易成本
|
15
|
|
|
(
|
)
|
|||||||||||
|
淨現金流量(用於融資活動)/來自融資活動
|
(
|
)
|
|
|
||||||||||||
|
現金和現金等價物淨額(減少)/增加
|
(
|
)
|
(
|
)
|
|
|||||||||||
|
年初的現金和現金等價物
|
|
|
|
|||||||||||||
|
外匯對現金及現金等價物的影響
|
|
|
(
|
)
|
||||||||||||
|
年終現金和現金等價物
|
|
|
|
|||||||||||||
合併財務報表附註是合併財務報表的組成部分
報表
F-6
目錄表
|
GH研究PLC
|
|
|
合併財務報表附註
|
1. 企業信息
GH Research PLC(“本公司”)於2021年3月29日註冊成立。本公司的註冊辦事處位於Joshua Dawson House,Dawson愛爾蘭都柏林2號大街。公司控制着一家全資子公司:GH Research愛爾蘭有限公司,該公司於2018年10月16日在愛爾蘭都柏林註冊成立。本公司及其附屬公司組成GH研究集團(以下簡稱“集團”或《GH研究》).
The
集團是一家臨牀階段的生物製藥公司,致力於改變精神和神經疾病的治療方法。它最初的重點是開發新型和專利的美布福汀(5-甲氧基-N,N-二甲基色胺,或5-MeO-DMT)療法,用於治療難治性抑鬱症(TRD)患者。其產品組合目前包括一種專有的可吸入美布福汀產品候選產品GH001、一種靜脈注射的專有美布福汀產品候選產品GH002和一種專有的鼻腔內美布福汀產品候選產品GH003。
On
2021年3月29日,GH Research PLC根據愛爾蘭法律註冊成立,根據公司重組成為GH Research愛爾蘭有限公司的最終控股公司,這一重組在附註15“股本和儲備”中有更詳細的描述。
These
合併財務報表已提交董事會,並由董事會批准於3月3日發佈7, 2024.
2. 準備基礎、重大判斷和會計政策
準備的基礎
遵守國際財務報告準則
截至2023年12月31日止年度的綜合財務報表乃根據國際會計準則委員會(IASB)頒佈的國際財務報告準則(IFRS)編制。該等綜合財務報表以美元(“美元”或“美元”)列報,美元是本公司的功能貨幣,亦是本集團的列報貨幣。財務報表乃根據歷史成本慣例編制,但貨幣市場基金及有價證券的所有投資均按公允價值計量,以及按最初授予日期的股份付款計量。
GH Research PLC的註冊被視為採用前身會計方法的資本重組。在前置資產會計項下,本集團結轉先前於GH Research愛爾蘭有限公司的財務報表中所反映的前置資產淨值及負債的賬面價值,並在此基礎上列報可比較結餘。在GH Research PLC成立之前提供的財務信息僅與GH Research愛爾蘭有限公司有關。
本報告中提供的財務信息並不代表《2014年公司法》所界定的完整法定賬户。GH Research PLC截至2023年12月31日的年度法定賬目預計將於2024年11月26日之前提交給公司註冊局。
新的和修訂的國際財務報告準則
於2023年1月1日開始的財政年度內,並無與本集團相關並對綜合財務報表有任何重大影響的新國際財務報告準則、對準則的修訂或解釋屬強制性。尚未生效的新標準、對標準的修訂和解釋被本集團視為
目前不相關,未在此處列出。
F-7
目錄表
持續經營基礎
GH Research是一家臨牀階段的生物製藥公司,開發創新療法。本集團面臨着建立和發展業務所固有的所有風險,包括當前項目能否成功的重大不確定性。本集團自成立以來的經營活動產生了負現金流
,研發費用從本集團活動開始就已產生。
自成立以來,集團一直通過增資為其增長提供資金。該集團擁有不是 截至2023年12月31日的銀行貸款或其他未償債務,租賃負債除外。因此,本集團不會因要求提前償還貸款而面臨流動資金風險。
截至2023年12月31日,集團的現金及現金等價物為#美元78.4 百萬美元(2022年12月31日:美元166.0 百萬)。該集團還持有#美元的有價證券。88.7 百萬美元和其他金融資產55.6
截至2023年12月31日(2022年12月31日:有價證券:美元)85.7 百萬美元和其他金融資產)。本集團的有價證券在活躍的市場中報價,是額外的流動資金來源。
董事會相信,本集團擁有足夠的財務資源,以支付自該等綜合財務報表刊發之日起計至少12個月的現金流出計劃。因此,本集團繼續採用持續經營基礎編制其綜合財務報表。
預算和判決的使用
編制合併財務報表需要管理層作出判斷、估計和假設,這些判斷、估計和假設會影響會計政策的應用以及資產和負債、收入和費用的報告金額。實際結果可能與這些估計不同。
在編制這些合併財務報表時,管理層在應用本集團會計政策時作出的重大判斷和估計不確定性的主要來源如下:
功能貨幣
如本附註及附註18所述,附屬公司GH Research愛爾蘭有限公司的功能貨幣為歐元。在確定歐元是子公司的適當功能貨幣時適用了判斷。支持這一決定的主要考慮因素是參考子公司目前從事的活動,即執行主要以歐元計價的臨牀試驗。判斷也適用於確定美元是母公司的本位幣,主要考慮因素是發生的大部分費用和籌集的所有資金都是以美元計價。
基於股份的薪酬費用
如附註17所解釋,所採用的預期波動率假設是基於由其他可比較上市公司的中位數所釐定的選定波動率。在選擇可比上市公司和用於確定中位數
值的相關觀察期時採用了判斷。
預付和
應計研發費用
集團已與研究機構和其他公司簽訂了各種研發合同。作為編制綜合財務報表的一部分,本集團需要估計預付和應計的研究和開發費用
。這一過程包括審查未結合同、與我們的人員溝通以確定代表集團提供的服務、估計已提供的服務水平以及在尚未向集團開具發票或以其他方式通知集團實際成本的情況下評估與該服務相關的成本。預付和應計研發費用的估計是在每個資產負債表日期根據當時已知的事實和情況進行的。預付和應計研發費用的估計在一定程度上取決於從CRO和其他第三方服務提供商收到的及時和準確的信息。雖然本集團預期估計不會與實際發生的金額有重大差異,但其對所提供服務的狀況及時間的理解可能有所不同,並可能導致在任何特定期間作出過高或過低的報告。
F-8
目錄表
遞延税額餘額與納税經營損失的計價
在GH Research愛爾蘭有限公司註冊成立至2023年12月31日期間,集團發生了虧損,如果集團未來報告應納税利潤,這將是一個潛在的好處。在編制該等財務報表時,本集團已評估目前未能充分確定該等
潛在利益是否會被確認為遞延税項資產。本次評估基於對本集團主要調查產品的研究現狀以及在確保營業利潤之前仍然存在的重大挑戰(請參閲附註7,“遞延所得税”)。
材料會計政策
整固
合併財務報表包括本公司及其子公司GH Research愛爾蘭有限公司的財務報表。
子公司是本公司控制的所有實體。當本公司對某一實體擁有權力,並因參與該實體而面臨或有權獲得可變回報,並有能力通過其對該實體的權力影響回報時,即可實現控制權。子公司自控制權移交給本公司之日起全面合併。它們從控制權停止之日起解除合併。已取消所有公司間交易
。
外幣折算
公司的功能貨幣是美元,因為它在納斯達克上市,其籌款活動和產生的大部分費用都是以美元計算的。其子公司GH Research愛爾蘭有限公司的本位幣為歐元,因為其費用主要以歐元計價。該等綜合財務報表以本集團列報貨幣美元
列報。
本公司子公司財務報表中包含的項目是使用實體經營所處的主要經濟環境的貨幣
,即歐元來計量的。
外幣交易採用
交易日期的現行匯率換算為記賬本位幣。 交易以外幣計值之貨幣資產及負債於綜合財務狀況表日期重新換算。該子公司持有美國現金餘額,由於會計
在這種處理方法中,當在附屬賬户中將其換算為歐元時,會在收益表中產生外匯損益。在合併時,子公司的外幣資產和負債重新換算,
由此產生的外幣差額計入外幣折算儲備。
現金和現金等價物
現金及現金等價物指銀行活期賬户中原始到期日少於三個月的現金,以及可隨時轉換為已知金額且價值變動不大的投資
。現金及現金等價物按攤餘成本列賬,或如投資於貨幣市場基金,則按公允價值計入損益,因為來自這些基金的現金流並不只代表本金及利息的支付。本集團將其投資確定為現金等價物需要判斷,其中包括評估將票據輕易轉換為現金的能力。
本集團的現金結餘由久負盛名的高評級金融機構維持。大部分現金餘額以美元持有
。
金融資產
當本集團成為其合約條款的一方時,金融資產即於財務狀況表中確認。在初始確認時,金融資產按公允價值計量,並按直接應佔交易成本進行調整,但按公允價值計入損益的金融資產除外,該金融資產按公允價值計量,並被分配下列分類之一用於後續計量:
| - |
按攤銷成本計算的金融資產;
|
| - |
通過其他全面收益以公允價值計算的金融資產(“FVOCI”);
|
| - |
FVTPL的金融資產。
|
F-9
目錄表
本集團根據金融資產的合同現金流特徵和持有金融資產的業務模式的目標確定適當的分類。在決定一組金融資產的業務模式時,本集團會考慮以下因素:集團內部如何評估和報告業績、影響業績的風險及其管理方式,以及預期出售金融資產的頻率、價值和時機。
在考慮金融資產的合同現金流特徵時,本集團確定合同條款是否在指定日期增加僅為未償還本金的本金和利息支付的現金流量。在作出這項決定時,本集團評估該金融資產是否包含可能改變合約現金流時間或金額的合約條款,以致不符合該條件。
當本集團對金融資產現金流的合約權利到期、終止或轉讓予第三方時,金融資產將不再確認。
有價證券主要由投資級債券組成。在初始確認時,有價證券按公允價值計量,隨後在滿足以下兩個條件時按FVOCI計量:
| • |
該資產具有在指定日期產生現金流的合同條款,該現金流僅為支付未償還本金的本金和利息;以及
|
| • |
資產是在一種商業模式下持有的,其目標是通過收集合同現金流和出售這些資產來實現。
|
工具買賣於交易日確認,公允價值變動所產生的損益計入
其他全面收益(“保監處”)。利息收入採用有效利率法,在損益表中確認。減值損失準備確認為預期信貸損失(“ECL”)。減值損失
撥備不會減少資產的賬面價值,但相當於撥備的金額在保監處確認為累計減值金額,相應的減值收益或損失在損益表中確認。在取消確認時,以前在保監處確認的累計損益重新分類到損益表中。
其他金融資產指加權平均到期日超過90 由於這些基金的現金流並不僅代表本金和利息的支付,因此按公允價值計入損益。
財產、廠房和設備
財產、廠房和設備按成本入賬,並在相應資產的估計使用年限內使用直線折舊,具體如下:
|
估計有用
生命
|
|
|
IT設備
|
|
|
辦公設備
|
|
|
醫療設備
|
|
租賃和使用權資產
除12個月或以下的租約(短期租約)及低價值租約外,本集團就其為承租人的所有安排確認使用權資產及相應的租賃負債。
根據國際財務報告準則第16號,本集團於租賃開始日按未來租賃付款的現值(按本集團的遞增借款利率貼現)確認使用權資產及租賃負債。該ROU資產隨後於租賃期內於折舊支出內按直線折舊,而租賃負債利息支出則於本集團綜合全面收益表中於財務支出內確認。
利息支出按本集團的增量借款利率計算。
F-10
目錄表
就短期或低價值租賃而言,本集團按直線法於租賃期內確認租賃付款為營運開支。
應付貿易款項和其他流動負債
應付貿易賬款及其他流動負債最初按公允價值確認,其後按攤銷成本計量。
基於股份的薪酬費用
根據購股權計劃授予的購股權的公允價值被確認為基於股份的薪酬支出和相應的
股本增加。總費用在歸屬期間內確認,歸屬期間是滿足所有指定歸屬條件的期間。
股本及額外實收資本
股本
股本是指流通股的面值(見附註15,“股本和準備金”)。
額外實收資本
超過面值的出資額計入額外實收資本。直接應佔權益交易的增量成本(例如發行新股本)在權益中列示為扣除税項後從額外實收資本內的收益中扣除。與股權和非股權交易有關的交易成本
按照合理且與類似交易一致的分配基礎分配給這些交易。如果股權工具隨後沒有發行,交易成本將被計入費用。
研發費用
研發費用包括進行研發活動所產生的成本,包括工資、基於股份的薪酬和福利、受聘進行臨牀開發活動、臨牀試驗、技術開發活動的外部供應商的差旅和外部成本,以及臨牀試驗材料的製造成本。
研究支出在發生當年確認為支出。只有在內部發展支出符合國際會計準則第38號“無形資產”的確認標準時,才將其資本化。在監管和其他不確定因素導致不符合標準的情況下,支出在全面收益表中確認。當符合某些
標準時,本集團可按其估計使用年限、內部發展開支以直線方式資本化及攤銷。到目前為止,集團尚未對任何研發費用進行資本化。
一般和行政費用
一般及行政開支涉及本集團的行政管理,包括薪金、以股份為基礎的薪酬及福利、
差旅及外部成本,包括法律及專業費用。
財務收支
該集團的財務收入和支出包括:
| • |
現金及現金等價物、其他金融資產和有價證券的利息收入;
|
| • |
利息支出;以及
|
| • |
在FVTPL分類的金融資產的淨收益或淨虧損。
|
F-11
目錄表
利息收入或費用採用有效利率法確認。實際利率是指通過金融工具的預期壽命對金融資產的賬面總價值進行折現的預期未來現金收入。從貨幣市場基金收到的金額,除與單位銷售有關的金額外,在確定支付權時確認,這通常發生在收到相關資金時。
當期所得税和遞延所得税
本財政年度的税項支出包括當期税項和遞延税項。税項在損益表中確認,但與其他全面收益或直接在權益中確認的項目有關的除外。在這種情況下,相關税項分別在其他全面收益或直接在權益中確認。
本期所得税按本集團產生應課税收入的資產負債表日頒佈或實質頒佈的税法計算。管理層會就適用税務法規須予解釋的情況,定期評估報税表內的立場。它在適當的情況下以預計應向税務機關支付的金額為基礎制定了規定。
所得税應計入與其相關的收入和支出的同一財政年度。本財政年度的當期所得税資產和負債按預計應向税務機關收回或支付的金額計量。
遞延所得税資產只有在有可能獲得未來應課税利潤的情況下才予以確認。
暫時的差額或未使用的税項虧損可以用來抵銷這些利潤。來自税項抵免結轉的遞延所得税資產的確認範圍為:相關税項利益通過未來應課税利潤實現的可能性。
研發税收抵免
根據愛爾蘭税法,本集團可根據該等税法所界定的符合資格的研發支出而獲得研發税項抵免。研發税項抵免按其公允價值確認,但須有合理保證可獲得税項抵免,且本集團會遵守附帶的所有條件。於確認時,若相關金額先前已作為已發生支出予以扣除,或若相關成本已資本化,則在達到相關
資產的賬面價值時,將從相關營運開支金額中扣除税項抵免。
作為一個集團,我們開展了廣泛的研究和開發活動,並評估了這些活動是否有資格根據愛爾蘭研究和開發税法獲得抵免
。基於這一分析,該集團已就截至2022年12月31日和2021年12月31日的年度提交了研發税收抵免申請。截至2023年12月31日,研發税收抵免按以下比例計算25 符合條件的支出的%。迄今為止,該集團已收到#美元。0.1 已確認為從研發費用中扣除的研究和開發税收抵免。截至2023年12月31日,餘額為$1.3 仍有100萬人未被認出。判決適用於這一決定。將在適當的時候評估截至2023年12月31日的年度的研發税收抵免申請。
或有事件
本集團評估任何不利結果作為意外情況的可能性,包括法律事項。此類或有事項的撥備在可能發生負債並能夠可靠地估計損失金額的情況下記錄。如果債務的存在只有在未來的事件中才能得到確認,或債務的金額無法可靠地計量,則披露或有負債。
細分市場報告
管理層認為本集團只有一個
細分:研發(“R&D”)。這與專家組內部為分配資源和評估業績而報告信息的方式是一致的。
F-12
目錄表
每股虧損
每股基本虧損乃按股東應佔淨虧損除以已發行股份加權平均數計算
年內
3. 本質上的費用
下表按性質提供了我們費用的綜合綜合收益分類報表:
|
截至的年度
十二月三十一日,
|
||||||||||||
|
2023
|
2022
|
2021
|
||||||||||
| |
$’000 | $’000 | $’000 | |||||||||
| 研發 | ||||||||||||
|
外部研發費用
|
||||||||||||
|
員工開支(1)
|
|
|
|
|||||||||
|
折舊
|
||||||||||||
|
其他費用
|
||||||||||||
|
研發費用總額
|
|
|
|
|||||||||
|
一般和行政
|
||||||||||||
|
外部成本
|
|
|
|
|||||||||
|
員工開支(2)
|
|
|
|
|||||||||
|
折舊
|
||||||||||||
|
一般和行政費用總額
|
|
|
|
|||||||||
|
總運營費用
|
|
|
|
|||||||||
(1) 包括在內在員工開支中是sh.基於ARE的薪酬支出為$1.4 百萬,$1.0 百萬及$0.2 百萬截至2023年12月31日、2022年12月31日和2021年12月31日止年度,分別與研發部僱員有關.
(2) INC 遲緩的 在員工支出中,以股份為基礎的薪酬支出為$0.9
百萬,$0.7 百萬 及$0.2
百萬 截至2023年、2022年和2021年12月31日的年度,分別與總務部門和行政部門的僱員有關。
4. 員工開支
|
截至的年度
十二月三十一日,
|
||||||||||||
|
2023
|
2022
|
2021
|
||||||||||
|
$’000
|
$’000
|
$’000
|
||||||||||
|
工資及相關費用
|
|
|
|
|||||||||
|
社會保障費用
|
|
|
|
|||||||||
|
基於共享的薪酬費用
|
|
|
|
|||||||||
|
|
|
|
||||||||||
有關購股權計劃的資料載於附註17“基於股份的薪酬”。在截至2023年12月31日的年度內,0.1 百萬美元被確認為與固定繳款養卹金計劃有關的費用(2022年:#美元0.04 百萬)。
F-13
目錄表
5. 財務收入和費用
|
截至的年度
十二月三十一日,
|
||||||||||||
|
2023
|
2022 |
2021 |
||||||||||
|
$’000
|
$’000
|
$’000
|
||||||||||
|
財政收入
|
||||||||||||
|
現金、現金等價物和其他金融資產的財務收入
|
||||||||||||
|
FVTPL的現金等價物和其他金融資產收益
|
|
|
|
|||||||||
|
FVOCI按有效利率法計算的利息收入
|
|
|
|
|||||||||
|
財政收入
|
|
|
|
|||||||||
|
財務費用
|
||||||||||||
|
投資財務費用
|
(
|
)
|
(
|
)
|
|
|||||||
|
利息支出
|
(
|
)
|
|
(
|
)
|
|||||||
|
財務費用
|
(
|
)
|
(
|
)
|
(
|
)
|
||||||
6. 所得税
本集團的預期税項/(抵免)為$每一年以愛爾蘭適用的税率為基礎,並與實際税費/(抵免)進行對賬,如下:
|
截至的年度
十二月三十一日,
|
||||||||||||
|
2023
|
2022
|
2021
|
||||||||||
|
$’000
|
$’000
|
$’000
|
||||||||||
|
税前虧損
|
|
|
|
|||||||||
|
按國內税率計算的税收抵免
|
(
|
)
|
(
|
)
|
(
|
)
|
||||||
|
以下各項的税務影響:
|
||||||||||||
|
未確認遞延税項資產的損失
|
|
|
|
|||||||||
| 按較高税率徵税的所得 |
||||||||||||
|
其他永久性差異
|
||||||||||||
|
税費/(抵免)
|
|
|
|
|||||||||
7. 遞延所得税
於2023年12月31日,集團的未用淨虧損為$65.0 百萬美元(2022年:美元30.0 百萬)。遞延税項資產有不是
本集團於截至2023年12月31日止年度持有貨幣市場基金及有價證券投資。遞延税項資產尚未就該等工具於2023年12月31日的公允價值變動所導致的未實現資本虧損確認,因為不能肯定本集團未來將產生足夠的資本利潤以利用該等虧損
。
F-14
目錄表
8. 現金和現金等價物
|
截至的年度
十二月三十一日,
|
||||||||
|
2023
|
2022 |
|||||||
|
$’000
|
$’000
|
|||||||
|
銀行現金和手頭現金
|
|
|
||||||
|
現金等價物
|
|
|
||||||
|
|
|
|||||||
現金等價物包括對貨幣市場基金的投資,該基金通過損益按公允價值持有。
現金等價物的公允價值通過單位資產淨值乘以報告日持有的投資來計算。
在截至2023年12月31日的年度內,投資為54.0 100萬美元來自一隻貨幣市場基金。這項投資已被歸類為其他金融資產,因為這些基金的現金流不僅代表本金和利息的支付,而且公允價值為#美元。55.6 2023年12月31日為100萬人。
9. 其他流動資產
|
截至的年度
十二月三十一日,
|
||||||||
|
2023
|
2022
|
|||||||
|
$’000
|
$’000
|
|||||||
|
預付費用
|
|
|
||||||
|
增值税應收賬款
|
|
|
||||||
|
其他
|
|
|
||||||
|
|
|
|||||||
10. 有價證券
|
截至的年度
十二月三十一日,
|
||||||||
|
2023
|
2022 |
|||||||
| 公允價值 |
$’000 |
$’000 |
||||||
|
1月1日
|
|
|
||||||
|
加法
|
||||||||
|
應計利息
|
||||||||
|
收到的利息
|
( |
) | ( |
) | ||||
|
公允價值變動
|
(
|
)
|
|
|||||
|
12月31日
|
|
|
||||||
F-15
目錄表
有價證券的公允價值為$88.7
2023年12月31日為百萬美元(2022年:$85.7 百萬)。報告日期的預期信貸損失減值損失準備(“ECL”)為$。0.1 百萬美元(2022年美元0.1
百萬)。保監處的整體動向如下表所示。
|
截至的年度
十二月三十一日,
|
||||||||
|
2023
|
2022 |
|||||||
|
$’000
|
$’000
|
|||||||
|
重估調整
|
(
|
)
|
|
|||||
|
按FVOCI計量的資產的ECL變動
|
(
|
)
|
|
|||||
|
通過保監處對有價證券的公允價值變動
|
(
|
)
|
|
|||||
FVOCI的有價證券聲明利率為0.25 %至3.75 % (2022: 0.25 %至3.75 %),並在2個月 至3年 時間到了。
11. 財產、廠房和設備
|
電腦
裝備
$’000
|
辦公室
裝備
$’000
|
醫療
設備
$’000
|
ROU
資產
$’000
|
總計
$’000
|
||||||||||||||||
|
成本
|
|
|||||||||||||||||||
|
1月1日,2022
|
|
|
|
|
|
|||||||||||||||
|
加法
|
|
|
|
|
||||||||||||||||
|
匯兑差額
|
(
|
)
|
|
(
|
)
|
(
|
)
|
|||||||||||||
|
12月31日,2022
|
|
|
|
|
||||||||||||||||
|
累計折舊
|
||||||||||||||||||||
|
1月1日,2022
|
|
|
|
|
||||||||||||||||
|
按年收費
|
|
|
|
|
||||||||||||||||
|
匯兑差額
|
|
|
|
|
||||||||||||||||
|
12月31日,2022
|
|
|
|
|
||||||||||||||||
|
賬面淨額
|
||||||||||||||||||||
|
12月31日,2022
|
|
|
|
|
||||||||||||||||
|
成本
|
||||||||||||||||||||
|
1月1日,2023
|
|
|
|
|
||||||||||||||||
|
加法
|
|
|
|
|
||||||||||||||||
|
匯兑差額
|
(
|
)
|
(
|
)
|
|
|
||||||||||||||
|
12月31日,2023
|
|
|
|
|
||||||||||||||||
|
累計折舊
|
||||||||||||||||||||
|
1月1日,2023
|
|
|
|
|
||||||||||||||||
|
按年收費
|
|
|
|
|
||||||||||||||||
|
匯兑差額
|
|
|
|
|
||||||||||||||||
|
12月31日,2023
|
|
|
|
|
||||||||||||||||
|
賬面淨額
|
||||||||||||||||||||
|
12月31日,2023
|
|
|
|
|
||||||||||||||||
F-16
目錄表
折舊費用為$35
千(2022年:$33 千元,2021年:美元15
千)已計入研發費用和$0.3 百萬美元(2022年:美元14 千元,2021年:美元4 1,000)和
管理費用。
物業、廠房及設備增加是由於本集團於截至2023年12月31日止年度簽訂的寫字樓租賃。租期為四年零九個月 與之相關的年度現金流為$0.3 百萬美元。
12. 貿易應付款
貿易應付賬款主要指提供製造、研究和諮詢服務以及法律和專業費用所產生的金額,這些費用在年底尚未支付。貿易應付款將在12個月內的不同時間進行結算。
13. 其他流動負債
|
截至的年度
十二月三十一日,
|
|||||||
|
2023
|
2022
|
||||||
|
$’000
|
$’000
|
||||||
|
應計項目
|
|
|
|||||
|
應付社會保障
|
|
|
|||||
|
其他
|
|
|
|||||
|
|
|
||||||
其他流動負債主要包括應計營運開支及應付僱員税項,預計於一年內清償。
14. 租契
如附註11“物業、廠房及設備”所述,於截至2023年12月31日止年度內,本集團訂立一份寫字樓租約。與此租賃相關的使用權資產已包括在
財產、廠房和設備中。於租賃開始日,使用權資產按未來租賃付款的現值確認,並按本集團的增量借款利率折現,計算如下6 %. 在截至2023年12月31日的年度內,使用權資產的變動如下所示。
|
寫字樓
|
||||
| $’000 | ||||
|
2023
|
||||
|
1月1日的餘額
|
|
|||
|
對使用權資產的補充
|
|
|||
|
折舊費
|
(
|
)
|
||
|
匯兑差額
|
|
|||
|
12月31日的結餘
|
|
|||
F-17
目錄表
於2023年12月31日,本集團的租賃負債為#美元1.0 百萬美元。利息支出$0.1 在截至2023年12月31日的年度確認租賃負債百萬美元(2022年:美元). 下表列出了未貼現基礎上的租賃付款到期日分析。
|
成熟度分析
|
||||
| $’000 | ||||
|
2023年12月31日
|
||||
|
不到一年
|
|
|||
|
一到兩年
|
|
|||
|
兩到三年
|
|
|||
|
三到四年
|
|
|||
|
應付未貼現租金總額
|
|
|||
短期租賃的租賃費用為#美元。0.1 截至2023年12月31日的年度為百萬美元(2022年:美元0.1 百萬,2021年:美元0.1
百萬)。
15. 股本和儲備金
股本
已發行和繳足股款的股份:
|
數量
傑出的
股票
|
股本
|
其他內容
實收資本
|
||||||||||
|
$’000
|
$’000
|
|||||||||||
|
1月1日,2021 (1)
|
|
|
|
|||||||||
|
發行股本--A類普通股(一)
|
|
|
|
|||||||||
|
發行股本--B系列優先股(二)
|
|
|
|
|||||||||
|
股票交易所(三)
|
|
(
|
)
|
|
||||||||
|
A股普通股贖回(四)
|
(
|
)
|
|
|
||||||||
| 股份合併(五) |
(
|
)
|
|
|
||||||||
|
發行股本(Vi)
|
|
|
|
|||||||||
|
2021年12月31日
|
||||||||||||
|
12月31日,2022
|
|
|
|
|||||||||
| 行使購股權(附註17) |
||||||||||||
|
12月31日,2023
|
||||||||||||
| (1) |
|
GH Research PLC的法定股本為40,000,000,000 面值為$的普通股0.025 截至2023年12月31日。
| (i) |
GH Research PLC的註冊成立
|
2021年3月29日,GH Research PLC註冊成立,法定股本為歐元25,000 ,分為25,000 面值為歐元的普通股1.00 每個人。GH Research PLC公司章程的唯一認購人是弗洛裏安·舍恩哈廷,他
認購了25,000 A歐元普通股1.00 每個人。發行及其後的贖回於發行股本內列示淨額。
F-18
目錄表
| (Ii) |
股票發行--B系列優先股
|
2021年4月8日,GH Research愛爾蘭有限公司發佈25,379,047 B系列優先股(重新指定為10,151,618
普通GH Research PLC首次公開招股收盤前的股票)。是次發行的淨收益為$。118.8 百萬美元,扣除直接可歸屬交易成本#美元6.4
百萬。
| (Iii) |
股份交易所
|
5月5日 2021年7月27日,作為公司重組的一部分,GH Research愛爾蘭有限公司的所有股東交換了他們持有的GH Research愛爾蘭有限公司的每股股份,這些股份的面值為歐元0.01 ,GH Research PLC的股份
與其持有的GH Research愛爾蘭有限公司的股份具有相同的股東權利,因此,GH Research愛爾蘭有限公司成為GH Research PLC的全資子公司。
GH Research PLC發行了以下股票:
| - |
|
| - |
|
| - |
|
這導致股本減少,額外實收資本相應增加#美元。160 一千個。
| (Iv) |
A股普通股贖回
|
2021年6月24日,GH Research PLC贖回25,000
A歐元普通股1.00 每個都是面值的,在贖回之後,取消了25,000 A歐元普通股1.00 每個人。發行和贖回在發行股本中顯示為淨額。
| (v) |
轉換和股份合併
|
2021年6月24日,GH Research PLC(A)改制(I)5,923,079 A系列面值優先股$0.01 每進一進5,923,079 面值為$的普通股0.01
每個和(Ii)25,379,047 面值為$的B系列優先股0.01 每進一進25,379,047 面值為$的普通股0.01 及(B)各填妥2.50 -一股換一股
將現有普通股合併為總計40,520,850 面值為$的普通股0.025 每個人。
| (Vi) |
股票發行-IPO
|
2021年6月29日,GH Research PLC完成了11,499,999 納斯達克全球市場普通股價格為1美元16.00 每股
。首次公開募股的淨收益為$167.6 百萬美元,扣除承保折扣和直接歸屬交易成本
美元16.4 百萬美元。
分紅
儲量
其他儲備金#美元4.7 截至2023年12月31日,百萬美元(2022年:美元2.6 綜合全面收益表中與根據購股權計劃作出的獎勵(見附註17,
“基於股份的薪酬”)及有價證券的公允價值變動(見附註10,“有價證券”)相關的支出金額。
外幣折算準備金#美元10.5 截至2023年12月31日(2022年:$13.0 百萬歐元)包括GH Research
愛爾蘭有限公司的累計貨幣換算調整,其本位幣為歐元。翻譯調整產生於重新翻譯結果從當年平均匯率到財務狀況表日匯率的折算,以及子公司適用資產和負債的重新換算。
F-19
目錄表
16. 或有事件
截至2023年12月31日,本集團財務報表並無重大或有事項需要調整或披露(2022年:無)。
17. 基於股份的薪酬
股票期權
2021年6月,本公司通過了一項購股權計劃,根據該計劃,將向
名合資格參與者授予購股權。該公司已預留1,202,734 根據購股權計劃未來發行的普通股,包括根據迄今已發行的以股份為基礎的股權獎勵而發行的普通股。截至2023年12月31日,公司已404,718
可用於未來發行基於股份的股權獎勵的普通股(2022:741,138 股票,2021年:1,045,547 股份)。
根據購股權計劃,購股權只能以本公司普通股結算。因此,根據購股權計劃授予的購股權已根據IFRS 2作為權益結算入賬。因此,本公司記錄了授予授予的既得部分的費用以及部分賺取但未歸屬的獎勵贈款部分.
於截至2023年12月31日止年度內,本公司授予購入420,820 普通股(2022年:304,409 股票,2021年:149,891 股份)分別向符合上述購股權計劃一般條款的僱員出售。在截至2023年12月31日的年度內,104,299 股票期權(2022年:,
2021: )被沒收。
中的420,820 在截至2023年12月31日的年度內授予員工的購股權,175,000
授予股票期權的合同期限(到期)為七年了 從授予之日起,行使價為
$0.025 每股。再來一次20,000
在截至2023年12月31日的年度內授予的股票期權立即歸屬,且不附帶任何服務條件。除了175,000 以上確定的股票期權,在截至2023年12月31日的年度內授予員工的所有其他股票期權的合同期限(到期)為八年 自授出日起,以授出前一天收市價的行使價計算。
在截至2023年12月31日的年度內,公司授予
購買19,899 授予董事會成員的普通股,在授予之日授予,並受兩年制 服務條件。這些股票期權的合同期限(到期日)為七年了 自授權日起,行使價為$0.025 每股。截至2023年12月31日止年度,董事會成員共行使7,296 行權價為$的股票期權2.05 每個選項。與行使該等購股權有關的
股份於2023年10月發行。截至2023年12月31日止年度內,已行使股份的加權平均股價為$9.90 .
F-20
目錄表
下表彙總了截至2023年、2022年和2021年12月31日的未償還股票期權獎勵:
|
平均值
行權價格
中的每股
美元
|
數量
獎項
|
加權
平均值
剩餘生命在
年份
|
||||||||||
|
2020年12月31日
|
|
|
—
|
|||||||||
|
授與
|
|
|
|
|||||||||
|
2021年12月31日
|
|
|
|
|||||||||
| 授與 | ||||||||||||
|
12月31日,2022
|
||||||||||||
| 授與 | ||||||||||||
|
被沒收
|
( |
) | ||||||||||
|
已鍛鍊
|
( |
) | ||||||||||
|
12月31日,2023(1)
|
||||||||||||
(1) 112,244 在截至2023年12月31日的懸而未決的裁決中(2022: , 2021: ).
截至2023年12月31日止年度內所批出獎勵的加權平均批出日期公平價值為$7.72 (2022: $9.92 , 2021: $14.44 )每個獎項。
授予期權的公允價值是在授予之日採用布萊克-斯科爾斯期權定價模型確定的。公司
使用一家獨立的評估公司來協助計算每位參與者的獎勵贈款的公允價值。
在截至2023年、2023年、2022年和2021年12月31日的年度內授予的期權的公允價值是根據以下假設在授予之日確定的:
|
截至的年度
十二月三十一日,2023
|
|
|
截至的年度
十二月三十一日,2022
|
|
|
截至的年度
2021年12月31日
|
||||||
|
股價,以美元為單位
|
|
|||||||||||
|
執行價格,以美元為單位-員工(加權平均)
|
|
|||||||||||
|
執行價格,以美元為單位-非執行董事
|
|
|||||||||||
|
預期波動率
|
|
%
|
% | % | ||||||||
|
獎勵期限(加權平均)
|
|
|||||||||||
|
預期股息
|
|
|
||||||||||
|
無風險利率
|
|
%
|
% | % | ||||||||
預期波動率是根據在其他可比上市公司中觀察到的中值確定的選定波動率計算得出的。
獎勵期限以授出日期與購股權有效期內的日期之間的時間間隔為基準,在此之後,
進行授出時,本公司平均預期參與者將行使其購股權。
截至2023年12月31日,權益內的其他準備金包括美元4.2 百萬美元(2022年12月31日,$2.0 百萬美元)有關本集團的購股權計劃。在截至2023年12月31日的年度內,就所獲服務所確認的所有獎項的開支為
$2.3 百萬美元(2022年:美元1.7
百萬,2021年:$0.4 百萬)。
18. 金融風險管理
金融風險因素
董事會目前正審核本集團的現金預測及流動資金需求。本集團的活動使其面臨各種金融風險,包括外匯風險、信用風險、利率風險和流動性風險。
F-21
目錄表
外匯風險
本集團經營國際業務,並面臨各種貨幣風險所產生的外匯風險,主要涉及美元、歐元和英鎊。產生交易風險的原因是,以外幣計價的交易中支付或收到的當地貨幣金額可能因匯率變化而有所不同。外匯
風險來自:
| ● |
以實體本位幣以外的貨幣計價的預測費用;以及
|
| ● |
確認的資產和負債以實體的本位幣以外的貨幣計價。
|
本集團的現金、現金等價物和其他金融資產Are
以下列貨幣計價:
|
2023
|
2023
|
2022
|
2022
|
|||||||||||||
|
本地
貨幣
‘000
|
$’000
|
本地
貨幣
‘000
|
$’000 | |||||||||||||
|
以美元為單位
|
|
|
|
|
||||||||||||
|
歐元
|
|
|
|
|
||||||||||||
|
在英鎊
|
||||||||||||||||
|
|
|
|||||||||||||||
由於其功能貨幣為歐元,本集團對其附屬公司有外匯風險。該子公司持有大量現金存款和其他以美元計價的金融資產。因此,未來歐元和美元匯率的變化將使本集團面臨貨幣收益或損失,這將影響報告的
資產、負債、收入和支出金額,影響可能是重大的。
截至2023年12月31日止年度,本集團確認外匯損失$2.6 百萬(二零二二年:收益$7.2 2021年,百萬美元:收益$5.9 百萬)。外匯損失主要與其子公司持有的美元現金和其他金融資產以及年內美元兑歐元的相關貶值有關。外匯匯率變動可能對本集團產生正面或負面影響,
影響可能是重大的。這些外匯變動在很大程度上被其他全面收益內的相關變動所抵消。
專家組認為,目前沒有必要訂立具體的合同,以減少外匯匯率變化的風險,例如訂立期權或遠期合同。本集團未來可能會考慮使用期權或遠期合約來管理貨幣交易風險。所有可交易證券均以美元計價,不受外匯風險的影響,因為它們所在的實體的功能貨幣為美元。 其他金融資產以美元計價,但持有在功能貨幣不是美元的實體中,因此面臨外匯風險。
在2023年12月31日,如果在所有其他變量保持不變的情況下,美元對歐元貶值/升值10%,那麼該年度的税前虧損將為$6.4 百萬美元/更低(2022年:美元8.5 百萬高/低),主要與翻譯有關公司子公司GH Research愛爾蘭有限公司以美元持有的現金和其他金融資產,其功能貨幣為歐元,如
附註2“準備基礎、重大判斷和會計政策”所述。這將被其他全面收入中的同等金額所抵消.
信用風險
本集團面臨現金、現金等價物、其他金融資產和有價證券的信用風險。本集團的現金結餘由久負盛名的高評級金融機構維持。截至2023年12月31日,現金餘額為三 S的最低信用評級為A-的銀行。於2023年12月31日,現金及現金等價物財務狀況表中反映的金額代表本集團對該等工具的最大信貸風險敞口。
於2023年12月31日,本集團持有投資級債券及貨幣市場基金的投資(“投資組合”)。在交易對手違約的情況下,這些投資面臨信用風險。
本集團不投資於股權工具或衍生品,並且無 的債券分別在上面3 投資組合價值的%。
F-22
目錄表
本集團的有價證券按FVOCI計量,須遵守預期信貸損失模型。本集團就其於FVOCI持有的資產計提國際財務報告準則第9號所規定的預期信貸損失。國際財務報告準則第9號下的預期信貸損失模型要求計算金融資產的“12個月預期信貸損失”。這些是基於報告日期後12個月內可能發生的違約的損失
。除非該資產於報告日期並不被視為低信用風險,並被視為自初始確認以來信用風險已顯著增加,否則必須這樣做。如果是這種情況,則應記錄終身預期信用損失。管理層將現有有價證券的低信用風險視為至少擁有一家主要評級機構的投資級信用評級。在FVOCI
持有的資產如果違約風險較低,且發行人有較強的能力在短期內履行其合同現金流義務,則被視為信用風險較低。本集團目前的政策是主要投資於
投資級證券。降級後,遵守這一限制的情況將及時恢復。截至2023年12月31日,本集團有價證券的信用風險被認為是低的。本期間確認的減值準備是根據12個月的預期信貸損失計算的,與期初減值準備的對賬如下:
|
|
截至的年度
十二月三十一日,
|
|||||||
|
|
2023
|
2022
|
||||||
| $’000 | $’000 | |||||||
|
期初減值津貼
|
|
|
||||||
|
本年度減值準備變動情況
|
(
|
)
|
|
|||||
|
結賬減值準備
|
|
|
||||||
減值準備是基於關於違約概率、違約損失、違約風險敞口和貼現率的假設。根據任何歷史經驗和當前市場狀況,以及報告期末的前瞻性估計,在作出這些假設和選擇預期信貸損失計算的投入時使用判斷。
利率風險
利率風險是指金融工具的價格因利率波動而發生變化,從而導致財務損失的風險。本集團的有價證券面臨利率風險。雖然債券按固定利率支付利息,但如果另類投資利率上升,本集團有價證券的價值將在短期內下降。
截至2023年12月31日,如果利率上調/下調
50 基點,在所有其他變數保持不變的情況下,集團的總綜合虧損將為#美元0.7 百萬美元/更低(2022年:美元1.1 由於本集團有價證券的公允價值變動所致。
流動性風險
流動資金風險指本集團可能無法產生足夠的現金資源以悉數清償其到期債務的風險,或只能按對其構成重大不利的條款清償。謹慎的流動性風險管理意味着保持足夠的現金來滿足營運資本要求。現金由本集團管理層監管。
董事會和管理層定期審查資金和流動性風險。本集團透過集資為其資本需求提供資金。除附註14“租賃”所載的租賃負債外,所有金融負債均於資產負債表日起一年內到期。
F-23
目錄表
資本管理
本集團認為資本相當於資產負債表上的IFRS權益(包括股本、額外實收資本和
本公司擁有人應佔所有其他權益儲備)。本集團並無計息債務。
本集團管理資本的目標是保障本集團持續經營的能力,併為
通過推進我們的研究藥物候選產品的監管批准,其股東。
公允價值估計
賬面值被認為是公平
以下金融資產和負債的價值:
| ● |
現金
|
| ● |
其他流動資產
|
| ● |
應付貿易款項和其他流動負債
|
下表列示金融資產之賬面值及公平值。該表不包括
的公允價值信息 倘賬面值與公平值合理相若,則並非按公平值計量之金融資產或金融負債。
|
|
|
賬面金額 |
||||||
|
|
FVOCI
$’000
|
FVTPL
$’000
|
||||||
|
金融資產按公允價值計量
|
||||||||
|
有價證券
|
|
|
||||||
|
現金等價物
|
|
|
||||||
| 其他金融資產 |
||||||||
|
|
|
|
||||||
公允價值方法學
本集團採用以下層次結構來確定和披露金融工具的公允價值:
1級:相同資產和負債的活躍市場報價(未調整)
。
第2級:1級內可直接或間接觀察到的資產的市場報價以外的其他投入。
第3級:如果一項或多項重大投入不是基於可觀察到的市場數據,則該工具包括在第三級。未上市的股權證券就是這種情況。
有價證券、其他金融資產及現金等價物的公允價值以代表一級投入的報價市場價格為基礎。
公允價值-基於股份的薪酬
有關購股權計劃下的獎勵,公允價值必須持續估計。估值方法遵循授予日期公允價值原則,以股份為基礎的薪酬獎勵的主要投入因素載於附註17“以股份為基礎的薪酬”。
F-24
目錄表
19. 關聯方披露
2021年4月8日,GH Research愛爾蘭有限公司發佈5,270,400 B系列優先股(重新指定為2,108,159
首次公開招股結束前的普通股)給董事及與董事有關聯的實體。
2021年6月4日,GH Research PLC授予了購買126,218 普通股(重新指定為50,487
IPO結束前的普通股)至密鑰管理層。
2021年6月24日,GH Research PLC贖回25,000
A歐元普通股1.00 每個都是面值的,在贖回之後,取消了25,000 A歐元普通股1.00 詳情見附註15,
“股本和準備金”。
2021年6月29日,GH Research PLC發佈625,000 從首次公開募股到與董事有關聯的實體的普通股。
在截至2023年12月31日的年度內,GH Research PLC授予購買122,399 普通股到密鑰管理。中的122,399 於截至2023年12月31日止年度內授出的購股權,72,399
授予股票期權的合同期限(到期)為七年了 從授予日期開始,行使價為
$0.025 每股其餘 50,000
授予股票期權的合同期限(到期)為八年 自授出日期起,行使價按授出前一天的收市價
計算。19,899 於授出日期歸屬之購股權,但須受兩年制 服務條件。在同一時期,7,296 股票期權由關聯方行使。詳情見附註17“基於股份的薪酬”。
密鑰管理補償
關鍵管理層是那些有權和責任規劃、指導和控制集團活動的人員。主要管理層由在本報告所述期間任職的高管和董事會組成。
|
截至的年度
十二月三十一日,
|
||||||||||||
|
2023
|
2022
|
2021
|
||||||||||
|
$’000
|
$’000 | $’000 | ||||||||||
|
工資及相關費用
|
|
|
|
|||||||||
|
基於共享的薪酬費用
|
|
|
|
|||||||||
|
|
|
|
||||||||||
20. 每股虧損
每股基本虧損的計算方法為:本年度股東應佔虧損除以該財政年度已發行股份的加權平均數,如下所示:
|
截至的年度
十二月三十一日,
|
||||||||||||
|
2023
|
2022
|
2021
|
||||||||||
|
股東應佔虧損(單位:$‘000)
|
(
|
)
|
(
|
)
|
(
|
)
|
||||||
|
加權平均已發行股數
|
|
|
|
|||||||||
|
每股基本及攤薄虧損(美元)
|
(
|
)
|
(
|
)
|
(
|
)
|
||||||
於截至2023年、2023年、2022年及2021年12月31日止年度,每股基本及攤薄虧損按已發行及已發行股份的加權平均數計算,不包括將根據購股權計劃發行的股份,因為計入該等股份的效果將為反攤薄。
21. 報告日期之後的事件
於報告日期後,並無任何事項需要在本集團的綜合財務報表中披露。
F-25