
Legend Biotech 公司介紹本演示文稿僅用於投資者關係
目的——不用於產品促銷目的 2024 年 1 月

免責聲明 3 本演示文稿僅用於投資者關係目的 — 不適用於
產品促銷目的。本演示文稿由聯想生物科技公司(“Legend Biotech” 或 “公司”)編寫,僅供參考,不包含與公司有關的所有相關信息。本演示中討論的藥物和/或用途的
安全性和有效性尚未確定,除非先前從相關衞生
當局獲得的上市許可中特別規定。此外,對於研究藥物和/或用途,公司無法保證衞生當局的批准,也無法保證此類藥物和/或用途將在任何國家上市。本
演示文稿中包含的某些信息以及本演示期間的口頭陳述涉及或基於從第三方來源獲得的研究、出版物、調查和其他數據,以及Legend Biotech自己的內部估計和研究。儘管Legend
Biotech認為截至本演示文稿之日這些第三方來源是可靠的,但它尚未獨立核實
從第三方來源獲得的任何信息的充分性、公平性、準確性或完整性,也沒有做出任何陳述。儘管Legend Biotech認為其內部研究是可靠的,但此類研究尚未得到任何獨立來源的證實。本演示文稿中關於未來預期、計劃和前景的陳述,以及
以及有關非歷史事實事項的任何其他陳述,均構成 1995 年《私人證券訴訟改革法》所指的 “前瞻性陳述”。這些聲明包括但不限於與聯想生物科技戰略和目標有關的
聲明;與CARVYKTI® 相關的聲明,包括聯想生物科技對CARVYKTI® 的預期,包括對CARVYKTI® 的生產預期;以及關於監管部門提交CARVYKTI® 的聲明,以及向美國食品和藥物管理局、歐洲藥品管理局和其他監管機構提交此類文件的進展情況;以及臨牀試驗的預期結果和時間;Legend Biotech 對 LB2102 及其潛在益處的期望;
Legend Biotech 的能力完成與諾華的許可交易以及該交易的潛在收益;聯想生物對推進其產品線和產品組合的期望;以及聯想生物技術
候選產品的潛在好處。“預期”、“相信”、“繼續”、“可以”、“估計”、“預期”、“打算”、“可能”、“計劃”、“潛在”、“預測”、“項目”、“應該”、“目標”、“將” 和類似的表述旨在識別
前瞻性陳述,儘管並非所有前瞻性陳述都包含這些識別詞。由於各種重要因素,實際結果可能與此類前瞻性陳述所示的結果存在重大差異。
Legend Biotech的預期可能會受到以下因素的影響:新藥產品開發所涉及的不確定性;意想不到的臨牀試驗結果,包括對現有
臨牀數據或意想不到的新臨牀數據進行額外分析的結果;意想不到的監管行動或延遲,包括要求提供額外的安全性和/或有效性數據或對數據的分析,或一般的政府監管;由於我們的第三方
採取行動或未能採取行動而導致的意外延遲派對夥伴;聯想生物的專利或其他專有知識產權保護面臨挑戰所產生的不確定性,包括美國
訴訟程序中涉及的不確定性;總體競爭;政府、行業、一般產品定價和其他政治壓力;COVID-19 疫情的持續時間和嚴重程度以及為應對
不斷變化的形勢而採取的政府和監管措施;以及聯想生物科技20-F表年度報告 “風險因素” 部分討論的其他因素已歸檔2023年3月30日向美國證券交易委員會(SEC)提交了文件,聯想生物科技向美國證券交易委員會提交的其他
文件。如果其中一種或多種風險或不確定性成為現實,或者基本假設被證明不正確,則實際結果可能與本演示文稿中描述的預期、認為、
估計或預期的結果存在重大差異。本演示文稿中包含的任何前瞻性陳述僅代表截至本演示文稿之日。Legend Biotech明確聲明不承擔任何更新任何前瞻性陳述的義務,無論是由於新信息、未來事件還是其他原因造成的。

Legend Biotech重點介紹核心技術:CAR-T,包括通用
CAR CAR-NK — T3 CARVYKTI® 的全球製造基地:3 本演示僅用於投資者關係目的 — 不用於產品促銷目的 1 個美國基地 2 個歐盟(根特)工廠 4 1 諾華基地
(CMO)管道計劃涵蓋:血液系統惡性腫瘤現金和現金等價物、存款, 和短期投資5 1.與強生合作;2.請閲讀處方信息以獲取全部安全信息
:https://www.janssenlabels.com/package-insert/product-monograph/prescribing-information/CARVYKTI-pi.pdf;3. gamma delta T 細胞;4.歐盟和中國製造基地建設正在進行中;5.截至 2023 年 9 月 30 日上市產品:CARVYKTI®(ciltacabtagene autoleucel;cilta-cel)自成立以來已有 1,2 年了,是最早為 BCMA 蛋白設計 CAR-T 細胞的公司之一致力於研發的員工

CARVYKTI® 的吸收仍在繼續 → 美國季度增長23%
主要是由以下因素推動的:成功的啟動執行深化市場份額產能改善使美國活躍的治療場所數量增加到64個 → 由於德國的推出,歐盟季度增長了300%。持續的市場滲透率、地域擴張和
人口是重要的增長動力和機會 CARVYKTI® 產品淨銷售額(百萬美元)+176%的增長 vs
22 年第三季度美國歐盟 24 55 55 70 114 140 0 0 0 0 0 0 2 3 12 0 20 40 60 100 120 120 140 160 2022年第二季度第二季度第三季度2022年第四季度第一季度2023 年 2023 年第二季度 2023 年第三季度同比增長比 23 年第二季度增長美國 155% 23% 歐盟
N/A 300% 全球 176% 30% 本演示文稿僅用於投資者關係目的——不用於產品促銷目的
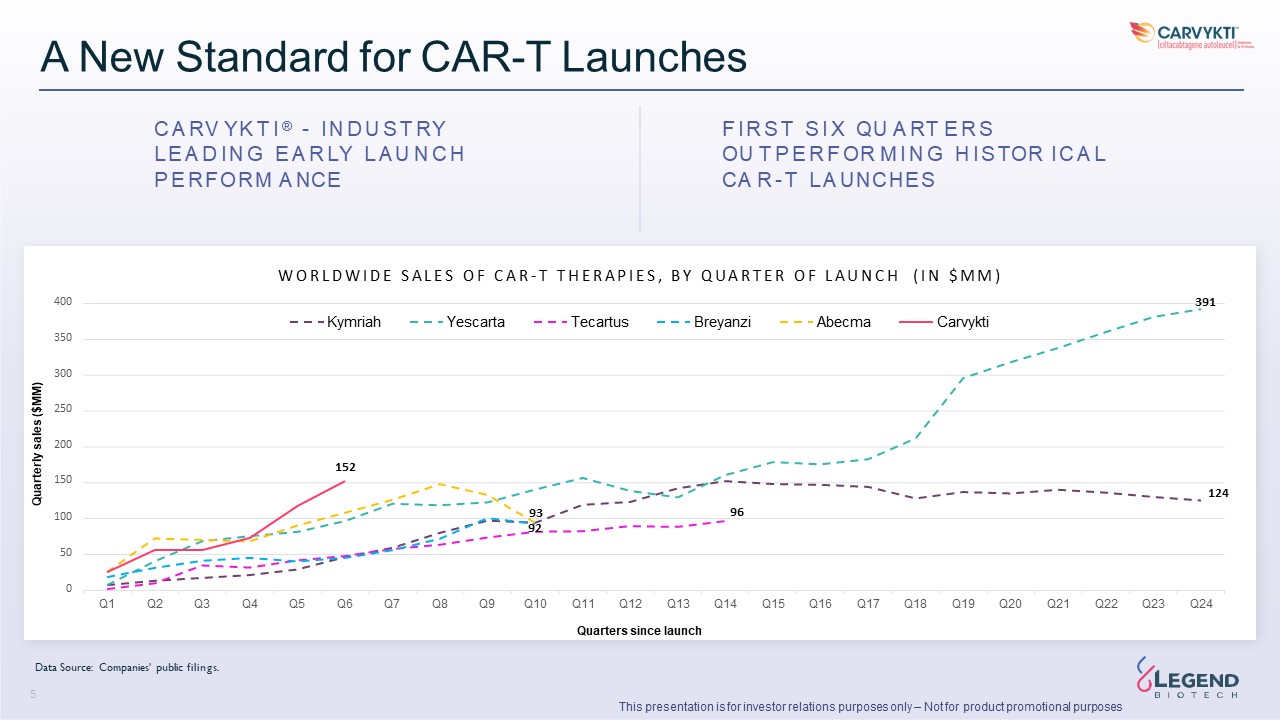
CAR-T 發佈的新標準 C A RV YK T I®-I N D U S T RY L E A D I N G
E A R LY U U N C H P E REFORM A NICE F I X QUA RT A RT E R S OU T X QUA RT E R S OUT P E R S OU T P E X QUA RT E R S OUT P E R S OU T P E X QUA RT E R S OUT P E R S OU T P E R S OUT P E R S OU T P E R S OUT P E O M I N N G A L L CA R-T L A UNCHES 93 96 92 50 0 第 1 季度第 2 季度第 3 季度第 5 季度第 5 季度第 7 季度第 9 季度第 10 季度第 11 季度第 12 季度第 13 季度第 13 季度第 14 季度第 16 季度第 18 季度19 Q20 Q23 Q24 W O R L D W I D E S A L E S A L E S A L E S O F F C A R-T T H E R A P I E S,B Y Q U A R T E E R T E E O F L E A R-T T H E R A P I E S,B Y Q U A R T E E R T E E O F L A R-T T H E R A P I E S H(I 百萬美元)400 391 Kymriah Yescarta Tecartus Tecartus Breyanzi Abecma Carvykti 350 300 250 200 152 152 150 自
推出以來的 124 個季度季度銷售額(百萬美元)數據來源:公司的公開文件。3 本演示文稿僅用於投資者關係目的,不用於產品促銷目的

細胞療法的先驅和領導者 3 本演示文稿僅用於投資者關係
目的——不用於產品促銷目的

7 通過與強生的全球合作開發的細胞療法制造專業知識的全面整合全球領導者
將 Legend 在細胞療法領域的領導地位與強生*在全球藥物開發方面的專業知識相結合,擴大美國和中國的製造能力
,在歐盟綜合細胞療法平臺建設大型製造設施內部抗體生成和 CAR-T 特異功能篩選技術早期臨牀概念驗證,與中國的關鍵人物合作,
美國和全球自體和異體平臺可實現可持續增長和可擴展性,以滿足未來的商業需求 KOL,主要意見領袖 *協議的法律實體是詹森
生物技術公司;合作成立於2017年12月,市場領先的多發性骨髓瘤 (MM) CAR-T 療法 sbLA 和 II 型變體以支持標籤擴展,已獲美國食品藥品管理局和歐洲藥品管理局接受(PDUFA 目標行動日期為2024年4月5日)和EMA接受,
分別是第一項針對西爾塔-cel使用的隨機3期研究支持該應用程序作為 2L 引人注目的 MM 計劃和創新產品線,Cilta-cel 在臨牀試驗中表現出持續深刻而持久的反應,
安全性可控的 3 期項目為釋放早期系列 MM 適應症的價值提供了機會。其他針對血液學和實體瘤適應症的臨牀前/早期項目本
演示文稿僅用於投資者關係目的,不用於產品促銷目的
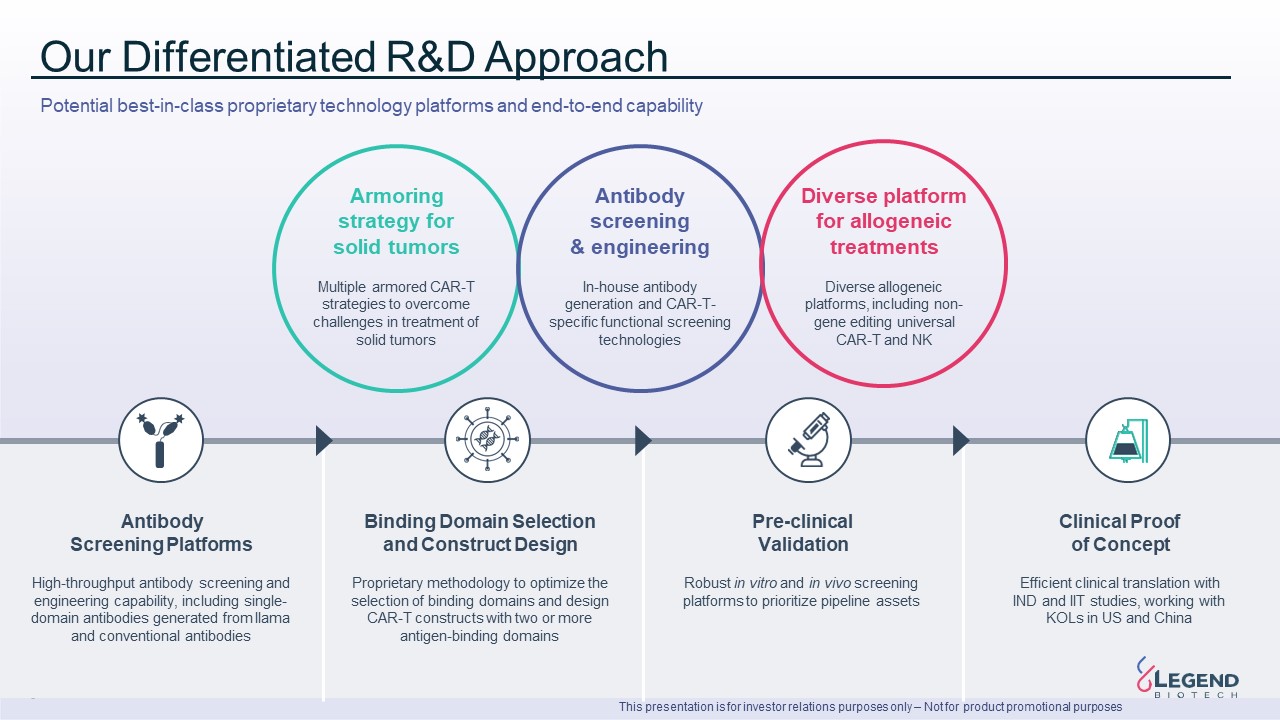
8 我們的差異化研發方法不同的異基因
治療平臺多樣的異體平臺,包括非基因編輯通用 CAR-T 和 NK 抗體篩選與工程內部抗體生成和 CAR-T 特異性功能篩選技術固體
腫瘤的裝甲策略克服實體瘤治療挑戰的多種裝甲CAR-T策略抗體篩選平臺本演示文稿僅用於投資者關係目的——不用於產品促銷目的高通量
抗體篩查和工程能力,包括源自美洲駝和常規抗體的單域抗體結合域選擇和構造設計專有方法,可優化結合
結構域的選擇以及設計具有兩個或更多抗原結合結構域的CAR-T結構臨牀前驗證強大的體外和體內篩選平臺可優先考慮管道資產臨牀概念驗證通過
IND 和IIT研究進行高效的臨牀翻譯,與美國和中國的KOL合作潛在的同類最佳研究專有技術平臺和端到端能力
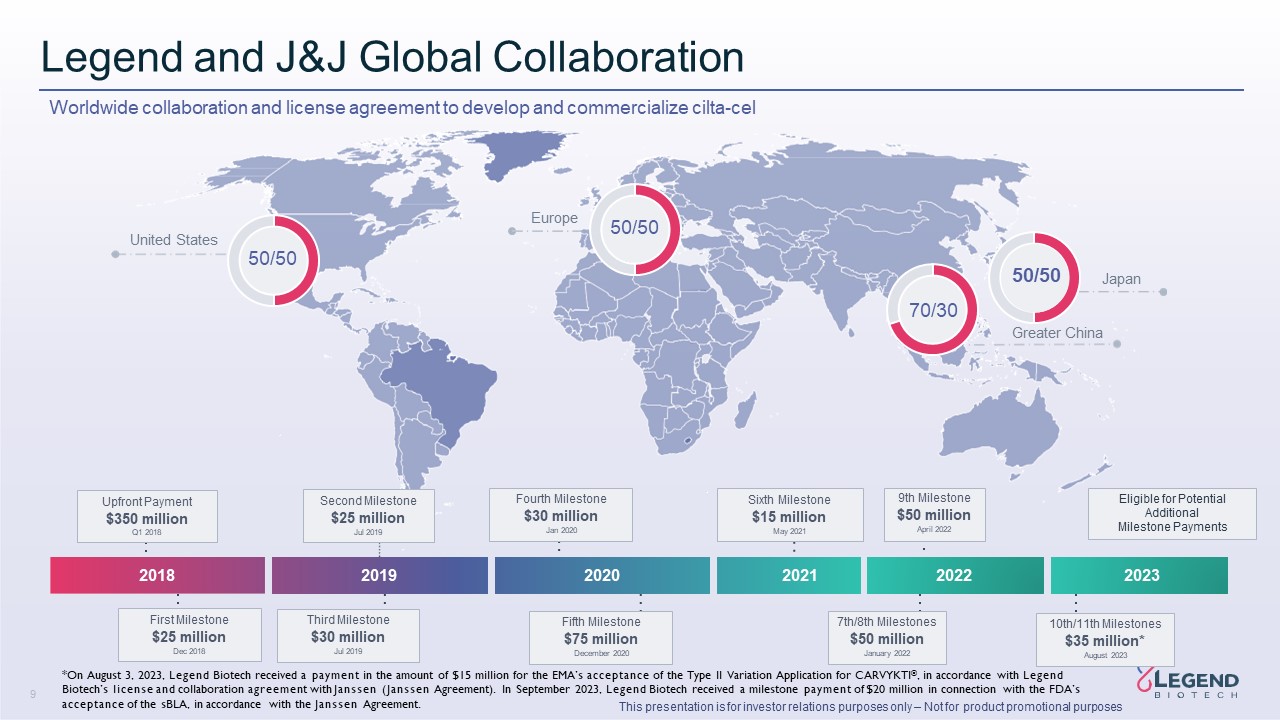
9 本演示僅用於投資者關係目的 — 不用於產品
促銷目的 Legend 和 J&J 全球合作開發和商業化 cilta-cel 2023 2018 2019 2021 有資格獲得潛在的額外里程碑付款第一
里程碑 2018 年 12 月 2,500 萬美元第四里程碑 3,000 萬美元第三里程碑 2019 年 7 月 2,500 萬美元預付款 3.5 億美元 2020 年 12 月 7,500 萬美元第五個里程碑 7,500 萬美元
第六個里程碑 5月1500萬美元2021 50/50 美國歐洲日本 50/50 50/50 70/30 大中華區 7/8 里程碑 2022年1月9日裏程碑 5000萬美元 2022年4月 10/11日裏程碑 3,500萬美元* 2023年8月 *根據聯想生物科技的許可和與Jans的
合作協議,2023年8月3日,聯想生物收到一筆金額為1,500萬美元的款項,用於EMA接受CARVYKTI® 的第二類變更申請(詹森協議)。2023年9月,聯想生物收到一筆2,000萬美元的里程碑式付款,這筆款項與美國食品藥品管理局根據詹森協議接受sBLA有關。

全球製造足跡歐盟設施美國工廠中國
設施新澤西州力登南京 75 英畝新澤西州薩默塞特南京傳奇中國管道項目臨牀供應場地和潛在的中國CARVYKTI® GMP 投產地運營潛力
CARVYKTI® 建設的未來商業用地正在進行美國/歐盟/日本/ROW 啟動/ CARVYKTI® GMP運營商業用地美國/歐盟/日本Legend臨牀供應基地 Pipeline Programs Building E Ghent, Building, Building, E Building, Building, Building促銷目的:比利時根特計劃於2024年1月用於CARVYKTI® 臨牀生產的未來商業用地,預計將於2024年下半年實現商業化生產
CARVYKTI® 建設的未來商業用地正在進行中

擴大我們的製造能力諾華作為臨牀
供應首席營銷官強生內部慢病毒設施*鑑於改善整體供應的獨特挑戰,將細胞療法推向市場最先進的比利時根特的CARVYKTI® 製造設施方尖碑工廠已獲得比利時聯邦藥品和保健品管理局
的臨牀供應制造許可等待地方當局的研究藥品檔案批准預計在生產 cilta-cel 根特用於臨牀用途
in2024 年 1 月以及 2024 年下半年的商業用途 13 本演示文稿僅用於投資者關係目的 — 不用於產品促銷目的 J&J 瑞士的工廠目前正在內部生產慢性病毒
所有商用慢病毒
現已內部生產,我們實現了自給自足。預計強生將在2024年和2025年從美國和荷蘭的工廠提供額外的慢病毒供應,分別在2023年第二季度與諾華簽訂了 CMO 協議於
有望在2024年上半年生產臨牀材料 *所有慢病毒設施均歸強生所有。

與諾華簽訂的針對DLL3 Legend
的CAR-T療法的許可協議於2023年11月13日宣佈與諾華簽訂獨家全球許可協議,以推進某些靶向DLL3的CAR-T療法,包括小細胞肺癌的研究療法 LB2102。Legend 於 2024 年 1 月 3 日宣佈關閉
許可交易。符合預付條件的里程碑式付款高達10.1億美元的可能使用諾華T-Charge™ 平臺進行製造 DL3 開發和成本 → Legend 將在美國
開展 LB2102 的第 1 階段 → 諾華將進行許可產品的所有其他開發加上淨銷售額的分級特許權使用費 13 本演示文稿僅用於投資者關係目的 — 不用於產品促銷目的 1億美元

我們的 Pipeline Global 美國中國 P R E C L I N I C A L P H A S E 2 P H A S E 3 P
H A S E 1 NSCLC (GPC3) 自體 *與強生製藥公司詹森合作。†中國第一階段的個人所得税。‡ IND 申請已獲得美國食品和藥物管理局的批准。§受與
諾華製藥股份公司簽訂的獨家許可協議的約束。根據許可協議,Legend Biotech將在美國進行 LB2102 的1期臨牀試驗,諾華將對許可產品進行所有其他開發。正在調查的藥物
和/或用途的安全性和有效性尚未確定。無法保證這些藥物會獲得衞生當局的批准或在任何國家上市,以用於正在調查的用途。此外,由於某些
項目仍然是機密的,因此某些候選人可能不包括在此列表中。ALL,急性淋巴細胞白血病;BCMA,B 細胞成熟抗原;DLL3,delta樣配體 3;GPC3,glypican-3;GCC,鳥苷環化酶 C;HCC,肝細胞
癌;IIT,研究者發起的試驗;MM,多發性骨髓瘤;ND,新診斷;NHL,非霍奇金淋巴瘤;NSCLC,非小細胞肺癌;RRMM,復發或難治性多發性骨髓瘤;SCLC,小細胞肺癌
癌。結直腸 (GCC) 自體 NHL† /ALL † (CD19 X CD20 X CD22) † 自體 NCT05318963 NCT05292898 MM† (BCMA) 異體 — CAR-T NCT05376345 RRMM (BCMA) LEGEND-2† 自體 NCT03090659 MM† (BCMA) 異體
CAR-NK NCT05498545 胃和食道及胰腺‡ (CLAUDIN 18.2)) Autologous NCT05539430 HCC† (GPC3) Autologous NCT05352542 RRMM (BCMA) * CARTIFAN-1 Autologus NCT03758417 RRMM (BCMA) * CARTITUDE-1 Autolous HCC† (BCMA) * Autolous HCC† (BCMA) * Autolous RRMM (BCMA) * Autologous HCC† (BCMA) * NCT03548207 CARTITUDE-2 NCT04133636 CARTITUDE-4 NCT04181827無意移植 1L CARTITUDE-5 自體 NCT04923893 NDMM (BCMA) * 符合移植資格 1L
CARTITUDE-6 自體 NCT05257083 SCLC‡ § (DLL3) 自體 NCT05680922 13 本演示文稿僅用於投資者關係目的 — 不用於產品促銷目的

近期目標展望:2024 年及以後 → 繼續提高製造
產能和效率 → 從根特工廠開始生產 → 在 24 年上半年完成 CARTITUDE-5 的註冊 → 正在進行的 CARTITUDE-6 註冊 → 推進早期管道計劃 → 如果獲得監管機構的批准,將推出基於 CARTITUDE-4 的來那度胺耐火原料 1-3 個先前生產線
適應症。PDUFA的目標行動日期是2024年4月5日。CHMP預計將在2024年第一季度發表意見 → 將CARVYKTI® 轉向早期療法;提高在美國的滲透率,
向全球市場擴張 → 關注血液學/腫瘤學領域未得到滿足的醫療需求 → 開發具有轉化潛力的療法 → 通過較低的成本和可擴展的製造提高可及性 → 通過
利用外部合作建立全球強國長期增長戰略 13 本演示文稿僅用於投資者關係目的——不用於產品促銷目的