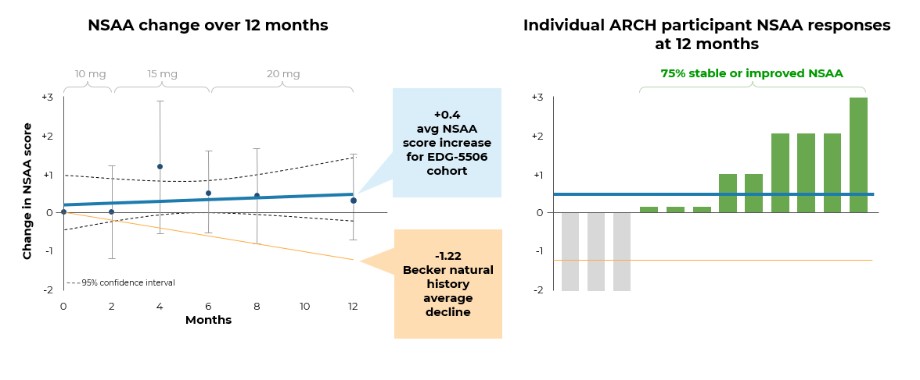
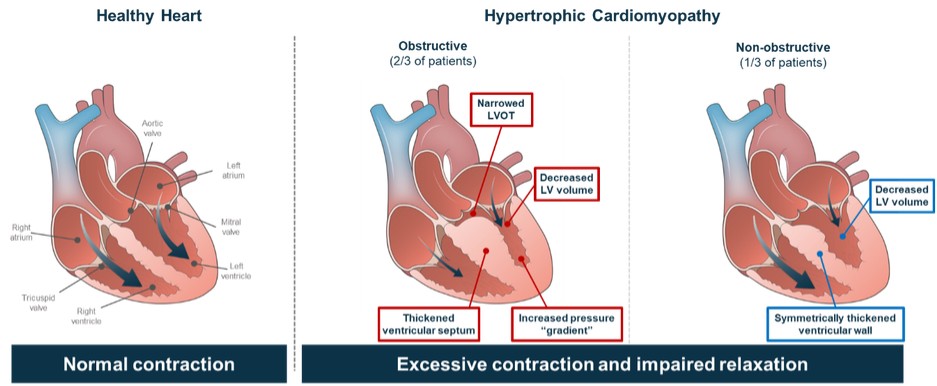
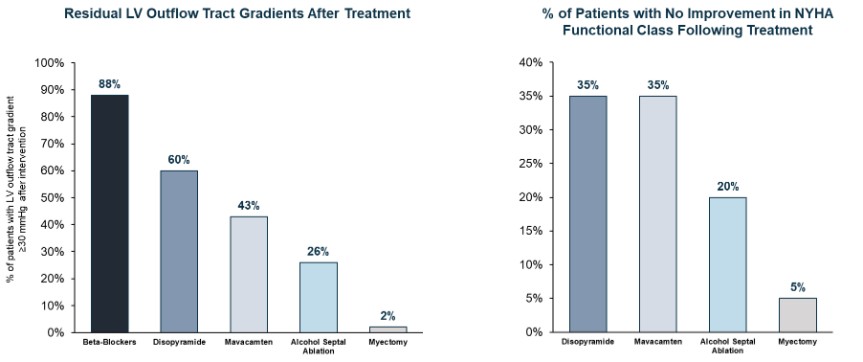
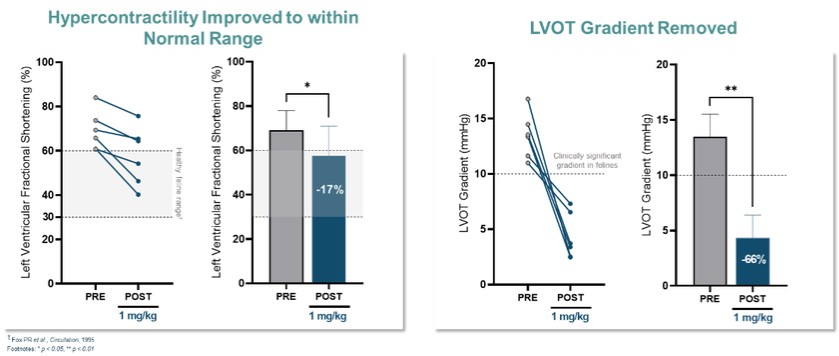
目錄表
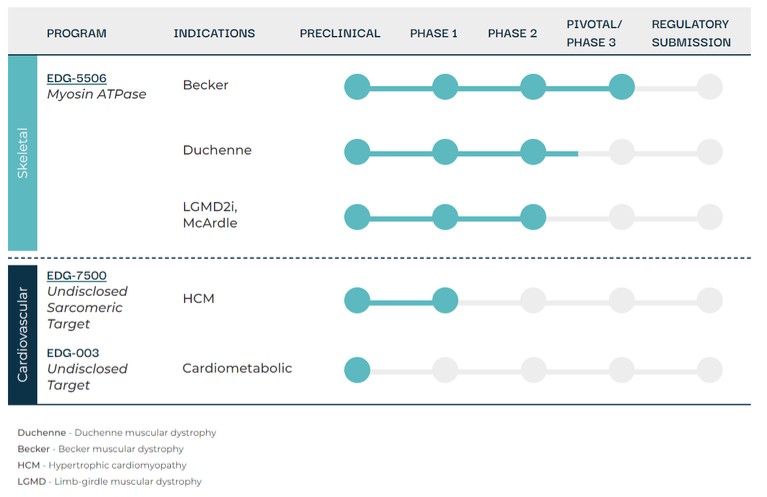
我們的管道
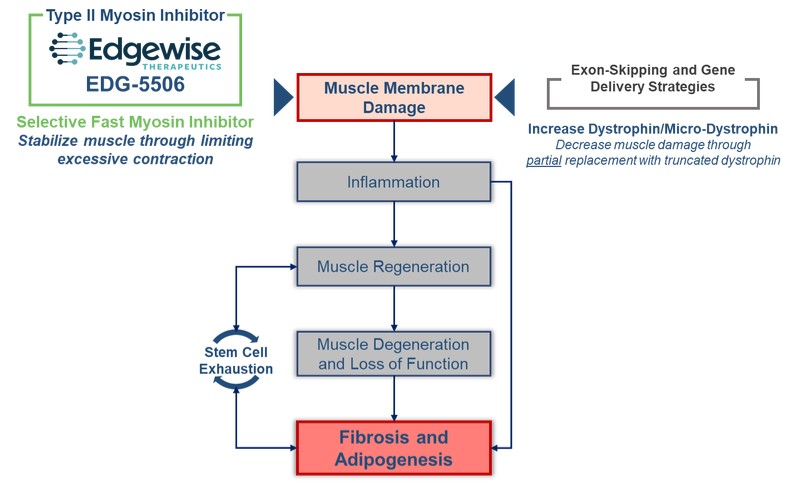
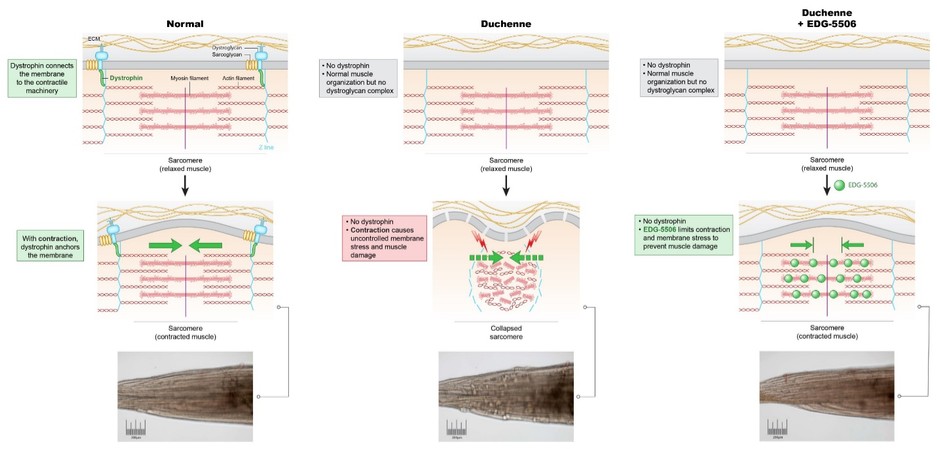
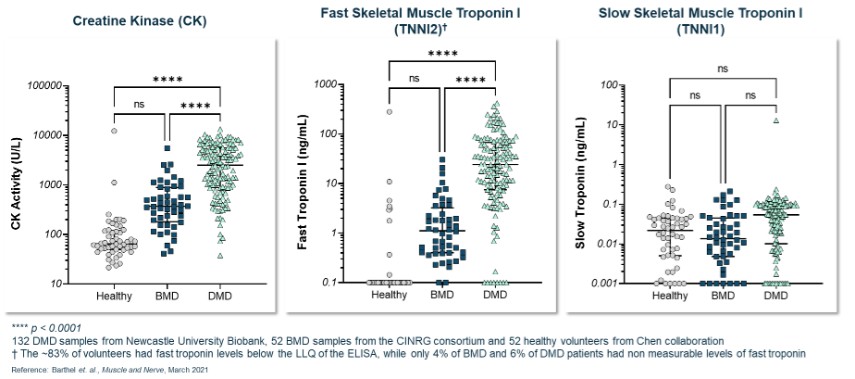
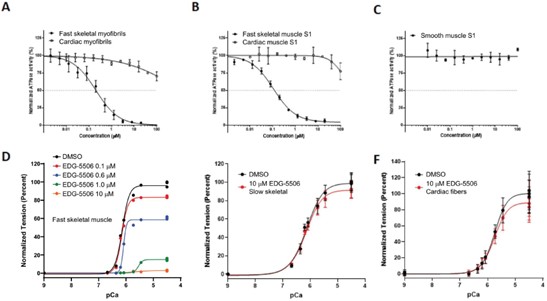
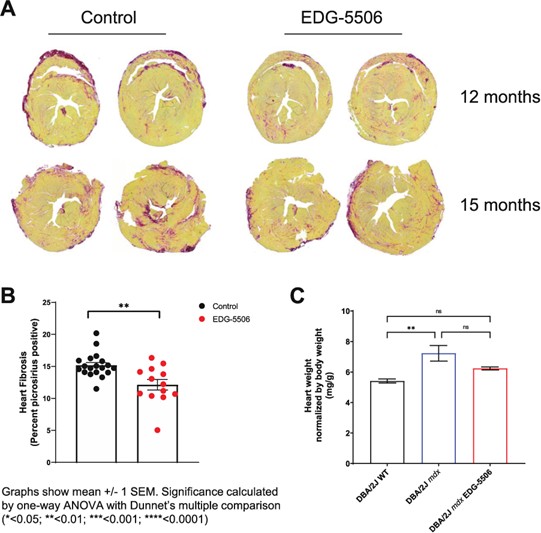
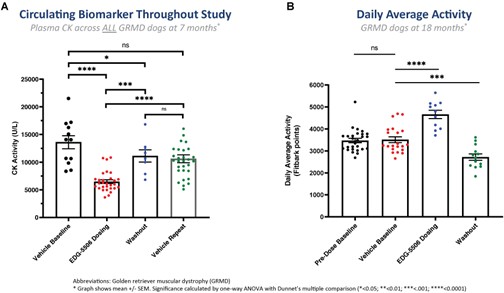
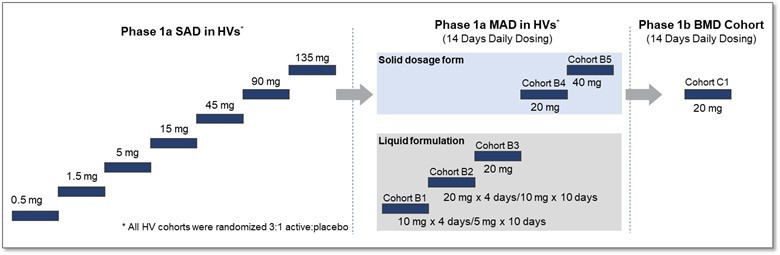
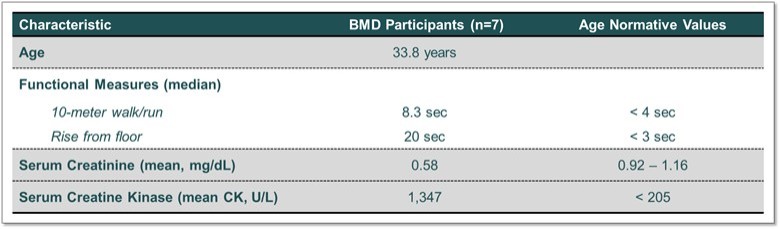
利用我們的專利藥物發現平臺,我們正在開發一系列針對關鍵肌肉蛋白和調節器的精準候選藥物產品,以解決廣泛的肌肉疾病。我們保留了所有項目的全球開發和商業化權利。我們目前正在進行的工作總結如下。
我們的歷史和團隊
我們組建了一支經驗豐富、積極進取的管理團隊,在生物技術和製藥行業有着良好的業績記錄。我們致力於打造一家領先的、以患者為中心、全面整合的全球肌肉疾病公司。我們的團隊成員在肌肉疾病、小分子藥物的發現和開發以及患者倡導方面擁有廣泛的專業知識,並在Alexion、Amgen、Array Biophma、Catabsis、CytoDynamic、Genzyme、GlaxoSmithKline、Parent Project肌肉營養不良、輝瑞、Biogen和MyoKardia等機構擁有成熟的跟蹤記錄。
我們於2017年由我們的首席科學官Alan Russell博士、Peter Thompson醫學博士和Badreddin Edris博士共同創立,前者目前是OrbiMed的合夥人,後者目前是SpringWorks Treateutics,Inc.的首席運營官,資金由OrbiMed提供。羅素博士在為骨骼肌相關疾病開發新療法方面擁有豐富的經驗,曾於2010年至2017年擔任葛蘭素史克副董事長兼肌肉代謝發現表現部門主管,並於2002年至2010年擔任細胞動力學董事、肌肉生物學和治療學助理,期間他是肌萎縮側索硬化症的直接肌肉增敏劑替拉西米夫和瑞地塞米夫的聯合發明人。
我們由Kevin Koch博士領導,他在生命科學行業已有30多年的經驗,專注於藥物發現、轉化醫學和臨牀開發。科赫博士此前曾擔任生物遺傳公司藥物發現、化學和分子治療部門的高級副總裁,負責管理全球藥物發現和生物標記物開發。科赫博士是陣列生物製藥的聯合創始人,從1998年公司成立到2013年擔任首席科學官和董事會成員總裁。在那裏,他建立了一個完全整合的研發團隊,負責監督多個治療領域的20多個臨牀開發候選者的發明,其中幾個現在是上市藥物。在加入陣列之前,科赫博士曾在安進和輝瑞中央研究公司擔任高級職位。此外,我們的首席商務官Behrad Derakhshan博士、我們的首席財務官R.
7