

投資者演示文稿第 42 屆摩根大通 年度醫療保健會議納斯達克:ATRA 附錄 99.1

前瞻性陳述本 演示和隨附的口頭陳述包含根據1995年《私人證券訴訟改革法》的安全港條款做出的前瞻性陳述。本演示文稿中包含的除歷史事實陳述 以外的所有陳述,包括有關我們未來的經營業績和財務狀況、未來交易、業務戰略、產品、候選產品、與監管機構的通信和討論、 監管機構提交的文件、監管批准、臨牀前研究和臨牀試驗以及我們的研發計劃的啟動、時間、進展和結果、EBV 與多發性硬化症之間的機制聯繫以及能力 的 ATA188 具體針對此類鏈接、銷售、製造或以其他方式商業化我們的候選產品和產品的能力、研發成本、成功的時機和可能性、管理層對未來 運營的計劃和目標、任何特許權使用費支付、我們為候選產品和產品獲得和維持知識產權保護的能力,以及Atara為其計劃運營提供資金的現金、現金等價物、短期投資的充足性,均為前瞻性陳述 Atara Biotherapeutics, Inc.(“Atara”)或 “公司”)。這些陳述涉及已知和未知的風險、不確定性和其他重要因素,這些因素可能導致我們的實際 業績、業績或成就與前瞻性陳述所表達或暗示的任何未來業績、業績或成就存在重大差異。在某些情況下,您可以通過前瞻性詞語 來識別這些陳述,例如 “相信”、“可能”、“將”、“估計”、“繼續”、“預期”、“打算”、“可能”、“會”、“項目”、 “預測”、“計劃”、“期望”,或者這些詞語的負數或複數或類似表述。這些前瞻性陳述受風險和不確定性影響,包括 Atara向美國證券交易委員會(SEC)提交的文件中討論的風險和不確定性,包括 公司最近提交的10-K表和10-Q表定期報告的 “風險因素” 和 “管理層對財務狀況和經營業績的討論和分析” 部分,以及其中以引用方式納入的文件。這些風險和不確定性包括但不限於與昂貴而耗時的藥品開發過程以及臨牀成功的不確定性相關的風險和不確定性 ;COVID-19 疫情以及烏克蘭和中東戰爭,這可能會嚴重影響 (i) 我們的業務、 研究、臨牀開發計劃和運營,包括我們在南加州、丹佛和臨牀試驗場所的業務,以及第三方製造商的業務或運營,合同研究與我們開展業務的組織或 其他第三方,(ii)我們獲得資本的能力,以及(iii)我們普通股的價值;未來和待定立法和法規的影響;我們的信息技術和通信 系統的使用和網絡安全攻擊;我們現金資源的充足性和對額外資本的需求,以及可能導致我們或我們行業實際業績、活動水平、業績或成就的其他因素與前瞻性預期存在重大差異聲明。由於前瞻性陳述本質上受風險和不確定性的影響,其中一些是無法預測或量化的,有些是我們無法控制的,因此 您不應依賴這些前瞻性陳述作為對未來事件的預測。我們的前瞻性陳述中反映的事件和情況可能無法實現或發生,實際結果可能與前瞻性陳述中預測的 存在重大差異。除非適用法律要求,否則我們不計劃公開更新或修改此處包含的任何前瞻性陳述,無論是由於任何新信息、未來事件、 情況變化還是其他原因。本演示文稿中包含的某些信息以及本演示期間的口頭陳述涉及或基於從第三方來源獲得的研究、出版物、調查和其他數據以及 Atara 自己的內部估計和研究。儘管Atara認為截至本演示之日這些第三方研究、出版物、調查和其他數據是可靠的,但它尚未獨立核實,也沒有以 的名義陳述從第三方來源獲得的任何信息的充分性、公平性、準確性或完整性。此外,沒有獨立消息來源評估過Atara內部估計或研究的合理性或準確性,也不應 依賴本演示文稿中與此類內部估計和研究有關或基於此類內部估計和研究的任何信息或陳述。本演示文稿的內容受版權保護,版權將由 Atara 主張,未經 Atara 事先書面許可,不得複製 本演示文稿的任何部分、存儲在檢索系統中或以任何形式或任何方式傳輸。

第一家獲得監管機構 批准的異基因T細胞免疫療法的公司於2022年12月獲得EMA的批准;BLA的申請預計將於2024年第二季度提交。擴大與皮爾法伯的全球tab-cel® 合作伙伴關係已於2023年12月結束近期里程碑, ATA3219,採用臨牀驗證技術的異基因CD19 CAR T細胞狼瘡腎炎IND申請預計將在2024年第一季度獲得復發/難治性批准預計 2024 年下半年將有初步臨牀數據的 B-cell NHL 重點運營 活動和相關的戰略重組將 Cash Runway 延續到2027年 ATARA是第一個發揮異基因T細胞療法變革潛力的公司
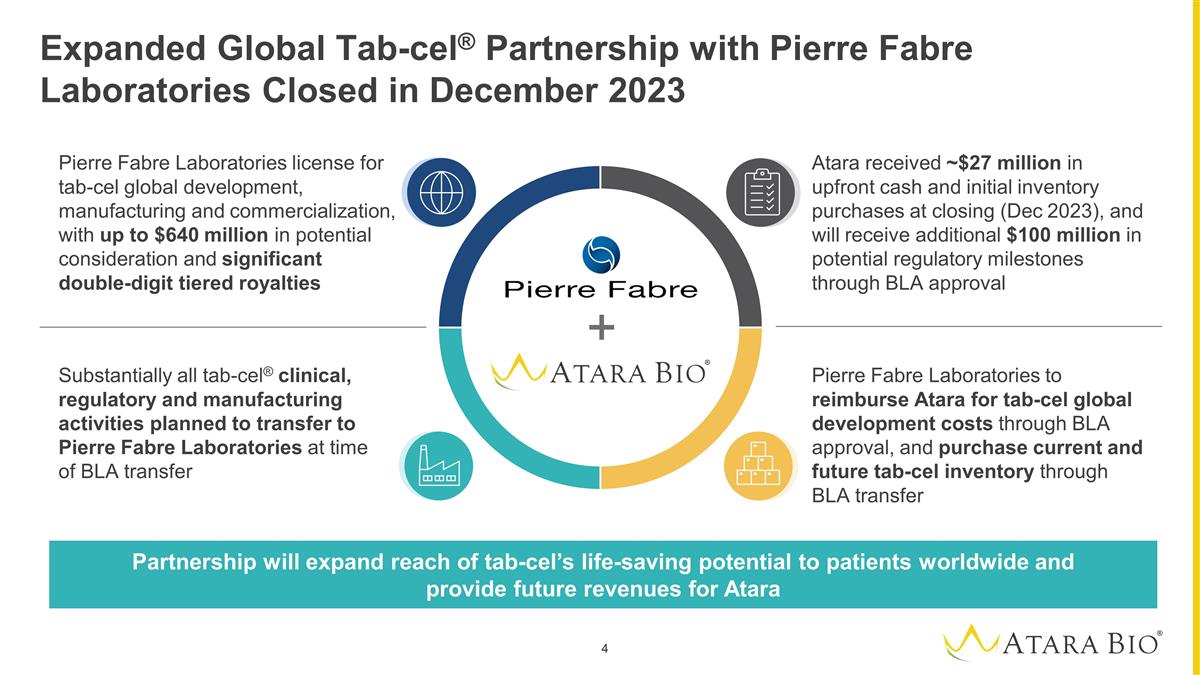
擴大與皮爾法伯實驗室的全球 Tab-cel® 合作伙伴關係已於 2023 年 12 月結束 Pierre Fabre 實驗室的 tab-cel 全球開發、製造和商業化許可證,潛在對價高達 6.4 億美元,以及鉅額的 兩位數分級特許權使用費皮爾法伯實驗室通過 BLA 批准向阿塔拉償還 tab-cel 全球開發成本,並通過 BLA 轉讓購買當前和未來的 tab-cel 庫存幾乎所有 tab-cel® 臨牀、 監管和生產活動計劃於在BLA轉讓時向皮爾法伯實驗室轉移Atara在收盤時(2023年12月)收到了約2700萬美元的預付現金和初始庫存購買,並將通過BLA批准獲得額外的1億美元潛在監管里程碑合作伙伴關係將擴大全球患者對tab-cel救生潛力的覆蓋範圍,併為Atara提供未來的收入

根據強大的臨牀檔案,Tab-cel BLA有望在2024年第二季度提交BLA最新3期等位基因數據削減分析增強了人們對tab-cel BLA申報包的信心 49% ORR(p
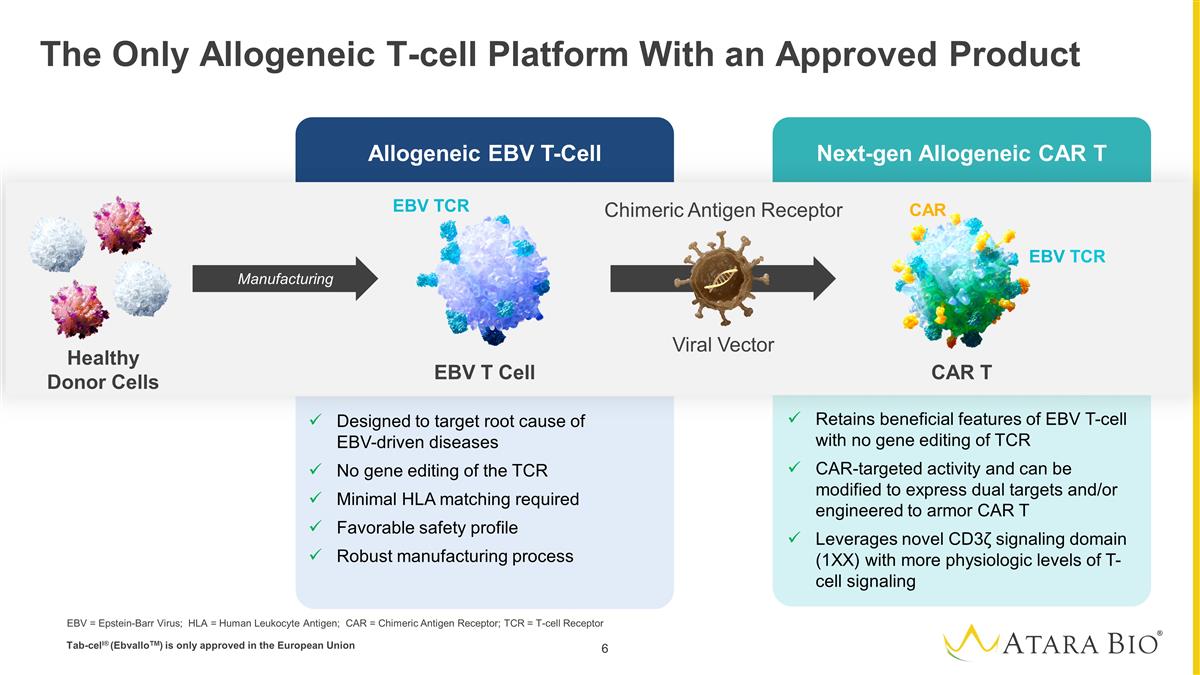
異基因 EBV T-Cell 下一代 Allogeneic CAR T 唯一獲得批准產品的異體 T 細胞平臺專為靶向 EBV 驅動疾病的根本原因而設計無需對 TCR 進行基因編輯 TCR 最低的 HLA 匹配要求良好的安全性配置穩健的製造工藝保留 EBV T 細胞的有益特徵,可以修飾以表達雙重靶標和/或設計成裝甲 CAR T 槓桿新型 CD3信號域 (1XX) 具有更高生理水平的 T 細胞 信號 EBV T 細胞 CAR T Chimeric抗原受體 EBV TCR EBV TCR CAR 製造病毒載體健康供體細胞 EBV = 愛潑斯坦-巴爾病毒;HLA = 人類白細胞抗原;CAR = 嵌合抗原受體;TCR = T 細胞受體 tab-Cell® (ebVallotM) 僅在歐盟獲得批准
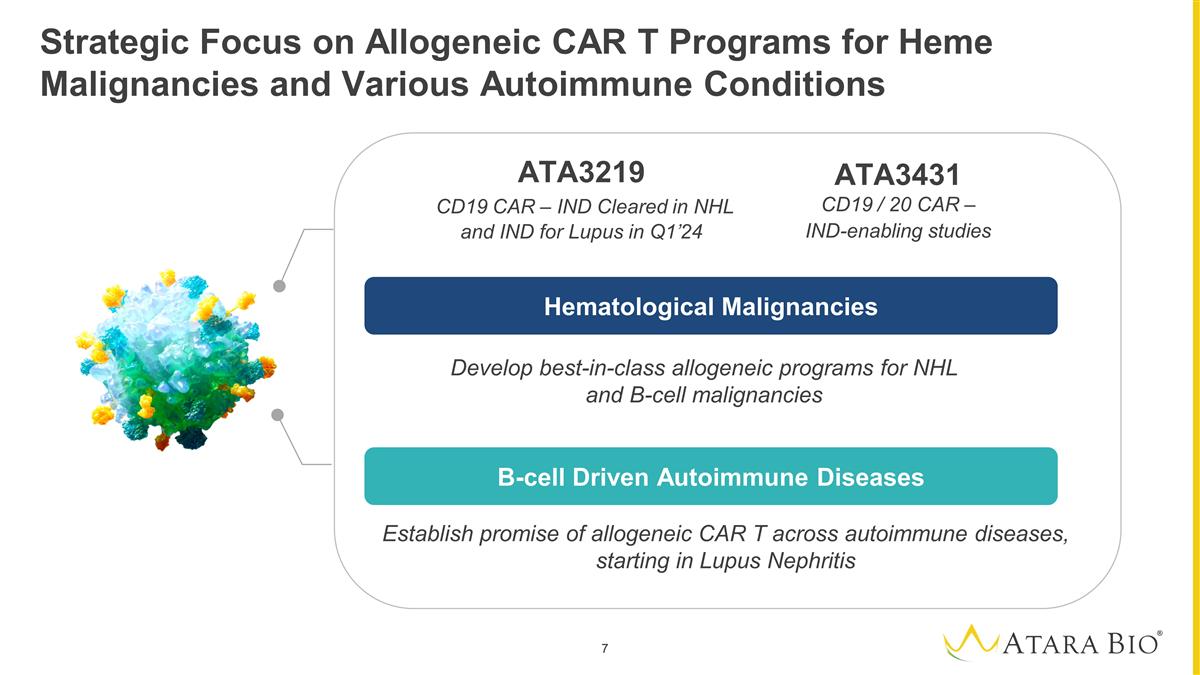
戰略重點是針對血紅素惡性腫瘤和各種自身免疫性疾病的異基因 CAR 項目制定一流的異基因計劃針對 NHL 和 B 細胞惡性腫瘤確定同種異體 CAR T 在自身免疫性疾病中的希望,首先是狼瘡腎炎 `` 血液學惡性腫瘤 B 細胞驅動的自身免疫性疾病 ATA3219 CD19 CAR — IND 在 NHL 和印度 24 年第一季度治療狼瘡 ATA3431 CD19/20 CAR — 支持 IND 的 研究
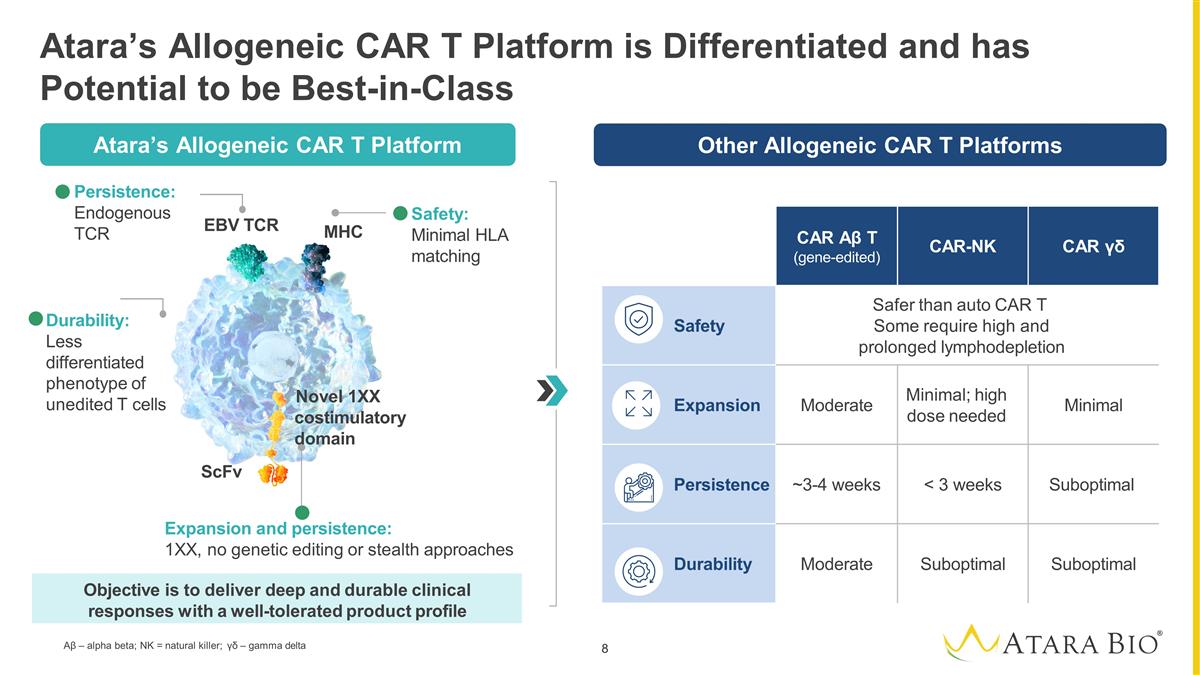
其他同種異體 CAR 平臺 Atara 的異基因 CAR T 平臺具有差異化特性,有可能成為一流的 CAR αβ T(基因編輯)CAR-NK CAR γβ 安全性比汽車 CAR T 更安全有些需要長期的淋巴消耗 膨脹量中等最小;需要高劑量最小持續時間 ~3-4 周

1。Park、JH 等海報 163A。ASH 2022. 2.Curran KJ 等人ASH 2023. 3.Barba、P 等人海報 439。ASH 2022. 9 項來自行業領導者的臨牀驗證證實了我們的異基因 CAR T 平臺 TAK-940 CD19 auto CAR T 的關鍵特性為 1XX 劑量等級 1 (25M),產生 ORR 89%,CR 78% (n=9) 1 Memorial Sloan Kettering 異基因 EBV CD19 CAR T 移植後患者的總存活率可達 3 年2 YTB323 富含 STEM 的汽車 CD19 CAR T 69% 耐用 CR (DL2 — 12.5M,n=30) 3 1 2 3 分化程度較低的 T 細胞耐久性 1XX 信號結構域擴展和持久性內源性 TCR 和最低限度 HLA 匹配持久性和安全性
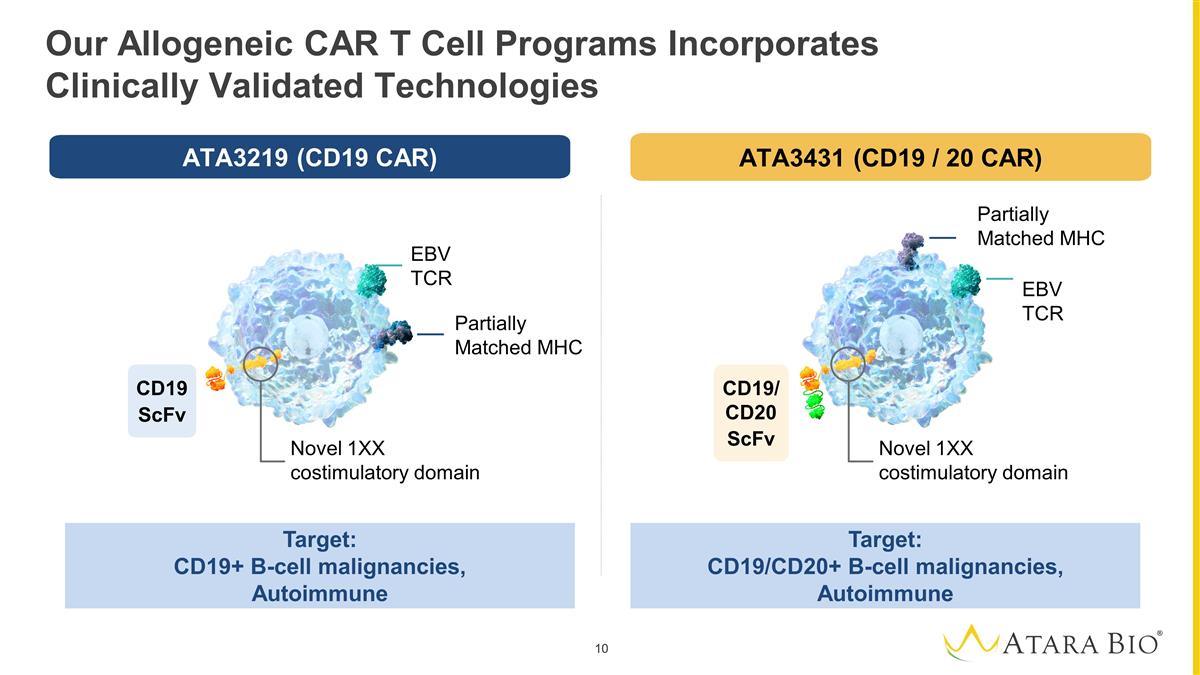
我們的同種異體 CAR T 細胞項目 採用臨牀驗證的技術,靶向:CD19+ B 細胞惡性腫瘤,自身免疫靶標:CD19/CD20+ B 細胞惡性腫瘤,自身免疫性 EBV TCR 部分匹配 MHC 新型 1XX 共刺激結構域新型 1XX 共刺激結構域部分 匹配的 MHC EBV TCR CD19 scfV CD19/CD20 scfV ATA3219 (CD19 CAR) ATA3431(CD19/20 汽車)
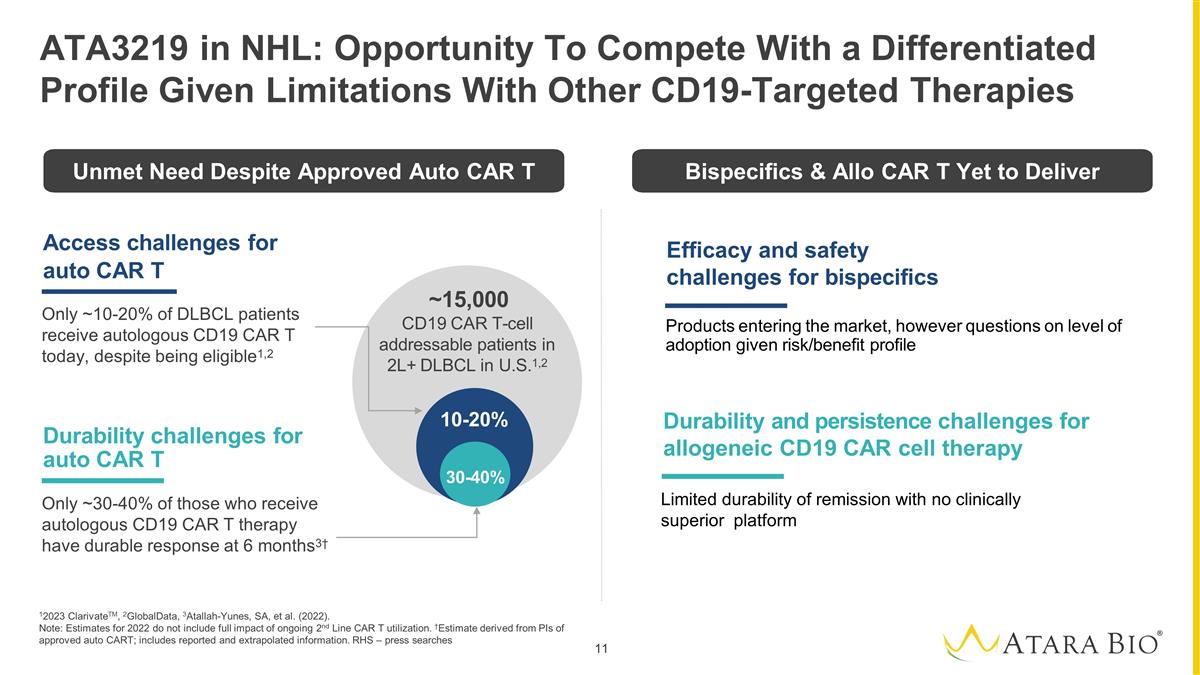
自動 CAR T 僅有大約 10-20% 的 DLBCL 患者儘管有資格接受自體 CD19 CAR T 治療1,2 僅限自體 CAR T 的耐久性挑戰 ~ 30-40% 接受自體 CD19 CAR T 療法的患者在 6 個月時有持久的反應3† 10-20% 30-40% ~15,000 名美國2L+ DLBCL 患者中可尋址的 CD19 CAR T 細胞1,2 12023 ClarivateTM、2GlobalData、3Atallah-Yunes、SA 等(2022年)。注意:2022年的估計值不包括正在進行的二號線CAR T使用率的全部影響。†估計 源自批准的自動 CART 的 PI;包括報告和推斷的信息。RHS — 媒體在 NHL 中搜索 ATA3219:鑑於其他 CD19 靶向療法的侷限性 的耐久性 和異體 CD19 CAR 細胞療法的持續性挑戰,雙特異性產品進入市場的功效和安全性挑戰,但是,鑑於風險/收益概況的採用水平存在問題儘管獲得批准 Auto CAR 雙特異體和 Allo CAR T 尚未提供有限的緩解耐久性沒有臨牀上優越的平臺

ATA3219 臨牀前數據 顯示,在 NHL 中表達變異反應性低的 CD19 腫瘤細胞具有長期體內擴張、多功能表型和高效靶向 5 ATA3219:IND 獲批,Atara 首個異基因 CAR T 1 的 1 期研究已開始。Park、JH 等海報 163A。ASH 2022.2.Stenger D 等人Blood 2020. 3.Barba、P 等人海報 439。ASH 2022.4.沙希德、S 等人海報在 ASH; 2023 上展出。5.Pham、C 等。摘要在 2023 年移植與細胞 療法 (TCT) 會議上發表。臨牀上差異化程度較低的 T 細胞表型與改善和耐久的臨牀反應相關3 1XX 信號結構域與良好的反應率、耐久性和安全性1 保留 定義明確的內源性 TCR,對反應壽命至關重要2 原理證明:對前一代異體 CD19 靶向 CAR EBV T 細胞結構的學術臨牀研究顯示,其總體存活時間可長達三年 12 名造血細胞移植後出現復發/難治性 B 細胞惡性腫瘤的患者4 2 1 3 Novel 1XX共刺激域 EBV TCR CD19 scfV 部分匹配 MHC 2 1 3 ATA3219:下一代現成的異基因 CD19-1XX CAR+ EBV T 細胞 採用了多種經過臨牀驗證的技術
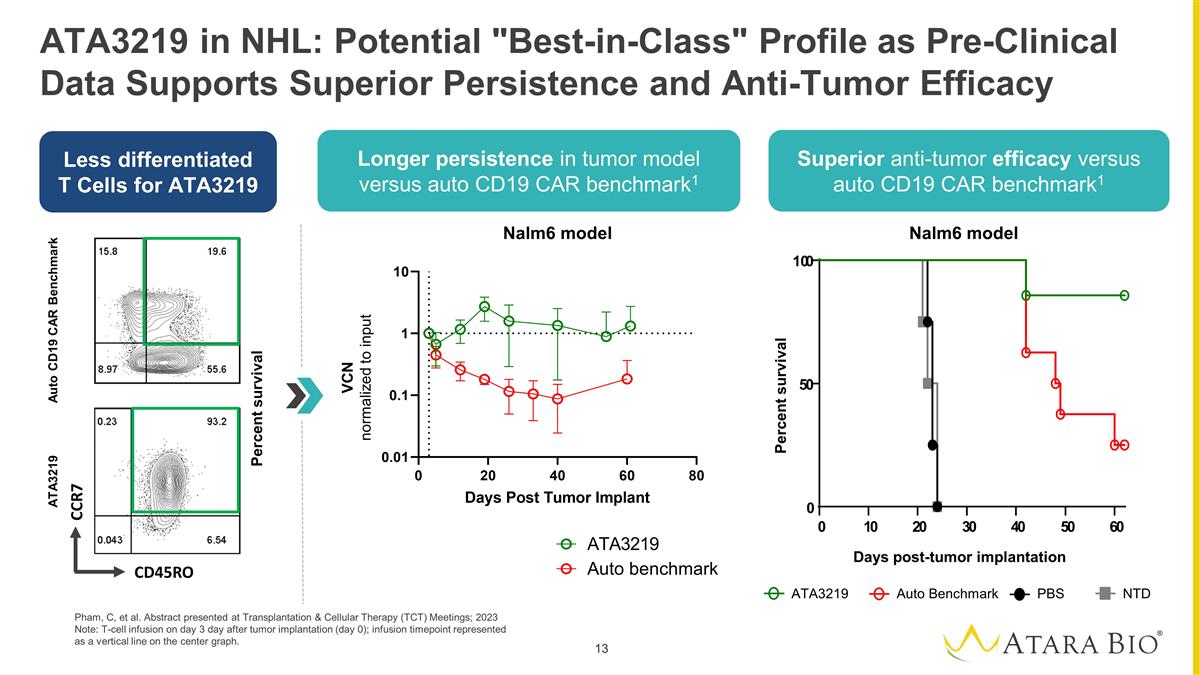
NHL 中的 ATA3219:潛在的 “同類最佳” 概況,因為臨牀前數據支持卓越的持久性和抗腫瘤功效 Pham、C 等人。摘要在移植與細胞療法(TCT)會議上發表;2023 年注意:腫瘤 植入後的第 3 天(第 0 天)輸注 T 細胞;輸液時間點以中心圖上的垂直線表示。ATA3219 差異化較小 T 細胞與自動 CD19 相比在腫瘤模型中的持續時間更長 CAR 基準測試1 與自動 CD19 相比具有卓越的抗腫瘤功效 CAR 基準1 Nalm6 模型 ATA3219 自動基準 PBS 腫瘤移植後存活天數存活百分比 0 1 0 2 0 3 0 4 0 0 6 0 0 0 0 0 VCN 標準化為輸入 Auto CD19 CAR 基準 ATA3219 存活百分比 CR7 CD45RO Nalm6 模型

時間表計劃在 24 年第一季度對狼瘡 腎炎進行臨牀試驗 ATA3219 在自身免疫領域的研究:在勢頭不斷增長的領域,Atara 在狼瘡腎炎領域迅速發展未得到滿足的需求;護理標準和批准的產品療效有限 概念驗證自體 CAR T 學術研究的令人信服的驗證(8/8 名患者在 CAR T 細胞生成 >1 年)Lupus1) 輸液獲得緩解和新興行業數據 Novel Approach 尚無 B 細胞靶向異體產物 狼瘡或自身免疫性疾病的臨牀數據在狼瘡腎炎中使用 CD19 CAR T 的理由 ATA3219 在狼瘡模型中藥效強勁且特異性的 B 細胞耗竭,具有相關的細胞因子反應,分化程度較低 表型和 1XX 驅動細胞適應度可能導致快速和深度消耗 B 細胞的潛力安全性有限狼瘡模型中的非特異性活性無需基因編輯 — 500 多名患有異基因 EBV T 細胞的 疾病患者具有豐富的安全經驗 1XX 旨在減少炎症。許多其他自身免疫性疾病可能會從中受益ATA3219 1.血液 (2023) 142(補充 1):220。

ATA3431:現成的同種異體 CD19/CD20 CAR T 計劃正在進行支持臨牀試驗的研究進展美國血液學會於 2021 年12月舉行的會議上公佈的針對CD19和CD20的積極臨牀前數據降低了因CD19抗原丟失而復發的可能性, 據推測是CD19 CAR T治療後出現耐藥性或疾病復發的主要原因。靶向CD19和CD20提供潛在的增量療效益處和 1XX 共刺激可增強持久性 Autologous CD19/CD20 雙 CAR T 已顯示出令人鼓舞的療效和臨牀試驗中的安全性(IMPT-314)ATA3431 臨牀前數據顯示,基於強效的抗腫瘤活性、長期持久性和卓越的腫瘤生長抑制作用 EBV TCR 部分匹配的 MHC Novel 1XX 共刺激結構域 CD19/CD20 scfV Cha、S 等人。海報 4800。ATA3431:用於治療 B 細胞惡性腫瘤的異體 CD19/CD20 雙特異性 CAR EBV T 細胞。灰燼 2023。
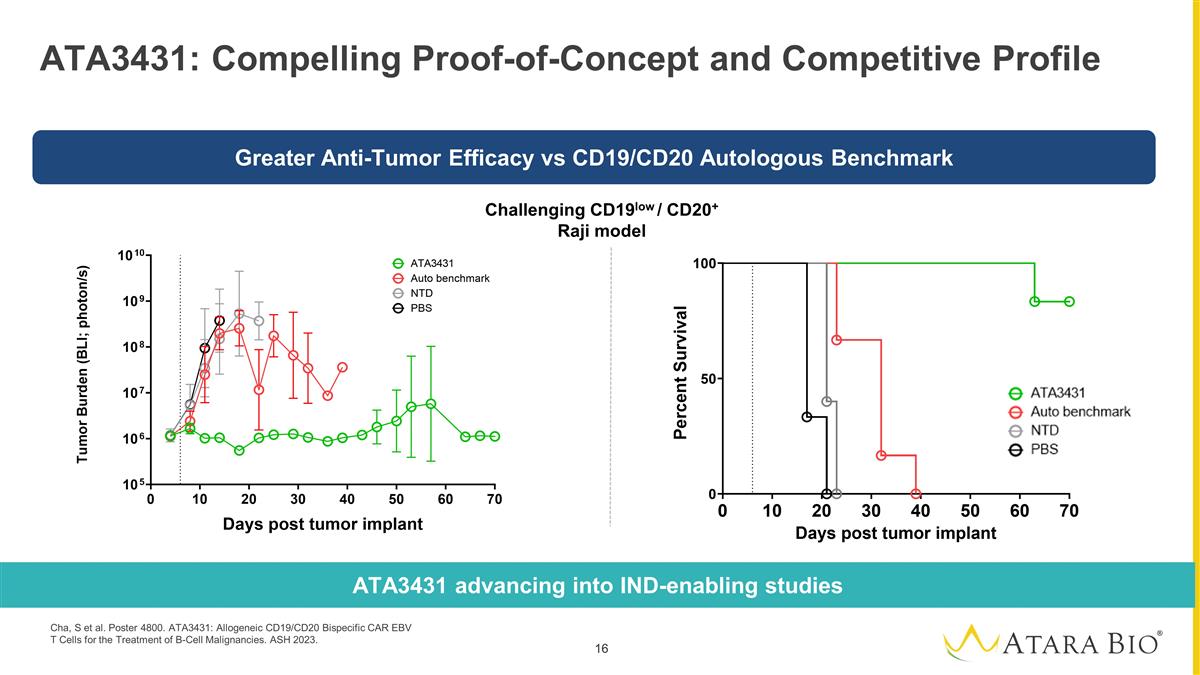
ATA3431:引人注目的 概念驗證和競爭概況挑戰 CD19low/CD20+ Raji 模型 ATA3431 進入支持臨牀試驗的研究與 CD19/CD20 自體基準測試相比,抗腫瘤療效更高 Cha、S 等人海報 4800。ATA3431:用於治療 B 細胞惡性腫瘤的異體 CD19/CD20 雙特異性 CAR EBV T 細胞。灰燼 2023。
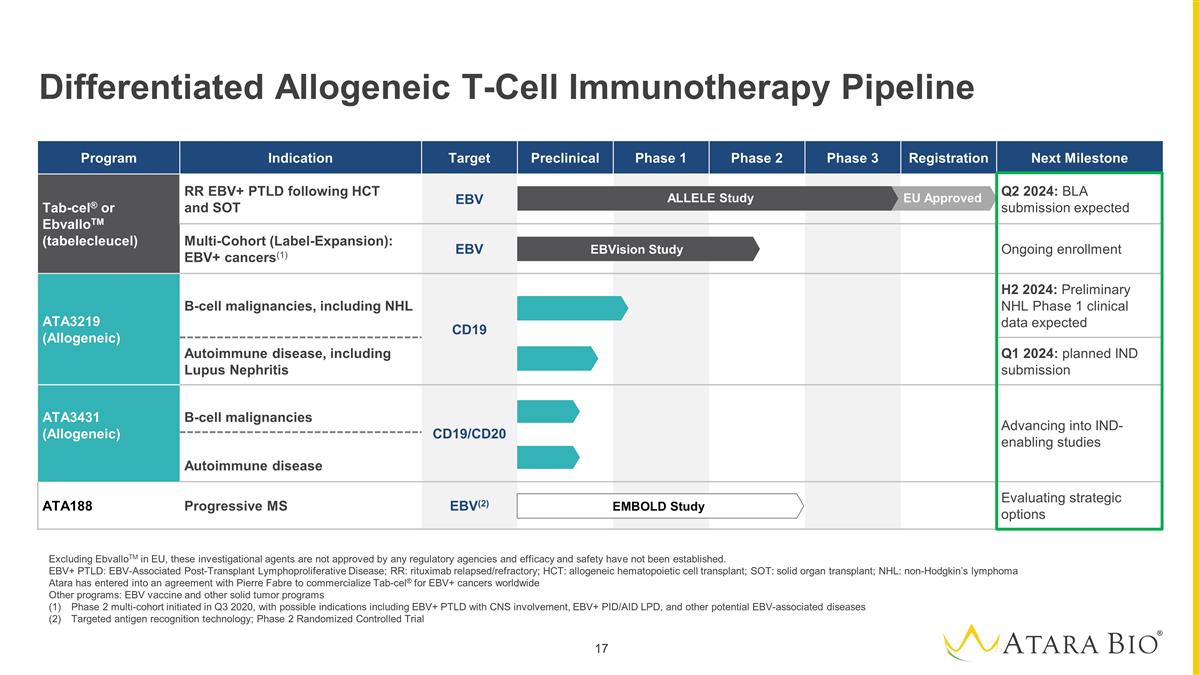
差異化異體T細胞 免疫療法產品線不包括歐盟的ebvalloTM,這些研究藥物未經任何監管機構的批准,療效和安全性尚未確定。EBV+ PTLD:EBV 相關移植後淋巴細胞增生性疾病;RR: 利妥昔單抗復發/難治性;HCT:異基因造血細胞移植;SOT:實體器官移植;NHL:非霍奇金淋巴瘤 Atara 已與皮爾法伯達成協議,將用於EBV+癌症的Tab-Cel® 商業化 全球其他項目:EBV 疫苗和其他實體瘤項目 2 期多隊列於 2020 年第三季度啟動,可能的適應症包括受累中樞神經系統的 EBV+ PTLD、EBV+ PID/AID LPD 以及其他潛在的 EBV 相關疾病 靶向疾病抗原識別技術;2 期隨機對照試驗計劃適應症目標臨牀前 1 期 2 期 3 期註冊下一個里程碑 Tab-cel® 或 ebvalloTM(tabelecleucel)RR EBV+ PTLD 繼 HCT 和 SOT EBV 第二季度之後:BLA 預計提交多隊列(標籤擴展):EBV+ 癌症(1)EBV 正在進行的入組 ATA3219(異基因)B 細胞惡性腫瘤腫瘤,包括 NHL CD19 H2 2024:NHL 1 期初步臨牀數據預計會出現自身免疫性疾病, 包括 2024 年第一季度狼瘡腎炎:計劃提交 IND ATA3431(異基因)B 細胞惡性腫瘤 CD19/CD20 進入支持臨牀試驗的研究自身免疫性疾病 ATA188 進行性多發性硬化症 EBV (2) 評估戰略選擇 EMBOLD 研究 ebVision 研究 歐盟批准的等位基因研究

謝謝納斯達克:ATRA