附錄 99.1
在一項針對輕度至中度阿爾茨海默氏病的隨機戒斷試驗中,口服 Simufilam 減緩了認知能力下降
德克薩斯州奧斯汀,2023年7月5日(GLOBE NEWSWIRE)——生物技術公司Cassava Sciences, Inc.(納斯達克股票代碼:SAVA)今天公佈了其認知維持研究(CMS)的頂級臨牀結果。CMS是一項小型概念驗證研究,旨在證明藥物與安慰劑在隨機戒斷試驗設計中的作用。該研究招收了157名患有輕度至中度阿爾茨海默氏病的患者,這是一種更晚期、更難治療的疾病階段。
在這項雙盲、安慰劑對照的隨機研究中,所有患者首先接受開放標籤 simufilam 100 mg,持續 12 個月;然後隨機分組(1:1)接受simufilam 100 mg或安慰劑治療 6 個月。16 個美國臨牀研究機構參與其中。CMS有一個預先指定的認知終點:藥物與安慰劑相比,Adas-Cog11分數在6個月內的平均變化。
在輕度至中度阿爾茨海默氏病(MMSE 16-26)中,與安慰劑相比,6個月的Simufilam治療使認知能力下降減緩了38%。安慰劑組在ADAS-Cog上下降了1.5個百分點,而該組在所有測得的時間點都下降了1.5個百分點。simufilam分組在ADAS-Cog上下降了0.9個百分點,在第6個月,偏向藥物的差異為38%(95%置信區間,—2.1至1.0;樣本量不顯著)。參見表 1 和圖表 1。
表 1:隨機退出研究的結果——認知變化,完整分析集(FAS)
| 完整分析集 | Simufilam 100 毫克 (N = 78) | 安慰劑 (N = 77) | 數值差異 | 百分比差異 |
| 6 個月的變動 ADAS-COG | 0.9 個積分 拒絕 | 1.5 個積分 拒絕 | – 0.6 | 38% 的人贊成毒品 |

隨機分為CMS後,simufilam和安慰劑組的平均基線MMSE分數分別為18.6和18.1。simufilam和安慰劑組的平均基線ADAS-Cog分數分別為19.3和21.9。
首席醫學官詹姆斯·庫皮克醫學博士説:“在18個月的大型3期試驗中,單克隆抗體藥物使阿爾茨海默氏症早期患者的認知能力下降減緩了35%或更少。”“在這種情況下,我們認為我們為期6個月的研究結果令人鼓舞,儘管與大型3期試驗相比,我們的隨機戒斷研究在患者選擇以及設計和結果方面存在巨大差異。”
Simufilam藥物的作用有利於輕度阿爾茨海默氏病患者。
與安慰劑相比,6個月的Simufilam治療使認知能力下降減緩了> 200% 温和的阿爾茨海默病。CMS 患者 温和的安慰劑的阿爾茨海默氏症(MMSE 21-26)在6個月內Adas-cog上下降了0.6個百分點。CMS 患者 温和的作為一個羣體,simufilam服用的阿爾茨海默氏症在6個月內改善了0.6個百分點,有利於藥物的差異為205%(95%置信區間,——2.6比0.4;對樣本量來説並不顯著)。參見表 2 和圖表 2。
表 2:隨機戒斷研究結果 — 認知變化,輕度患者
| 輕度患者 | Simufilam 100 毫克 (N= 40) | 安慰劑 (N= 36) | 數值差異 | 百分比差異 |
| 6 個月的變動 ADAS-COG | 0.6 個積分 改進 | 0.6 個積分 拒絕 | – 1.1 | 205% 的人贊成使用藥物 |
總裁兼首席執行官雷米·巴比爾説:“患者在註冊CMS之前開始服用開放標籤的simufilam12個月。”“實際上,服用安慰劑的CMS患者已停用simufilam6個月。這個安慰劑組下降了,而隨機分配到simufilam的CMS組有所改善。我們認為,這兩隻手臂之間正在出現的認知分數分離是一種藥物效應。”
Pentara Corporation首席執行官蘇珊娜·亨德里克斯博士補充説:“simufilam的業績仍然值得注意。根據ADAS-COG在輕度患者治療18個月內衡量,認知能力缺乏進展,遠遠超出了許多其他研究中歷史安慰劑下降率的範圍。CMS中的安慰劑組已再次開始下降,但繼續保持與歷史安慰劑組相比的益處。”

隨機分配到 CMS 後,平均基線 MMSE 分數 温和的simufilam 和安慰劑組的患者分別為 MMSE 24.0 和 MMSE 24.1。的平均基線 ADAS-COG 分數 温和的simufilam 和安慰劑組的患者分別為 11.0 和 11.2。
Simufilam 在 18 個月內穩定了認知能力 温和的阿爾茨海默病。
服用開放標籤 simufilam 12 個月後,76 名患者患有 温和的阿爾茨海默氏病(MMSE 21-26)加入了CMS,並被隨機分配接受simufilam(N=40)或安慰劑(N=36),持續6個月。在CMS中隨機使用simufilam的輕度患者,在18個月內,ADAS-COG分數沒有實質性下降,這表明認知能力穩定。在CMS中隨機使用安慰劑(因此退出simufilam治療6個月)的輕度患者在ADAS-COG中下降了0.8個百分點。參見圖 1。
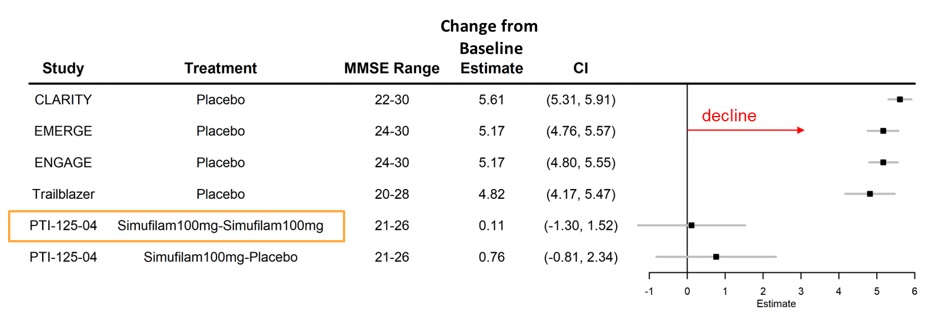
圖 1。在阿爾茨海默氏病(MMSE 20-30)、安慰劑武器與simufilam治療方面,ADAS-cog在18個月內歷史性下降。1備註:Lecanemab 的 CLARITY P3 試驗、阿杜卡努單抗的 EMERGE 和 ENGAGE P3 研究以及多那那單抗的 TRAILBLAZER P3 試驗顯示了結果;在本圖中,CMS 被稱為 “PTI-125-04” 研究;“simufilam100mg” 是指在開放標籤階段和 CMS 階段均接受西穆菲蘭治療的患者;'simufilam100mg' 是指在開放標籤階段和 CMS 接受西姆非蘭治療的患者;'simufilam100mg' filam100mg-Placebo” 是指在開放標籤階段接受西姆非拉姆和在CMS中接受安慰劑的患者。
安全數據
在這項研究中,每天兩次 100 mg Simufilam 是安全的,耐受性良好。沒有發生與藥物相關的嚴重不良事件。在CMS的研究參與者中,有5%或更多的研究參與者沒有發生治療緊急不良事件(TEAE)。
討論
CMS 是一項隨機退出研究。完成12個月的開放標籤simufilam治療的患者都被邀請參加CMS。目前尚不清楚可能需要多長時間的洗滌期才能消除先前12個月的開放標籤西姆非拉姆治療中揮之不去的藥物作用(如果有的話)。
在這項針對輕度至中度阿爾茨海默氏病患者口服西姆非拉姆的小型研究中,預先規定的認知終點顯示,六個月內ADAS-Cog下降了38%,轉而使用simufilam,藥物安全性良好。在輕度患者中效果明顯。鑑於每隻手臂的體積都很小,平均基線 MMSE 和 ADAS-Cog 分數大致保持平衡。
療效終點分析
Pentara Corporation對預先指定的認知終點進行了分析,Pentara Corporation是一家專門對臨牀試驗結果進行復雜統計分析的獨立諮詢公司。Pentara首席執行官蘇珊娜·亨德里克斯博士發表了150多篇關於臨牀試驗結果和臨牀試驗統計方法的同行評審出版物,其中許多出版物側重於阿爾茨海默氏病的統計方法。
臨牀數據的監管鏈
研究人員網站從研究參與者那裏收集了臨牀數據。站點將其臨牀數據直接輸入到由獨立的外部數據管理供應商管理的電子數據採集系統中。數據管理供應商還維護臨牀數據庫。數據管理供應商將臨牀數據庫直接傳輸給 Pentara 公司進行分析。
研究侷限性
CMS是一項概念驗證研究,涉及少量患者和有限的數據。頂級臨牀CMS結果不構成也不應解釋為simufilam在阿爾茨海默病中的安全性或有效性的監管證據。藥物安全性和有效性的嚴格證據來自一項或多項大型隨機安慰劑對照的3期研究。CMS 的有限規模可能會帶來臨牀或統計偏差,或者可能產生的結果可能無法完全區分藥物效應和隨機變異。對同一研究的臨牀數據進行不同的統計分析方法可能會導致客觀上不同的數值結果。我們CMS研究的這些以及其他統計和臨牀特徵增加了數據解釋範圍的複雜性或侷限性。此外,“頂線數據” 是臨牀數據庫完成全面和最終審計或質量控制之前的臨牀數據的摘要。我們正在傳達第一線數據,以便利益相關者可以在我們收到最終數據集之前及時獲得CMS調查結果的摘要。最終數據可能會與今天的頂線數據有所不同。
正在進行的 Simufilam 三期研究
Cassava Sciences目前正在兩項3期臨牀研究中評估simufilam片劑治療阿爾茨海默氏病痴呆症。這些是大型的隨機、雙盲、安慰劑對照試驗。第三階段計劃共招募了大約1,750名同時符合其他研究資格標準的輕度至中度阿爾茨海默氏病患者。這兩項第三期研究均已獲得美國食品藥品監督管理局的特殊方案評估 (SPA)。三期研究正在美國、加拿大、波多黎各、韓國和澳大利亞的100多個臨牀場所積極招募阿爾茨海默氏症患者。
預計到2023年年底,這兩項3期研究的患者入組工作都將完成。
關於 Simufilam
Simufilam是木薯科學專有的小分子(口服)候選藥物,可恢復大腦中改變後的纖維素A(FLNA)蛋白的正常形狀和功能。Cassava Sciences擁有其阿爾茨海默氏病研究項目和相關技術的全球開發和商業權利,不對任何第三方承擔特許權使用費。
關於 Cassava Sciences, Inc.
Cassava Sciences是一家臨牀階段的生物技術公司,總部位於德克薩斯州奧斯汀。我們的使命是檢測和治療神經退行性疾病,例如阿爾茨海默氏病。我們的新科學的基礎是穩定大腦中的關鍵蛋白質,但不去除這種蛋白質。我們的候選產品尚未獲得任何監管機構的批准,其安全性、有效性或其他理想屬性尚未確定。
欲瞭解更多信息,請訪問:https://www.CassavaSciences.com
欲瞭解更多信息,請聯繫:
埃裏克·肖恩,首席財務官
(512) 501-2450
ESchoen@CassavaSciences.com
關於前瞻性陳述的警示説明:
本新聞稿包含前瞻性陳述,包括根據1995年《私人證券訴訟改革法》的安全港條款發表的聲明,內容涉及: 我們對阿爾茨海默病患者的隨機戒斷研究或 simufilam 第 3 期計劃的設計、範圍、實施或預期目的;simufilam 為患者提供藥物作用的能力;simufilam 有利於輕度阿爾茨海默氏病患者的明顯能力; simufilam在CMS臨牀試驗中的安全性或耐受性;我們目前對3期研究的時間和目標患者入組人數的期望; 3期研究的任何預期臨牀結果;阿爾茨海默病痴呆患者的治療;simufilam對阿爾茨海默病痴呆患者的安全性或療效;我們的員工對simufilam、藥物作用和阿爾茨海默病治療的評論;以及我們的候選產品的潛在益處(如果有)。這些陳述可以用 “可能”、“預期”、“相信”、“可以”、“期望”、“將”、“預測”、“打算”、“計劃”、“可能”、“潛在” 等詞語以及其他含義相似的詞語和術語來識別。
Simufilam 是我們的研究候選產品。它未經任何司法管轄區的任何監管機構的批准,其安全性、有效性或其他理想屬性尚未在患者身上得到證實。
藥物開發涉及高風險,只有少數研發計劃會導致產品的監管批准和商業化。 我們先前研究的臨牀結果可能並不代表未來或更大規模的臨牀試驗的結果,也不能確保監管部門的批准。您不應過分依賴這些陳述或我們提供或發佈的任何科學數據。
此類陳述主要基於我們當前對未來事件的預期和預測。此類陳述僅代表截至本新聞稿發佈之日,並受許多風險、不確定性和假設的影響,包括但不限於與在預期時間表內進行或完成臨牀研究、證明我們候選產品的特殊性、安全性、有效性或潛在健康益處的能力有關的風險、通貨膨脹對我們業務運營的任何意想不到的影響,以及我們的年度表格中標題為 “風險因素” 的部分中描述的風險截至12月31日的年度為10-K2022年,以及將向美國證券交易委員會提交的未來報告。上述內容列出了許多(但不是全部)可能導致實際業績與任何前瞻性陳述中的預期不同的因素。鑑於這些風險、不確定性和假設,本新聞稿中討論的前瞻性陳述和事件本質上是不確定的,可能不會發生,實際結果可能與前瞻性陳述中預期或暗示的結果存在重大不利差異。因此,您不應依賴前瞻性陳述作為對未來事件的預測。除非法律要求,否則我們對更新或修改本新聞稿中包含的任何前瞻性陳述不承擔任何意圖或責任。有關這些風險以及與我們的業務相關的其他風險的更多信息,投資者應查閲我們向美國證券交易委員會提交的文件,這些文件可在美國證券交易委員會的網站上查閲 www.sec.gov.
本新聞稿還可能包含基於獨立行業出版物或其他公開信息的統計數據和藥物信息。我們尚未獨立驗證這些公開數據和信息來源中包含的數據的準確性或完整性。因此,我們對此類數據或信息的準確性或完整性不作任何陳述。提醒您不要過分重視此類數據。
本演示文稿的內容完全由我們負責,並不代表美國國立衞生研究院或任何其他政府機構的官方觀點。
___________________________________
1圖 1:彭塔拉公司的森林地塊。數據來自安慰劑組,這些試驗是由其他贊助者在阿爾茨海默氏病(MMSE 20-30)中進行的單克隆抗體的隨機對照試驗。
本公告附帶的照片可在以下網址獲得
https://www.globenewswire.com/NewsRoom/AttachmentNg/c920d107-3c33-450a-b801-48b008614378
https://www.globenewswire.com/NewsRoom/AttachmentNg/35197b1c-ad89-4067-b692-2163afc22158
https://www.globenewswire.com/NewsRoom/AttachmentNg/bb23047a-5f15-4047-b402-c3cce6d70290