

附錄 99.2 帕圖索汀 3 期 PATHFNDR-2 研究的主要結果 2024 年 3 月 19 日,一項隨機、安慰劑對照、多中心研究,旨在評估帕替西汀對非藥物治療的肢端肥大症受試者的安全性和有效性 1

安全港聲明本演示文稿包含前瞻性 陳述。Crinetics Pharmaceutics, Inc.(“Crinetics”、“公司”、“我們” 或 “我們的”)提醒您,本演示文稿中有關非 歷史事實的事項的陳述均為前瞻性陳述。這些陳述基於公司當前的信念和期望。此類前瞻性陳述包括但不限於以下方面的陳述: 帕替索汀的戰略目標;帕替索汀臨牀開發的計劃和時間表,包括其治療潛力和臨牀益處或安全性;提交用於治療肢端肥大症的帕圖索汀 新藥申請和相關的開放標籤延期研究的預計時間;分享全部結果的計劃和時機與美國食品藥品管理局對類癌綜合徵中的帕圖索汀的二期研究保持一致關於 3 期計劃以及相關開放標籤擴展研究的計劃和入組 ;CRN04894 對先天性腎上腺增生症或庫欣氏病患者的潛在益處,以及正在進行的臨牀 研究數據和頭條數據讀出的預期計劃和時機;PTH 受體拮抗劑對甲狀旁腺功能亢進患者的潛在益處,促甲狀旁腺激素拮抗劑的潛在益處針對格雷夫斯病或甲狀腺眼病;我們正在進行的任何臨牀研究 顯示安全性或有效性的可能性;我們正在進行的針對甲狀旁腺功能亢進、多囊腎病、格雷夫斯病、甲狀腺眼病或糖尿病/肥胖症未來適應症的研究可能性,以及 候選藥物篩選和臨牀開發此類候選藥物的預期計劃和時機;我們為其他疾病確定和開發新候選藥物的計劃,或任何此類新候選藥物顯示安全性或有效性的可能性;方向或軌跡 公司的潛在未來增長、從產品銷售中獲得的任何收入以及此類收入支持持續增長的能力,以及我們預期的帕圖索汀和其他候選產品 商業化的計劃和時機,尚待監管部門批准;帕圖索汀作為首個用於治療肢端肥大症的每日一次口服 SRL 的商業化;帕圖索汀有效為肢端肥大症 患者提供症狀控制和生化控制的能力;以及麻痺症的商業認可奧汀作為肢端肥大症的新療法,可改善治療經驗和獲得護理的機會患者和醫療提供者。在某些情況下,你可以通過諸如 “可能”、“相信”、“預期”、“可能”、“應該”、“估計”、“預期”、“打算”、“計劃”、“項目”、“將”、“考慮”、“預測”、“繼續”、“預測”、“渴望” 等術語來識別前瞻性 陳述 “目標”、“潛在”、 “目標” 或否定詞或其他類似術語。這些陳述僅代表截至本演講之日,涉及已知和未知的風險、不確定性、假設和其他重要因素,這些因素可能導致我們的實際 業績、業績或成就與前瞻性陳述所表達或暗示的任何未來業績、業績或成就存在重大差異,包括但不限於:在對與臨牀研究和此類數據相關的數據進行更全面的審查後,我們報告的標題和初始數據可能 發生變化可能無法準確反映臨牀研究的完整結果,美國食品和藥物管理局和其他監管機構可能不同意我們對此類結果的解釋;臨牀前研究或臨牀研究的初步結果不一定能預測最終結果,並且隨着患者入組 的繼續,對數據進行更全面的審查,以及隨着更多患者數據的出現,可能出現不利的新臨牀數據和對現有臨牀數據的進一步分析,出現不利的新臨牀數據和對現有臨牀數據的進一步分析臨牀數據;潛在延遲在開始、註冊 和完成臨牀研究以及報告臨牀研究數據時;美國食品和藥物管理局或其他監管機構可能要求在批准新藥申請或適用的外國監管批准之前對帕圖索汀進行額外的臨牀研究,或建議更改我們計劃中的三期臨牀研究;國際衝突可能會干擾我們的業務以及我們所依賴的第三方的業務,包括延遲或以其他方式幹擾我們的臨牀研究和 臨牀前研究,製造業和供應鏈,或降低員工工作效率;我們在產品製造、研究、臨牀前和臨牀測試方面對第三方的依賴;我們的臨牀研究、 非臨牀研究和帕替索汀臨牀前研究的成功;美國和國外的監管發展或價格限制;我們的候選產品出現意想不到的不良副作用或療效不足,可能會限制 的開發、監管批准和/或商業化;我們的能力獲得和維持對候選產品的知識產權保護;我們可能會比預期更快地使用我們的資本資源;以及我們不時向美國證券交易委員會(“SEC”)提交的文件中 “風險因素” 標題下描述的其他風險。由於前瞻性陳述本質上受風險和不確定性的影響,其中一些無法預測或量化,有些是我們無法控制的,因此您不應依賴這些前瞻性陳述作為對未來事件的預測。所有前瞻性陳述均受本警告 聲明的全部限定,該聲明是根據1995年《私人證券訴訟改革法》的安全港條款作出的,除非適用法律要求,否則我們不計劃公開更新或修改此處包含的任何前瞻性陳述, 無論是由於任何新信息、未來事件、情況變化還是其他原因。2

3 期研究達到了主要和所有次要終點, Paltusotine 是耐受性良好的主要終點 56% 的參與者達到 IGF-1 ≤ 1.0xULN,而安慰劑為 5%(p

Paltusotine:旨在讓肢端肥大症和類癌 綜合徵患者專注於活下去 PALTUSOTINE 目標產品標準可靠、不一致的概況* 護理一致、症狀和持久控制對照組報告注射效果良好-與部位的耐受反應每日一次。疼痛、口服片劑 不一致且注射劑量不方便*帕替索汀是臨牀研究中用於治療的研究藥物肢端肥大症和類癌綜合徵。參考文獻 1.Geer EB、Sisco J、Adelman DT 等患者報告了常規臨牀實踐中接受可注射生長抑素受體配體 (SRL) 治療的肢端肥大症患者的預後數據 。BMC Endocr Disord. 2020;20 (1): 117. doi: 10.1186/s12902-020-00595-4;2.Strasburger CJ、Karavitaki N、Störmann S 等。患者- 4 報告了195例肢端肥大症患者的腸胃外生長抑素類似物注射結果。Eur J Endocrinol。2016;174 (3): 355-62。doi: 10.1530/eje-15-1042;3.Fleseriu 等人內分泌學前沿;2021 年 3 月,第 12 卷;4.博伊德等人 Pancreas 2013; 42:878—882。
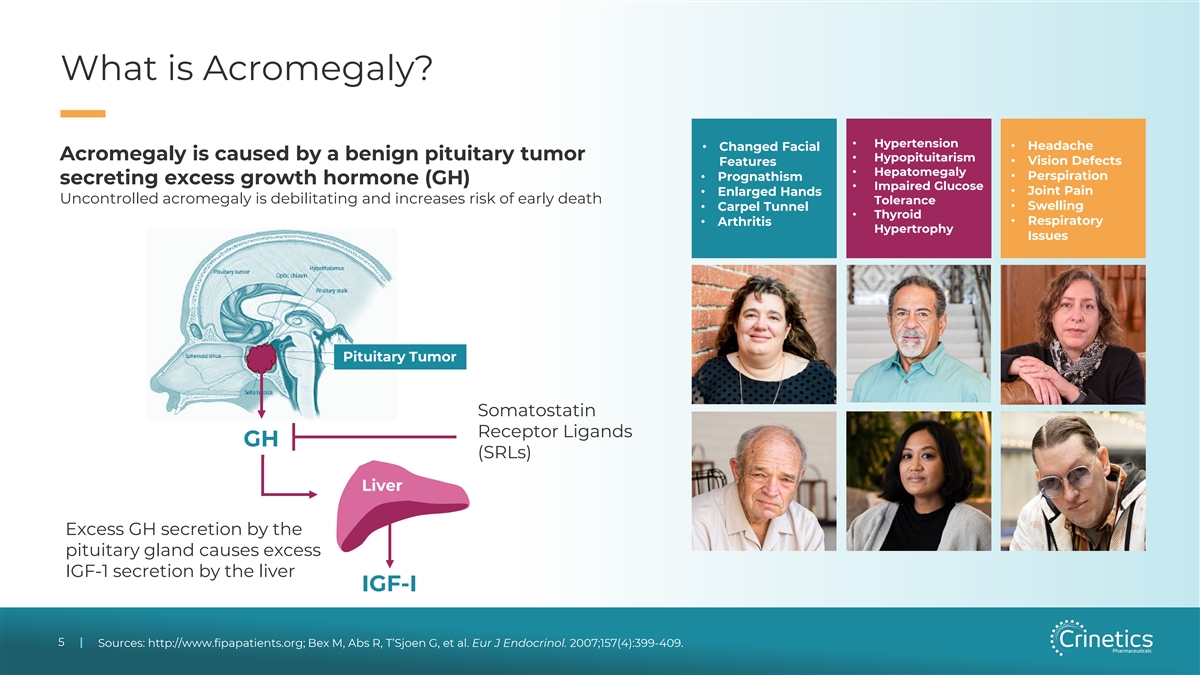
什麼是肢端肥大症?• 高血壓 • 頭痛 • 改變的面部肢端肥大症是由良性垂體腫瘤引起的 • 垂體功能減退 • 視力缺陷特徵 • 肝腫大 • 排汗 • 分泌過量生長激素 (GH) • 葡萄糖受損 • 關節疼痛 • 手部腫大 • 不受控制的肢端肥大症會使人虛弱並增加過早死亡耐受的風險 • 甲狀腺腫脹 • 地毯隧道 • 呼吸系統 • 關節炎肥大問題 垂體瘤生長抑素受體配體 GH (sRL) 肝臟垂體分泌過多的生長激素會導致 IGF-1 過多肝臟分泌 IGF-I 5 5 | 來源:http://www.fipapatients.org;Bex M、Abs R、T'SJoen G 等。Eur J 內分泌。2007;157 (4): 399-409。
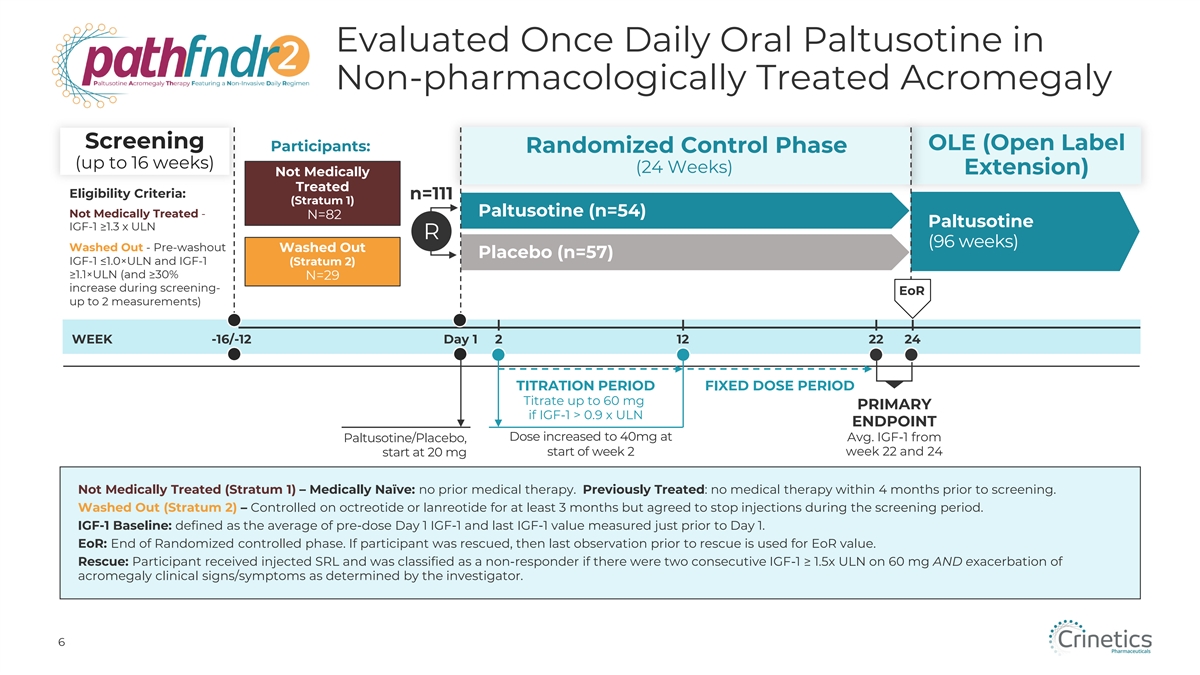
在非藥物治療的肢端肥大症篩查 OLE(開放標籤參與者:隨機對照階段(最長 16 周)(24 周)延期)中每日評估一次口服帕替沙丁未接受藥物治療的資格標準:n=111(第 1 層)帕圖索汀(n=54)未接受藥物治療-N=82 帕圖索汀 IGF-1 ≥1.3 x ULN R(96 周)洗掉——預洗 Out Washed Out 安慰劑(n=57)IGF-1 ≤1.0×ULN 和 IGF-1(第 2 層)≥1.1×ULN(篩查期間增加 ≥ 30% N=29-eoR 最多 2 次測量)周 -16/-12 天 1 2 12 22 24 滴定週期固定劑量週期如果 IGF-1 > 0.9 x ULN 終點劑量在平均值時增加到 40 mg,則滴定至多 60 mg 初級。來自 Paltusotine/Placebo 的 IGF-1,從 20 mg 開始,第 2 周開始第 22 周和 24 周未接受藥物治療(第 1 層)— 醫學上天真:之前沒有藥物治療。先前接受過治療:篩查前4個月內未接受任何藥物治療。Washed Out(Stratum 2)— 對奧曲肽或蘭瑞肽的控制至少3個月,但同意在篩查期間停止注射 。IGF-1 基線:定義為服藥前第 1 天 IGF-1 的平均值和在第 1 天之前測量的最後一個 IGF-1 值。EoR:隨機控制階段結束。如果參與者獲救,則使用救援前的最後一次觀察 作為 EoR 值。救援:參與者接受了注射 SRL,如果在 60 mg 上連續兩次 IGF-1 ≥ 1.5x ULN,並且由 研究人員確定的肢端肥大症臨牀體徵/症狀加重,則被歸類為無反應者。6
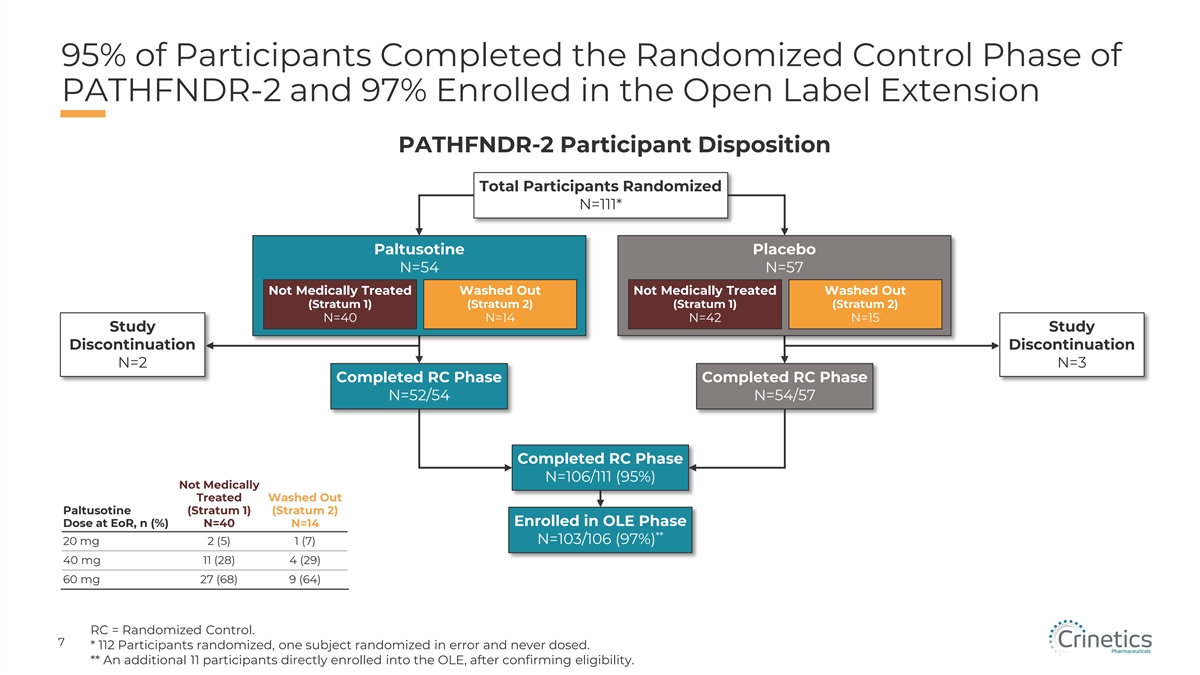
95% 的參與者完成了 PATHFNDR-2 的隨機對照階段,97% 的參與者註冊了開放標籤延期 PATHFNDR-2 參與者處置總數隨機分配 N=111* Paltusotine 安慰劑 N=54 N=57 未經藥物治療衝出去(第 1 層)(第 1 層) (第 2 層)N=40 N=14 N=42 N=15 研究中止停產 N=2 N=3 已完成 RC 階段已完成 RC 階段 N=52/54 N=54/57 已完成 RC 階段 N=106/111 (95%) 未經藥物治療沖洗掉的帕圖索汀(第 1 層)(第 2 層) 在 EoR 時參加 OLE 階段劑量,n (%) N=40 N=14 ** N=103/106 (97%) 20 mg 2 (5) 1 (7) 40 mg 11 (28) 4 (29) 60 mg 27 (68) 9 (64) RC = 隨機對照。7 * 112 名參與者隨機分組,一名受試者錯誤隨機分配,從未給藥。** 另外 11 名參與者直接入組 OLE,在確認資格之後。
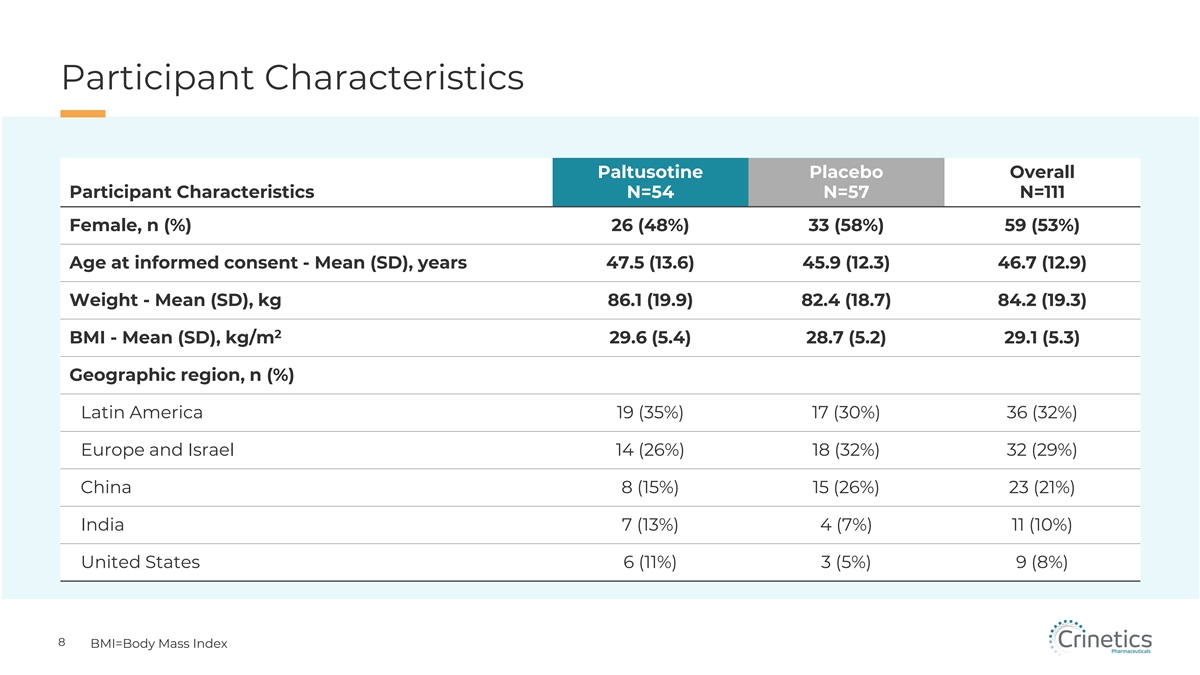
參與者特徵 Paltusotine 安慰劑總體參與者 特徵 N=54 N=57 N=111 女性,n (%) 26 (48%) 33 (58%) 59 (53%) 知情同意時的年齡-平均值 (SD),年齡 47.5 (13.6) 45.9 (12.3) 46.7 (12.9) 體重-平均值 (SD),kg 86.1 (19.9) 82.4 (18.7) 82.4 (18.7) 82.4 (18.7) 82.4 (18.7) 82.4 (18.7) 82.4 (18.7) 82.4 (18.7) 82.4 (18.7) 82.4 (18.7) 4.2 (19.3) 2 BMI-平均值 (SD),kg/m 29.6 (5.4) 28.7 (5.2) 29.1 (5.3) 地理區域,n (%) 拉丁美洲 19 (35%) 17 (30%) 36 (32%) 歐洲和以色列 14 (26%) 18 (32%) 32 (29%) 中國 8 (15%) 15 (26%) 23 (21%) 印度 7 (13%) 4 (7%) 11 (10%) 美國 6 (11%) 3 (5%) 9 (8%) 8 BMI=體重 索引
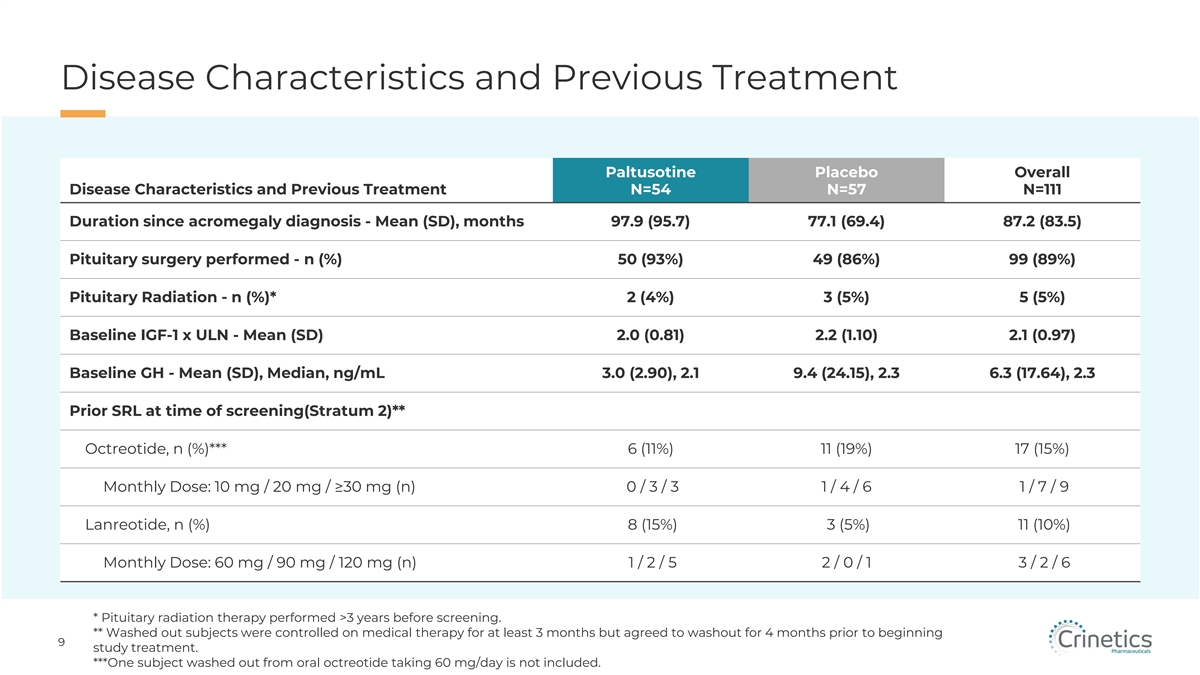
疾病特徵和先前的治療 Paltusotine 安慰劑 總體疾病特徵和先前的治療 N=54 N=57 N=111 自肢端肥大症診斷以來的持續時間-平均值 (SD),月 97.9 (95.7) 77.1 (69.4) 87.2 (83.5) 87.2 (83.5) 進行的垂體手術-n (%) 50 (93%) 49 (86%) 99 (89%) 99 (89%) 垂體放射-n (%) * 2 (4%) 3 (5%) 5 (5%) 基線 IGF-1 x ULN-平均值 (SD) 2.0 (0.81) 2.2 (1.10) 2.1 (0.97) 基線 GH-平均值 (SD)、中值、ng/mL 3.0 (2.90)、2.1 9.4 (24.15)、2.3 6.3 (17.64)、2.3 篩查時的先前 SRL(第 2 層)**,n (%) *** 6(11%) 11 (19%) 17 (15%) 每月劑量:10 mg/20 mg/≥30 mg (n) 0/3 1/4/6 1/7/9 Lanreotide,n (%) 8 (15%) 3 (5%) 11 (10%) 每月劑量:60 mg/90 mg/120 mg (n) 1/2/0/1 3/2/6 * Pitux 接受放射治療 在篩查前超過 3 年進行的。** 被沖洗的受試者接受藥物治療控制至少 3 個月,但同意在開始 9 項研究治療之前進行 4 個月的清洗。***不包括一名從口服奧曲肽中洗掉的受試者,每天服用 60 mg。
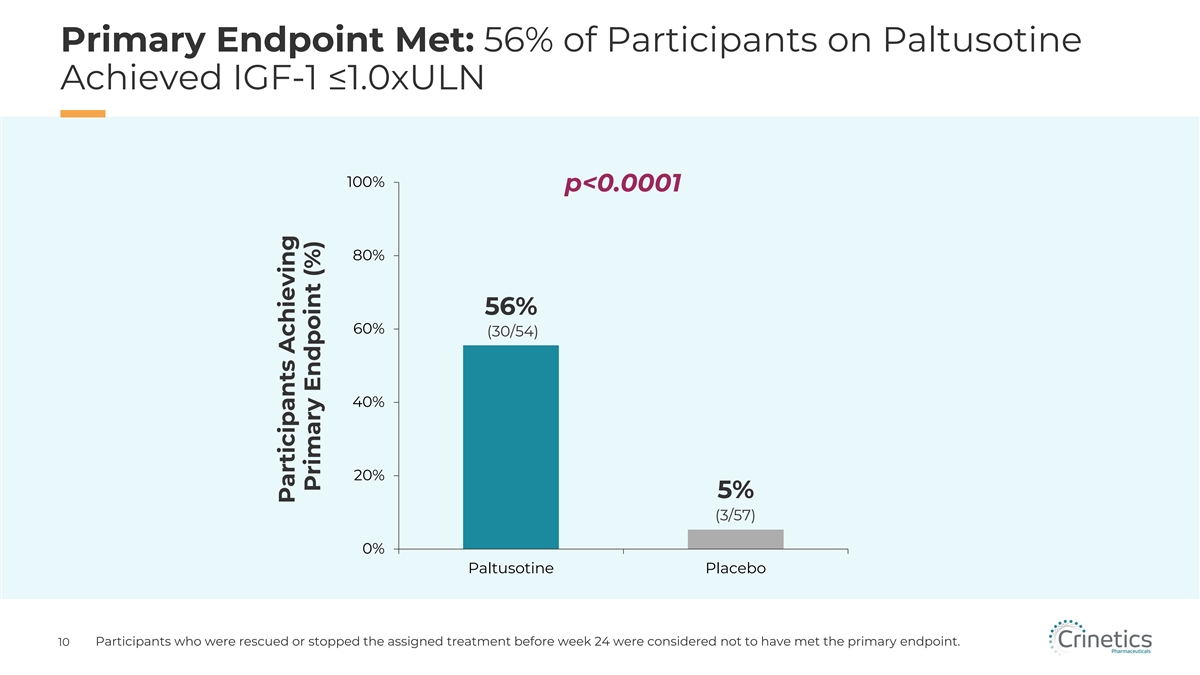
主要終點達到:56% 的帕圖索汀參與者達到 IGF-1 ≤1.0xULN 100% p
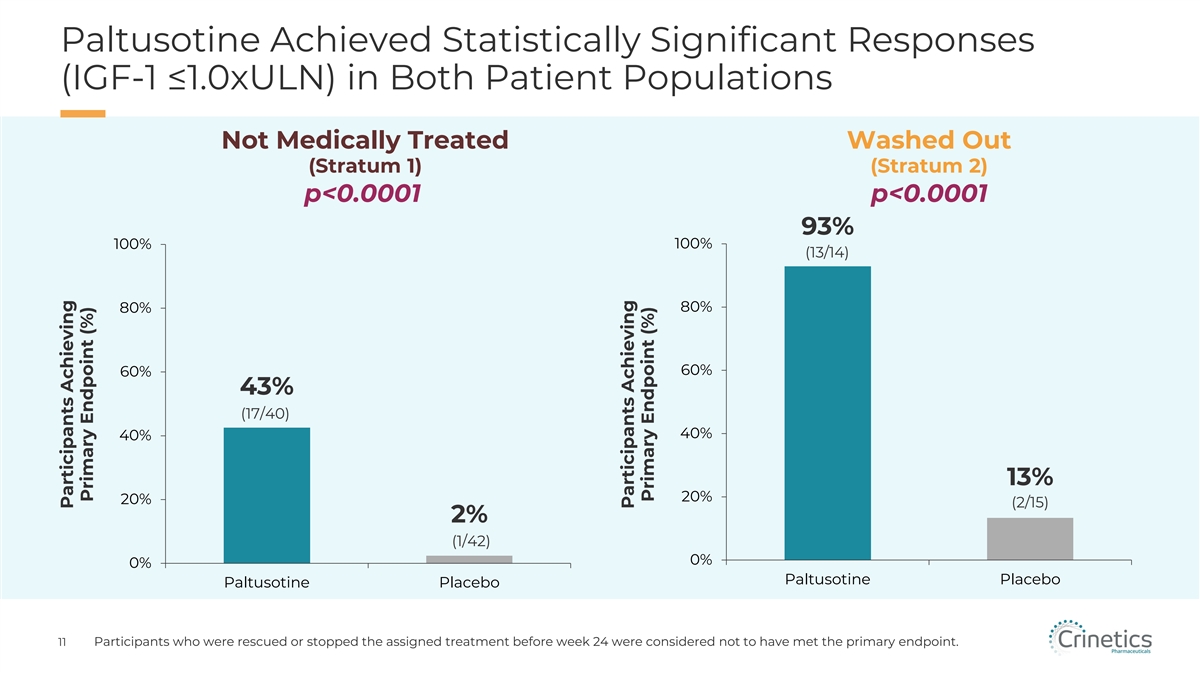
在兩個未接受藥物治療的患者羣體中(第 1 層)(第 2 層)p 在兩個患者羣體中均取得了具有統計學意義的反應 (IGF-1 ≤1.0xULN)
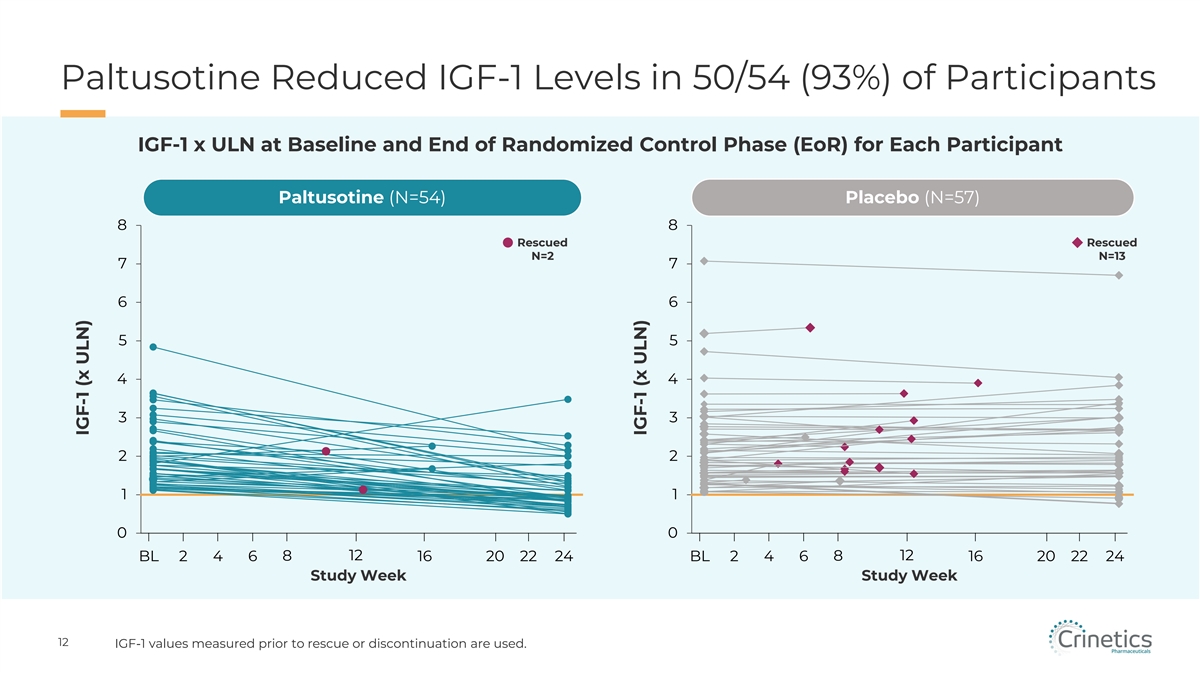
Paltusotine 降低了 50/54 (93%) 參與者的 IGF-1 水平 IGF-1 x ULN 處於基線和隨機控制階段 (EoR) 末期 Paltusotine (N=54) 安慰劑 (N=57) 8 8 獲救獲救 N=2 N=13 7 6 6 6 5 5 5 4 4 3 3 2 2 1 0 0 12 BL 2 4 4 6 16 20 22 BL 2 4 6 8 16 20 22 BL 6 8 16 20 22 24 學習周研究周 12 IGF-1 使用在救援或停藥之前測量的值。IGF-1 (x ULN) IGF-1 (x ULN)
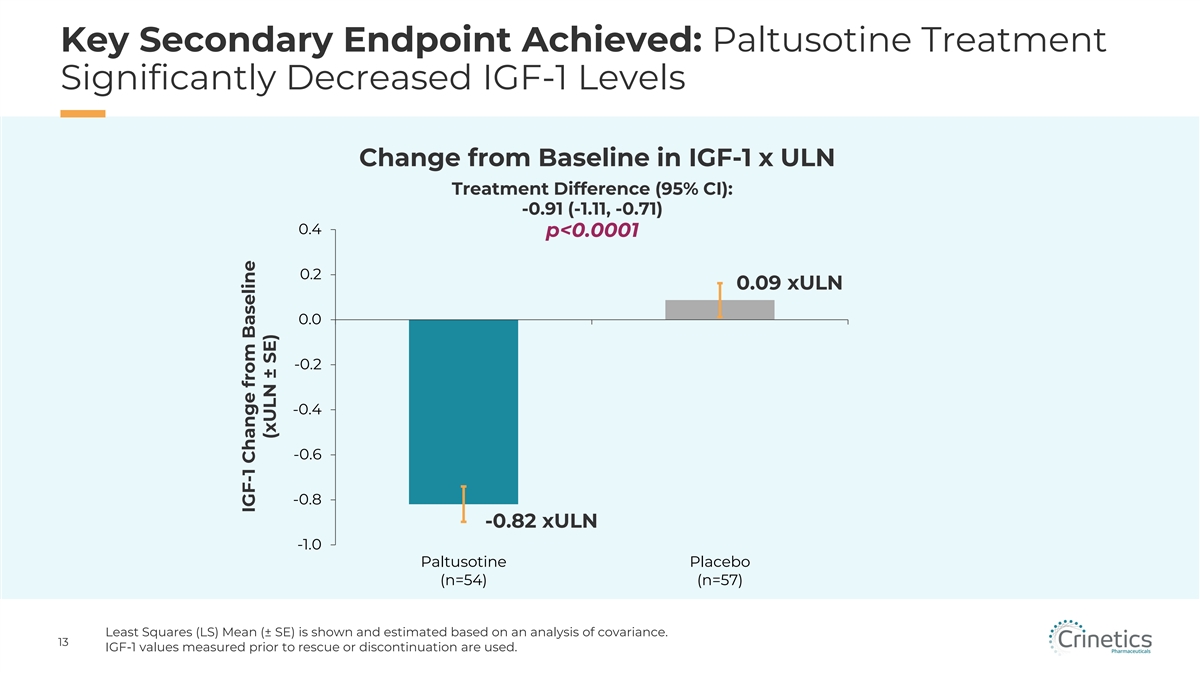
已實現的關鍵次要終點:帕替索汀治療顯著降低 IGF-1 x ULN 治療差異(95% 置信區間)與基線相比的 IGF-1 水平變化(95% 置信區間):-0.91(-1.11,-0.71)0.4 p
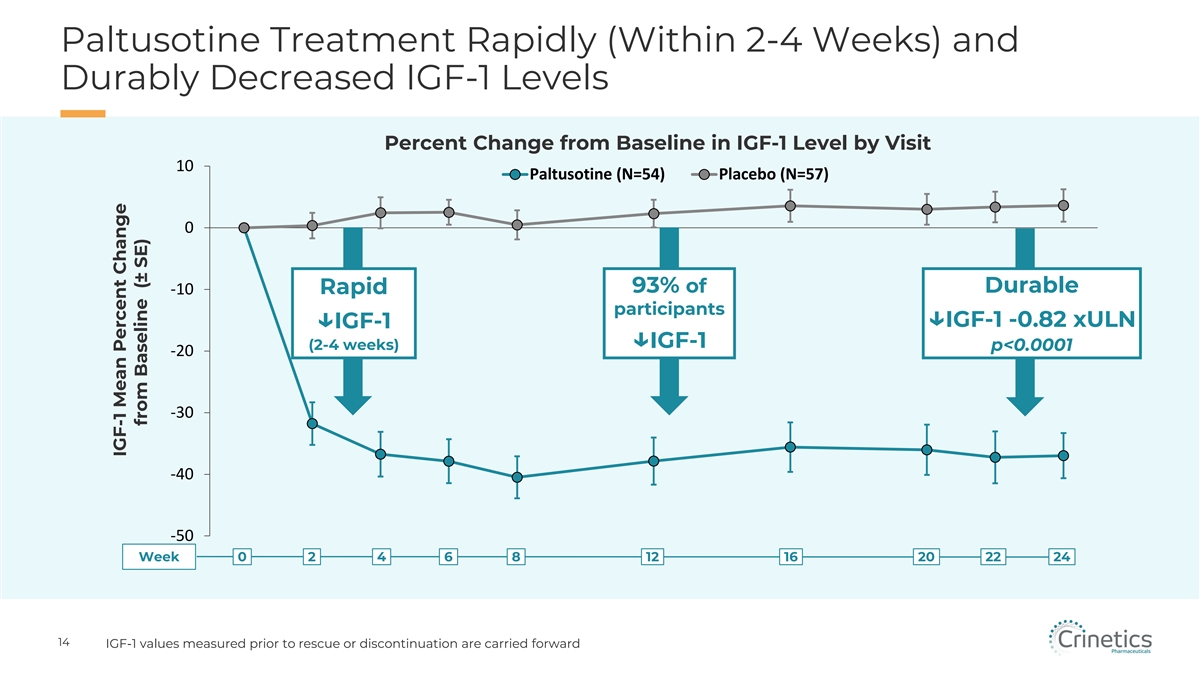
Paltusotine 治療快速(2-4 周內)持續降低 IGF-1 水平與 Visit 10 Paltusotine(N=54)安慰劑(N=57)0 93% 的耐用 -10 快速參與者 ↓ IGF-1 -0.82 xULN ↓ IGF-1 ↓ IGF-1(2-4 周)p IGF-1
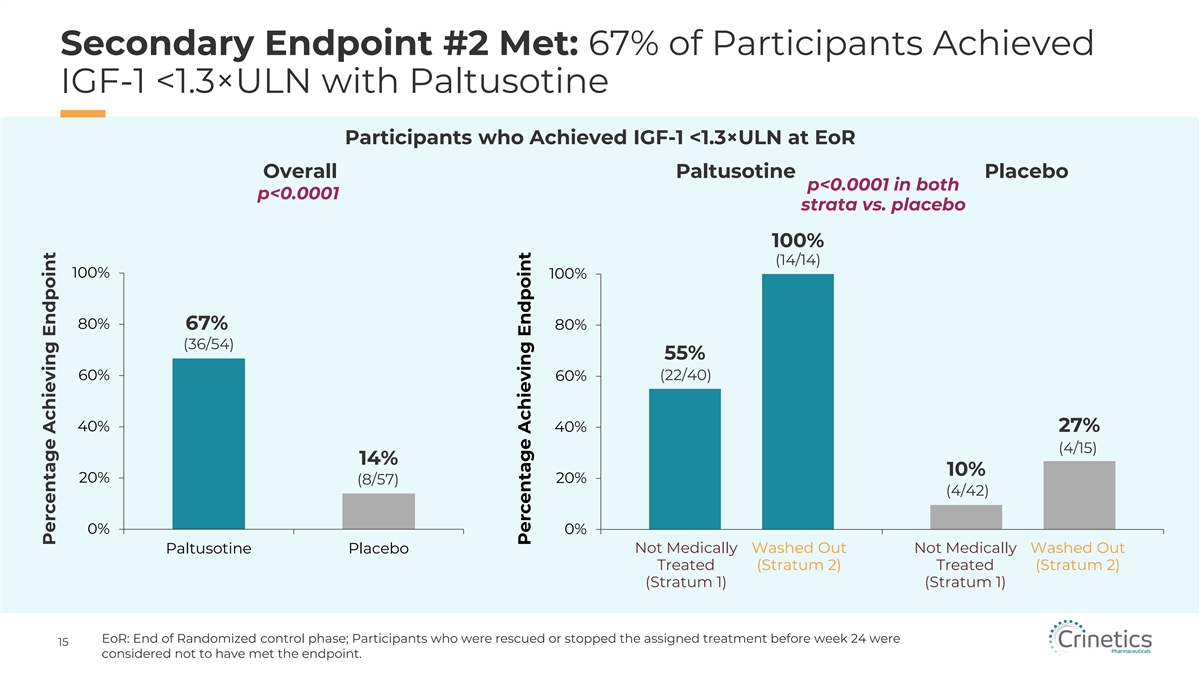
次要終點 #2 已達到:67% 的參與者達到了 IGF-1

參與者報告症狀嚴重程度使用肢端肥大症症狀 日記 (ASD) 在 ASD 頭痛中進行症狀評估 • ASD 是根據美國食品藥品管理局關節痛指南開發的,旨在評估臨牀試驗中肢端肥大症的症狀* 疲勞 • 每種症狀的評級從 0(無腿部 虛弱症狀)到 10(最嚴重的症狀),腫脹總數 0 到 70 麻木/刺痛 • 每日症狀清單為在研究治療之前和期間為參與者收集的總分(0-70)數字量表(每種症狀)無症狀 最壞症狀 0 1 2 34 5 6 7 8 9 10 16 * Martin 等人患者報告結果雜誌 (2023) 7:15;https://doi.org/10.1186/s41687-023-00541-7。
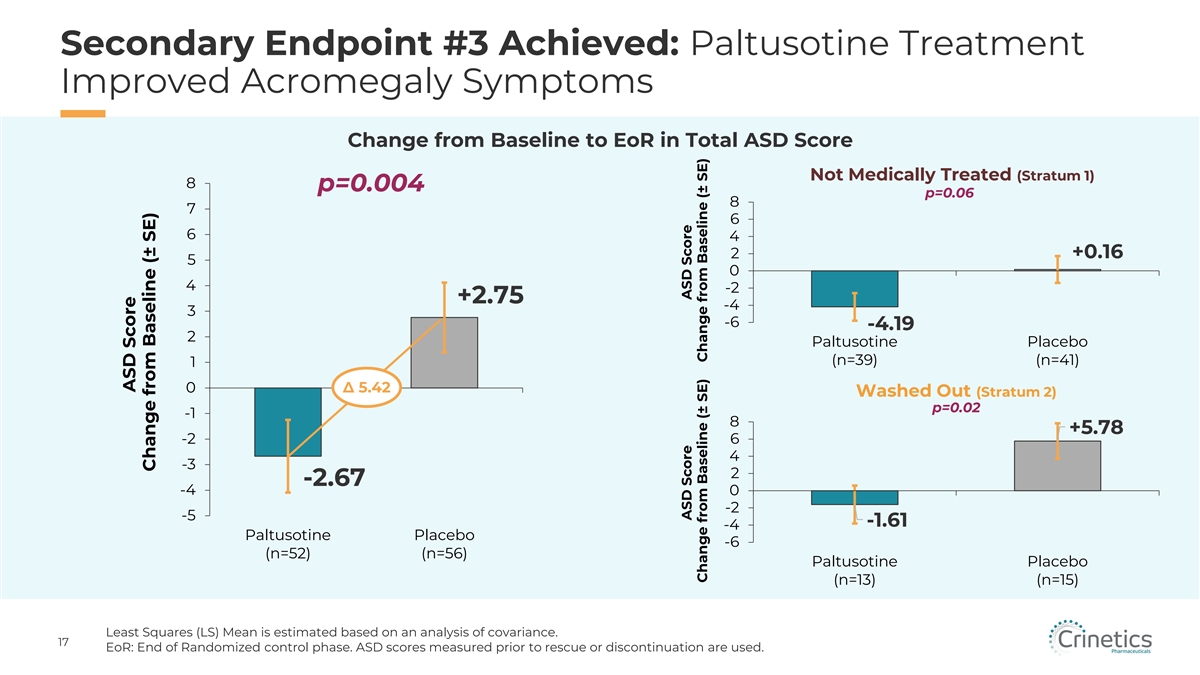
次要終點 #3 已實現:帕圖索汀治療改善 未經藥物治療的 ASD 總評分的肢端肥大症狀從基線變為 EoR(第 1 層)8 p=0.004 p=0.06 8 7 6 6 4 2 +0.16 5 0 4 -2 +2.75 -4 3 -6 -4.19 2 Paltusotine 安慰劑 (n=39) (n=41) 1 0 5.42 洗滌 Out(Stratum 2)p=0.02 -1 8 +5.78 -2 6 4 -3 2 -2.67 -4 -2 -5 -1.61 -4 Paltusotine 安慰劑 -6(n=52)(n=56)Paltusotine 安慰劑(n=13)(n=15)最小二乘法(LS)均值是根據協方差分析估算出的。17 eOR:隨機控制階段結束。使用在救援或停藥之前測量的 ASD 分數 。ASD 分數與基線的變化 (± SE) ASD 分數與基線的變化 (± SE) 與基線 (± SE) 的變化 (± SE)
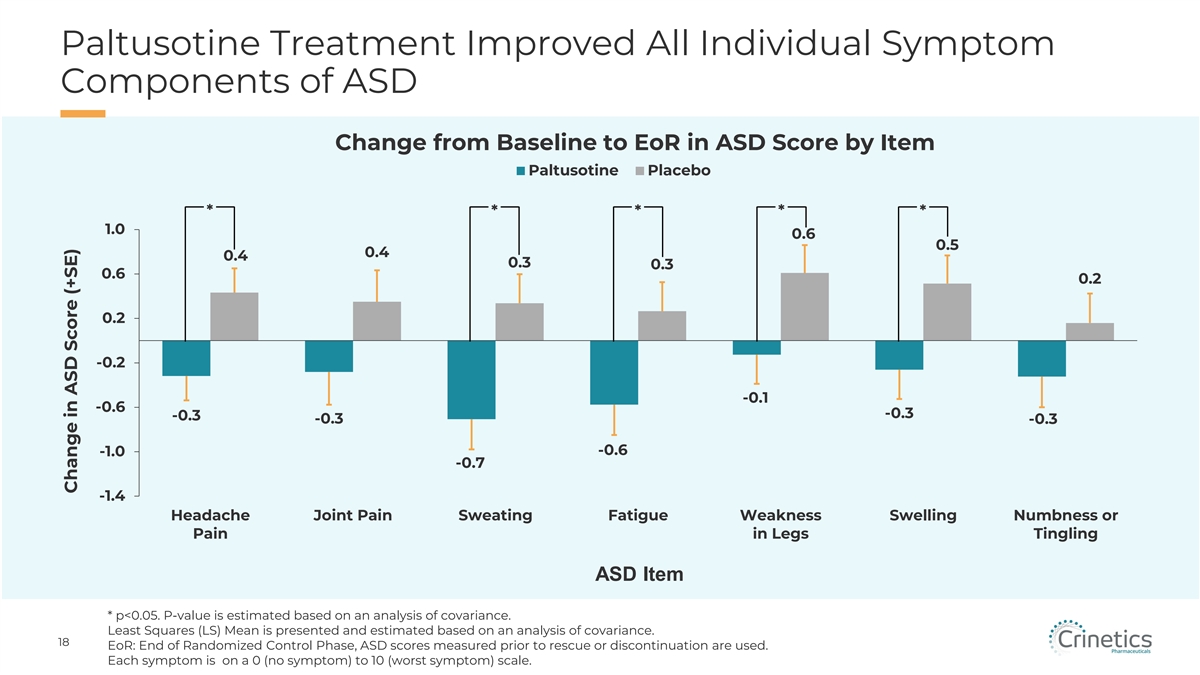
帕替索汀治療改善了 ASD 的所有個體症狀成分從 ASD 評分從基線變為 EoR,按項目劃分的 Paltusotine 安慰劑 * * * * * 1.0 0.6 0.6 0.6 0.2 0.2 -0.2 -0.2 -0.3 -0.3 -0.3 -0.3 -0.3 -0.3 -0.6 -0.3 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6 -0.6
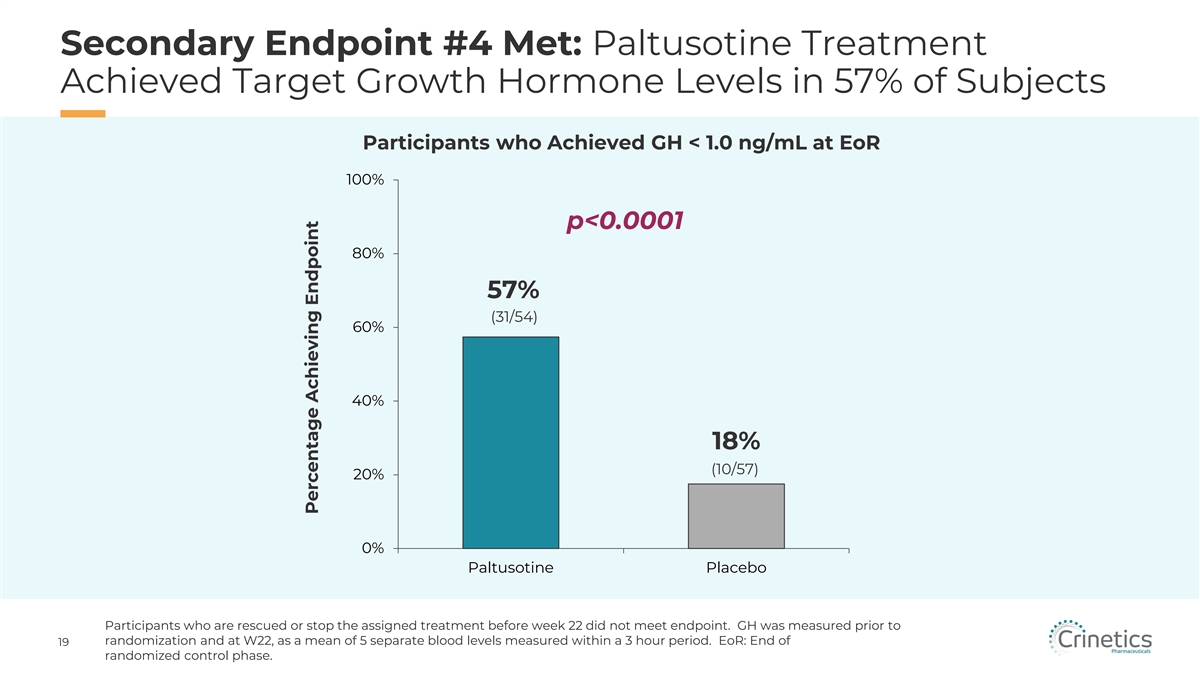
次要終點 #4 已達到:在達到 GH 的受試者中,有 57% 的受試者中,帕圖索汀治療達到了目標生長 激素水平
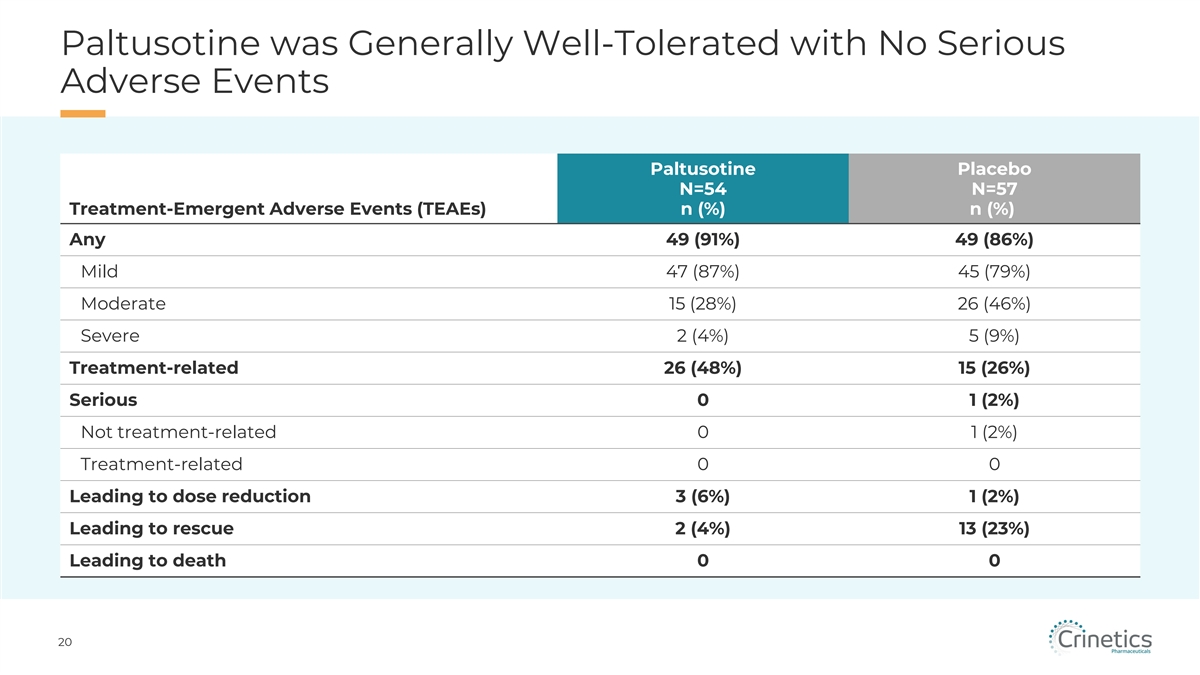
帕圖索汀總體耐受性良好,無嚴重不良事件 帕圖索汀安慰劑 N=54 N=57 治療-緊急不良事件 (TEAE) n (%) n (%) 任意 49 (91%) 49 (86%) 輕度 47 (87%) 45 (79%) 中度 15 (28%) 26 (46%) 重度 2 (4%) 5 (9%) 治療相關 26 (48%)%) 15 (26%) 嚴重 0 1 (2%) 與 治療無關 0 1 (2%) 治療相關 0 0 導致劑量減少 3 (6%) 1 (2%) 導致救援 2 (4%) 13 (23%) 導致死亡 0 0 20

帕圖索汀未顯示出新的安全信號 TEAE,參與者總髮生率 ≥ 5% Paltusotine 安慰劑 N=54 N=57 TEAE n (%) n (%) 腹瀉 18 (33%) 10 (18%) 頭痛 11 (20%) 19 (33%) • PATHFNDR-2 Arthralgia 6 (11%) 13 (23%) 的安全狀況與觀察到的腹痛相當 6 (20%) 11%) 2 (4%) 迄今為止臨牀項目中的感覺異常 5 (9%) 3 (5%) 噁心 5 (9%) 2 (4%) 腹部不適 5 (9%) 1 (2%) • TEAE(粗體)是症狀上呼吸道感染 4 (7%) 10 (18%) 疲勞 3 (6%) 8 (14%) 已知與 有關消化不良 3 (6%) 6 (11%) 肢端肥大症貧血 3 (6%) 5 (9%) 背痛 3 (6%) 4 (7%) 尿路感染 3 (6%) 4 (7%) 虛弱 3 (6%) 3 (5%) 外周腫脹 2 (4%) 6 (11%) 多汗症 1 (2%) 5 (9%) 包括 在救援期間發生的不良反應。當不包括救助期時,發病率相似,AE通常與21種肢端肥大症症狀相關的AE以粗體顯示。

PATHFNDR-2 安全摘要 • 帕圖索汀的耐受性總體良好,未報告嚴重的不良事件 • 最常見(> 10%)報告的不良事件包括腹瀉、頭痛、關節痛和腹痛 • 在帕圖索丁治療期間,在不良事件、重要 體徵、心電圖或實驗室值中未觀察到新的安全信號 • 帕圖索汀治療與垂體腫瘤大小穩定或減小有關,根據核磁共振成像正在進行的開放標籤擴展研究測量:目前約有225名參與者 接受了長達4年的治療 22

PATHFNDR 計劃提供評估肢端肥大症 生化和症狀控制的獨特豐富數據集 Crinetics 首次商業發佈,帕圖索汀數據現在支持美國食品藥品管理局批准的用於肢端肥大症廣泛應用於肢端肥大症吸入的保密協議:推出一種重要的新 藥物 • 以前,PATHFNDR-1 滿足肢端肥大症患者和醫療提供者的所有預先規定的治療方案:從 SRL 切換時維持控制的終點 • 第一個每日一次的口服 SRL • 今天,PATHFNDR-2 滿足 全部預先規定 •降低未接受藥物治療的患者的終點治療負擔 • 降低准入壁壘使基線的 IGF-1 水平升高 • 提供快速、持久和持續的控制今天 2025 年下半年肢端肥大症 NDA 提交的類癌綜合徵第 3 階段正在等待與 FDA 23 達成一致
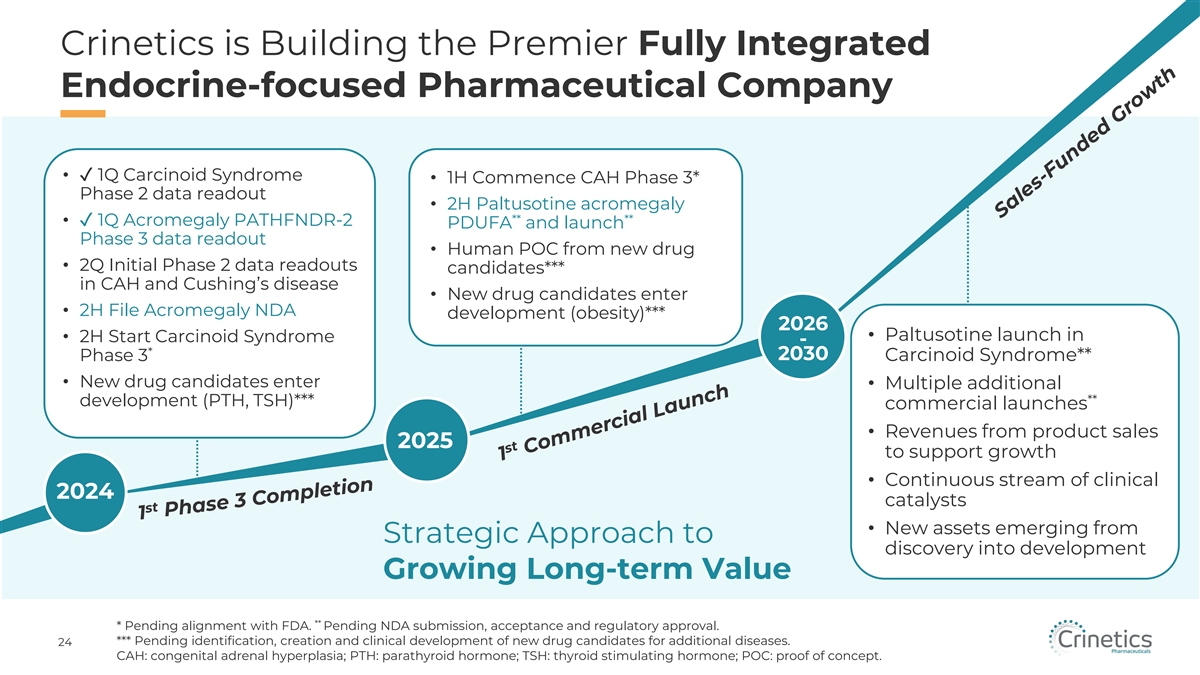
Crinetics 正在建設一家專注於內分泌的首屈一指的完全整合的 製藥公司 • ✓ 1Q 類癌綜合徵 • 1H 開始 CAH 3期第 2 階段數據讀取 • 2H Paltusotine 肢端肥大症 ** ** • ✓ 1Q 肢端肥大症 PATHFNDR-2 PDUFA 並啟動第 3 階段數據讀取 • 來自新藥的人類 POC • 第二季度初始階段數據讀取候選人*** 還有庫欣氏病 • 新候選藥物進入 • 2H 文件肢端肥大症新藥開發項目(肥胖)*** 2026 • 帕圖索汀上市 • 2H Start 類癌綜合徵-* 2030 年 3 期類癌綜合徵** • 新藥候選人進入 • 多項額外**開發(PTH、TSH)*** 商業發佈 • 2025 年用於支持增長的產品銷售收入 • 持續的 2024 年臨牀催化劑流 • 從《戰略方針》中湧現的新資產轉化為開發長期價值增長***有待與美國食品藥品管理局達成一致。尚待NDA提交、驗收和監管部門批准。*** 待定 針對其他疾病的新候選藥物的鑑定、創建和臨牀開發。24 CAH:先天性腎上腺皮質增生;PTH:甲狀旁腺激素;TSH:甲狀腺刺激激素;POC:概念驗證。

斯科特·斯特拉瑟斯博士創始人兼首席執行官問答 Dana Pizzuti,醫學博士首席醫療與開發官艾倫·克拉斯納,醫學博士首席內分泌學家馬克·威爾遜首席財務官吉姆·哈薩德首席商務官 25

謝謝 26