| APG777 第 1 階段數據 2024 年 3 月 |
| © Apogee Therapeutics, Inc. 2 免責聲明和前瞻性陳述 本演示文稿包含適用證券法所指的某些 “前瞻性陳述”。除歷史事實陳述外,本演示文稿中包含的所有陳述均為 前瞻性陳述,包括有關我們的計劃、目標、目標、戰略和未來事件的陳述、APG777 的療效、安全性、耐受性、PK 和 PD 概況、APG777 的潛在給藥方案、APG777 與當前療法相比的潛在優勢、我們對當前和未來候選產品和項目計劃的期望、我們當前 的計劃以及未來的臨牀試驗,我們的臨牀試驗設計計劃、我們臨牀試驗的啟動時間和結果、APG777、APG808、 APG990、APG222 和任何其他潛在項目的潛在臨牀益處和半衰期、我們對未來產品線更新的預期時機和對市場規模的估計。在某些情況下,你可以通過術語 來識別前瞻性陳述,例如 “預期”、“相信”、“可以”、“設計”、“估計”、“預期”、“打算”、“可能”、“可能”、“計劃”、“潛在”、“預測”、“建議”、“目標”、“將” 或這些術語的否定詞, 和旨在識別前瞻性陳述的類似表達。前瞻性陳述基於我們對未來業績的信念、假設和預期,同時考慮了 我們目前可獲得的信息。這些陳述只是基於我們當前的預期和對未來事件的預測而作出的預測。前瞻性陳述 受已知和未知風險、不確定性和其他因素的影響,這些因素可能導致我們的實際業績、活動水平、業績或成就與此類前瞻性陳述所表達或暗示的結果存在重大差異,包括我們在截至2023年12月31日提交的10-K表年度報告中 “風險因素” 和 “管理層對財務狀況和經營業績的討論和分析” 中描述的風險美國證券交易委員會 2024 年 3 月 5 日以及隨後的披露我們可能向美國證券交易所 委員會提交的文件。儘管我們試圖確定可能導致實際業績與前瞻性陳述中包含的結果存在重大差異的重要因素,但可能還有其他因素 導致結果不如預期、估計或預期。 本演示涉及正在臨牀研究且尚未獲得美國食品藥品監督管理局批准的候選藥物。目前,聯邦 法律僅限於研究用途,對於其調查目的的安全性或有效性,不作任何陳述。 儘管我們在準備本演示文稿時認為這是合理的,但可能被證明是不正確的。請注意,該信息 基於對許多因素的假設,實際結果可能與預測的結果有所不同,此類差異可能是重大的。因此,您不應過分依賴此處包含的任何 前瞻性陳述,或將其作為對未來事件的預測。本演示文稿中的所有前瞻性陳述僅在發表之日起適用,並明確受本演示文稿中包含的警示性陳述的限定 。除非根據適用的證券法,否則我們不承諾更新任何前瞻性陳述。 本演示文稿中出現的商標、商品名稱和服務標誌是其各自所有者的財產。本演示文稿中包含的某些信息涉及或基於從第三方來源獲得的 研究、出版物和其他數據,以及我們自己的內部估計和研究。儘管我們認為截至本 演示文稿之日這些第三方來源是可靠的,但它尚未獨立核實,也沒有對從第三方來源獲得的任何信息的充分性、公平性、準確性或完整性做出任何陳述。 |
| © Apogee Therapeutics, Inc. 3 簡介及內容提要 邁克爾·亨德森,醫學博士 首席執行官 APG777 第一階段中期業績 首席醫學官 APG777 特應性皮炎 2 期試驗 醫學博士克里斯汀·諾格拉萊斯 臨牀開發高級副總裁 打造一家領先的 I&I 公司 br} 邁克爾·亨德森,總經理 首席執行官 分析師問答 邁克爾·亨德森,總經理,首席執行官 卡爾·丹布科夫斯基,總經理,首席營銷官 Jane Pritchett Henderson,首席財務官 議程 |
| © Apogee Therapeutics, Inc. 4 患有這些疾病的人 應該得到儘可能好的治療 大量需求仍未得到滿足 Apogee計劃重塑炎症和免疫疾病護理的現行標準 專注於開發具有已知生物學驅動因素的差異化 生物製劑 拒絕停留在 “足夠好” 近期優先考慮治療方面特應性 皮炎 (AD)、哮喘和慢性 阻塞性肺病 (COPD) |
| © Apogee Therapeutics, Inc. 5 第 1 季度更新反映了重大進展 預計將在 24 年上半年(提前)啟動健康志願者的第一階段 APG777 APG808 第 1 階段中期數據加速至 2024 年下半年(從 2025 年起) 第 1 階段的初始數據已超過所有試驗目標 計劃中的整合 2a 和 2b 期要素,有可能顯著加快時間表(來自 A 部分的主要數據仍為 2025 年下半年) 預計 AD 第 2 階段將於 2024 年上半年開始(提前) 增強型 180 mg/mL 配方使與相同體積的雷博珠單抗相比,劑量高44% |
| © Apogee Therapeutics, Inc. 6 APG777 利用來布里吉珠單抗的機制在產品抗體 0.6 1.4 0.5 0.5 STAT6 TARC 1.4 13.4 13.4 IC90 (nM) APG777 濃度 Lebrikizumab 時間 28 與 18 天 APG777 Lebri DUBRI DUBRI DUBRI DUBRI DUBRI DUBRI DUBRI ENT 重疊 區域 人類 IL-13 APG777 在 IL-13 上的表位與 lebrikizumab 重疊, 利用經過驗證的 moA 和生物學 APG777 在關鍵 臨牀前試驗中與萊布利珠單抗和 DUPIXENT 一樣強大 意義重大 APG777 比 lebrikizumab 長 注意:moA = 作用機制。 |
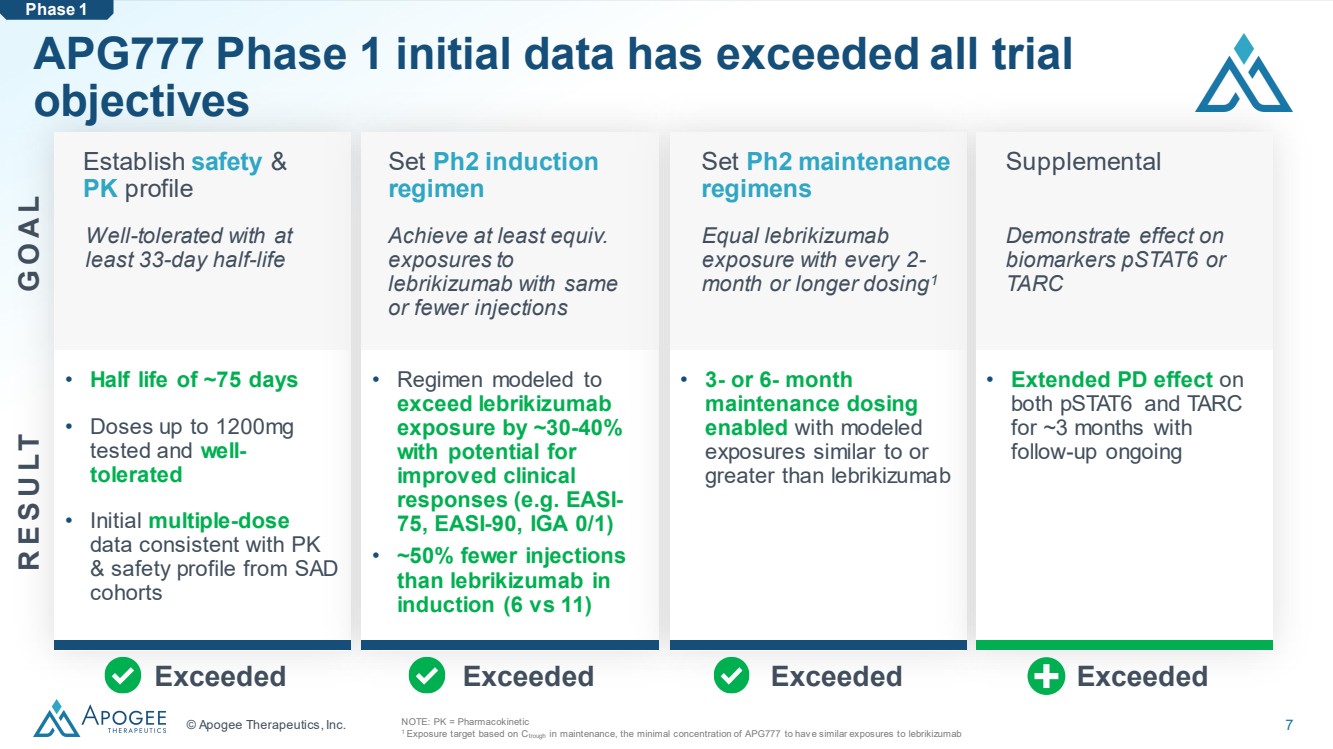
| © Apogee Therapeutics, Inc. 7 APG777 第 1 階段的初始數據已超過所有試驗 目標 注意:PK = 藥代動力學 1 暴露目標基於 Ctrough 維持期,APG777 的最低濃度與來布里珠單抗 第 1 階段的暴露量相似 建立安全性和 PK 配置文件 耐受性良好,半衰期至少為 33 天 設置 Ph2 誘導 方案 達到至少等效。 以相同或更少的注射劑量接觸 lebrikizumab 設置 Ph2 維護 方案 每 2- 月或更長劑量均等於 lebrikizumab 暴露量1 補充 對 生物標誌物 pstat6 或 TARC 超出超過 } • 半衰期約為 75 天 • 劑量高達 1200 mg 測試且耐受性良好 • 初始多劑量 數據與 SAD 隊列的 PK 和安全概況一致 • 以 為模型的方案比來曲珠單抗 暴露量高約 30-40% ,有 改善的潛力臨牀 反應(例如 EASI-75、EASI-90、IGA 0/1) • 在 誘導(6 與 11)中,注射 的次數 比來曲單抗少約 50% 同時使用 pStat6 和 TARC 持續約 3 個月, 正在進行隨訪 G O A L R E S U LT |
| 健康志願者的 APG777 第 1 階段 |
| © Apogee Therapeutics, Inc. 9 APG777 中期數據來自正在進行的 健康志願者的 1 期試驗 ` 單次上升劑量 雙盲、安慰劑對照、首次人體試驗 的單一遞增劑量成分 成分 N = 40 8個隊列(6:2 活性:安慰劑)) 關鍵納入標準:健康成人 參與者 主要終點:安全 次要終點:PK、ADA 探索性生物標誌物:pStat6、TARC 300 mg (SQ) x 1 劑量 x 1 劑 1200 mg(SQ) x 1 劑量 300 mg (SQ) 第 1 天,15 個試驗設計元素 300 mg (SQ) 第 1 天,29 來自所有三個 SAD 隊列的中期數據,至少有 3-6 個月的隨訪 |
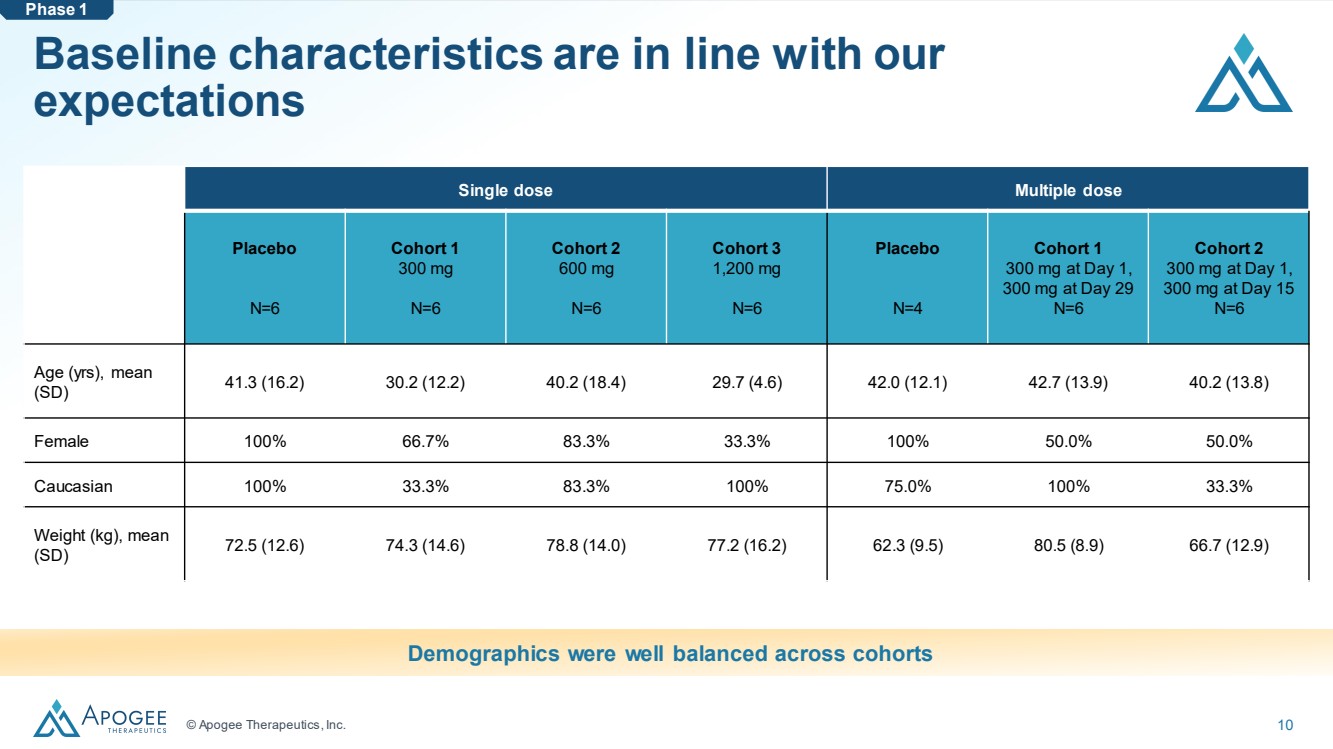
| © Apogee Therapeutics, Inc. 10 基線特徵符合我們的 預期 單劑量 安慰劑 N=6 隊列 1 300 mg N=6 隊列 2 600 mg N=6 隊列 3 1,200 mg N=6 安慰劑 N=4 隊列 1 300 mg 在第 1 天, n=6 隊列 1 300 mg 第 29 天 N=6 隊列 2 第 1 天 300 mg,第 15 天 300 mg N=6 年齡(年),平均值 (SD) 41.3 (16.2) 30.2 (12.2) 40.2 (18.4) 29.7 (4.6) 42.0 (12.1) 42.7 (13.9) 40.2 (13.8) 女 100% 66.7% 33.3% 53.3% 53.3% 53.3% 53.3% 53.3% 53.3% 53.3% 53.3% 53.3% 53.3% 53.3% 50.0% 50.0% 高加索 100% 33.3% 83.3% 100% 75.0% 100% 33.3% 體重 (kg),平均值 (SD) 72.5 (12.6) 74.3 (14.6) 78.8 (14.0) 77.2 (16.2) 62.3 (9.5) 80.5 (8.9) 66.7 (12.9) 羣組之間的人口結構平衡良好 第 1 階段 |
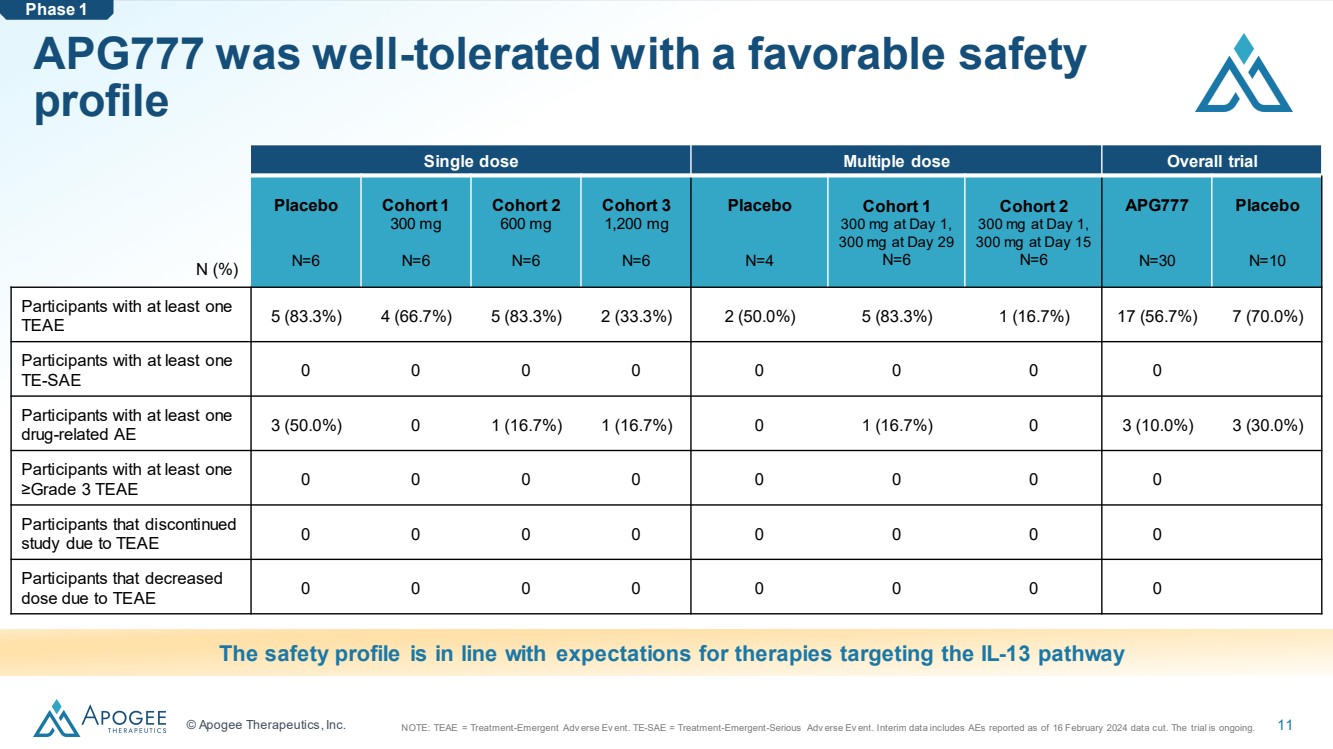
| © Apogee Therapeutics, Inc. 11 APG777 耐受性良好,安全性良好 單劑量多劑量總體試驗 安慰劑 N=6 隊列 1 300 mg N=6 隊列 2 600 mg N=6 隊列 3 1,200 mg N=6 隊列 1 300 mg, N=6 隊列 1 300 mg, N=6 隊列 3 1,200 mg N=6 隊列 1 300 mg, N=6 隊列 1 300 mg, } 第 29 天 300 mg N=6 隊列 2 第 1 天 300 mg,第 15 天 300 mg N=6 APG777 N=30 安慰劑 N=10 至少有一個 TEAE 5 (83.3%) 4 (66.7%) 5 (83.3%) 2 (50.0%) 2 (50.0%) 5 (83.3%) 1 (16.7%) 17 (57%) 17 (57%) 6.7%) 7 (70.0%) 參與者至少有一個 TE-SAE 0 0 0 0 0 0 0 0 0 0 0 0 0 0 參與者至少有一名 藥物相關的 AE 3 (50.0%) 0 1 (16.7%) 1 (16.7%) 0 1 (16.7%) 0 3 (10.0%) 3 (30.0%) 參與者至少有一個 ≥三級 TEAE 0 0 0 0 0 0 0 0 0 0 由於TEAE 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 參與者中止 研究由於 TEAE 0 0 0 0 0 0 0 0 0 0 0 安全概況符合對針對 IL-13 途徑的療法的預期 N (%) 第 1 階段注意:TEAE = Treatment-Emergent Adv erse Ev ent。TE-SAE = 治療-緊急情況-嚴重進階版本中期數據包括截至2024年2月16日公佈的數據截止日期。審判正在進行中。 |
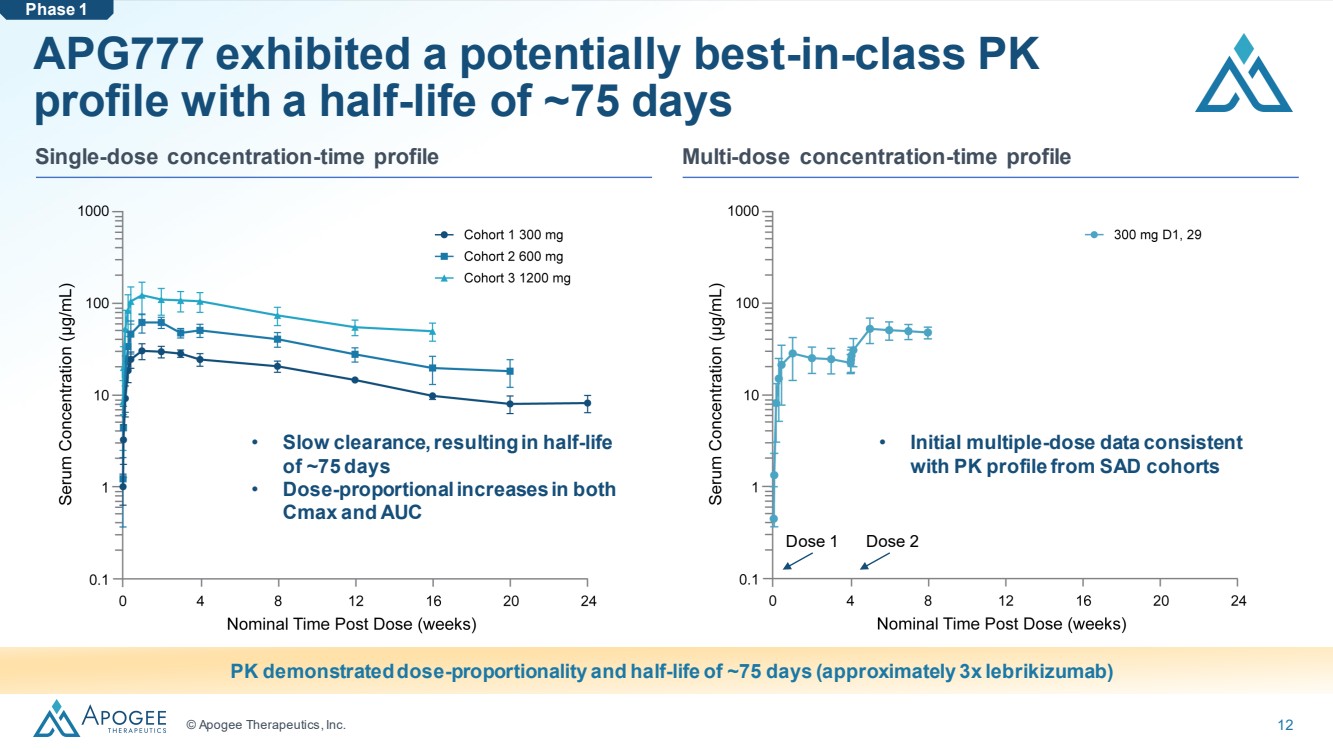
| © Apogee Therapeutics, Inc. 12 APG777 可能表現出同類最佳的 PK 特徵,半衰期約為 75 天 • 清除緩慢,導致半衰期 約為 75 天 • Cmax 和 AUC PK 的劑量成比例和半衰期約為 75 天(大約 3 倍來曲單抗) } • 初始多劑量數據 與 SAD 隊列的 PK 分佈一致 單劑量濃度時間分佈多劑量濃度時間分佈圖 第 1 階段劑量 1 劑量 2 |
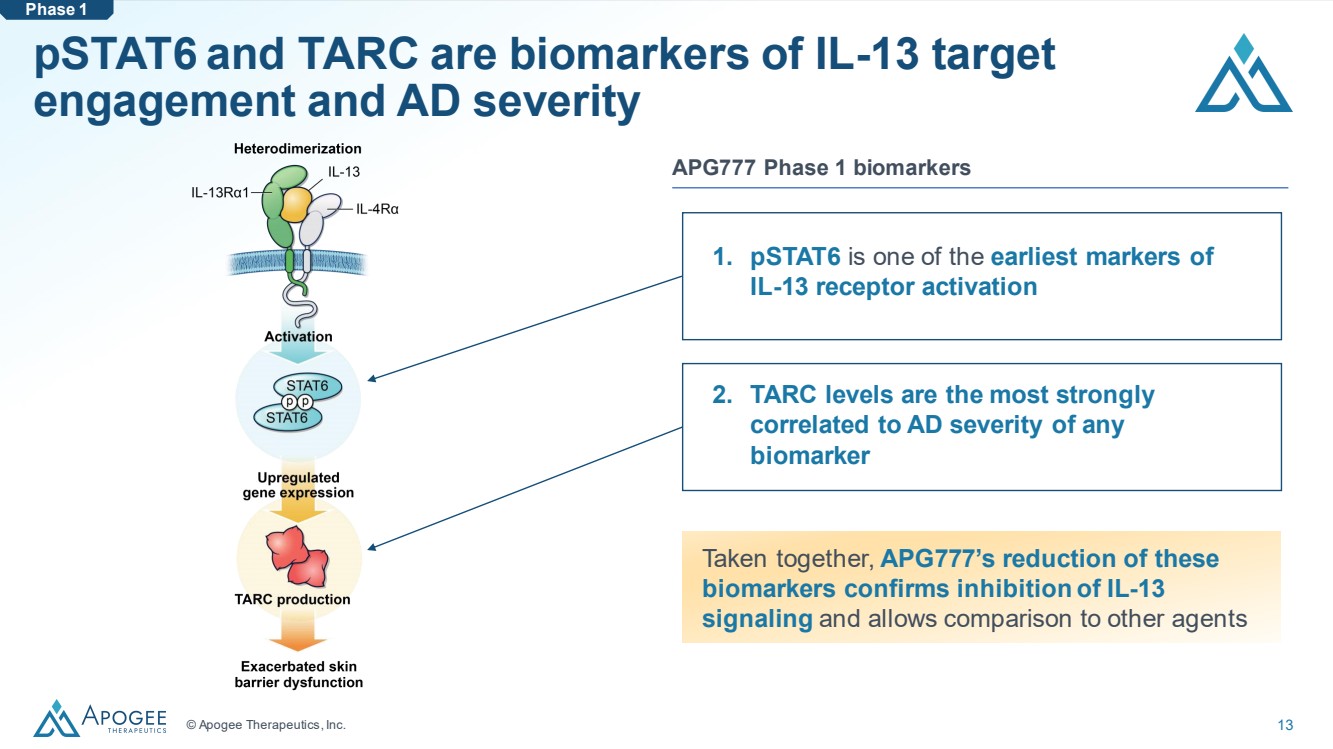
| © Apogee Therapeutics, Inc. 13 pStat6 和 TARC 是 IL-13 靶向 參與度和 AD 嚴重程度 1 的生物標誌物。pStat6 是 IL-13 受體激活的最早標誌物之一 APG777 1 期生物標誌物 綜合來看,APG777 對這些 生物標誌物的還原證實了 IL-13 信號的抑制,可以與其他藥物 進行比較第 1 階段 2.在所有 生物標誌物中,TARC 水平與 AD 嚴重程度相關性最強 |
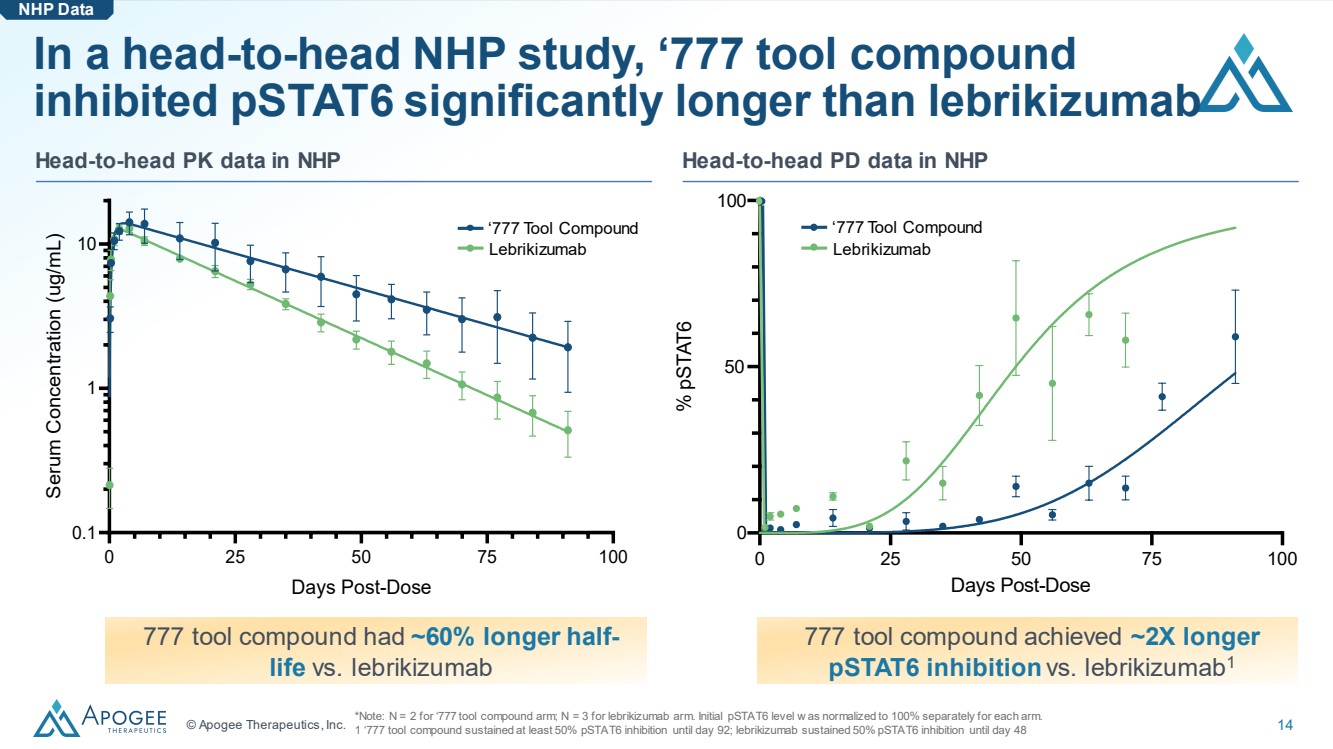
| © Apogee Therapeutics, Inc. 14 0 25 50 75 100 50 100 0 0 劑量後 % pstat6 '777 工具化合物 Lebrikizumab 在一項正面交鋒的NHP研究中,'777工具化合物 對pStat6的抑制時間明顯長於NHP頭對頭PD數據中的來布里珠單抗 頭對頭PK數據與 lebrikizumab 相比,HP 777 工具化合物的半衰期延長了約 60%。*注意:'777 工具複合臂為 N = 2;lebrikizumab 手臂為 N = 3。每隻手臂的初始 pStat6 級別 w 分別標準化為 100%。 1 '777 工具化合物在第 92 天之前持續了至少 50% 的 pStat6 抑制;lebrikizumab 在第 48 天之前持續抑制了 50% 的 pStat6 NHP 數據 777 工具化合物的抑制時間延長了約 2 倍 pstat6 的抑制時間比 lebrikizumab1 '777 工具化合物 0 25 50 75 100 0.1 1 給藥後 10 天 血清濃度 (ug/mL) |
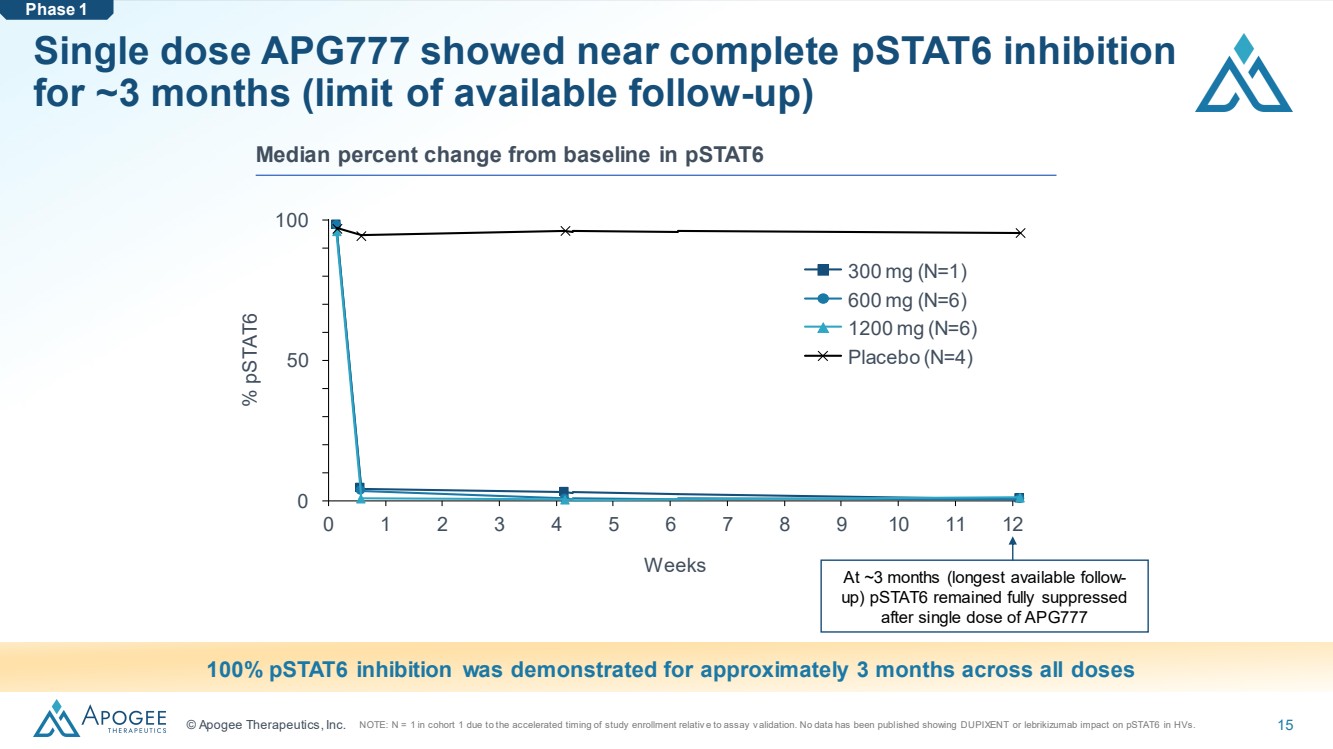
| © Apogee Therapeutics, Inc. 15 單劑量 APG777 在大約 3 個月內表現出接近完全的 pStat6 抑制 (可用隨訪的限制) 0 1 2 3 4 5 6 7 8 9 10 11 12 0 50 100 周 % pStat6 300 mg (N=1) 600 mg (N=6) 1200 mg (N=6) 安慰劑 (N=4) 在所有劑量下均顯示出大約 3 個月的 pStat6 抑制效果持續了大約 3 個月 pStat6 第 1 階段與基線相比的中位數變化百分比在大約 3 個月(可用時間最長的隨訪時間)單劑量 APG777 後 pstat6 仍完全被抑制 注意:由於隊列1中的N = 1研究入學率與化驗和驗證相關。尚未公佈任何數據顯示DUPIXENT或lebrikizumab對HV中的pStat6有影響。 |
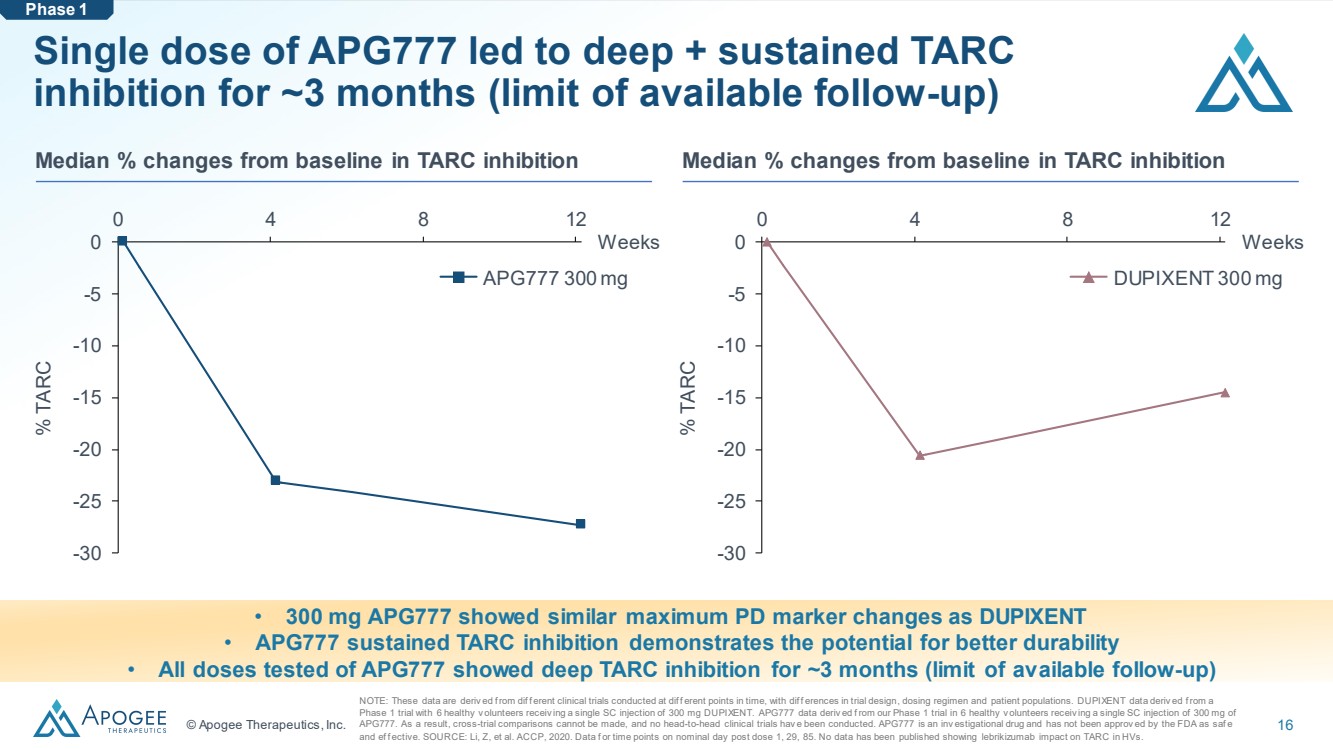
| © Apogee Therapeutics, Inc. 16 單劑量 APG777 可導致大約 3 個月的深度 + 持續抑制 TARC (可用隨訪的極限) • 300 mg APG777 顯示出與 DUPIXENT 相似的最大 PD 標誌物變化 • APG777 持續的 TARC 抑制顯示出更高的耐久性 • 所有對 APG777 進行測試的劑量均顯示出大約 3 個月的深度 TARC 抑制作用(可用極限)隨訪) -30 -25 -20 -15 -10 -5 0 0 4 8 12 周 % TARC APG777 300 mg 300 mg 注:這些數據源自在 diff f erent 下進行的臨牀試驗的差異時間點,試驗設計、給藥方案和患者羣體存在差異。DUPIXENT的數據源自一項 1期試驗,6名健康的志願者接受了單次300毫克的DUPIXENT注射。APG777 數據源自我們針對 6 名接受單次 SC 注射 300 mg APG777 的健康志願者進行的 1 期試驗。因此,無法進行跨試驗比較,也沒有進行過正面交鋒的臨牀試驗。APG777 是一種臨牀試驗藥物,尚未被美國食品藥品管理局批准為安全 和有效作用。資料來源:Li、Z 等。ACCP,2020 年。劑量 1、29、85 後標稱天的數據或時間點。尚未公佈任何數據顯示來布里珠單抗對HV中TARC的影響。 TARC 抑制與基線相比的中位數百分比變化 TARC 抑制與基線相比的中位數變化百分比 -30 -25 -20 -15 -5 0 0 4 8 12 周 % TARC DUPIXENT 300 mg 階段 1 |
| © Apogee Therapeutics, Inc. 17 APG777 陽性 PK 讀數是降低風險的關鍵里程碑,它驗證了項目和管線 1 期抗體屬性的臨牀概況 在相關的臨牀前分析中與第一代 抗體相等效或更好 表位與來布里珠單抗 表位重疊 表位 經臨牀驗證的 IL-13 靶標 PK 數據支持每 3 至 6 個月 維持劑量: ~75 天半衰期 接近最大通路抑制,持續約 3 個月(當前隨訪限制) 耐受性良好,有能力達到 誘導暴露量增加 可能改善的臨牀反應 Apogee打算在2024年上半年啟動特應性皮炎的第二階段 |
| APG777 特應性皮炎的第 2 階段 |
| © Apogee Therapeutics, Inc. 19 APG777 特應性皮炎的第二階段預計 將於 2024 年上半年開始,在 2025 年下半年提供 16 周療效數據 APG777 180 mg/mL 配方 在相同體積下 的劑量比 高劑量 啟用 計劃將 pH2a 和 ph2b 元素合成單一協議; 與 傳統測序方法相比,時間表顯著加快 INTEGRATED Topline A 部分 16 週數據 預計將於 2025 年下半年上半年開始 臨牀反應改善潛力 (例如 EASI-75、EASI-90、IGA 0/1)基於 的模擬暴露量比 lebrikizumab 高約 30-40%,注射量減少約 50% 更大 誘導暴露 每 3 或 6 個月的維護 方案,與來布里珠單抗的模型暴露 Q4W 延長 維持劑量 |
| © Apogee Therapeutics, Inc. 20 第二階段集成設計有可能顯著加快時間表 • 將 pH2a 和 pH2b 元素合併為單一協議;所有 A 部分站點均為 B 部分站點(避免各部分之間的站點啟動延遲) 預計在 25 年下半年 A 部分中獲得 16- 周的頭條數據:概念驗證(N ~110) 誘導維護 br} 篩查 2:1 W0 W2 W4 W12 720mg 720mg 360mg 360mg 每 3 個月(Q12W) 每 6 個月(Q24W) W16 主要終點 注意:誘導中的數量和劑量以及B 部分中待測試的維持方案是初步的,將根據 A 部分的新興數據予以確認。 延期至 OLE 或 52 周 隨訪期 AD 第 2 階段 B 部分:劑量優化(N ~360) 篩選 1:1:1 方案 A(待定)延期至 OLE 或 52 周 隨訪期 高劑量 br} 中等劑量 低劑量 安慰劑 誘導維護 W16 主要終點 方案 B(待定) 安慰劑 安慰劑 |
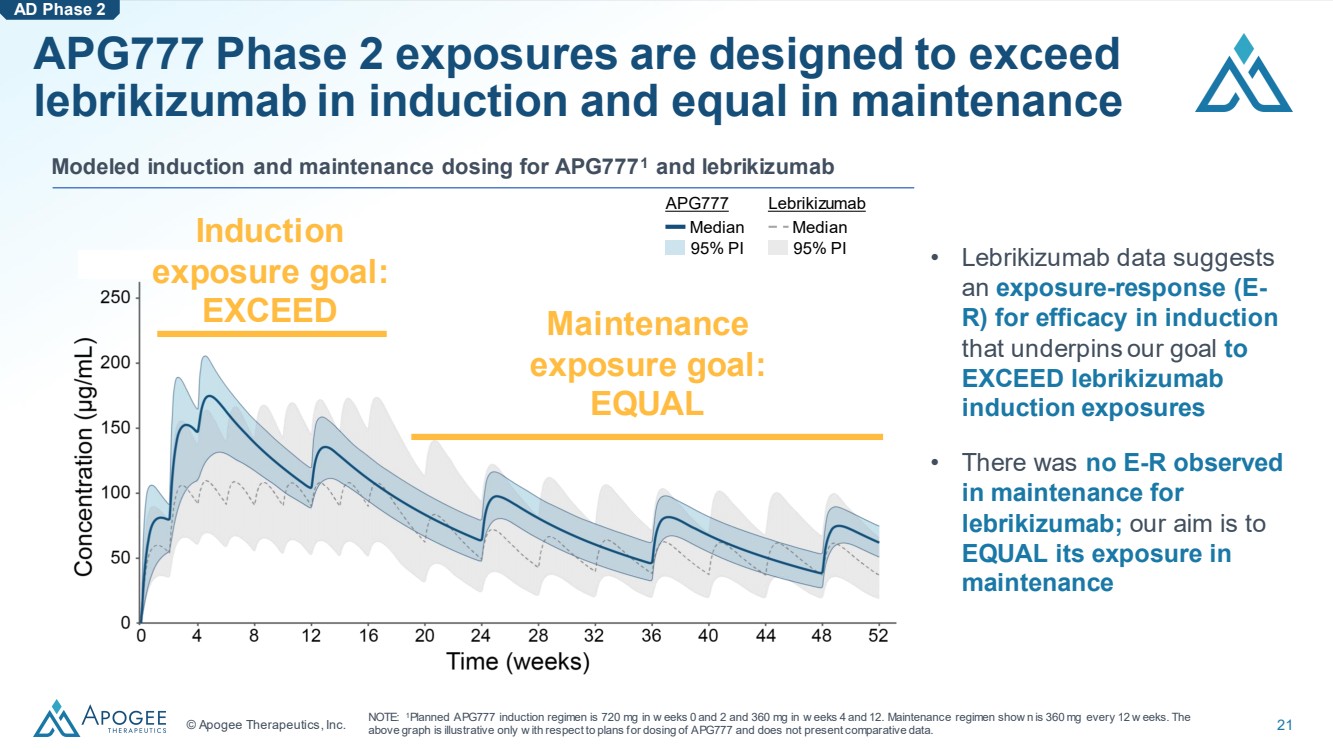
| © Apogee Therapeutics, Inc. 21 APG777 第 2 期暴露量設計為在誘導時超過 lebrikizumab,維持期等於 APG7771 和來布里珠單抗 誘導 暴露目標: EQUAL AD 第 2 階段 • Lebrikizumab 數據顯示 br} 暴露目標: EQUAL AD 第 2 階段 • Lebrikizumab 數據顯示 br 暴露目標: EQUAL AD 第 2 階段 • Lebrikizumab 的數據顯示 br } 誘導療效 的暴露反應 (E-R) 支撐了我們 超出來曲珠單抗 誘導暴露量的目標 • 在 lebrikizumab 的維持中未觀察到 的 E-R;我們的目標是 等於其暴露量 維護 APG777 中位數 95% PI Lebrikizumab Median 95% PI 注意:1計劃的 APG777 誘導方案在第 0 周和第 2 周內為 720 mg,在第 4 周和第 12 周內為 360 mg。保養方案顯示 n 為每 12 周 360 毫克。上面的 圖表僅説明瞭 APG777 的劑量計劃,沒有提供比較數據。 |
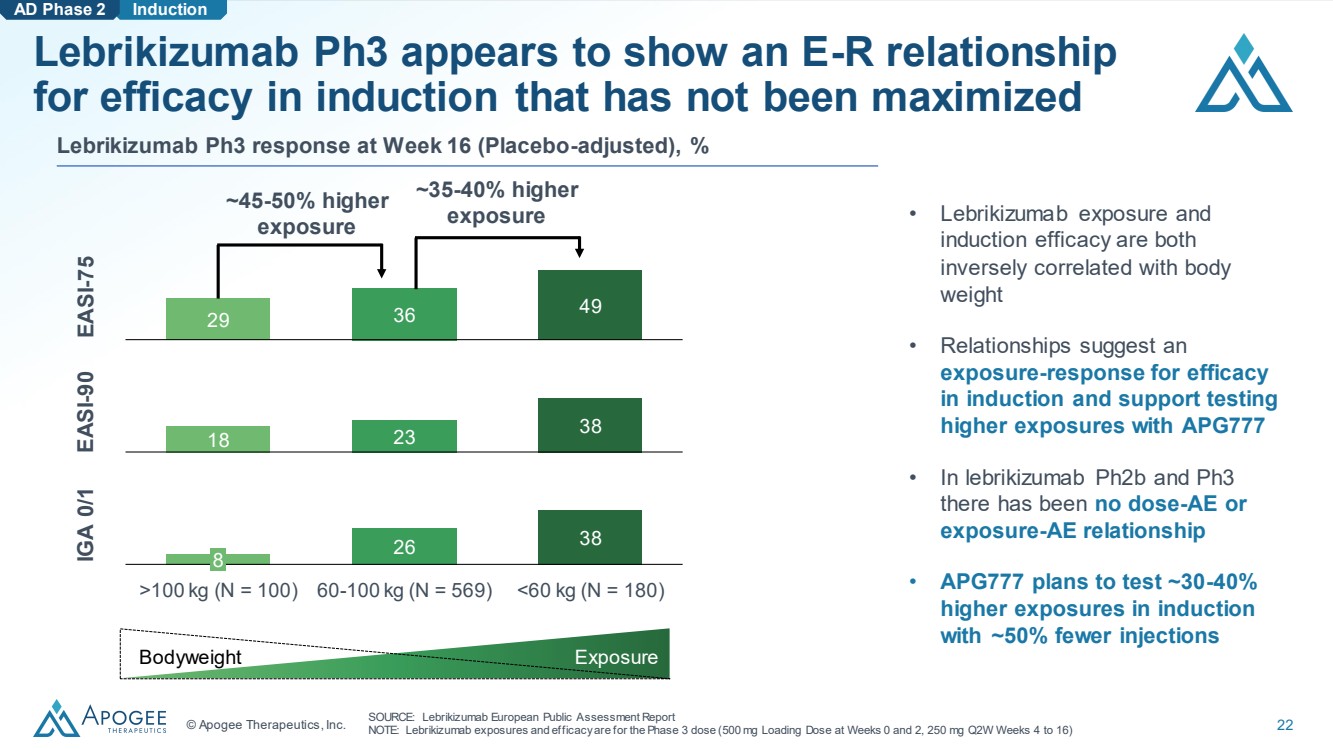
| © Apogee Therapeutics, Inc. 22 暴露 Induction Lebrikizumab ph3 似乎顯示出誘導療效的 E-R 關係 ,但尚未最大化 來源:萊博珠單抗歐洲公開評估報告 注意:雷博珠單抗的暴露和療效適用於第 0 周和第 2 周的 500 mg 負荷劑量,250 mg Q2W 第 4 周至 16 周) Lebrikizumab Ph3 在第 16 周的反應(安慰劑調整),% 26 38 8 >100 kg(N = 100)60-100 kg(N = 569) |
| © Apogee Therapeutics, Inc. 23 暴露 Induction Lebrikizumab ph3 似乎顯示出誘導療效的 E-R 關係 ,但尚未最大化 來源:萊博珠單抗歐洲公開評估報告 注意:雷博珠單抗的暴露和療效適用於第 0 周和第 2 周的 500 mg 負荷劑量,250 mg Q2W 第 4 周至第 16 周) Lebrikizumab Ph3 在第 16 周的反應(安慰劑調整),% 26 38 26 8 >100 kg(N = 100)60-100 kg(N = 569) |
| © Apogee Therapeutics, Inc. 24 APG777 和 lebrikizumab 模擬的 2 期誘導暴露量比 lebrikizumab 的模擬誘導劑量比 約 30-40% 暴露量增加 APG777 Lebrikizumab 注射量 x2 x2 x2 x2 x2 誘導 注意:APG777 誘導方案在第 0 周和第 2 周內為 720 mg,在第 4 周和第 12 周內為 360 mg。暴露量增加基於 APG777 與 lebrikizumab 的建模 Caverage。上圖僅説明瞭 APG777 的劑量計劃,沒有提供比較數據。 ~ 50% 注射減少 AD 第 2 階段 APG777 中位數 95% PI Lebrikizumab Median Median Median 95% PI |
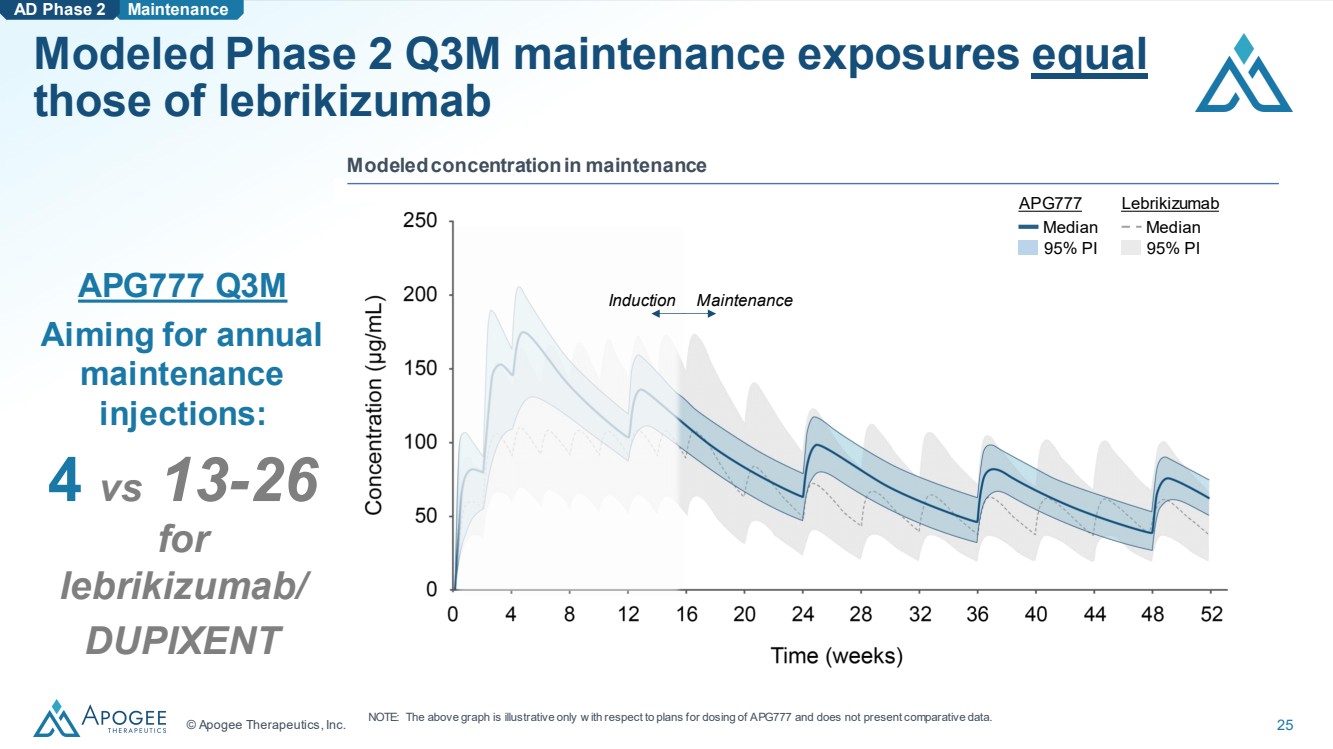
| © Apogee Therapeutics, Inc. 25 模擬的第二季度第三季度維護暴露量等於 lebrikizumab AD 第二階段維護 APG777 Q3M 目標是每年 維護 注射量: lebrikizumab/ DUPIXENT 模擬維持濃度 入職維護 APG777 中位數 95% PI Lebrikizumab 中位數 95% PI 注意:上圖僅説明瞭 APG777 的給藥計劃,沒有提供比較數據。 |
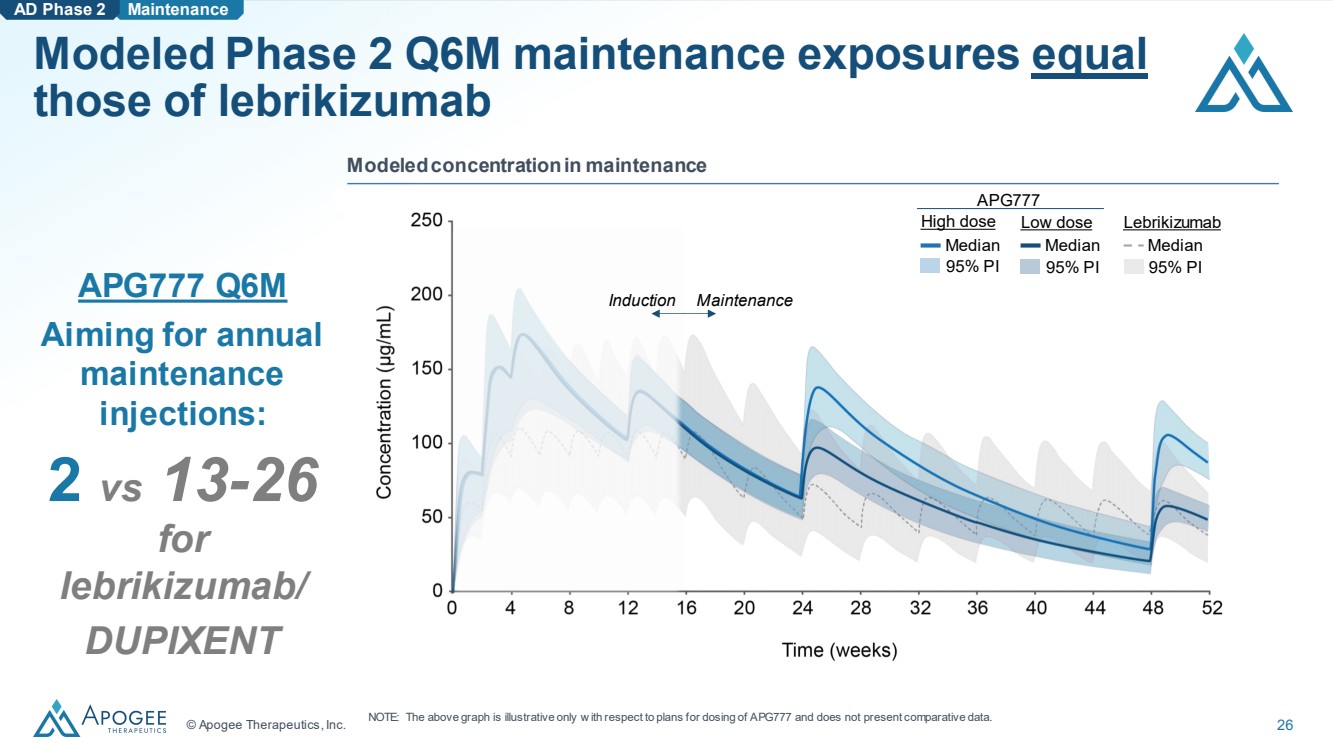
| © Apogee Therapeutics, Inc. 26 模擬第二季度第六季度維護暴露量等於 lebrikizumab AD 第二階段維護 APG777 Q6M 目標是每年 維護 2對比13-26, lebrikizumab/ DUPIXENT 模擬維持濃度 br} 誘導維護 95% PI 中位數 低劑量 中位數 95% PI Lebrikizumab 中位數 95% PI APG777 高劑量 注意:上圖僅説明瞭 APG777 的給藥計劃,沒有提供比較數據。 |
| 打造一家領先的 I&I 公司 |
| © Apogee Therapeutics, Inc. 28 APG777 一流的第 1 階段 PK 概況顯示 有潛力成為預期的 500 億美元以上廣告市場的領先產品1 有利的產品特性和 COGS • 每年維護期僅需 2-4 劑 • 預計配方、可製造性和粘度有所改善 有可能改善臨牀反應(例如 EASI-75、 EASI-90、IGA 0/1)與 lebrikizumab 相比,建模 誘導暴露量高約 30-40% • 表位重疊,效力與來布里珠單抗 (KD) 等效 |
| © Apogee Therapeutics, Inc. 公元 29 年是最大的主要併購市場, 預計未來十年將大幅增長 估計人口規模,MM 7 個主要市場為中度或重度1 2510萬 AD 140 萬 IBD 290 萬 RA 15.2M 940萬 940萬 940萬 慢性阻塞性肺病 920萬 pSO • 牛皮癬預計將成為300億美元以上的市場;特應性 皮炎 (AD) 代表着更大的 機會 。• AD 生物製劑的滲透率 已超過早期 銀屑病生物製劑的滲透率 ics(5 年時為 8% 對 5%) •預計廣告市場 的增長將超過任何其他 I&I 市場 1 7個主要市場是美國、日本、德國、法國、意大利、西班牙和英國。市場規模估計截至2022年。牛皮癬預計到2028年將達到300億美元以上的市場規模,包括生物製劑和小 分子。IBD = 信息性炎性腸病;RA = 類風濕關節炎;pSO = 牛皮癬;慢性阻塞性肺病;AD = 特應性皮炎 來源:公司備案、年度報告、新聞稿、分析預測、學術期刊、GlobalData、Ev AluatePharma、Clariv Late。 |
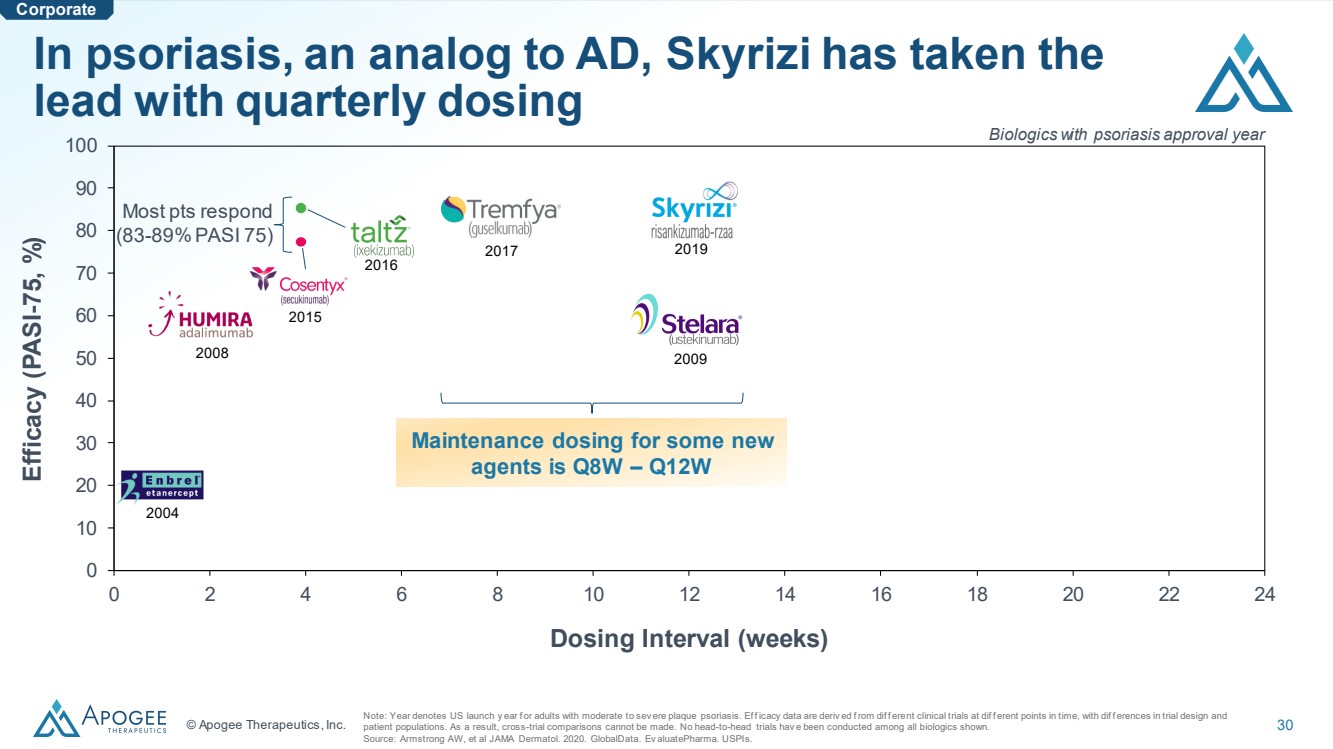
| © Apogee Therapeutics, Inc. 30 0 10 20 30 40 50 60 70 80 90 100 0 0 2 4 6 8 10 12 14 16 18 20 22 24 給藥間隔(周) 功效(PASI -75,%) 在銀屑病(類似於 AD)中,Skyrizi 以 的季度劑量領先 注:年份表示美國按年推出對於中度至SEV的成年人來説,是斑塊狀銀屑病。Eff icacy 數據源自不同時間點的不同臨牀試驗的差異,試驗設計和 患者羣體中的參考文獻差異。因此,無法進行交叉試驗比較。尚未對顯示的所有生物製劑進行正面交鋒試驗。 資料來源:Armstrong AW 等人 JAMA Dermatol,2020 年。全球數據。Ev AluatePharmaUSPI。 大多數 pts 迴應 (83-89% PASI 75) 2019 2017 2017 2016 2008 2004 獲得銀屑病批准年份的生物製劑 一些新 藥物的維持劑量為第 8W — Q12W |
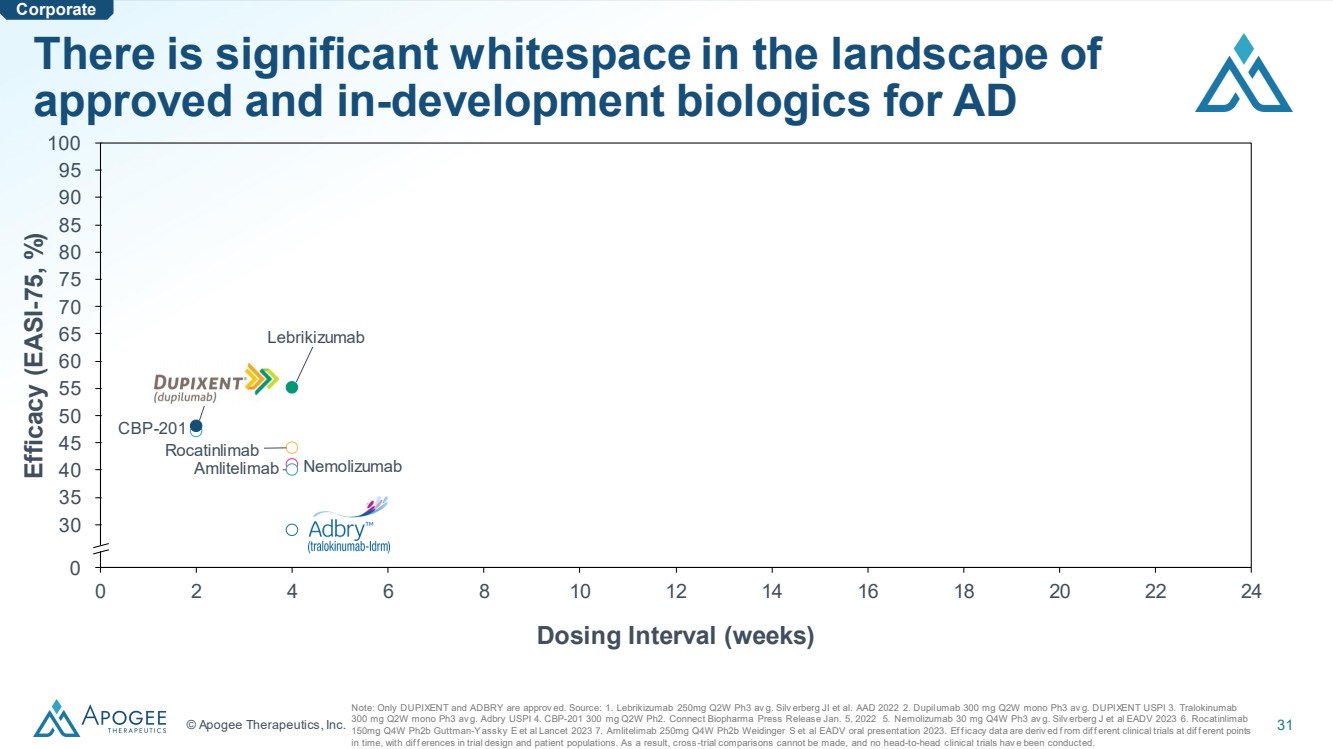
| © Apogee Therapeutics, Inc. 31 0 2 4 6 8 10 12 14 16 18 20 22 24 0 30 35 40 45 50 55 60 65 70 75 80 90 100 85 給藥間隔(周) CBP-201 Nemolizumab Nemolizumab Nemolizumab Racatinlimab Amlitelimab Dupilumab Traluokinb mab 已獲批准和正在開發的用於AD 的生物製劑格局中存在大量空白。注意:只有DUPIXENT和ADBRY獲得批准。資料來源:1.Lebrikizumab 250mg Q2W Ph3 av g. Silv erberg JI 等人AAD 2022 2.Dupilumab 300 mg Q2W mono Ph3 av g. DUPIXENT USPI 3。Tralokinumab 300 mg Q2W 單 Ph3 av. g. Adbry USPI 4。CBP-201 300 毫克 Q2W Ph2。Connect Biopharma 新聞稿 2022 年 1 月 5 日 5.Nemolizumab 30 mg Q4W Ph3 av g. Silv erberg J 等人 EADV 2023 6。Rocatinlimab 150mg Q4W ph2b Guttman-Yassky E 等人《柳葉刀》2023 7.Amlitelimab 250mg Q4W ph2b Weidinger S 等人 EADV 2023 年口頭報告。Eff icacy 數據源自不同時間點的不同臨牀試驗的差異 ,試驗設計和患者羣體存在差異。因此,無法進行跨試驗比較,也沒有進行過正面交鋒的臨牀試驗。 功效 (EASI -75,%) 企業 |
| © Apogee Therapeutics, Inc. 32 0 2 4 6 8 10 12 14 16 18 20 22 24 0 30 35 40 45 50 55 60 65 70 75 80 90 100 85 給藥間隔(周) CBP-201 Nemolizumab Nemolizumab Nemolizumab Racatinlimab Amlitelimab Dupilumab Traluokinb mab Apogee 計劃將 APG777 推進到 2 期試驗 ,維持劑量為 3 或 6 個月 注意:*Apogee 計劃的定位僅供參考,僅基於第 1 階段的中期結果,並説明瞭我們認為我們可能實現的目標。只有 DUPIXENT 和 ADBRY 獲得批准。資料來源:1.Lebrikizumab 250mg Q2W pH3 平均值西爾弗伯格二世等AAD 2022 2.Dupilumab 300 mg Q2W 單體 Ph3 平均值DUPIXENT USPI 3.Tralokinumab 300 mg Q2W 單 Ph3 平均值Adbry USPI 4.CBP-201 300 毫克 Q2W Ph2。Connect Biopharma 新聞稿 2022 年 1 月 5 日 5. Nemolizumab 30 mg Q4W Ph3 平均值Silverberg J 等人 EADV 2023 6.Rocatinlimab 150mg Q4W ph2b Guttman-Yassky E 等人 2023 年 7.Amlitelimab 250mg Q4W ph2b Weidinger S 等人 EADV 2023 年口頭報告。療效數據 來自不同時間點的不同臨牀試驗,試驗設計和患者羣體存在差異。因此,無法進行交叉試驗比較,也沒有進行過正面交鋒的臨牀試驗。 企業功效 (EASI -75,%) APG777 計劃在誘導時測試比來布里珠單抗高約 30-40% 的 。APG777 半衰期允許每 3 或 6 個月的維持劑量 APG777* |
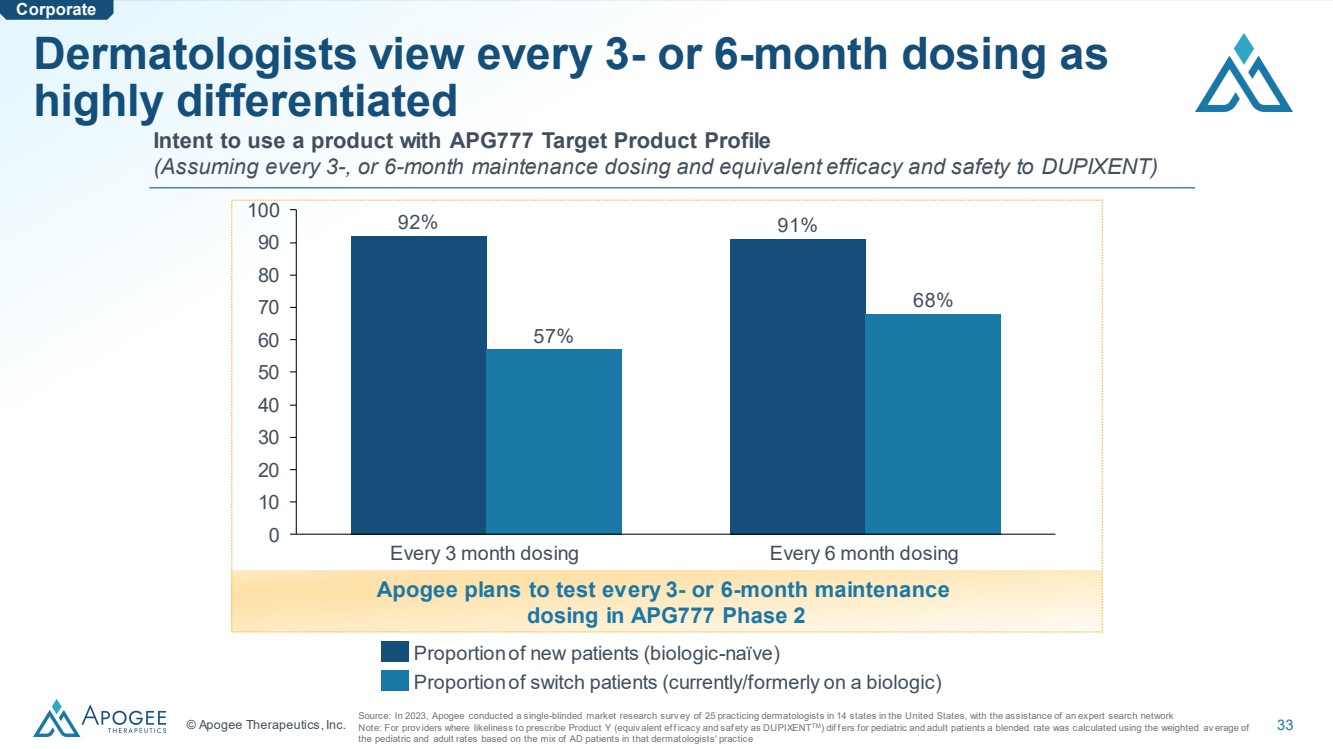
| © Apogee Therapeutics, Inc. 33 位皮膚科醫生將每 3 或 6 個月的劑量視為高度差異化的 來源:2023 年,Apogee 在專家搜索網絡 的協助下,對美國 14 個州的 25 名執業皮膚科醫生進行了單盲市場研究調查 注意:適用於可能開出產品 Y(等同於兒童和成人患者的毒性和安全性(如 DUPIXENTTM)的差異。混合比率是使用 的加權平均值計算得出的,兒童和成人比率的加權平均值是根據以下因素的混合得出的皮膚科醫生執業中的 AD 患者 0 10 20 30 40 50 60 70 80 90 100 每 3 個月給藥每 6 個月給藥一次 92% 57% 91% 68% 新患者的比例(生物學天真) 轉診患者(目前/以前使用生物製劑)的比例 有意使用具有 APG777 的產品產品簡介 (假設每 3 或 6 個月的維持劑量,其療效和安全性與 DUPIXENT 相同) Apogee 計劃在 APG777 第 2 階段 Corporate 中每隔 3 或 6 個月的維持劑量進行一次測試 |
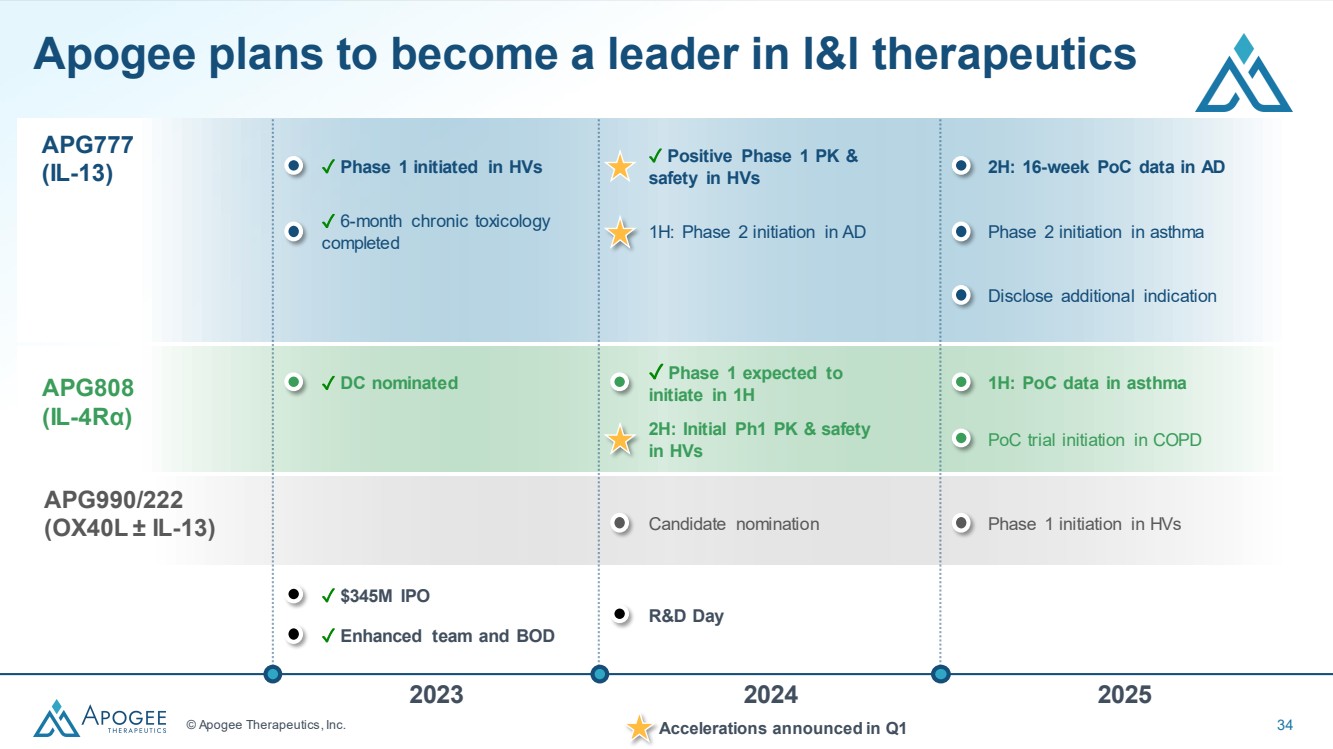
| © Apogee Therapeutics, Inc. 34 APG777 (IL-13) ✓ HV 的 1 期 PK 和 安全性陽性 1H:AD 2H 中 16 周的 PoC 數據啟動哮喘 第 2 階段 披露其他適應症 ✓ 在 HV 中啟動第 1 階段 ✓ 6 個月慢性毒理學 已完成 候選人提名 HV 的第 1 階段啟動 Apogee 計劃成為 l&l 療法 2023 2024 2025 研發日的領導者 APG990/222 (OX40L ± IL-13) APG808 (IL-4Rα) ✓ 第 1 階段預計將於 1H 2H 啟動:HV 1H 的初始 Ph1 PK 和安全 :哮喘的PoC數據 在慢性阻塞性肺病中啟動的PoC試驗 ✓ DC提名 ✓ 3.45億美元的首次公開募股 ✓ 增強型團隊和BOD 加速將在第一季度宣佈 |
| 問答備份 |
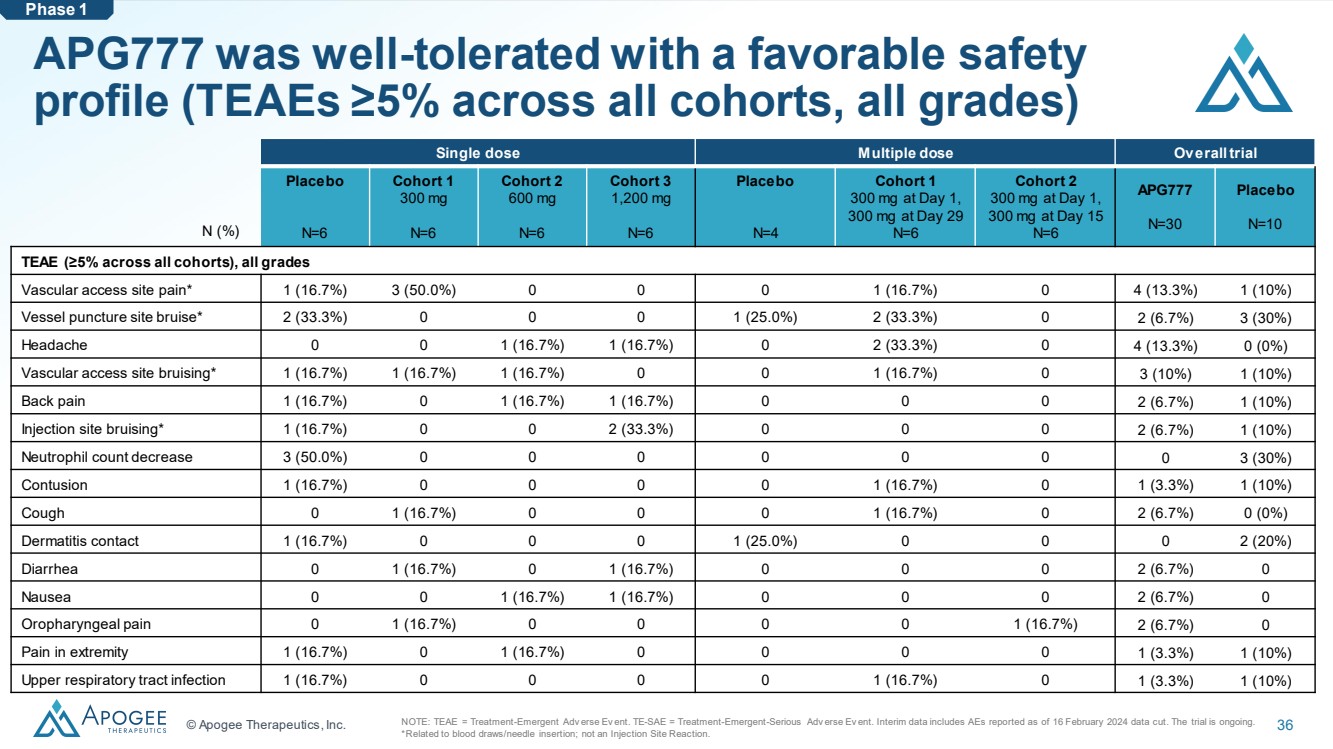
| © Apogee Therapeutics, Inc. 36 APG777 耐受性良好,安全性良好 (所有隊列中所有等級的 TEAE ≥ 5%) 單劑量多劑量總體試驗 N=6 隊列 1 300 mg N=6 隊列 1 300 mg N=6 隊列 2 600 mg N=6 隊列 3 1,200 mg N=6 安慰劑 N=4 隊列 1 第 1 天 300 mg,第 29 天 300 mg N=6 隊列 2 第 1 天 300 mg,第 15 天 300 mg APG777 N=30 安慰劑 N=10 TEAE(所有隊列中≥ 5%),所有等級 血管通路部位疼痛* 1 (16.7%) 3 (50.0%) 0 0 1 (16.7%) 0 0 1 (16.7%)) 0 4 (13.3%) 1 (10%) 血管穿刺部位瘀傷*2 (33.3%) 0 0 0 1 (25.0%) 2 (33.3%) 0 2 (6.7%) 3 (30%) 頭痛 0 0 1 (16.7%) 1 (16.7%) 1 (16.7%) 0 2 (33.3%) 0 4 (13.3%) 0 (0%) 血管通路部位淤青* 1 (16.7%) 1 (16.7%) 0 0 (16.7%) 0 (16.7%) 0 1 (16.7%) 0 (16.7%) 0 (16.7%) 0 (16.7%) 0 3 (10%) 1 (10%) 背痛 1 (16.7%) 0 1 (16.7%) 1 (16.7%) 0 0 0 2 (6.7%) 1 (10%) 注射部位淤青* 1 (16.7%) 0 0 2 (33.3%) 0 0 0 (6.7%) 1 (10%) 中性粒細胞計數減少 3 (50.0%) 0 0 0 0 0 0 0 3 (30%) 挫傷 1 (16.7%) 0 0 0 0 1 (16.7%) 0 1 (3.3%) 1 (10%) 咳嗽 0 1 (16.7%) 0 0 0 0 1 (16.7%) 0 2 (6.7%) 0 (0%) 皮炎接觸 1 (16.7%) 00 0 1 (25.0%) 0 0 0 2 (20%) 腹瀉 0 1 (16.7%) 0 1 (16.7%) 0 0 0 2 (6.7%) 0 噁心 0 0 1 (16.7%) 1 (16.7%) 1 (16.7%) 1 (16.7%) 0 (16.7%) 0 (6.7%) 0 四肢疼痛 1 (16.7%) 0 1 (16.7%) 0 0 0 1 (3.3%) 1 (10%) 上呼吸道感染 1 (16.7%) 0 0 0 1 (16.7%) 0 1 (3.3%) 1 (10%) N (%) 第 1 階段注意:TEAE = 治療-緊急進階版 Event。TE-SAE = 治療-緊急情況-嚴重進階版本中期數據包括截至2024年2月16日公佈的數據截止日期的AE。審判正在進行中。 *與抽血/針頭插入有關;與注射部位反應無關。 |
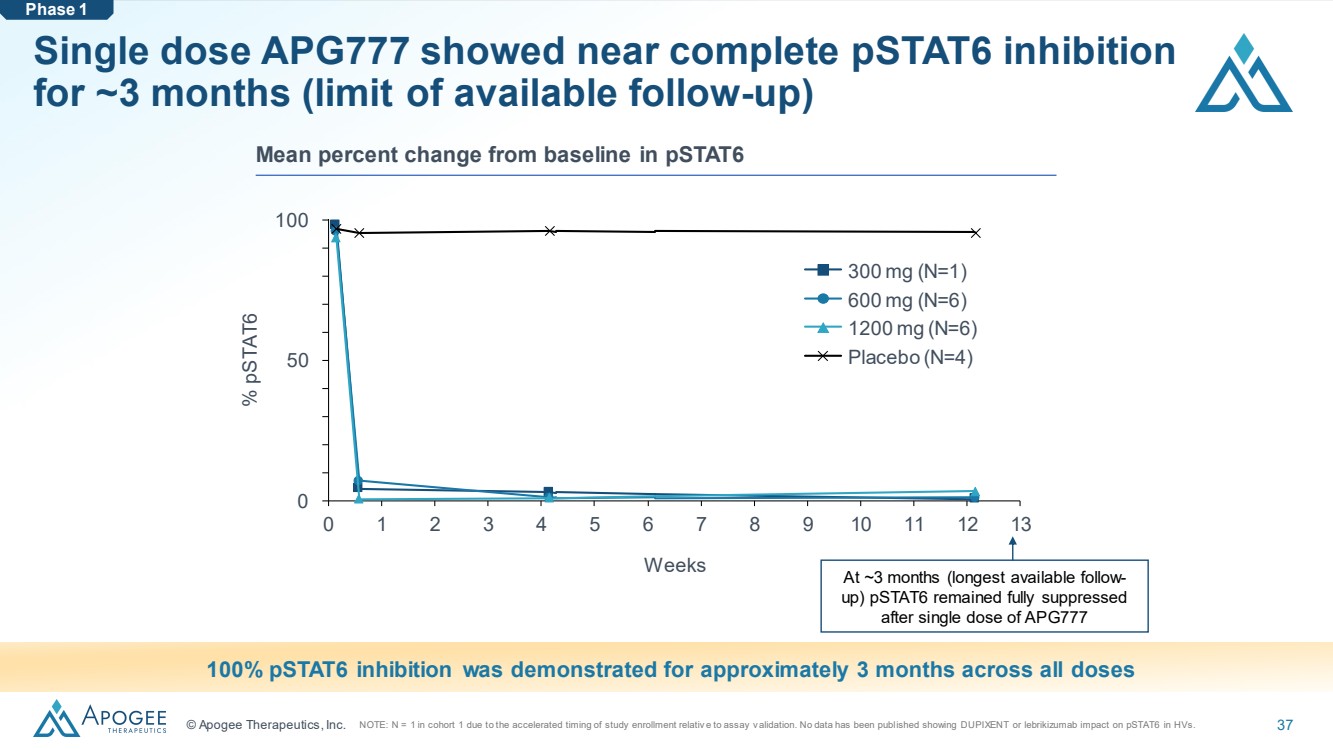
| © Apogee Therapeutics, Inc. 37 單劑量 APG777 在大約 3 個月內表現出接近完全的 pStat6 抑制 (可用隨訪的限制) 0 1 2 3 4 5 6 7 8 9 10 11 12 13 0 50 100 周 % pStat6 300 mg (N=1) 600 mg (N=6) 1200 mg (N=6) 安慰劑 (N=4) 在所有劑量下均顯示出大約 3 個月的 pStat6 抑制效果持續了大約 3 個月 pStat6 第 1 階段與基線的平均變化百分比在大約 3 個月(可用時間最長的隨訪時間)單劑量 APG777 後 pstat6 仍處於完全抑制狀態 注意:由於隊列1中的N = 1研究入學率與化驗和驗證相關。尚未公佈任何數據顯示DUPIXENT或lebrikizumab對HV中的pStat6有影響。 |
| 公司概述 |
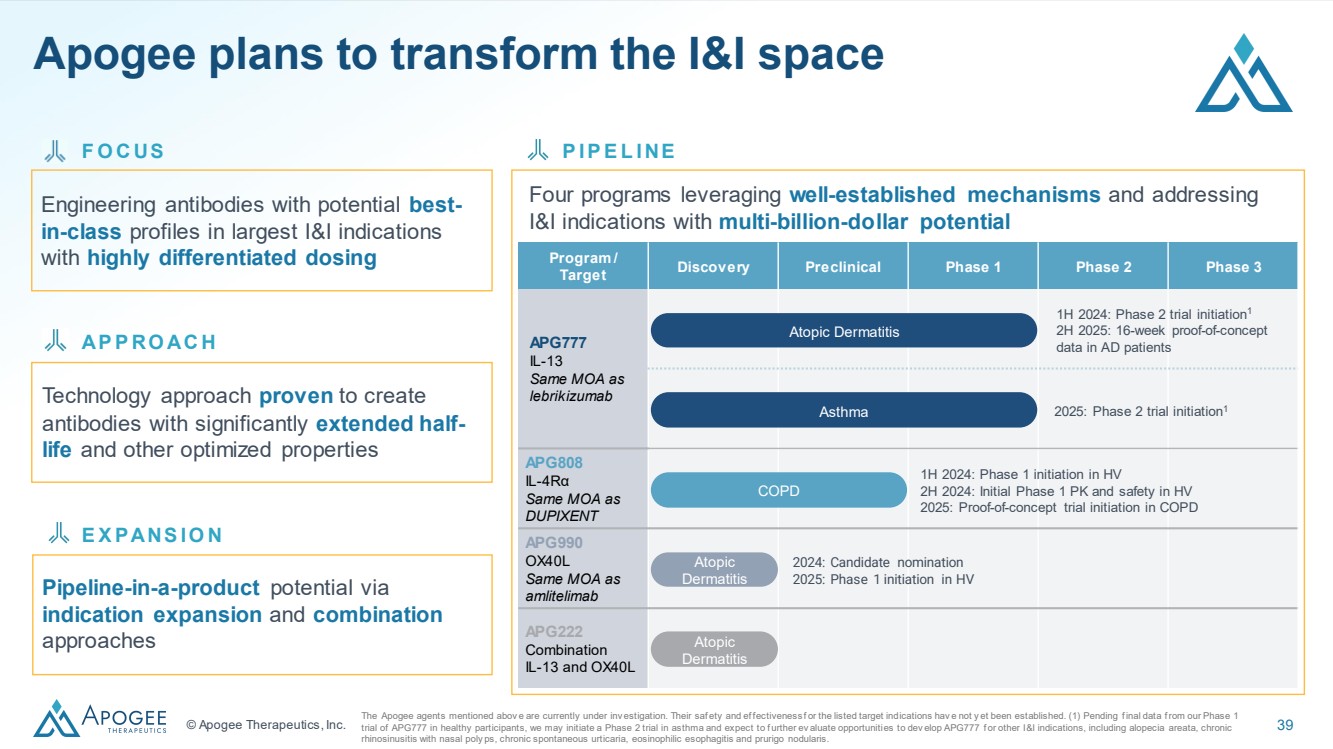
| © Apogee Therapeutics, Inc. 39 在最大的 I&I 適應症中具有最佳特性的工程抗體 具有高度差異化劑量 四個項目利用既定機制處理具有數十億美元潛力的 I&I 適應症 經證實 具有顯著延長半衰期和其他優化特性的 抗體 I P E L I NE AP RO AC H 項目/ 靶標發現臨牀前第一期第二階段 3 期 APG777 IL-13 MOA 與 lebrikizumab APG808 IL-4Rα 相同 IL-4Rα MOA 與 DUPIXENT APG990 OX40L 相同 MOA 與 amlitelimab APG222 組合 IL-13 和 OX40L 特應性 皮炎 特應性皮炎 2024 年上半年:AD 患者 16 周概念驗證 數據 2024 年上半年:HV 2024 年下半年啟動 1 階段:HV 2025 年初期 PK 和安全性:COPD 2024 年特應性 皮炎 的概念驗證試驗啟動:2025 年 HV 哮喘 1 期啟動:上述 Apogee 藥物是目前正在調查中。我們列出的靶向適應症的安全性和效應有效性尚未確定。(1) 在健康參與者中進行的 APG777 一期試驗的最終數據之前,我們可能會啟動一項針對哮喘的 2 期試驗,並預計將進一步評估開發 elop APG777 或其他 I&I 適應症的機會,包括脱髮、伴有鼻腔的慢性 鼻竇炎 poly ps、慢性自發性蕁麻疹、嗜酸性食管炎和結節性瘙癢。 F O C US 通過 指示擴張和合並 方法實現產品管道的潛力 E X PANS I O N Apogee 計劃改造 I&I 領域 |
| © Apogee Therapeutics, Inc. 40 種 Apogee mAb 專為一流的 特性而設計,包括延長半衰期 的 PK 可能性: • 優化暴露 • 減少變異性 • 延長半衰期 • 旨在最大化 抗體回收利用率 • 藥物存在於更高的 水平以延長療效 效力 粘度 PK 穩定性 Backbone 基於經臨牀驗證的表位,其表位具有五種特性 性能: |
| APG777 |
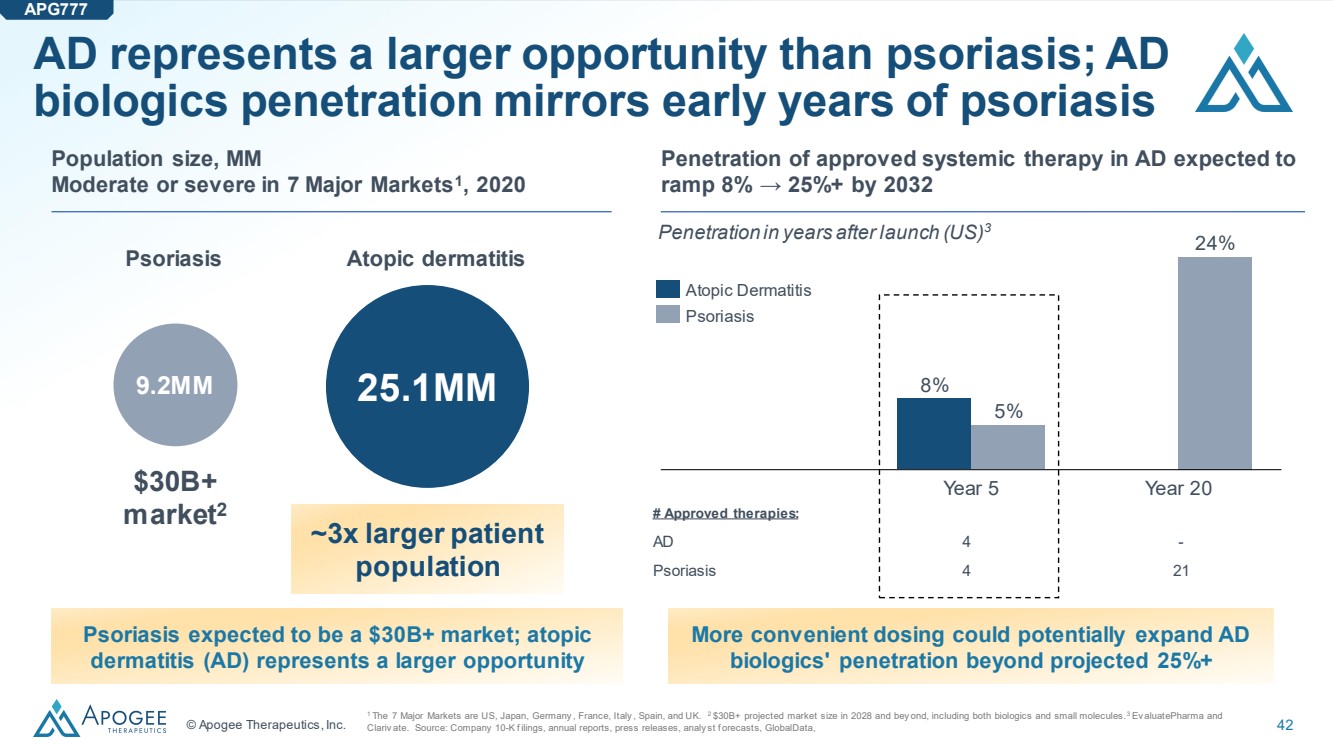
| © Apogee Therapeutics, Inc. 42 AD 代表着比牛皮癬更大的機會;AD 生物製劑的滲透反映了牛皮癬的早期 1 7個主要市場是美國、日本、德國、法國、意大利、西班牙和英國。2 2028年預計市場規模將超過300億美元,包括生物製劑和小分子。3 AluEv Ev atePharma 和 Clariv 吃了。來源:公司1萬份申報、年度報告、新聞稿、預測集、GlobalData、 920萬 251MM 人口規模,MM 7個主要市場的中度或重度1,2020 年銀屑病特應性皮炎 300億美元以上 market2 患者大約 3 倍 人羣 銀屑病預計將是 300億美元以上的市場;特應性 皮炎 (AD) 代表着更大的機會 20 年 5% 5% 24% 24% 特應性皮炎 # 批准的療法: AD 4- 牛皮癬 4 21 上市後數年的滲透率(美國)3 已獲批准的全身療法的滲透率預計到2032年,AD 將增長8% → 25%以上。更便捷的劑量可能會使AD 生物製劑的滲透率超過預計的25% + APG777 |
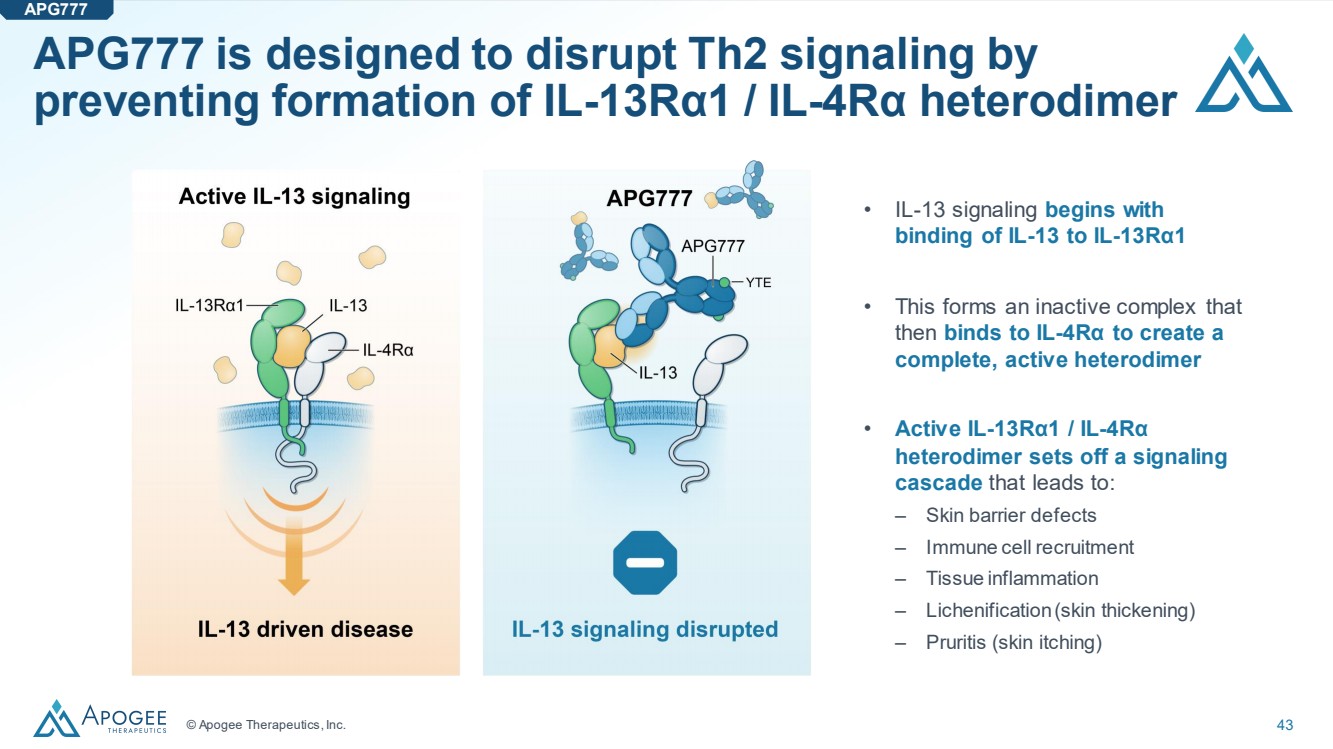
| © Apogee Therapeutics, Inc. 43 APG777 旨在通過 阻止 IL-13Rα1/IL-4Rα 異二聚體的形成來破壞 Th2 信號 • IL-13 信號傳導從 開始 IL-13 與 IL-13Rα1 結合 • 它形成一種無活性複合物 然後 與 IL-4Rα 結合以產生 完整、活性異二聚體 • IL-13Rα1/IL-4Rα 異二聚體引發信號 級聯,導致: − 皮膚屏障缺陷 − 免疫細胞招募 − 組織炎症 − 地衣化(皮膚增厚) − 瘙癢(皮膚瘙癢) APG777 |
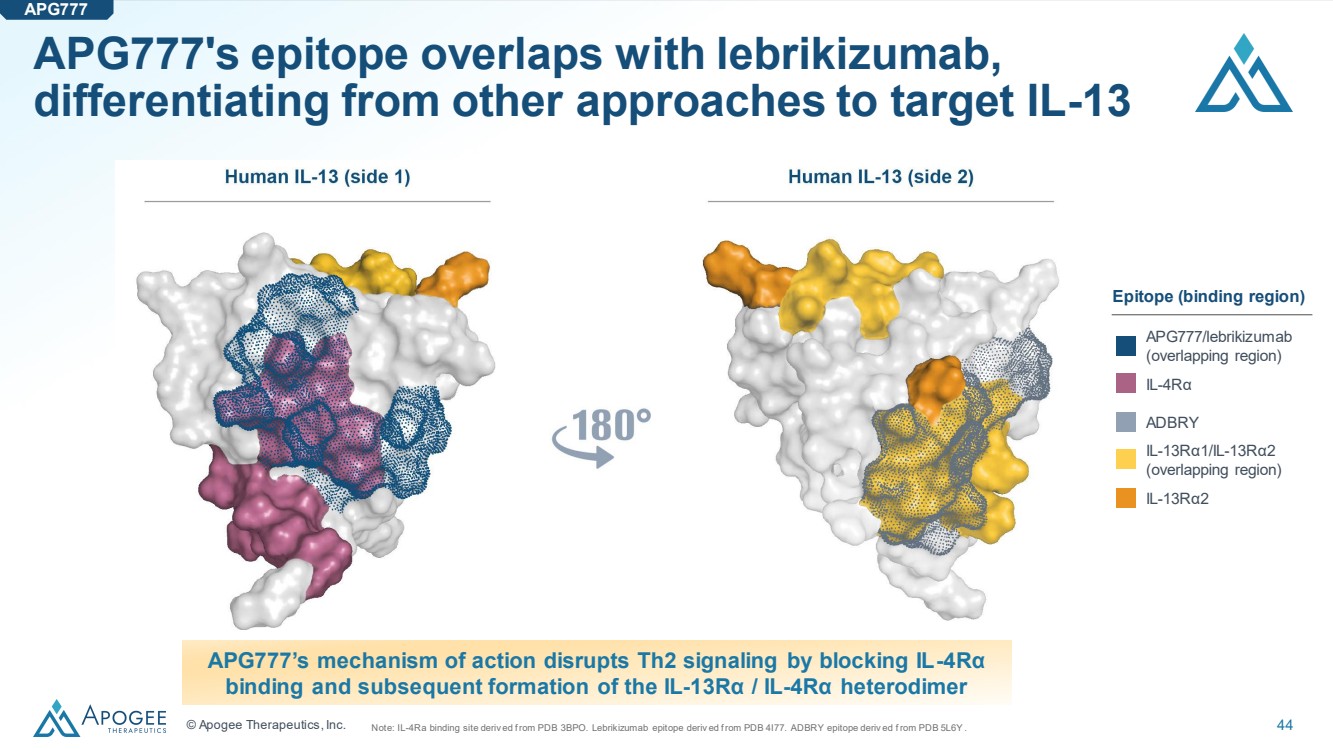
| © Apogee Therapeutics, Inc. 44 APG777 的表位與來布里珠單抗重疊, 區別於其他靶向 IL-13 的方法注意:IL-4ra 結合位點源自 PDB 3BPO。Lebrikizumab 表位源自 PDB 4I77。ADBRY 表位源自 PDB 5L6Y。 APG777 的作用機制通過阻斷 IL-4Rα 結合以及隨後形成 IL-13Rα/IL-4Rα 異二聚體 apg777/lebrikizumab (重疊區域) ADBRY IL-13Rα1/IL-13Rα2(重疊區域) ,從而破壞 Th2 信號傳導 13Rα2 表位(結合區) APG777 |
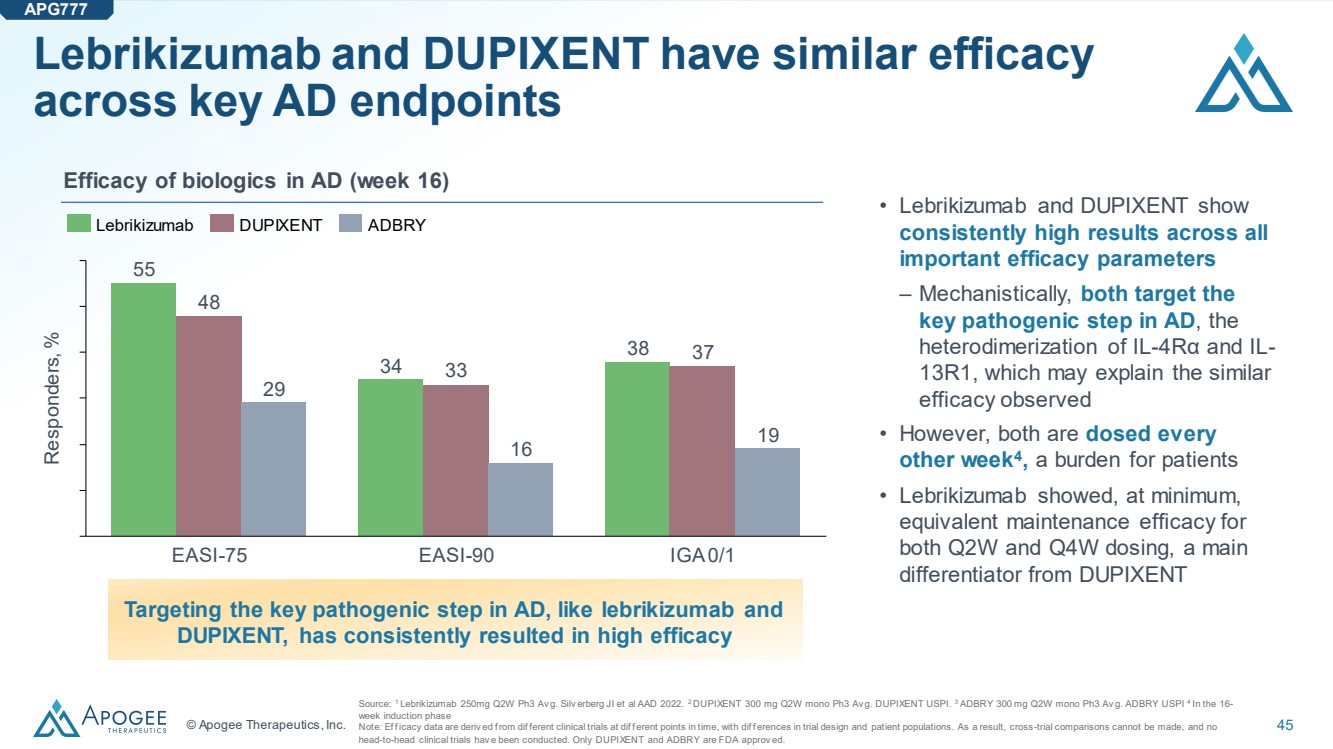
| © Apogee Therapeutics, Inc. 45 Lebrikizumab 和 DUPIXENT 在關鍵的 AD 終點中具有相似的功效 來源:1 Lebrikizumab 250mg Q2W Ph3 Av g. Silv erberg JI 等人 AAD 2022。2 DUPIXENT 300 mg Q2W mono Ph3 Av g. DUPIXENT 300 mg Q2W mono Ph3 Av g. DUPIXENT 300 mg Q2W mono Ph3 Av g. DUPIXENT 300 mg Q2W mono Ph3 Av g. 3 Av g. ADBRY USPI 4 在 16- 周的誘導階段 注意:Ef of icacy 數據源自不同時間點的不同臨牀試驗,試驗設計和患者羣體存在差異。因此,無法進行跨試驗比較,也沒有進行過 頭對頭臨牀試驗。只有 DUPIXENT 和 ADBRY 獲得 FDA 的批准。 生物製劑在 AD 中的功效(第 16 周) • Lebrikizumab 和 DUPIXENT 在所有 重要功效參數中均顯示出持續較高的結果 — 從機制上講,兩者都針對 AD 的 關鍵致病步驟,即 IL-4Rα 和 IL-13R1 的 異二聚化,這也許可以解釋觀察到的類似 療效 ,兩者每隔一週 給藥一次 4,這給患者帶來了負擔 • Lebrikizumab 在 Q2W 和 Q4W 的給藥中至少顯示出 同等的維持療效,這是 DUPIXENT 的主要區別因素瞄準關鍵AD 中的致病步驟,例如 lebrikizumab 和 DUPIXENT,一直帶來高療效 APG777 55 34 38 33 37 29 16 受試者,% EASI-75 EASI-90 IGA 0/1 Lebrikizumab DUPIXENT DUPIXENT ADBRY |
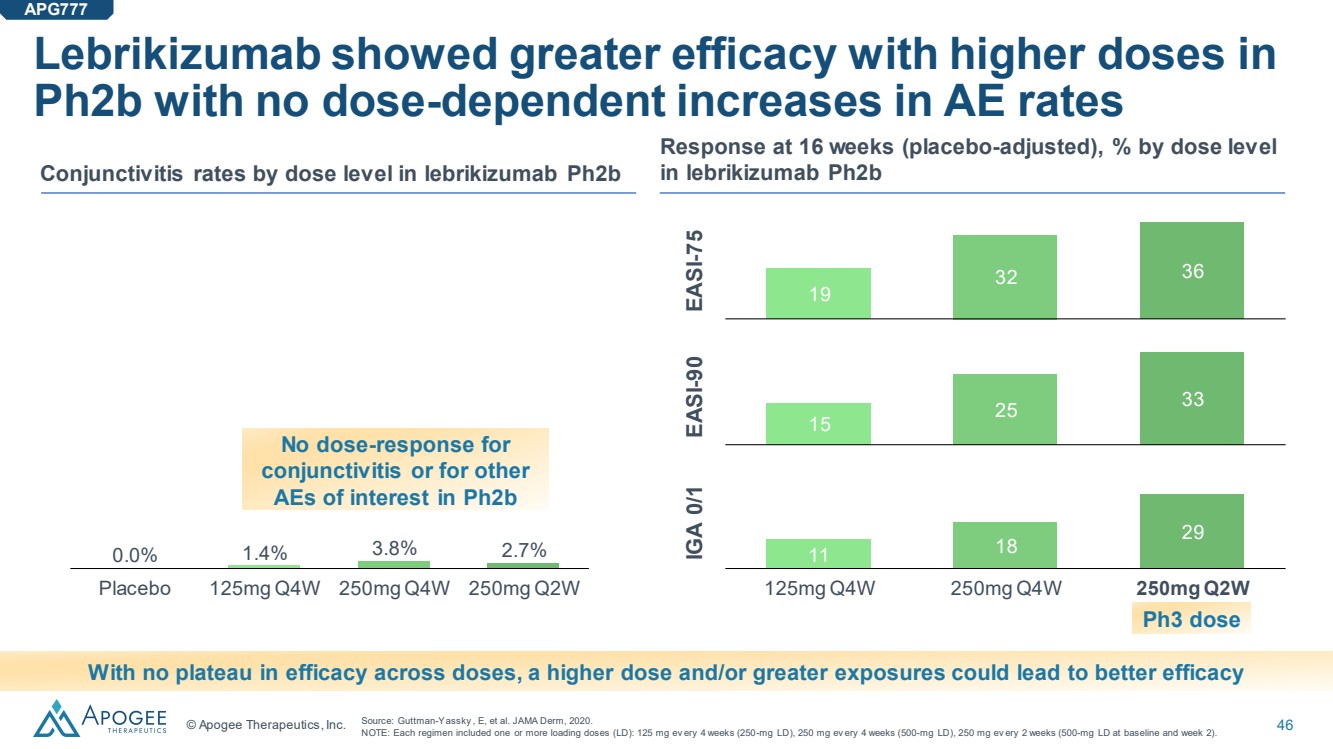
| © Apogee Therapeutics, Inc. 46 Lebrikizumab 在 pH2b 的劑量越高時表現出更大的療效,AE 率沒有劑量依賴性增加 安慰劑 125mg Q4W 250mg Q4W 250mg Q2W 0.0% 1.4% 3.8% 2.7% 按劑量水平計算的結膜炎率 ph2b lebrikizumab ph2b 在 16 周時的反應(經安慰劑調整),按劑量水平 的百分比。由於不同劑量的療效沒有平衡,更高的劑量和/或更大的暴露量可以帶來更好的療效 來源:Guttman-Yassky,E 等JAMA Derm,2020 年。 注意:每種方案包括一個或多個負荷劑量(LD):每 4 周 125 毫克(250 毫克 LD),每 4 周 250 毫克(500 毫克 LD),每 2 周 250 毫克(基線和第 2 周為 500 毫克 LD)。 對 結膜炎或其他 ph2b 感興趣的 AE 沒有劑量反應 APG777 11 18 29 125mg Q4W 250mg Q4W 250mg Q4W 250mg Q2W 250mg Q2W EASI-75 EASI-90 IGA 0/1 15 25 33 19 32 36 Ph3 劑量 |
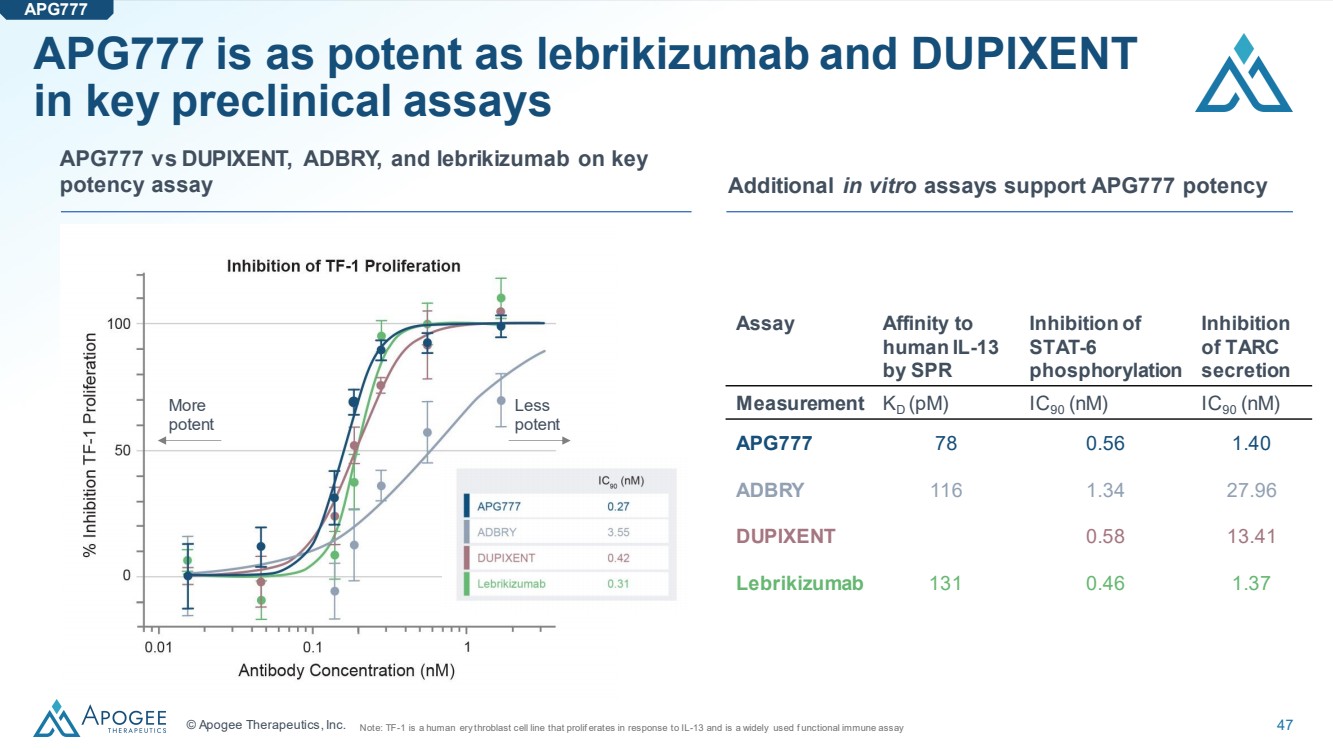
| © Apogee Therapeutics, Inc. 47 在關鍵臨牀前分析中,APG777 的效力與來布里珠單抗和 DUPIXENT 一樣有效 更多 效力 測定對 人 IL-13 的親和力抑制 TARC 的 磷酸化 抑制 分泌 測量 KD (pM) IC90 (nM) IC90 (nM) APG777 78 0.56 1.40 ADBRY 116 1.34 27.96 DUPIXENT 0.58 13.41 13.41 Lebrikizumab 131 0.46 1.37 注意:TF-1 是一種對 IL-13 產生催化反應的人類凝血細胞系,是一種廣泛使用的功能性免疫檢測 其他體內 ro 試驗 STAT-6在關鍵 效力測定中支持 APG777 效力 APG777 與 DUPIXENT、ADBRY 和 lebrikizumab 對比 APG777 |
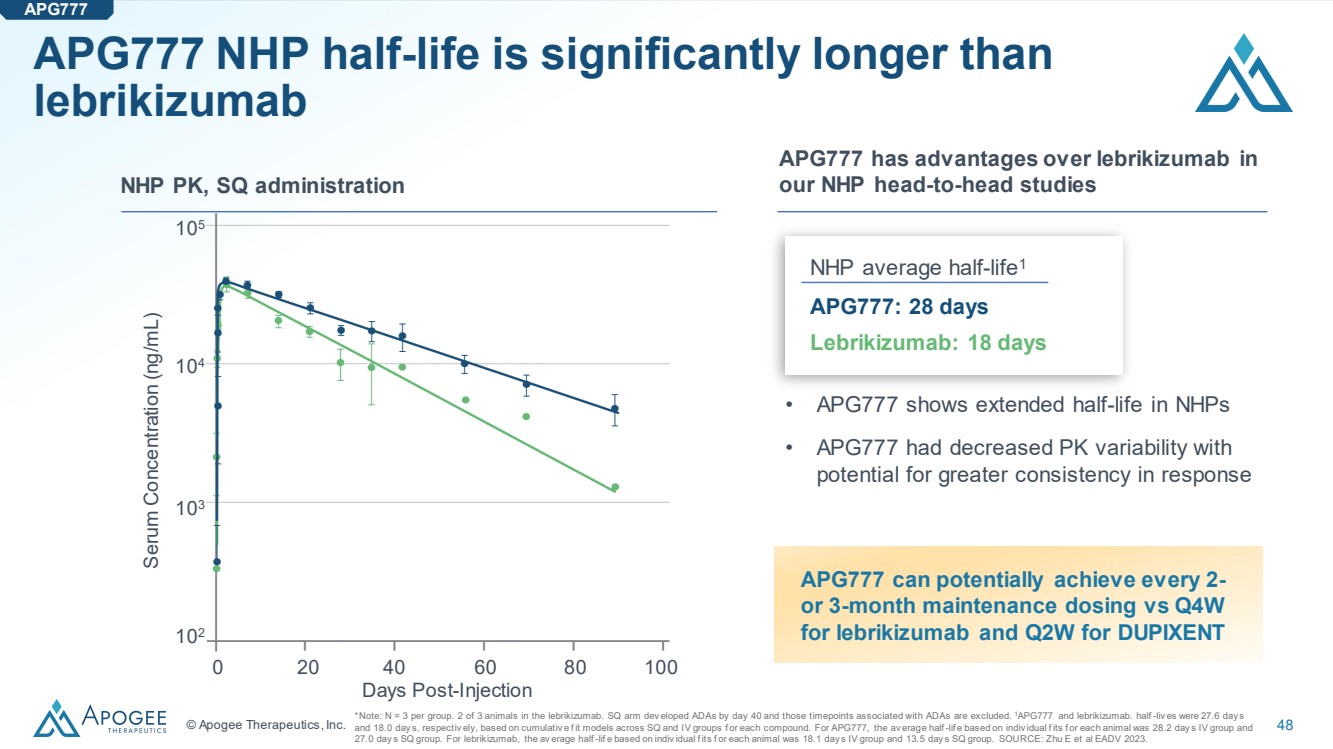
| © Apogee Therapeutics, Inc. 48 APG777 NHP 的半衰期明顯長於 lebrikizumab *注意:N = 每組 3 只。lebrikizumab 中 3 只動物中有 2 只。SQARM 開發人員在第 40 天之前私奔了 ADAs,與 ADAS 相關的時間點不包括在內。1APG777 和 lebrikizumab。根據每種化合物的 SQL 和 IV 組的累積模型,半衰期分別為 27.6 天 和 18.0 天。對於 APG777,根據每隻動物的個體偶像,靜脈注射組的平均半衰期為 28.2 天,SQL 組為 27.0 天。對於lebrikizumab,根據每隻動物的個體偶數,靜脈注射組的平均半衰期為18.1天,SQL組的平均半衰期為13.5天。資料來源:Zhu E 等人 EADV 2023。 注射後天數 0 20 40 60 80 100 血清濃度 (ng/mL) 102 103 104 105 APG777 在 NHP PK 中比來曲單抗具有優勢,SQ 管理局我們的 NHP 平均半衰期1 APG777:28 天 萊博珠單抗:18 天 • APG777 顯示 NHP 的半衰期延長 } • APG777 降低了 PK 變異性, 有可能提高反應的一致性 APG777 APG777 有可能達到每 2- 或 3 個月的維持劑量,lebrikizumab 的 Q4W 和 DUPIXENT 的 Q2W |
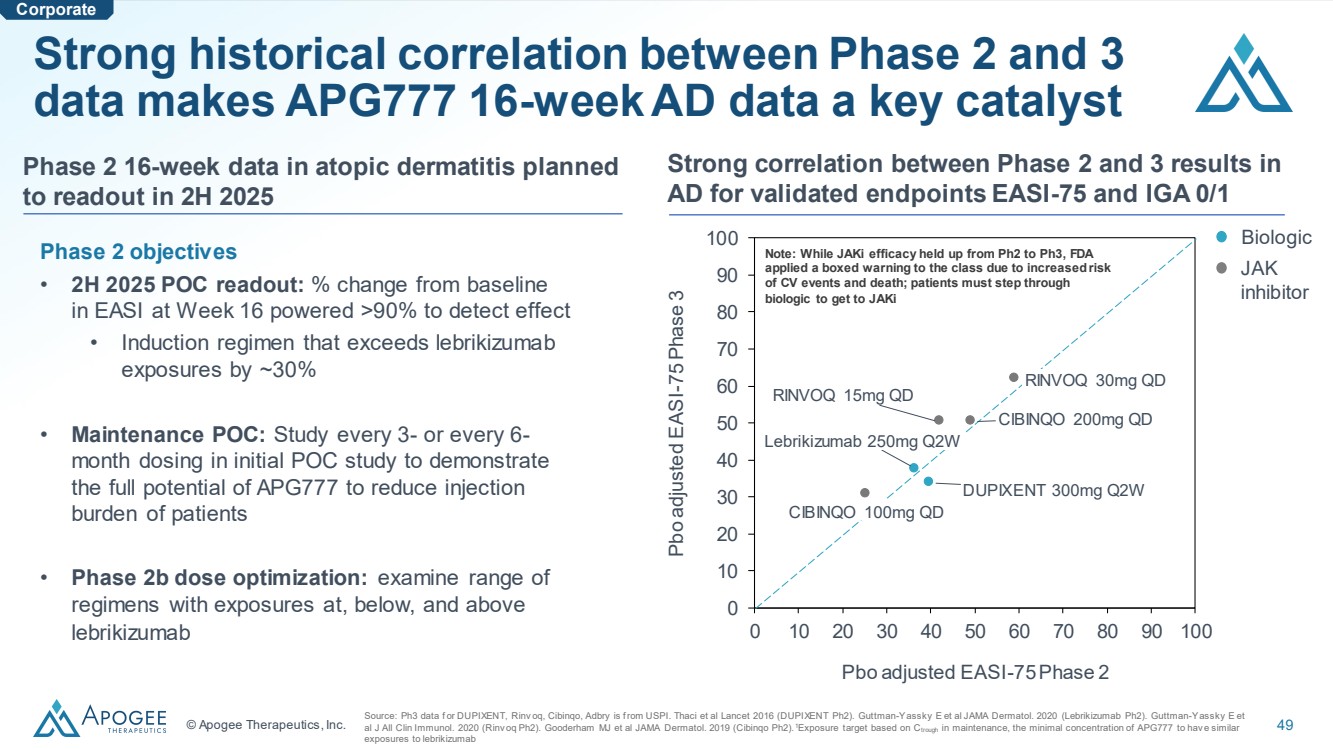
| © Apogee Therapeutics, Inc. 49 經過驗證的終點會產生 AD 的強相關性 EASI-75 和 IGA 0/1 第 2 階段和第 3 階段數據之間的強大歷史相關性使 APG777 16 周的 AD 數據成為關鍵催化劑 來源:我們的 Ph3 數據 f 或 DUPIXENT、Rinv oq、Cibinqo、Adbry 來自美國消費價格指數。Thaci 等人 2016 年《柳葉刀》(DUPIXENT Ph2)。Guttman-Yassky E 等人 JAMA Dermatol. 2020(Lebrikizumab Ph2)。Guttman-Yassky E 等人 al J All Clin Immunol。2020 年(Rinv oq Ph2)。Gooderham MJ 等人 JAMA Dermatol。2019(Cibinqo Ph2).1暴露目標基於 Ctrough 維持期間,APG777 的最低濃度與 相似 0 10 20 30 50 60 70 80 90 90 100 pbo 調整後 EASI-75 第 2 期 Pbo 調整後 EASI-75 第 3 期 DUPIXENT 300mg Q2W Lebrikizumab 250mg Q2W RINVOQ 15mg QD RINVOQ 30mg QD CIBINQO 100mg QD CIBINQO 200mg QD Biologic 注意:雖然 jAki 的療效從 Ph2 到 Ph3 一直處於停滯狀態,但由於以下原因,FDA 向該學員發出了方框警告 的風險增加心血管事件和死亡;患者必須通過 生物製劑才能獲得 jAKi JAK 抑制劑 第 2 階段目標 • 2025 年下半年 POC 讀數:與第 16 周 EASI 基線 相比的變化百分比超過 90% 才能檢測出效果 • 誘導方案比來曲單抗 暴露量高約 30% • 維護 POC C:在最初的 POC 研究中,每 3 個月或每 6 個月給藥一次,以證明 APG777 完全有可能減輕患者注射 負擔 • 2b 期劑量優化:檢查暴露量等於、低於和高於 的 方案範圍lebrikizumab 計劃在 2025 年下半年公佈第 2 階段 16 周的特應性皮炎數據 |
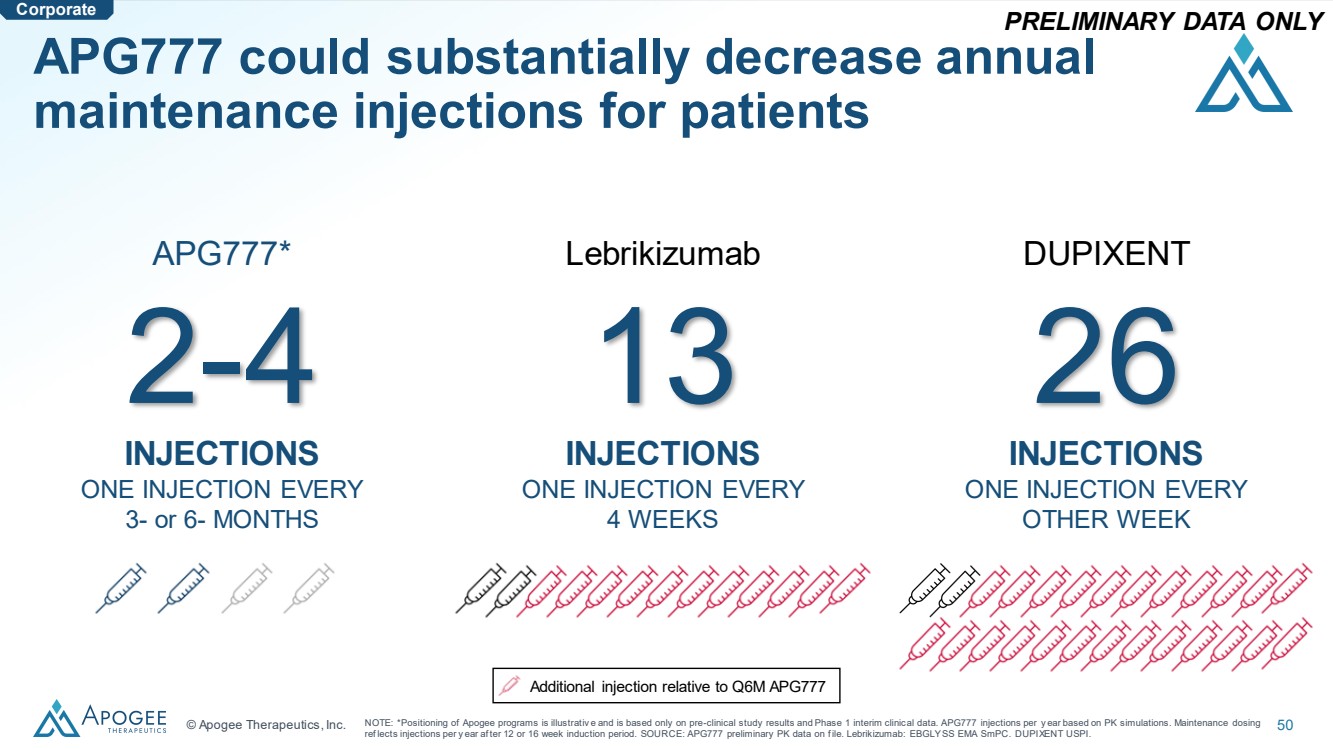
| © Apogee Therapeutics, Inc. 50 APG777 可能會大幅減少患者每年 Lebrikizumab 13 次注射 每 4 周注射一次 26 次注射 每週 一次 每週 注射一次 每隔一次 } 3 或 6 個月 注意:*Apogee 項目的定位僅供參考,僅基於臨牀前研究結果和 1 期中期臨牀數據。基於 PK 模擬,每年注射一次 APG777。維持劑量 ref 允許在 12 或 16 周的入職期之後每年注射一次。來源:f 文件中的 APG777 初步 PK 數據。Lebrikizumab:EBGLYSS EMA smPC。DUPIXENT USPI。 僅提供初步數據 與 APG777 第 6 季度相關的額外注資 |
| APG808 |
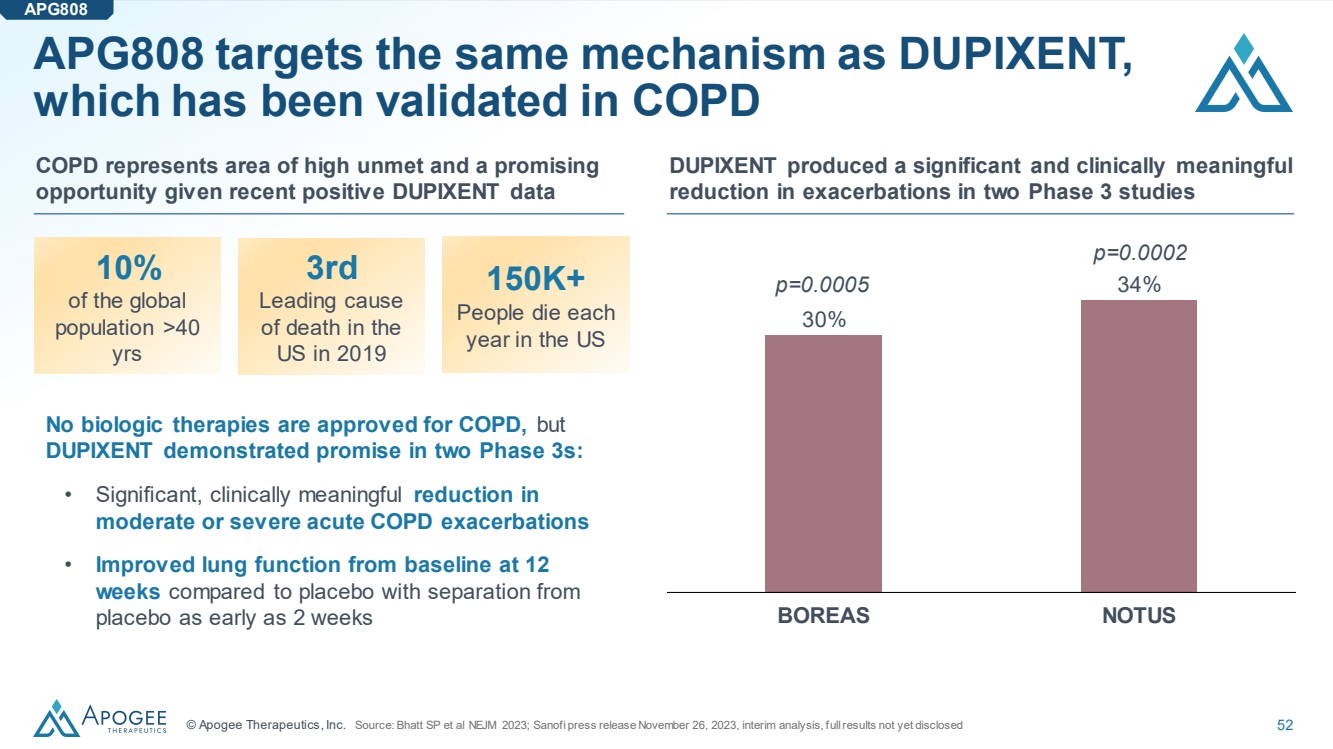
| © Apogee Therapeutics, Inc. 52 APG808 的目標機制與 DUPIXENT 相同, 已在慢性阻塞性肺病中得到驗證 是一個高未被滿足的區域,鑑於最近的 DUPIXENT 數據呈陽性 全球 人口中超過 40 歲 的 10% 人口在 2019 年美國第 3 位 死亡原因 位居第三 在美國 每年有超過 15 萬人死亡 沒有批准用於慢性阻塞性肺病的生物療法,但是 DUPIXENT 在兩個第 3 階段都顯示出希望: • 中度或重度急性慢性阻塞性肺病發作顯著減少 } • 與安慰劑相比,最早在 2 周內從 安慰劑分離後 12 周時肺功能得到改善 APG808 DUPIXENT 在兩項 3 期研究中顯著降低了惡化程度 30% 34% BOREAS NOTUS p=0.0002 p=0.0005 來源:Bhatt SP 等人 NEJM 2023;Sanjm 2023;Ofi 新聞稿 2023 年 11 月 26 日,中期分析,完整業績尚未披露 |
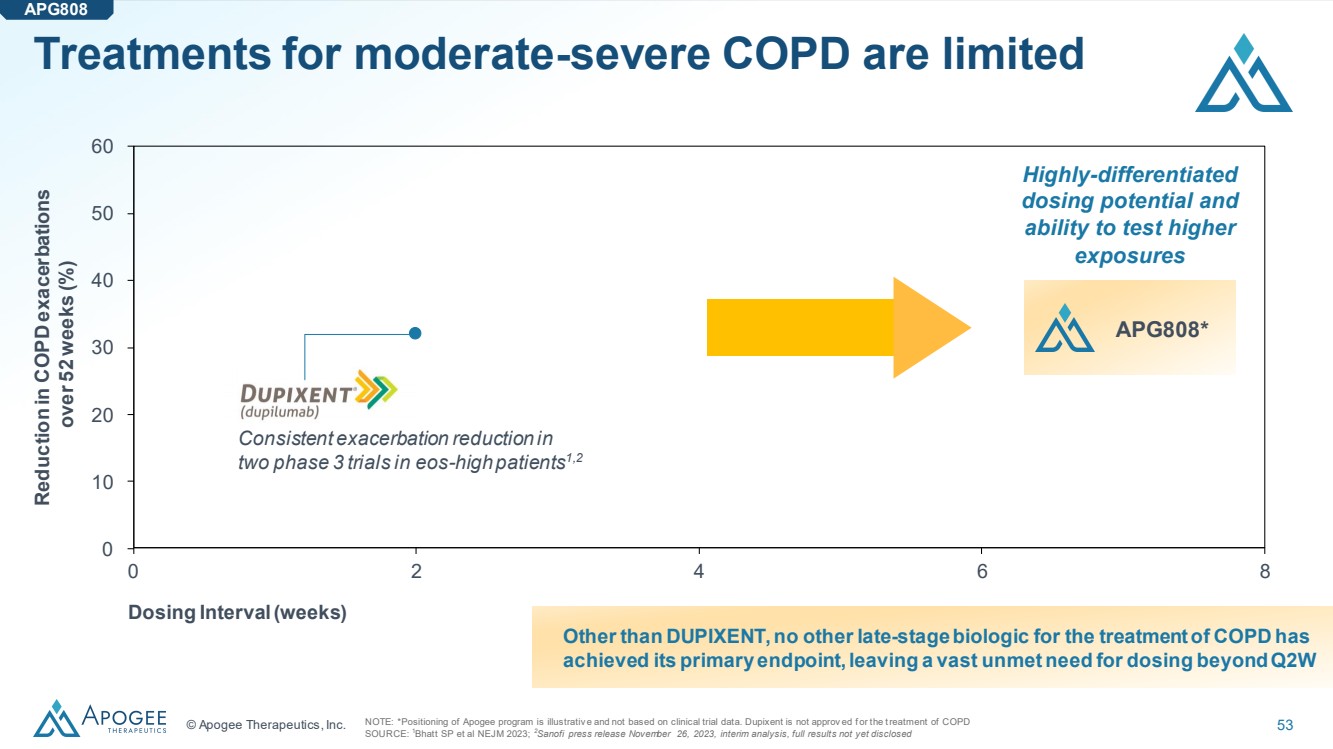
| © Apogee Therapeutics, Inc. 53 中度重度慢性阻塞性肺病的治療是有限的 注意:*Apogee 計劃的定位僅供參考,並非基於臨牀試驗數據。Dupixent 未獲批准治療慢性阻塞性肺病 來源:1Bhatt SP 等人 NEJM 2023;2賽諾菲新聞稿,2023 年 11 月 26 日,中期分析,完整結果尚未公佈 除了 DUPIXENT 之外,沒有其他用於治療慢性阻塞性肺病的後期生物製劑 達到其主要終點,第二季度以後的劑量需求仍未得到滿足 } 0 2 4 6 8 30 40 20 50 10 60 0 在 52 周內減少慢性阻塞性肺病發作 (%) 給藥間隔(周) 高度差異化的 給藥潛力和 測試更高 暴露量的能力 APG808* 一致 兩項針對 eos 高發患者 3 期試驗的惡化程度減少1,2 APG808 |
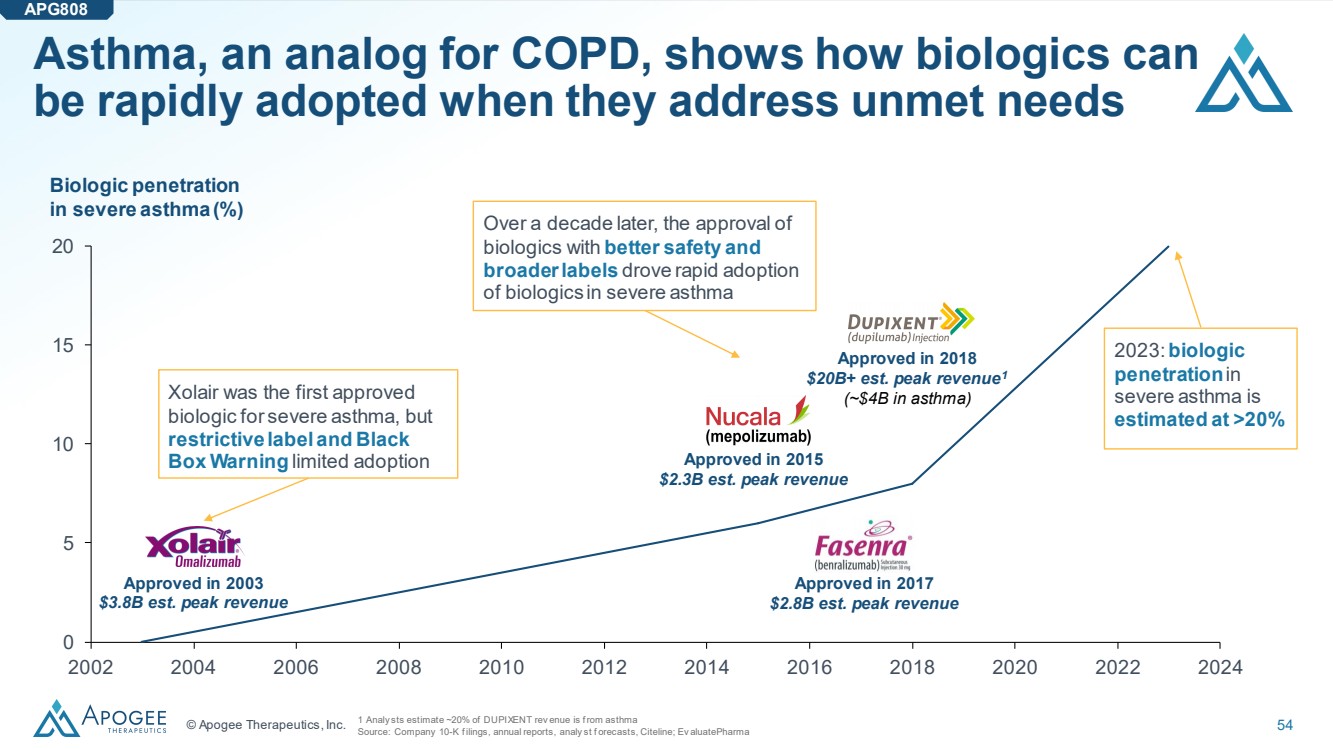
| © Apogee Therapeutics, Inc. 54 哮喘是慢性阻塞性肺病的類似物,它展示了生物製劑在滿足未滿足的需求時如何能夠迅速被採用 0 5 10 20 2002 2004 2006 2008 2012 2014 2016 2016 2018 2024 年 2024 年重度哮喘的生物滲透率 2018 年批准的預計收入超過200億美元(約40億美元)在哮喘中) 用於嚴重哮喘的生物製劑,但是 限制性標籤和黑色 方框警告限制了採用 十年後,安全性更好和 更廣泛標籤的 生物製劑的批准推動了 的迅速採用嚴重哮喘中的生物製劑 2023: 嚴重哮喘的生物學 滲透率估計在 20% 以上 1 分析師估計,大約 20% 的 DUPIXENT 註冊場所來自哮喘 來源:公司 10-K 份申報、年度報告、分析預測,Citeline;Ev AluatePharma APG808 於 2017 年獲批 28億美元。峯值收入 於 2015 年獲得批准,預計收入為 23B 美元。峯值收入 於 2003 年獲得批准,預計收入峯值為 38 億美元 |
| © Apogee Therapeutics, Inc. 55 APG808 第一階段預計將於2024年上半年啟動(提前)啟動,計劃於2024年下半年發佈 1 SAD 劑量增加最終將由SRC(科學審查委員會)根據現有數據確定。2哮喘患者研究的擴展部分的設計將最終確定。 2024 年下半年:目前的 APG808 安全性和 PK,包括可能 延長半衰期、優化暴露和低變異性 APG808 `` 單一升序劑量1 雙盲、安慰劑對照、首次人體試驗 健康 參與者的單次遞增劑量 N ~ 32 每個隊列 8 個(6:2 活性:安慰劑) 關鍵納入標準:健康成人 參與者 主要終點:安全 次要終點:PK,ADA 劑量 1 (SQ) x 1 劑量 x 1 劑 x 1 劑量 x 1 劑量 x 1 劑量 x 1 劑量 x 1 劑量 br} ` 哮喘隊列2 劑量或方案 待定 |
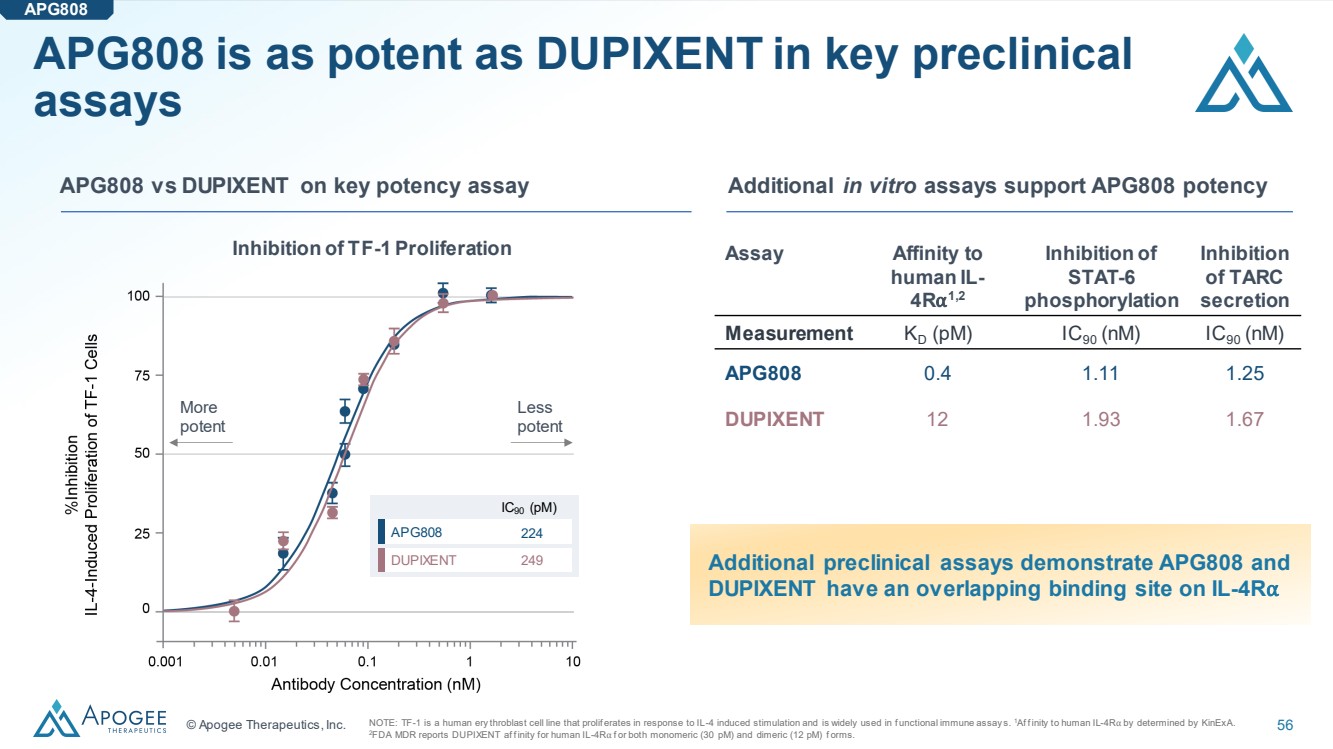
| © Apogee Therapeutics, Inc. 56 在關鍵的臨牀前 分析中,APG808 與 DUPIXENT 一樣有效 APG808 APG808 與關鍵效力測定的 DUPIXENT 其他體外分析支持 APG808 效力 測定對 人類 IL-4R{ br} 1,2 抑制 STAT-6 磷酸化 抑制 C 分泌物 測量 KD (pM) IC90 (nM) IC90 (nM) APG808 0.4 1.11 1.25 DUPIXENT 12 1.93 1.67 注意:TF-1 是一種人體凝血細胞系,會在 IL-4 誘導的刺激下產生催化反應,廣泛用於功能性免疫測定。1Af f inity由 KineXA 決定轉化為人類 IL-4R。 2FDA MDR 報告説,人類 IL-4Rf 或單體(30 pM)和二聚體(12 pM)f 形式均為 DUPIXENT af f inity。 更多 有效 效力較低 IC90 (pM) APG808 DUPIXENT 224 249 抑制 TF-1 增殖 其他臨牀前試驗表明 APG808 和 DUPIXENT 在 IL-4R上具有重疊的結合位點 |
| © Apogee Therapeutics, Inc. 57 APG808 NHP 的半衰期明顯長於 DUPIXENT 。APG808 APG808 在我們的 NHP NHP PK、SQ 管理機構的正面交鋒研究中比 DUPIXENT 更具優勢 NHP 平均半衰期1 APG808:~26 天 APG808 顯示 延長 NHP 的半衰期 br} *注意:N = 每組 5 只動物。根據 第 56 天的數據,dupilumab SQARM 開發的 5 只動物中有 3 只在第 35 天私奔了 ADAS,與 ADAS 相關的時間點不包括在半衰期 e e 估計值中。1APG808 和 dupilumab 初步 SQ根據其使用截至第56天的中期數據 對每種化合物的SQ組的累積效應,或25 mg/kg的半壽命分別為26.4天和11.5天。NHP PK研究正在進行中,最終數據預計將在第91天公佈。最終的 NHP 半衰期 e 估計值和 PK 參數將根據第 91 天發佈的完整數據集計算。 DUPIXENT 血清濃度 (µg/mL) 與 Q2W 相比,APG808 有可能達到 6 或 8- 周的劑量。• APG808 還顯示 PK 的變異性降低, 可能提高反應一致性 |
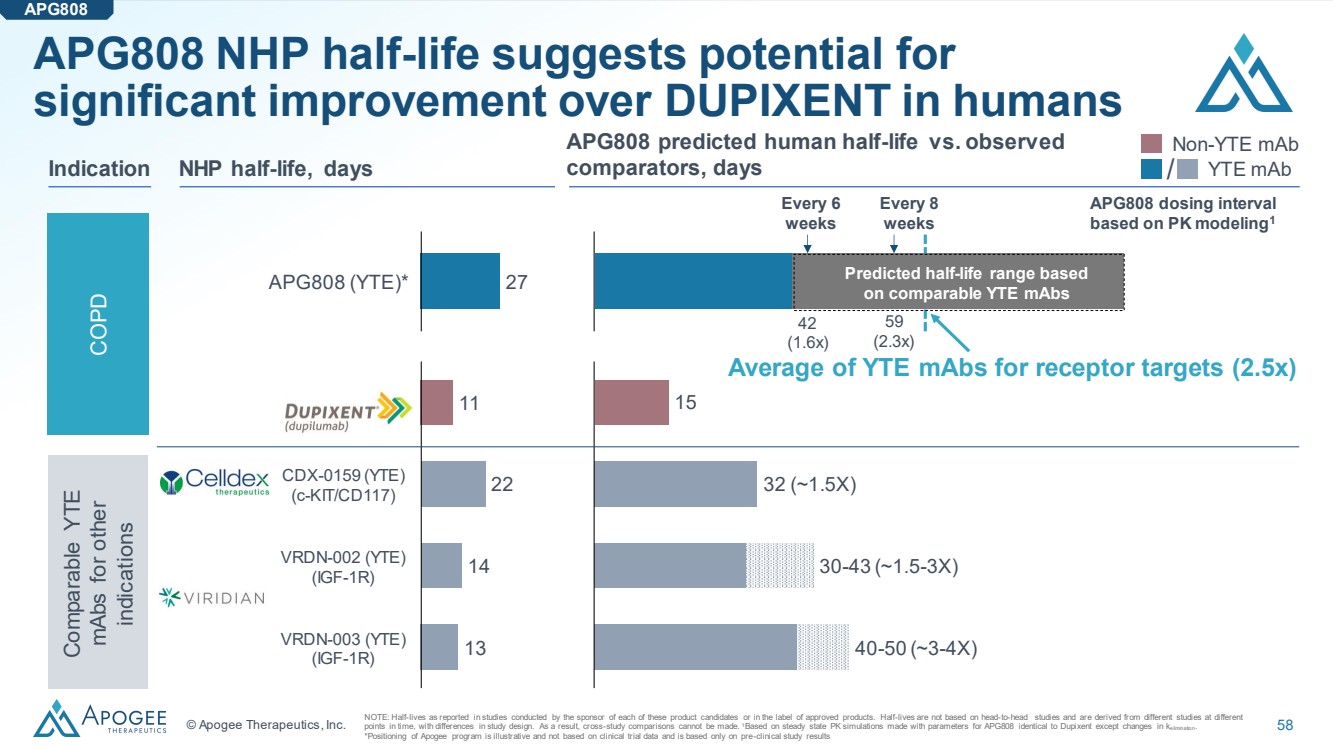
| © Apogee Therapeutics, Inc. 58 APG808 (YTE) * 27 APG808 預測的人類半衰期與觀測到的 NHP 半衰期、天數比較器、天數 22 14 13 Dupixent CDX-0159 (YTE) (YTE) (YTE) VRDN-002 (YTE) ~1.5X) 30-43 (~1.5-3X) 40-50 (~3-4X) 非 YTE mAb 適應症/YTE maB COPD 其他適應症的類似YTE mAb 的半衰期 表明 在人體中可能比 DUPIXENT 得到顯著改善 APG808 注:該贊助商開展的研究報告的半衰期 IGF-1R VRDN-003 IGF-1R APG808這些候選產品中的每一個或在批准的產品的標籤中。半衰期不是基於正面交鋒的研究,而是來自不同 時間點的不同研究,研究設計有所不同。因此,無法進行交叉研究比較。1基於穩態 PK 模擬,使用 APG808 的參數與 Dupixent 的參數相同,但排除的變化除外。 *Apogee 計劃的定位僅供參考,並非基於臨牀試驗數據,僅基於臨牀前研究結果 根據可比的 YTE mAbs 每 8 周 每 8 周 每隔 6 周 APG808 給藥間隔 基於 PK 建模1 42 (1.6x) YTE mAbs 的平均值1 42 (1.6x) 用於受體靶標的 ABS (2.5x) |
| APG990/APG222 |
| © Apogee Therapeutics, Inc. 60 APG990 可阻斷 OX40L,並有可能重新平衡 OX40L 阻斷靶向 Th2、Th17 和 Th22 通路,這些途徑與許多 I&I 疾病有關 即將發佈的臨牀試驗結果可能為 AD 以外的 OX40L 提供概念驗證,包括哮喘、化膿性汗腺炎、 脱髮、乳糜瀉和系統性硬化 APG990 |
| © Apogee Therapeutics, Inc. 61 OX40L 和 OX40 抑制劑顯示出相似的 療效,但是 OX40L 在安全性方面具有明顯的優勢 22 17 第 16 周的 IGA 0/1 反應 Amlitelimab (OX40L) 1 Rocatinlimab (OX40) 2 40 42 EASI-75 APG990 • 在第 2b 階段, rocatinlimab (OX40) 是 } 與發熱 (17% 的患者)和 寒戰(11% 的患者)有關 • 相比之下,在 2b 期 中,amlitelimab (OX40L) 沒有發熱 3 或發冷 來源:1Amelitelimab 250mg Q4W Weidinger 等人EADV 口頭陳述(2023 年)。2Rocatinlimab av g. 含有 150 毫克 Q4W 和 600 毫克 Q4W Guttman-Yassky E 等人《柳葉刀》(2023)。3EADV的演講顯示, “在注射後的72小時內” 沒有py rexia。 注意:Eff icacy 數據源自不同時間點的不同臨牀試驗,試驗設計和患者羣體存在差異。因此,無法進行跨試驗比較,也沒有進行過 頭對頭臨牀試驗。 |
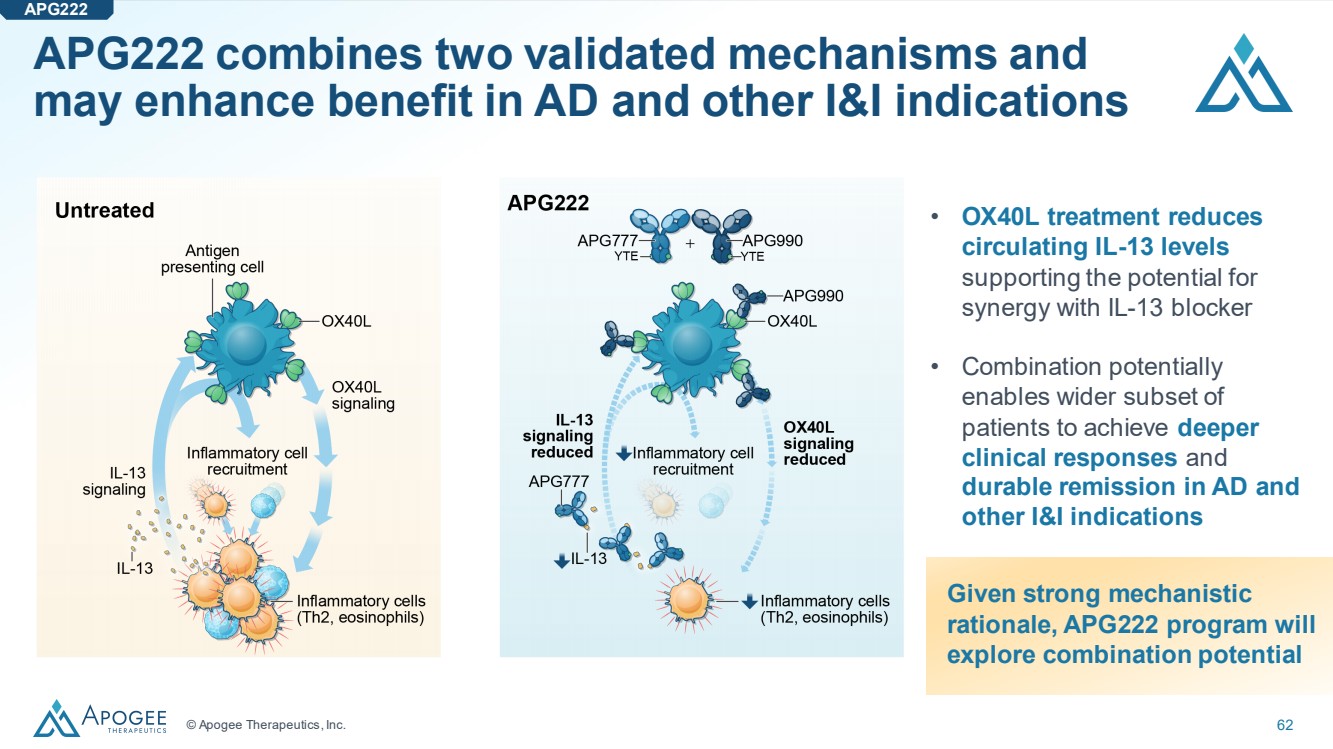
| © Apogee Therapeutics, Inc. 62 • OX40L treatment reduces circulating IL-13 levels supporting the potential for synergy with IL-13 blocker • Combination potentially enables wider subset of patients to achieve deeper clinical responses and durable remission in AD and other I&I indications Given strong mechanistic rationale, APG222 program will explore combination potential APG222 combines two validated mechanisms and may enhance benefit in AD and other I&I indications APG222 |
| Corporate |
| © Apogee Therapeutics, Inc. 64 Michael Henderson, MD Chief Executive Officer, Director Carl Dambkowski, MD Chief Medical Officer Jane Pritchett Henderson Chief Financial Officer Rebecca Dabora, PhD Chief Technical Officer Matt Batters, JD General Counsel Wendy Aspden-Curran SVP of Clinical Operations Drew Badger, PhD SVP of Regulatory Affairs & Toxicology Dan Mulreany SVP of Business Development & Strategy Kristine Nograles, MD, MSc SVP of Clinical Development Corporate Experienced team with proven history of clinical development and commercial execution |
| © Apogee Therapeutics, Inc. 65 Michael Henderson, MD CEO, Apogee Therapeutics BJ Jones CCO, NewAmsterdam Pharma Mark McKenna Chairman Peter Harwin Managing Member, Fairmount Jennifer Fox CFO & CBO, Zenas BioPharma Andrew Gottesdiener, MD Venrock Tomas Kiselak Managing Member, Fairmount Nimish Shah Venrock Corporate Board of Directors with industry-leading development, commercial and management expertise |
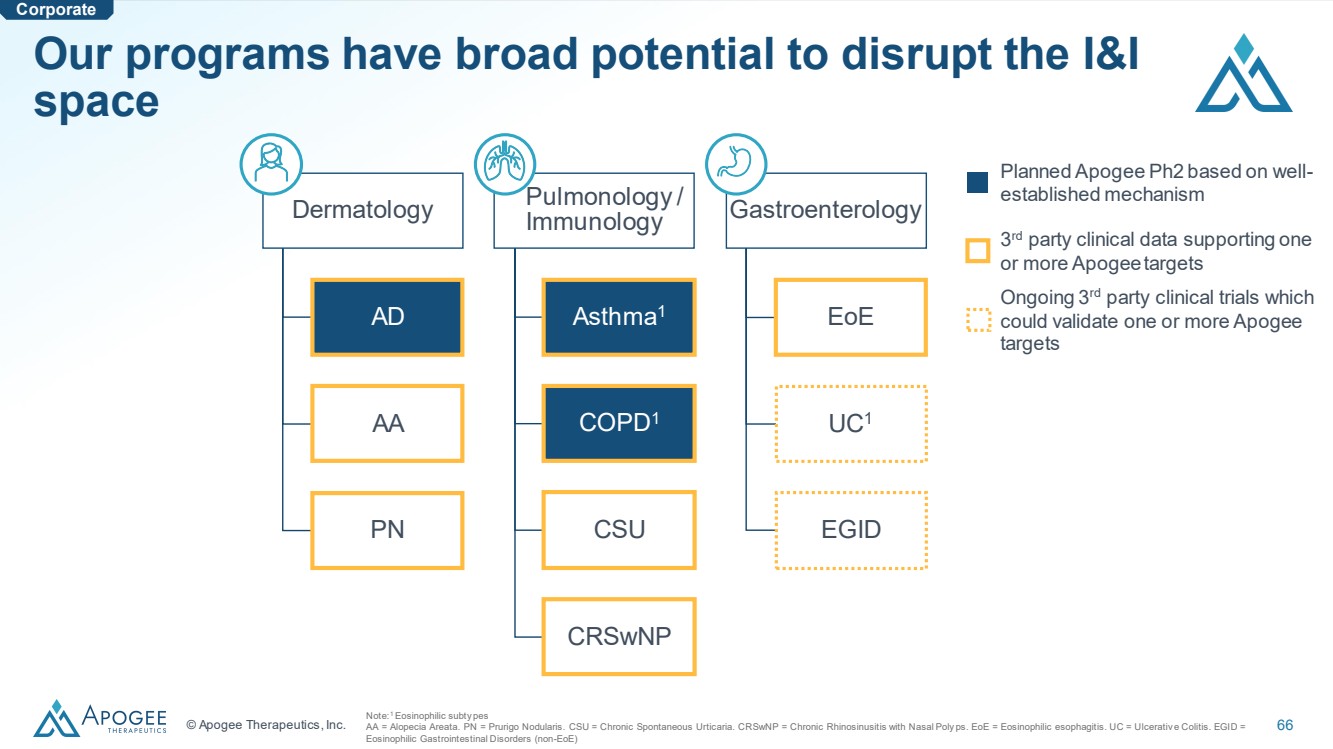
| © Apogee Therapeutics, Inc. 66 Dermatology AD AA PN Pulmonology / Immunology Asthma1 COPD1 CSU CRSwNP Gastroenterology EoE UC1 EGID Planned Apogee Ph2 based on well-established mechanism 3 rd party clinical data supporting one or more Apogee targets Ongoing 3rd party clinical trials which could validate one or more Apogee targets Note:1 Eosinophilic subty pes AA = Alopecia Areata. PN = Prurigo Nodularis. CSU = Chronic Spontaneous Urticaria. CRSwNP = Chronic Rhinosinusitis with Nasal Poly ps. EoE = Eosinophilic esophagitis. UC = Ulcerativ e Colitis. EGID = Eosinophilic Gastrointestinal Disorders (non-EoE) Corporate Our programs have broad potential to disrupt the I&I space |
| Apogee /ˈapəjē/ noun The highest point in the development of something; a climax or culmination |