

附錄 99.2 VTX002 2 期潰瘍性結腸炎結果 2023 年 10 月 9 日 1

前瞻性陳述 Ventyx Biosciences, Inc. (“Ventyx” 或 “公司”)提醒您,本演示文稿中有關非歷史事實事項的陳述均為前瞻性陳述。這些陳述基於公司當前 的信念和期望。此類前瞻性陳述包括但不限於以下方面的陳述:Ventyx 候選產品的潛力和這些 候選產品的開發渠道的預期持續進展;以及 VTX002 在潰瘍性結腸炎中的治療和商業潛力。Ventyx不應將納入前瞻性陳述視為其任何計劃都將實現的陳述。由於 Ventyx 業務固有的風險和不確定性,實際結果 可能與本演示文稿中列出的結果有所不同,包括但不限於:臨牀試驗的開始、註冊和完成可能出現延遲; Ventyx 在產品製造、研究、臨牀前和臨牀測試方面對第三方的依賴;供應鏈中斷,包括製造所需原材料和研究中使用的動物; 延遲臨牀試驗的場地激活和註冊;結果的臨牀前研究;早期臨牀試驗不一定能預測未來的結果;中期結果不一定能預測最終結果;隨着試驗的繼續、更多的患者數據的可用以及更全面的審計和驗證程序, 一個或多個結果可能會發生實質性變化;美國和國外 國家的監管發展;Ventyx候選產品的意外不良副作用或療效不足,可能會限制其開發、監管批准和/或商業化,或可能導致召回或產品責任索賠; Ventyx獲得和維持其候選產品的知識產權保護的能力;Ventyx比預期更快地使用資本資源;烏克蘭持續的軍事衝突導致Ventyx的運營中斷,包括臨牀試驗的延遲;以及Ventyx先前的新聞稿和Ventyx向美國證券交易委員會提交的文件中描述的其他風險 (SEC),包括在 Ventyx 的 季度報告的第二部分第 1A 項(風險因素)中截至2023年6月30日的季度期限的10-Q表格,於2023年8月10日提交,以及隨後向美國證券交易委員會提交的任何文件。提醒您不要過分依賴這些前瞻性陳述,這些陳述僅代表截至本文發佈之日,Ventyx沒有義務更新此類陳述以反映在本聲明發布之日之後發生的事件或存在的情況。所有前瞻性陳述均受這份警告 聲明的全部限制,該聲明是根據1995年《私人證券訴訟改革法》的安全港條款作出的。本演示文稿包括我們從行業出版物和研究、第三方進行的 調查和研究中獲得的統計數據和其他行業和市場數據,以及我們自己對潛在市場機會的估計。行業出版物和第三方研究、調查和研究通常表明,他們的信息是從被認為可靠的 來源獲得的,儘管它們不能保證此類信息的準確性或完整性。我們對產品潛在市場機會的估計包括基於我們的行業知識、 行業出版物、第三方研究和其他調查的幾個關鍵假設,這些假設可能基於少量樣本,可能無法準確反映市場機會。雖然我們認為我們的內部假設是可靠的,但此類假設並未得到任何第三方的驗證。由於各種重要因素,我們經營的行業面臨高度的不確定性和風險,這些因素可能導致結果與 第三方和我們的估計結果存在重大差異。本演示文稿中的商標是其各自所有者的財產,僅用於信息和教育目的。2

簡介 Raju Mohan,博士,創始人兼首席執行官 3

VTX002 第二階段潰瘍性結腸炎結果演講者和參與者 Ventyx 管理團隊特邀發言人兼關鍵人物 Martin Auster,醫學博士 Chris Krueger,JD Raju Mohan,博士 William Sandborn,醫學博士首席執行官、總裁兼首席醫學官 胃腸病學創始人兼董事西奈山衞生系統首席執行官桑茲博士是該試驗的主要研究員和帶薪顧問適用於擁有公司股票和股票期權的 Ventyx Biosciences, Inc.

VTX002 第 2 期潰瘍性結腸炎結果 William Sandborn,醫學博士 總裁兼首席營銷官 5

內容提要-潰瘍性結腸炎數據的 2 期試驗確立 VTX002 作為潛在的病中最佳口服藥物 Ø 潛在的病中最佳口服療效和安全性:§ 在嚴格和客觀的結果指標上具有高度差異化的療效 § 前所未有的完全內窺鏡緩解率 § 實現內窺鏡緩解/正常化是重中之重 § 卓越的安全性:§ 無房室傳導阻滯或心動過速 § 無嚴重或 機會性感染 § 否黃斑水腫 Ø 第 2 期數據支持 VTX002 在潰瘍性結腸炎中的進一步發展 6

VTX002 II 期 UC 試驗設計概述關鍵資格標準: 終點:• 中度至重度活性 UC 患者,定義為 • 主要終點:第 13 周臨牀緩解,定義為修改後的 Mayo 評分的改性(3 組分)梅奧分數 • 反應不足、反應喪失和/或不耐受 • 關鍵次要終點:內窺鏡改善;傳統或晚期療法症狀緩解;組織學緩解;內窺鏡改善組織學緩解主要終點基準第 52 周第 13 周 R VTX00260 mg VTX002 60 mg 患者隨機分配中度至 VTX002 30 mg VTX002 30 mg 1:1:1 重度 UC(N=213)安慰劑無反應的患者 NR *開放標籤延期 — VTX002 60 mg 至約 2 年注意: NCT05156125。彩信:修改後的梅奧分數;R:回覆者;NR:無回覆者。7

受試者傾向:試驗完成率高 (N=213) * 安慰劑 (N=70) VTX002 30 mg (N=73) VTX002 60 mg (N=70) 停藥停止治療停止治療 (N=3,4.3%) (N=3,4.1%) (N=4;5.7%) 主要原因:主要原因:疾病惡化 (n=1) 疾病 惡化 (n=1) 疾病惡化 (n=1) 不良事件 (n=2) 撤回同意 (n=1) 不合規 (n=1) 不良事件 (n=1) 調查人員決定 (n=1) 不合規 (n=1) 不合規 (n=1) 已完成 (N=66,94.3%) 已完成 (N=67,94.9%)95.7%) *協議最初允許基線 MMS 為 4 到 9 的參與者。隨後對納入標準進行了修訂,允許基準MMS為5至9。對四名基線 MMS 為 4 的參與者進行了隨機分組和治療。 將這些參與者排除在主要療效分析集合中,但包含在安全性分析集合中。彩信:修改了 8 梅奧分數。ES:梅奧內窺鏡分數。RB:梅奧直腸出血分數。
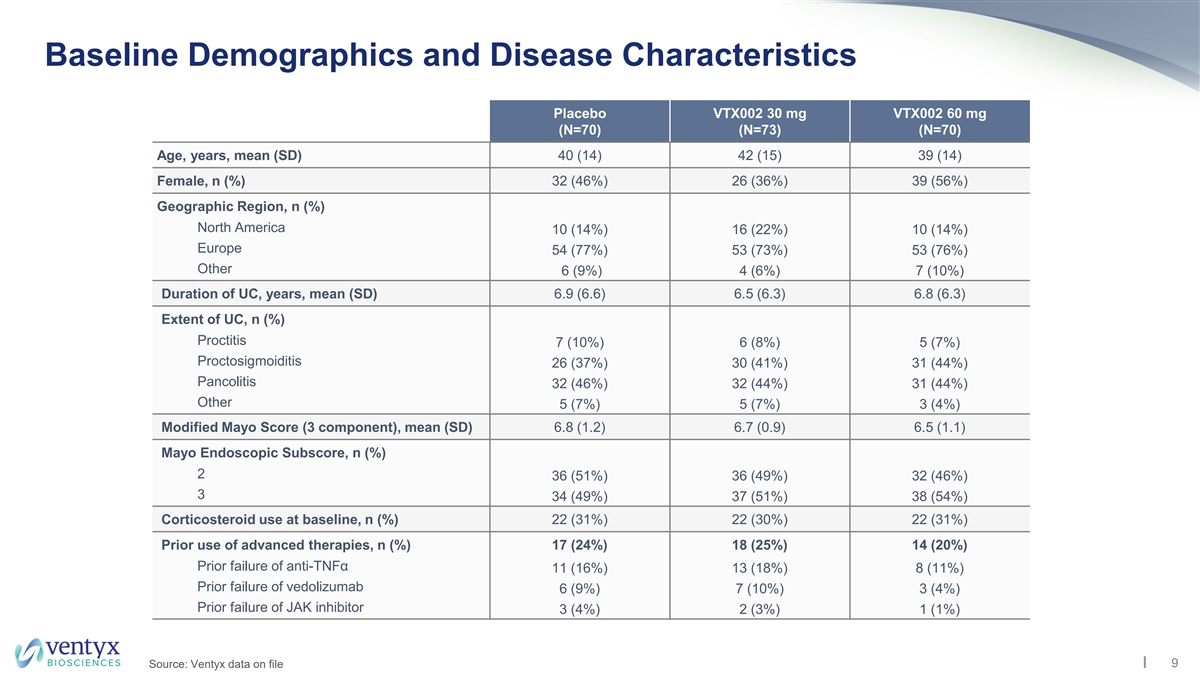
基線人口統計學和疾病特徵安慰劑 VTX002 30 mg VTX002 60 mg (N=70) (N=70) (N=70) 年齡、年齡、平均值 (SD) 40 (14) 42 (15) 39 (14) 女,n (%) 32 (46%) 26 (36%) 39 (56%) 地理區域,n (%) 北美 10 (14%) 16 (22%) 10 (14%) 10 (14%) 10 (14%)) 歐洲 54 (77%) 53 (73%) 53 (76%) 其他 6 (9%) 4 (6%) 7 (10%) UC 持續時間,年份,平均值 (SD) 6.9 (6.6) 6.5 (6.3) UC 的程度,n (%) 直腸炎 7 (10%) 6 (8%) 5 (7%) 26 (37%) 30 (41%)) 31 (44%) Pancolitis 32 (46%) 32 (44%) 31 (44%) 其他 5 (7%) 5 (7%) 5 (7%) 3 (4%) 修改後的梅奧分數(3 個成分),平均值(SD)6.8(1.2)6.7(0.9)6.5(1.1)梅奧內窺鏡分數,n(%)2 36(51%)36(49%)32(46%)3 34(49%)37(51%)38(54%)基線使用皮質類固醇,n(%)22(30%)22(30%)22(31%)先前使用過高級皮質類固醇療法,n (%) 17 (24%) 18 (25%) 14 (20%) 先前抗腫瘤壞死因子α失敗 11 (16%) 13 (18%) 8 (11%) vedolizumab 6 (9%) 7 (10%) 3 (4%) 3 (4%) 3 (4%) 先前失敗 JAK 抑制劑 3 (4%) 2 (3%) 1 (1%) 9 來源:存檔的 Ventyx 數據
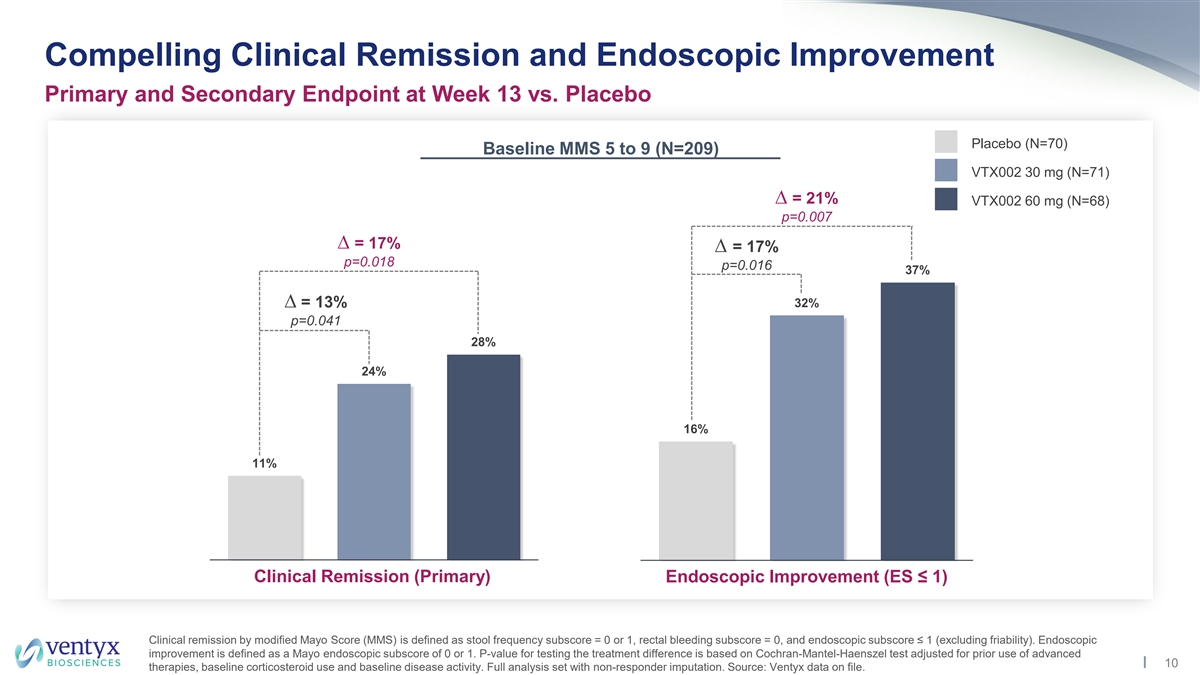
與安慰劑安慰劑(N=70)基線 MMS 5 至 9(N = 209)第 13 周的臨牀緩解和內窺鏡改善主要和 次要終點相比,MMS 5 至 9(N = 209)VTX002 30 mg(N=71)= 21% VTX002 60 mg(N=68)p=0.007 = 17% p=0.018 p=0.016 37% = 13% 32% p=0.041 28% 24% 16% 11% 安慰劑 VTX002 VTX002 安慰劑 VTX002 VTX002 臨牀緩解(主要)內窺鏡改善(ES ≤ 1)30mg 60mg 30mg 60mg 60mg 根據修改後的梅奧評分(MMS)進行臨牀緩解定義為糞便頻率分數 = 0 或 1,直腸出血分數 = 0, 和內窺鏡亞分數 ≤ 1(不包括脆弱性)。內窺鏡改善的定義是 Mayo 內窺鏡分數為 0 或 1。測試治療差異的P值基於Cochran-Mantel-Haenszel測試,該測試根據先前使用的 高級10種療法、基線皮質類固醇使用情況和基線疾病活動進行了調整。包含非響應者歸因的完整分析集。來源:存檔的 Ventyx 數據。

與安慰劑安慰劑(N=70)基線 MMS 5 至 9(N = 209)相比,第 13 周完全內窺鏡緩解次要終點 的比率 前所未有的 VTX002 30 mg(N = 71)VTX002 60 mg(N=68)= 22% = 16% p=0.001 p=0.007 = 14% 29% = 10% p=0.014 p=0.046 22% 21% 16% 7% VTX002 VTX002 安慰劑 VTX002 VTX002 內窺鏡緩解(ES=0)內窺鏡和臨牀緩解 30mg 60mg 30mg 60mg 60mg 根據修改後的梅奧評分(MMS)進行的臨牀緩解定義為糞便頻率分數 = 0 或 1,直腸出血分數 = 0,內窺鏡亞分數 ≤ 1(不包括易碎性)。內窺鏡緩解的定義為梅奧內窺鏡分數為 0。測試治療差異的P值基於Cochran-Mantel-Haenszel測試,該測試根據先前使用過的先進療法、11個基線 皮質類固醇的使用情況和基線疾病活動進行了調整。包含非響應者歸因的完整分析集。來源:存檔的 Ventyx 數據。
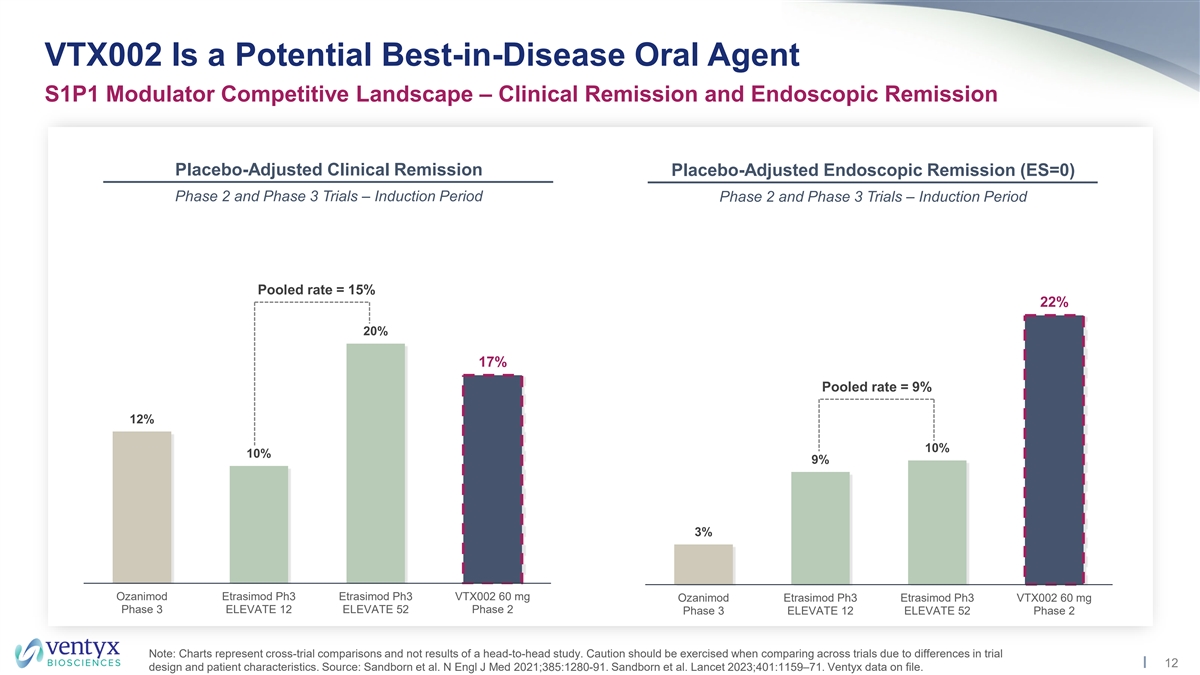
VTX002 是潛在的病中最佳口服藥物 S1P1 調節劑 競爭格局 — 臨牀緩解和內窺鏡緩解安慰劑調整後的臨牀緩解安慰劑調整內窺鏡緩解期 (ES=0) 2 期和 3 期試驗 — 誘導期 2 期和 3 期試驗 — 誘導期合併率 = 15% 22% 20% 17% 合併率 = 9% 12% 10% 9% 3% Ozanimod Etramod Etramod Etramod Etramod Etramod Etramod Etramod Etramod Etramod Etramod Etramod Etrasimod ph3 ELEVATE Ph3 VTX002 60 mg Ozanimod Etrasimod ph3 Etrasimod ph3 VTX002 60 mg 第 3 期 ELEVATE 12 ELEVATE 52 第 2 階段 3 ELEVATE 12 ELEVATE 52 第 2 階段注意:圖表代表跨試驗比較,而不是正面交鋒研究的結果。由於試驗 12 的設計和患者特徵的差異,在比較各項試驗時應謹慎行事。資料來源:桑德伯恩等人。N Engl J Med 2021; 385:1280-91。桑德伯恩等人《柳葉刀》2023; 401:1159 —71。Ventyx 數據已存檔。

競爭激烈的臨牀緩解率競爭格局 — 絕對和安慰劑調整後的臨牀緩解臨牀緩解(三組分梅奧評分)* 2 期和第 3 期試驗 — 誘導期 33% 28% 27% 26% 25% 23% 10% 18% 18% 17% 29% 17% 17% 17% 15% 15% 12% 12% 11% 8% 7% 5% 4% 2% 2% O Tremfya PRA023 Xeljanz Xeljanz Rinvoq Rinvoq Ozanimod Etrasimod ph3 Etrasimod ph3 VTX002 60 mg 第 3 階段 3 期 UC-1 第 3 階段 UC-2 第 3 階段 UC-1 第 3 階段 UC-2 第 3 階段 ELEVATE 12 ELEVATE 52 第 2 階段 α4β7 IL-23 p19TL1A S1P1 jAki *Entyvio 臨牀緩解以 4 組分梅奧評分為基礎;所有其他分量使用 3 組分梅奧分數。注意:圖表代表跨試驗比較,而不是正面交鋒研究的結果。由於試驗設計和患者特徵的差異,在比較不同試驗時應謹慎 。資料來源:丹尼斯等人。《柳葉刀》2022年;399:2113 —28。Feagan 等人N Engl J Med 2013;369:699-710。桑德伯恩等人N Engl J Med 2017;376:1723-36。桑德伯恩等人N Engl J Med 2021;385:1280-91。13 Sandborn 等人。《柳葉刀》2023; 401:1159 —71。PRA023:Danese 等人(ECCO 2023)。Tremfya:JNJ Ph3 頭條新聞稿。Ventyx 數據已存檔。
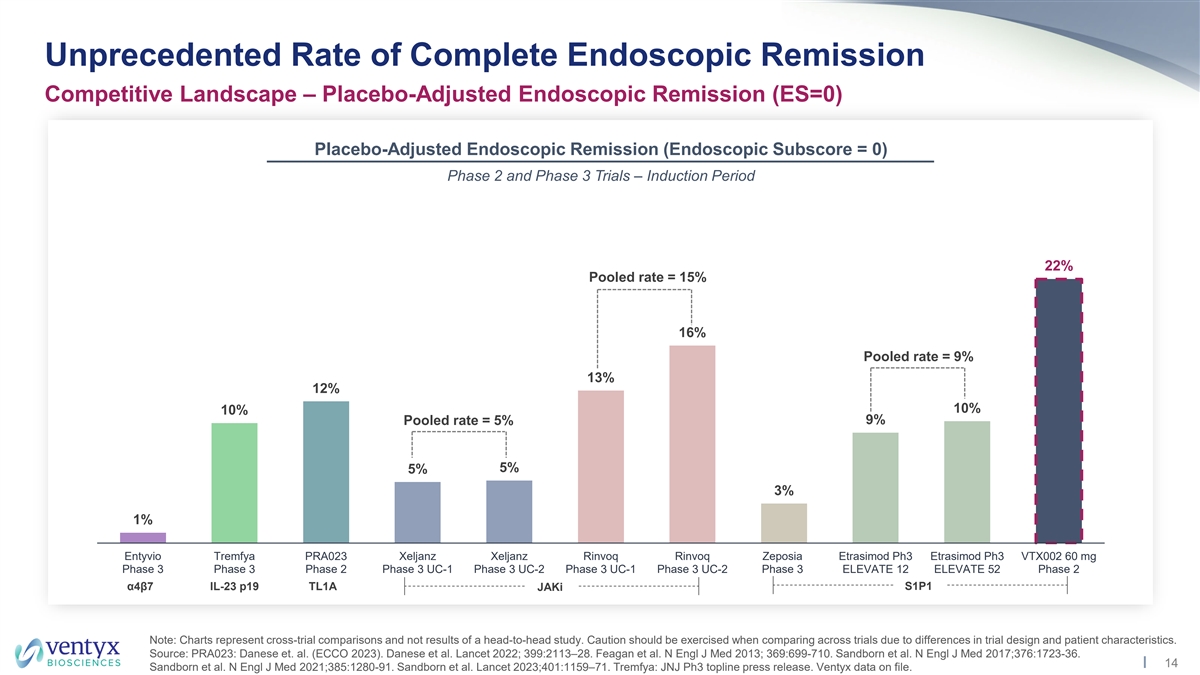
前所未有的完全內窺鏡緩解率競爭力 格局 — 安慰劑調整後的內窺鏡緩解率(ES=0)安慰劑調整後的內窺鏡緩解率(內窺鏡分數 = 0)2 期和第 3 期試驗 — 引導期 22% 合併率 = 15% 16% 合併率 = 9% z 13% 12% 10% 10% 合併 率 = 5% 9% 5% 3% 1% Entyvio Tremfya PRA023 JANZ Xeljanz Rinvoq Rinvoq Zeposia Etrasimod ph3 Etrasimod ph3 VTX002 60 mg 第 3 階段 3 期 UC-1 第 3 階段 UC-2 第 3 階段 UC-1 第 3 階段 UC-2 第 3 階段 UC-2 第 3 階段 ELEVATE 12 ELEVATE 52 第 2 階段 α4β7 IL-23 p19 TL1A S1P1jAki 注意:圖表代表跨試驗比較,而不是正面交鋒研究的結果。由於試驗設計和患者特徵的差異,在比較試驗時應謹慎行事。 來源:PRA023:Danese 等人(ECCO 2023)。丹尼斯等人《柳葉刀》2022年;399:2113 —28。Feagan 等人N Engl J Med 2013;369:699-710。桑德伯恩等人N Engl J Med 2017;376:1723-36。14 Sandborn 等人N Engl J Med 2021; 385:1280-91。桑德伯恩等人 《柳葉刀》2023;401:1159 —71。Tremfya:JNJ Ph3 頭條新聞稿。Ventyx 數據已存檔。
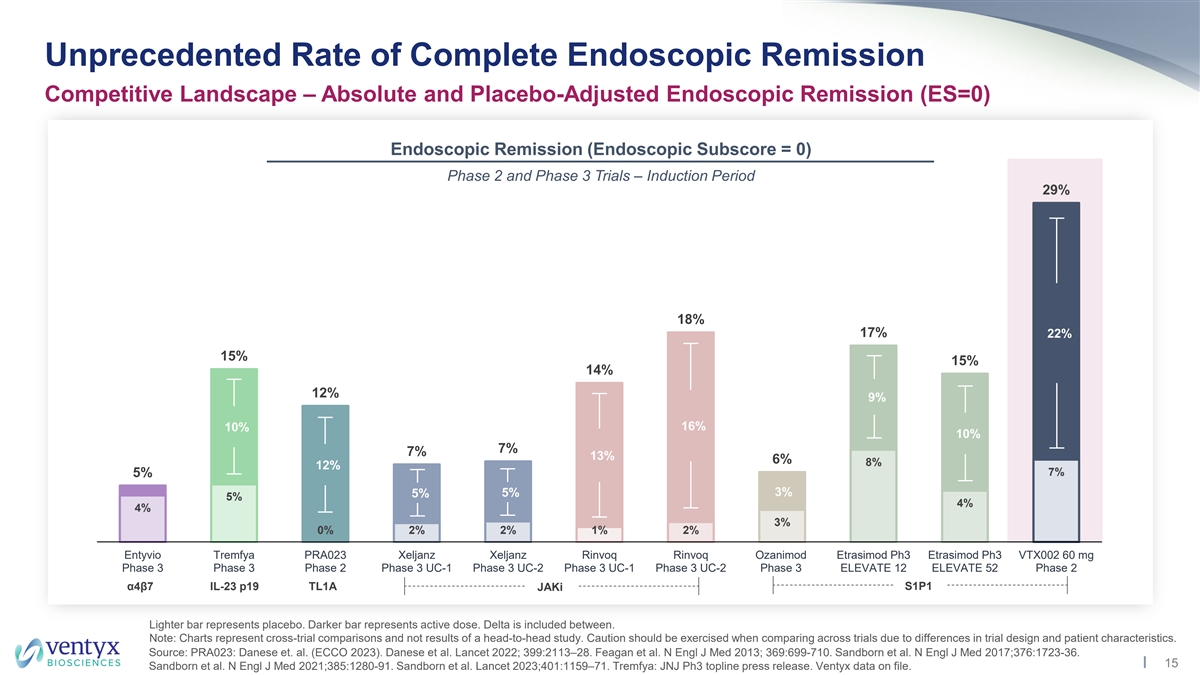
前所未有的完全內窺鏡緩解率 格局——絕對和安慰劑調整後的內窺鏡緩解率(ES=0)內窺鏡緩解率(內窺鏡分數= 0)2期和3期試驗 — 引導期 29% 18% 17% 22% 27% 15% 15% 15% z 14% 22% 22% 12% 12% 9% 10% 7% 7% 13% 12% 7% 7% 7% 8% 5% 5% 4% 3% 0% 2% 2% 1% 2% Entyvio Tremfya PRA023 Xeljanz Xeljanz Rinvoq Rinvoq Rinvoq Ozanimod Etrasimod ph3 VTX002 60 mg 第 3 階段 3 期 UC-1 第 3 階段 UC-2 第 3 階段 ELEVATE 12 ELEVATE 52第 2 階段 α4β7 IL-23 p19 TL1A S1P1 jAki Lighter 棒代表安慰劑。較暗的條表示活性劑量。介於兩者之間包括三角洲。注意:圖表代表跨試驗比較,而不是正面交鋒研究的結果。由於試驗設計和患者特徵的差異,在比較不同試驗時應謹慎 。資料來源:PRA023:Danese 等人。(ECCO 2023)。丹尼斯等人《柳葉刀》2022年;399:2113 —28。Feagan 等人N Engl J Med 2013;369:699-710。 桑德伯恩等人N Engl J Med 2017;376:1723-36。15 Sandborn 等人N Engl J Med 2021; 385:1280-91。桑德伯恩等人《柳葉刀》2023; 401:1159 —71。Tremfya:JNJ Ph3 頭條新聞稿。Ventyx 數據已存檔。

藥效學效應與劑量反應相一致絕對 淋巴細胞數 (ALC) 與基線相比變化百分比 VTX002 30mg VTX002 60mg (N=71) (N=68) 0% • 觀察到絕對淋巴細胞數 (ALC) 快速、穩健且劑量依賴性 -10% 的絕對淋巴細胞計數 (ALC) 減少了 -20% -30% • VTX002 60 mg 與前代相比實現了 差異化藥效應 -40% UC 中的 50% -55% -56% S1P1 受體調節劑 -64% -60% • 對嚴格的 -70% -67% -67% -67% -68% 臨牀結果有明確的劑量反應支持 ALC -80% 以上的增量降低 -68% 的益處依曲西莫德和奧扎尼莫德達到的約 50% 水平 -90% -100% 基準第 1 周第 4 周第 8 周第 13 周第 16 周來源:存檔的 Ventyx 數據。依曲莫德和奧扎尼莫德淋巴細胞數據分別來自加州大學的2期和3期試驗。 絕對淋巴細胞數 (ALC) 與基線相比的百分比變化,平均值

VTX002 安全且耐受性良好 第 13 周安慰劑 VTX002 30 mg VTX002 60 mg 治療緊急不良事件 (N=70) (N=70) (N=70) (N=70) 受試者有任何不良事件,n (%) 24 (34%) 34 (47%) 33 (47%) 與研究藥物相關的不良事件,n (%) 3 (4%) 7 (10%) 11 (16%) 不良事件事件 導致研究藥物停藥,n (%) * 0 1 (1%) 2 (4%) † 任何嚴重不良事件 (SAE),n (%) 0 2 (3%) 3 (4%) SAE 與研究藥物有關,n (%) 0 0 0 死亡 0 0 0 *AE 導致停藥的受試者:食慾下降和 疲勞 (2 級,30 mg,與研究藥物無關);頭痛(2 級,60 mg);UC 惡化(3 級,60 mg,無關)。† SAE 受試者:直腸出血(3 級,30 mg,無關)、膽囊炎(3 級,30 mg,無關)、 肺水腫(3 級,60 mg,無關——高血壓和糖尿病患者、肺部疾病利尿療法可緩解水腫);潰瘍性結腸炎(3 級,60 mg,無關緊要);貧血(3 級,60 mg,無關聯)17 來源: 文件上的 Ventyx 數據
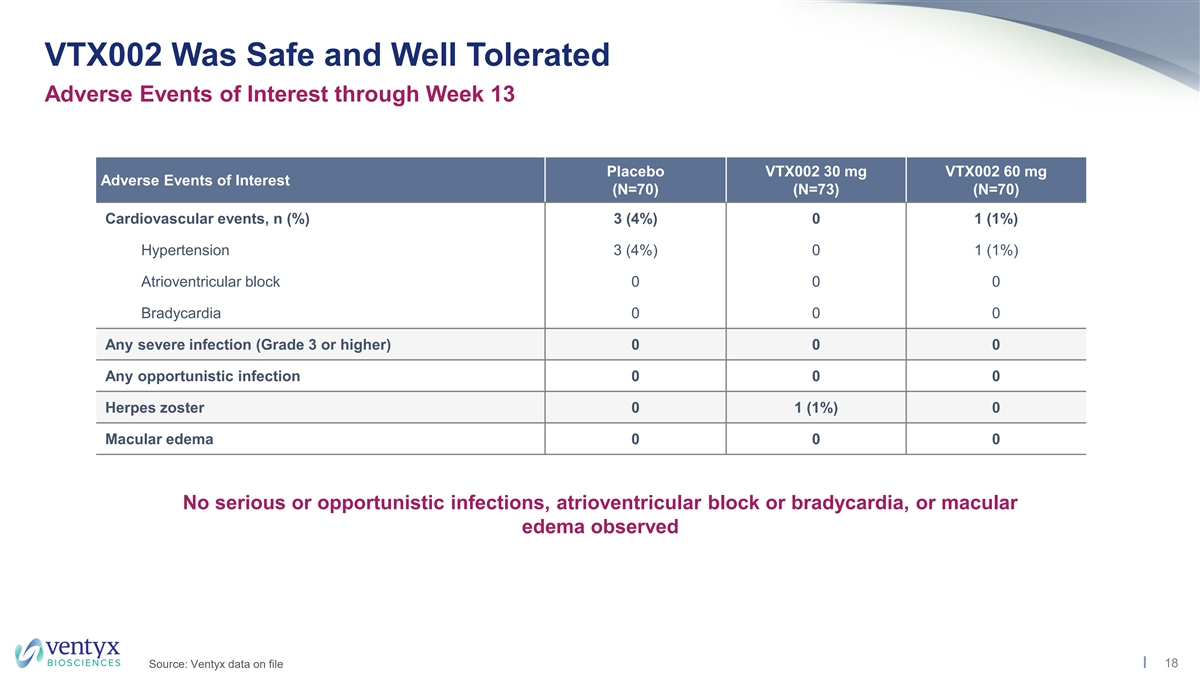
VTX002 通過 第 13 周安慰劑 VTX002 30 mg VTX002 60 mg 關注的不良事件 (N=70) (N=70) (N=70) (N=70) (N=70) 心血管事件,n (%) 3 (4%) 0 1 (1%) 高血壓 3 (4%) 0 1 (1%) 房室傳導阻滯 0 0 0 0 任何嚴重感染(3 級或 更高) 0 0 0 任何機會性感染 0 0 0 帶狀皰疹 0 1 (1%) 0 黃斑水腫 0 0 0 未觀察到嚴重或機會性感染、房室傳導阻滯或心動過緩或黃斑水腫 18 來源:存檔的 Ventyx 數據

潰瘍性結腸炎 2 期臨牀試驗的結論 2 期數據 將 VTX002 確立為潛在的病中最佳口服藥物 Ø 潛在的病中最佳口服療效和安全性:§ 在嚴格和客觀的結果指標上具有高度差異化的療效 § 令人信服的臨牀緩解率 § 前所未有的完全內窺鏡緩解率 § 實現內窺鏡緩解/正常化是重中之重 § 卓越的安全性:§ 無房室傳導阻滯或心動過緩 § 沒有 嚴重或機會性感染 §無黃斑水腫 Ø 第 2 期數據支持 VTX002 在潰瘍性結腸炎中的進一步發展 19

問答環節 Ventyx 管理團隊和客座關鍵人物布魯斯·桑茲,醫學博士 西奈山衞生系統胃腸病學負責人