

2024 年 3 月 GAD 投資者演示文稿附錄 99.2 MM120

免責聲明本演示文稿(“演示文稿”)由 Mind Medicine (MindMed) Inc.(“MindMed”、“公司”、“我們”、“我們的” 或 “我們”)編寫,僅供參考。MindMed、其關聯公司或其各自的員工、 董事、高級職員、承包商、顧問、成員、繼任者、代表或代理均不對本演示文稿中包含的任何信息的準確性或完整性作出任何陳述或保證,也不對本演示文稿中包含的任何 陳述(明示或暗示)或任何遺漏承擔任何責任。本演示文稿不構成MindMed證券的發行或收購要約的邀請,在任何情況下, 都不得將其解釋為招股説明書、廣告或證券公開發行。此處包含的任何商標均為其所有者的財產,僅用於參考目的。此類使用不應被解釋為對 MindMed 產品或服務的認可 。除非另有説明,否則任何金額均以美元為單位。MindMed 的證券未經美國證券交易委員會(SEC)或任何州、省或其他 證券監管機構的批准或拒絕,美國證券交易委員會或任何州、省或其他證券監管機構也未透露本演示文稿的準確性或充分性。任何與此相反的陳述均屬刑事犯罪。關於前瞻性陳述的警示説明 本演示文稿包含1995年美國私人 證券訴訟改革法案和其他適用的證券法安全港條款所指的 “前瞻性陳述”,我們的高級管理人員和代表可能會不時作出。前瞻性陳述通常可以用諸如 “計劃”、“預期”、“預期”、 “預算”、“計劃”、“估計”、“預測”、“打算”、“預期”、“將”、“項目” 或 “相信” 或變體(包括負面的 變體)等詞語來識別,或某些行動、事件、結果或條件的陳述 “可能”、“可能”、“將”、“可能” 或 “將” 被採取、發生或實現, 對未來時期的類似提法。除歷史事實陳述外,前瞻性陳述的示例包括與以下內容有關的陳述:任何藥物或療法的開發和商業化,或上述任一藥物或療法的 療效,我們開發活動的成功和時機;我們計劃進行的臨牀試驗的成功和時機;我們實現本文規定的里程碑的能力;任何臨牀試驗 成功或獲得食品藥品管理局或其他監管機構批准的可能性;我們的現金跑道通過關鍵臨牀為業務提供資金讀數及2026年;獲得專利的可能性或此類專利一旦獲得批准的效力,以及MindMed預期進入的市場潛力 。前瞻性陳述既不是歷史事實,也不是對未來表現的保證。相反,它們僅基於我們當前對我們 業務的未來、未來計劃和戰略、預測、預期事件和趨勢、經濟以及截至本演示文稿之日的其他未來狀況的信念、預期和假設。儘管 MindMed 認為這些假設是合理的,但 本質上會受到難以預測的重大業務、社會、經濟、政治、監管、競爭和其他風險和不確定性的影響,其中許多風險和不確定性不在 MindMed 的控制範圍內,實際結果和 財務狀況可能與前瞻性陳述中顯示的存在重大差異。因此,您不應依賴這些前瞻性陳述中的任何一項。可能導致實際業績和財務狀況 與前瞻性陳述中顯示的存在重大差異的重要因素包括:我們籌集資金以完成計劃和資助其研究的能力;正在開發的 藥物和治療的醫療和商業可行性;MindMed的負現金流歷史;MindMed的有限運營歷史;未來出現虧損;遵守法律法規;相關困難研究和 開發;與臨牀試驗或研究相關的風險;加強監管審查;早期產品開發;臨牀試驗風險;監管批准程序;迷幻藥行業的新穎性;以及 MindMed最近向美國證券交易委員會提交的10-K表年度報告以及我們未來向美國證券交易委員會和 證券監管機構提交的其他文件中的 “風險因素” 部分中討論或提及的風險因素加拿大所有省份和地區,可在公司在 SEDAR 上的簡介,網址為 www.sedar.com。MindMed在本演示文稿中做出的任何前瞻性陳述僅基於公司目前可用的信息 ,並且僅代表截至發表之日的信息。MindMed 沒有義務公開更新可能不時發表的任何前瞻性陳述,無論是書面還是口頭陳述,無論這些陳述是新信息、未來發展還是其他原因造成的。關於監管事項的警示説明美國聯邦政府通過《管制物質法》對藥物進行監管。MM120 是專有的、經過藥物優化的 形式的 D-酒石酸麥角苷,而 MM402 或 R (-)-MDMA 是我們專有的 MDMA(3,4-亞甲二氧基甲基苯丙胺)的 R-對映異構體。根據《管制物質法》,Lysergide和MDMA是附表一物質。儘管公司 專注於使用迷幻或致幻化合物以及這些化合物的非致幻衍生物的項目,包括其 MM120、MM402 和其他候選產品,但該公司並未直接或間接參與 在其經營所在司法管轄區非法銷售、生產或分銷任何物質的活動。該公司是一家神經藥物開發公司,不經營迷幻或致幻物質,除非是在批准的監管框架內進行的 實驗室和臨牀試驗環境中。公司的產品在獲得適用的監管批准之前不會商業化,只有在成功開發出用於預期用途的安全性和有效性 的臨牀證據後,才會獲得批准。市場和行業數據本演示文稿包括從第三方來源(包括行業出版物)獲得的市場和行業數據。MindMed 認為行業數據 是準確的,估計和假設是合理的,但無法保證這些數據的準確性或完整性。第三方消息來源通常表示,其中包含的信息是從被認為可靠的 來源獲得的,但無法保證所含信息的準確性或完整性。儘管數據被認為是可靠的,但MindMed尚未獨立驗證本演示文稿中提及 的第三方來源的任何數據,也沒有確定這些來源所依據的基本經濟假設。本演示文稿中對研究報告或文章和出版物的引用不應解釋為描述了整個引用報告或文章的 的完整發現。MindMed 對此類信息的準確性不作任何陳述。投資者演示文稿 | 2024 年 3 月 2

介紹性發言羅伯特·巴羅首席執行官
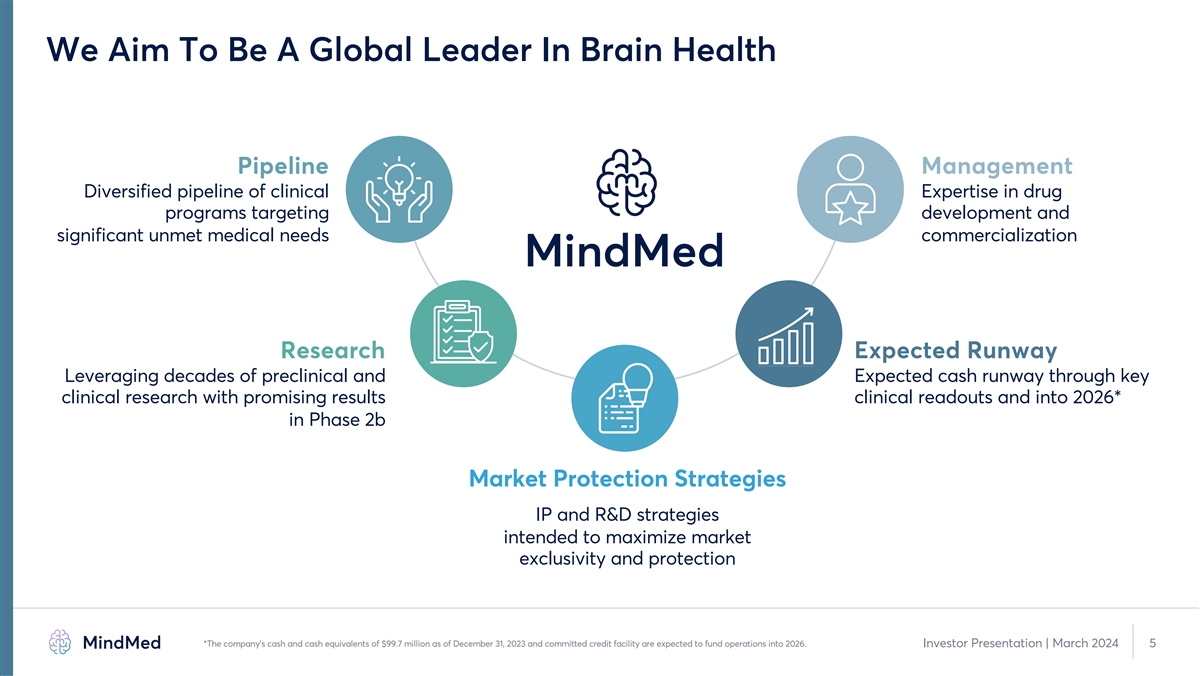
我們的目標是成為大腦健康管道管理領域的全球領導者 針對開發和重大未滿足的醫療需求商業化的藥物項目臨牀專業知識渠道研究預期走向 通過關鍵臨牀研究 利用數十年的臨牀前和預期現金流 取得令人鼓舞的結果,以及到2026年*的2b期市場保護戰略知識產權和研發戰略旨在最大限度地提高市場排他性和保護*公司的現金和現金等價物為美元截至 12 月,9,970 萬預計2023年31日和承諾信貸額度將為2026年的運營提供資金。投資者演示文稿 | 2024 年 3 月 5 日
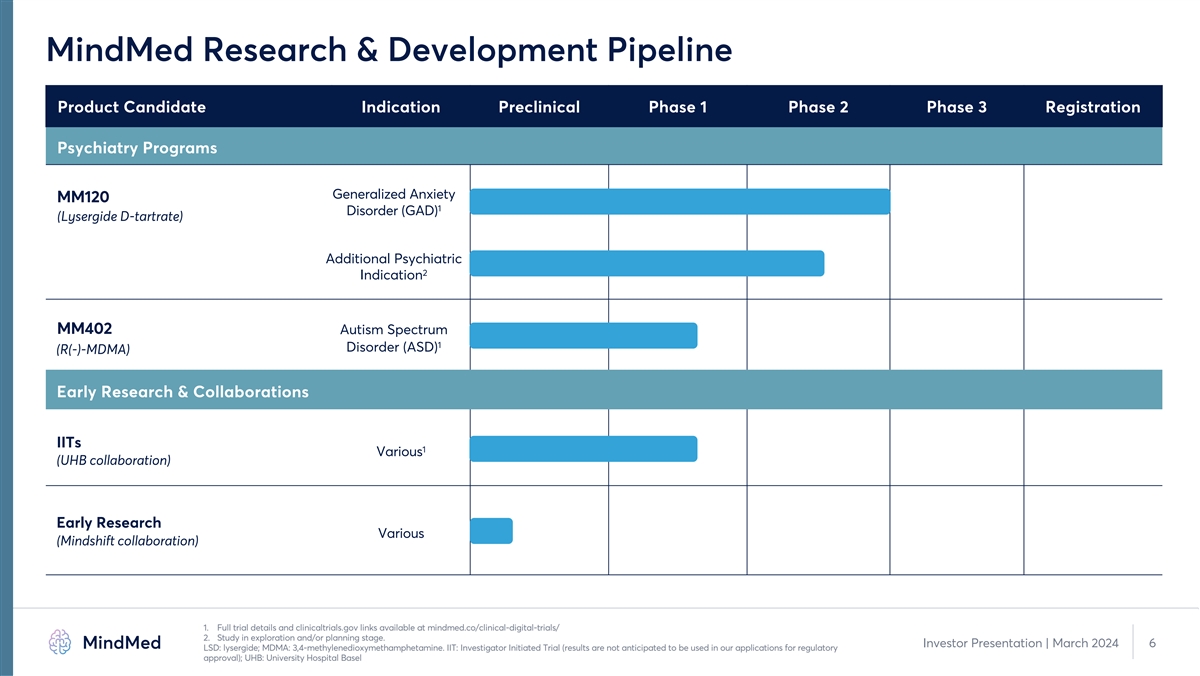
MindMed 研發管道產品候選適應症 臨牀前 1 期 2 期 3 期註冊精神病學項目廣泛性焦慮 MM120 1 障礙 (GAD) (Lysergide d-酒石酸鹽) 其他精神病學 2 適應症 MM402 自閉症譜系 1 障礙 (ASD) (R (-)-MDMA) 早期研究和 合作 IITs 1 各種(UHB 合作)各種早期研究(Mindshift 合作)1.完整的試驗詳情和 clinicaltrials.gov 鏈接可在 mindmed.co/clinical-digital-trials/ 2 上獲得。研究處於勘探和/或規劃階段。 投資者演示文稿 | 2024 年 3 月 6 日 LSD:lysergide;MDMA:3,4-亞甲二氧基甲基苯丙胺。IIT:研究者發起的試驗(預計不會將結果用於我們的監管批准申請);UHB:巴塞爾大學醫院

MM-120 有可能解決廣泛性焦慮症 (GAD) 中大量未得到滿足的需求 機會 1 • GAD 是成人中第二常見的精神障礙,可能是同類最佳但治療選擇有限使用新型 MOA 的治療 • 症狀可能會使人衰弱, 治療無效會導致完全緩解和不可忍受的副作用。1 大型市場 1300 萬 650 萬人沒有反應,大約 2,000 萬患有 GAD 3 1 2 的美國成年人接受一線治療的機會 77% 中度至重度 1 SSRI/SNRI:50%失敗率常伴有不良副作用苯二氮卓類藥物:成癮、耐受風險;通常用於短期新療法的重大需求 4 丁螺環酮:療效不佳抗精神病藥物:短期和長期風險; 耐受性差 1.精神和藥物使用障礙患病率研究(MDPSU):2023年調查結果報告。2.凱斯勒 RC、Chiu WT、Demler O 等。全國合併症中12個月的DSM-IV疾病的患病率、嚴重程度和合並症 調查-複製。2005 Arch Gen Psychiatry;62 (6):617-627。7 投資者演示文稿 | 2024 年 3 月 3.安薩拉,耐藥性廣泛性焦慮症管理,Ment Health Clin 2020 年 11 月;10 (6) 326-334) 美國人口普查局, 公司計算。4.Garakani A等人,(2020)焦慮症的藥物療法:當前和新興的治療選擇。正面。精神病學 11:595584. doi:10.3389/fpsyt.2020.595584

MM-120 更新的主要亮點 1 GAD 2b 期試驗中 12 周耐久性陽性 • 主要和次要終點具有統計學意義 • 與安慰劑(d=0.81;p=0.003)相比改善了 7.7 個百分點 • 第 12 周使用 MM-120 ODT 增強產品概況• 在 PK 橋接研究中觀察到的差異化特徵 • 快速吸收、提高生物利用度和更高的治療效果 AUC 1。來源:研究 MMED008 內部研究文件和計算。8 投資者演示文稿 | 2024 年 3 月 2.來源:研究 MM120-101 內部研究文件和計算。

單劑量 1,2 次後,GAD 中 MM120 的結果顯示在目標產品概況中,所有終點均有顯著改善,在 24 小時內快速起效 CGI-S 降低 1.8 個百分點(p
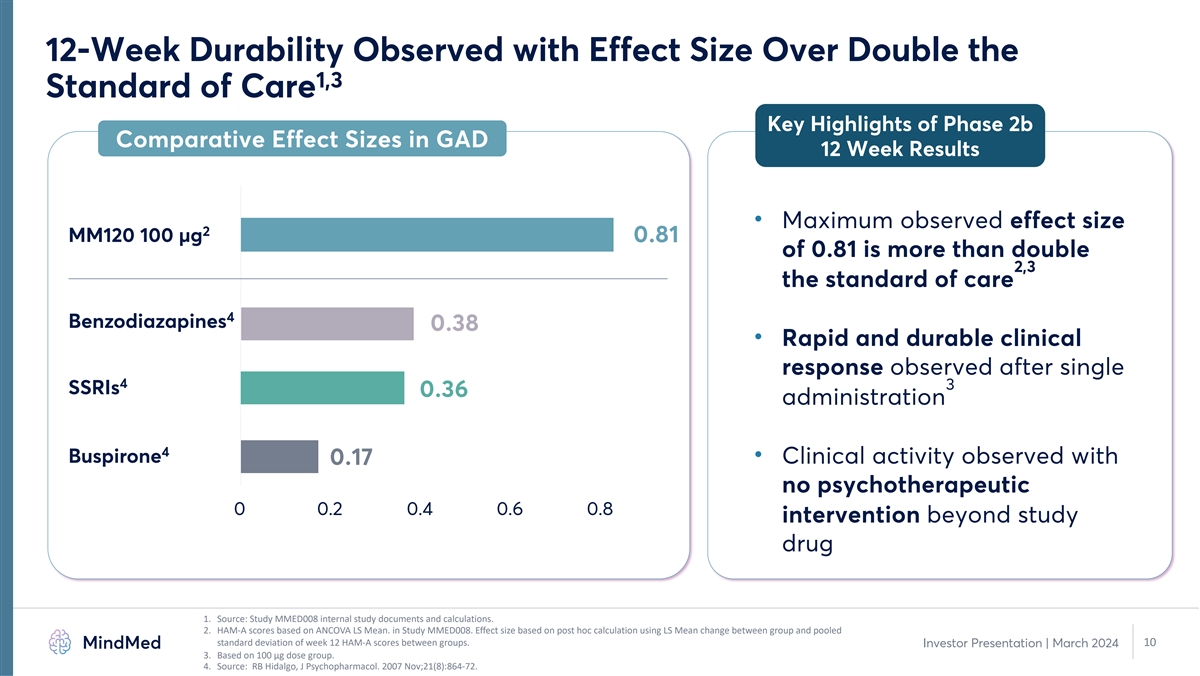
觀察到 12 周的耐久性,效果大小是 GAD 12 周結果中 2b 期比較效果大小的兩倍以上 • 最大觀測效果尺寸 2 MM120 100 µg 0.81 of 0.81 是護理標準 4 苯二氮卓類 0.38 的兩倍以上 • 在單 4 3 SSRI 0.36 給藥 4 丁螺環酮後觀察到的快速和 持久的臨牀反應 • 使用 0.17 no 觀察到的臨牀活性心理治療 0 0.2 0.4 0.6 0.8 研究藥物 1 以外的幹預措施。來源:研究 MMED008 內部研究 文件和計算。2.在 MMED008 研究中,HAM-A 分數基於 ANCOVA LS 平均值。效應大小基於事後計算,使用組間的 LS 平均值變化和第 12 周 HAM-A 分數的合併標準差。10 投資者 演示文稿 | 2024 年 3 月 3.基於 100 微克劑量組。4.資料來源:RB Hidalgo,J Psychopharmacol。2007 年 11 月;21 (8): 864-72。

PK 橋接研究表明,MM120 ODT 的產品特性得到增強 1 對比 PK Profile 2.5 MM120 膠囊的差異化性能 MM120 ODT MM120 ODT 2 2 起作用的速度加快 50% 1.5 3 17% 生物利用度提高 1 4 0.5 23%。AUC 0 5 0 2 4 6 8 10 12 14 16 18 20 22 24 減少胃腸道副作用時間(小時)1.公司對來自 MM120-101 研究的藥代動力學數據的分析。PK 分析基於完成兩次給藥的 n=24 名受試者。2.基於達到大於 1 ng/mL 的目標濃度的時間。3.基於 曲線下總面積的幾何平均比率的比較。投資者演示文稿 | 2024 年 3 月 11 4.基於平均AUC的比率。目標濃度定義為高於該水平會出現感知效應。>1ng/mL 5。基於 GAD 中 MM120 膠囊的 2b 期研究與 MM120 ODT 的 PK 橋接研究的 比較:曲線下方區域;胃腸道;ODT:口服溶解片;PK:藥代動力學 MM120 濃度 (ng/mL)

MM120 LSD-D-酒石酸鹽治療廣泛性焦慮症 (GAD) 2b 期試驗 完整結果摘要 Daniel R Karlin,醫學博士,馬薩諸塞州首席醫學官

GAD 2b 期研究的 12 周陽性主要結果:單劑量 MM120 2 後效果持久性強 1 • 符合具有統計學意義的主要和所有次要終點 • MCP-Mod 分析結果支持 GAD 3,4 中 MM120 的劑量反應關係 • 12 周觀察到的 d=0.81 的大型 效應大小是護理標準的兩倍多 o 觀察到單劑 MM120 後至少 3 個月的耐久性 • 第12周(p=0.0025)3的HAM-A分數提高了21.9個百分點,具有統計學和臨牀意義與四周的頭號數據相比有所改善 o 臨牀活性快速持久,在 12 周的觀察期內,臨牀緩解率持續改善 5 至 48% 2 o 第 12 周所有分析的次要終點均有顯著改善 • MM120 耐受性良好,無相關的嚴重不良事件 o 與藥物類別和先前的研究一致,多為短暫的、輕度至中度的不良事件 6 o 沒有 藥物相關嚴重不良事件 (SAE) 且沒有與自殺相關的安全信號 • 長期支持單次給藥 MM120 的耐久性,我們認為這進一步支持將 100 µg MM120 推進 GAD 1 的第 3 階段開發。 來源:研究 MMED008 內部研究文件和計算。報告了 100 µg 劑量組與安慰劑的個體組結果。2.代表第12周頂線分析中所有分析的次要終點,包括HAM-A、CGI-S和MADRS。 3。基於 100 µg 劑量組;HAM-A 分數基於 ANCOVA LS 平均值。效應大小基於研究統計學家使用組間的 LS 均值變化和各組期末 HAM-A 分數的合併標準差進行的事後計算。4. 檢查所有研究的基線組分配(20項研究使用HAM-A(漢密爾頓焦慮量表),1項研究使用PARS(小兒焦慮量表)進行主要結局測量。資料來源:RB Hidalgo,J 13 Investor 演示文稿 | 2024 年 3 月 Psychopharmacol。2007 年 11 月;21 (8): 864-72. 5.緩解的定義是 HAM-A 分數為 ≤7. 6。根據報告的不良事件進行自殺性評估。

MM120 的 2b 期試驗採用標準 GAD 設計和終點 1,與 FDA 藥物類別指南草案一致 • 標準 GAD 研究設計,其終點支持批准藥物的註冊 • 隨機、雙盲、安慰劑對照 12 周試驗 o 單次給藥 或安慰劑 o 不進行心理治療幹預 2 o 試驗設計與隨後發佈的 FDA 2023 年關於在隨機分組之前退出焦慮藥物治療的患者指南草案緊密一致 • 入組 198 名 GAD 患者 • 五臂劑量 MM-120採用 1:1:1:1:1 隨機化進行優化設計 • 主要終點:第 4 周漢密爾頓焦慮量表 (HAM-A) 的變化 o 由對治療分配和就診次數 1 視而不見的中心評估員進行評估。來源:研究 MMED008 內部研究文件和計算結果。14 投資者演示文稿 | 2024 年 3 月 2.FDA 2023 年指南草案:迷幻藥物:臨牀研究注意事項。
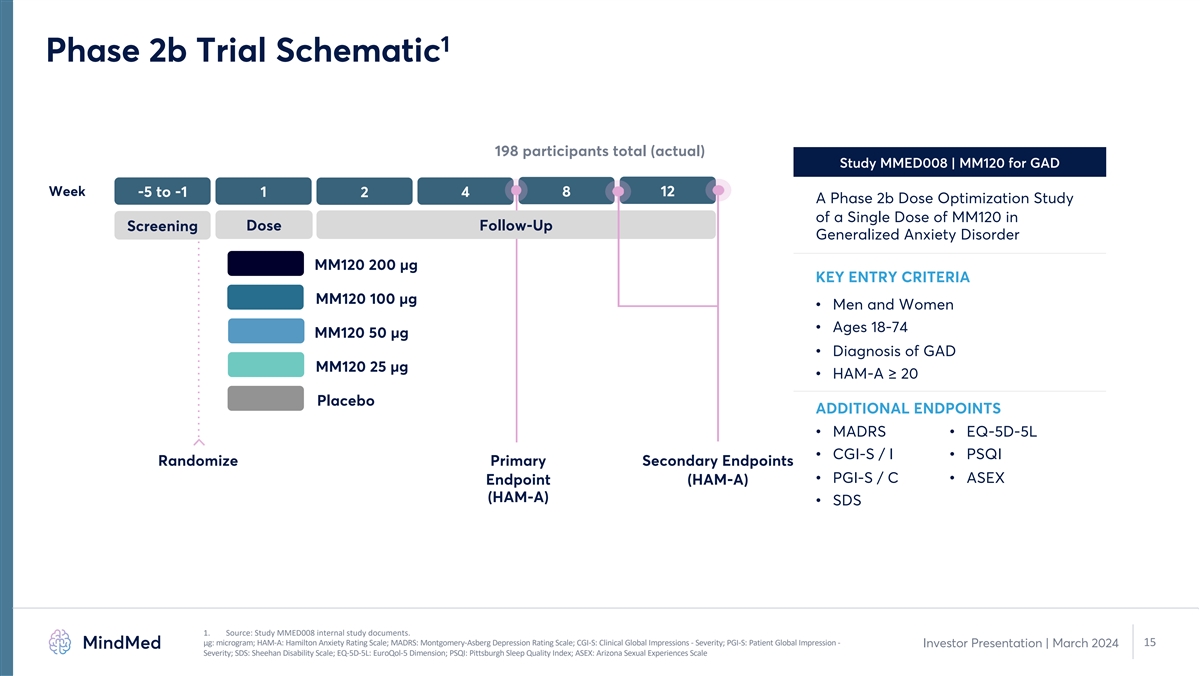
1 2b 期試驗示意圖共有 198 名參與者(實際)研究 MMED008 | MM120 用於 GAD 周 -5 至 -1 1 4 8 12 2 A 2b 期劑量優化研究在劑量隨訪篩查中單劑 MM120 的劑量優化研究 MM120 200 µg 關鍵進入標準 MM120 100 µg • 男性和女性 • 年齡 18-74 MM120 50 µg • GAD MM120 25 µg 的診斷 • HAM-A ≥ 20 安慰劑額外安慰劑終端 • MADRS • EQ-5D-5L • CGI-S/I • PSQI 隨機分配主要次要終點 • PGI-S/C • ASEX 終點 (HAMA) (HAM-A) (HAM-A) • SDS 1。來源:MMED008 研究內部研究文件。μg:微克;HAM-A:漢密爾頓焦慮評級量表;MADRS:蒙哥馬利-阿斯伯格抑鬱評級量表;CGI-S:臨牀全球印象- 嚴重程度;PGI-S:患者全球印象——15 投資者報告 | 2024 年 3 月嚴重程度;SDS:希恩殘疾量表;EQ-5D-5L:EuroQol-5 維度;PSQI:匹茲堡睡眠質量指數;ASEX:亞利桑那州性行為指數體驗規模

2b 期治療模式:獨立藥物效應,第 1 種心理治療幹預措施 • 房間內給藥監視器 (DSM) 不提供心理治療幹預 2 • 交付方案與 2023 年 FDA 指南草案一致 • 治療後治療期間 2 期和第 3 階段預治療之間未計劃更改藥物遞送 ü 全面的知情同意程序 ü DSM的持續監測 ü 隨訪僅用於評估的患者 ü 資格評估 ü 音樂、眼睛 shades、reading,在 MMED008 ü 中寫作《旅程》當出院標準滿足時得出結論 x 沒有 “準備” x 沒有 “輔助治療” x 沒有 “整合” 不是 x 預治療活動中的患者旅程 包括 x 沒有心理治療,也沒有治療 x 沒有持續的治療參與,因為臨牀試驗活動中研究藥物部分之外的 MMED008 全面知情同意程序幹預 1.來源:MMED008 研究內部研究 文件。16 投資者演示文稿 | 2024 年 3 月 2.FDA 2023 年指南草案:迷幻藥物:臨牀研究注意事項。
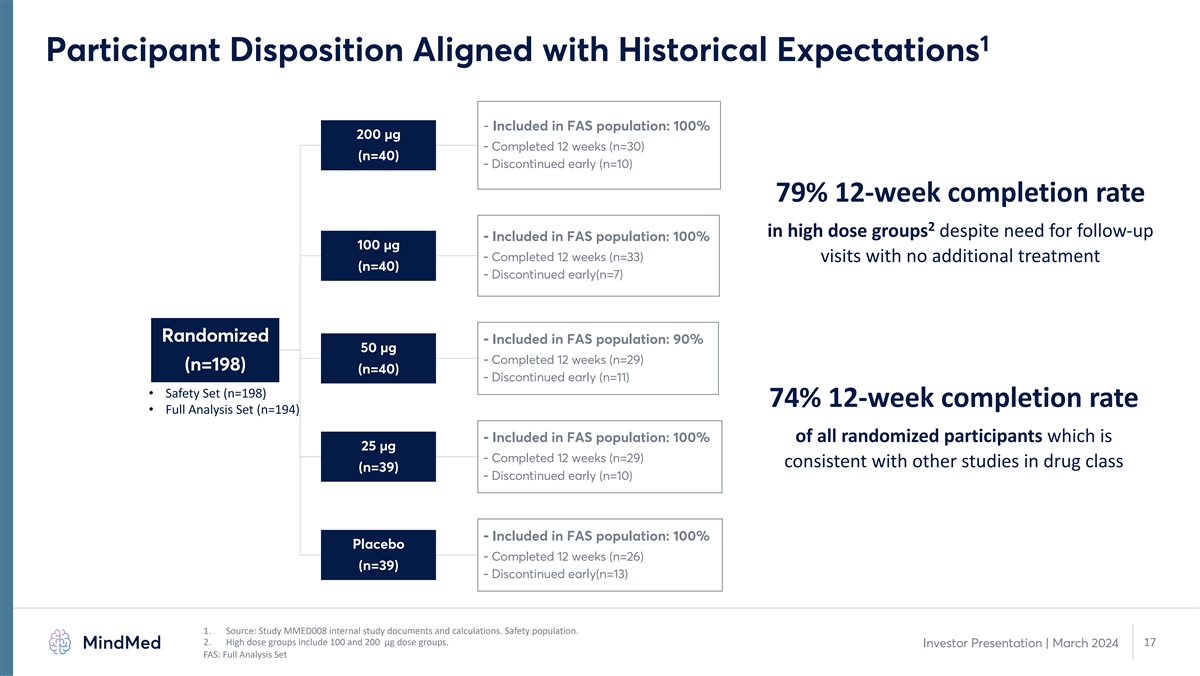
1 受試者傾向符合歷史預期- 包括在 FAS 人羣中:100% 200 µg-已完成 12 周 (n=30) (n=40)-儘管需要隨訪,但高劑量組 12 周完成率為 79% 2-包括在 FAS 人羣中:100% 100 µg-已完成 12 周 (n=33) 次就診,無需額外治療 (n=40)-提前停診 (n=7)) 隨機化-包含在 FAS 人羣中:90% 50 µg-已完成 12 周 (n=29) (n=198) (n=40)-提前停產 (n=11) • 安全套裝 (n=198) 74% 12 周 完成率 • 已滿分析集(n = 194)-包含在 FAS 人羣中:100% 的隨機參與者,即 25 µg-完成了 12 周(n = 29),與其他藥物類別的研究(n=39)一致-提前停止(n = 10)- 包含在 FAS 人羣中:100% 安慰劑-完成 12 周(n = 26)(n = 39)-提前停止(n = 13)1。來源:研究 MMED008 內部研究文件和計算。安全人羣。2.高劑量組包括 100 和 200 µg 劑量 組。17 投資者演示文稿 | 2024 年 3 月 FAS:完整分析集
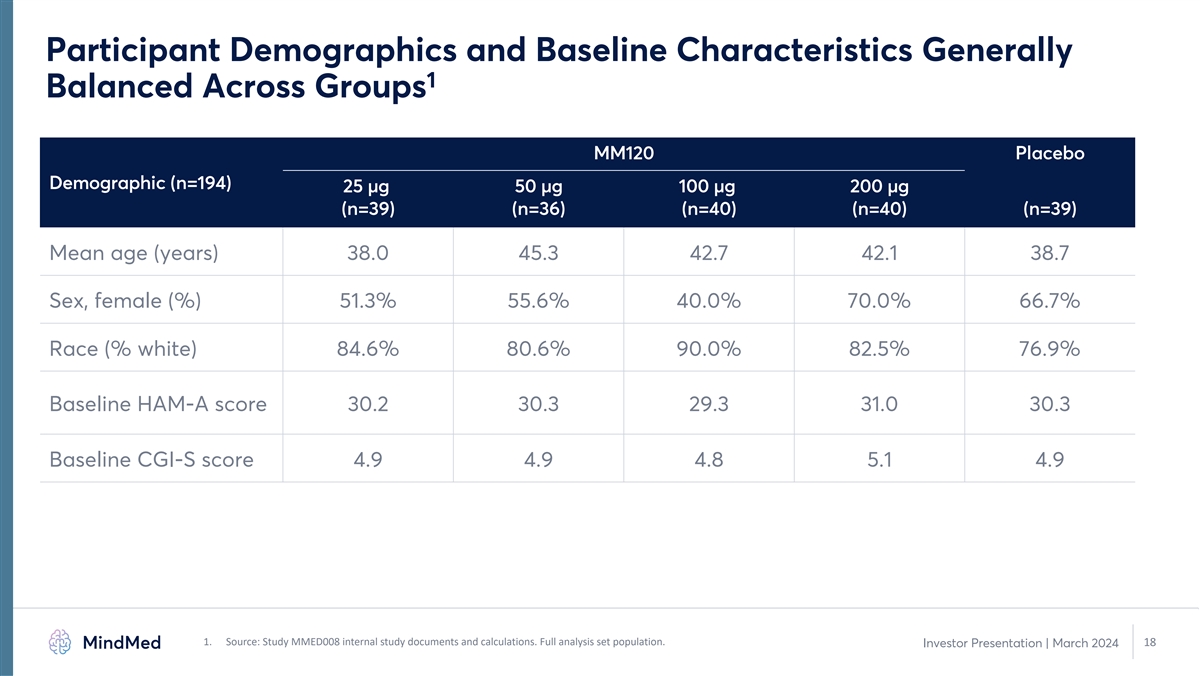
參與者人口統計學和基線特徵通常 1 各組均衡 MM120 安慰劑人口統計 (n=194) 25 µg 50 µg 100 µg 200 µg (n=39) (n=36) (n=40) (n=40) (n=39) (n=39) 平均年齡 (歲) 38.0 45.3 42.7 38.7 性別、女性 (%) 51.3% 40.0% 70.0% 66.7% 種族(% 白人)84.6% 80.6% 90.0% 82.5% 76.9% 基線 HAM-A 分數 30.2 30.3 29.3 31.0 30.3 31.0 30.3 30.3 基線 CGI-S 分數 4.9 4.9 4.9 4.9 4.9 1。來源:研究 MMED008 內部研究文件和計算。完整分析集合人羣。18 投資者演示文稿 | 2024 年 3 月
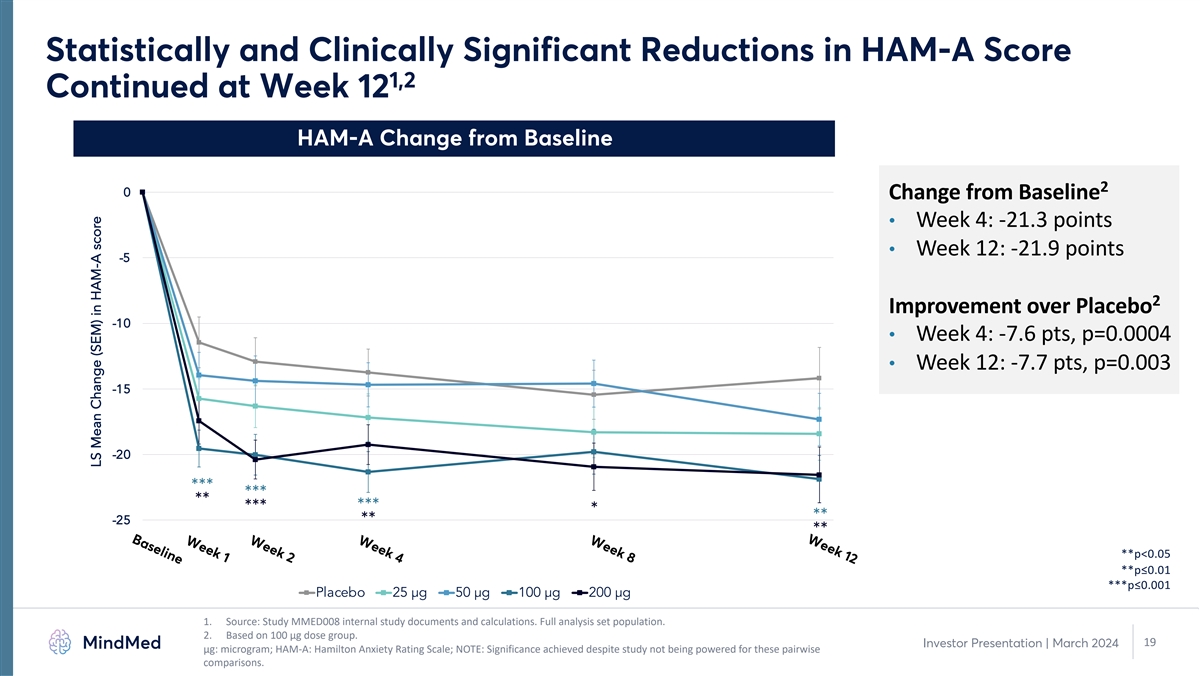
第 12 周第 8 周第 4 周第 2 周基線統計學和 HAM-A 分數 1,2 的臨牀顯著下降第 12 周 HAM-A 與基線 2 的變化 0 與基線的變化 • 第 4 周:-21.3 分 • 第 12 周:-21.9 分 -5 2 比安慰劑改善 -10 • 第 4 周:-7.6 分, p=0.0004 • 第 12 周:-7.7 點,p=0.003 -15 -20 *** *** *** *** -25 ** **** **p

在第 12 周持續反應和緩解,臨牀緩解率為 65% 1,臨牀緩解率為 48% 2 2 HAM-A 第 12 周的緩解率 HAM-A 緩解率 12 周 50 48 70 65 45 63 60 56 40 33 50 30 28 40 21 31 20 30 20 10 10 0 0 安慰劑 25 µg 50 µg 100 µg 200 µg 安慰劑 25 µg 50 µg 100 µg 100 µg 100 µg 100 µg 100 µg 安慰劑 25 µg 50 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg 100 µg p 值未計算 p 值未計算 p 值未計算 1。來源:研究 MMED008 內部研究文件和計算。完整分析集合羣體。2.迴應定義為比 HAM-A 分數提高50%或以上;緩解定義為HAM-A分數≤7。20 投資者演示文稿 | 2024 年 3 月 μg:微克;HAM-A:漢密爾頓焦慮評級量表受訪者百分比匯款人

主要和關鍵二次分析 (MCP-Mod) 支持劑量反應 1 GAD 2 中 MM120 的關係 MCP-Mod 分析的關鍵要點 • 具有統計意義的劑量反應關係,多模型擬合的劑量反應關係具有統計學意義 • 支持 GAD 後續研究 100 µg 的劑量選擇 • 預先指定的模型估計值和觀察到的反應驅動 3 期研究劑量 1 的劑量選擇。來源:研究 MMED008 內部研究文件和計算。完整分析集合羣體。2.來源:諾華。“MCP-Mod 方法 — 劑量反應的統計方法。21 投資者演示文稿 | 2024 年 3 月 `模型意味着

全球臨牀印象快速持續改善 — 1 嚴重程度 (CGI-S) 從第 2 天開始持續到第 12 周 2 CGI-S 第 12 周 100 µg 組 CGI-S 分數有所改善 6 — 重病 • 到第 2 天統計學和臨牀均有顯著改善 5 — 明顯病情持續至第 12 周 4 — 中度疾病 • 截至第 12 周 CGI-S 評分改善超過 2 個單位 **** 3 — 輕度疾病 *** • 參與者平均只有 2 人 — 第 12 周處於臨界病情的臨界病情到輕度疾病 1 — 正常,基準第 2 天根本沒有生病第 4 周第 12 周安慰劑 100 µg *p

第 12 周第 8 周第 4 周第 2 周基線統計學和 截至第 12 周的所有時間點合併抑鬱症 1,2 (MADRS) 的臨牀顯著下降 3 MADRS 與基線的變化 0 2,3 與基線的變化 • 第 4 周:-18.1 點 • 第 12 周:-18.7 點 -5 2,3 與安慰劑 -10 相比改善 • 第 4 周:-5.7 分,p
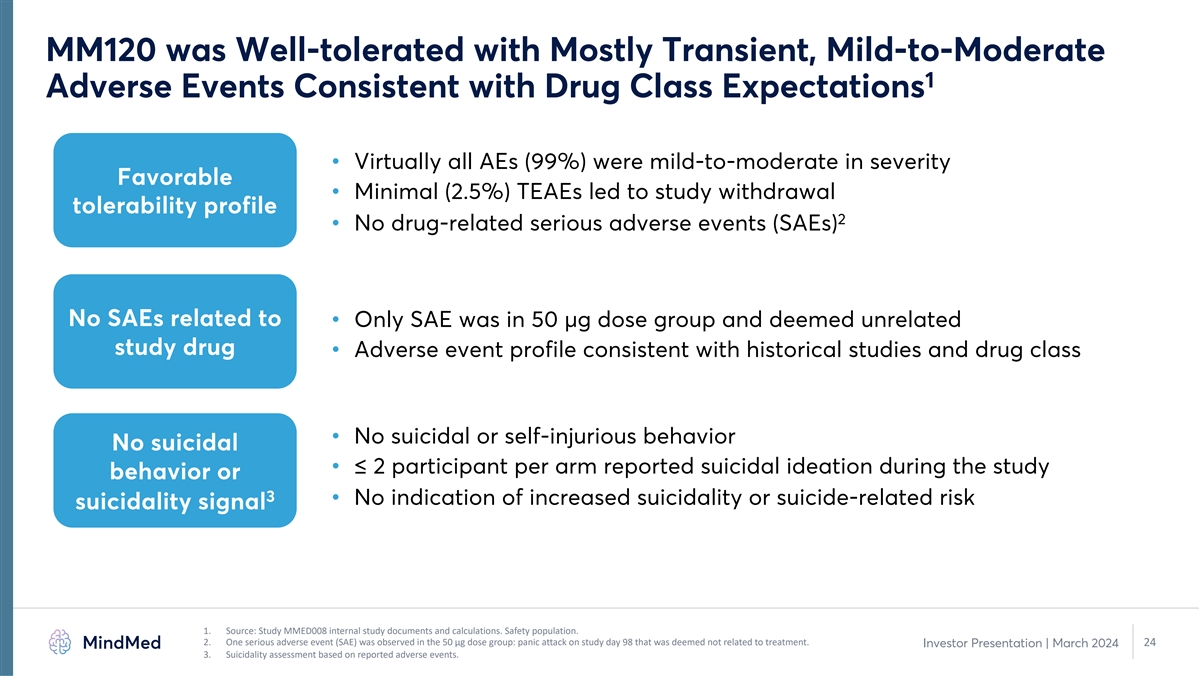
MM120 耐受性良好,多為短暫性、輕度至中度 1 種不良事件,符合藥物類別預期 • 幾乎所有 AE (99%) 的嚴重程度均為輕度至中度良好 • 極低 (2.5%) TEAE 導致了研究戒斷耐受性概況 2 • 無藥物相關嚴重不良事件 (SAE) 無關 • 只有 SAE 屬於 50 µg 劑量組,被視為無關研究藥物 • 不良事件概況與歷史研究一致和藥物類別 • 無自殺或自殘行為無自殺行為 • 每組 ≤ 2 名受試者報告研究期間有自殺意念或 3 •沒有自殺率增加的跡象或與自殺相關的風險自殺信號 1.來源:研究 MMED008 內部研究文件和 計算。安全人羣。2.在50微克劑量組中觀察到一種嚴重的不良事件(SAE):研究日第98天的驚恐發作,被認為與治療無關。24 投資者演講 | 2024年3月 3.根據報告的不良事件進行自殺性評估 。
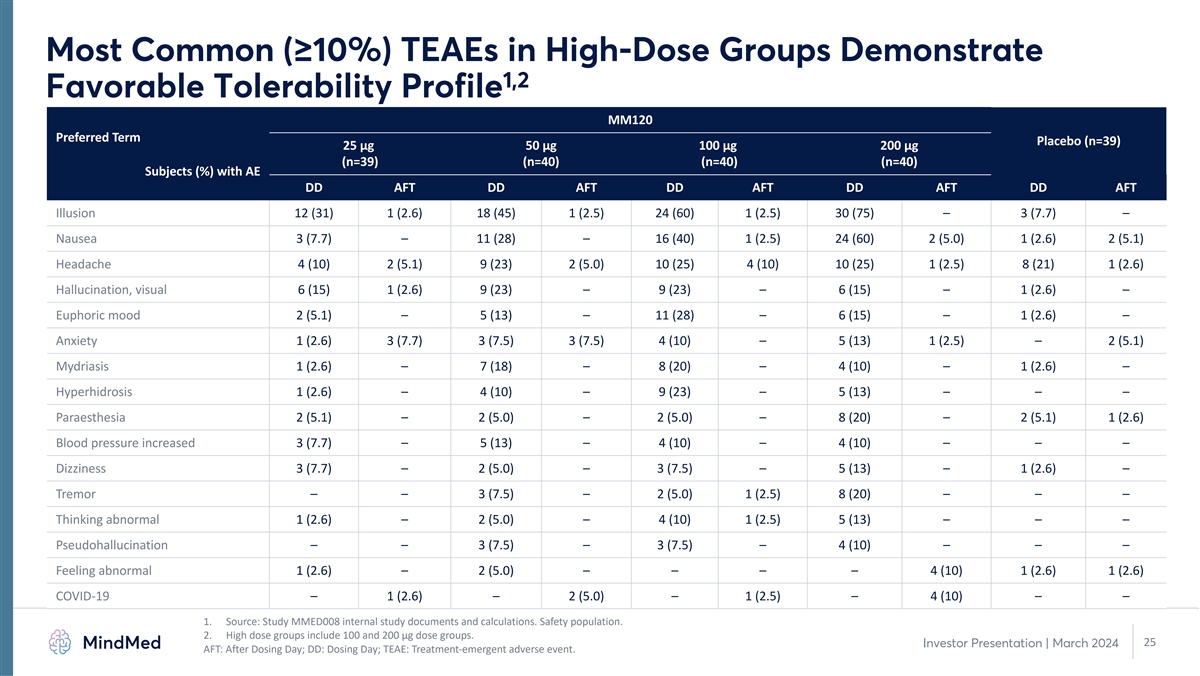
高劑量組中最常見 (≥ 10%) TEAE 表現出 1,2 良好的耐受性 MM120 首選術語安慰劑 (n=39) 25 µg 50 µg 100 µg 200 µg (n=39) (n=40) (n=40) (n=40) (%) AFT DD AFT DD AFT DD AFT DD AFT Illusion 12 (31) 1 (2.6) 18 (45) 1 (2.5) 24 (60) 1 (2.5) 30 (75) — 3 (7.7) — 噁心 3 (7.7) — 11 (28) — 16 (40) 1 (2.5) 24 (60) 2 (5.0) 1 (2.6) 2 (5.1) 頭痛 4 (10) 2 (5.1) 9 (23) 2 (5.0) 10 (25) 1 (2.5) 8 (21) 1 (2.6) 幻覺,視覺 6 (15) 1 (2.6) 9 (23) — 9 (23) — 6 (15) — 1 (2.6) — 欣快情緒 2 (5.1)— 5 (13) — 11 (28) — 6 (15) — 1 (2.6) — 焦慮 1 (2.6) 3 (7.7) 3 (7.5) 3 (7.5) 4 (10) — 5 (13) 1 (2.5) — 2 (5.1) — 2 (5.1) — 2 (5.1) — 7 (18) — 8 (20) — 4 (10) — 1 (2.6) — 4 (10) — 9 (23) — 5 (13) — — — 麻醉 2 (5.1) — 2 (5.0) — 2 (5.0) — 8 (20) — 2 (5.1) 1 (2.6) 血壓升高 3 (7.7) — 5 (13) — 4 (10) — 4 (10) — — 4 (10) — — — 頭暈 3 (7.7) — 2 (5.0) — 3 (7.5) — 3 (7.5) — 5 (13) — 1 (2.6) — 震顫 — — 3 (7.5) — 2 (5.0) 1 (2.5) 8 (20) — — 思維異常 1 (2.6) — 2 (5.0) — 4 (10) 1 (2.5) 5 (13) — — — 假幻覺 — — 3 (7.5)— 3 (7.5) — 4 (10) — — — 感覺異常 1 (2.6) — 2 (5.0) — — — 4 (10) 1 (2.6) 1 (2.6) COVID-19 — 1 (2.6) — 2 (5.0) — 1 (2.5) — 1 (2.5) — 4 (10) — — 1.來源:研究 MMED008 內部研究文件和計算。安全 人口。2.高劑量組包括 100 和 200 微克劑量組。25 投資者演示文稿 | 2024 年 3 月 AFT:給藥後;DD:給藥日;TEAE:治療緊急不良事件。

MM120 LSD-D-酒石酸鹽治療廣泛性焦慮症 (GAD) MM120 ODT PK 橋接研究 Daniel R Karlin,醫學博士,馬薩諸塞州首席醫學官

PK 橋接研究表明,MM120 ODTs 的產品特性得到增強 1 對比 PK Profile 2.5 MM120 膠囊的差異化性能 MM120 ODT MM120 ODT 2 2 起作用的速度加快 50% 1.5 3 17% 生物利用度提高 1 4 0.5 23%。AUC 0 5 0 2 4 6 8 10 12 14 16 18 20 22 24 減少胃腸道副作用時間(小時)1.公司對來自 MM120-101 研究的藥代動力學數據的分析。2.基於達到大於 1 ng/mL 的目標濃度的時間。3.基於曲線下總面積的幾何平均比率的比較。 投資者演示文稿 | 2024 年 3 月 27 日 4.基於平均AUC的比率。目標濃度定義為高於該水平會出現感知效應。>1ng/mL 5。基於 GAD 中 MM120 膠囊的 2b 期研究與 MM120 ODT 的 PK 橋接研究的比較 AUC:曲線下方區域;胃腸道;ODT:口服溶解片劑;PK:藥代動力學 MM120 濃度 (ng/mL)

1 MM120 ODT PK 橋接研究示意性研究 MM120-101 | ODT-PK 共有 29 名參與者(實際)一項第一階段的開放標籤研究,旨在比較第 -21 天與 -1 1 2-13 14 15-29 兩種沖洗劑量 MM120 配方 2 後續篩查劑量 1 健康志願者 MM120 MM120 入標準 Zydis ODT Zydis ODT • 男性和女性 (100 µg) (100 µg) • 年齡 18-55 歲 • 健康志願者 • 無違禁藥物 MM120 MM120 膠囊膠囊(100 µg)(100 µg)(100 µg)註冊人數 1。基於 MM120-101 研究投資者演示文稿的內部研究 文件 | ODT 2024 年 3 月 28 日:口服溶解片劑

MM120 ODT 與膠囊的對比 PK 顯示 MM120 ODTs 2.5 MM120 膠囊 MM120 ODT 的 1 個特徵 ODT MM120 MM120 1 2 PK 參數膠囊 ODT 1.5 T (hr) 2.25 2.0 max C (ng/mL) 2.63 2.68 最大 1 AUC (ng*hr/mL) 15.7 18.7 0-Ÿ 0.5 AUC (ng*HR/mL) 9.7 12.0 >1ng/mL 0 2 4 6 8 10 12 14 16 18 20 22 24 時間 (小時)1.公司對來自 MM120-101 研究的藥代動力學數據的分析。PK 分析基於完成兩次給藥的 n=24 名受試者。投資者演示文稿 | 2024 年 3 月 29 日 AUC:曲線下方區域;C:最大達到濃度; ODT:口服溶解片劑;PK:藥代動力學;T:達到最大濃度的時間 MM120 最大濃度 (ng/mL)

MM120 ODT 表現出更快的吸收速度和更短的達到 目標濃度的時間 1.2 MM120 膠囊 1 MM120 ODT MM120 ODT 1 2 的差異化 PK 分佈圖 0.8 0.6 3 17% 生物利用度提高 0.4 4 0.2 23% AUC 高於目標濃度 0.4 4 0.2 23%。AUC 0 0 10 20 30 時間(分鐘)1. 公司對來自 MM120-101 研究的藥代動力學數據的分析。PK 分析基於完成兩次給藥的 n=24 名受試者。2.基於達到大於 1 ng/mL 的目標濃度的時間。3.基於曲線下方 總面積的幾何平均比率的比較。投資者演示文稿 | 2024 年 3 月 30 日 4.基於平均AUC的比率。目標濃度定義為高於該水平會產生感知效應。>1ng/mL AUC:曲線下方區域;ODT:口服溶解片劑; PK:藥代動力學 MM120 濃度 (ng/mL)
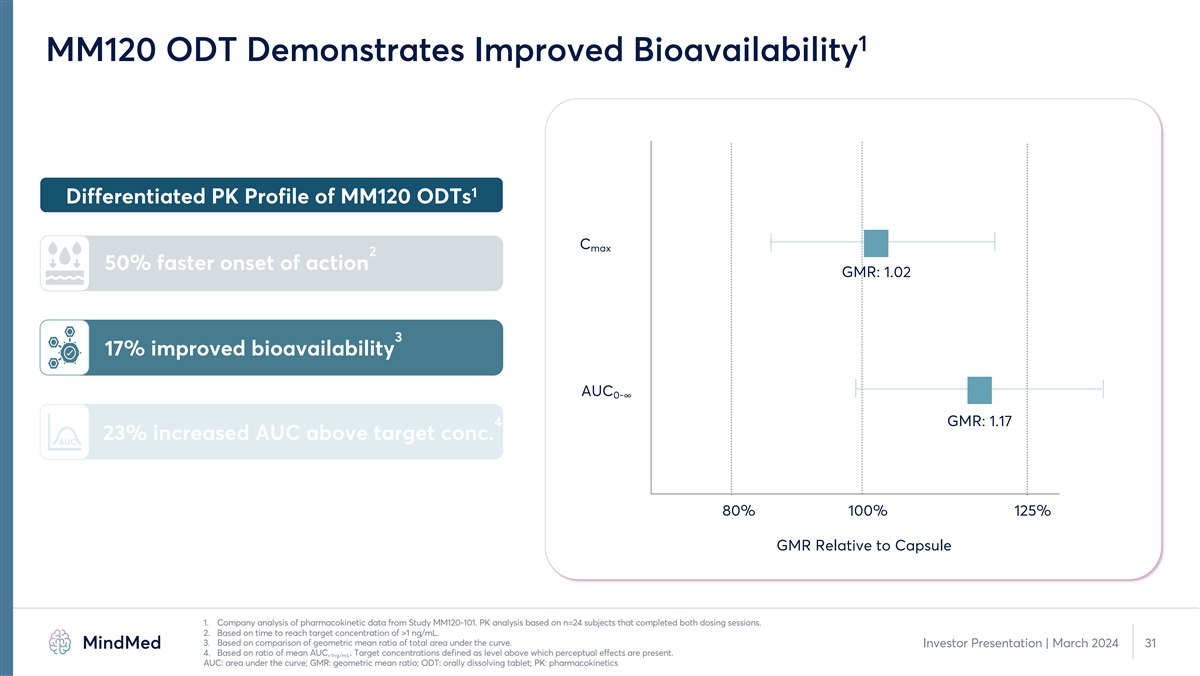
1 MM120 ODT 顯示生物利用度得到提高 1 MM120 ODTs 的差異化 PK 概況 C 最大 2 起效快 50% GMR:1.02 3 生物利用度提高 17% AUC 0-Ÿ 4 GMR:AUC 比目標濃度增加 1.17 23%。AUC 80% 100% 125% GMR 相對於膠囊 1。公司對來自 MM120-101 研究的藥代動力學數據的分析 。PK 分析基於完成兩次給藥的 n=24 名受試者。2.基於達到大於 1 ng/mL 的目標濃度的時間。3.基於曲線下總面積的幾何平均比率的比較。投資者 演示文稿 | 2024 年 3 月 31 日 4.基於平均AUC的比率。目標濃度定義為高於該水平會產生感知效應。>1ng/mL AUC:曲線下方區域;GMR:幾何平均比率;ODT:口服溶解片劑;PK: 藥代動力學
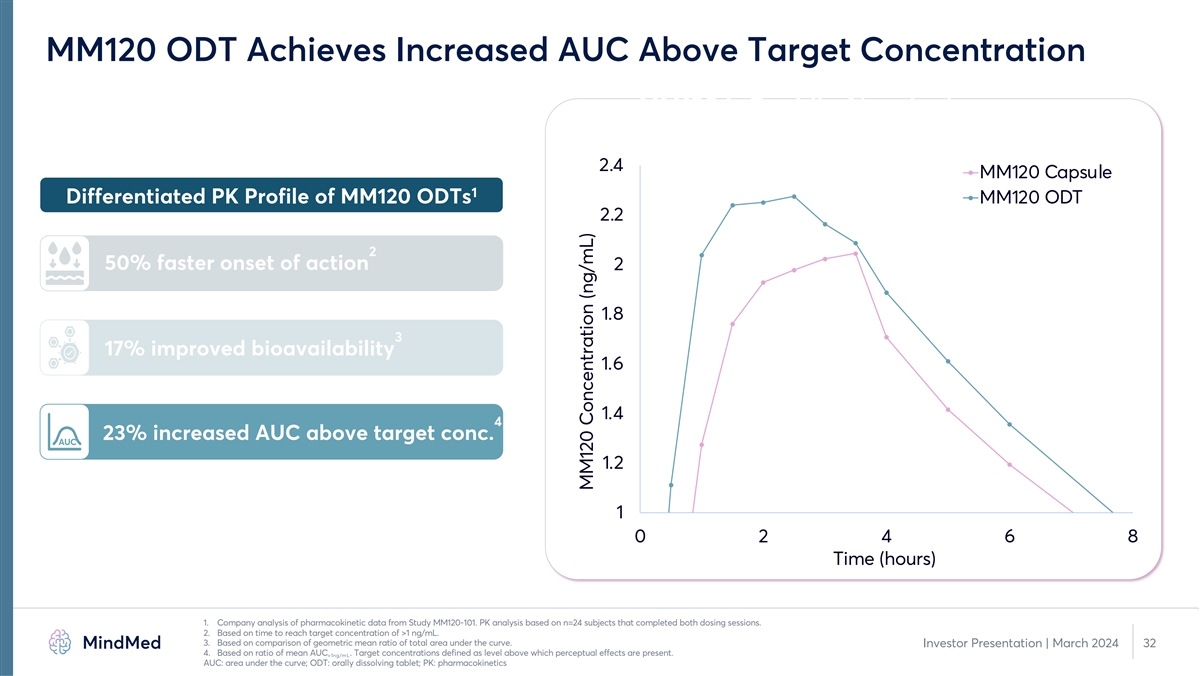
MM120 ODT 實現了高於目標濃度的AUC 增加 MM120 是 快速吸收的 2.4 MM120 膠囊 1 的差異化 MM120 ODT 2.2 2 的作用開始速度加快 50% 2 1.8 3 17% 生物利用度提高 1.6 1.4 4 23% AUC 高於目標濃度。MM120AUC 1.2 1 0 2 4 6 8 時間(小時)1.公司 分析來自 MM120-101 研究的藥代動力學數據。PK 分析基於完成兩次給藥的 n=24 名受試者。2.基於達到大於 1 ng/mL 的目標濃度的時間。3.基於曲線下總 面積的幾何平均比率的比較。投資者演示文稿 | 2024 年 3 月 32 4.基於平均AUC的比率。目標濃度定義為高於該水平會產生感知效應。>1ng/mL AUC:曲線下方區域;ODT:口服溶解片劑;PK: 藥代動力學 MM120 濃度 (ng/mL)

MM120 發展計劃摘要評論羅伯特·巴羅首席執行官 執行官

多項研究支持 MM120 1 的第 3 階段開發 • 實現了 2 期開發的目標 o 為GAD中的劑量選擇提供信息的特徵劑量反應 o GAD 中具有統計學意義且具有臨牀意義的效果 o 在沒有心理治療幹預的情況下對經過驗證的終點 o 獨立藥物效果具有快速和持久的治療益處 • 多項支持 MM120 o 2b 期隨機、安慰劑對照試驗活性的雙盲、安慰劑對照研究在 GAD(研究 MMED008)o 一個前現代的 中,焦慮症中麥草吉的隨機、安慰劑對照IIT o 超過二十多項關於麥角苷治療焦慮症和其他神經質疾病的傳統研究 • 2b 期數據支持劑量選擇和進入第 3 階段開發 1。來源:研究 MMED008 內部研究文件和計算。34 投資者演示文稿 | 2024 年 3 月

MM120 開發途徑 1 • 兩項三期關鍵臨牀試驗 計劃進行為期 12 周的隨機、安慰劑對照的主要療效研究設計 o 開放標籤延期,以確定再治療參數 o 預計將於 2024 年下半年啟動 3 期開發 • 第 4 周漢密爾頓焦慮量表 (HAM-A) 的 2b 期和 3 期研究的關鍵設計要素預計將保持一致 預期主要終點 o 關鍵納入/排除標準的變化有限 o 未計劃更改劑量會話監控協議 1。第 3 階段和 後續臨牀研究設計尚待監管機構討論和審查,包括可能的第 2 階段結束會議。35 投資者演講 | 2024 年 3 月
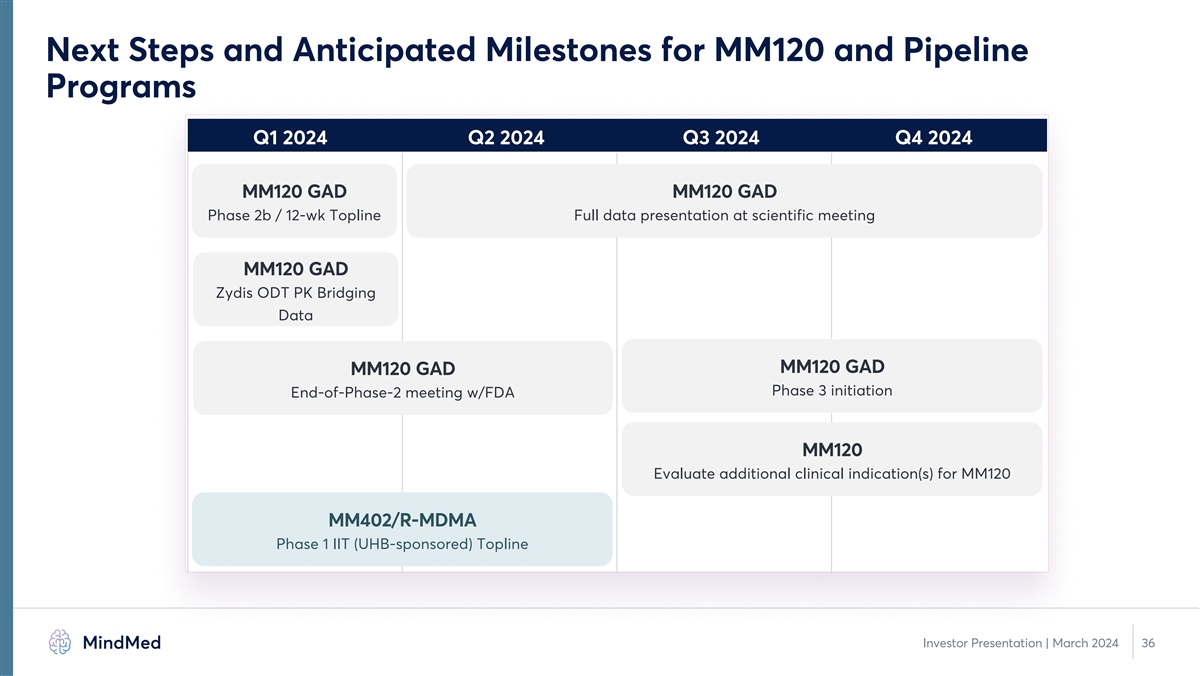
MM120 和管道項目的下一步措施和預期里程碑 2024 年第一季度第二季度 2024 年第四季度 MM120 GAD MM120 GAD 第 2b 期/12 周科研會議上的完整數據介紹 MM120 GAD Zydis ODT PK 橋接數據 MM120 GAD MM120 GAD 第 3 階段啟動會議與 FDA MM120 評估 UHB 贊助)Topline 投資者演示文稿 | 2024 年 3 月 36 日 MM120

問答 37 投資者演示文稿 | 2024 年 3 月

附錄
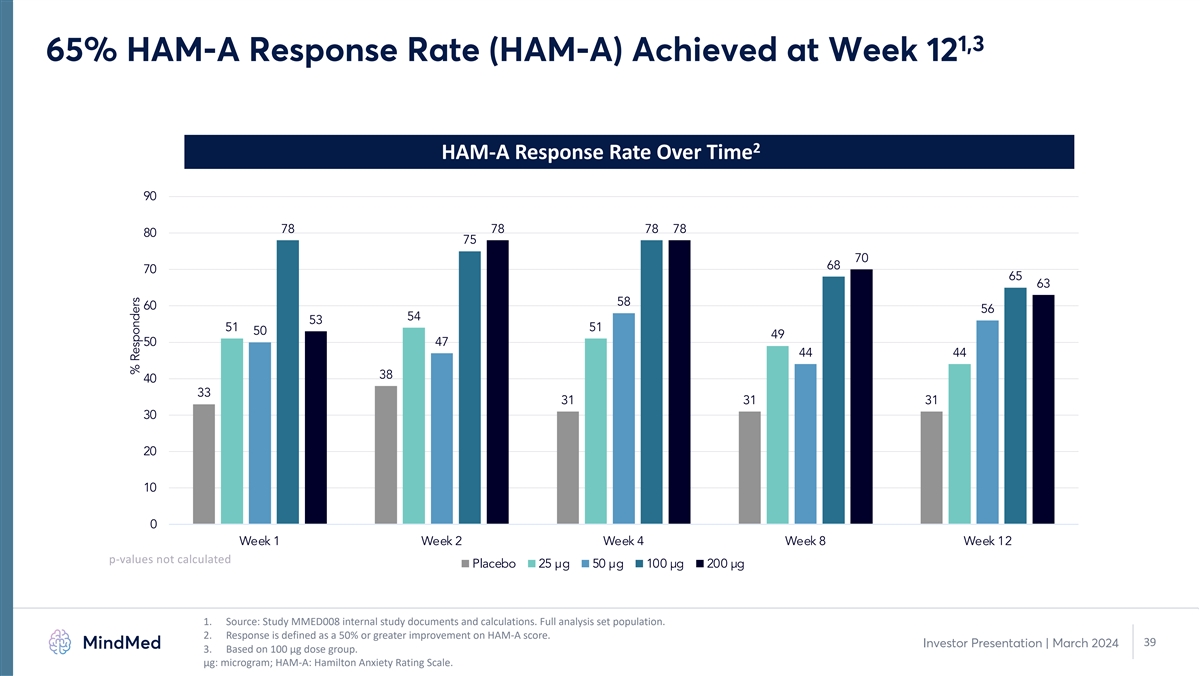
1,3 65% HAM-A 回覆率 (HAM-A) 在第 12 周達到 HAM-A 一段時間內的回覆率 90 78 78 78 80 75 70 68 70 68 65 63 58 60 54 53 51 50 49 50 47 44 44 38 31 31 31 30 20 10 0 第 1 周第 4 周 12 p 值未計算安慰劑 25 µg 50 µg 100 µg 200 µg 1。 來源:研究 MMED008 內部研究文件和計算。完整分析集合羣體。2.迴應的定義是HAM-A分數提高50%或以上。39 投資者演示文稿 | 2024年3月 3.基於 100 µg 劑量組。μg: 微克;HAM-A:漢密爾頓焦慮評級量表。受訪者百分比

1,3 48% 的緩解率 (HAM-A) 在第 12 周達到 HAM-A 一段時間內的緩解率 60 50 50 48 45 45 45 45 45 43 40 38 33 33 33 33 33 33 33 33 33 33 28 26 25 21 21 21 20 18 15 10 0 第 1 周第 4 周第 8 周 p 值未計算安慰劑 25 µg 50 µg 100 µg 200 µg 1。來源: Study MMED008 內部研究文件和計算。完整分析集合羣體。2.緩解定義為HAM-A分數≤7。40 投資者演示文稿 | 2024年3月 3.基於 100 µg 劑量組。μg:微克;HAM-A: 漢密爾頓焦慮評級量表。% 匯款者
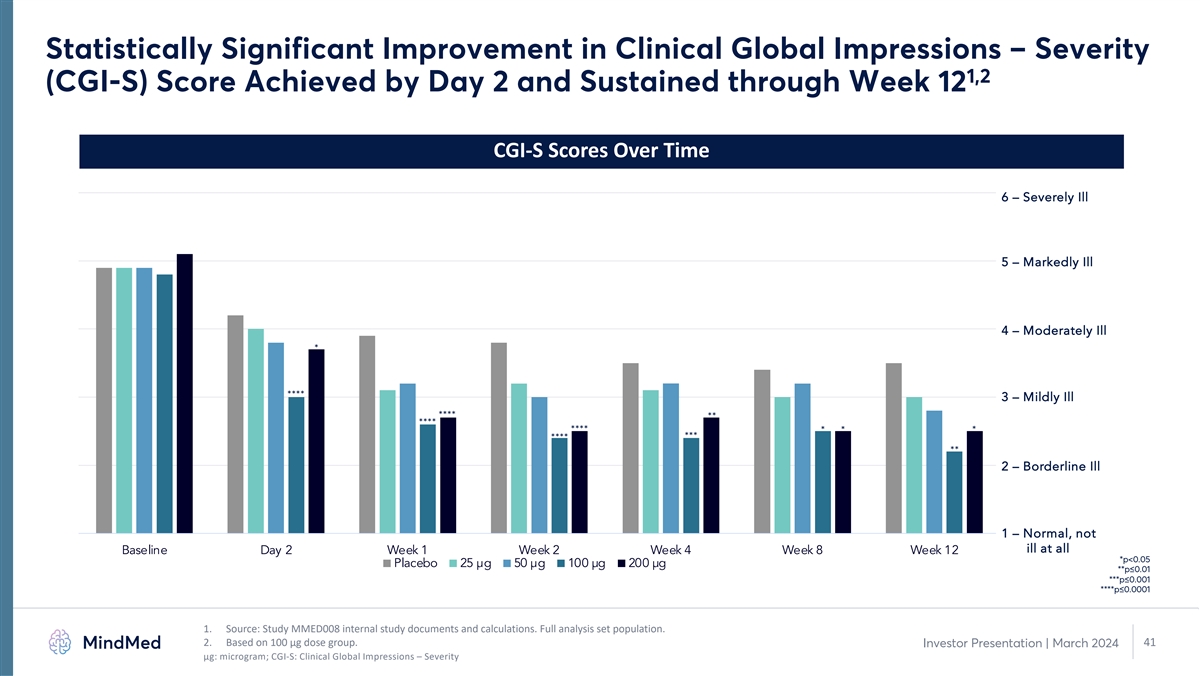
臨牀全球印象有統計學上的顯著改善 — 第 2 天達到嚴重程度 1,2 (CGI-S) 分數並持續到第 12 周 CGI-S 分數 6 — 重病 5 — 明顯疾病 4 — 中度疾病 * **** 3 — 輕度疾病 **** **** * *** ** 2 — 臨界疾病 1 — 正常,基準第 2 周第 2 周第 4 周第 8 周 12 周*** p
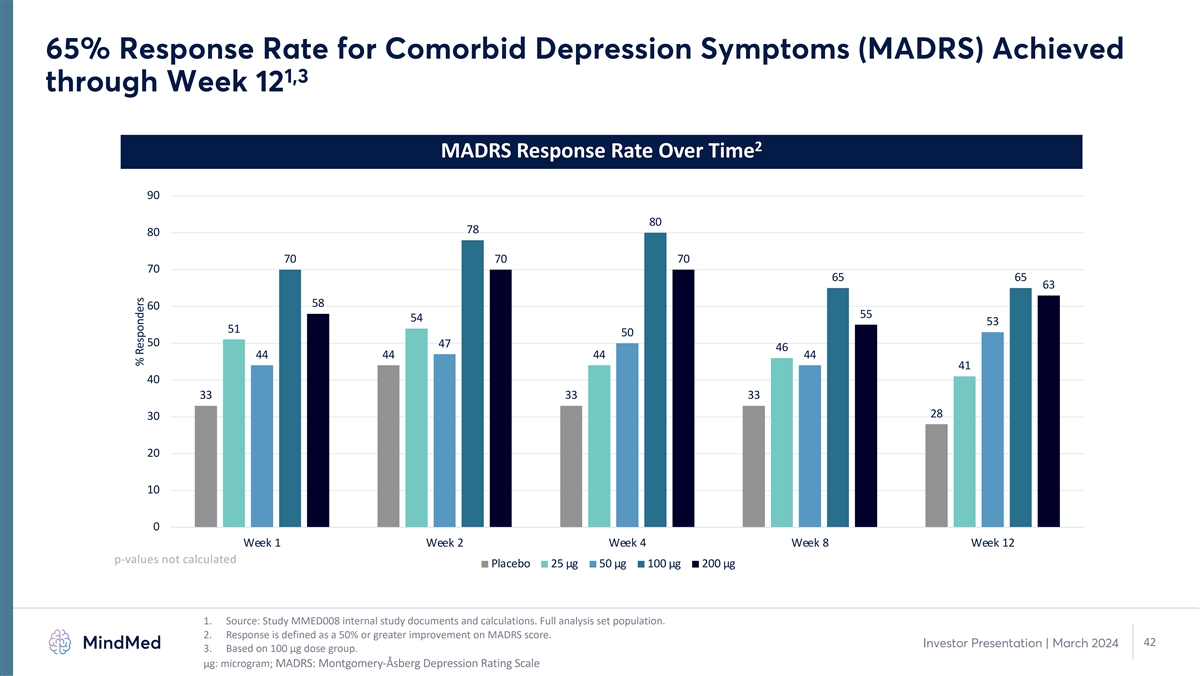
65% 的合併抑鬱症狀緩解率(MADRS)在第 12 周達到了 1,3 2 隨時間推移的 MADRS 緩解率 90 80 70 70 70 70 70 65 65 63 58 60 54 53 53 50 47 46 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44 44來源:研究 MMED008 內部研究文件和計算。完整分析集合羣體。2.迴應定義為MADRS分數提高50%或以上。42 投資者演示文稿 | 2024年3月 3.基於 100 µg 劑量組。μg:微克;MADRS:蒙哥馬利-阿斯伯格抑鬱評級量表受訪者百分比
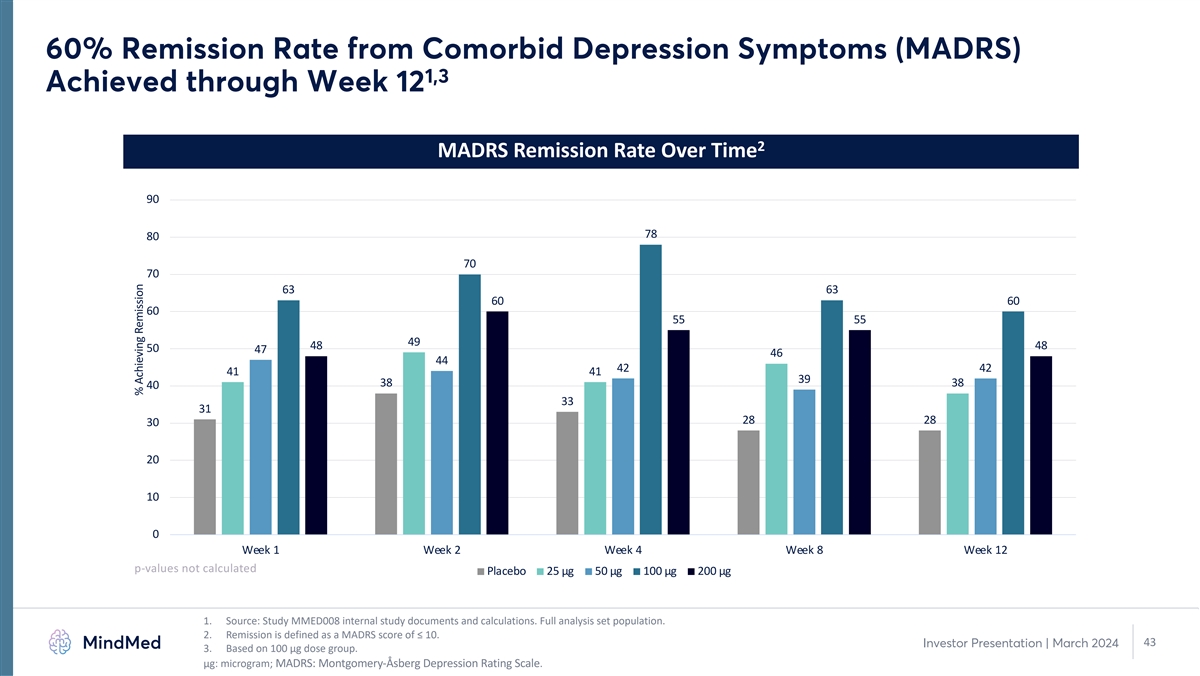
合併抑鬱症狀(MADRS)的緩解率為60% 1,3 在第 12 周達到 2 隨時間推移的 MADRS 緩解率 90 78 80 70 70 63 63 60 60 55 55 49 48 50 47 46 44 42 41 41 38 38 40 33 31 28 28 30 20 10 0 第 1 周第 4 周 12 p 值未計算安慰劑 25 µg 50 µg 100 µg 200 µg 1。來源:研究 MMED008 內部研究文件和計算。完整分析集合羣體。2.緩解是指MADRS分數≤10。43 投資者演示文稿 | 2024年3月 3.基於 100 µg 劑量組。μg:微克;MADRS:蒙哥馬利-阿斯伯格抑鬱症評級量表。實現緩解的百分比

1 所有劑量組中最常見 (≥ 10%) 的 TEAE MM120 耐受性良好 ,主要是短暫的、輕度至中度的不良事件 MM120 安慰劑 (n=39) 首選期限 25 µg 50 µg 100 µg 100 µg 200 µg (n=40) (n=40) (n=40) (%) AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT DD 幻覺 12 (31) 1 (2.6) 18 (45) 1 (2.5) 24 (60) 1 (2.5) 30 (75) — 3 (7.7) — 噁心 3 (7.7) — 11 (28) — 16 (40) 1 (2.5) 24 (60) 2 (5.0) 1 (2.6) 2 (5.1) 頭痛 4 (10) 2 (5.1) 9 (23) 2 (5.0) 10 (25) 4 (5) 10) 10 (25) 1 (2.5) 8 (21) 1 (2.6) 幻覺,視覺 6 (15) 1(2.6) 9 (23) — 9 (23) — 6 (15) — 1 (2.6) — 欣快情緒 2 (5.1) — 5 (13) — 11 (28) — 6 (15) — 1 (2.6) — 焦慮 1 (2.6) 3 (7.7) 3 (7.5) 3 (7.5) 4 (10) — 5 (13) 1 (2.5) — 2 (5.1) Mydriasis 1 (2.6) — 2 (5.1) mydriasis 1 (2.6) — 2 (5.1) 2.6 (2.6) — 1 (2.6)) — 7 (18) — 8 (20) — 4 (10) — 1 (2.6) — 多汗症 1 (2.6) — 4 (10) — 9 (23) — 5 (13) — — — 疲勞 2 (5.1) — 6 (15) 2 (5.0) 3 (7.5) 1 (2.5) 3 (7.5) 1 (2.5) — 1 (2.6) — 2 (5.0) — 2 (5.0) — 8 (20) — 2 (5.1) 1 (2.6) 血壓升高 3 (7.7) — 5 (13) — 4 (10) — 4 (10) — — — 頭暈 3 (7.7) — 2 (5.0) — 3 (7.5) — 5 (13) — 1 (2.6) — 震顫 —— 3 (7.5) — 2 (5.0) 1 (2.5) 8 (20) — — — 思維異常 1 (2.6) — 2 (5.0) — 4 (10) 1 (2.5) 5 (13) — — 1.來源:研究 MMED008 內部研究文件和計算。安全人羣。AFT:給藥日後;DD:給藥日;TEAE:治療緊急不良事件。44 投資者演講 | 2024 年 3 月
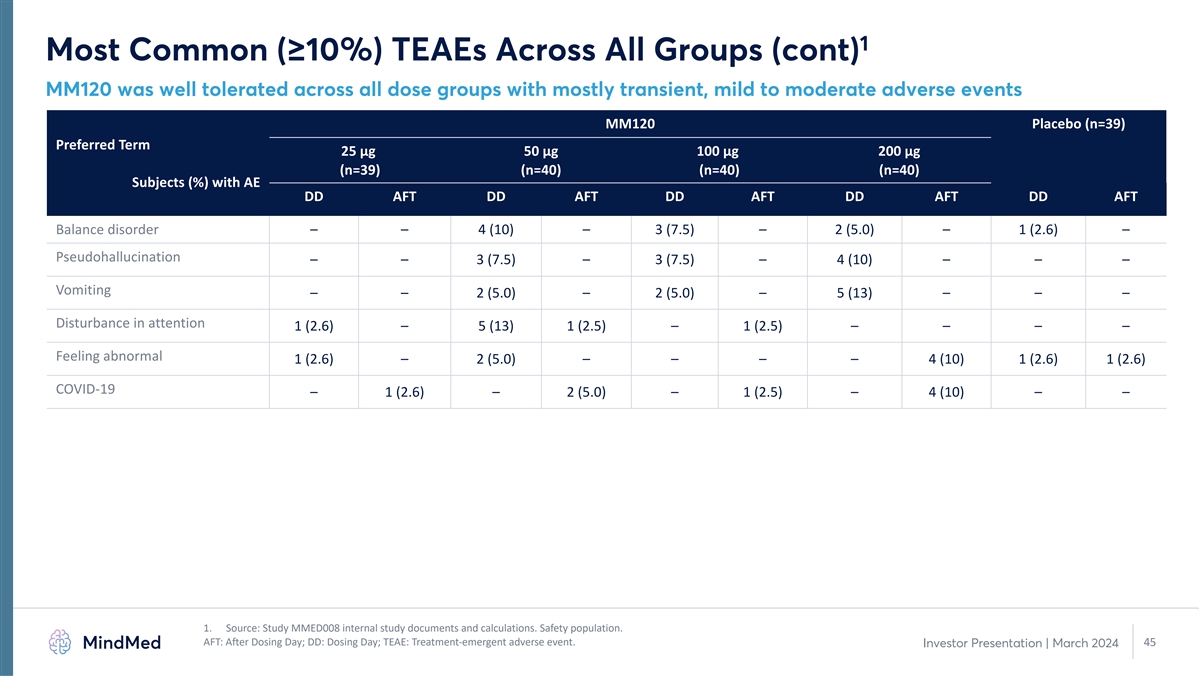
1 所有組中最常見(≥ 10%)TEAE(續)MM120 在所有劑量組中耐受性良好,主要是短暫的、輕度至中度的不良事件 MM120 安慰劑(n=39)首選術語 25 µg 50 µg 100 µg 100 µg 200 µg(n=39)(n=40)(n=40)(n=40)受試者(%)AE DD AFT DD AFT DD AFT DD AFT DD AFT DD AFT 平衡障礙 — — 4 (10) — 3 (7.5) — 2 (5.0) — 1 (2.6) — 假幻覺 — — 3 (7.5) — 4 (10) — — — 嘔吐 — — 2 (5.0) — 2 (5.0) — 5 (13) — 5 (13) — 1 (2.5) — 1 (2.5) — 1 (2.5) — — — 感覺異常 1 (2.6) — 2 (5.0) — — — — 4 (10) 1 (2.6) 1 (2.6) COVID-19 — 1 (2.6) — 2 (5.0) — 1 (2.5) — 4 (10) — — 1。來源:研究 MMED008 內部研究文件和計算。安全人羣。AFT:給藥日之後;DD:給藥日;TEAE:治療緊急不良 事件。45 投資者演講 | 2024 年 3 月