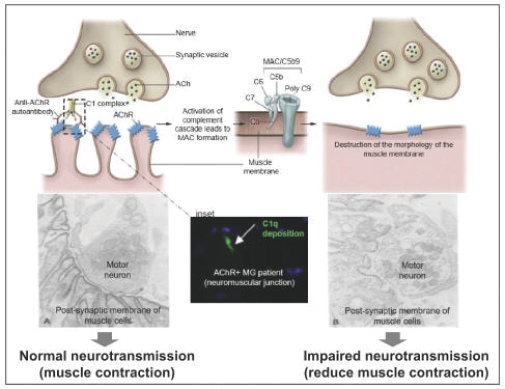
我們從未將候選產品商業化,可能缺乏必要的專業知識、人員和
資源來單獨或與合適的合作伙伴一起成功將候選產品商業化。
我們從未將候選產品
商業化,目前我們沒有銷售隊伍、營銷或分銷能力。為了實現候選產品的商業成功,我們可能會將其授權給其他人,我們可能會依賴這些合作者的幫助和指導。對於我們保留商業化權利和營銷批准的候選產品,我們必須建立自己的銷售、營銷和供應組織,或者將這些活動外包給第三方。如果獲得批准,
可能會影響我們將候選產品商業化的能力的因素包括招聘和保留足夠數量的有效銷售和營銷人員、制定足夠的教育和營銷計劃以提高公眾對我們批准的候選產品的接受度、確保我們的員工和第三方遵守適用的醫療保健法以及與創建獨立的銷售和營銷組織相關的其他不可預見的成本
。建立一個銷售和營銷組織將是昂貴和耗時的,而且可能會推遲候選產品的發佈。我們可能無法建立一個有效的銷售和營銷組織。如果我們
無法建立自己的分銷和營銷能力,或無法找到合適的合作伙伴將經批准的候選產品商業化,我們可能無法從中獲得收入,也無法達到或維持盈利能力。
我們從未完成過任何後期臨牀試驗,我們可能無法提交IND、CTA或其他監管機構批准申請,以
按照我們預期的時間表開始其他臨牀試驗,即使我們能夠這樣做,FDA、EMA或類似的外國監管機構也可能不允許我們繼續進行,並可能在試驗開始後暫停/終止試驗
。
We are early in our development efforts and will need to successfully complete later-stage and pivotal clinical
trials in order to obtain FDA, European Medical Agency (EMA), or comparable foreign regulatory approval to market our product candidates. Carrying out clinical trials and the submission of a successful IND or CTA is a complicated
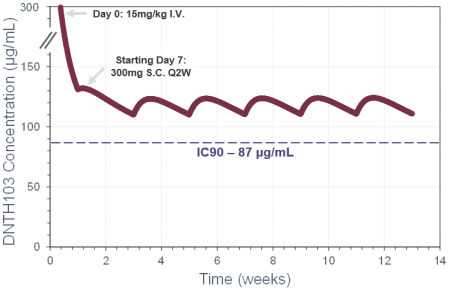
process. As an organization, we have limited experience in preparing, submitting and prosecuting regulatory filings. We remain on track to initiate a global Phase 2 clinical trial of DNTH103 in gMG in the first quarter of 2024, following receipt of
FDA clearance of our IND application. We also plan to submit a CTA in the European Union in the first quarter of 2024. In addition, pending clearance of the INDs and/or the CTAs that we plan to submit, we anticipate initiating Phase 2 clinical
trials of DNTH103 in patients with MMN in the second quarter of 2024 and CIDP in the second half of 2024. However, we may not be able to file the IND or CTA in accordance with our desired timelines. For example, we may experience manufacturing
delays or other delays with IND- or CTA-enabling studies, including with suppliers, study sites, or third-party contractors and vendors on whom we depend. Moreover, we
cannot be sure that submission of an IND or a CTA or submission of a trial to an IND or a CTA will result in the FDA or EMA or comparable foreign regulatory authorities allowing further clinical trials to begin, or that, once begun, issues will not
arise that lead us to suspend or terminate clinical trials. For example, upon submission of our IND or CTA for a Phase 2 clinical trial of DNTH103, the FDA or EMA may recommend changes to our proposed study designs, including the number and size of
registrational clinical trials required to be conducted in such Phase 2 programs. Consequently, we may be unable to successfully and efficiently execute and complete necessary clinical trials in a way that leads to regulatory submission and approval
of our product candidates. Additionally, even if regulatory authorities agree with the design and implementation of the clinical trials set forth in an IND or a CTA, such regulatory authorities may change their requirements in the future. The FDA,
EMA or comparable foreign regulatory authorities may require the analysis of data from trials assessing different doses of the product candidate alone or in combination with other therapies to justify the selected dose prior to the initiation of
large trials in a specific indication. Any delays or failure to file INDs or CTAs, initiate clinical trials, or obtain regulatory approvals for our trials may prevent us from completing our clinical trials or commercializing our products on a timely
basis, if at all. We are subject to similar risks related to the review and authorization of our protocols and amendments by comparable foreign regulatory authorities.
19