

2024 年 3 月 13 日 Larimar Therapeutics Leerink 演示套件

本演示文稿包含前瞻性陳述,這些陳述基於Larimar Therapeutics, Inc.(“公司”)的信念和假設以及管理層目前可獲得的信息。除歷史事實陳述外,本演示文稿中包含的所有陳述均為前瞻性陳述,包括但不限於Larimar開發和商業化nomlabofusp(CTI-1601)和其他計劃候選產品的能力、Larimar的計劃研發工作,包括其nomlabofusp臨牀試驗和總體發展計劃的時機以及與Larimar的業務戰略、籌集資金的能力、資本使用、經營業績有關的其他事項財務狀況以及計劃和目標未來的運營。在某些情況下,你可以通過這些術語或其他類似術語的 “可能”、“將”、“可能”、“應該”、“期望”、“打算”、“預測”、“相信”、“估計”、“預測”、“項目”、“潛在”、“繼續”、“持續” 或否定詞語或其他類似術語來識別前瞻性陳述,儘管並非所有前瞻性陳述都包含這些詞語。這些陳述涉及風險、不確定性和其他因素,這些因素可能導致實際業績、業績或成就與這些前瞻性陳述所表達或暗示的信息存在重大差異。這些風險、不確定性和其他因素包括Larimar產品開發活動、非臨牀研究和臨牀試驗的成功、成本和時機,包括nomlabofusp的臨牀里程碑和與美國食品藥品管理局的持續互動;初步臨牀試驗結果可能與最終臨牀試驗結果不同,早期的非臨牀和臨牀數據以及nomlabofusp的測試可能無法預測後來的臨牀試驗和評估的結果或成功;美國食品藥品管理局最終可能不會同意 Larimar 的觀點nomlabofusp 發展戰略;公共衞生危機對拉里瑪未來臨牀試驗、製造、監管、非臨牀研究時間表和運營以及總體經濟狀況的潛在影響;Larimar 和第三方製造商 Larimar 參與優化和擴展 nomlabofusp 製造流程的能力;Larimar 獲得 nomlabofusp 和未來候選產品的監管批准的能力;Larimar 發展銷售和營銷能力的能力,無論是單獨還是與潛在的未來合作者一起,以及成功將任何經批准的候選產品商業化;Larimar籌集必要資金以開展其產品開發活動的能力;以及Larimar向美國證券交易委員會(SEC)提交的文件中描述的其他風險,包括但不限於Larimar的定期報告,包括10-K表年度報告、10-Q表季度報告以及向美國證券交易委員會提交或提供並可用的8-K表最新報告在 www.sec.gov。這些前瞻性陳述是基於Larimar目前已知的事實和因素及其對未來的預測的組合,目前尚無法確定這些事實和因素。因此,前瞻性陳述可能不準確。本演示文稿中的前瞻性陳述僅代表拉里瑪管理層截至本文發佈之日的觀點。除非法律要求,否則Larimar沒有義務出於任何原因更新任何前瞻性陳述。前瞻性陳述

Nomlabofusp(CTI-1601)的 Topline 2 期數據陽性皮膚和頰細胞中組織弗拉他辛(FXN)水平的劑量依賴性增加 Nomlabofusp 在反覆皮下注射長達 28 天后,總體耐受性良好。參與者使用 50 mg 治療 14 天,然後每隔一天再治療 14 天,直到第 28 天皮膚細胞中的基線 FXN 水平

臨牀階段的新型蛋白質替代療法平臺主要候選藥物nomlabofusp(CTI-1601)是一種重組融合蛋白,旨在通過將蛋白質輸送到線粒體來直接解決弗裏德賴希共濟失調(FA)患者的frataxin缺乏問題。在一項為期4周的安慰劑對照的2期研究和一項多升劑量的1期研究中,Nomlabofusp被授予孤兒藥(美國和歐盟)、罕見兒科疾病(美國)、Fast Track(美國)和PRIME(歐盟)稱號,總體耐受性良好,表現出皮膚和口腔細胞中frataxin(FXN)水平與基線相比的劑量依賴性增加 2024年第一季度,預計將於2024年第四季度提供中期數據為了有可能增加OLE研究的劑量,來自2期研究的50 mg隊列的數據和OLE研究的可用數據將由於部分臨牀持有期限,已提交美國食品藥品管理局審查現金——截至23年12月31日預計為8,680萬美元*加上2024年2月公開發行的1.61億美元淨收益為2026年的潛在第一種提高弗拉他辛水平的療法第一和第二階段的研究結果一致的1期和2期研究結果打算加快批准使用短期催化劑的FDA OLE研究強勁的財務基礎*該估計未經審計,初步和實際結果可能因完成而有所不同我們的 2023 財年結算程序。因此,不應將這一估計視為我們根據美國公認會計原則編制的完整經審計的財務報表的替代品。美國食品和藥物管理局承認,FXN缺乏似乎對FA的致病機制至關重要,而且針對潛在疾病病理生理學的治療需求仍未得到滿足。支持加快批准的討論仍在進行中。BLA 的提交計劃於 2025 年下半年提交
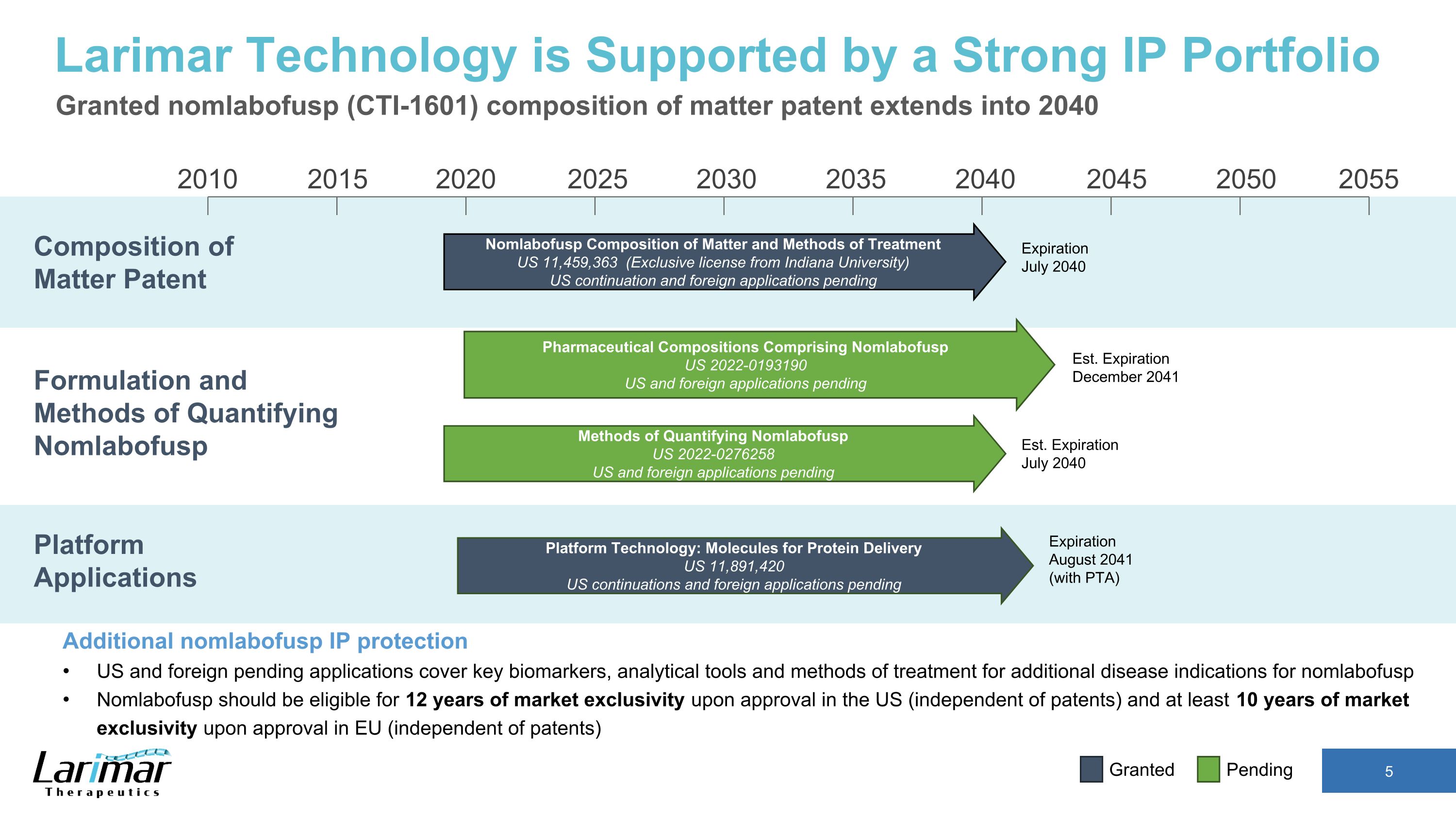
2015 2020 2030 2035 2040 2040 2045 2050 2055 2010 2025 Nomlabofusp 物質成分和處理方法 11,459,363 美元(印第安納大學獨家許可)美國延期申請和外國申請待於 2040 年 7 月到期的物質專利構成 Larimar Technology 由強大的知識產權組合支持 nomlabofusp (CTI-1601) 物質組成專利擴展至 2040 年 nomlabofusp 知識產權保護美國和外國待處理的申請涵蓋其他疾病的關鍵生物標誌物、分析工具和治療方法nomlabofusp 的適應症 Nomlabofusp 在美國獲得批准後應有資格獲得 12 年的市場獨家經營權(獨立於專利),在歐盟獲得批准後應有資格獲得至少 10 年的市場獨家經營權(獨立於專利)平臺應用配方和定量方法 Nomlabofusp 平臺技術:用於蛋白質輸送的分子美國 11,891,420 美國延續產品和外國申請,包括 Nomlabofusp 美國 2022-0193190 待處理的美國和外國申請量化方法 Nomlabofusp 美國 2022-0276258 美國和外國的申請正在等待美國東部標準時間美國東部標準時間 2041 年 12 月到期2040 年 7 月到期 2041 年 8 月到期(含 PTA)待批准

弗裏德賴希共濟失調(FA):一種罕見的進展性疾病 6 * E.C. Deutsch 等人。分子遺傳學與代謝 101 (2010) 238—245。根據組織、採樣技術和所考慮的化驗,大多數FA患者產生的frataxin水平僅為正常水平的20-40%左右*兩個等位基因的遺傳缺陷都會降低frataxin水平進行性疾病初期症狀包括姿勢不穩定和頻繁跌倒,患者最終只能在輪椅上預期壽命為30-50年,通常由心臟病引起的過早死亡影響全球約2萬名患者約有5,000名美國患者歐盟剩餘的大多數患者約 70% 的患者在 14 歲之前就診未獲批准的療法增加 frataxin 水平只有獲準用於 FA 的治療才能解決弗拉他辛缺乏的問題
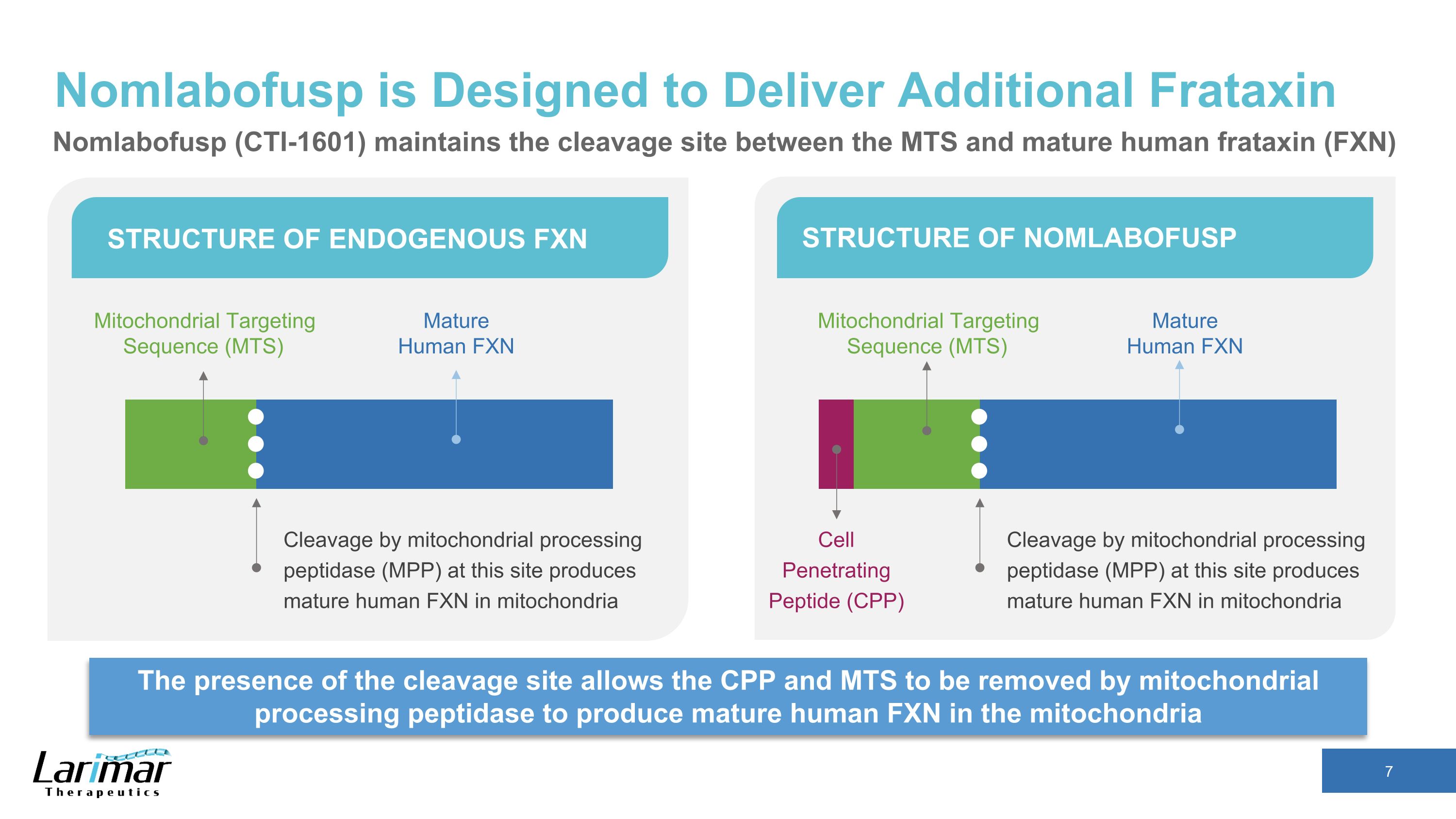
Nomlabofusp 旨在提供額外的 Frataxin 裂解位點的存在允許線粒體處理肽酶去除 CPP 和 MTS,在內源性 FXN 結構的線粒體結構中產生成熟的人類 FXN 通過線粒體處理肽酶 (MPP) 在該位點進行切割 NOMLABOFUSP Cleavage 產生成熟的人類 FXN 線粒體中的線粒體靶向序列 (MTS) 通過線粒體處理肽酶 (MPP) 進行成熟人類 FXN Cleavage 在此位點在線粒體中產生成熟人類 FXN 成熟人類 FXN 細胞穿透肽 (CPP) 線粒體靶向序列 (MTS) Nomlabofusp (CTI-1601) 維持 MTS 和成熟人類 frataxin (FXN) 之間的裂解位點
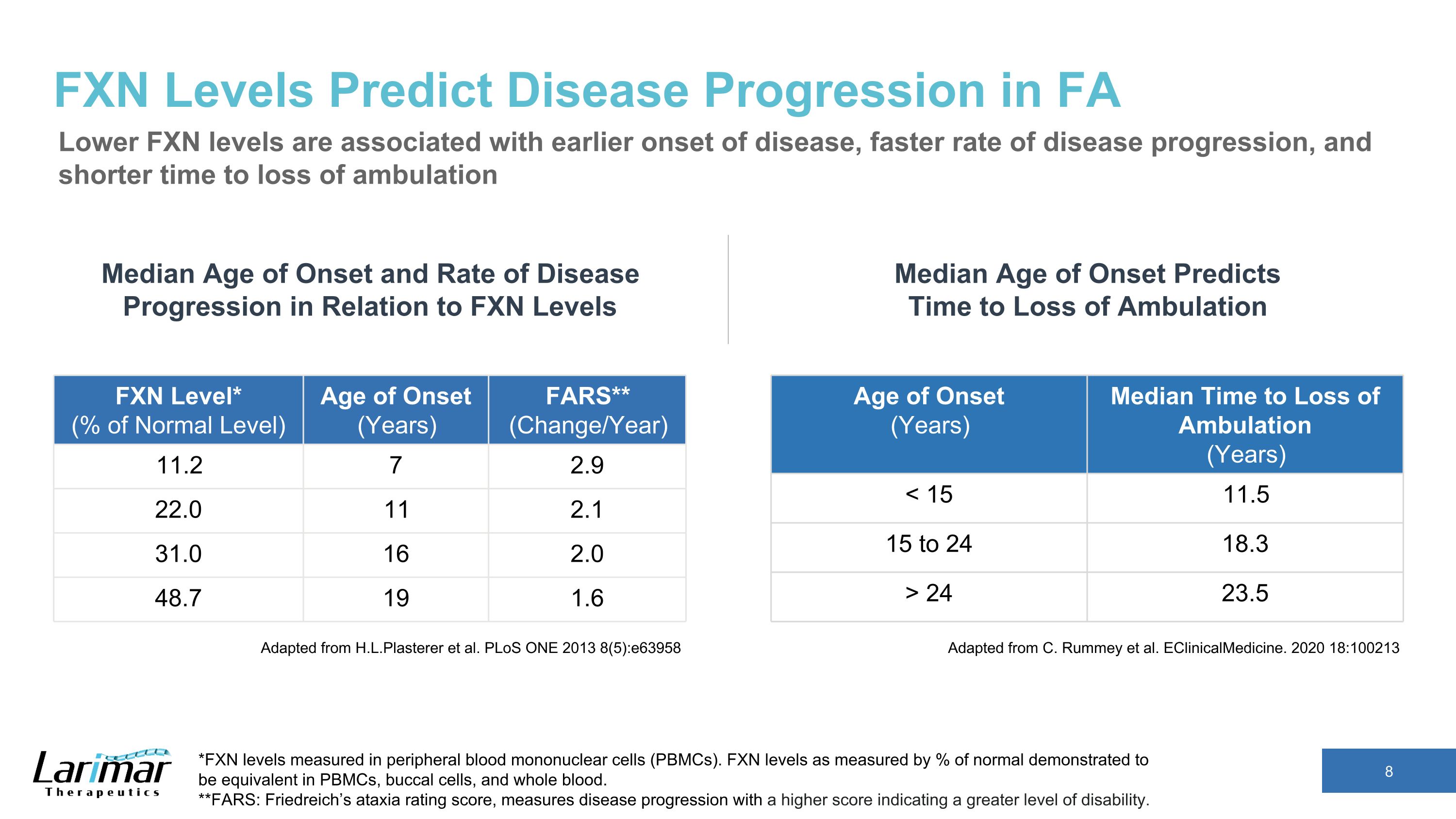
FXN 水平可預測 FA 中的疾病進展較低的 FXN 水平與較早發病、更快的疾病進展速度和更短的喪失行動時間有關。改編自 H.L.Plasterer 等人。PloS ONE 2013 8 (5): e63958 發病年齡(年)中位數無法行走的時間(年)24 23.5 發病年齡和疾病進展速度與FXN水平的平均發病年齡和進展速度 *以外周血單核細胞(PBMC)測得的FXN水平。以正常水平的百分比衡量的 FXN 水平被證明在 PBMC、口腔細胞和全血中是相同的。**FARS:弗裏德賴希的共濟失調評級分數用於衡量疾病進展,分數越高表示殘疾程度越高。FXN 級別*(正常水平的百分比)發病年齡(年)FARS**(變化/年)11.2 7 2.9 22.0 11 2.1 2.1 31.0 16 2.0 2.0 16 2.0 2.0 2.0 2.0 2.0 2.0 48.7 19 1.6 改編自 C. Rummey 等人。eClinicalMedicine. 2020 18:100213 發病年齡中位數預測了停止行走的時間

針對 25 和 50 mg 隊列的 2 期劑量探索研究目標:進一步表徵 PK/PD 並評估安全性,為長期劑量和劑量方案治療時間表提供信息-nomlabofusp (CTI-1601) 或安慰劑 28 天治療期 16 17 18 19 15 20 21 22 23 24 25 26 27 28 2 3 4 5 1 6 7 8 9 10 11 12 13 14 = 皮下給藥 nomlabofusp (CTI-1601) 或安慰劑 = 無給藥研究詳情人羣流動和非流動性弗裏德賴希共濟失調患者 ≥18 歲 Nomlabofusp (CTI-1601) 治療天真或參與過(如果符合條件)先前的 Larimar 研究劑量隊列 1:25 mg 隊列 2:50 mg 關鍵終點外周組織中的弗拉他辛水平、PK、安全性和耐受性;其他探索性終點包括脂質和基因表達水平患者人數 1:入組 13 名參與者(9 名服用 nomlabofusp;4 名使用安慰劑)隊列 2:入組 15 名參與者(10 名服用 nomlabofusp;5 名服用安慰劑)
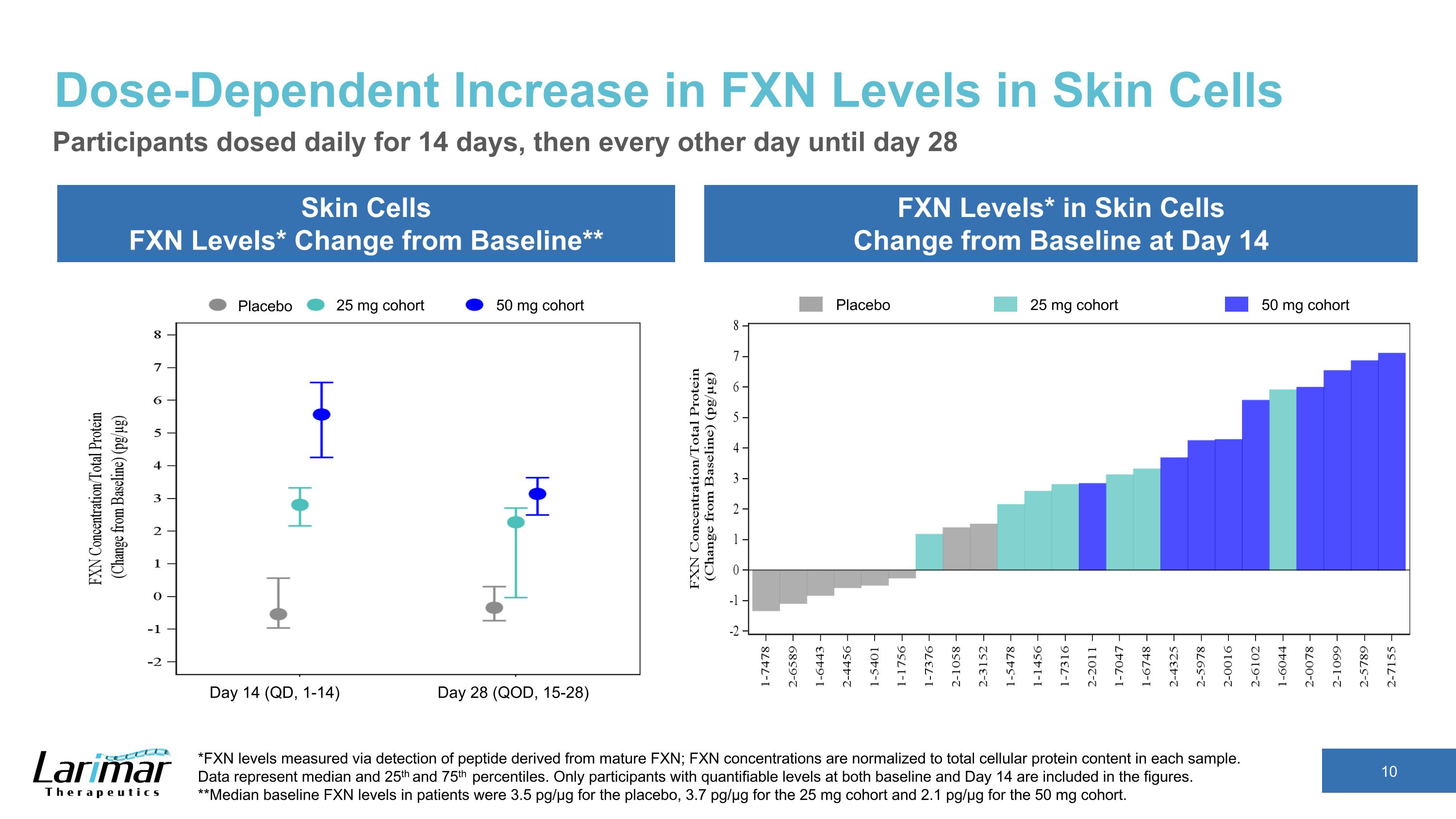
皮膚細胞中 FXN 水平的劑量依賴性增加皮膚細胞 FXN 水平* 與基線相比** FXN 水平*變化參與者在第 14 天每天給藥 14 天,然後每隔一天給藥一次,直到第 28 天 *FXN 水平通過檢測源自成熟 FXN 的肽測量;FXN 濃度歸一化為每個樣本中的細胞蛋白總含量。數據代表中位數、第 25 和第 75 個百分位數。數字中僅包括基線和第14天均具有可量化水平的參與者。**安慰劑患者的基線FXN水平中位數為3.5 pg/µg,25 mg隊列的3.7 pg/µg,50 mg隊列的2.1 pg/µg。安慰劑 25 mg 隊列 50 mg 隊列安慰劑 25 mg 隊列 50 mg 隊列第 14 天(QD,1-14)第 28 天(QD,15-28)
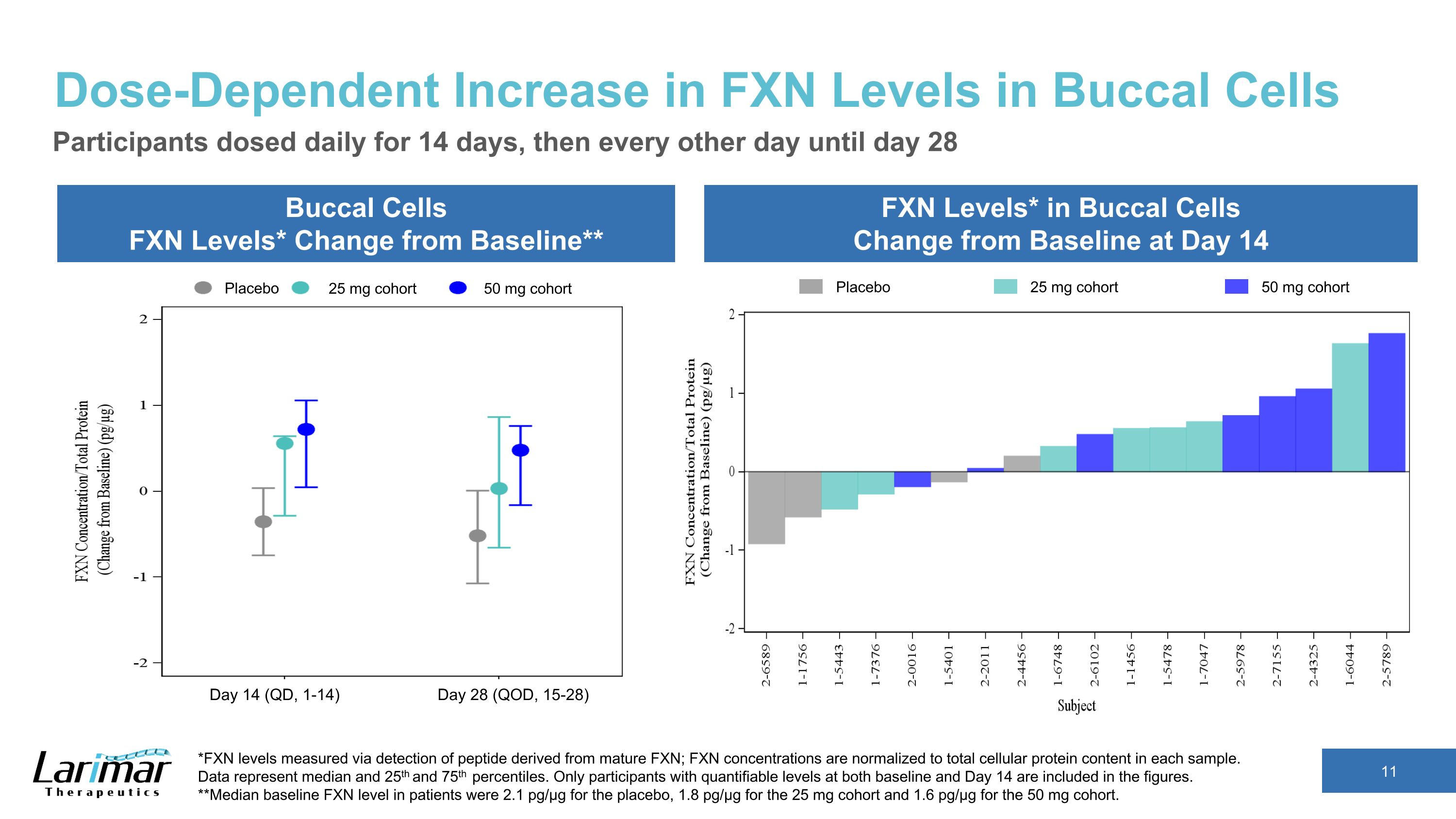
口腔細胞中FXN水平的劑量依賴性增加口腔細胞FXN水平*與基線的變化**口腔細胞中的FXN水平*與基線的變化參與者在第14天每天給藥14天,然後每隔一天給藥直到第28天*通過檢測源自成熟FXN的肽測得的FXN水平;FXN濃度歸一化為每個樣本中的細胞蛋白總含量。數據表示中位數以及第 25 和第 75 個百分位數。數字中僅包括基線和第14天均具有可量化水平的參與者。**安慰劑患者的基線FXN水平中位數為2.1 pg/µg,25 mg隊列的1.8 pg/µg,50 mg隊列的1.6 pg/µg。安慰劑 25 mg 隊列 50 mg 隊列安慰劑 25 mg 隊列 50 mg 隊列第 14 天(QD,1-14)第 28 天(QD,15-28)
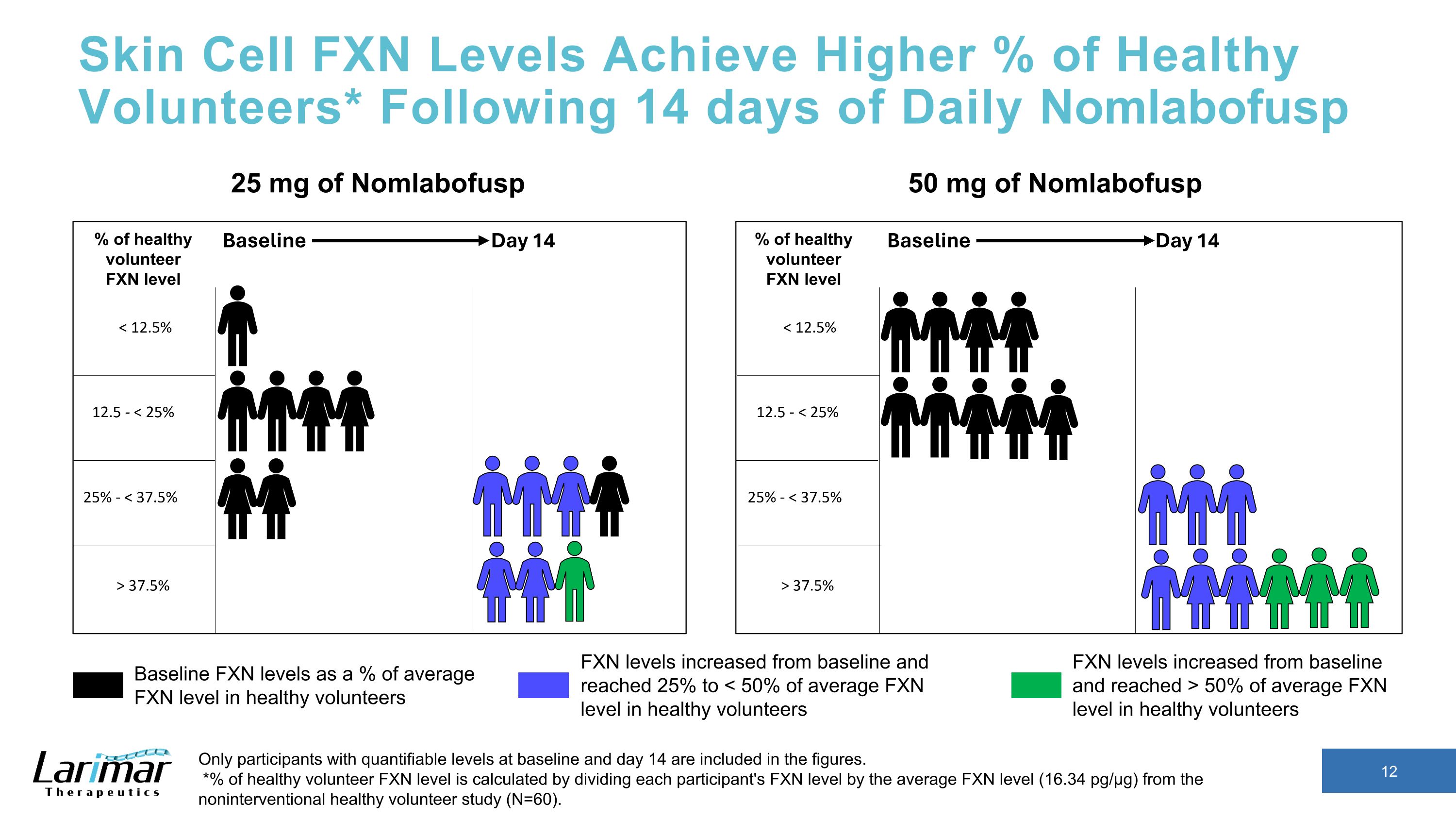
皮膚細胞 FXN 水平達到更高的健康志願者百分比* 每日 Nomlabofusp 14 天后,數字中僅包含基線和第 14 天可量化水平的參與者。*健康志願者 FXN 水平的百分比是通過將每位參與者的 FXN 水平除以非介入性健康志願者研究(N = 60)的平均 FXN 水平(16.34 pg/µg)計算得出。25 mg Nomlabofusp 50 mg 的 Nomlabofusp 基線 FXN 水平佔健康志願者平均 FXN 水平的百分比 FXN 水平高於基線,達到平均 FXN 水平的 50% 以上健康志願者 FXN 水平從基線提高到 25% 至
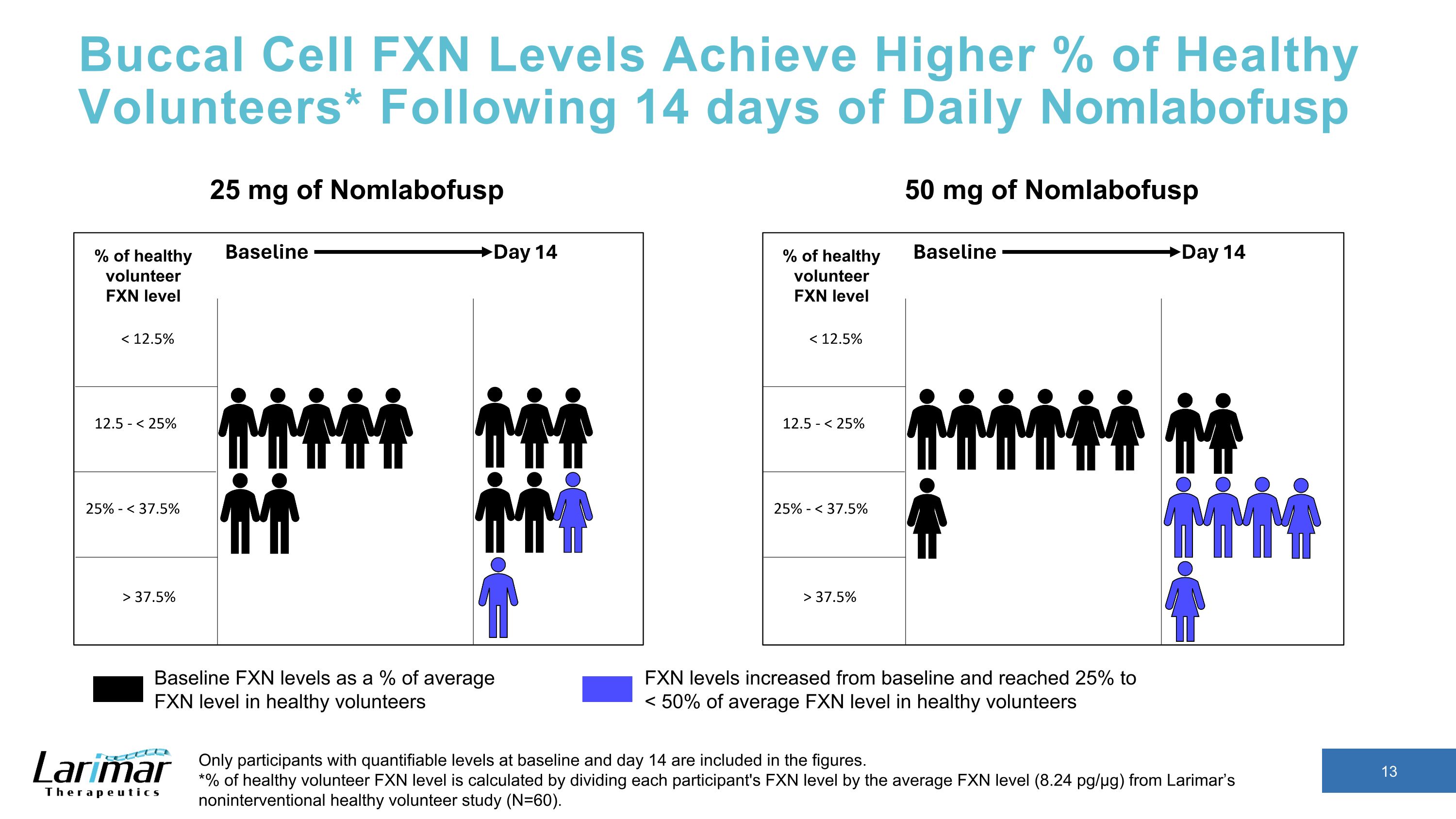
口腔細胞 FXN 水平達到更高的健康志願者百分比* 在每日服用 Nomlabofusp 14 天后,數字中僅包含基線和第 14 天可量化水平的參與者。*健康志願者 FXN 水平的百分比是通過將每位參與者的FXN水平除以拉里瑪非幹預性健康志願者研究(N = 60)中的平均FXN水平(8.24 pg/µg)計算得出。50 mg Nomg labofusp 基線 FXN 水平佔健康志願者平均 FXN 水平的百分比 FXN 水平從基線上升並達到 25% 至

Nomlabofusp:可預測的藥代動力學皮下給藥後快速吸收 1 2 3 觀察到的暴露量與劑量成比例的增加 cc 藥代動力學特徵與 1 期研究一致

Ph1 和 Ph2 數據:Nomlabofusp 的耐受性總體良好 46 名服用 nomlabofusp 的臨牀試驗參與者中,有 44 名完成了各自的研究 25 mg 隊列中的一名 2 期參與者因過敏反應通過標準治療而退出 50 mg 隊列中的一期受試者因輕度至中度噁心和嘔吐而退出 61 名患者參與了我們的 1 期和 2 期研究,沒有出現任何嚴重的不良事件 labofusp 臨牀研究。一種嚴重的不良事件(過敏反應通過下文提及的標準治療得到緩解)。最常見的不良事件(AE)為輕度和中度注射部位反應(ISR)。沒有因ISR而中止研究,且均已解決
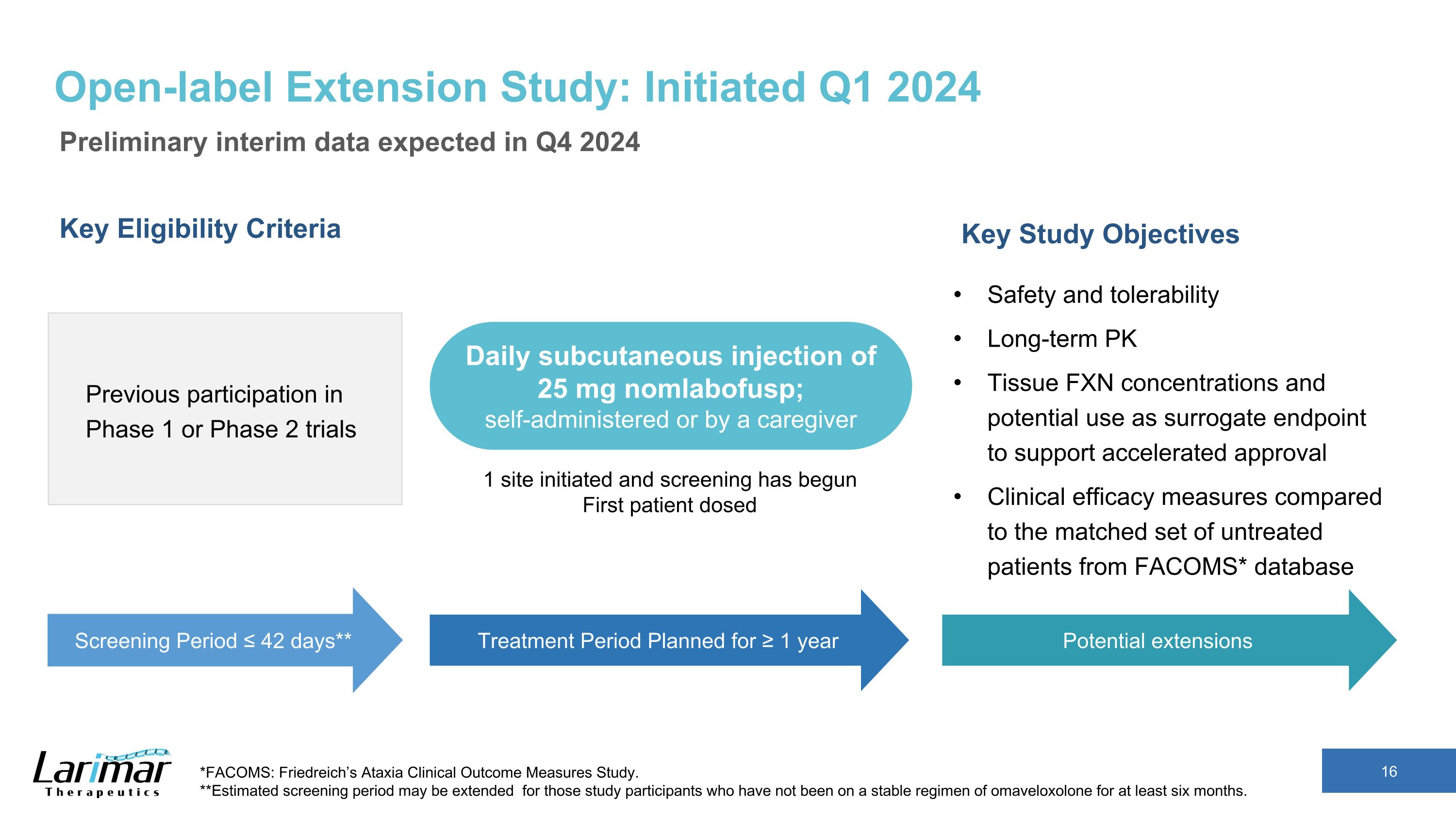
開放標籤延期研究:2024年第一季度啟動初步中期數據預計將於2024年第四季度公佈關鍵資格標準先前參與的1期或2期試驗關鍵研究目標安全性和耐受性長期PK組織FXN濃度以及可能用作替代終點以支持加快批准的替代終點與FACOMS*數據庫中未經治療的患者相比臨牀療效衡量標準*FACOMS:弗里德里希的共濟失調臨牀結果衡量研究。**對於那些至少六個月未接受穩定奧馬維洛索龍療法的研究參與者,預計的篩查期可能會延長。篩查期 ≤ 42 天** 治療期計劃為 ≥ 1 年每日皮下注射 25 mg nomlabofusp;自行給藥或由護理人員注射 1 個部位已啟動篩查已開始第一位患者給藥潛在延期
Nomlabofusp臨牀開發計劃計劃進行全球雙盲安慰劑對照註冊/確認研究**計劃將2至17歲的兒科患者納入臨牀開發*打算加快批准途徑,計劃於2025年下半年提交BLA*公司正在與美國食品藥品管理局討論哪些額外的成人臨牀試驗數據將為將2至17歲的兒科患者納入我們的研究提供依據。**公司已開始與美國食品和藥物管理局討論可能使用FXN級別來支持加速批准的問題。此外,該公司正計劃與美國以外的監管機構和調查人員進行討論,將臨牀項目擴展到國際地區。由於部分臨牀擱置,其他美國臨牀試驗的啟動取決於美國食品藥品管理局對臨牀數據的審查。正在進行的開放標籤延期研究,針對參與SAD、MAD和/或四周劑量探索研究的符合條件的患者,每日劑量為25 mg OLE BLA提交的目標是2025年下半年有資格參與長期研究的參與者提交初步數據

2024年第一季度監管更新:2024年第四季度OLE研究的首位患者給藥:來自OLE研究的初步數據;啟動於2024年第一季度2024年下半年:最終的2期數據計劃在2025年下半年的會議上公佈:BLA提交的2024/2025年裏程碑一致的第1期和第2期研究結果已開始與FDA討論使用FXN作為替代終點以支持加快批准打算加快批准並可能在2025年下半年提交BLA的準備工作將nomlabofusp臨牀項目擴展到美國以外的地區,Nomlabofusp總體上表現良好在長達 4 周的測試劑量下耐受受評估組織(皮膚和口腔細胞)中 FXN 水平與基線相比的劑量依賴性增加 50 mg 隊列中皮膚細胞中的基線 FXN 水平為

謝謝 Larimar Therapeutics Leerink 演示套件 2024 年 3 月 13 日