附錄 99.2 關於推進下一波針對 炎性疾病的重點藥物浪潮 2024 年 1 月 ©2024 THIRD HARMONIC BIO

前瞻性陳述本演示文稿包含前瞻性 陳述,這些陳述是根據1995年《私人證券訴訟改革法》的安全港條款作出的。本演示文稿中任何非歷史事實陳述的陳述,包括 關於我們的信念和期望的陳述,均為前瞻性陳述,應據此進行評估。前瞻性陳述包括有關 THB335 的預期概況、療效和靶向適應症、 完成 THB335 IND-毒理學研究的預期時間、THB335 候選藥物臨牀和非臨牀研究的預期開發和時間表以及提交 THB335 IND 申請的預期時間的信息。這些陳述通常包含諸如 之類的詞語,如 “預期”、“期望”、“建議”、“計劃”、“相信”、“打算”、“估計”、“目標”、“項目”、“應該”、“可能”、“可能”、“將”、“預測” 和其他類似的表達。這些前瞻性陳述包含在本演示文稿中。這些前瞻性 陳述的依據是我們當前的預期、計劃和假設,這些預期、計劃和假設是根據我們的行業經驗,以及我們對歷史趨勢、當前狀況、預期未來發展以及我們 認為在當時情況下合適的其他因素的看法。在閲讀和考慮本演示文稿時,您應該明白,這些陳述並不能保證未來的表現或結果。前瞻性陳述受 約束,涉及風險、不確定性和假設,您不應過分依賴這些前瞻性陳述。儘管我們認為這些前瞻性陳述是基於發表時的合理假設,但 您應該意識到,許多因素可能會影響我們的實際業績或經營業績,並可能導致實際業績與前瞻性陳述中表達的業績存在重大差異。可能對這類 前瞻性陳述產生重大影響的因素包括:我們的運營歷史有限,我們在第一階段之後沒有完成任何臨牀試驗,也沒有批准任何候選產品進行商業銷售;我們自 成立以來蒙受的鉅額淨虧損以及在可預見的將來可能蒙受額外損失;我們對大量額外資金的需求;我們項目的早期開發階段以及它們在開發中可能失敗的可能性;我們的未來 性能基本上是取決於我們識別和開發未來候選產品的能力;法律和監管風險;以及與知識產權相關的風險等。我們於2023年11月9日向美國證券交易委員會提交的截至2023年9月30日的三個月的10-Q表季度報告以及我們在美國證券交易委員會 的其他文件(可在我們網站的投資者與媒體頁面 https://ir.thirdharmonicbio.com/ 和美國證券交易委員會網站www.sec.gov上查閲)中,在 “風險因素” 標題下更全面地描述了可能影響我們 財務業績和業務的其他風險和不確定性。您不應將這些警示性陳述解釋為詳盡無遺, 僅在本演示之日作出。除非適用法律要求,否則我們沒有義務更新或修改任何前瞻性陳述,無論是由於新信息、未來事件還是其他原因。本演示文稿 還包含獨立方和我們提供的與市場規模和增長相關的估計和其他統計數據,以及有關我們行業的其他數據。這些數據涉及許多假設和限制,提醒您不要 過分重視此類估計。此外,對我們未來表現的預測、假設和估計以及我們經營的市場的未來表現必然受到高度的不確定性和風險的影響。本 演示不應構成出售要約或徵求購買這些證券的要約,在根據任何此類州或司法管轄區的證券法進行註冊或獲得資格認證之前,在任何州或司法管轄區出售此類證券是非法的 ,也不得在任何州或司法管轄區出售這些證券。2

近期要聞任命克里斯·墨菲為首席財務和商業 官 IND 支持的 THB335 毒理學研究即將完成 IND 前與美國食品藥品管理局的互動有望在 24 年上半年提交美國 IND 並啟動 THB335 的 1 期研究。截至 2023 年 9 月 30 日,現金和現金 等價物總額為 2.739 億美元 3

Third Harmonic Bio:專注於KIT抑制以治療肥大 細胞介導的炎症性疾病大型成熟試劑盒:一種新穎的選擇性市場,具有高度臨牀驗證的 “PIPELINE-IN-A-TARGET” 口服試劑盒未得到滿足需要靶向抑制劑潛在肥大細胞介導的疾病數百萬患者 正在進行臨牀驗證高度選擇性口服小劑量重度肥大細胞介導的分子潛在的變革性靶標具有吸引力有機會選擇一系列疾病的治療;儘管如此,殘留 需求仍然很高肥大細胞介導的疾病可優化治療指數,與炎症性疾病注射劑相比,經皮膚、氣道和胃腸道多項批准的產品為患者提供了便利 4

肥大細胞是炎症的支點當前的治療方法 在機制上受到限制許多激活劑肥大細胞許多介質 IgE 抗原受體結合激動劑預製介質奧馬珠單抗 IgE 組胺抗組胺受體補體 IL-4、IL-13 杜皮魯單抗神經肽 TNF、GM-CSF 脱顆粒微生物產品蛋白酶細胞因子血清素 TSLP 肝素 Tezepelumab 趨化因子新合成的物理活化劑介質温度前列腺素壓力白三烯抗白三烯細胞因子組胺趨化因子 細胞-細胞接觸神經肽 PAF、自由基淋巴細胞配體最佳幹預點肥大細胞本身 5

KIT 是肥大細胞功能和存活的主要調節劑 抑制 KIT 的細胞內小分子方法具有多種潛在的治療優勢 KIT SCF 二聚體 • 肥大細胞增殖、遷移、激活和存活的主調節劑 KIT 受體 • KIT 抑制驅動 肥大細胞失活二聚和耗盡 P P P P Small P P 細胞內小分子 P 分子P 抑制 • 治療指數優化的潛力 Ras/Raf/Mek/Erk JAK2/STAT PLC PI3K/AKT 函數, 生長、分化、存活,脱顆粒趨化性、細胞因子產生 • 為患者和醫療實踐提供便利 • 避免 MAB 介導的肥大細胞激活/過敏反應的風險 6

第一代 THB001 口服 KIT 抑制劑的臨牀結果 7

第一代候選產品:THB001 早期結果支持口服 KIT 抑制的潛力,為下一代開發提供信息 THB001 1 期研究結果:• THB001 在多項非臨牀治療結束研究中顯示出高效、劑量依賴性的血清胰蛋白酶選擇性快速降低
模型療效 10% • 1a 期 14 天健康志願者研究完成 -30% — THB001 血漿暴露的劑量依賴性增加血清胰蛋白酶降低 -70% — 血液學中輕度降低
參數和頭髮顏色變化與 KIT 的靶向效果一致 -110% 抑制 0 5 10 15 20 研究日 • 14 天的研究結果在很大程度上預測了 12 周的 PBO 400mg BID
500mg QD FED 研究 200mg QD 200mg BID PBO = 安慰劑;與基線的平均變化百分比,使用 “0” 作為數值計算
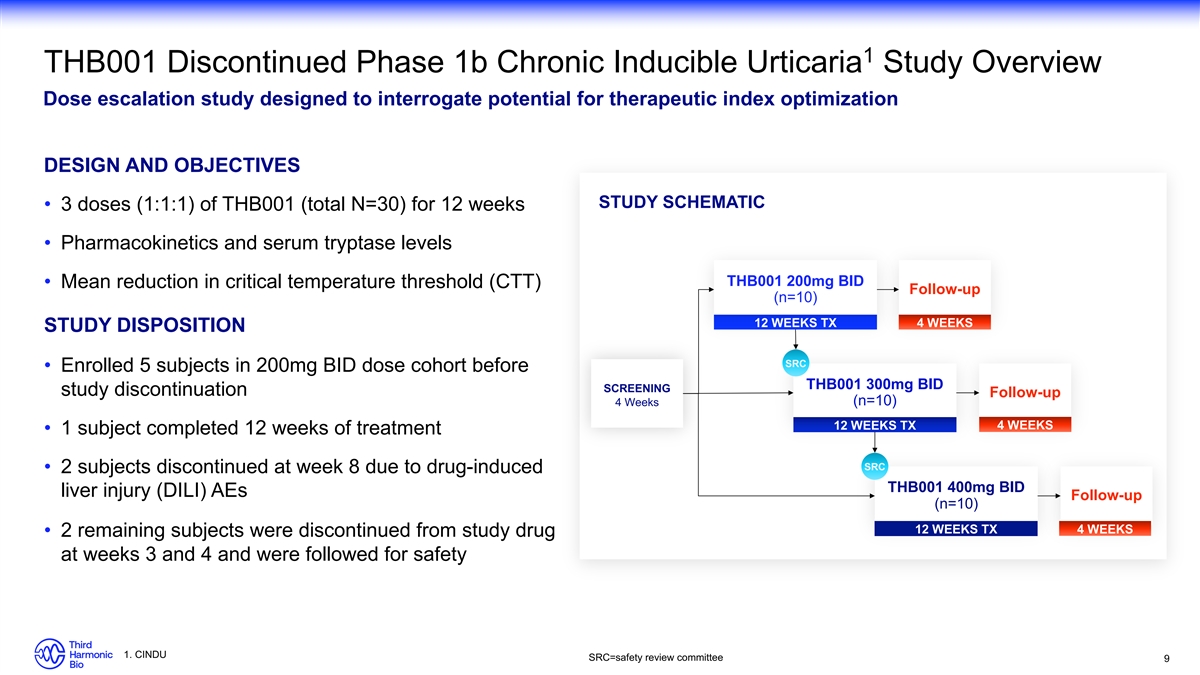
1 THB001 已停止的 1b 期慢性誘發性蕁麻疹研究
概述劑量遞增研究旨在探討治療指數優化設計和目標研究示意圖 • 3 劑(1:1:1)THB001(總計 N=30),持續 12 周 • 藥代動力學和血清胰蛋白酶水平
THB001 200mg BID • 臨界温度閾值 (CTT) 隨訪平均值 (n=10) 12 周 TX 4 周研究處置 SRC • 在 THB001 300mg BID 篩查研究中止之前,在 200 mg BID 劑量隊列中招收了 5 名受試者
隨訪 4 周(n=10)) 12 周 TX 4 周 • 1 名受試者完成了 12 周的治療 SRC • 2 名受試者因藥物誘發的 THB001 400mg BID 肝損傷 (DILI) AEs 隨訪 (n=10) 12 周 TX 4 周 • 其餘 2 名受試者在第 3 周和第 4 周停用研究藥物,並接受了安全性 1 的隨訪。CINDU src=s https://www.sec.gov/Archives/edgar/data/1923840/000119312524001929/afety 審查委員會 9
THB001 處於 1b 期 CINDU 研究安全摘要 THB001 血液學
隨時間推移按受試者分列的血紅蛋白和中性粒細胞計數血紅蛋白 (g/dL) 16 • 無嚴重或嚴重不良事件 (AE) ULN 基線 15 • 兩個中度轉氨炎在隨訪 LLN 12 的第 17 周和第 25 周消退 •
所有其他不良反應均為輕度 11 11 中性粒細胞 abs。(/cmm) — 總體概況與 1a 7000 ULN 6000 期研究中觀察到的 8000 個 KIT 抑制效果一致(例如,頭髮顏色變化)5000 4000 — 血液學特徵
與 1a 期和 3000 LLN 2000 相似,觀測值趨於穩定為 1000 1000 預計值 -10 0 10 20 30 40 50 60 70 80 90 100 110 120 研究日基線治療對象:受試者 1 受試者 2 受試者 3 主題 4 主題 5 10
血清胰蛋白酶 µg/L THB001 在第 1b 期研究中以最低計劃
劑量產生反應 5 名受試者中 4 名達到了部分(n=2)或完全(n=2)臨界温度閾值反應對象 1 >> 受試者 2>> 受試者 3>> 受試者 4 >> 受試者 5 >> 部分反應完全反應完全反應 7 6 23 5 18 4 3 13 2 8 1 3 0 研究日 0 20 40 60 80 100 0 20 40 60 80 100 0 20 40 60 80 100 0 20 40 60 80 100 0 20 40 60 80 100 100 基線治療後處理 • 快速降低胰蛋白酶:-83%
到第 1 周與基線相比的平均變化與 1a 期結果基本一致 • 血清胰蛋白酶減少與臨牀反應之間存在很強的相關性,與其他已公佈的蕁麻疹臨牀數據一致 • 儘管研究提前終止,仍有 4/5 名患者獲得了
臨牀反應
瞭解 THB001 對肝臟的影響機械理解
允許區分下一代候選藥物進行了表徵 THB001 的肝臟代謝和表型效應的研究採用綜合方法:• 評估脱靶生物學負債的證據 •
特徵肝臟代謝和反應性代謝物形成的可能性 • 在先進肝臟測試系統中確定與 THB001 相關的表型效應應用於下一代化合物篩選和候選物
選擇 12
THB001 顯示有毒活性代謝物形成的證據
機械研究的三項發現為觀察到的轉氨炎提供了潛在的基礎 14 [ C]THB001 在人體肝臟微粒體中形成共價蛋白加合物 • 研究確定了人血漿中的主要代謝物,該代謝物是通過
活性中間體形成的,即人血漿中存在較高水平的代謝物 p
下一代口服 KIT 抑制劑 THB335 14
THB335 強效和選擇性小分子 KIT 抑制劑保持了 THB001 的
激酶抑制特徵,但缺乏反應性代謝物形成的證據。比較關鍵激酶和代謝途徑參數 THB335 KinomeScan THB001 THB335 467 項分析測試了 8 種相互作用映射的試劑盒 IC 23 nM 9.5 nM 50 pdgFRA 選擇性 >100 倍控制 0% CSF1R 選擇性 65 倍 >100 倍試劑盒 0.1% 脱靶細胞活力 0.1% 0.1-1% 在 3 µM 時的影響 1-5% 5-10% 腦血漿比 0.9 至 1.2 35% 反應性
中間體是不是代謝物谷胱甘肽加合物的形成是否 KinomeScan 在 nanoBRET 確定的 100 nM THB335 試劑盒和 CSF1R IC 下完成。PDGFRIC 由均勻的時間分辨熒光 (HTRF) 確定。分別評估了依賴於 CSF1R 和 PDGFRβ 的
細胞系的活力。50 50 15
THB335 在非臨牀模型中表現出良好的非臨牀特徵 THB335 MAST CELL
DELUTION THB335 PK 為期 14 天的非 GLP 毒理學研究(口服)皮膚(耳)腸(空腸)肺(胸膜)10000 p
Third Harmonic Bio 下一步行動將 THB335 推向臨牀
,着眼於特許經營擴張 • THB335 美國 IND 申請和臨牀試驗有望在 24 年上半年啟動 • 將慢性自發性蕁麻疹作為初步臨牀適應症 • 計劃在 2 期擴展到
其他肥大細胞介導的炎症性疾病 • 藥物化學,下一代努力繼續支持管道內靶向潛力 • 選擇性評估擴張的業務發展機會
投資組合 • 保持專注運營戰略 • 截至2023年9月30日的現金及現金等價物為2.739億美元 17
下一波治療炎症性疾病的藥物
18