

附錄 99.1 開發治療癌症的精準藥物 來自 KOMET-007 的初步數據 — 2024 年 1 月 30 日

歡迎和介紹特洛伊·威爾遜博士、法學博士 — Kura Oncology 總裁 兼首席執行官

前瞻性陳述本演示文稿包含前瞻性 陳述。此類聲明包括但不限於有關我們的研究、臨牀前和臨牀開發活動、齊夫託美尼、替匹法尼和 KO-2806 的計劃和預計時間表、監管 申報計劃、我們對候選產品相對於競爭療法相對優勢的預期、我們對候選產品治療和商業潛力的預期、我們對現金 跑道的期望以及我們對預期用途的預期的淨收益的私募於 2024 年 1 月 26 日結束。“相信”、“可能”、“應該”、“將”、 “估計”、“承諾”、“計劃”、“繼續”、“預期”、“打算”、“預期”、“潛在” 等詞語以及類似的表達(包括其否定性), 旨在識別前瞻性陳述。由於此類陳述受風險和不確定性的影響,因此實際結果可能與此類前瞻性陳述所表達或暗示的結果存在重大差異。導致前瞻性陳述 不確定性的風險包括:我們的臨牀前研究和臨牀試驗可能不成功;美國食品藥品監督管理局(FDA)可能不同意我們對 候選產品臨牀試驗數據的解釋;我們可能會決定,或者 FDA 可能要求我們進行額外的臨牀試驗或修改正在進行的臨牀試驗;我們可能會延遲開始、註冊、完成或分析 我們的候選產品的臨牀測試,或可能會出現與我們的臨牀試驗設計充分性或臨牀試驗執行有關的重大問題,這可能會導致成本增加和延遲,或限制我們獲得監管機構 批准的能力;臨牀試驗的開始、註冊和完成以及從中報告數據;COVID-19 疫情可能會干擾我們和我們所依賴的第三方的業務,包括延遲或以其他方式幹擾 我們的臨牀試驗和臨牀前研究、製造和供應鏈,或損害員工生產力;我們的候選產品可能無法獲得監管部門的批准或成功商業化;我們的候選產品出現意想不到的不良副作用或 療效不足可能會延遲或阻礙監管部門的批准或商業化;我們可能無法獲得額外的融資;與私募相關的市場狀況和成交條件滿意度相關的風險;與我們的現金需求相關的風險;以及與我們的業務和總體財務相關的風險和不確定性。額外的風險和不確定性可能會不時出現,庫拉的管理層不可能預測所有的風險因素和不確定性。本演示文稿中包含的所有前瞻性陳述僅代表其發表之日。 在我們向美國證券交易委員會提交的文件中更全面地描述了影響我們的其他風險和不確定性。我們沒有義務更新此類聲明以反映在聲明發表之日後發生的事件或存在的情況。本演示文稿 還包含從第三方獲得並由第三方編制的統計和臨牀數據。提醒收件人不要過分重視此類披露。在本演示之日之後,公司或任何其他人均未對此類數據的準確性或 完整性作出任何陳述,也沒有承擔任何更新此類數據的義務。3
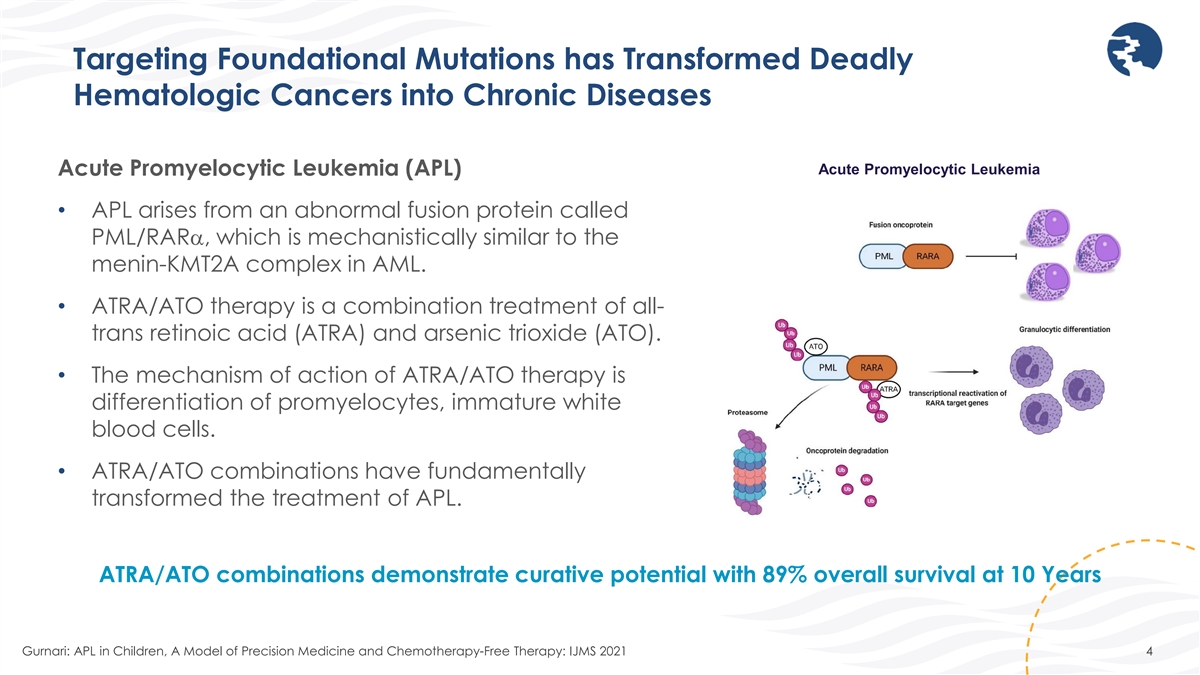
靶向基礎突變已將致命的血液學 癌轉化為慢性疾病急性早幼粒細胞白血病急性早幼粒細胞白血病 (APL) • APL 源自一種名為 PML/RARα 的異常融合蛋白,其機制與急性髓細胞白血病中的腦膜-KMT2A 複合物的機制相似。• ATRA/ATO 療法是全反式視黃酸 (ATRA) 和三氧化二砷 (ATO) 的聯合療法。• ATRA/ATO 療法的作用機制是分化早幼粒細胞,即未成熟的白細胞。• ATRA/ATO 組合從根本上改變了 APL 的治療。ATRA/ATO 組合顯示出治療潛力,10 歲時總存活率為 89% Gurnari:兒童APL,精準醫療和無化療療模型:IJMS 2021 4
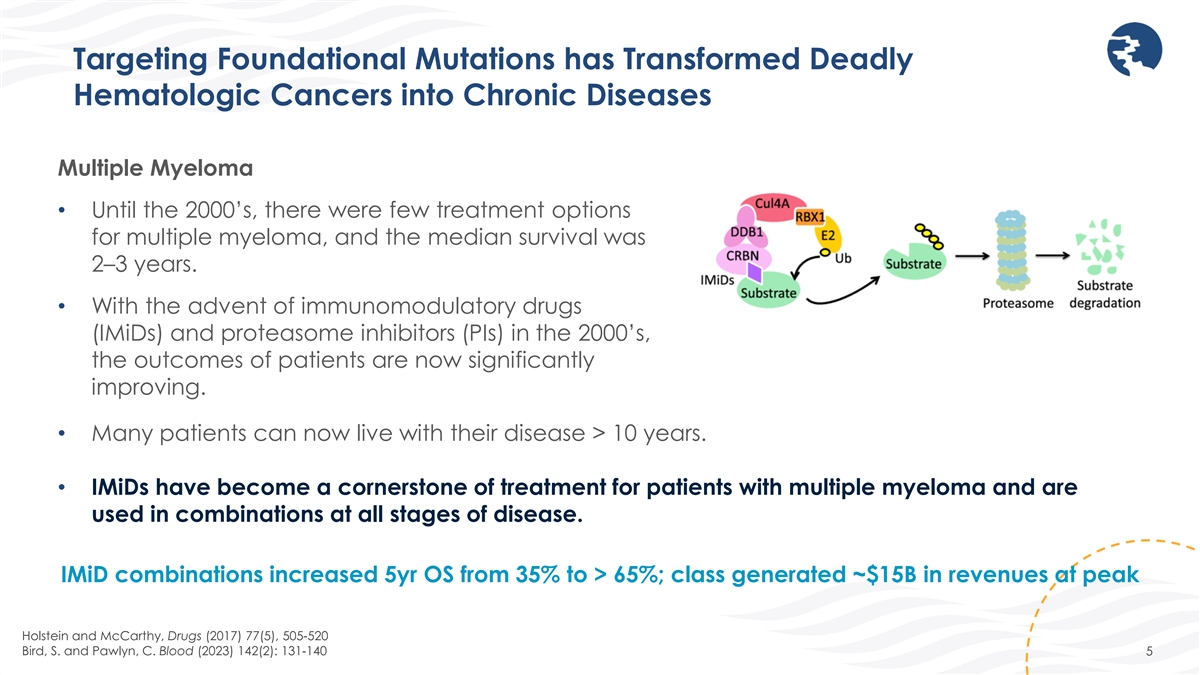
靶向基礎突變已將致命的血液學 癌轉變為慢性病多發性骨髓瘤 • 直到 2000 年代,多發性骨髓瘤的治療選擇很少,中位存活率為 2-3 年。• 隨着 2000 年代免疫調節藥物 (IMID) 和 蛋白酶體抑制劑 (PI) 的問世,患者的預後現已顯著改善。• 許多患者可以現在患病已超過 10 年。• IMID 已成為 多發性骨髓瘤患者治療的基石,可組合使用於疾病的各個階段。iMid 組合將5年操作系統從35%提高到65%以上;該類別在荷斯坦和麥卡錫的峯值時創造了約150億美元的收入,藥物(2017)77(5)、505-520 Bird,S. 和 Pawlyn,C. Blood(2023)142(2):131-140 5

ZIFTOMENIB KOMET-007 研究人員的機會和簡介 Stephen Dale,醫學博士 — Kura Oncology 首席醫學官

Ziftomenib 顯示出成為反洗錢療法基石的潛力 靶向高達 50% 的急性髓細胞白血病病例的核心突變 • 良好的耐受性狀況,可與SOC聯合使用持續給藥 • 組合 似乎可以降低分化綜合徵的風險 • 未觀察到或預測的藥物相互作用 • 臨牀活性的初步證據令人鼓舞 • 快速入組證明瞭研究者的強烈熱情 跨研究 • 前 20在不到四個月的時間內參加 KOMET-007 聯合試驗的患者 • KOMET-001 單一療法註冊試驗預計將在 2024 年中期完成入組 7

KOMET-007 調查人員阿米爾·法西,醫學博士 Amer Zeidan,MBBS • 白血病中心項目主任,• 麻省總醫院癌症中心惡性腫瘤血液學科臨時主任、耶魯癌症中心血液學早期治療研究主任 • 哈佛醫學院 醫學副教授 • 耶魯大學醫學(血液學)副教授 8

ZIFTOMENIB 作為單一療法/組合機會 Amir Fathi,醫學博士 — 麻省總醫院

KOMET-001 齊託美尼在復發/難治性急性髓細胞白血病 1a 階段 1b 階段第 2 階段 1b 劑量遞增註冊支持驗證隊列(正在進行中)已完成 600 mg QD 隊列 1 的持續擴展:200 mg QD 50 mg 100 mg 1000 mg 600 mg QD QD QD 隊列 2:600 mg QD npm1-m,Kmt2a-r、其他 npm1-m npm1-m npm1-m 或 Kmt2a-R 目標 • 安全性和耐受性繼續註冊階段 • 主要終點:• 安全性和耐受性 • cr/CRH • 藥代動力學 1b 驗證 隊列 • 藥代動力學 •抗腫瘤的早期證據與美國食品藥品管理局的項目一致 • 臨牀活性 • 次要終點:Optimus • CR/CRH 持續時間 • 安全性和耐受性 • 輸血獨立性 • 藥代動力學 • CR/CRH MRD 陰性 • 不良事件 • 臨牀活性 CR,完全緩解;cRH,完全緩解,部分血液學恢復;FDA、美國食品藥品監督管理局 管理局;MRD,可測量的殘留物疾病;R/R,復發/難治性;RP2D,推薦的第 2 期劑量。10 ~
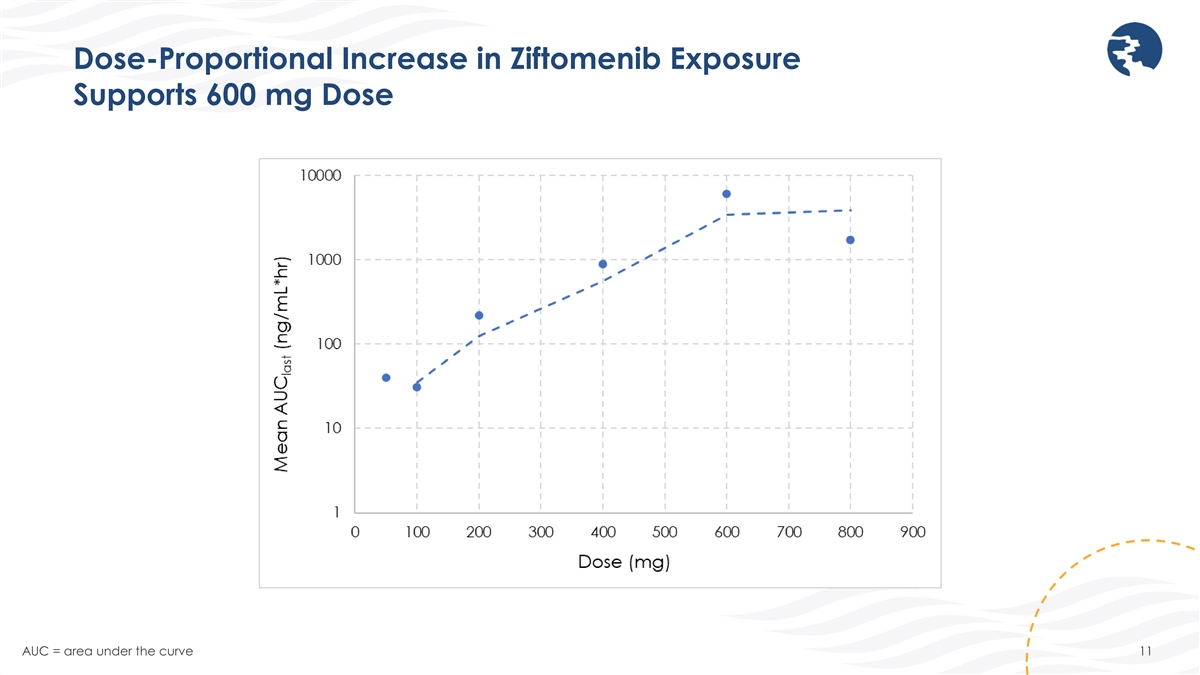
Ziftomenib 暴露量的劑量成比例增加支持 600 mg 劑量 AUC = 曲線下方的面積 11

Ziftomenib 在 1b 期表現出令人鼓舞的安全性 • 採用緩解策略的 npm1-m 單一療法患者中分化綜合徵 (DS) 似乎可以控制 • 輕度至中度 DS 的發生率為 20% • Kmt2a-R 單一療法患者的分化綜合徵 20% 在 200 mg 時為 38.5%,600mg 時為 37.5%;聯合使用 有可能緩解 • DS 是靶向不良反應,代表臨牀活性的證據 • 無報告藥物誘導的 qTc 延長 • 維持計數恢復表明沒有藥物誘發的骨髓抑制 Fathi 等人EHA 2023 #LB2713(截至 2023 年 4 月 12 日的初步數據)12

Ziftomenib 具有高度差異化的單一療法總體反應最佳 在 npm1-m 期 600 mg 差異化 CR 率與 SOC 的比較 1a + 1b (n=20) 40% 的 NPM1 重度預治療患者患者 CR 7 (35.0) 在 cRC 8 (40.0) npm1m 的先前療程中實現了中位數 cr/crH 7 (35.0) 突變 CR% mdOR CR 35% 研究 Ziftomenib 1 MRD 陰性 4 (50.0) flt3m-3 33% 600mg QD IDH 1/2-50% ORR 9 (45.0) Gilteritinib flt3m 14.2% 14.8 mo 1 kmt2a-R 期 1a + 1b (n=18) Enasidenib IDH2 19% 8.2 mo 2 cr/CRH 2 (11.1) Ivosidenib IDH2 19% 8.2 cr/CRH 2 (11.1) Ivosidenib IDH2 H1 25% 10.1 mo 2 cRC 3 (16.7) *未經審查的 cRC DoR 中位數 HSCT MRD 陰性 3 (100.0) 來源:USPI 的 ORR 3 (16.7)(截至 2023 年 4 月 10 日的初步數據)Ø 活性高、反應持久、良好的形象表明 ziftomenib 有可能成為 在整個急性髓細胞白血病護理過程中的骨幹療法 1 對 6/8 cRC 患者進行了評估;在這6名患者中,有4名接受了評估接受檢測的患者(67%)為 MRD 陰性 13 cRC 包括 CR、cRH、cRi、cRp;ORR 包括 CR、crH、cRi、cRi、cRp、MLFS
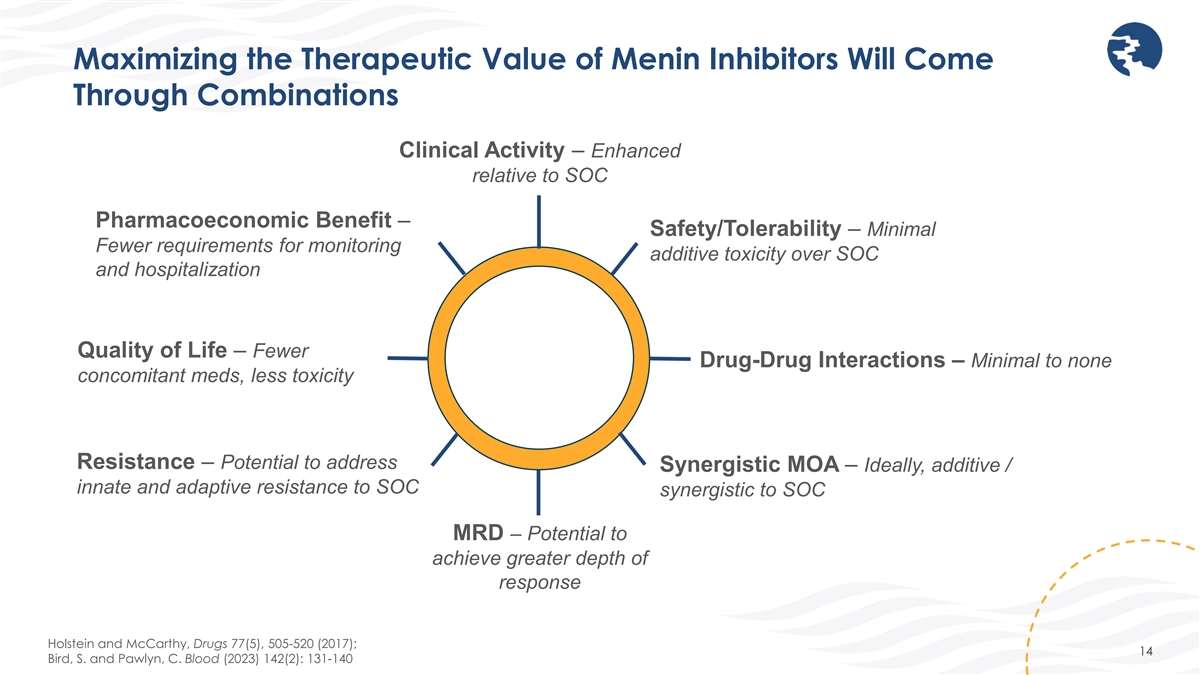
最大限度地提高梅寧抑制劑的治療價值將通過 組合臨牀活性 — 相對於 SOC 藥物經濟效益而言得到增強 — 安全性/耐受性 — 最低監測添加劑毒性比 SOC 和住院生活質量的要求更低 — 更少 藥物相互作用 — 幾乎沒有伴隨藥物,毒性耐藥性更低 — 可能解決協同性 MOA — 理想情況下,對 SOC 協同作用的添加劑/先天和適應性耐藥性到 SOC MRD — 有可能實現更大的響應深度 Holstein 和McCarthy,Drugs 77 (5),505-520 (2017);14 Bird、S. 和 Pawlyn,C. Blood (2023) 142 (2):131-140

來自 KOMET-007 試驗的初步組合數據 Amer Zeidan,MBBS — 耶魯癌症中心披露:Kura Oncology 提供的酬金或諮詢費

KOMET-007:齊託莫尼布對新診斷或複發性急性髓細胞白血病患者的1期聯合試驗 ziftomenib/cytarabine/Daunorubicin(7+3)組合患者 • 齊夫託莫尼布的給藥將從第 1 週期開始,之後持續給藥 • 阿糖胞苷將在 C1 第 1-7 天給藥; 再給藥骨髓活檢結果 • Daunorubicin 將在 C1 第 1-3 天給藥;根據 C1 骨髓活檢結果再給藥一個週期 • 對有 不良風險的患者進行劑量遞增* *年齡 >60 年和/或治療相關急性髓細胞白血病和/或不良風險細胞遺傳學根據 ELN 16 DL = 齊夫託美尼劑量水平;zifto = 齊夫託美尼;7+3 = 阿糖胞苷/柔紅黴素;RP2D = 推薦的 2 期劑量;1L = 一線;IC = 強化 化療
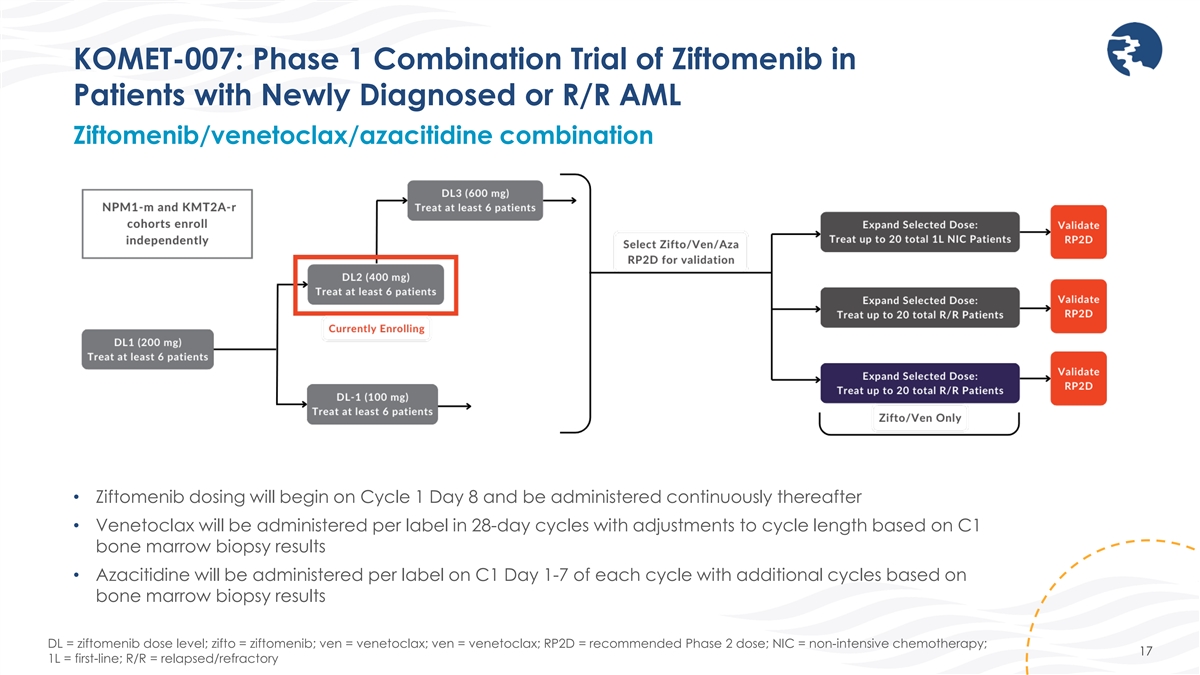
KOMET-007:齊託莫尼布對新確診或複發性急性髓細胞白血病患者的1期聯合試驗 ziftomenib/Venetoclax/Azacitidine 組合患者 • 齊夫託莫尼布的給藥將從第 1 週期開始,之後持續給藥 • Venetoclax 將以 28 天為週期給藥, 將根據 C1 骨髓活檢結果調整週期長度 • 阿西替丁將在每個週期的 C1 第 1-7 天按標籤給藥,並根據骨髓活檢結果延長週期 DL = 齊夫託美尼的劑量水平;zifto = ziftomenib;ven =venetoclax;ven = venetoclax;RP2D = 推薦的 2 期劑量;NIC = 非強化化療;17 1L = 一線;R/R = 復發/難治性
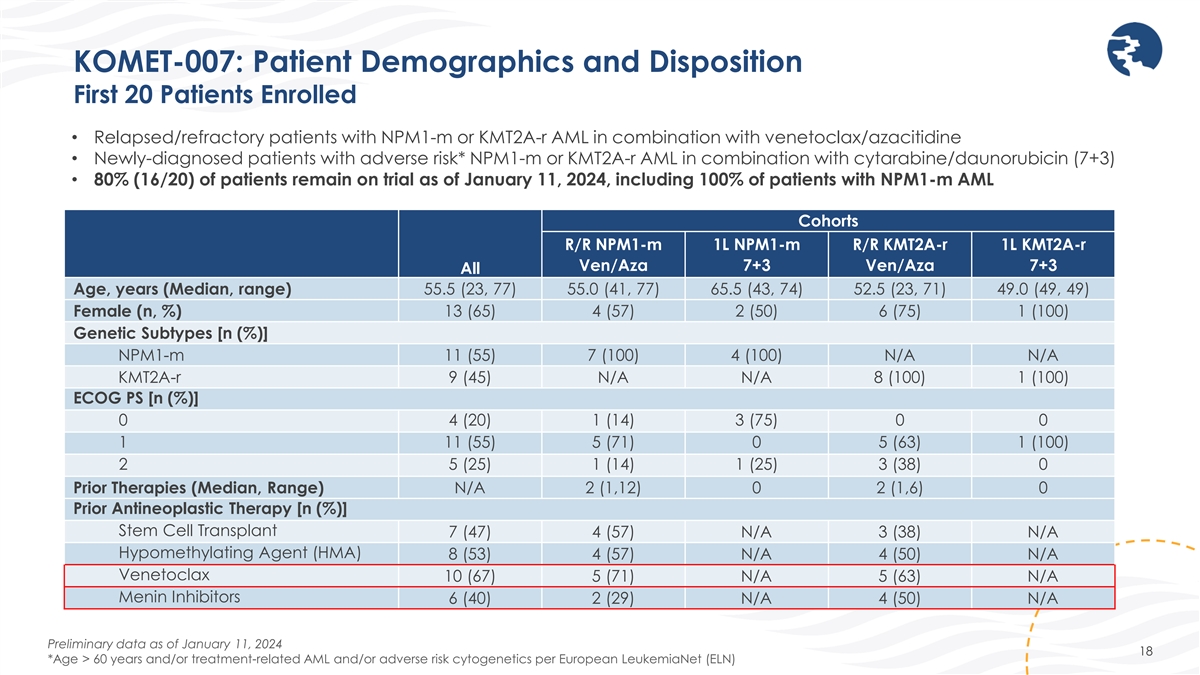
KOMET-007:患者人口統計和處置前 20 名患者 入組患者 • npm1-m 或 kmt2a-R 急性髓細胞白血病聯合使用 venetoclax/azacitidine 的復發/難治性患者 • 新診斷的不良風險患者* npm1-m 或 Kmt2a-R 急性髓細胞白血球聯合阿糖濱/柔比星 (7+3) • 80% (16/20)) 的患者截至 2024 年 1 月 11 日仍在試驗中,包括 100% 的 npm1-m AML 同期患者 R/R npm1-m 1L npm1-m R/R kmt2a-R 1L kmt2a-R 1L kmt2a-R Ven/Aza 7+3 Ven/Aza 7+3 所有年齡、年齡(中位數,範圍)55.5 (23, 77) 55.0 (41, 77) 65.5 (43, 74) 65.5 (43, 74) 52.5 (23, 71)) 49.0 (49, 49) 13 (65) 4 (57) 2 (50) 6 (75) 1 (100) 雌性 (n,%) 遺傳亞型 [n (%)]npm1-m 11 (55) 7 (100) 4 (100) N/A N/A kmt2a-R 9 (45) N/A 8 (100) 1 (100) ECOG PS [n (%)]0 4 (20) 1 (14) 3 (75) 0 0 1 11 (55) 5 (71) 0 5 (63) 1 (100) 2 5 (25) 1 (14) 1 (25) 1 (25) 3 (38) 0 先前的療法(中位數,範圍)N/A 2 (1,12) 0 2 (1,6) 0 先前的抗腫瘤療法 [n (%)]幹細胞移植 7 (47) 4 (57) N/A 3 (38) N/A 低甲基化劑 (HMA) 8 (53) 4 (57) N/A 4 (50) N/A Venetoclax 10 (67) 5 (71) N/A 5 (63) N/A Menin 抑制劑 6 (40) 2 (29) N/A 4 (50) N/A 截至2024年1月11日的初步數據 18 *年齡 > 60 歲和/或治療相關 AMS 根據歐洲白血病網 (ELN) 的 L 和/或不良風險細胞遺傳學

KOMET-007:組合 組合具有良好的安全性和耐受性可降低分化綜合徵 (DS) 等級 ≥ 3 TEAE (≥ 10%) n (%) ≥ 3 級 Ziftomenib 相關不良反應(全部)n (%) ≥ 3 級患者齊夫託梅尼布相關不良反應的患者 18 (90) Ziftomenib 相關 AE 的患者 6 (30) 血小板計數減少 6 (30) 血小板計數減少 3 (15) 發熱性中性粒細胞減少症 5 (25) 貧血 1 (5) 白細胞計數下降 4 (20) 發熱性中性粒細胞減少症 1 (5) 肺炎 3 (15) 白細胞減少症 1 (5) 缺氧 2 (10) 中性粒細胞計數 1 (5) 中性粒細胞計數減少了 2 (10) 血小板減少症 1 (5) 敗血癥 2 (10) 血小板減少症 2 (10) • 未報告 DS 事件 • 迄今未觀察到劑量限制毒性 (DLT),包括血液學計數恢復延遲 • 未觀察到 qtC 延期 • TEAE 與基礎疾病和骨幹療法一致 2024 年 1 月 11 日的初步數據 19 TEAES = Treatment-emerment-emergent 嚴重的不良事件
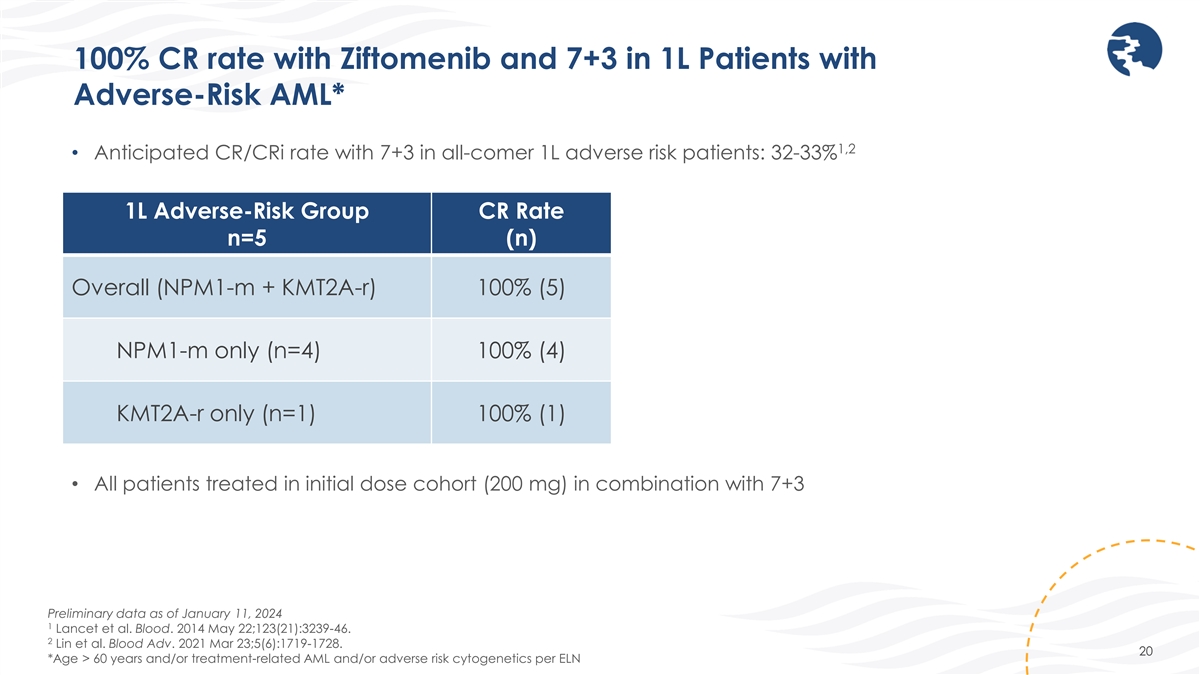
齊託莫尼布的CR率為100%,1L不良風險患者的CR率為7+3 AML* 1,2 • 全來者 1L 不良風險患者的預期 CR/CRI 率為 7+3:32-33% 1L 不良風險組 cr 率 n=5 (n) 總體 (npm1-m + kmt2a-r) 100% (5) 僅限 npm1-m (n=4) 100% (4) 僅限 Kmt2a-R (n=1) 100% (1) • 所有患者 在初始劑量隊列(200 mg)中聯合使用 7+3 截至2024年1月11日的初步數據 1 Lancet 等人Blood。2014 年 5 月 22 日;123 (21): 3239-46. 2 Lin 等人。Blood Adv. 2021 年 3 月 23 日;5 (6): 1719-1728. 20 *根據ELN,年齡 > 60 歲和/或 治療相關急性髓細胞白血病和/或不良風險細胞遺傳學

Ziftomenib + Ven/Aza 在腦膜抑制劑中具有明顯活性 天真患者 1 • ven-naive 復發/難治性患者 cr/CRI 預計約為 35-45% 2 • Kmt2a-R 復發/難治性 AML 的預期反應率
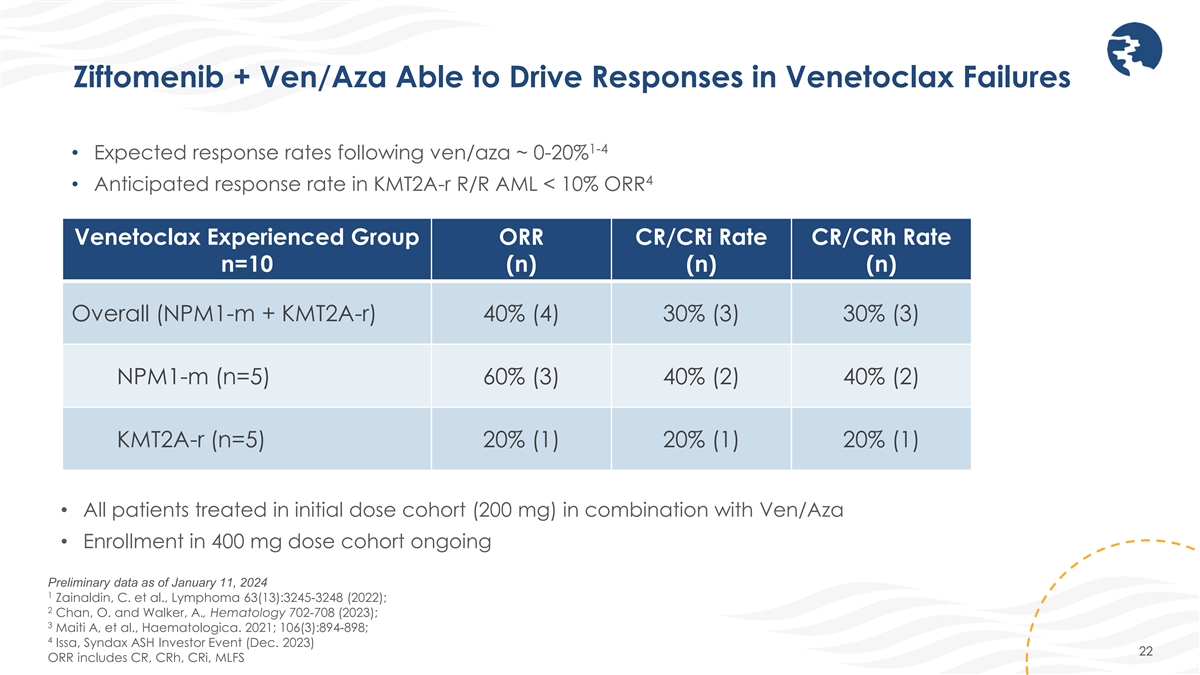
Ziftomenib + Ven/Aza 能夠在 Venetoclax 失敗 1-4 中推動響應 • ven/aza 之後的預期響應率 ~ 0-20% 4 • Kmt2a-R R/R AML 的預期響應率
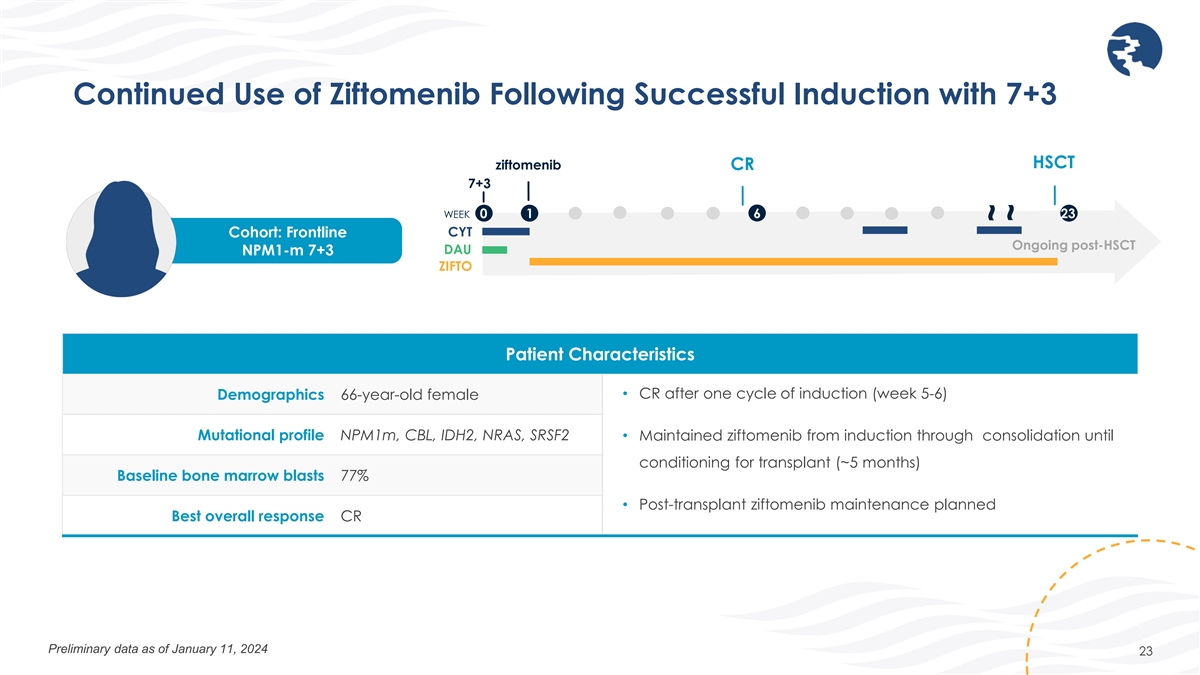
成功引導 7+3 HSCT ziftomenib CR 7+3 WEEK 0 1 6 23 CYT 隊列後繼續使用 Ziftomenib 後繼續使用 Ziftomenib DAU npm1-m 7+3 ZIFTO 患者特徵 • 一個誘導週期(第 5-6 周)後的 CR 人口統計 66 歲女性突變概況 npm1m、CBL、IDH2、NRAS、 SRSF2 • 從誘導到鞏固直至移植條件維持齊夫託美尼(約 5 個月)基線骨髓爆發 77% • 計劃移植後齊夫託美尼維持最佳總體反應 CR 截至1月11日的初步數據 2024 23 ~~
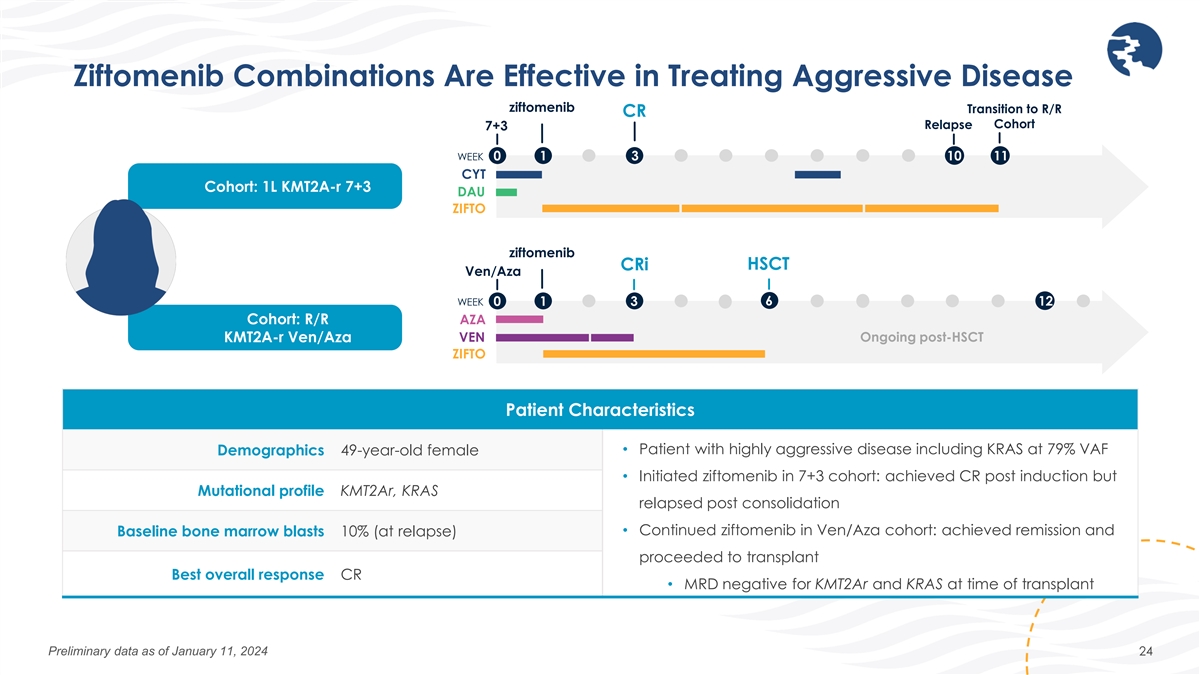
齊託莫尼布組合可有效治療侵襲性疾病 ziftomenib 過渡到復發/R CR 復發隊列 7+3 周 0 1 3 10 11 CYT 隊列:1L kmt2a-R 7+3 DAU ZIFTO ziftomenib crI HSCT ven/Aza 6 周 0 1 3 12 隊列:R/R AZA kmt2a-R Ven/Aza VEN/AZA 後仍在繼續 sct ZIFTO 患者特徵人口統計 49 歲女性 • 患有高侵襲性疾病的患者,包括 KRAS,VAF 為 79% • 在 7+3 隊列中開始使用齊託美尼:誘導後獲得 CR 但突變特徵 kmt2ar,KRAS 在鞏固後復發 • 續 ziftomenib 在 Ven/Aza 隊列:已實現緩解,基線骨髓爆炸 10%(復發時)繼續移植最佳總體反應 CR • 移植時 KMT2ar 和 KRAS 的 MRD 陰性截至2024年1月11日的初步數據 24
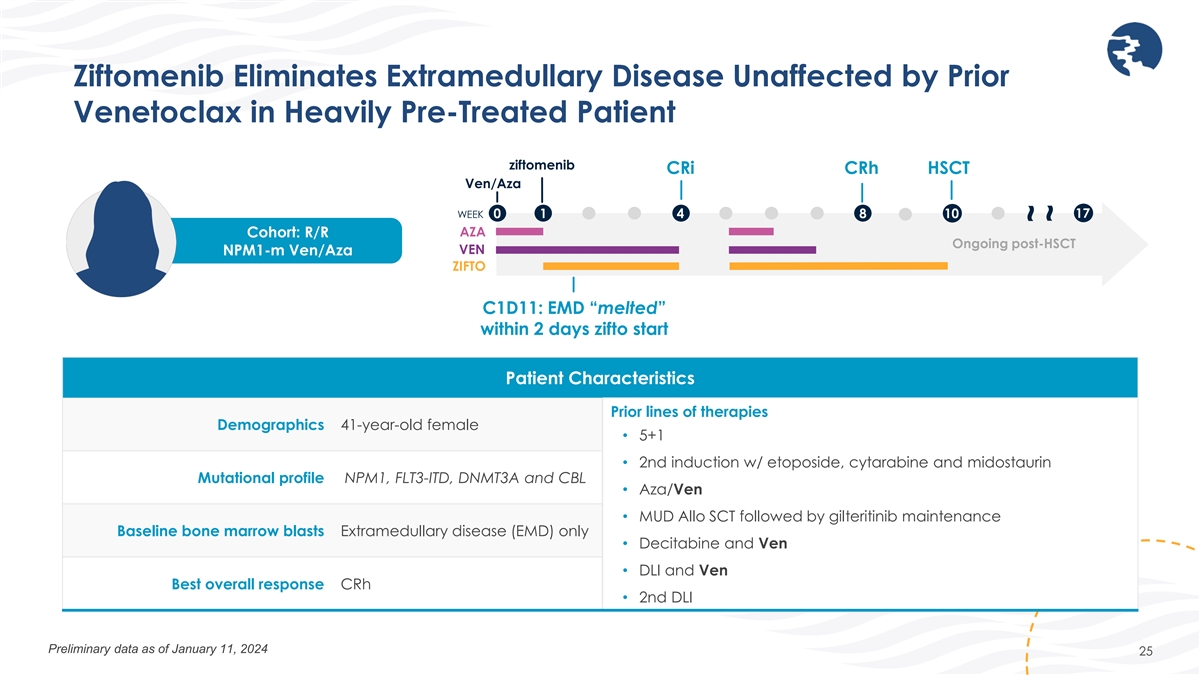
Ziftomenib 可消除未受先前 Veneclax 影響的重度預治療患者中的髓外疾病 ziftomenib crI crH HSCT Ven/Aza 17 周 0 1 4 8 10 AZA 隊列:R/R 後 HSCT 正在進行中 Venpm1-m Ven/Aza ZIFTO C1D11:EMD 在 2 天內 “融化” 了 zifto 開始患者特徵 療法的先前線路人口統計 41 歲女性 • 5+1 • 使用依託泊苷、阿糖胞苷和米多司他林進行第二次誘導 Mutational profice NPM1、FLT3-ITD、DNMT3A 和 CBL • Aza/Ven • MUD Allo SCT 其次是吉特替尼維持基線 骨髓細胞外爆炸僅限疾病(EMD)• 地西他濱和 Ven • DLI 和 Ven Best 總體反應 crH • 第 2 次 DLI 截至 2024 年 1 月 11 日的初步數據 25 ~ ~

臨牀開發計劃 Mollie Leoni,醫學博士 — 臨牀開發執行副總裁

Ziftomenib 臨牀開發路徑開發方法計劃中的研究 啟動階段 1 註冊定向試驗 NPM1 突變體急性髓系白血病 (AML) 單一療法 non-npm1-m/kmt2a-R 急性髓細胞白血病(復發/難治性)KMT2A-重排所有與 NPM1 突變體 AML VENETOCLAX + 阿扎西替丁 KMT2A-重排的 AML (復發/難治性,前線)與 NPM1 突變體 AML 阿糖胞苷 + 柔紅黴素 (7+3) KMT2A 重組急性髓細胞白血病(復發/難治性,前線)聯合吉利替尼、NPM1 突變體 AML FLAG-IDA、LDAC KMT2A-重排急性髓細胞白血病 (復發/難治性)npm1-突變體急性髓細胞白血病研究員/公司-移植後維護贊助的研究 KMT2A 重新安排的 AML 兒科急性髓細胞白血病和所有聯合療法 FLA 研究者贊助的研究兒科全部與 BV-DAM 聯合使用 27

市場機會和即將到來的里程碑特洛伊·威爾遜博士、法學博士 — Kura Oncology 總裁兼首席執行官

Ziftomenib 在反洗錢及其他領域提供了數十億美元的機會 有可能改變整個護理過程的預後 • 初步批准佔潛在患者復發的 30%/• KOMET-001 註冊導向的研究獲得 FDA 全面批准的難治劑 • 1L 反洗錢和維護前線的重大機遇/• 有可能推動超過 50% 的收入維持 • 安全性、耐受性和臨牀活動預計將是與 SOC 和 SOC 聯合治療的理想選擇維護指示 • 除 AML 之外還有引人注目的 其他機會提供數十億美元的其他潛在適應症 • 早期轉化數據支持實體瘤和非腫瘤學適應症的潛力 29

齊託莫尼布在急性白血病中的即將到來的里程碑預計時間 成就里程碑與 FLT3 抑制劑吉利替尼聯合使用 KOMET-008 試驗的首批患者劑量,2024 年第一季度 LDAC 和 FLAG-IDA 啟動移植後維持計劃 2024 年第一季度將齊夫託莫尼的開發擴展到急性淋巴細胞 白血病 (ALL) 2024 年第一季度完成 KOMET-001 註冊中期試驗中 85 名患者的入組 2024 確定與 ven/aza 聯合使用的推薦的 2 期劑量 2024 年中期在 1L 中與 ven/aza 聯合使用啟動劑量驗證/擴展 AML 2024 年中期提供 2024 年下一次 KOMET-007 組合更新 • 5.7 億美元的預計現金*為進入 2027 年提供了機會,使齊夫託梅尼布和其他管道 資產的價值最大化 * 包括截至2023年12月31日的4.24億美元現金、現金等價物和短期投資,以及2024年1月26日結束的私募中扣除發行費用後的1.46億美元估計收益 30

開發治療癌症的精準藥物來自 KOMET-007 的初步 數據 — 2024 年 1 月 30 日