目錄
ROC
美國
證券交易委員會
華盛頓特區 20549
表單
(Mark One)
根據1934年《證券交易法》第13或15(d)條提交的季度報告 |
在截至的季度期間
或者
根據1934年《證券交易法》第13或15(d)條提交的過渡報告 |
|
在過渡期內 |
|
到 |
|
|
委員會檔案編號:
(註冊人的確切姓名如其章程所示)
|
|
|
|
||
(州或其他司法管轄區 公司或組織) |
|
(美國國税局僱主 證件號) |
(主要行政辦公室地址)(郵政編碼)
(
(註冊人的電話號碼,包括區號)
根據該法第12(b)條註冊的證券:
每個班級的標題 |
|
交易 符號 |
|
註冊的每個交易所的名稱 |
|
|
這個 |
用複選標記表明註冊人(1)在過去的12個月中(或註冊人需要提交此類報告的較短期限)是否提交了1934年《證券交易法》第13或15(d)條要求提交的所有報告,以及(2)在過去的90天中是否受此類申報要求的約束。
用複選標記表明註冊人是否在過去 12 個月內(或者在要求註冊人提交此類文件的較短時間內)以電子方式提交了根據第 S-T 法規(本章第 232.405 節)第 405 條要求提交的所有交互式數據文件。
用複選標記指明註冊人是大型加速申報人、加速申報人、非加速申報人、小型申報公司還是新興成長型公司。參見《交易法》第12b-2條中 “大型加速申報人”、“加速申報人”、“小型申報公司” 和 “新興成長型公司” 的定義。
大型加速過濾器 |
|
☐ |
|
加速過濾器 |
|
☐ |
|
☒ |
|
規模較小的申報公司 |
|
||
新興成長型公司 |
|
|
|
|
|
如果是新興成長型公司,請用複選標記表明註冊人是否選擇不使用延長的過渡期來遵守根據《交易法》第13(a)條規定的任何新的或修訂的財務會計準則。☐
用複選標記表明註冊人是否為空殼公司(定義見《交易法》第12b-2條)。是的
在根據法院確認的計劃進行證券分發後,用複選標記表明註冊人是否提交了1934年《證券交易法》第12、13或15(d)條要求提交的所有文件和報告。是的
截至2023年10月31日,發行人普通股的已發行股票數量為面值0.00000002美元
目錄
MEI 製藥有限公司
的表內容
|
|
|
|
|
|
|
|
|
|
|
頁面 |
|
|
|
|
|
||||
第一部分 |
|
財務信息 |
|
|
3 |
|
|
|
|
||||
第 1 項。 |
|
簡明合併財務報表(未經審計) |
|
|
3 |
|
|
|
|
|
|
|
|
|
|
截至2023年9月30日和2023年6月30日的簡明合併資產負債表 |
|
|
3 |
|
|
|
|
|
|
|
|
|
|
截至2023年9月30日和2022年9月30日的三個月的簡明合併運營報表 |
|
|
4 |
|
|
|
|
|
|
|
|
|
|
截至2023年9月30日和2022年9月30日的三個月的簡明合併股東權益表 |
|
|
5 |
|
|
|
|
|
|
|
|
|
|
截至2023年9月30日和2022年9月30日的三個月的簡明合併現金流量表 |
|
|
6 |
|
|
|
|
|
|
|
|
|
|
簡明合併財務報表附註 |
|
|
7 |
|
|
|
|
|
|
|
|
第 2 項。 |
|
管理層對財務狀況和經營業績的討論和分析 |
|
|
18 |
|
|
|
|
|
|
|
|
第 3 項。 |
|
關於市場風險的定量和定性披露 |
|
|
29 |
|
|
|
|
|
|
|
|
第 4 項。 |
|
控制和程序 |
|
|
29 |
|
|
|
|
||||
第二部分 |
|
其他信息 |
|
|
31 |
|
|
|
|
|
|
|
|
第 1 項。 |
|
法律訴訟 |
|
|
31 |
|
|
|
|
|
|
|
|
第 1A 項。 |
|
風險因素 |
|
|
31 |
|
|
|
|
|
|
|
|
第 2 項。 |
|
未註冊的股權證券銷售和所得款項的使用 |
|
|
31 |
|
|
|
|
|
|
|
|
第 3 項。 |
|
優先證券違約 |
|
|
31 |
|
|
|
|
|
|
|
|
第 4 項。 |
|
礦山安全披露 |
|
|
31 |
|
|
|
|
|
|
|
|
第 5 項。 |
|
其他信息 |
|
|
31 |
|
|
|
|
|
|
|
|
第 6 項。 |
|
展品 |
|
|
32 |
|
|
|
|||||
簽名 |
|
|
33 |
|
||
2
目錄
第一部分財務信息
第 1 項。簡明合併財務報表
MEI 製藥有限公司
簡明的合併資產負債表
(以千計,面值數據除外)
|
|
9月30日 |
|
|
6月30日 |
|
||
|
|
2023 |
|
|
2023 |
|
||
資產 |
|
|
|
|
|
|
||
流動資產: |
|
|
|
|
|
|
||
現金和現金等價物 |
|
$ |
|
|
$ |
|
||
短期投資 |
|
|
|
|
|
|
||
未開單應收賬款 |
|
|
|
|
|
|
||
預付費用和其他流動資產 |
|
|
|
|
|
|
||
流動資產總額 |
|
|
|
|
|
|
||
經營租賃使用權資產 |
|
|
|
|
|
|
||
財產和設備,淨額 |
|
|
|
|
|
|
||
總資產 |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
||
負債和股東權益 |
|
|
|
|
|
|
||
流動負債: |
|
|
|
|
|
|
||
應付賬款 |
|
$ |
|
|
$ |
|
||
應計負債 |
|
|
|
|
|
|
||
遞延收入 |
|
|
|
|
|
|
||
經營租賃責任 |
|
|
|
|
|
|
||
流動負債總額 |
|
|
|
|
|
|
||
長期遞延收入 |
|
|
|
|
|
|
||
長期經營租賃負債 |
|
|
|
|
|
|
||
負債總額 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
股東權益: |
|
|
|
|
|
|
||
優先股,$ |
|
|
|
|
|
|
||
普通股,$ |
|
|
|
|
|
|
||
額外的實收資本 |
|
|
|
|
|
|
||
累計赤字 |
|
|
( |
) |
|
|
( |
) |
股東權益總額 |
|
|
|
|
|
|
||
負債和股東權益總額 |
|
$ |
|
|
$ |
|
||
見簡明合併財務報表附註。
3
目錄
MEI 製藥有限公司
簡明合併運營報表
(以千計,每股金額除外)
(未經審計)
|
|
在截至9月30日的三個月中 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
收入: |
|
|
|
|
|
|
||
來自客户的收入 |
|
$ |
|
|
$ |
|
||
來自合作協議的收入 |
|
|
|
|
|
|
||
總收入 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
運營費用: |
|
|
|
|
|
|
||
研究和開發 |
|
|
|
|
|
|
||
一般和行政 |
|
|
|
|
|
|
||
運營費用總額 |
|
|
|
|
|
|
||
運營收入(虧損) |
|
|
|
|
|
( |
) |
|
其他收入(支出): |
|
|
|
|
|
|
||
認股權證負債公允價值的變化 |
|
|
|
|
|
|
||
利息和股息收入 |
|
|
|
|
|
|
||
其他費用,淨額 |
|
|
( |
) |
|
|
( |
) |
其他收入總額,淨額 |
|
|
|
|
|
|
||
淨收益(虧損) |
|
$ |
|
|
$ |
( |
) |
|
|
|
|
|
|
|
|
||
每股淨收益(虧損)——基本收益和攤薄後收益 |
|
$ |
|
|
$ |
( |
) |
|
|
|
|
|
|
|
|
||
用於計算每股淨收益(虧損)的加權平均份額——基本和攤薄後 |
|
|
|
|
|
|
||
見簡明合併財務報表附註。
4
目錄
MEI 製藥有限公司
簡明的股東權益合併報表
(以千計)
(未經審計)
|
|
常見 |
|
|
額外 |
|
|
累積的 |
|
|
總計 |
|
||||
截至 2023 年 6 月 30 日的餘額 |
|
|
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
淨收入 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||
基於股份的薪酬支出 |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
截至 2023 年 9 月 30 日的餘額 |
|
|
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
|
|
常見 |
|
|
額外 |
|
|
累積的 |
|
|
總計 |
|
||||
截至2022年6月30日的餘額 |
|
|
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
淨虧損 |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
為既得限制性股票單位發行普通股 |
|
|
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
|
基於股份的薪酬支出 |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
2022 年 9 月 30 日的餘額 |
|
|
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
見簡明合併財務報表附註。
5
目錄
MEI 製藥有限公司
簡明的合併現金流量表
(以千計)
(未經審計)
|
|
在截至9月30日的三個月中 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
來自經營活動的現金流: |
|
|
|
|
|
|
||
淨收益(虧損) |
|
$ |
|
|
$ |
( |
) |
|
調整淨收益(虧損)與經營活動中使用的淨現金: |
|
|
|
|
|
|
||
認股權證負債公允價值的變化 |
|
|
|
|
|
( |
) |
|
基於股份的薪酬 |
|
|
|
|
|
|
||
非現金租賃費用 |
|
|
|
|
|
|
||
折舊費用 |
|
|
|
|
|
|
||
運營資產和負債的變化: |
|
|
|
|
|
|
||
未開單應收賬款 |
|
|
|
|
|
|
||
預付費用和其他流動資產 |
|
|
|
|
|
|
||
應付賬款 |
|
|
( |
) |
|
|
|
|
應計負債 |
|
|
( |
) |
|
|
( |
) |
遞延收入 |
|
|
( |
) |
|
|
( |
) |
經營租賃責任 |
|
|
( |
) |
|
|
( |
) |
用於經營活動的淨現金 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
|
|
|
||
來自投資活動的現金流: |
|
|
|
|
|
|
||
購買財產和設備 |
|
|
|
|
|
( |
) |
|
購買短期投資 |
|
|
( |
) |
|
|
( |
) |
短期投資到期所得收益 |
|
|
|
|
|
|
||
投資活動提供的淨現金 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
來自融資活動的現金流: |
|
|
|
|
|
|
||
支付與限制性股票單位歸屬相關的預扣税 |
|
|
|
|
|
( |
) |
|
融資活動提供的(用於)淨現金 |
|
|
|
|
|
( |
) |
|
現金及現金等價物淨減少 |
|
|
( |
) |
|
|
( |
) |
期初的現金和現金等價物 |
|
|
|
|
|
|
||
期末的現金和現金等價物 |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
||
補充現金流信息: |
|
|
|
|
|
|
||
應付賬款所列財產和設備的採購 |
|
$ |
|
|
$ |
|
||
為換取經營租賃負債而獲得的經營租賃使用權資產 |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
||
見簡明合併財務報表附註。
6
目錄
MEI 製藥有限公司
簡明合併財務報表附註
(未經審計)
1。業務描述和陳述基礎
業務描述
MEI Pharma, Inc.(納斯達克股票代碼:MEIP)是一家臨牀階段的製藥公司,致力於開發新的差異化癌症療法。我們通過收購有前途的抗癌藥物來建立我們的產品線,並酌情通過開發、戰略合作伙伴關係、外包許可或商業化為項目創造價值。我們的腫瘤藥物開發方法是評估我們的候選藥物與標準護理療法的組合,以克服已知的耐藥機制,滿足明確的醫療需求,從而改善患者的受益。我們的產品線包括口服細胞週期素依賴性激酶 9(“CDK9”)抑制劑 voruciclib 和 ME-344,一種靶向氧化磷酸化途徑的靜脈注射小分子線粒體抑制劑。
反向股票分割
2023 年 4 月 14 日,我們修訂了公司註冊證書,以一比二的比例對已發行和已發行普通股進行組合(“反向股票拆分”)。由於反向股票拆分,我們普通股的面值和授權股票沒有進行調整。反向股票拆分於2023年4月14日生效,市場生效日期為2023年4月17日。所有歷史股票和每股金額均已調整,以反映所有報告期的反向股票拆分。所有股票期權、限制性股票單位和未償還認股權證均按比例進行了調整,以使反向股票拆分生效。
時事活動
合作協議
2023年10月31日,我們宣佈了與Anson Funds和Cable Capital的合作協議(“合作協議”),其中除其他非財務相關項目外,如概述部分所述 第 2 項。管理層對財務狀況和經營業績的討論和分析, 包含以股息形式向股東提供的資本回報,金額為美元
作為合作協議的一部分,Anson和Cable Car撤回了徵求同意的請求,並同意遵守慣常的停頓條款。此外,我們將報銷Anson和Cable Car迄今為止與我們的合作相關的費用和開支,金額不超過 $
現金分紅
2023 年 11 月 6 日,我們宣佈,根據合作協議,董事會宣佈特別現金股息為 $
流動性
我們累計虧損為 $
7
目錄
迄今為止,我們主要通過股權融資和許可協議獲得了現金併為我們的運營提供資金。為了繼續開發我們的候選藥物,我們預計將在未來的某個時候進行一項或多項資本交易,無論是通過出售股權證券、債務融資、許可協議還是建立戰略合作伙伴關係。無法保證我們將來能夠繼續籌集更多資金。
列報基礎和合並原則
簡明合併財務報表是根據美國普遍接受的中期財務信息會計原則(“美國公認會計原則”)以及表格10-Q的説明和第S-X條例第10條編制的。因此,隨附的財務報表不包括美國公認會計原則要求的完整財務報表的所有信息和附註。管理層認為,所附的簡明合併財務報表反映了公允列報所列期間的財務狀況、經營業績和現金流量所需的所有調整(包括正常的經常性調整)。
隨附的未經審計的簡明合併財務報表包括MEI Pharma, Inc.和我們的全資子公司Meadow Merger Sub, Inc.的賬目。我們在合併中取消了所有重要的公司間賬目和交易。
隨附的截至2023年9月30日的季度未經審計的簡明合併財務報表應與截至2023年6月30日的財政年度的經審計的財務報表及其附註一起閲讀,包含在我們於2023年9月26日向美國證券交易委員會提交的10-K表年度報告(“2023年年度報告”)中。中期業績不一定代表全年的業績。
2。重要會計政策摘要
與2023年年度報告中所載經審計的合併財務報表附註中所述的政策相比,我們的重要會計政策沒有重大變化。
風險和不確定性
估算值的使用
根據美國公認會計原則編制合併財務報表要求管理層做出估算和假設,以影響合併財務報表之日的資產負債金額和或有資產負債的披露以及報告期內報告的收入和支出金額。我們將持續評估我們的估計,包括與股票獎勵估值、估算使用權資產和租賃負債現值時使用的貼現率、財產和設備的使用壽命、長期資產的可收回性、臨牀試驗應計額、收入應計期、相對獨立銷售價格、遞延所得税和相關估值補貼以及評估我們為運營提供資金的能力評估有關的估計自該日起至少未來 12 個月這些簡明合併財務報表的發佈。我們的估算基於歷史經驗和其他特定市場或其他相關假設,我們認為這些假設在當時情況下是合理的。每個報告期都對估計數進行評估並進行更新以反映當前信息。由於無法精確確定未來事件及其影響,實際結果可能與這些估計或假設存在重大差異。
信用風險的集中度
可能使我們面臨大量信用風險集中的金融工具主要包括現金、現金等價物和短期投資。我們的支票和貨幣市場賬户中的存款存放在聯邦保險的金融機構中,並受聯邦保險限額或證券投資者保護公司設定的限額的約束。
短期投資
短期投資是到期日超過三個月但自購買之日起不到一年的有價證券。截至2023年9月30日和2023年6月30日,我們的短期投資包括 $
8
目錄
收入確認
來自客户的收入
根據ASC主題606, 與客户簽訂合同的收入(“主題606”),當承諾的商品或服務的控制權移交給我們的客户時,我們確認收入,金額反映了我們為換取這些商品或服務而預計有權獲得的對價。對於與客户簽訂的可執行合同,我們首先確定合同中不同的履約義務或會計單位。履約義務是合同中向客户轉讓特殊商品或服務的承諾。
根據商業安排(例如技術權利許可)收到的款項可能包括協議開始時不可退還的費用、協議中規定的特定成就的里程碑付款以及產品銷售的特許權使用費。在包括里程碑付款的安排之初,我們使用判斷來評估里程碑是否有可能實現,並使用最可能的方法估算交易價格中應包含的金額(如果有)。如果可能不會發生重大的收入逆轉,則預計金額將包含在交易價格中。在獲得批准之前,不在我們或被許可方控制範圍內的里程碑付款,例如監管部門的批准,不包含在交易價格中。在每個報告期結束時,我們會重新評估實現發展里程碑和任何相關制約因素的可能性,並在必要時調整對總體交易價格的估計。
我們可能會簽訂包含多項履約義務的安排。此類安排可能包括我們交付成果的任意組合。如果合同包含多項承諾的交付成果,我們將進行判斷,以確定承諾的交付物在合同背景下是否能夠與眾不同。如果不滿足這些標準,則將承諾的交付項作為綜合履約義務入賬。對於具有多個不同績效義務的安排,我們將與50-50的開發服務成本分攤額相關的可變對價直接分配給相關的績效義務,然後根據其相對的獨立銷售價格在績效義務之間分配剩餘的對價。
獨立銷售價格是我們單獨向客户出售承諾的商品或服務的價格。當無法直接觀察時,我們通常會估算每項不同履約義務的獨立銷售價格。與我們履行特定履約義務的努力相關的可變對價完全分配給這些履約義務。交易價格的其他組成部分是根據相對的獨立銷售價格分配的,管理層對此做出了重要的判斷。我們制定的假設需要做出判斷,以確定與許可證相關的履約義務的獨立銷售價格,其中可能包括預測的收入、開發時間表、人員成本補償率、貼現率以及技術、監管和商業成功的概率。我們通過預測履行履約義務的預期成本加上適當的利潤率來估算研發績效義務的獨立銷售價格。
如果許可證是單獨的履約義務,則在許可證轉讓給被許可人且被許可人可以使用許可證並從中受益時,我們會從不可退還的預付費用中確認分配給許可證的收入。對於與其他不同或合併義務捆綁在一起的許可證,我們使用判斷來評估履約義務的性質,以確定履約義務是否在一段時間內得到履行,如果在一段時間內得到履行,則採用適當的方法來衡量進展情況,以確認收入。如果績效義務在一段時間內得到履行,我們會評估每個報告期的進展衡量標準,並在必要時調整業績衡量標準和相關的收入確認。
選擇衡量完成進展情況的方法需要作出判斷,並以所提供的產品或服務的性質為基礎。收入按成本發生的比例記錄。我們通常使用成本對成本的進度衡量標準,因為它最能描述在我們產生成本時向客户轉移控制權的情況。在衡量進展的成本對成本的衡量標準下,完成工作的進展程度是根據迄今發生的費用與履行義務完成時估計總成本的比率來衡量的(題目606下的 “輸入法”)。我們使用判斷來估算完成研發績效義務的預期總成本,其中包括分包商的成本、勞動力、材料、其他直接成本和間接成本的分配。我們會評估這些成本估算值和每個報告期的進展情況,並在必要時調整進展衡量標準和相關的收入確認。
對於包括基於銷售或基於使用量的特許權使用費的安排,我們在 (i) 相關銷售發生時或 (ii) 部分或全部特許權使用費分配的履約義務得到履行或部分履行時,以較晚者為準。迄今為止,我們尚未確認來自許可協議的任何基於銷售或基於使用量的特許權使用費收入。
關於我們在 2020 年 4 月的許可、開發和商業化協議(“KKC 商業化協議”)中描述的 注意事項 7.許可協議,我們提供與50-50成本分攤安排相關的開發服務,收入將隨着時間的推移予以確認。此外,我們應KKC的要求為他們提供服務,其費用將全額報銷給我們。我們將此類直通服務的報銷記錄為收入
9
目錄
成本, 因為在我們產生此類費用時,對KKC額外服務的控制權已移交。這些服務的成本在合併運營報表中確認為研發費用。我們不時為協和麒麟有限公司提供額外服務。 (“KKC”)應他們的要求,其費用已全額報銷給我們。這些服務的成本在合併運營報表中確認為研發費用。
我們確認了本報告所述期間與KKC商業化協議相關的收入(以千計):
|
|
在截至9月30日的三個月中 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
收入確認時間: |
|
|
|
|
|
|
||
一段時間內提供的服務 |
|
$ |
|
|
$ |
|
||
在某個時間點傳遞服務 |
|
|
|
|
|
|
||
|
|
$ |
|
|
$ |
|
||
合約餘額
在我們的簡明合併資產負債表中,應收賬款包含在預付費用和其他流動資產中,長期而言,合同負債包含在遞延收入和遞延收入中。我們在主題606下記賬的合同負債與分配給開發服務績效義務的初始預付金額有關。合同負債根據發生的成本相對於預期總成本在履約義務期內予以確認。
截至2023年9月30日和2023年6月30日,我們有
|
|
|
|
|||||
|
|
2023年9月30日 |
|
|
2023年6月30日 |
|
||
未開單應收賬款 |
|
$ |
|
|
$ |
|
||
合同負債 |
|
|
|
|
|
|
||
合同負債,期初 |
|
$ |
|
|
$ |
|
||
收入已確認 |
|
|
( |
) |
|
|
( |
) |
根據即將結清的履約義務的估算變動確認的收入 |
|
|
|
|
|
( |
) |
|
為不再開始的履約義務而確認的收入 |
|
|
|
|
|
( |
) |
|
合同負債,期末 |
|
$ |
|
|
$ |
|
||
收入確認、開具發票和現金收款的時機會產生已開票的應收賬款和未開票的應收賬款(合同資產)和遞延收入(合同負債)。我們根據商定的合同條款向客户開具發票,通常是定期開具或在合同里程碑完成後開具發票。開具發票可能會在收入確認之後發生,從而產生未開票的應收賬款。我們可能會在確認收入之前收到客户的預付款,從而產生合同負債。合併資產負債表上報告的未開票應收賬款和遞延收入與KKC商業化協議有關。
來自合作者的收入
在合同開始時,我們會評估合作安排是否屬於主題808的範圍,以確定此類安排是否涉及既積極參與活動又面臨重大風險和回報的各方開展的聯合經營活動,具體取決於此類活動的商業成功。該評估是根據協議中所有各方的責任進行的。對於主題808範圍內包含多個記賬單位的合作安排,我們首先確定該安排中的哪些記賬單位屬於主題808的範圍,哪些要素屬於主題606的範圍。對於合作安排中根據主題808核算的記賬單位,通過類比權威會計文獻,確定並一致地應用適當的確認方法。對於根據主題606核算的合作安排要素,我們確認上述收入。收到的不符合主題606收入確認標準要求的對價在隨附的合併資產負債表中記錄為遞延收入,根據我們對何時確認此類金額的最佳估計,歸類為當期或長期遞延收入。
10
目錄
每股淨收益(虧損)
每股基本和攤薄後的淨收益(虧損)是使用該期間已發行普通股的加權平均數減去任何可能被回購或沒收的股票計算得出的。曾經有
就截至2023年9月30日的三個月攤薄後的每股淨收益的計算而言,可能具有稀釋性的證券不包括在攤薄後的每股淨收益的計算中,因為截至2023年9月30日,它們的加權平均行使價高於我們的加權平均股價;因此,截至2023年9月30日的三個月中,基本和攤薄後的每股淨虧損相同。就截至2022年9月30日的三個月攤薄後每股淨虧損的計算而言,潛在的攤薄後每股淨虧損的計算中不包括潛在的稀釋證券,因為它們的影響將是反稀釋的,因此,截至2022年9月30日的三個月,基本和攤薄後的每股淨虧損相同。
下表列出了在攤薄後每股淨收益(虧損)(以千計)計算中排除的潛在稀釋性股票:
|
|
在截至9月30日的三個月中 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
股票期權 |
|
|
|
|
|
|
||
認股證 |
|
|
|
|
|
|
||
限制性庫存單位 |
|
|
|
|
|
|
||
反攤薄股票總額 |
|
|
|
|
|
|
||
最近的會計公告
最近採用
2016年6月,財務會計準則委員會(FASB)發佈了經修訂的2016-13年度會計準則更新《金融工具——信用損失(主題326):金融工具信用損失的衡量》(“ASU 2016-13”)。亞利桑那州立大學2016-13年度的修正案除其他外,要求按攤銷成本計量的金融資產按預期收取的淨額列報,而先前的美國公認會計原則將確認推遲到可能發生虧損之後。亞利桑那州立大學2016-13年度的修正案對2022年12月15日之後開始的財政年度有效,包括這些財政年度內的過渡期,允許提前通過。亞利桑那州立大學2016-13年度的通過並未對我們的財務報表和相關披露產生重大影響。
最近發行
3。資產負債表詳情
財產和設備
財產和設備包括以下物品,以千計:
|
|
|
|
|
|
|
||
|
|
2023年9月30日 |
|
|
2023年6月30日 |
|
||
傢俱和設備 |
|
$ |
|
|
$ |
|
||
租賃權改進 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
減去:累計折舊 |
|
|
( |
) |
|
|
( |
) |
財產和設備,淨額 |
|
$ |
|
|
$ |
|
||
截至2023年9月30日和2022年9月30日的三個月,財產和設備的折舊費用在簡明合併現金流量表中列報。
11
目錄
應計負債
應計負債包括以下各項,以千計:
|
|
|
|
|
|
|
||
|
|
2023年9月30日 |
|
|
2023年6月30日 |
|
||
應計臨牀前和臨牀試驗費用 |
|
$ |
|
|
$ |
|
||
應計薪酬和福利(1) |
|
|
|
|
|
|
||
應計法律和專業服務 |
|
|
|
|
|
|
||
向 KKC 提供的應計補償 |
|
|
|
|
|
|
||
其他 |
|
|
|
|
|
|
||
應計負債總額 |
|
$ |
|
|
$ |
|
||
4。公允價值測量
由於這些工具的短期到期,現金等價物、短期投資和應付賬款等金融工具的賬面金額接近相關的公允價值。我們將多餘的現金投資於易於兑換成現金的金融工具,例如貨幣市場基金和美國政府證券。根據公允價值層次結構的定義,現金等價物和短期投資被歸類為第一級。截至 2023 年 9 月 30 日和 2023 年 6 月 30 日,我們有
2018年5月,我們發行了與私募普通股相關的認股權證。根據認股權證的條款,如果收購我們,本可以要求我們以現金結算認股權證,因此,認股權證必須按公允價值計量,並在簡明的合併資產負債表中列報為負債。我們在發行時使用Black-Scholes估值模型記錄了認股權證的公允價值,並被要求在每個報告日對認股權證進行重估,並在我們的簡明合併運營報表中記錄公允價值的任何變化,直至2023年5月到期。認股權證的估值被視為公允價值層次結構的第三級,因為在估值中需要使用對公允價值衡量重要且不可觀察的假設。用於確定認股權證負債估計公允價值的輸入包括標的股票在估值日的估計公允價值、認股權證的估計期限、無風險利率、預期分紅和標的股票的預期波動率。權證負債公允價值衡量中使用的不可觀察的重要輸入是波動率和認股權證的估計期限。通常,標的股票公允價值和預計期限的增加(減少)將導致與公允價值衡量的方向相似的影響。三級認股權證負債公允價值的變化反映在截至2022年9月30日的三個月的簡明合併運營報表中。在截至2023年9月30日的三個月中而截至2023年6月30日的財年,有
計算截至當日認股權證負債的公允價值 2023 年 6 月 30 日,使用了以下假設:
|
|
|
|
|
無風險利率 |
|
|
% |
|
預期壽命(年) |
|
|
|
|
預期波動率 |
|
|
% |
|
股息收益率 |
|
|
% |
|
加權平均撥款日期公允價值 |
|
$ |
|
|
下表彙總了截至2022年9月30日的三個月中我們的三級認股權證負債的估計公允價值的變動(以千計):
|
|
|
|
|
截至2022年6月30日的餘額 |
|
$ |
|
|
負債分類認股權證的估計公允價值的變化 |
|
|
( |
) |
截至2022年9月30日的餘額 |
|
$ |
|
|
12
目錄
5。一次性解僱補助金
關於我們共同決定停止在日本以外地區開發贊德利西布,我們於2022年12月宣佈調整臨牀開發工作,精簡了我們的組織,以繼續對我們較早的兩個臨牀階段資產voruciclib和 ME-344 進行臨牀開發。因此,同樣在2022年12月,我們的董事會批准了分期裁員(“裁員”),影響了
下表彙總了我們與應計負債中包含的一次性員工解僱補助金相關的活動(以千計):
|
|
一次性員工解僱福利 |
|
|
截至 2023 年 6 月 30 日的餘額 |
|
$ |
|
|
應計重組增加 |
|
|
|
|
現金支付 |
|
|
( |
) |
截至 2023 年 9 月 30 日的餘額 |
|
$ |
|
|
6。承諾和意外開支
我們已經與各種顧問和第三方簽訂了合同,以協助我們為領先的藥物化合物進行臨牀前研發和臨牀試驗工作。合同可以隨時終止,但我們有義務向供應商償還截至終止之日所產生的任何時間或費用。我們還與某些在職員工簽訂了僱傭協議,其中規定,如果他們在特定情況下終止僱用,則應支付遣散費,並加快股份獎勵的歸屬。
訴訟
公司可能會不時參與正常業務過程中出現的各種訴訟、法律訴訟或索賠。管理層認為,截至2023年9月30日,沒有針對公司的索賠或訴訟待處理,這些索賠或訴訟將對公司的業務、流動性、財務狀況或經營業績產生重大不利影響。但是,訴訟存在固有的不確定性,這些或其他問題可能會不時產生不利結果,這可能會損害我們的業務。
賠償
根據我們經修訂和重述的備忘錄和公司章程,公司對其高級管理人員和董事在擔任此類職務期間的某些事件或事件負有賠償義務,但有一定的限制。迄今為止沒有索賠,公司有一份董事和高級管理人員責任保險單,這可能使其能夠收回為未來索賠支付的任何金額的一部分。
預售許可協議
如中所述 註釋 8.其他許可協議,我們是與Presage簽訂的許可協議的當事方,根據該協議,我們可能需要在實現某些開發、監管和商業里程碑後支付未來款項,並根據淨銷售額支付潛在的未來特許權使用費。截至 2023 年 9 月 30 日,我們有
7。許可協議
協和麒麟有限公司許可、開發和商業化協議
在 2020年4月,我們簽訂了KKC商業化協議,根據該協議,我們根據我們控制的某些專利和專有技術向KKC授予了共同獨家、可再許可、付費的許可,用於在美國開發和商業化贊德利西布和任何含有贊德利西布的藥品(“美國許可證”),以及獨家的(受某些保留的履行KKC商業化義務的保留權利的約束)協議),可再許可,付款,根據我們控制的某些專利和專有技術進行許可開發和商業化贊德利西布和任何含有贊德利西布的藥品,用於美國以外國家的所有人體適應症KKC根據KKC控制的某些專利和專有技術向我們授予了共同獨家、可再許可的許可,用於在美國為所有人體適應症開發和商業化zandelisib,並根據某些專利授予了共同獨家、可再許可、免版税、全額付費的許可
13
目錄
專有技術 由KKC控制,以履行我們在KKC商業化協議下在前美國的義務。KKC 向我們支付了首筆不可退還的款項 $
2022年11月,我們和KKC共同決定停止在美國開發贊德利西布,2023年5月,KKC決定停止在日本開發贊德利西布。考慮到停止在全球範圍內開發zandelisib的決定,雙方簽訂了終止協議
我們確定KKC商業化協議是根據主題808的合作安排,該協議包含多個記賬單位,因為我們和KKC都是開發和商業化活動的積極參與者,面臨的重大風險和回報取決於該安排活動的商業成功。我們確定美國許可證是主題808範圍內的單獨記賬單位,不是主題606下的交付品,而在其領土內發放給KKC的許可證和相關開發服務屬於主題606的範圍。參見內部討論 收入確認的子節 注意事項 2。重要會計政策摘要.
我們評估了ASC 606下的終止協議,並確定該協議符合合同修改的要求,該修改改變了KKC商業化協議的範圍,與清盤活動相關的剩餘商品和服務有待轉讓。履行我們向KKC提供同情用途供應的履約義務的成本確定為 最低限度因此,在KKC商業化協議的背景下並不重要。截至2023年9月30日,與同情用途供應相關的活動已經完成。
隨着終止協議的執行,我們重新獲得了全部的全球權利(受KKC有限的同情使用權的限制),KKC沒有進一步在美國開發、使用或商業化zandelisib的權利,我們也沒有任何剩餘的履約義務,從KKC收到的所有對價均不可退還。因此,截至2023年6月30日的剩餘長期遞延收入,為 $
8。其他許可協議
預售許可協議
2017年9月,我們作為被許可方與Presage Biosciences, Inc.(“Presage”)簽訂了許可協議。根據許可協議條款,Presage授予我們開發、製造和商業化voruciclib(一種臨牀階段、口服和選擇性CDK抑制劑及相關化合物)的全球獨家權利。作為交換,我們支付了 $
百濟神州合作
2018年10月,我們與百濟神州有限公司(“百濟神州”)開展臨牀合作,評估贊德利西布與百濟神州的zanubrutinib(名為Brukinsa®)(一種布魯頓酪氨酸激酶抑制劑)聯合用於治療B細胞惡性腫瘤患者的安全性和有效性。根據臨牀合作協議的條款,我們修改了正在進行的1b期試驗,將贊德利西布與扎努布替尼聯合用於B細胞惡性腫瘤患者的評估納入其中。研究費用由各方平均分擔,我們同意提供贊德利西布,百濟神州同意提供扎努布替尼。我們將百濟神州報銷的費用記錄為研發費用的減少額。我們保留了以下各項的全部商業權利
14
目錄
贊德利西布和百濟神州保留了zanubrutinib的全部商業權利。 隨着日本以外的贊德利西布計劃的終止,該臨牀合作於2023年9月28日終止。
9。租賃
2020年7月,我們簽訂了租賃協議(“初始租賃協議”),價格約為
經修訂的租賃協議還規定了額外的
租賃協議在所列期間的總運營租賃成本如下(以千計):
|
|
在截至9月30日的三個月中 |
|||||||
|
|
2023 |
|
|
2022 |
|
|
||
運營租賃成本 |
|
$ |
|
|
$ |
|
|
||
可變租賃成本 |
|
|
|
|
|
|
|
||
總租賃成本包含在一般和管理費用中 |
|
$ |
|
|
$ |
|
|
||
與我們的經營租賃相關的補充現金流信息如下(以千計):
|
|
截至9月30日的三個月 |
|
|
|||||
|
|
2023 |
|
|
2022 |
|
|
||
為計量租賃負債中包含的金額而支付的現金: |
|
|
|
|
|
|
|
||
來自經營租賃的運營現金流 |
|
$ |
|
|
$ |
|
|
||
|
|
|
|
|
|
|
|
||
以下是截至目前租賃協議下與經營租賃負債對賬的未來最低租賃付款明細表 2023 年 9 月 30 日(以千計):
|
|
2023年9月30日 |
|
|
截至 2024 年 6 月 30 日的財政年度的剩餘時間 |
|
$ |
|
|
截至6月30日的年份 |
|
|
|
|
2025 |
|
|
|
|
2026 |
|
|
|
|
2027 |
|
|
|
|
2028 |
|
|
|
|
此後 |
|
|
|
|
租賃付款總額 |
|
|
|
|
減去:現值折扣 |
|
|
( |
) |
經營租賃負債總額 |
|
$ |
|
|
|
|
|
|
|
資產負債表分類-經營租賃 |
|
|
|
|
經營租賃責任 |
|
$ |
|
|
長期經營租賃負債 |
|
|
|
|
經營租賃負債總額 |
|
$ |
|
|
|
|
|
|
|
其他資產負債表信息-經營租賃 |
|
|
|
|
加權平均剩餘租賃期限(以年為單位) |
|
|
|
|
加權平均折扣率 |
|
|
% |
|
15
目錄
10。股東權益
股權交易
認股證
2023 年 5 月,未兑現的認股權證
截至 2023 年 9 月 30 日,我們還有未兑現的認股權證可供購買
資本存量描述
我們的總法定股本為
常見 股票
普通股持有人有權
首選 股票
我們的董事會有權發佈最多
11。基於股份的薪酬
我們使用基於股權的薪酬計劃為員工提供長期績效激勵。這些激勵措施主要包括股票期權和限制性股票單位。2008年12月,我們通過了經不時修訂和重述的MEI Pharma, Inc.2008年股票綜合股權補償計劃(“綜合計劃”),根據該計劃
2021年5月,我們通過了2021年激勵計劃(“激勵計劃”),根據該計劃
所有股票獎勵的基於股份的薪酬支出總額包括所列期間的以下各項(以千計):
|
|
在截至9月30日的三個月中 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
研究和開發 |
|
$ |
( |
) |
|
$ |
|
|
一般和行政 |
|
|
|
|
|
|
||
基於股份的薪酬總額 |
|
$ |
|
|
$ |
|
||
16
目錄
股票期權
授予員工的股票期權背心
我們的股票期權活動和相關數據摘要如下:
|
|
的數量 |
|
|
加權平均值 |
|
|
加權平均值 |
|
|
聚合 |
|
||||
截至 2023 年 6 月 30 日的未付款 |
|
|
|
|
$ |
|
|
|
|
|
|
|
||||
已授予 |
|
|
|
|
$ |
|
|
|
|
|
|
|
||||
被沒收 |
|
|
( |
) |
|
$ |
|
|
|
|
|
|
|
|||
截至2023年9月30日未付清 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
2023 年 9 月 30 日歸屬並可行使 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
截至2023年9月30日,已發行期權的總內在價值是根據標的期權的行使價與我們的普通股收盤價之間的差額計算得出的 $
與非既得股票期權相關的未確認薪酬支出總額d $
我們使用Black-Scholes估值模型來估算股票期權的授予日公允價值。要計算這些公允價值,
|
|
在截至9月30日的三個月中 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
無風險利率 |
|
|
% |
|
|
% |
||
預期壽命(年) |
|
|
|
|
|
|
||
預期波動率 |
|
|
% |
|
|
% |
||
股息收益率 |
|
|
% |
|
|
% |
||
加權平均撥款日期公允價值 |
|
$ |
|
|
$ |
|
||
12。後續事件
開啟
如註釋1中更全面地描述的那樣。業務描述和陳述基礎,我們宣佈了與安生基金和纜車資本的合作協議(“合作協議”),自2023年10月31日起生效。 2023 年 11 月 6 日,根據合作協議,董事會宣佈特別現金股息為 $
17
目錄
第 2 項。管理層對財務狀況和經營業績的討論和分析
本10-Q表季度報告(“季度報告”)包括經修訂的1933年《證券法》(“證券法”)第27A條和經修訂的1934年《證券交易法》(“交易法”)第21E條所指的前瞻性陳述。除本季度報告中包含的歷史事實陳述以外的所有陳述,包括有關未來財務狀況、業務戰略以及管理層未來運營計劃和目標的陳述,均為前瞻性陳述。“相信”、“可能”、“將”、“估計”、“繼續”、“預測”、“打算”、“應該”、“計劃”、“期望” 等詞語以及與我們相關的類似表述旨在識別前瞻性陳述。我們的這些前瞻性陳述主要基於當前對未來事件和財務趨勢的預期和預測,我們認為這些事件和財務趨勢可能會影響我們的財務狀況、經營業績、業務戰略和財務需求。這些前瞻性陳述受許多風險、不確定性和假設的影響,包括但不限於我們在2023年9月26日向美國證券交易委員會提交的2023年10-K表年度報告(“2023年年度報告”)中 “風險因素” 中描述的風險、不確定性和假設。以下是我們面臨的主要風險的摘要:
摘要風險因素
我們的業務面臨許多風險和不確定性,在投資我們的普通股之前,您應該考慮這些風險和不確定性。以下是我們面臨的主要風險的摘要:
18
目錄
19
目錄
這些風險並非窮盡無遺。本報告的其他部分以及我們向美國證券交易委員會(“SEC”)提交的其他文件包括可能對我們的業務和財務業績產生不利影響的其他因素。此外,我們在競爭激烈且瞬息萬變的環境中運營。新的風險因素不時出現,我們無法預測所有風險因素,也無法評估所有因素對我們業務的影響,也無法評估任何因素或因素組合在多大程度上可能導致實際結果與任何前瞻性陳述中包含的結果存在重大差異。
您不應依賴前瞻性陳述作為對未來事件的預測。我們無法向您保證,前瞻性陳述中反映的事件和情況將會實現或發生。儘管我們認為前瞻性陳述中反映的預期是合理的,但我們無法保證未來的業績、活動水平、業績或成就。過去的表現可能不是未來業績的指標。以下討論完全受本季度報告其他地方的簡明合併財務報表及其附註中列出的更詳細信息的限制,以及我們向美國證券交易委員會提交的2023年年度報告中包含的經審計的財務報表及其附註中列出的更詳細的信息,應與這些信息一起閲讀。經營業績不一定代表未來可能出現的業績。
概述
MEI Pharma, Inc.(納斯達克股票代碼:MEIP)是一家臨牀階段的製藥公司,致力於開發新的差異化癌症療法。我們通過收購有前途的抗癌藥物來建立我們的產品線,並酌情通過臨牀開發、戰略合作伙伴關係、外包許可或商業化為項目創造價值。我們的腫瘤藥物開發方法是評估我們的候選藥物與標準護理療法的組合,以克服已知的耐藥機制,滿足明確的醫療需求,從而改善患者的受益。候選藥物管道包括口服細胞週期素依賴激酶9(“CDK9”)抑制劑voruciclib和靶向氧化磷酸化途徑的靜脈注射小分子線粒體抑制劑 ME-344。我們的普通股在納斯達克資本市場上市,股票代碼為 “MEIP”。
我們在2022年12月宣佈調整臨牀開發工作,將重點放在目前分別處於1期和1b期臨牀計劃的兩項臨牀資產voruciclib和 ME-344 之後,我們啟動了分期裁員以簡化運營,自宣佈以來,全職員工減少了61%。我們認為,通過分別報告正在進行和計劃中的voruciclib和 ME-344 1期和1b期臨牀項目的臨牀數據,我們的現金足以為至少12個月的運營提供資金。
20
目錄
2023年10月31日,我們宣佈了與安信基金(“安生”)和纜車資本(“纜車”)的合作協議(“合作協議”),其中包含以下關鍵條款:
作為合作協議的一部分,Anson和Cable Car撤回了徵求同意的請求,並同意遵守慣常的停頓條款。此外,我們將報銷Anson和Cable Car迄今為止與我們合作的相關費用和開支,金額不超過120萬美元。截至2023年9月30日,沒有與合作協議相關的任何支出或應計款項。
2023年11月6日,我們宣佈,根據合作協議,董事會宣佈向2023年11月17日營業結束時的登記股東派發每股普通股1.75美元的特別現金股息,該股息將於2023年12月6日支付。
臨牀開發項目
我們的臨牀階段候選藥物管線包括口服 CDK9 抑制劑 voruciclib 和 ME-344(一種靶向線粒體氧化磷酸化途徑的靜脈注射小分子線粒體抑制劑)。

Voruciclib:1期研究中的強效口服CDK9抑制劑
Voruciclib是一種有效的選擇性口服CDK9抑制劑。Voruciclib正在一項1期試驗中進行研究,該試驗評估了急性髓系白血病(“AML”)和B細胞惡性腫瘤患者的劑量和時間表,並與急性髓細胞淋巴瘤2(“BCL2”)抑制劑venetoclax(以Venclexta® 的名義銷售)聯合用於急性髓細胞白血病(“AML”)和B細胞惡性腫瘤患者的劑量和時間表。Voruciclib還在臨牀前研究中接受評估,以探索各種實體瘤癌的潛在活性,包括與靶向RAS信號通路的療法(例如KRAS抑制劑)聯合使用。
21
目錄
Voruciclib 科學概述:細胞週期信號
CDK9在細胞週期調節中具有重要功能,包括調節癌症的兩個治療靶標:
從歷史上看,直接抑制MCL1和MYC一直很困難,但是CDK9是間接靶向這些致癌基因的一種有前途的方法。
Voruciclib:抑制 MCL1
MCL1 的過度表達經常出現在許多腫瘤類型中,與腫瘤發生、預後不良和耐藥性密切相關。此外,據瞭解,提高對MCL1的監管在抵抗venetoclax方面起着作用。CDK9 是 MCL1 的已知轉錄調節劑。
在臨牀前研究中,voruciclib顯示出對MCL1的劑量依賴性抑制;2017年12月,發表在《自然科學報告》雜誌上的一項針對voruciclib的研究報告稱,voruciclib與 BCL-2 抑制劑venetoclax的組合能夠抑制兩種細胞存活的主要調節劑,MCL-1 和 BCL-2,並在DLBCL細胞的侵襲性子集中產生協同抗腫瘤作用。
在2020年發表的一份經過同行評審的手稿中,有報道稱,在急性髓細胞白血病臨牀前模型中,voruciclib對CDK9的抑制會協同增強 BCL-2 抑制劑venetoclax誘導的細胞死亡。數據表明,voruciclib與venetoclax協同作用,在急性髓細胞白血病細胞系和原發患者樣本中誘導程序性細胞死亡或細胞凋亡。研究還表明,voruciclib下調了MCL1,這與voruciclib和venetoclax之間的協同作用有關,而且voruciclib下調了MYC,這也有助於與venetoclax的協同作用。
該研究表明,voruciclib有可能成為一種有吸引力的治療藥物,用於與venetoclax或其他 BCL-2 抑制劑聯合治療癌症,以解決與MCL1相關的潛在耐藥性,並支持我們正在進行的voruciclib在B細胞惡性腫瘤和急性髓細胞白血病中的臨牀評估。
Voruciclib:抑制 MYC
許多癌症與 MYC 的過度表達有關,MYC 是一種調節細胞增殖和生長的轉錄因子。CDK9 是已知的 MYC 轉錄調節劑,也是 MYC 蛋白磷酸化的調節劑。美國癌症研究協會(“AACR”)2021年年會上在臨牀前模型中報告的數據表明,voruciclib:
提出的研究表明,視MYC的活性而定,voruciclib可能是治療血液癌和實體瘤的有吸引力的治療藥物。
臨牀項目
我們正在評估voruciclib劑量和時間表的1期臨牀試驗中評估血液系統惡性腫瘤患者。該試驗首先評估了先前標準療法失敗後復發和難治性B細胞惡性腫瘤和急性髓細胞白血病患者的單一療法voruciclib的劑量和時間表,以確定安全性、初步療效和最大耐受劑量。在完成該研究的單一療法劑量遞增階段後,我們現在正在評估voruciclib與venetoclax(一種 BCL-2 抑制劑)聯合使用的劑量和時間表,最初用於急性髓細胞白血病患者。1期研究的主要目標是評估voruciclib與venetoclax聯合給藥的安全性和可能的協同作用。 預計將在2024年初公佈voruciclib的1期研究的臨牀數據。
22
目錄
正如我們在2023年5月報道的那樣,該研究的voruciclib單一療法劑量遞增/擴大階段已經完成,該研究招收了40名復發和難治性(“R/R”)急性髓細胞白血病和B細胞惡性腫瘤患者。在40名入組患者中,前16名患者每天連續給藥50和100毫克,接下來的24名患者間歇性給藥(在28天週期內連續14天接受治療),分別為100、150和200 mg。所有患者均接受了大量預治療,平均為先前3種療法(範圍為1-8)。與voruciclib相關的最常見(≥5%)的不良事件是腹瀉(15%)、噁心(10%)和疲勞(7.5%),均為1或2級。在選擇進一步開發的間歇給藥時間表中,未觀察到劑量限制毒性(DLT),沒有三級或更高的藥物相關毒性,在達到最大耐受劑量之前,劑量遞增停止在200 mg,因為血漿濃度達到被認為足以抑制靶點的水平。在接受評估的最高劑量治療的10名急性髓細胞白血病患者中,間歇性療程為每天200 mg,這些患者的疾病控制率為50%,評估時的平均治療持續時間為72天(範圍為27-127)。
正如我們在2023年5月的最新報告中進一步報道的那樣,評估復發/難治性急性髓細胞白血病患者中使用voruciclib和venetoclax聯合用藥的第二階段研究正在進行中。第一個處於劑量遞增階段的隊列招收了6名患者,每隔一天服用50毫克的voruciclib,持續14天,在28天週期內不進行任何治療,外加標準劑量的venetoclax。所有患者都接受了大量的預治療,平均值為先前三種療法。值得注意的是,此前所有患者在接受venetoclax治療後均出現進展。未觀察到 DLT 或重疊的骨髓毒性。疾病控制率為50%,其中包括一名先前接受過包括幹細胞移植在內的五種療法並在第一週期治療後獲得部分緩解的患者,以及第二名病情穩定且輸血需求減少的患者。隨後,研究安全審查委員會批准了三種劑量水平的入組:50 mg、100 mg、150 mg和200 mg,連續給藥14天,然後在28天週期內連續給藥14天,不進行任何治療。
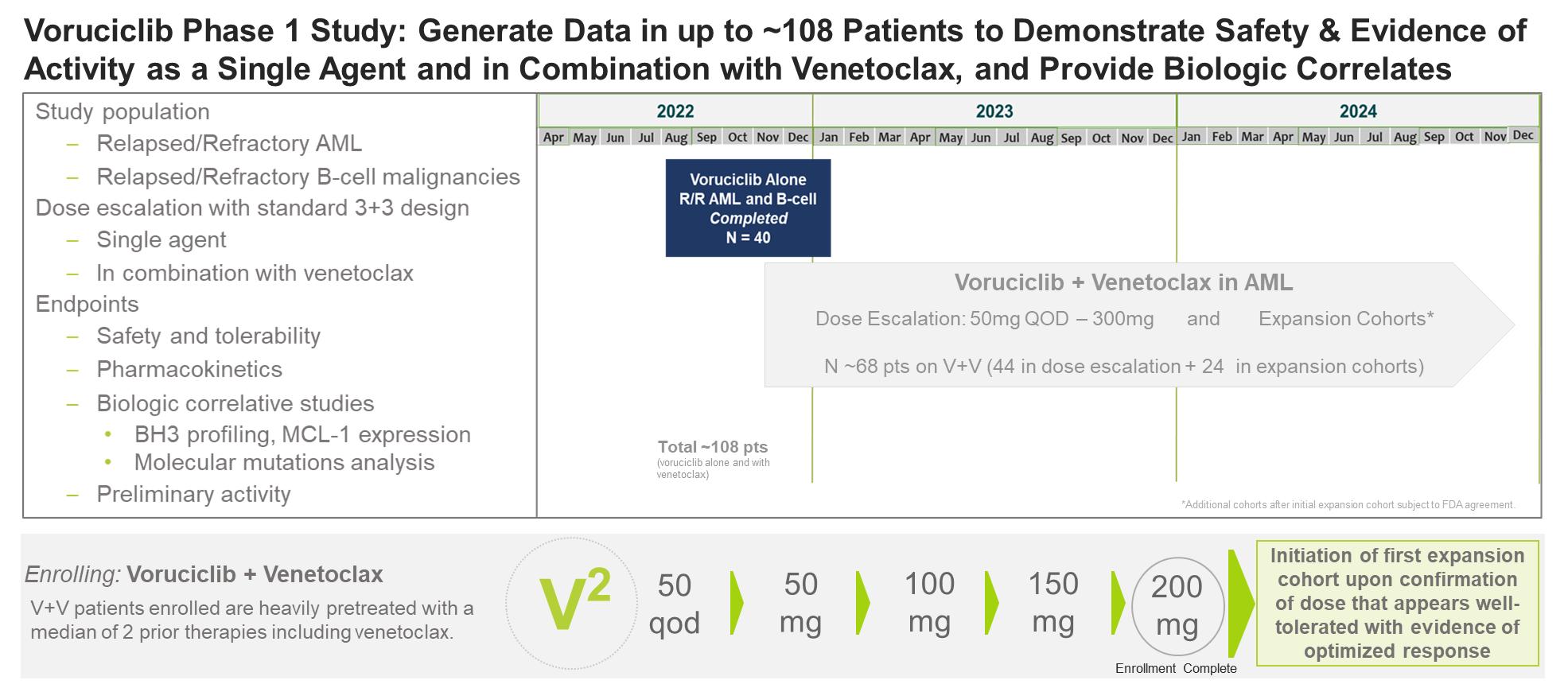
此前,在多項1期研究中,Voruciclib還對70多名實體瘤患者進行了評估。所有臨牀數據以及臨牀前研究的數據表明,voruciclib能夠在預計的每日劑量低至150 mg的情況下抑制其分子靶標。在一項臨牀研究中,評估了voruciclib與vemurafenib(以Zelboraf® 的名義銷售)聯合使用九名BRAF突變晚期/無法手術的惡性黑色素瘤患者。所有三名BRAF/MEK天真患者都取得了反應:兩次部分反應和一次完全反應。在這項研究中,voruciclib的劑量為每天150毫克,外加vemurafenib 720 mg或960毫克,每天兩次,週期為28天。最常見的不良事件是疲勞、便祕、腹瀉、關節痛和頭痛。3級疲勞的一個例子是劑量限制,沒有報告與voruciclib相關的嚴重不良事件。其他臨牀研究評估了voruciclib在實體瘤患者中的劑量高達850 mg,這表明有更多證據表明了潛在的生物活性,而且不良事件概況與同類其他藥物基本一致。
ME-344:具有組合潛力的臨牀階段線粒體抑制劑
ME-344 是一種新的線粒體抑制劑候選藥物,在臨牀前研究中顯示出腫瘤選擇活性。它靶向參與三磷酸腺苷(ATP)產生的 OXPHOS 途徑。通過幹擾細胞的主要能量來源 ATP 的產生,ME-344 在臨牀前已被證明可以通過誘導 DNA 片段和一種稱為自噬的過程(即細胞自我消耗)來誘發癌細胞死亡。ME-344 還在臨牀前和臨牀研究中證明瞭抗腫瘤活性的證據。
23
目錄
ME-344 科學概述:癌症代謝
以 ATP 形式提供的能量可促進腫瘤新陳代謝,支持細胞分裂和生長。因此, 腫瘤細胞通常表現出較高的代謝率,以支持腫瘤細胞的存活和增殖。這種新陳代謝的增強需要以ATP的形式持續供應能量。ATP的兩個主要來源是稱為線粒體的特殊細胞器中的氧化磷酸化,以及通過糖酵解途徑進行碳水化合物的代謝,糖酵解途徑在癌細胞中通常不受調節,這種現象稱為華堡效應。
據瞭解,抗血管生成藥物,例如血管內皮生長因子(“VEGF”)抑制劑貝伐珠單抗(以阿瓦斯汀® 的名義銷售),可能會降低腫瘤的糖酵解率。結果,腫瘤代謝隨後可能會轉移到線粒體以產生能量。在這種情況下,在使用抗血管生成藥物治療的情況下出現腫瘤可塑性,同時通過使用線粒體藥物抑制劑 ME-344 抑制 ATP 的產生,靶向替代代謝來源,這為臨牀評估提供了重要的治療機會。
MEI 正在對 ME-344 與 VEGF 抑制聯合進行評估,並獲得了該方法的初步臨牀驗證 一項由研究者發起的與貝伐珠單抗聯合的多中心、隨機、對照的機會之窗臨牀試驗,共招收了42名人類表皮生長因子受體2(“HER2”)陰性乳腺癌患者。此外,我們目前正在評估轉移性結直腸癌患者中 ME-344 和貝伐珠單抗的組合。
臨牀項目
ME-344 已作為單一藥物進行了臨牀前和臨牀評估,並與貝伐珠單抗等抗血管生成藥物聯合使用。當作為單一藥物進行評估時,ME-344 在 1b 期試驗中顯示出對難治性實體瘤具有活性的證據,在臨牀前研究中,使用 ME-344 治療的腫瘤細胞會導致 ATP 快速流失和癌細胞死亡。除了單一藥物活性外,ME-344 還顯示出與抗血管生成療法聯合使用的巨大潛力。
臨牀前研究表明,抗血管生成藥的一個結果是降低腫瘤糖酵解率,這是減緩腫瘤生長的一種機制。但是,當面對糖酵解減少和ATP產生減少時,腫瘤代謝能夠轉向線粒體代謝以產生能量,從而支持腫瘤的持續增殖。在這種情況下,在使用抗血管生成藥物治療的情況下出現腫瘤可塑性,同時使用 ME-344 靶向線粒體作為 ATP 的替代代謝來源可能會開啟重要的治療機會。
對這種組合使用 ME-344 的支持首次發表在 2016 年 6 月版的《細胞報告》上;與馬德里西班牙國家癌症研究中心合作的臨牀前數據表明,ME-344 對癌細胞具有線粒體特異性作用,包括與抑制血管內皮生長因子活性的藥物聯合使用時的抗腫瘤活性顯著增強。這些數據表明,由於抑制線粒體和糖酵解代謝,ME-344 與血管內皮生長因子抑制劑聯合使用具有潛在的抗癌作用,為研究者發起的 ME-344 與貝伐珠單抗聯合用於 HER2 陰性乳腺癌患者的試驗提供了基礎。
一項由研究者發起的多中心隨機對照臨牀試驗發表在2019年11月號的《臨牀癌症研究》上的結果,該試驗評估了42名早期 HER2 陰性乳腺癌女性中 ME-344 和貝伐珠單抗的組合,進一步支持了 ME-344 與抗血管生成療法的組合使用。
該試驗的主要目的是證明 ME-344 的生物活性,衡量標準是與單獨接受貝伐珠單抗的對照組相比,核蛋白 Ki67(其表達與腫瘤細胞增殖和生長密切相關)在第 0 天至第 28 天降低。次要目標包括確定 ME-344 生物活性是否與血管正常化相關。數據顯示 ME-344 治療組具有顯著的生物活性:
治療的耐受性總體良好;報告了三起 3 級高血壓不良事件,兩起發生在 ME-344 組,一起發生在貝伐珠單抗組。
我們早些時候針對難治性實體瘤患者進行的 ME-344 首次人體單藥物 1 期臨牀試驗的結果發表在 2015 年 4 月 1 日版的《癌症》上。結果表明,在21名可評估的患者中,有8名(38%)接受了治療
24
目錄
ME-344 的病情穩定或更好,其中包括五名患者無進展存活率,存活時間至少是進入試驗前最後一次治療的兩倍。此外,其中一名患者,一名經過大量預先治療的小細胞肺癌患者,已得到證實的部分緩解,並進行了兩年的研究。當劑量等於或小於 10 mg/kg 時,ME-344 的耐受性通常良好,每週一次交付,持續時間較長。與治療相關的不良事件包括噁心、頭暈和疲勞。在 15 mg/kg 和 20 mg/kg 劑量水平下均觀察到劑量限制毒性,主要包括 3 級周圍神經病變。

在一項評估復發結直腸癌患者的 1b 期研究中,我們正在推進 ME-344 與抗血管生成抗體貝伐珠單抗的聯合應用。該研究將標準療法失敗後的進展性疾病患者入組,患者接受治療直至疾病進展或不耐受。主要目標是無進度生存。次要終點包括總體反應率、反應持續時間、總體存活率和安全性。S在正在進行的 ME-344 1b 期研究中,第一組 20 名患者的安全和療效數據預計將在 2024 年上半年公佈。 此外,ME-344 還可能具有抗血液系統惡性腫瘤的臨牀潛力。在 AACR 2022年年會上,一份海報演示報告了探討 ME-344 增強venetoclax抗反洗錢活性的能力的臨牀前研究結果。評估標準耐藥性急性髓細胞白血病細胞系和復發或難治性急性髓細胞白血病患者樣本中 ME-344 與 venetoclax 組合的體外和體內臨牀前研究數據表明,ME-344 無論單獨使用還是與 venetoclax 聯合使用,均可抑制嘌呤生物合成、抑制氧化磷酸化、誘導細胞凋亡並降低 MCL-1,共同靶向急性髓細胞白血病細胞的代謝脆弱性。數據表明,ME-344 和 venetoclax 可以延長 MV4-11 和 mv4-11/ARAC-R 衍生的異種移植急性髓細胞白血病模型中的存活時間。海報得出的結論是,ME-344 增強了 venetoclax 對急性髓細胞白血病細胞(包括耐藥性 AML)的活性。
Zandelisib:PI3K抑制劑概述
贊德利西布是一種口服、每天一次的選擇性PI3K△抑制劑,根據2020年4月簽訂的全球許可、開發和商業化協議,我們與KKC共同開發。
Zandelisib完成了全球2期TIDAL研究,評估了在先前至少兩種全身療法(包括化療和抗CD20抗體)失敗後,Zandelisib作為復發/難治性(“r/r”)濾泡性淋巴瘤(“FL”)成人中的單一藥物。間歇給藥組共招收了121名復發/難治性FL患者,其中91人被納入主要療效人羣,用於評估客觀緩解率(“ORR”)和緩解持續時間(“DOR”)。FL 患者的平均年齡為 64 歲;45% 的患者在上次治療後出現難治性疾病,患者接受的治療中位數為先前的 3 條治療路線(範圍:2-8)。作為反應誘導療法,患者每天服用贊德利西布一次,週期為28天,然後在隨後的每個28天週期的前七天每天給藥一次,該時間表稱為間歇給藥療法(IDT)。
根據獨立審查,ORR為73%(95%置信區間,63.9至80.4%),完全迴應率為38%(95%置信區間,29.3%至47.3%),DOR中位數為16.4個月(95%置信區間,9.5個月未達到)。隨訪中位數為14.3個月(範圍為1至30.5個月),PFS中位數為11.6個月(95%置信區間,8.3%未達到)。21名患者(17%)因不良事件停用了贊德利西布。3-4級相關毒性為 6% 的患者出現腹瀉、5% 的肺部感染、3% 的皮疹、3% 的結腸炎、3% 的 AST 升高和 1% 的非感染性肺炎。
25
目錄
2022年3月,我們和KKC報告了與美國食品藥品管理局第二階段會議結束的結果,在該會議中,該機構不鼓勵根據單臂TIDAL二期試驗的數據提交申請。在這次會議上,美國食品藥品管理局表示,單臂研究(例如TIDAL二期試驗)生成的數據不足以充分評估評估惰性非霍奇金淋巴瘤的PI3K√抑制劑的風險/益處。當時,美國食品藥品管理局強調,該公司將繼續努力進行正在進行的評估復發或難治性濾泡性或邊緣區淋巴瘤患者的隨機3期COAST試驗。隨後,在美國食品藥品管理局腫瘤藥物諮詢委員會2022年4月的會議上,該委員會投票決定,未來對用於血液系統惡性腫瘤的PI3K√抑制劑的批准應得到隨機數據的支持。
2022年11月,我們和KKC在2022年3月第二階段會議結束後的後續會議上與美國食品藥品管理局會面。在這次會議上,美國食品和藥物管理局為COASTAL三期試驗的設計和統計分析提供了進一步的指導。在11月的會議之後,兩家公司共同得出結論,符合美國食品和藥物管理局最新指導方針的臨牀試驗,包括修改正在進行的COASTAL試驗,可能無法在支持進一步投資或足夠確定監管要求以獲得批准以證明持續全球開發努力合理的時間內完成。因此,我們和KKC共同決定停止在全球範圍內開發zandelisib用於治療日本以外的惰性非霍奇金淋巴瘤。停止在日本以外的地區開發贊德利西布是基於美國食品藥品管理局最新監管指導的商業決策,與迄今生成的贊德利西布臨牀數據無關。在共同決定終止日本境外開發後,我們和KKC開始關閉日本以外所有正在進行的zandelisib臨牀研究,包括COASTAL三期試驗、TIDAL二期試驗和CORAL二期試驗。
隨後,在2023年5月,KKC決定停止在日本開發贊德利西布。日本停用贊德利西布是KKC根據PMDA的最新監管指導做出的商業決定,與迄今生成的贊德利西布臨牀數據無關。
2023年7月14日,我們與KKC簽訂了終止協議(“終止協議”),終止雙方之間的所有協議,並在全球範圍內停止進一步的zandelisib臨牀開發。截至2023年9月30日,與同情用途供應相關的活動已經完成。我們預計將在2024財年完成與KKC商業化協議相關的清盤活動。
KKC 許可、開發和商業化協議
2020年4月,我們簽訂了KKC商業化協議,根據該協議,根據我們控制的某些專利和專有技術,我們向KKC授予了共同獨家、可再許可、付費的許可,用於在美國開發和商業化贊德利西布和任何含有贊德利西布的藥品(“美國許可證”),以及獨家的(受某些保留的履行KKC商業義務的保留權利的約束)授權協議),可再許可,付費,根據我們控制的某些專利和專有技術進行許可開發和商業化贊德利西布和任何含有贊德利西布的藥品,用於美國以外的國家(“前美國” 和 “前美國”)的所有人體適應症許可證”)。同樣根據KKC商業化協議,我們在KKC控制的某些專利和專有技術下獲得了共同獨家、可再許可的許可,用於在美國開發和商業化zandelisib,用於所有人體適應症;根據KKC控制的某些專利和專有技術,我們獲得了共同獨家、可再許可、免版税、全額付費的許可,以履行我們在美國的義務,並獲得了1億美元的首期不可退還的付款。此外,在日本,KKC商業化協議包括潛在的監管和商業化里程碑付款,以及zandelisib在日本的淨銷售額的特許權使用費,這些特許權使用費從青少年時期開始分級。在2023年7月14日執行終止協議之前,KKC負責zandelisib在前美國的開發和商業化,除某些例外情況外,所有與之相關的費用全權負責。我們還向KKC提供了某些在前美國開發和商業化贊德利西布所需的藥品供應,前提是KKC將在切實可行的情況下儘快承擔出境美國的生產責任。
如上所述,2023年7月14日,我們與KKC簽訂了終止協議,以共同終止最初的KKC商業化協議和雙方之間的所有其他相關協議。根據該條款國家協議:
截至2023年6月30日,我們有6,490萬美元與KKC商業化協議相關的遞延收入,其中6,450萬美元分配給美國許可,31.7萬美元用於開發服務業績
26
目錄
通過結束相關審判, 這些發展活動的相應表現繼續確認這些債務.正如進一步討論的那樣 注意事項 7。許可協議,在截至2023年9月30日的三個月中,與終止協議的執行有關,我們確認了與美國許可證相關的6,450萬美元遞延收入,以及與完成基礎按比例績效活動相關的剩餘31.7萬美元非現金遞延收入。截至2023年9月30日,與KKC商業化協議相關的所有遞延收入均已確認。
運營結果
截至2023年9月30日的三個月和2022年9月30日的三個月的比較
收入:截至2023年9月30日的三個月,我們確認的收入為6,530萬美元,而截至2022年9月30日的三個月,收入為870萬美元。收入的增加是由於確認了與美國許可證相關的遞延收入該協議於2023年7月終止,但被截至2023年9月30日的三個月中與KKC商業化協議中的成本分攤相關的確認收入減少所抵消。
研究和開發:以下是我們的研發費用摘要,以補充以下更詳細的討論(以千計)。
|
|
在截至9月30日的三個月中 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
贊德利西布 |
|
$ |
449 |
|
|
$ |
11,606 |
|
voruciclib |
|
|
(335 |
) |
|
|
733 |
|
ME-344 |
|
|
1,220 |
|
|
|
785 |
|
其他 |
|
|
2,151 |
|
|
|
6,339 |
|
研發費用總額 |
|
$ |
3,485 |
|
|
$ |
19,463 |
|
研發費用主要包括臨牀試驗成本(包括向合同研究組織 “CRO” 付款)、臨牀前研究成本以及為非臨牀和臨牀研究生產候選藥物的成本。其他研發費用主要包括工資和人員成本、基於股份的薪酬、法律費用以及其他未分配給特定藥物計劃的成本。與zandelisib相關的成本減少了1,120萬美元,這主要是由於該計劃在2023財年終止以及結束相關活動的完成。與voruciclib相關的成本減少了110萬美元,這主要是由於1期研究中公認的臨牀成本降低。由於與1b期研究相關的臨牀成本增加,與 ME-344 相關的成本增加了40萬美元。其他研發成本減少了420萬美元,這主要是由於與裁員相關的人員成本減少了340萬美元,非現金股票薪酬減少了70萬美元。
一般和行政: 截至2023年9月30日的三個月,一般和管理費用減少了100萬美元,至650萬美元,而截至2022年9月30日的三個月為750萬美元。減少的主要原因是員工人數減少導致人員成本減少了100萬美元,非現金股票薪酬減少了50萬美元,公司管理費用減少了30萬美元,外部專業服務增加了80萬美元,這部分抵消了主要與各種股東相關活動(包括股東發起的徵求同意工作)相關的諮詢和律師費的增加。
其他收入,淨額:截至2023年9月30日的三個月,其他收入淨減少了50萬美元,至110萬美元,而截至2022年9月30日的三個月為160萬美元。在截至2022年9月30日的三個月中,由於認股權證將於2023年5月到期,我們在截至2023年9月30日的三個月中記錄了110萬美元的非現金收益,這是由於認股權證負債的公允價值發生了變化,在截至2023年9月30日的三個月中沒有類似的收益。此外,截至2023年9月30日的三個月,我們獲得的利息和股息收入為110萬美元,而截至2022年9月30日的三個月為50萬美元。利息和股息收入的增加主要是由於截至2023年9月30日的三個月中收益率與截至2022年9月30日的三個月相比有所提高。
流動性和資本資源
自成立以來,我們已累計虧損3.496億美元,預計在可預見的將來將出現營業虧損併產生負的運營現金流。截至2023年9月30日,我們有8,220萬美元的現金和現金等價物以及短期投資。我們認為,自本季度報告發布以來,這些資源將足以為我們的運營提供至少12個月的資金。我們目前的業務運營側重於繼續進行候選藥物的臨牀開發。我們的研發計劃的變更或其他影響我們運營和運營支出的變化可能會影響現有現金資源的未來實際使用。我們無法確定與當前和未來相關的成本
27
目錄
臨牀試驗或監管批准程序。與開發我們的候選產品相關的持續時間、成本和時間將取決於多種因素,包括與我們的臨牀試驗結果相關的不確定性。
迄今為止,我們主要通過股權融資和許可協議獲得了現金併為我們的運營提供資金。為了繼續開發我們的候選藥物,我們預計將在未來的某個時候進行一項或多項資本交易,無論是通過出售股權證券、債務融資、許可協議還是建立戰略合作伙伴關係。無法保證我們將來能夠繼續籌集更多資金。
我們現金的來源和用途
截至2023年9月30日的三個月,用於經營活動的淨現金為1,850萬美元,其中包括我們的5,640萬美元淨收入,被7,570萬美元的運營資產和負債變動所抵消,這主要是由於確認了6,490萬美元的遞延收入,部分被80萬美元的非現金項目所抵消。截至2022年9月30日的三個月,用於經營活動的淨現金為1,480萬美元,其中1,660萬美元的淨虧損被100萬美元的運營資產和負債的變化以及90萬美元的非現金項目部分抵消。
截至2023年9月30日的三個月,投資活動提供的淨現金為500萬美元,而截至2022年9月30日的三個月,投資活動提供的現金為1,370萬美元。下降的主要原因是,在截至2023年9月30日的三個月中,扣除購買後的短期投資到期收益減少。
在截至2022年9月30日的三個月中,用於融資活動的淨現金為40,000美元,這是由於支付了RSU預扣款以換取RSU持有人交出的普通股。在截至2023年9月30日的三個月中,沒有來自融資活動的現金流。
資本資源需求
如上文概述部分所述,結合我們與Anson和Cable Car的合作協議,我們同意償還他們高達120萬美元的律師費。此外,我們還同意以向所有股東分紅的形式向股東提供至少一次資本回報,金額為每股普通股1.75美元。最後,如果我們正在進行的 ME-344 1b 階段試驗未能達到某些終點,或者我們的董事會決定不進行第二輪試驗,則董事會可能會批准第二輪總額約為 933 萬美元的資本回報,兩者均在《合作協議》中有進一步的描述。第二次資本回報可以採取股息或要約的形式,須經董事會批准以及與特拉華州法律適用要求相關的修改,兩者均在合作協議中有詳細規定。1.75美元的股息預計將在2024財年第二季度分配。
2022年1月,我們修改了設施租約,延長了20個月,直至2029年11月。修訂後的租賃協議還規定了額外的租賃空間,我們於2022年7月1日控制了該空間。根據租賃條款,截至2023年9月30日,我們有義務支付總額為1,580萬美元的剩餘租賃款項,其中不包括租賃協議規定的公共區域維護和其他可變對價。截至2024年6月30日的財年剩餘時間,預計租賃付款為180萬美元,其中不包括租賃協議規定的公共區域維護和其他可變對價。
截至2023年9月30日,我們有以下潛在的收購義務,其發生的時間和/或可能性尚不清楚;但是,如果將來出現此類索賠,它們可能會對我們的財務狀況、經營業績和現金流產生重大影響。
我們未來的資本要求將取決於許多因素,包括:
28
目錄
與宏觀經濟條件和其他地緣政治條件相關的估算注意事項
由於最近與銀行倒閉、COVID-19 疫情以及宏觀經濟和地緣政治狀況相關的銀行存款和貸款承諾中斷,全球經濟和金融市場出現了不確定性和混亂。截至2023年9月30日,我們不知道有任何需要更新其估計值或判斷或修訂其資產或負債賬面價值的具體事件或情況。儘管截至2023年9月30日的三個月,我們的簡明合併財務報表沒有重大影響,但隨着新事件的發生和獲得的更多信息,這些估計可能會發生變化,這可能會對我們未來報告期的簡明合併財務報表產生重大影響。
關鍵會計政策與管理估計
我們在中描述了我們的重要會計政策 注意事項 2.公司和重要會計政策摘要,我們2023年年度報告中包含的財務報表附註。我們在此討論我們的關鍵會計估算第 7 項。管理層對財務狀況和經營業績的討論和分析,在我們的 2023 年年度報告中。自2023年6月30日以來,我們的重要會計政策或關鍵會計估計沒有變化。
最近的會計公告
參見 附註2.重要會計政策摘要 在本季度報告的簡明合併財務報表附註中。
第 3 項。關於市場風險的定量和定性披露
利率風險
我們的市場利率敞口主要與現金餘額和短期投資的投資有關。我們有以美元持有的現金儲備,並將資金存入金融機構,這些資金隨時可用。我們的短期投資僅包括期限為三到十二個月的美國政府證券。
我們將現金存款存入信貸質量高的金融機構,並通過保單限制任何一家公司或銀行的信貸敞口金額。這些存款超過了聯邦存款保險公司(“FDIC”)的保險限額。我們對本金損失不利,我們通過限制違約風險、市場風險和再投資風險來確保投資資金的安全和保全。我們力求通過向信貸質量高的金融機構存入資金、限制對任何一家公司或銀行的信貸敞口、購買由美國政府證券組成的短期投資以及調整我們的投資組合以適當應對任何此類金融機構信用評級的大幅下降來降低來降低違約風險。
我們不認為利率變動的影響對我們的財務狀況構成重大風險。
第 4 項。控制和程序
(a) 披露控制和程序
我們的管理層在首席執行官或首席執行官和首席財務官或首席財務官的參與下,評估了我們的披露控制和程序(定義見《交易法》第13a-15(e)條和第15d-15(e)條)的有效性為
29
目錄
2023 年 9 月 30 日。根據此類評估,我們的首席執行官兼首席財務官得出結論,截至2023年9月30日,我們的披露控制和程序是有效的,可確保我們在根據《交易法》提交或提交的報告中要求披露的信息在美國證券交易委員會或美國證券交易委員會規則和表格規定的時間內記錄、處理、彙總和報告,並收集並傳達給我們的管理層,包括我們的首席執行官和首席財務官 FO,視情況而定,以便及時做出有關所需決策披露。
財務報告內部控制的變化
在包括首席執行官和首席財務官在內的管理層的監督和參與下,我們對截至2023年9月30日的財政季度財務報告內部控制的任何潛在變化進行了評估。在截至2023年9月30日的財政季度中,我們對財務報告的內部控制(定義見《交易法》第13a-15(f)條)沒有發生任何變化,這些變化對我們的財務報告內部控制產生了重大影響,也沒有合理地可能產生重大影響。
內部控制的固有侷限性
我們的管理層,包括首席執行官和首席財務官,預計我們的披露控制和程序或財務報告的內部控制不會防止或發現所有錯誤和所有欺詐行為。控制系統,無論設計和操作多麼精良,都只能為控制系統的目標得到滿足提供合理的保證,而不是絕對的保證。由於所有控制系統的固有侷限性,任何控制措施評估都無法絕對保證我們公司內部的所有控制問題和欺詐事件(如果有)都已被發現。這些固有的限制包括這樣的現實,即決策中的判斷可能是錯誤的,而崩潰可能是由於簡單的錯誤或錯誤造成的。此外,可以通過某些人的個人行為、兩人或更多人的串通或管理層無視控制來規避控制。任何控制系統的設計也部分基於對未來事件可能性的某些假設,因此無法保證任何設計在未來所有潛在條件下都能成功實現其既定目標。隨着時間的推移,由於條件的變化,控制措施可能會變得不足,或者對政策或程序的遵守程度可能會惡化。由於具有成本效益的控制系統固有的侷限性,由於錯誤或欺詐而導致的錯誤陳述可能會發生而無法被發現。
30
目錄
第二部分其他信息
第 1 項。法律程序種子
沒有。
第 1A 項。風險因素
與2023年年度報告中所包含的風險因素相比,我們的風險因素沒有實質性變化
第 2 項。未註冊 S股權證券的出售和所得款項的使用
沒有。
第 3 項。Seni 的默認設置或證券
沒有。
第 4 項礦山安全ty 披露
不適用。
第 5 項。其他信息憤怒的
沒有。
31
目錄
第 6 項。展品
展品索引
展品 |
|
|
3.1 |
|
自 2023 年 10 月 1 日起生效的 MEI Pharma, Inc. A 系列初級參與優先股指定證書(參照註冊人於 2023 年 10 月 3 日提交的 8-K 表最新報告(文件編號 000-50484)附錄 3.1 納入) |
4.1 |
|
截至 2023 年 10 月 1 日,MEI Pharma, Inc. 與 Computershare, Inc.(作為版權代理人)之間的權利協議(參考註冊人於 2023 年 10 月 3 日提交的 8-K 表最新報告(文件編號 000-50484)) |
10.1 |
|
MEI Pharma, Inc. 與協和麒麟有限公司(前身為協和發酵麒麟有限公司)之間於 2023 年 7 月 14 日達成的終止協議(參照註冊人於 2023 年 7 月 19 日提交的 8-K 表最新報告(文件編號 000-50484)附錄 10.1 納入) |
10.2 |
|
MEI Pharma, Inc. 於 2023 年 7 月 23 日向 Infinity Pharmicals, Inc. 發出的終止信(引用註冊人於 2023 年 7 月 24 日提交的 8-K 表最新報告(文件編號 000-0050484)) |
10.3 |
|
投資者與公司之間於2023年10月31日簽訂的合作協議(參照註冊人於2023年11月1日提交的8-K表最新報告(文件編號001-41827)附錄10.1納入) |
31.1 |
|
第13a-14 (a) 條或第15d-14 (a) 條首席執行官的認證。 |
31.2 |
|
第13a-14(a)條或第15d-14(a)條首席財務官的認證。 |
32.1 |
|
《美國法典》(18 U.S.C 1350)第13a-14(b)條或第15d-14(b)條和第18編第63章第1350條要求對首席執行官和首席財務官進行認證。 |
101.INS |
|
行內 XBRL 實例文檔 — 實例文檔未出現在交互式數據文件中,因為 XBRL 標籤嵌入在行內 XBRL 文檔中。 |
101.SCH |
|
內聯 XBRL 分類擴展架構文檔 |
101.CAL |
|
內聯 XBRL 分類擴展計算鏈接庫文檔 |
101.DEF |
|
內聯 XBRL 分類法擴展定義鏈接庫文檔 |
101.LAB |
|
內聯 XBRL 分類法擴展標籤 Linkbase 文檔 |
101.PRE |
|
內聯 XBRL 分類擴展演示鏈接庫文檔 |
104 |
|
封面交互式數據文件(嵌入在行內 XBRL 文檔中) |
32
目錄
簽名
根據1934年《證券交易法》的要求,註冊人已正式安排下列簽署人代表其簽署本季度報告,並經正式授權。
|
MEI Pharma, Inc |
|
|
|
/s/ 賈斯汀 J. 檔案 |
|
賈斯汀·J·文件 首席財務官兼祕書
|
|
|
|
日期:2023 年 11 月 9 日 |
33