目錄表
直接改變腫瘤的免疫表型。腫瘤免疫表型的改變是獨一無二的,並通過一種我們稱為抗原播種的機制利用ETB固有的細胞內路由特性。
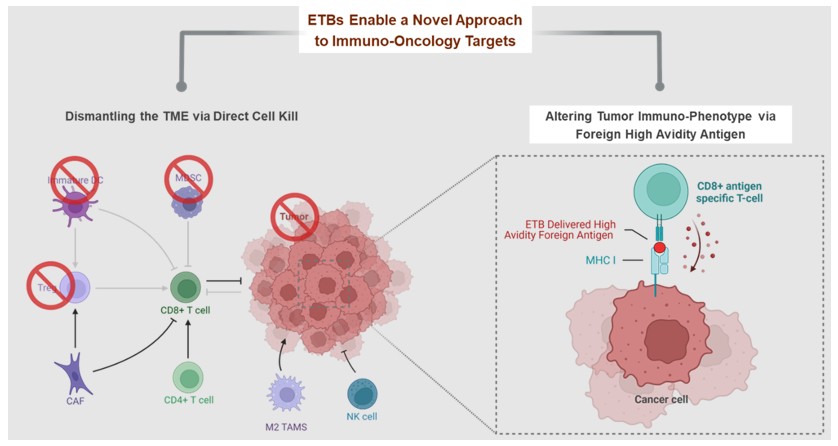
免疫腫瘤學ETBS
MT-6402-ETB針對PD-L1
我們於2020年12月提交了針對我們針對PD-L1的ETB MT-6402的研究新藥(IND)申請,並於2021年1月接受了IND申請。MT-6402在PD-L1表達腫瘤的復發/難治性患者中的I期研究於2021年7月開始,起始劑量為16微克/公斤。MT-6402的第一階段研究是一項多中心、開放標籤、劑量遞增和劑量擴大試驗。確診為PD-L1表達腫瘤或在TME中證實PD-L1表達的患者有資格參加登記,無論是HLA型還是CMV狀態。2021年11月,MT-6402獲得快速通道指定,用於治療表達PD-L1的晚期非小細胞肺癌(NSCLC)患者。
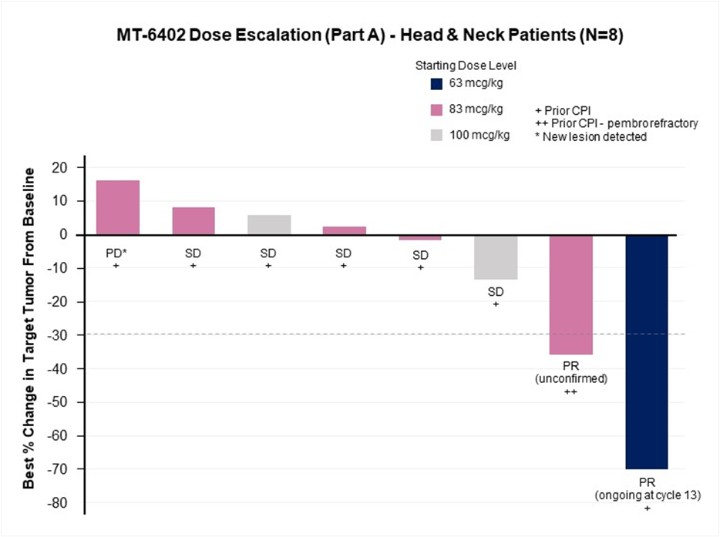
在MT-6402對復發/難治性腫瘤患者的研究中,48名患者接受了16、24、32、42、63、83和100微克/公斤的7個劑量遞增隊列的治療。我們繼續觀察藥效學(PD)效應,包括耗盡PD-L1+單核細胞、MDSCs、PD-L1+樹突狀細胞,以及伴隨的T細胞激活。到目前為止,還沒有觀察到與藥物有關的4級或5級不良事件。MT-6402在復發/難治性患者中的單一治療活性也被觀察到。
MT-6402第一階段研究的A部分劑量升級已經完成。100微克/公斤的劑量被認為是不可耐受的,因為3級皮疹和1級高敏感性肌鈣蛋白升高的兩種劑量限制毒性(DLT)均未出現臨牀後遺症,導致藥物中斷超過兩週。皮疹和高敏感性肌鈣蛋白升高是免疫相關的不良事件,已被批准的檢查點療法記錄在案。63和83微克/公斤劑量將在B部分劑量擴展研究中進一步探討。
在A部分劑量遞增中,10例頭頸部癌症患者按63、83或100微克/公斤的劑量進行治療。頭頸部腫瘤的TME通常富含免疫抑制細胞。其中兩名患者由於早期進展而無法評估第1週期DLT期,分別在僅接受一劑或兩劑MT-6402後停止研究。其餘8名頭頸部癌症病人的最佳反應如下:
28