
治癒心理健康障礙,讓世界各地的每個人都能過上更充實的生活。公司概述公司概述 — 2024 年 1 月

除非上下文另有要求,否則本演示文稿中所有提及 “我們”、“我們的”、“atai” 或 “公司”
的內容均指ATAI Life Sciences N.V. 及其合併子公司。本演示文稿包含1995年《私人證券訴訟改革法》所指的前瞻性陳述。我們
打算將此類前瞻性陳述納入經修訂的1933年《證券法》第27A條和經修訂的1934年《證券交易法》(
)第21E條所載的前瞻性陳述的安全港條款中。除本演示文稿中包含的歷史事實陳述以外的所有陳述,包括有關我們未來的經營業績和財務狀況、行業動態、業務戰略和計劃以及我們未來運營的
目標的陳述,均為前瞻性陳述。這些陳述代表了我們對未來的觀點、期望、信念、意圖、估計或戰略,這些觀點可能無法實現。在某些情況下,您可以使用 “可能”、“將”、“應該”、“計劃”、“預期”、“預期”、“可能”、“打算”、“目標”、“項目”、“考慮”、“相信”、“估計”、“預測”、“潛在” 或 “繼續” 等術語或其他類似表述的
否定詞來識別前瞻性陳述旨在識別前瞻性陳述。前瞻性陳述主要基於我們當前對未來事件和財務趨勢的預期和預測
,我們認為這些預期和預測可能會影響我們的財務狀況、經營業績、業務戰略、短期和長期業務運營和目標以及財務需求。這些前瞻性陳述受多種風險、
不確定性和假設的影響,包括但不限於我們最近向美國證券交易委員會(“SEC”)提交的10-K表年度報告中標題為 “風險因素” 的部分中描述的重要因素,這些因素可能導致我們的實際業績、業績或成就與前瞻性陳述所表達或暗示的業績、業績或成就存在重大不利差異。此外,我們在競爭激烈、瞬息萬變的環境中運營。新的風險不時出現。我們的管理層無法預測所有風險,也無法評估所有因素對我們業務的影響,也無法評估任何因素或
因素組合在多大程度上可能導致實際業績與我們可能做出的任何前瞻性陳述中包含的結果存在重大差異。鑑於這些風險、不確定性和假設,本演示文稿中討論的前瞻性事件和情況
可能不會發生,實際結果可能與前瞻性陳述中的預期或暗示存在重大和不利的差異。因此,我們提醒您不要依賴這些前瞻性
陳述,我們用這些警示性陳述來限定所有前瞻性陳述。本演示文稿中包含的前瞻性陳述僅截至本文發佈之日作出。儘管我們認為前瞻性陳述中反映的預期
是合理的,但我們不能保證前瞻性陳述中反映的未來業績、活動水平、業績或事件和情況能夠實現或發生。
此外,我們和我們的顧問以及任何其他人均不對前瞻性陳述的準確性和完整性承擔責任。除非法律要求,否則我們和我們的顧問均沒有義務在本演示文稿發佈之日後出於任何原因更新任何前瞻性陳述
,以使這些陳述與實際業績或我們的預期變化保持一致。您應該在閲讀本演示文稿的前提下,我們的
實際業績、活動水平、業績以及事件和情況可能與我們的預期存在重大差異。除非另有説明,否則本演示文稿中包含的有關我們的行業、競爭地位
和我們經營的市場的信息均基於來自獨立行業和研究機構、其他第三方來源的信息以及管理層的估計。管理層的估計來自獨立行業分析師和其他第三方來源發佈的公開信息
以及我們的內部研究數據,並基於我們在審查此類數據時做出的假設,以及我們在此類行業和市場方面的經驗和知識,
我們認為這是合理的。此外,對我們經營所在行業或任何單個競爭對手的未來表現以及我們未來表現的預測、假設和估計必然受包括上述因素在內的各種因素造成的不確定性和風險的影響。這些因素和其他因素可能導致結果與獨立各方和我們在估算中表達的結果存在重大差異。行業
出版物、研究、調查和研究通常表示,它們所包含的信息是從被認為可靠的來源獲得的,但不能保證此類信息的準確性和完整性。從這些來源獲得的預測和
其他前瞻性信息與本演示文稿中的其他前瞻性陳述具有相同的限定條件和不確定性。本演示文稿包含在第三方研究或其他背景下使用我們候選產品所含化合物的化合物或衍生物治療的
個人的證詞摘錄,這些證詞僅用於説明而不能代表此類化合物
可能產生的有益結果。我們的候選產品處於臨牀前或臨牀開發階段,我們的候選產品均未獲得 FDA 或任何其他監管機構的批准。此處包含的任何商標
均為其所有者的財產,僅用於參考目的。此類使用不應被解釋為對公司產品或服務的認可。免責聲明 02

1 心理健康障礙是全球最大的健康負擔之一;2019年,全球每8人中就有1人,即9.7億人,患有精神障礙1 3 八個臨牀階段的藥物開發計劃和戰略投資,每個項目都有大量的先前臨牀證據 2 atai 的
目標是通過開發快速有效的持久療法,為心理健康患者實現具有臨牀意義和持續的行為改變 tics 4 經過驗證的運營模式和獲取價值的能力:COMPASS Pathways 在
的首次公開募股2020年以及大冢與atai子公司Perception Neuroscience在2021年達成的許可協議 5 預計將為20262年提供資金 atai Life Sciences:治癒心理健康
障礙,使世界各地的每個人都能過上更加充實的生活 03 世界衞生組織承諾的定期貸款資金包括4500萬美元的額外資金,這些資金可以在不受Hercules
資本機制下的里程碑限制的情況下提取;合格證券包括貨幣市場基金、美國國庫證券、商業票據、公司票據/債券、美國政府機構證券和公開股票

我們的戰略將通過強大的迷幻藥和
非迷幻藥物開發計劃和戰略投資組合來實現 04 迷幻項目和戰略投資 Preclin 第一階段第二階段第 3 階段計劃/投資 RL-007/專業認知神經調節劑3 GRX-917 /氘化
etifoxine COMP3601/迷幻藥 VLS-01/DMT DMX-1002/Ibogaine EMP-01/R-MDMA EGX-A & EGX-A X-B/新型 5-HT2A 受體激動劑 BPL-0032/5-MEO-DMT ELE-1012/Psilocin 主要適應症與
精神分裂症相關的認知障礙全身性焦慮症耐藥性抑鬱症耐藥性抑鬱症阿片類藥物使用障礙創傷後應激障礙及其他未公開的耐藥性抑鬱症重度抑鬱症
非迷幻項目 2 對貝克利心理科技的戰略投資 1 對康帕斯途徑 3 的戰略投資 RL-007 化合物是 (2R, 3S) -2-氨基-3-羥基-3-吡啶-4-基-1-吡咯烷-1-基-1-吡咯烷-1-基-1-丙烷-1-酮 (L)-(+) 酒石酸鹽
鹽戰略投資

我們預計將在未來 18 個月內在關鍵項目
中實現幾個有意義的研發里程碑3 05 atai 生命科學:運營重點和計劃指南 2023 年第三季度第一階段初步結果在 24 年上半年提交 FDA 會議請求 23 年第二季度第一階段的初始結果 2023 年第三季度的 Ph 1b 首位
參與者在 23 年第 1 季度延遲突破在 2023 年 SOBP 年會上發表演講 CIAS Ph 2b 的 Ph 2a 試驗成功結果 2a 在 23 年第一季度第一季度給藥 Topline Ph 2b 數據 25 年中期 RL-007(Pro-Cognitive
神經調節劑)GRX-917(氘化依替福辛)VLS-01(DMT)DMX-1002(Ibogaine)EMP-01(R-MDMA)COMP3601(Psilocybin)Ph 1 試驗於 22 年第 3 季度啟動 Ph 1 的試驗 2013 年第四季度在 TRD Ph 2(創傷後應激障礙)中取得成功結果 — 數據
24 年春季 Ph 3 (TRD) — 關鍵試驗 1 的頂線數據 '24 年夏季 Ph 3 (TRD)-關鍵試驗 2 的頭條數據 25 年中期 BPL-0032 (5-MEO-DMT) 在 24 年中期 Ph 2a OL (AUD) 數據中,Ph 1 試驗 Ph 2a OL (TRD) 在 24 年中期 Ph 2a OL (AUD) 數據中的成功結果 2H 2b
(TRD) 在 2H'24 ELE-1012 (Psilocin) Ph 1/2a OL (MDD) 數據中 — 1H'24 PSYDELCHEIC 中的數據計劃與戰略投資非迷幻項目對Compass Pathways的戰略投資
對貝克利心理科技的投資提供的所有日期均為估計的縮寫:創傷後應激障礙;CIAS = 與精神分裂症相關的認知障礙;TRD = 耐藥性抑鬱症;澳元 = 酒精使用
障礙;MDD = 重度抑鬱症

BPL-003 (5-meo-DMT) 用於治療TRD和酒精使用障礙 06

12mg (n=5) 10mg (n=5) 8mg (n=5) 6mg (n=4) 4mg (n=4) 2.5mg (n=4) 1mg
(n=4) 平均血漿濃度水平 (ng/ml) 給藥後時間 (分鐘) BPL-003 1 期藥代動力學概況主要發現安全性所有不良事件 (AE) 均為輕度 (89.5%) 或中度 (10.5%) 5%);未發生嚴重不良反應最常見的不良反應
(> 10%):鼻部不適、噁心、嘔吐和頭痛藥代動力學(PK)暴露量與劑量成比例快速發作:平均Tmax為6-17分鐘短時間:15-30分鐘藥效學(PD)受試者為迷幻
天真所有受試者劑量 ≥6mg 達到強度分數 ≥7 感知效應通常在 60-90 分鐘內完全消除 BPL-003 第 1 階段主觀強度評級 0 12 30 60 90 12mg (n=5) 10mg (n=5) 8mg (n=5) 6mg
(n=4) 劑量後時間 (分鐘) 平均主觀藥物強度 (SDI) 已完成的 1 期 SAD 研究的結果顯示 BPL-003 具有良好的安全性且狀況良好耐受同時證明劑量成比例的 PK/PD 分佈 BPL-003:
鼻內 5-meo-DMT 0 12 30 60 90 縮寫:SAD = 單次升序劑量;PK = 藥代動力學;PD =藥效學 7 07

BPL-003 2a 期是一項針對 TRD 患者的開放標籤單一療法研究 BPL-003 第
2a 期臨牀試驗設計縮寫:MADRS = 蒙哥馬利—阿斯伯格抑鬱評級量表;CGI-S = 臨牀全球印象嚴重程度;PGIC = 患者對變化的全球印象;EQ-5D = EuroQOL-5D 8 篩查 10mg(n=12)打開
標籤第 2 天 85 預計將出現 Ph 2a (TRD) 的數據在 1H24 核心研究(12 周)中 57 29 8 關鍵納入標準中度至重度耐藥性抑鬱症患者蒙哥馬利-阿斯伯格抑鬱評級量表(MADRS)分數
≥24 願意且有能力停用目前的抗抑鬱藥關鍵目標:主要終點:BPL-003 單一療法的安全性和耐受性關鍵次要終點:第 2、8、29、57 和 85 天的 MADRS 變化 CGI-S、PGIC、EQ-5D 08
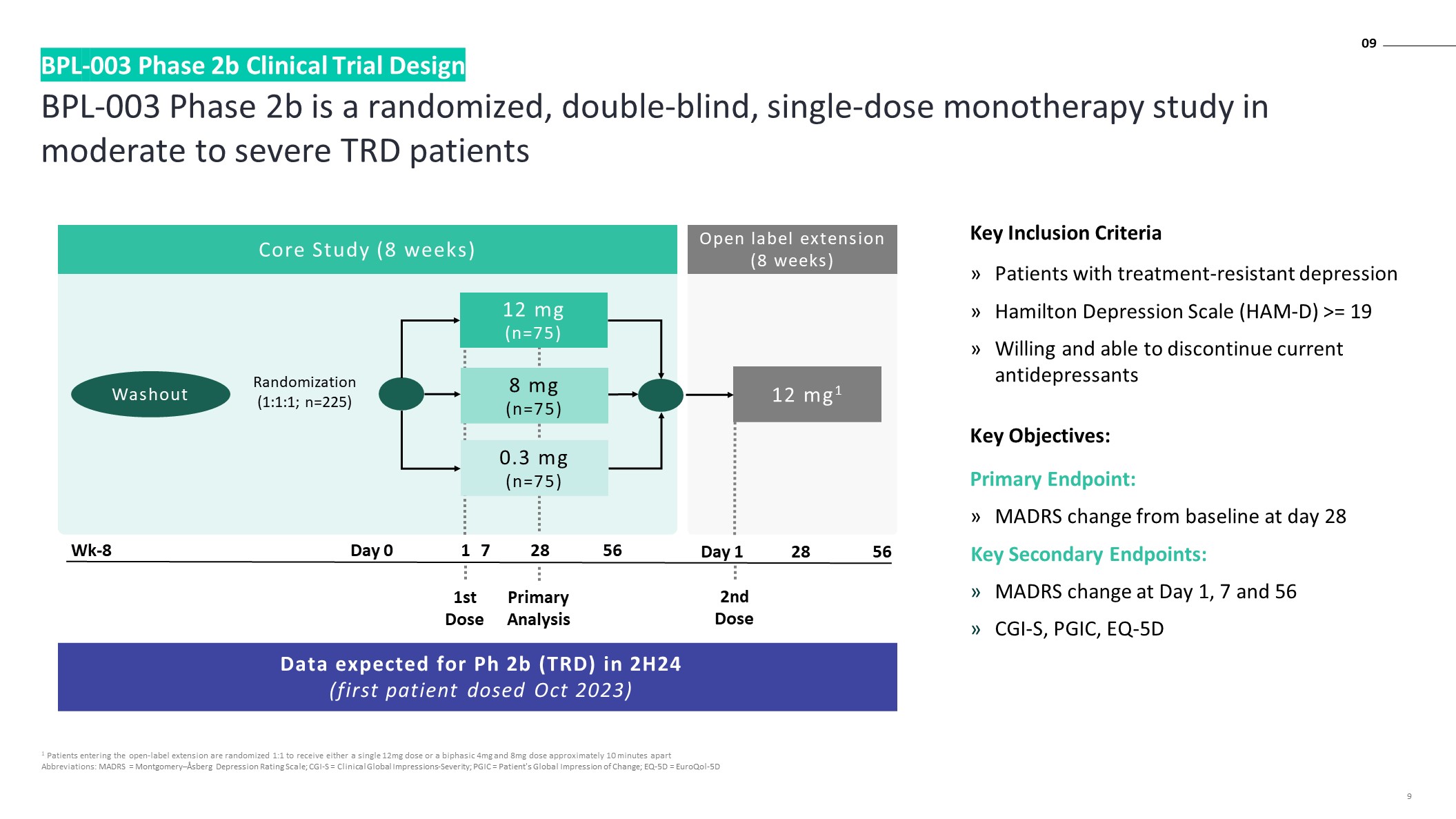
BPL-003 2b 期是一項針對
中度至重度 TRD 患者的隨機、雙盲、單劑量單一療法研究 BPL-003 2b 期臨牀試驗設計 1 進入開放標籤延期的患者按 1:1 隨機分配 12mg 單劑量或雙相 4mg 和 8mg 劑量
縮寫:MADRS = 蒙哥馬利—阿斯伯格抑鬱評級量表;CGI-S = 臨牀全球印象嚴重程度;PGIC = 患者對變化的全球印象;EQ-5D = euroqol-5D 9 隨機化 (1:1:1;n=225) 第 0 天 1 28 56
Wk-8 Washout 12 mg1核心研究(8 周)初步分析第 1 天 28 56 預計在 24 年下半年 Ph 2b (TRD) 的數據(首位患者給藥 2023 年 10 月)開放標籤延期(8 周)0.3 mg(n=75)8 mg(n=75)12 mg(n=75)第一劑第二劑量關鍵納入標準耐藥性抑鬱症患者漢密爾頓抑鬱量表(HAM-D)>= 19 願意並能夠停用當前的抗抑鬱症 sants 關鍵目標:主要終點:
MADRS 與基線相比在第 28 天發生變化關鍵次要終點:第 1、7 和 56 天 MADRS 變化 CGI-S、PGIC、EQ-5D 7 09

適用於 TRD 10 的 VLS-01 (DMT)

世界衞生組織 Salzer,“
嚴重精神疾病康復和緩解的全國估計”,《精神病學在線》(2018)健康志願者研究旨在通過單劑量快速持續減輕抑鬱症狀產品概述:VLS-01 抑鬱症主要適應症
概述 2019 年全球約3億抑鬱症患者1 33% 患者在當前治療後反應不足或復發2 抑鬱症是一種情緒障礙影響個人的思想和行為,導致
心理、生理,以及社會問題耐藥性抑鬱症(TRD)是在兩個療程的抗抑鬱藥失敗後被診斷出來的 FDA 批准的抑鬱症治療可表現為發作緩慢、長期副作用和
反應率不足 11 全球疾病負擔 VLS-01 關鍵產品特性專為單劑量後快速發作和持續療效而設計迷幻效果持續時間短(約 30 到 45 分鐘),耐受性提高,
相對於其他迷幻藥來説,OTF 給藥更方便抑鬱症藥物正在開發中 DMT (N, N-口服經粘膜薄膜(OTF)中的二甲基色胺)領先:耐藥性抑鬱症潛在擴展:飲食失調、物質
使用障礙23年第三季度第一階段最終數據1b預計將在243年上半年第一位參與者產品適應症當前狀態知識產權授予涵蓋OTF管理DMT的美國專利,並得到多個
待處理的美國專利和PCT專利申請的支持
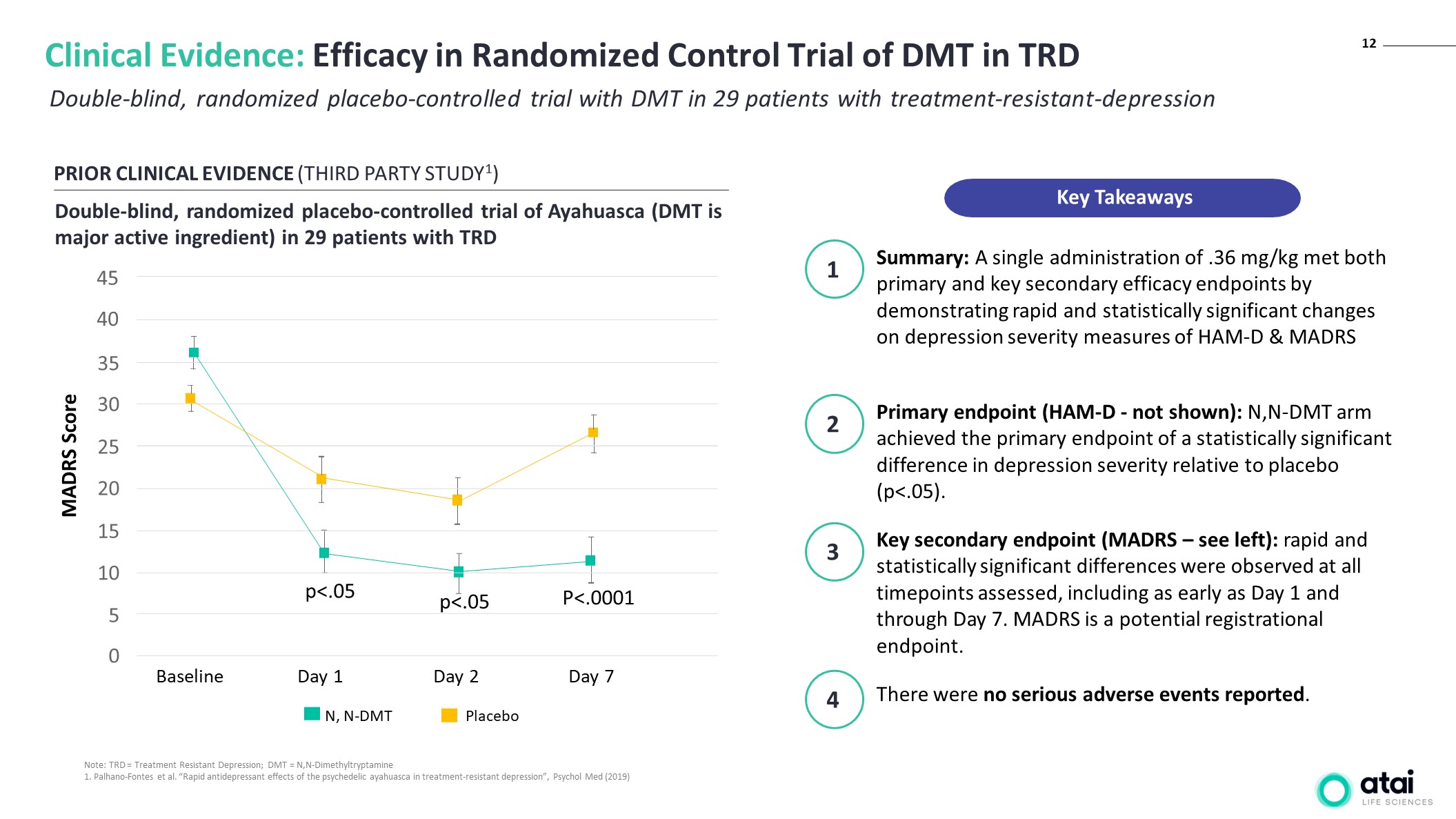
12 對 29 名
耐藥性抑鬱患者進行雙盲、隨機安慰劑對照試驗 DMT 臨牀證據:DMT 在 TRD 中的隨機對照試驗的療效先前的臨牀證據(第三方 STUDY1)雙盲、隨機安慰劑對照試驗 Ayahuasca(DMT 是主要活性成分)
對 29 名患者 TRD 安慰劑 N, N-DMT P<.0001 score trd="Treatment" resistant depression dmt="N,N-Dimethyltryptamine 1." palhano-fontes et al. antidepressant e of the psychedelic ayahuasca in treatment-resistant psychol med a single administration .36 mg met both primary and key secondary efficacy endpoints by demonstrating rapid statistically significant changes on severity measures ham-d madrs endpoint not shown n arm achieved difference relative to placebo were no serious adverse events reported. see left differences observed at all timepoints assessed including as early day through is potential registrational endpoint. takeaways>

13 VLS-01 第 1 階段:臨牀試驗設計與結果 VLS-01 耐受性良好,安全性良好,劑量依賴性增加已得到證實。注:IV = 靜脈注射;OTF = 口服透粘膜薄膜;PK/PD = 藥代動力學/藥效學;DMT = N,N-二甲基色胺計劃
狀態:1b 期 FSI 預計於 24 年 1 小時 VLS-01:PK/PD 結果與 DMT 的已知藥理特徵一致,使受試者的迷幻體驗強度因暴露而大幅增加。第 3 部分(OTF
VLS-01)第 2 部分(OTF VLS-01)第 1 部分(IV VLS-01)研究設計:OTF VLS-01:暴露量普遍呈劑量依賴性增加,接近靜脈給藥時的劑量依賴性增加,並且
大多數患者有主觀的迷幻體驗。OTF VLS-01:與其他OTF隊列相比,通過口腔給藥加襯層的160mg的暴露量和主觀影響增幅最大、最為穩定,結果與30毫克靜脈注射的DMT隊列相當。第 1 階段 PK/PD 結果:

COMP 360(psilocybin)用於治療創傷後應激障礙、創傷後應激障礙和厭食症 14

COMP360 2b 期試驗顯示抑鬱症
症狀可快速、持續減輕產品製藥生態學產品特徵適應症現狀知識產權口服迷幻藥 (COMP360) 5-HT2A-R 激動劑快速發作,單劑量後可能持續療效。初級:耐藥性
抑鬱症、神經性厭食症、創傷後應激障礙潛力:重度抑鬱症、自閉症、雙相情感障礙、慢性叢集性頭痛 1 期臨牀試驗預計將於夏季數據 -24 第 3 階段關鍵試驗 2 的數據預計在 25 年中期
的專有配方合成迷幻藥,COMP360 摘要:COMP360 亮點 COMP360 在 2b 期研究中表現出可有效減輕抑鬱症狀嚴重程度,反應迅速持久;人類先前證據(COMP360 階段
2b)15.5% 1 所有權注:MADRS = 蒙哥馬利-阿斯伯格抑鬱評級量表;COMP360 = 專有的高純度多態性迷幻藥晶製劑;在 COMPASS 的迷幻藥療法模型中,COMP360 由
與經過專門訓練的治療師的心理支持一起給藥。截至2023年9月30日的所有權百分比事後分析顯示,在列出的其他時間點的25mg劑量結果也為陽性,但是,10mg組和1mg組之間比較的微不足道的
結果終止了基於預先規定的分層測試程序對所有後續關鍵次要療效終點的顯著性測試。15 主要終點

16 COMPASS Pathways 目前正在進行第三階段的關鍵計劃,
預計將在 2024 年夏季和 2025 年中期提供數據第 6 周主要終點1 第 3 周進行長期隨訪關鍵研究 1 單劑量單一療法 (COMP 005) COMP360 25mg 安慰劑隨機化 = 2:1 目標 N2 = 255 Topline
數據預計:2024 年夏季關鍵研究 2 固定重複劑量單一療法 (COMP 006) COMP360 25mg COMP360 25mg COMP360 10mg COMP360 10mg COMP360 1mg COMP360 1mg 隨機分配 = 2:1:1 目標 N2 = 568 預計頂線數據:
2025 年中期 0 周 0 周來源:截至2023年5月11日,Compass Pathways資本市場日演講主要終點 = 第6周MADRS總分與基線相比變化參與者羣體(TRD定義和核心納入/
排除標準)與2b階段相比保持不變進行長期隨訪Pivotal 3階段試驗設計第6周主要終點1

適用於 MDD 17 的 ELE-101(psilocin)

psilocybin活性部分在優化給藥和
治療模型中的潛在益處 ELE-01:靜脈迷幻藥1迷幻菌素模擬基於布朗等人2017年、Madsen等人(2019年)、Hasler等人(1997年)和Carhart-Harris等人(2011年)的主要數據。2 Holze F. 等人(2023)的主要數據。健康參與者口服迷幻藥的藥代動力學和藥效學
。Clin Pharmacol Ther.靜脈注射迷幻藥的迷幻藥代動力學(模擬)與口服 psilocybin1 有效劑量為 25mg 的典型血漿迷幻藥濃度
psilocybin1 感知閾值2 靜脈注射迷幻藥對比口服迷幻藥的預期益處:變異性縮短半衰期 = 更短的迷幻效果持續時間,預計為

對健康志願者進行隨機 1 期劑量遞增研究,隨後在 MDD 中進行
2a 期開放標籤研究 ELE-101 1/2a 期臨牀試驗設計 19 ELE-101 1/2a 階段 — A 部分關鍵目標:PK 和 PD 的安全性和耐受性評估
中迷幻星的目標濃度

用於藥物使用障礙的 DMX-1002(ibogaine)20

分別是創傷後應激障礙和創傷性腦損傷,世界
衞生組織 Salzer,“全國嚴重精神疾病康復緩解估計”,《在線精神病學》(2018)旨在通過迷幻效果快速、持續地減輕抑鬱症狀產品概述:
DMX-1002 阿片類藥物使用障礙主要適應症概述 2022 年美國約 300 萬例阿片類藥物相關死亡人數 >10 萬例阿片類藥物使用相關死亡疾病非常普遍,其特徵是無法控制
合法藥物的使用或非法藥物,例如阿片類藥物(包括處方阿片類藥物)或酒精。OUD 的當前護理標準主要包括心理支持和合成的全和部分阿片類藥物受體激動劑(美沙酮和
丁丙諾啡),其中大約 30% 的患者獲得治療成功(定義為 > 80% 的非法阿片類藥物無週期)。此外,長效阿片類藥物拮抗劑(納曲酮)使一定比例的患者成功獲得治療
。21 全球疾病負擔 DMX-1002 關鍵產品特點在監測環境中給予的單劑量伊博加因可能支持阿片類藥物使用障礙患者的戒斷和長期復發預防先前的臨牀證據:
在第三方開放標籤研究中,伊博加因與阿片類藥物的渴望顯著減少有關,無論是在出院時還是在治療後一個月,OUD 患者的情緒都有所改善此外,針對可卡因使用障礙受試者的雙盲
安慰劑對照研究顯示,與安慰劑相比,經證實單次給藥伊博加因復發的尿液具有統計學上的顯著益處。阿片類藥物使用障礙(“OUD”)潛在擴展:Add'l 藥物使用障礙、創傷後應激障礙、TBI1 階段結果預計將在24年上半年提交FDA會議請求產品適應症當前狀態知識產權已發佈和待處理的治療方法索賠
OUD DMX-1002 是伊博加因的口服制劑,它是一種吲哚生物鹼有可能通過神經元效應獲得臨牀益處

22 對尋求阿片類藥物和可卡因排毒的患者進行 8-12 mg/kg ibogaine 的開放標籤研究的結果臨牀證據:伊博加因在開放標籤安全性和有效性研究中的功效先前的臨牀證據(第三方 STUDY1)注:TRD = 耐藥性抑鬱症;DMT = N,N-二甲基色胺 1 Mash 等人,“伊博加因排毒過渡阿片類藥物依賴和禁慾之間的藥物和可卡因濫用者:臨牀觀察和治療結果”(2018)1 2 安全性:據報道,Ibogaine 耐受性良好,沒有嚴重的
不良事件。4 個關鍵要點 HCQ-29 亞量表預劑量(N=75)5 4 3 2 1 0 出院(N=74)1 個月(N=37)情緒(負面情緒狀態)強迫性(對戒煙能力缺乏信心)目的性(使用
的意願)預期(吸毒的預期積極益處)自我報告的渴望療效維度 — 急性後戒斷綜合症:體徵和症狀與劑量前的基線戒斷嚴重程度
衡量標準相比,劑量後評估有所降低。阿片類藥物戒斷的客觀症狀較輕,在以後的時間點沒有加劇。3 療效 — 復發預防(左圖):阿片類藥物依賴患者在項目出院時測得的四個 HCQ-29 渴望域的平均分數顯著降低,而持續完成研究的患者的平均分數降至一個月。渴望是復發的重要媒介。概要:單劑量的依博加因顯示 74 名阿片類藥物依賴患者對阿片類藥物
的渴望有所降低。

DMX-1002 的安全水平和血漿濃度與先前試驗 1 期研究一致:DMX-1002 試驗設計和結果摘要已完成第 1 期試驗:單次遞增劑量未報告嚴重不良事件幾乎所有不良事件均為輕度至中度(> 94%),與先前對伊博加因的
試驗一致。潛在治療血漿水平 DMX-1002 的 9 mg/kg 達到的血漿濃度與先前觀察到治療效果的研究中描述的無症狀 qtC 延期的兩個
參與者之一隊列 3,觀察到無症狀 qTc 延長,無心律失常。在沒有幹預或後遺症的情況下,90-94ms的qtcf變化得到緩解第一階段結果摘要隊列 1 N = 12 3 mg/kg 隊列 2 N = 6 6 mg/kg 隊列 3 N = 2 9 mg/kg 第 1 天:單次口服劑量

DMX-1002 有可能成為首款也是同類最佳的
OUD 治療方法,最大限度地降低復發風險摘要 DMX-1002 有可能成為阿片類藥物使用障礙 (OUD) 的轉變療法 OUD 的當前護理標準是藥物療法,需要具有顯著
副作用的阿片類藥物替代品持續預防復發在監控環境下給藥單劑,提供戒斷支持和促進持續緩解的單劑量治療發作極少濫用可能性不含阿片類藥物
效果高依從性/低復發風險膽鹼能、穀氨酸能和單胺能受體調節劑作用機制 Ibogaine (DMX-1002) 療法藥物輔助療法1 在
門診環境中每天進行阿片類藥物替代療法,試圖戒掉阿片類藥物 MU 激動劑部分 MU 拮抗劑美沙酮丁丙諾啡納曲芬 xone 戒斷支持2 在監督戒斷期間給予症狀管理的療法
(解毒)Alpha-2 激動劑 Alpha-2 激動劑 Clonidine Lofexidine 當前的戒斷策略支持的複發率很高注意:OUD = 阿片類藥物使用障礙來源:公開信息,包括公司網站
和clinicaltrials.gov、GlobalData、Evaluate Pharma(均截至2022年)當前護理標準鑑於複發率高,很少使用。主要用於機構或監獄環境 demerX 24

用於認知障礙的 RL-007 25

世界衞生組織博拉等人,《精神分裂症和
情感性精神病的認知障礙:對DSM-V標準及其他方面的影響 GlobalData(截至2023年6月1日)4。Schaffer 等人,2013 年在先前的臨牀試驗中表現出持續的促認知作用,對超過 500 名受試者具有良好的安全性產品概述:RL-007 用於認知障礙主要適應症概述約 2400 萬全球精神分裂症患者¹ > 80% 的精神分裂症患者出現嚴重的認知障礙2 與精神分裂症 (CIAS) 相關的認知障礙
以注意力、學習、記憶和執行力為特徵功能缺陷此類缺陷導致認知功能比平均值低約 2.5 個標準差普通人羣4 CIAS 是精神分裂症中常見的主要致殘原因,超過 80% 的患者表現出嚴重損傷2 未獲美國食品藥品管理局批准的治療方法3 26 全球疾病負擔 RL-007 關鍵潛在產品特徵
在先前的四項臨牀研究,包括兩項 1 期和兩項 2 期試驗,臨牀和臨牀前研究中均顯示出一致的 “倒置U” 劑量反應在沒有證據的情況下表現出安全性和耐受性針對 500 多名受試者的10項臨牀研究的鎮靜劑
副作用口服、促認知神經調節劑領導:與精神分裂症相關的認知障礙潛在擴展:認知障礙包括阿爾茨海默氏痴呆和/或
自閉症 2a 期 CIAS 試驗在 H2'21Phase 2b 的首位患者給藥於 23 年第 1 季度 2b 期數據預計在 25 年中期產品適應症當前狀態知識產權發佈的物質成分、配方和使用方法 IP

27 DPNP 的第三方 2 期研究顯示出具有統計學意義的陽性
認知信號(探索性終點)注意:* = P

2a 期試驗-成分 MCCB 複合信號的功效數據
改善 n=7 n=8 n=8 cohen's d*(符號編碼):20 mg:0.79 40 mg:0.56 80 mg:0.38 *活性與 pbo T 分數(按年齡、性別和教育水平進行標準化)atai 在 CIAS 的 2a 期研究顯示 MCB 子集出現了陽性認知信號
神經認知終點臨牀證據:CIAS研究的2a期研究中重現的療效信號顯示,每個MCCB神經認知終點都有與劑量相關的改善趨勢,包括科恩的d效應
大小為0。在 BACS 符號編碼測試中,20mg、40mg 和 80mg 分別為 79、0.56 和 0.38。1 重要的是,符號編碼是最敏感的子成分,與 MCCB 神經認知
複合材料的整體表現相關,後者是正在進行的 RL-007 2b 期研究的註冊終點和主要終點。2 此外,qEEG 數據與先前的臨牀證據一致顯示出
α波段和α-慢波指數的振幅增加,警覺性標誌被認為與之相關認知方面。3 對四個 RL-007 羣組(10、20、40 和 80 毫克)的 31 名 CIAS 患者的認知功能進行了評估。患者
在 4 天內接受了四劑安慰劑,然後接種了六劑 RL-007。將第 2 天 “在 RL-007 之前” 與第 4 天 “之後 RL-007” 進行了比較。這項單盲研究的主要目標是確認SOC的安全性,並確定CIAS患者有認知益處的信號
,包括三項MCCB子成分神經認知測試,HVLT1,BACS符號編碼和類別流暢度背景關鍵要點1。霍普金斯口頭學習測驗 28

29 臨牀試驗設計:RL-007 2b 期研究説明:MCCB = MATRICS 共識
認知電池;BACS = 精神分裂症認知簡要評估;CIAS = 與精神分裂症相關的認知障礙;TID = 每天 3 次給藥試驗狀態:首位患者在 23 年第一季度給藥,Topline 數據預計在 25 年中期隨機,
安慰劑對照研究 RL-007 約 234 名 CIAS RL-007 TID (40 mg) RL-007 TID (20 mg) 安慰劑 R 隨機 1:1:1 主要終點患者:第 6 周的 MCB 神經認知綜合評分關鍵次要終點:選擇個人
MCCB 的組成部分,包括 BACS 符號編碼臨牀全球印象分數第 6 周第 1 天

用於焦慮症的 GRX-917 30

美國世界衞生組織焦慮與抑鬱協會
(2021)GlobalData(截至 2023 年 6 月 1 日)——美國食品藥品管理局最近批准的所有批准都是對長期存在的抗抑鬱藥和苯二氮卓類藥物的重新配方,旨在快速產生抗焦慮活性,但不會產生苯二氮卓類藥物的負面副作用
產品概述:用於焦慮症的 GRX-917 主要適應症概述約3億焦慮症患者 20191 #1 最常見的心理健康障礙1 焦慮症是在憂慮感
和不安情緒會持續很長一段時間,並可能隨着時間的推移而惡化 50% 的美國患者由於次優的治療方案而得不到治療2 在過去十年中沒有獲得美國食品藥品管理局批准的新療法3 31 全球疾病
負擔 GRX-917 關鍵產品特徵顯示出抗焦慮活性的快速起效活性(法國批准了非氘化依託福克辛)對法國約1400萬張處方的審查突顯了
etifox的良好安全記錄耐受性差異,鎮靜劑有限、成癮和/或認知障礙特性,與苯二氮卓類藥物鹽酸氘代依替福辛口服劑型(GRX-917)不同。導致:焦慮症(例如 GAD、SAD、PTSD、
等)第 1 階段試驗於 H2'22 完成探索夥伴關係和外部融資機會產品指標當前狀態知識產權發佈了關於氘化依替福辛(GRX-917)和相應的
使用方法的物質成分

32 注意:PK/PD = 藥代動力學/藥效學;qeeg = 定量
腦電圖;BID = 每日兩次表現出快速且劑量依賴性的 PK/PD 效應以及良好的安全性 1 期研究:GRX-917 試驗設計和結果摘要已完成第 1 階段試驗第 2 部分:多次
遞增劑量第 1 部分:單次遞增劑量 42 名健康受試者:5 組 25mg 至 500 PD 終點:qeeg 60 名健康受試者:5 組 100mg 至 300 mg BID PD 終點:qeeg 安全性/PK/PD 治療安全性/PK/PD 治療安全性/PK/PD 治療安全
且耐受性良好-可耐受,無劑量限制毒性,不良反應與安慰劑相當。靶向參與顯示,與安慰劑同用的安慰劑鎮靜
相比,qeeg β功率的劑量依賴性增加鎮靜劑量,這與腦電圖結果一致,且未顯示 qeeg α功效下降第 1 階段結果摘要
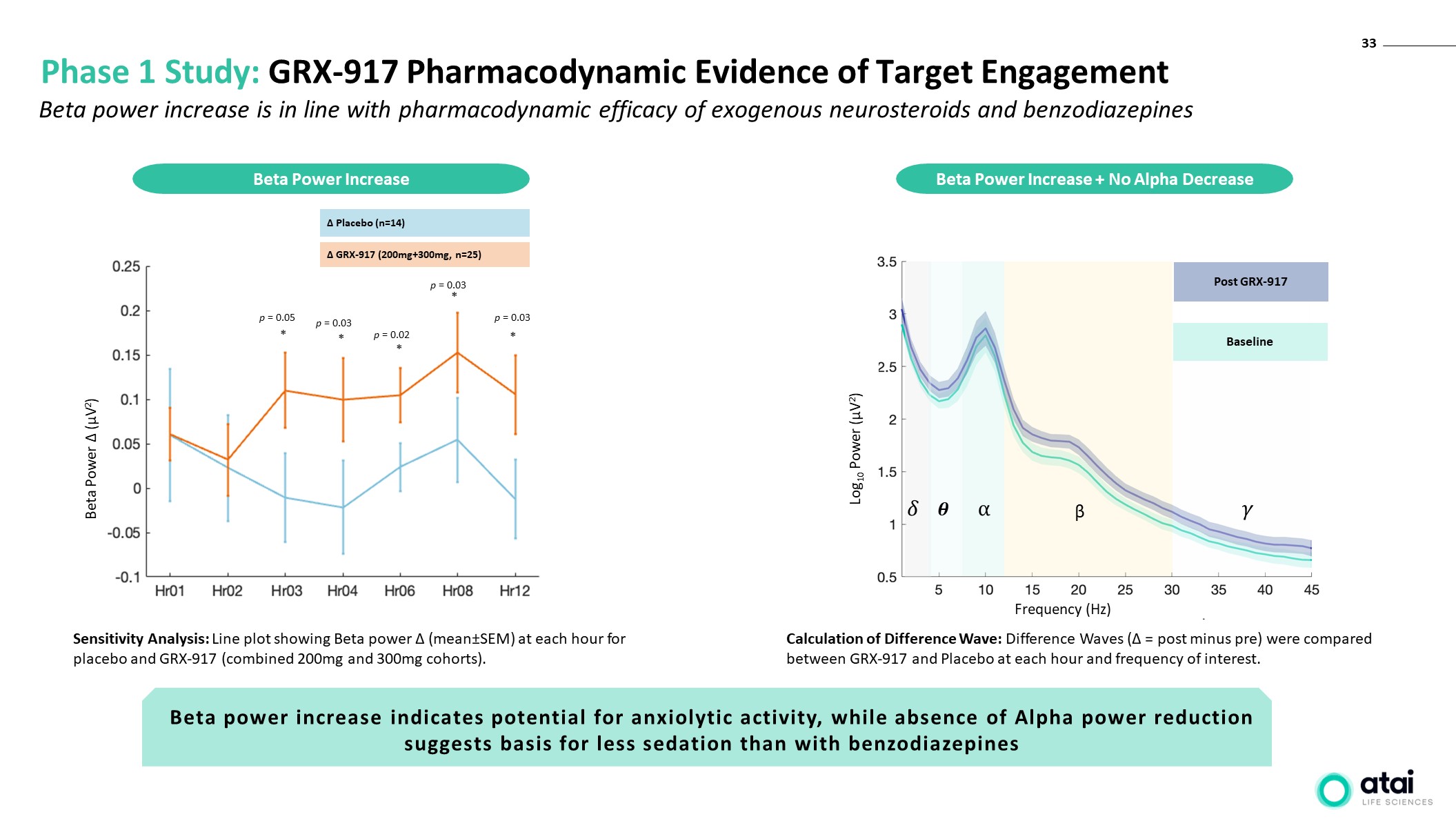
33 第 1 階段研究:GRX-917 靶向參與的藥效學證據 Beta
功率 (µV2) 安慰劑 (n=14) GRX-917 (200mg+300mg,n=25) p = 0.05 p = 0.03 p = 0.03 p = 0.03 p = 0.03 p = 0.03 p = 0.03 * * * * 靈敏度分析:線形圖顯示安慰劑和 GRX-917(組合
200 毫克和 300 毫克隊列)。Beta 功率增加 Beta 能量增加 + 不降低 β 在 GRX-917 後基線 Log10 功率 (µV2) 頻率 (Hz) Beta 功率增加符合外源
神經類固醇和苯二氮卓類藥物的藥效學功效 β功率的增加表明存在抗焦慮活性的潛力,而沒有 Alpha 能量降低表明鎮靜效果低於苯二氮卓類藥物差異計算波動差異:差異
對比了 GRX-917 和安慰劑在每個小時和感興趣頻率下的波浪(= 後減去前)。

納斯達克:ATAI