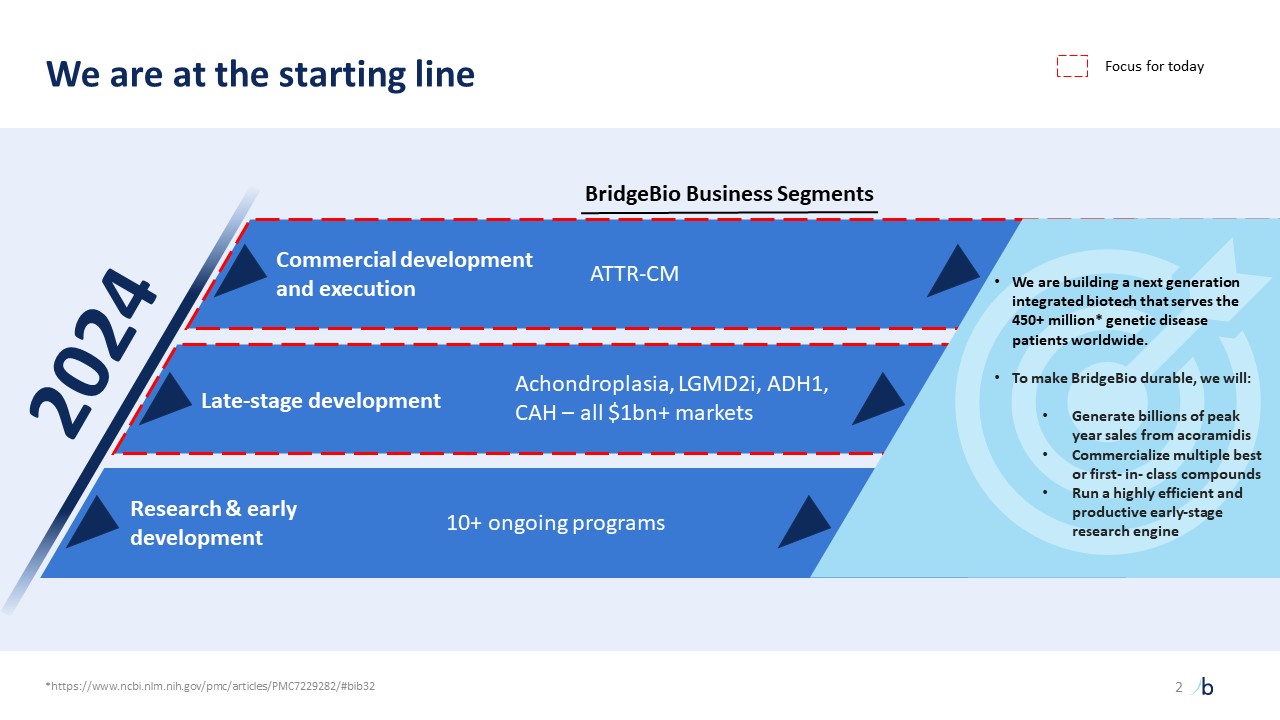
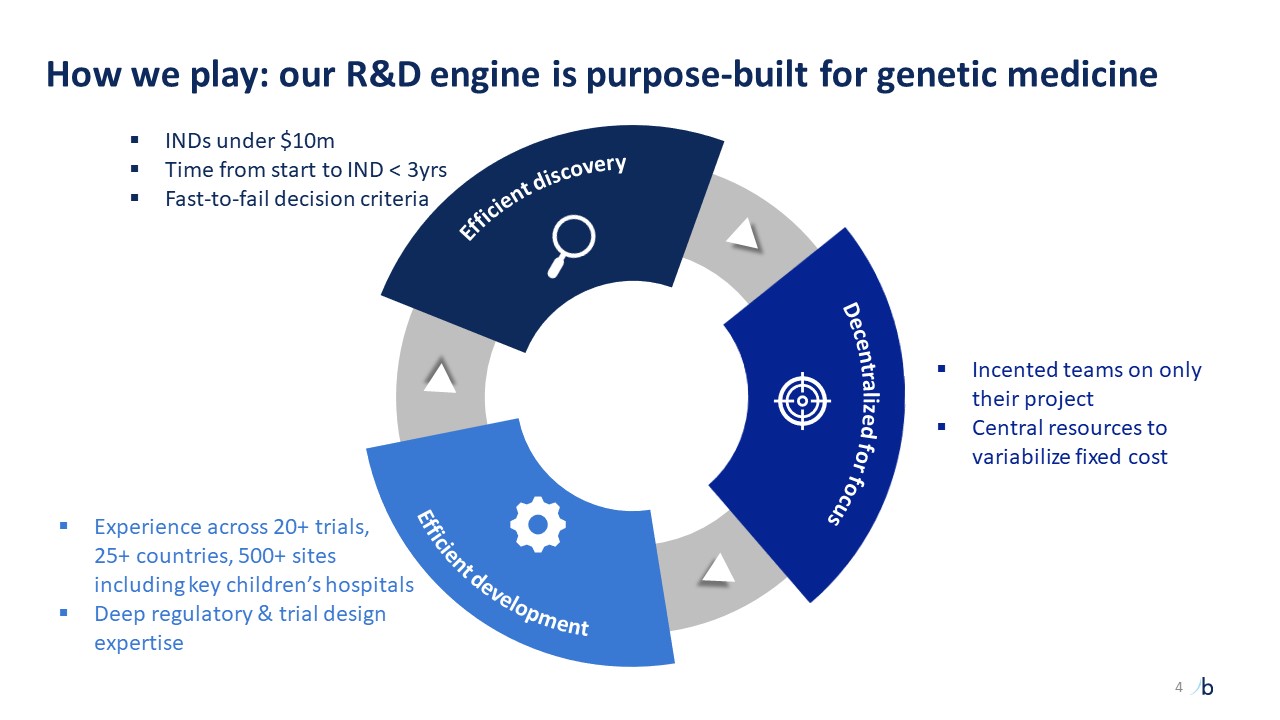
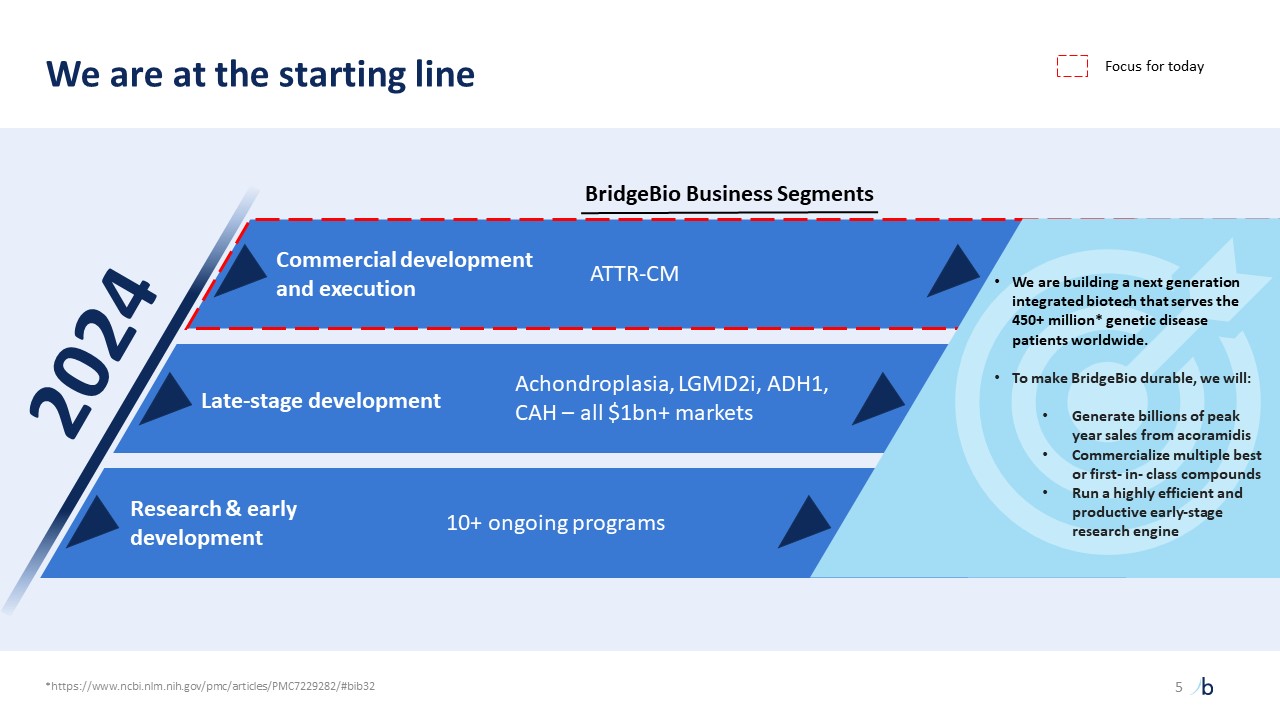
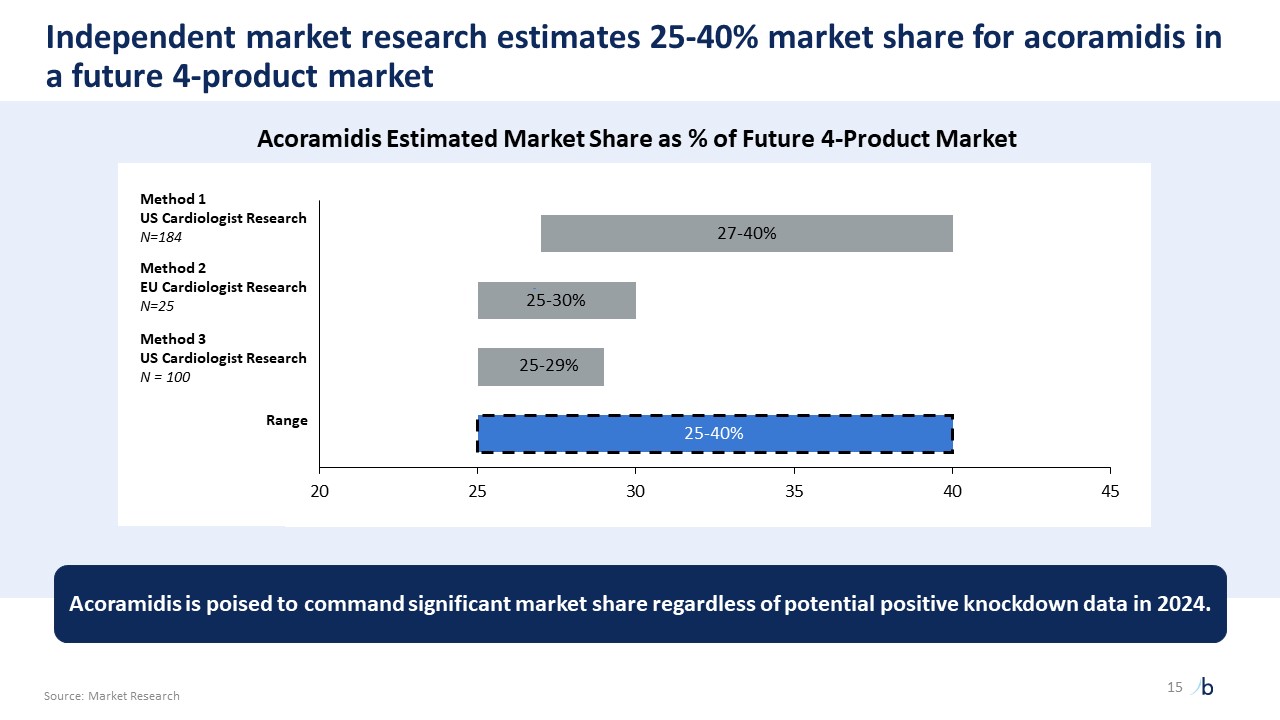
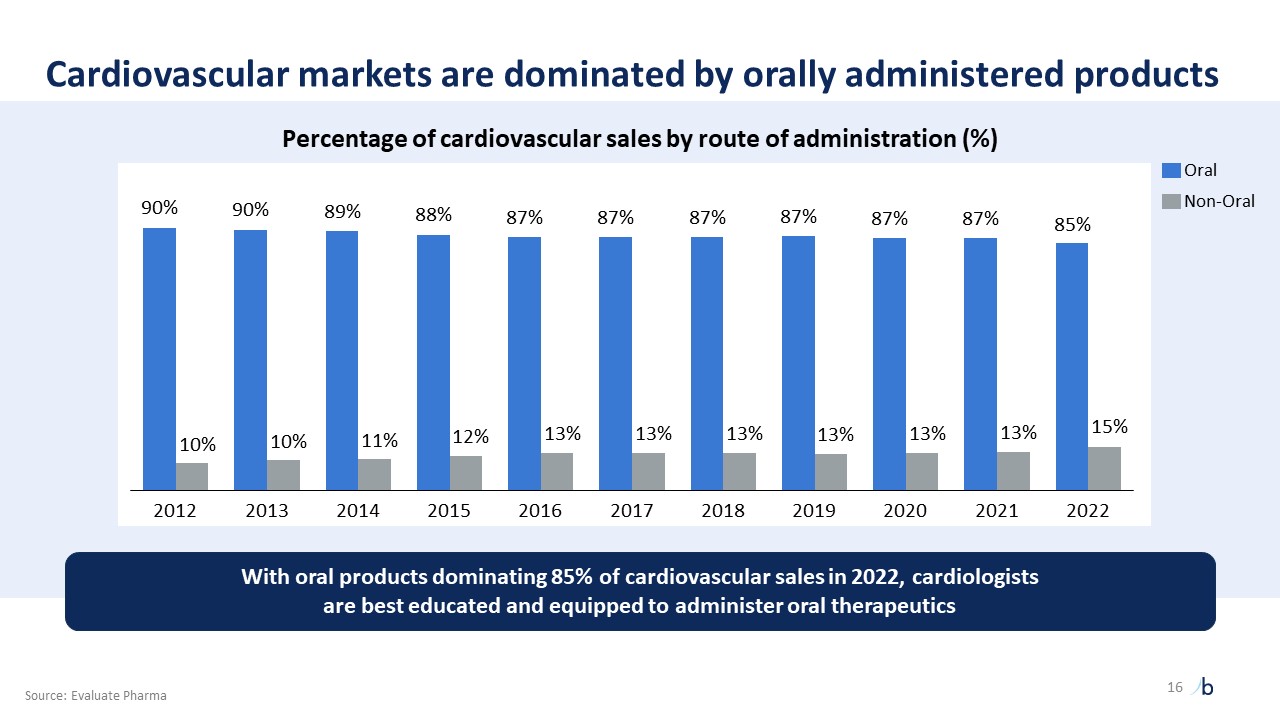
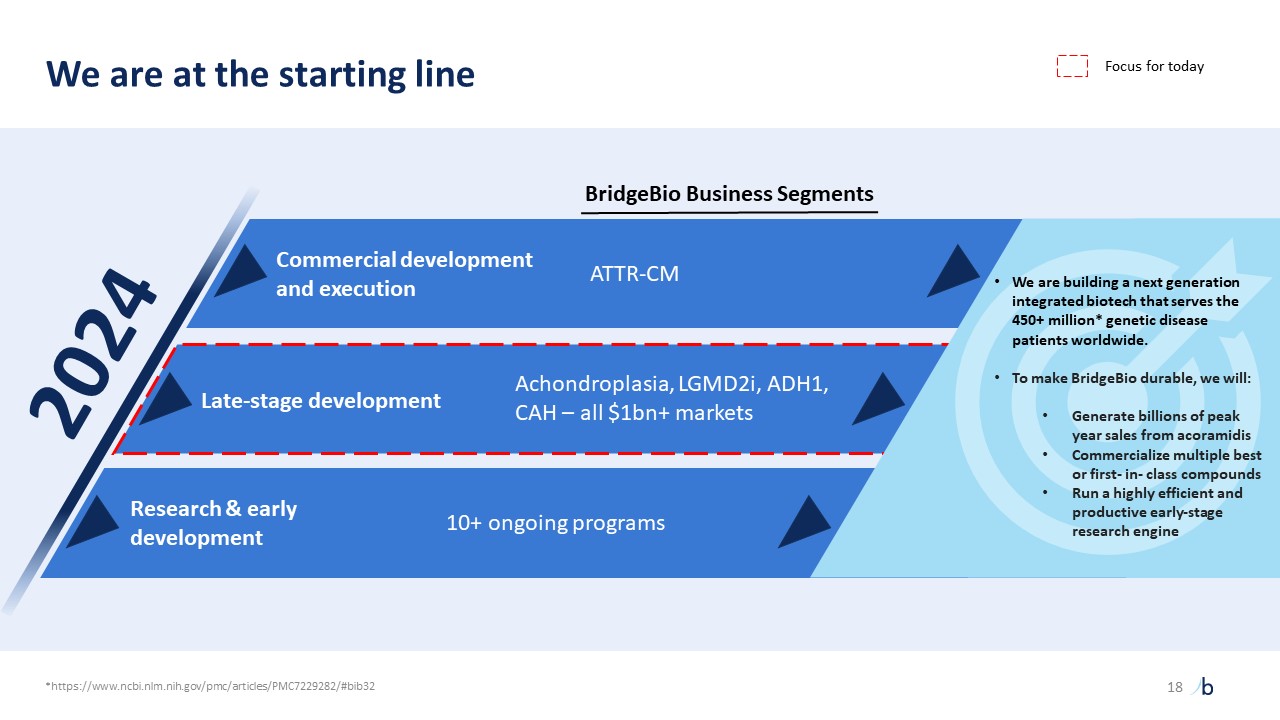
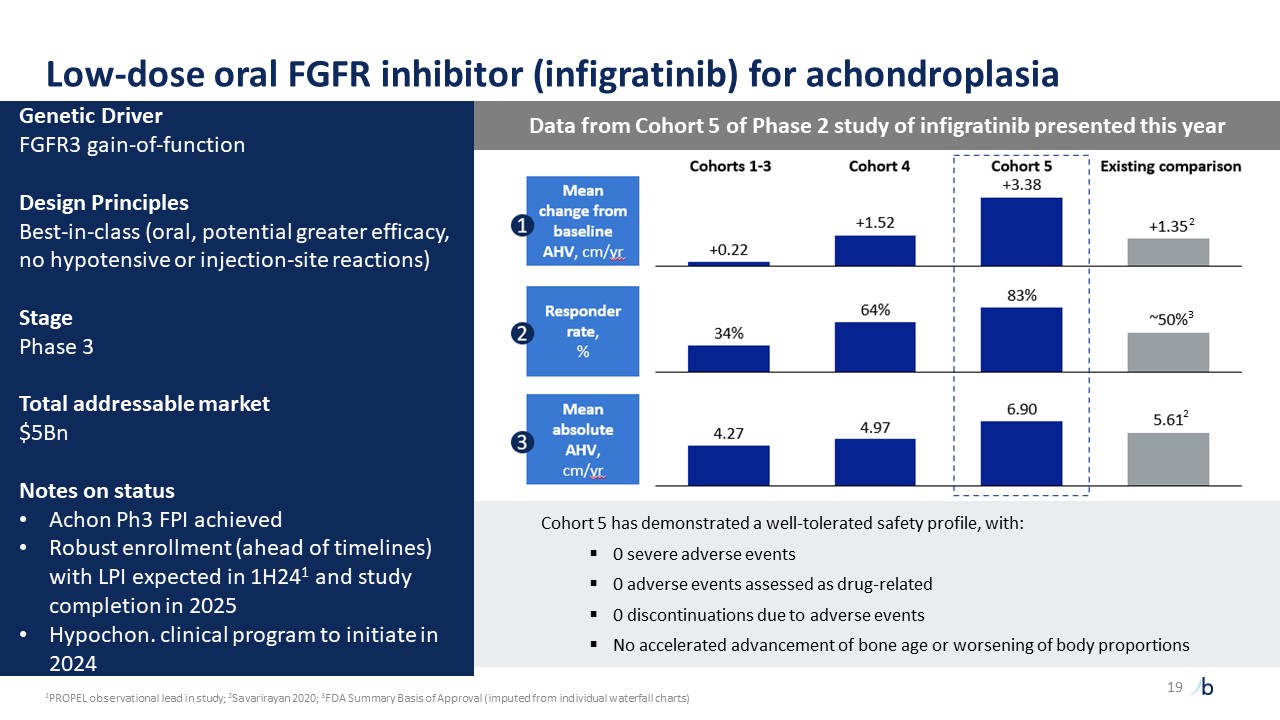
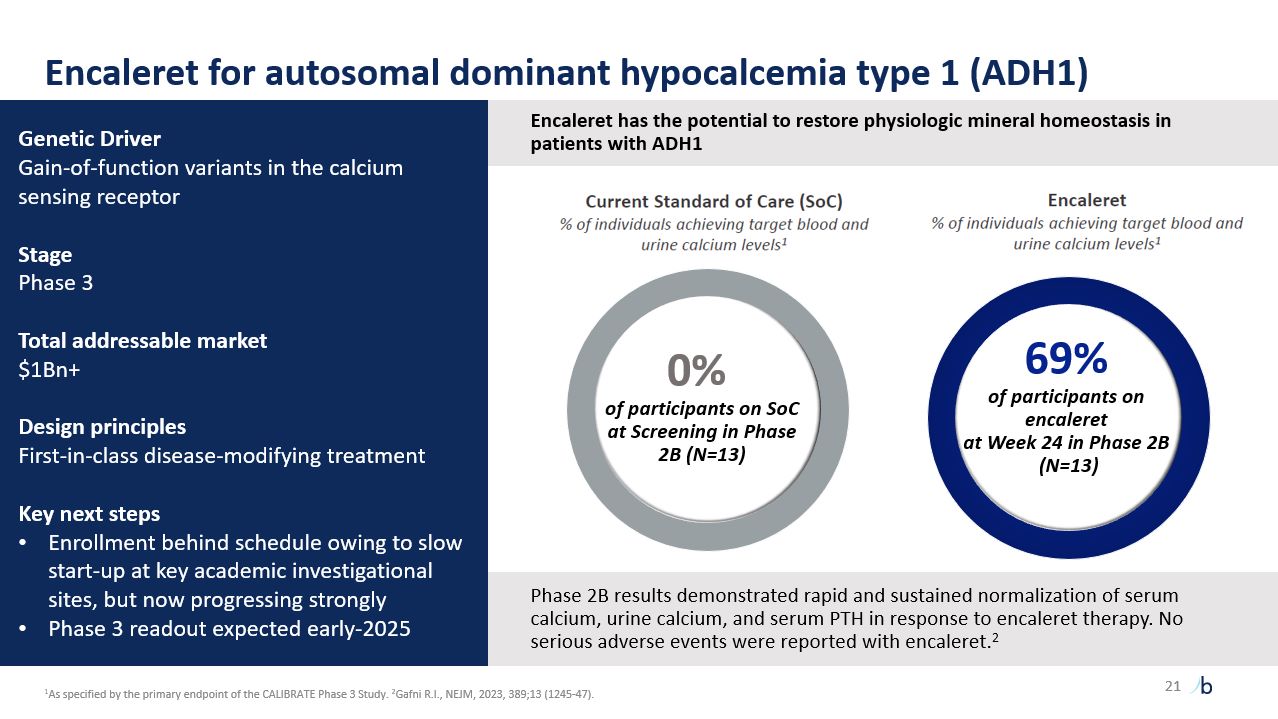
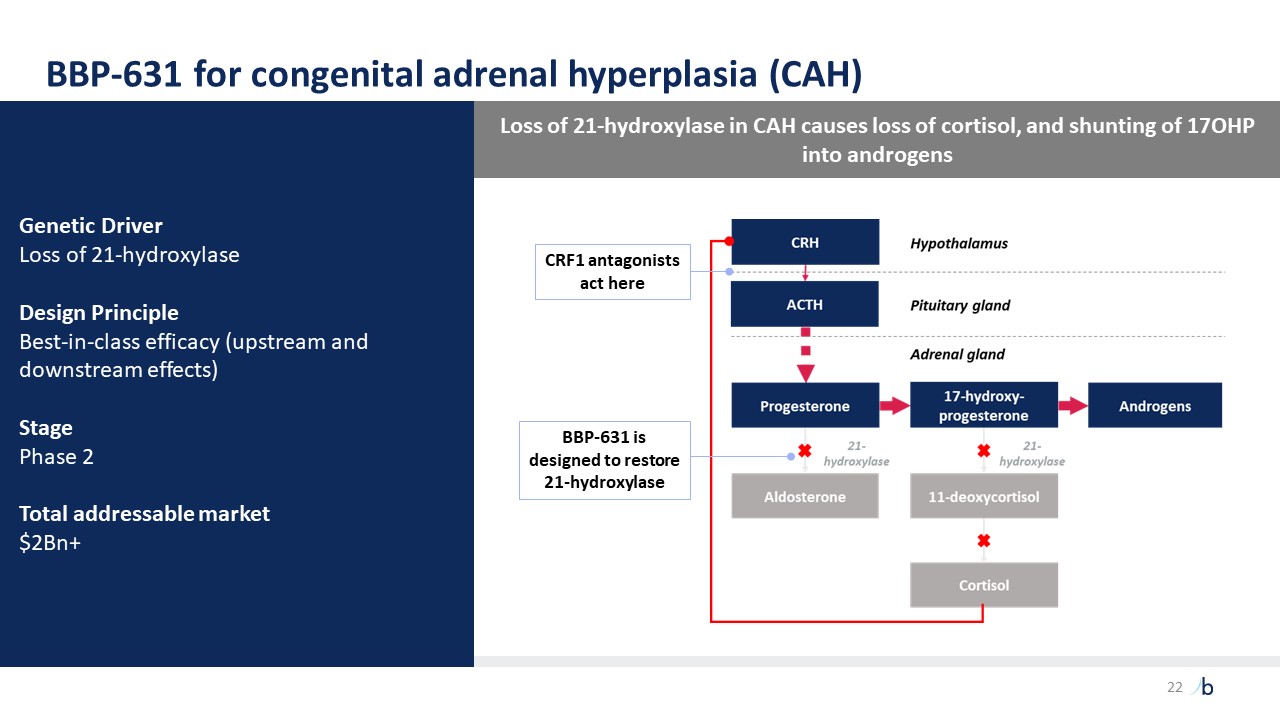
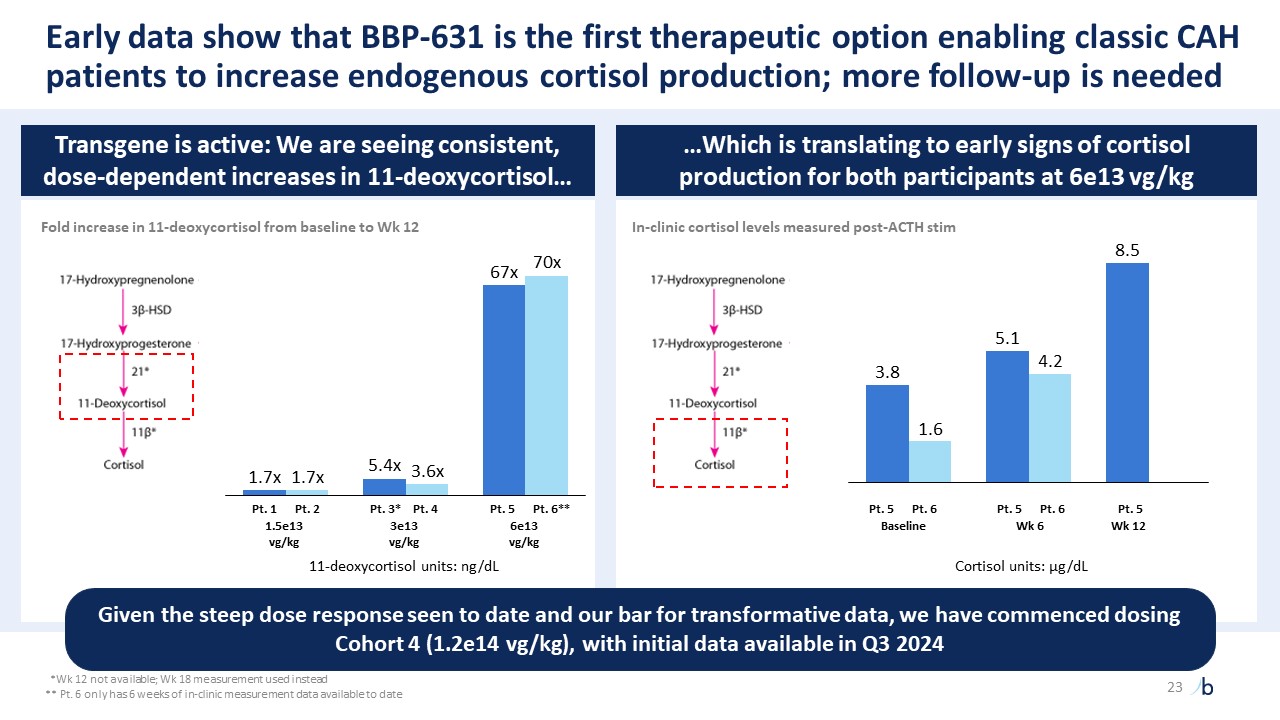
自摩根大通 2023 年以來,ATTR-CM 的經驗教訓提供了前所未有的
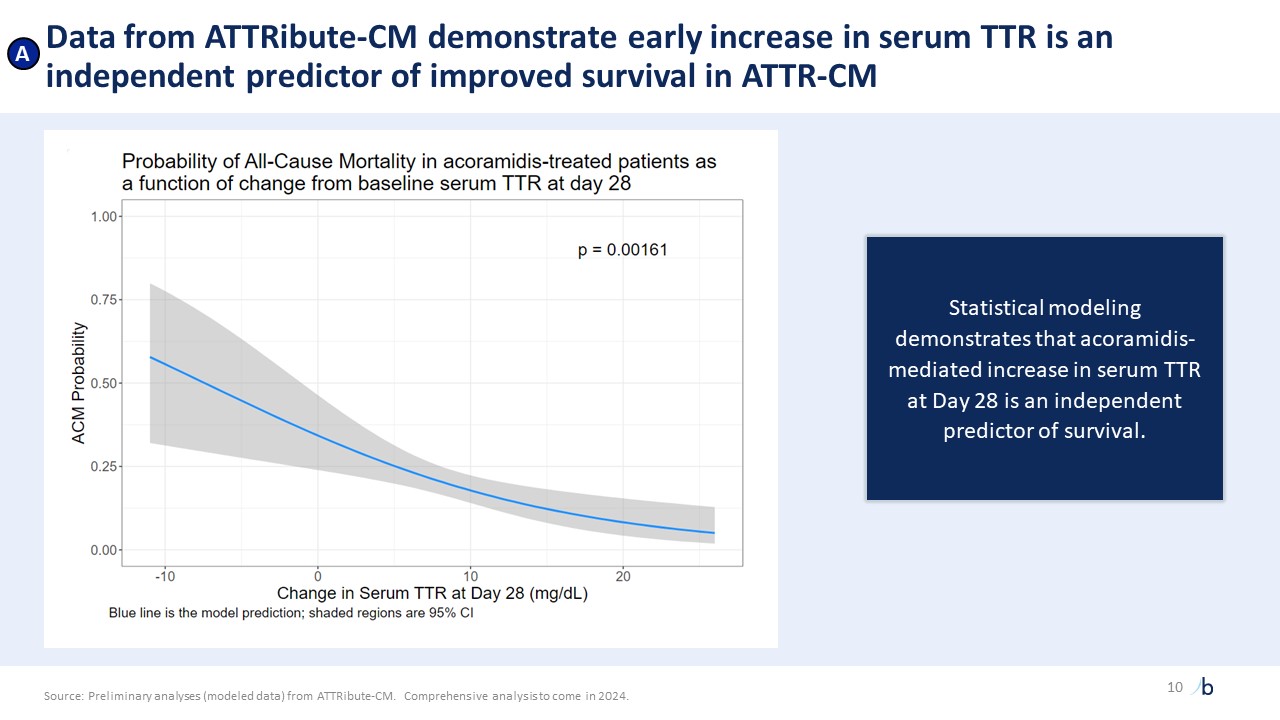
絕對存活率和住院率。作為一種高效的下一代穩定劑,acoramidis的絕對存活率和住院率接近與年齡相匹配的普通人羣1,2,3 Acoramidis在ACM+CVH上顯示出3個月的分離
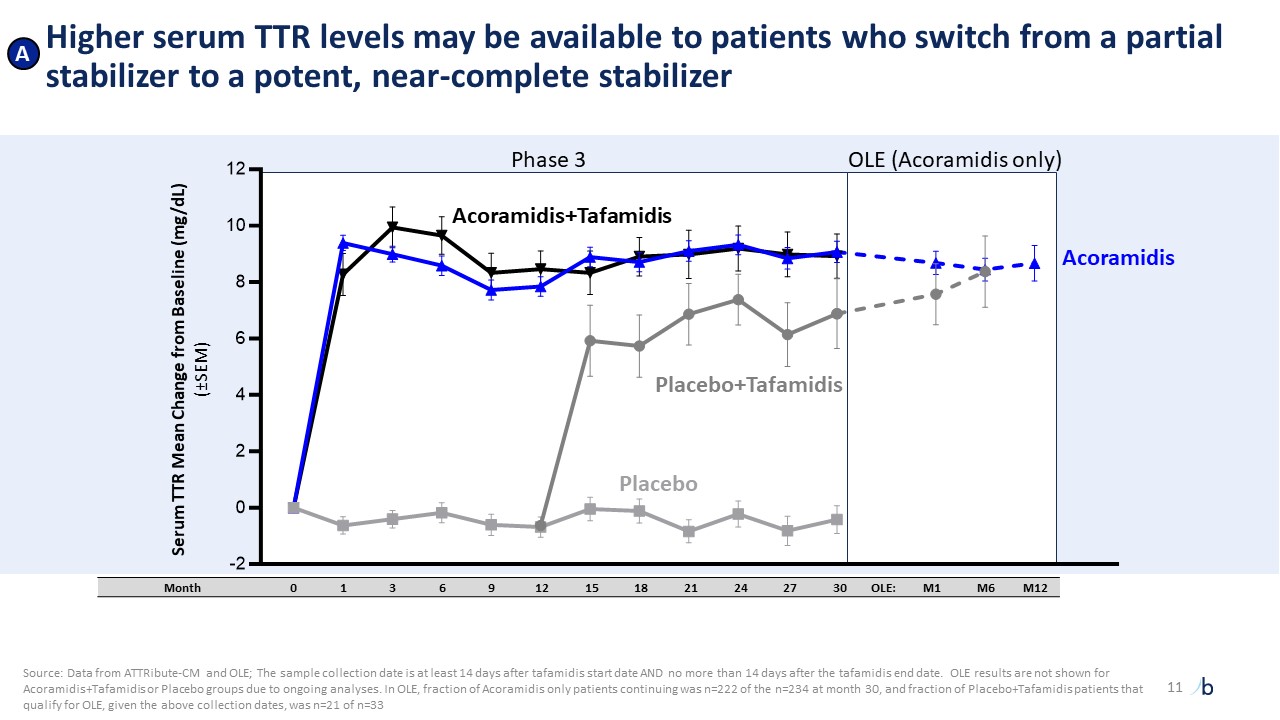
,這是迄今為止已知的最早分離4統計學上阿科拉米德達到的穩定水平與下游死亡率相關,達到前所未有的水平5 顯著的臨牀改善,與新型
無關療法 ATTR-CM 患者的臨牀環境已顯著改善 ATTR-ACT6 的安慰劑組表現優於活躍的塔非米迪斯組 ATTR-CM 市場經久耐用且不斷增長 ATTR-CM
市場在第7季度以約15%的速度增長。歐盟反對部聽取了有關多態專利中塔法米迪斯索賠有效性的爭論,並同意輝瑞的觀點,維持了新穎性和創造性主張,
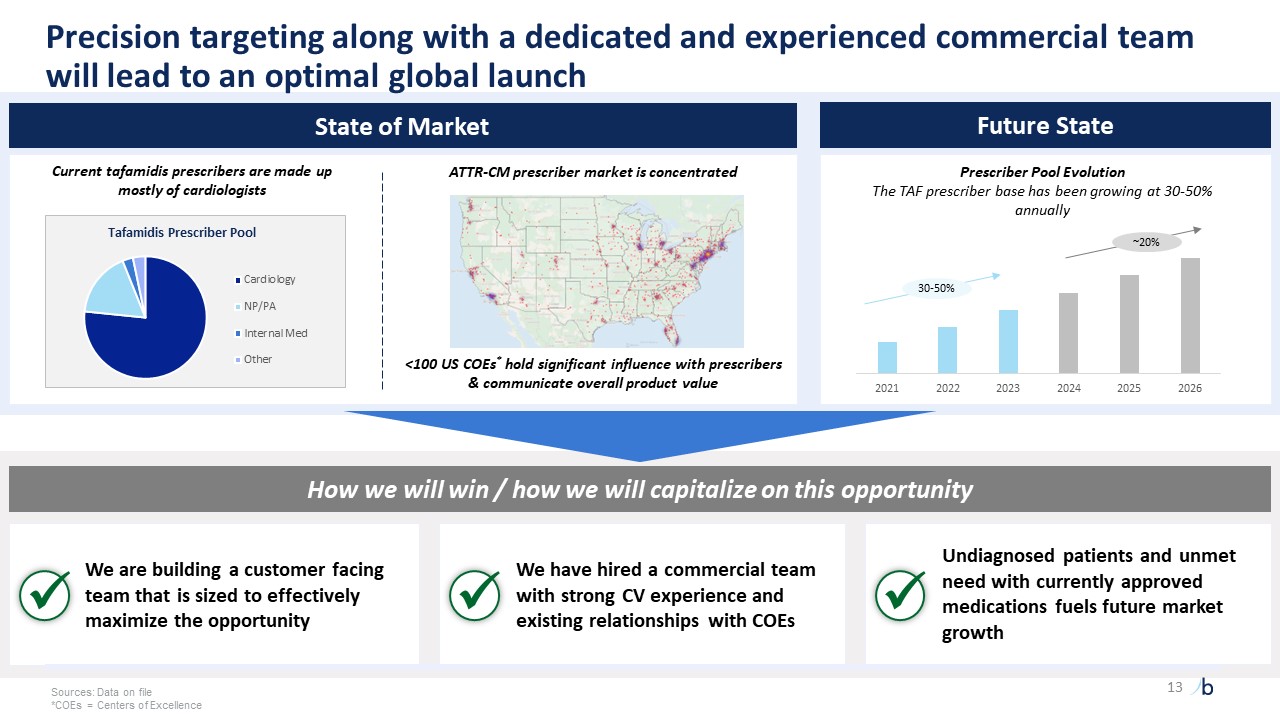
預計 Vyndaqel 將在歐盟八國在 2035 年 8 月之前保持市場排他性對識別現有治療進展者的認識不斷提高。儘管目前市場上有
療法,但ATTR-CM仍有大量未得到滿足的需求通過NT-proBNP識別 “無反應者”,即在現有治療上取得進展的患者 1ssa.gov. 2美國衞生與公共服務部,2018年。3自然史反映了美國醫療保險非新生兒、
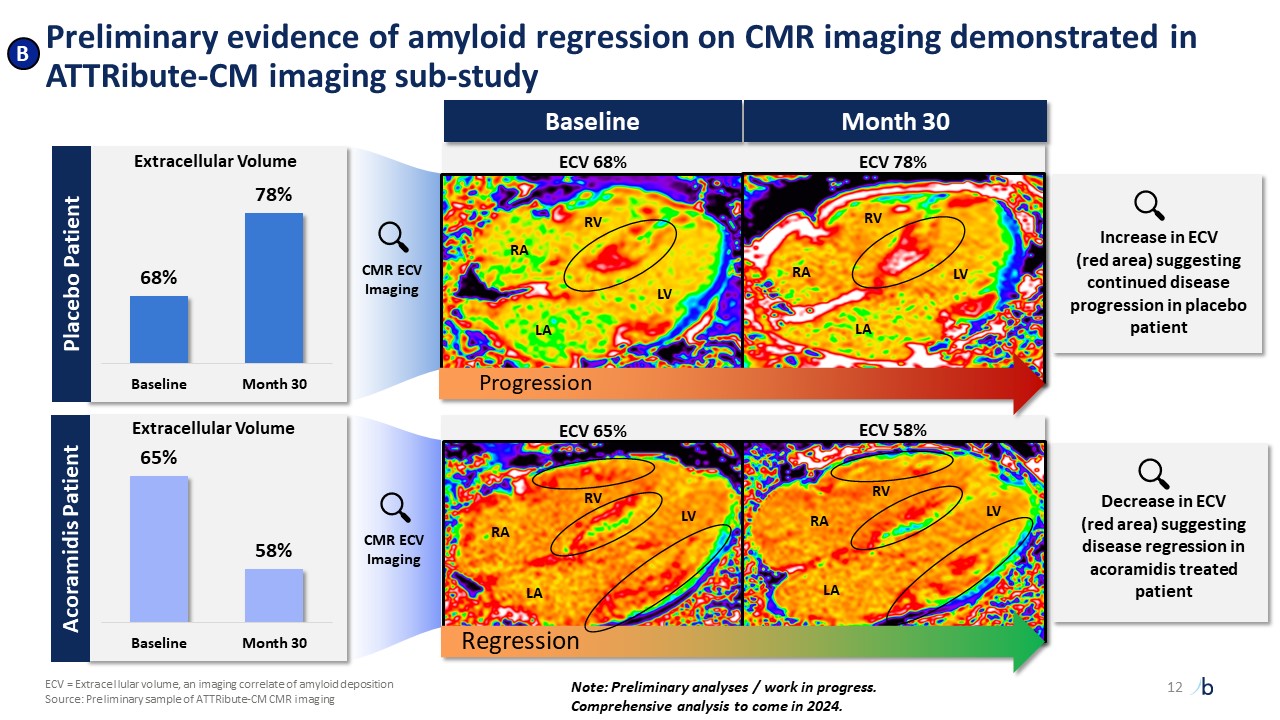
非孕產婦的住院情況。Attribute-CM 數據反映了與心血管相關的住院情況。4Attribute-CM 數據,複合 ACM/CVH 的 Kaplan-Meier。5來自 Attribute-CM 的初步分析(建模數據)。將在
2024 年進行全面分析。6Masri等人,HFSA 2023 “一項多中心研究 Tafamidis 在轉甲狀腺素澱粉樣心肌病中的實際結果”。注意:直接的交叉研究比較可能表明存在誤導性的相似之處或不同之處。7Corporate SEC 文件。
8歐洲專利局,異議處,檔案 #EP3191461