

摩根大通醫療保健大會 Agios Pharmicals Brian Goff,首席執行官 2024 年 1 月 10 日附錄 99.2

前瞻性陳述本 演示文稿以及我們在本次演講中發表的各種言論包含1995年《私人證券訴訟改革法》所指的前瞻性陳述。此類前瞻性陳述包括關於PYRUKYND®(mitapivat)、AG-946、TMPRSS6 siRNA及其多環芳烴穩定劑的潛在 益處的聲明;Agios對其藥物開發的臨牀前、臨牀和商業進展的計劃、戰略和預期,包括PYRUKYND®、AG-946 及其多環芳烴穩定劑;Agios的戰略願景和目標,包括其2024年的關鍵里程碑和到2026年的潛在催化劑;以及Agios戰略計劃和重點的潛在好處。“預期”、 “期望”、“目標”、“希望”、“里程碑”、“機會”、“計劃”、“潛力”、“可能”、“戰略”、“意願”、“願景” 和類似的 表述旨在識別前瞻性陳述,儘管並非所有前瞻性陳述都包含這些識別詞。此類陳述受許多重要因素、風險和不確定性的影響,這些因素可能導致實際的 事件或結果與 Agios 當前的預期和信念存在重大差異。例如,無法保證 Agios 正在開發的任何候選產品都能成功開始或完成必要的臨牀前和 臨牀開發階段,也無法保證 Agios 任何候選產品的開發都能成功繼續。無法保證Agios業務的任何積極發展都會導致股價上漲。 管理層的預期以及本演示文稿中的任何前瞻性陳述以及我們在本次演講中發表的各種言論也可能受到與許多其他重要因素相關的風險和不確定性的影響, 包括但不限於:疫情或其他突發公共衞生事件對Agios的業務、運營、戰略、目標和預期里程碑,包括其正在進行和計劃中的研究 活動的影響相關的風險和不確定性,持續開展研究的能力以及計劃中的臨牀試驗,當前或未來候選藥物的臨牀供應、當前或未來批准產品的商業供應,以及推出、營銷和銷售當前或未來批准的 產品;Agios 的臨牀試驗和臨牀前研究結果,包括對現有數據和從正在進行和未來研究中獲得的新數據的後續分析;美國食品藥品監督管理局、EMA 或 其他監管機構、臨牀試驗場所的研究審查委員會和出版物審查委員會做出的決策的內容和時間身體;Agios 獲得和維持必要的監管批准並讓患者參與其計劃中的臨牀試驗; 計劃外的現金需求和支出;Agios 為其正在開發的任何候選產品獲得、維持和執行專利和其他知識產權保護的能力;Agios 建立和維持關鍵 合作的能力;與出售 Agios 腫瘤業務或 TMPRSS6 siRNA 許可相關的任何里程碑或特許權使用費支付的不確定性,以及不確定性任何此類付款的時機;不確定性結果 和使用與Servier交易所得收益的有效性;競爭因素;以及總體經濟和市場狀況。 Agios向美國證券交易委員會提交的公開文件中包含的 “風險因素” 標題下詳細描述了這些風險和其他風險。除非法律要求,否則本演示文稿中包含的任何前瞻性陳述以及我們在本演講中發表的各種言論僅代表截至本演示之日,Agios明確 不承擔任何更新任何前瞻性陳述的義務,無論是由於新信息、未來事件還是其他原因。
成為一家領先的罕見病 公司,為需求量大的疾病提供一流和/或一流的新療法 Aim High Come Together Come Together Cell Self Insease 開闢新途徑 Tamara 丙酮酸激酶缺乏症 在改變罕見疾病的聯繫的推動下開發和提供可提升和延長患者壽命的變革性藥物我們的願景我們的價值觀我們的使命 Ryan Thalassemia
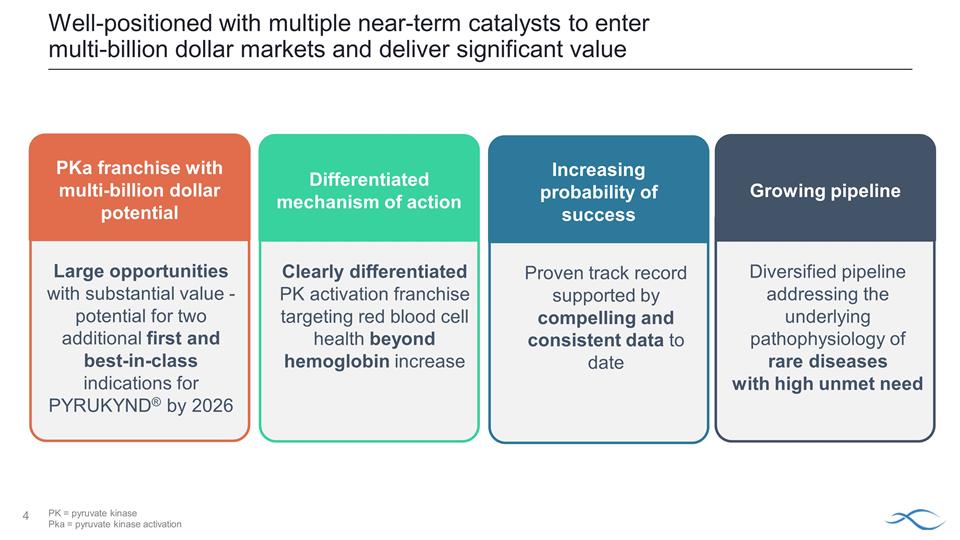
憑藉多種 短期催化劑處於有利地位,可以進入數十億美元的市場並創造巨大價值提高成功概率提高迄今為止令人信服且一致的數據支持差異化的行動機制顯然 差異化PKa激活特許經營權具有數十億美元潛力巨大的機會——到2026年,PYRUKYND® 可能再出現兩項首創和同類最佳 適應症成長pipeline 針對未得到滿足的高需求罕見疾病的潛在病理生理學的多元化產品線 PK = 丙酮酸激酶 Pka = 丙酮酸激酶激酶 Pka = 丙酮酸激酶活化
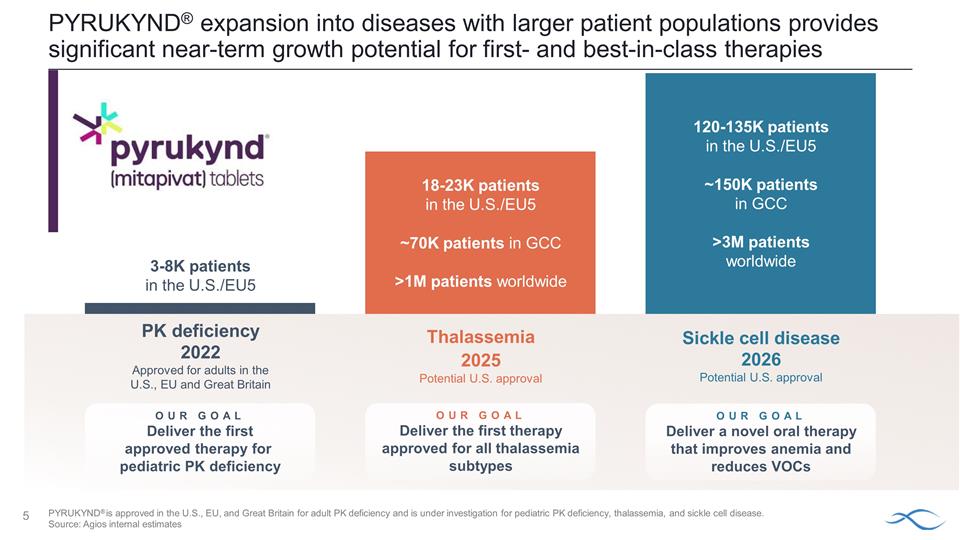
PYRUKYND® 擴展到患者羣體較多的疾病 為一流和同類最佳療法提供了巨大的短期增長潛力鐮狀細胞病 2026 美國潛在批准量美國有120-135萬名患者/歐盟5~15萬海灣合作委員會患者全球超過300萬名患者 我們的目標提供一種改善貧血和減少揮發性有機化合物的新型口服療法美國18-23K患者/歐盟5約7萬GC患者全球超過 100 萬患者我們的目標提供第一種獲準用於所有地中海貧血亞型的療法 2025 年地中海貧血 PK 缺乏可能獲得美國批准2022 年 PYRUKYND® 獲準用於美國、歐盟和英國的成年人我們的目標為美國的兒科磷鉀缺乏症提供首款獲批准的療法 3-8K 患者/歐盟5 PYRUKYND® 已獲美國、歐盟、 和英國批准用於成人 PK 缺乏症,並正在研究兒科 PK 缺乏症、地中海貧血和鐮狀細胞病。來源:Agios 內部估計
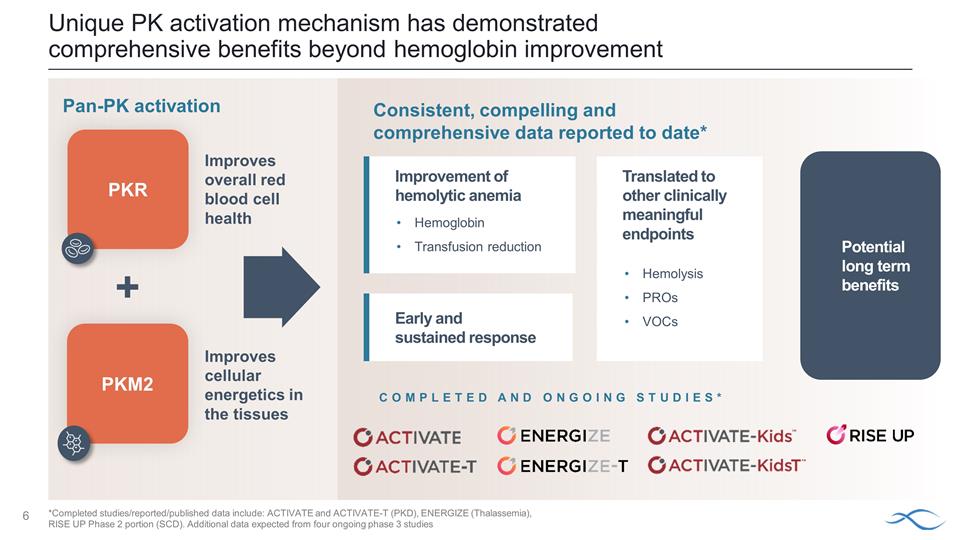
獨特的 PK 激活機制已顯示出除改善血紅蛋白之外的全面益處 PKR 改善組織中的細胞能量改善整體紅細胞健康 PKM2 改善溶血性貧血早期和持續反應潛在的長期益處 迄今為止報告的一致、令人信服和全面的數據* 減少血紅蛋白輸血 + 已完成和正在進行的研究* 轉化為其他具有臨牀意義的終點 Hemolysis proS VOC *已完成的研究/報告發布/發佈的數據 包括:ACTIVATE 和 ACTIVATE-T(PKD)、ENERGIZE(地中海貧血)、RISE UP 第 2 階段部分(SCD)。預計將從四項正在進行的3期研究中獲得更多數據 pan-PK激活
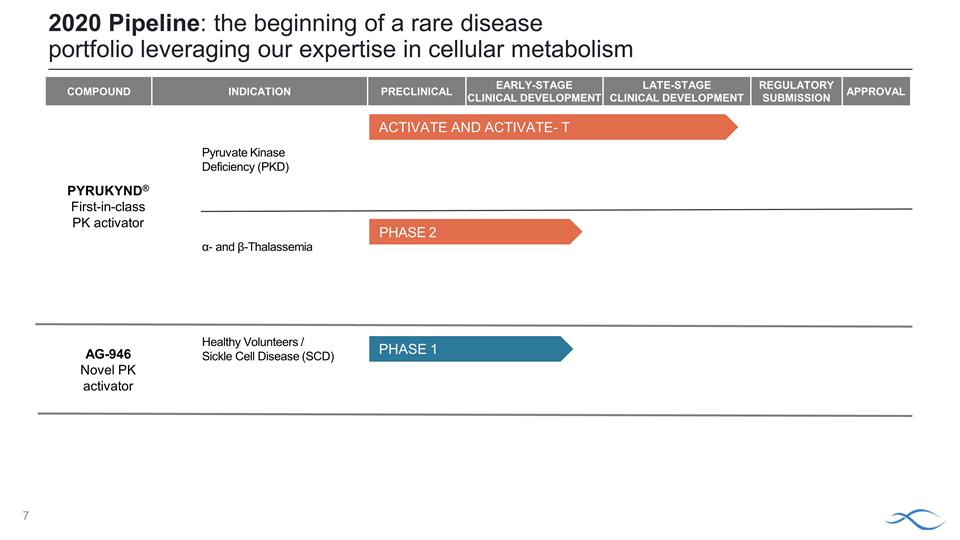
化合物適應症臨牀前 早期臨牀開發後期臨牀開發監管機構提交批准丙酮酸激酶缺乏症 (PKD) α-和 β-地中海貧血健康志願者/鐮狀細胞病 (SCD) 2020 年管道:利用我們在細胞代謝激活和激活方面的專業知識推出罕見 疾病組合——T 第 1 期美國、歐盟、英國第 2 期 PYRUKYND® 同類首創 PK 激活劑 AG-946 新型 PK 活化劑激活劑
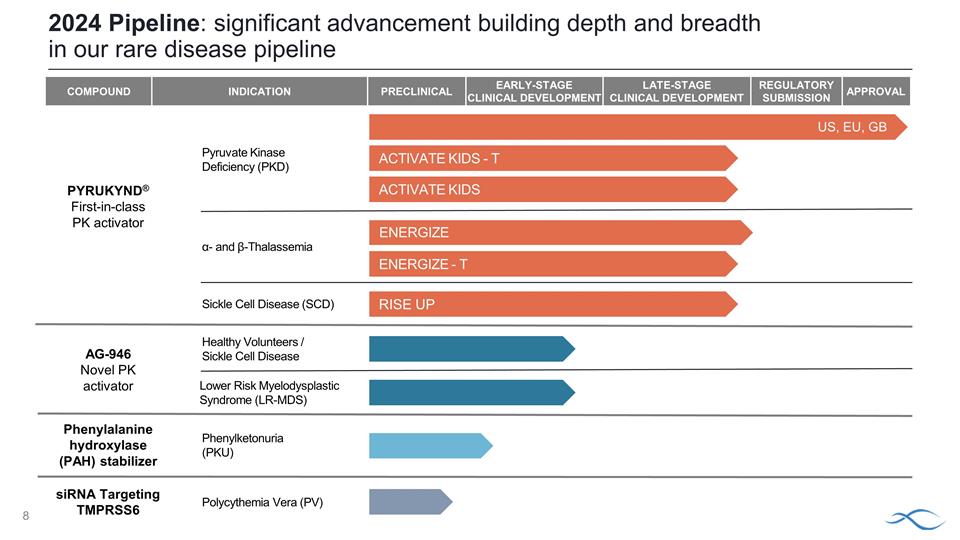
化合物適應症臨牀前 早期臨牀開發後期臨牀開發監管機構提交批准丙酮酸激酶缺乏症 (PKD) α-和 β-地中海貧血鐮狀細胞病 (SCD) 低風險骨髓增生異常綜合徵 (LR-MDS) 健康志願者 /鐮狀細胞病苯丙酮尿症 (PKU) 2024 年產品線:在深度和廣度方面取得重大進展 Polycythemas Ia Vera (PV) PYRUKYND® 同類首創 PK 活化劑 ENERGIZE-T ACTIVATE KIDS-T ACTIVATE KIDS RISE UP 苯丙氨酸羥化酶 (PAH)穩定劑 siRNA 靶向 TMPRSS6 美國、歐盟、英國 AG-946 新型 PK 活化劑 ENERGIZE
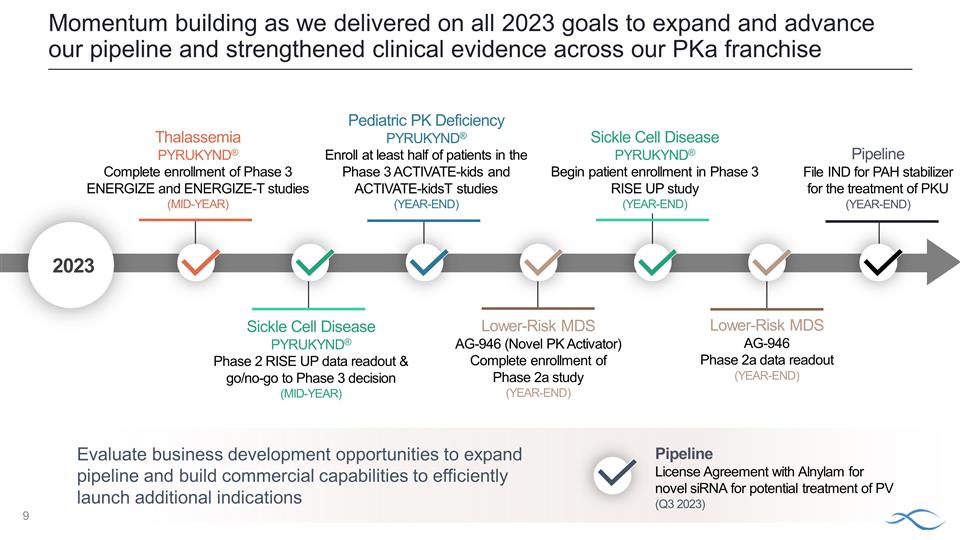
2023 評估業務發展 擴大產品線和建立商業能力以有效啟動更多適應症的機會。我們實現了 2023 年所有目標,即擴大和推進我們的產品線,強化了 pKa 系列低風險 MDS AG-946(新型 PK 激活劑)2a 期研究(年底)地中海貧血 PYRUKYND® 完成第 3 期 ENERGIZE 和 ENERGIZE-T 研究的入組(年中)鐮狀細胞研究(年中)疾病 PYRUKYND® 第 2 階段 RISE UP 數據讀出並進入/不進入第 3 階段決定(年中)兒科PK缺乏 PYRUKYND® 在與 Alnylam 簽訂的 用於潛在治療半數的新型 siRNA 的第 3 階段 Activate-Kids 和 Activate-KIDST 研究(年底)管道許可協議中至少有一半的患者入組(2023 年第三季度)鐮狀細胞病 PYRUKYND® 開始第 3 期 RISE UP 研究(年底)低風險 MDS AG-946 2a 期數據讀取(年底)管道文件用於治療PKU 的多環芳烴穩定劑的IND(年底)
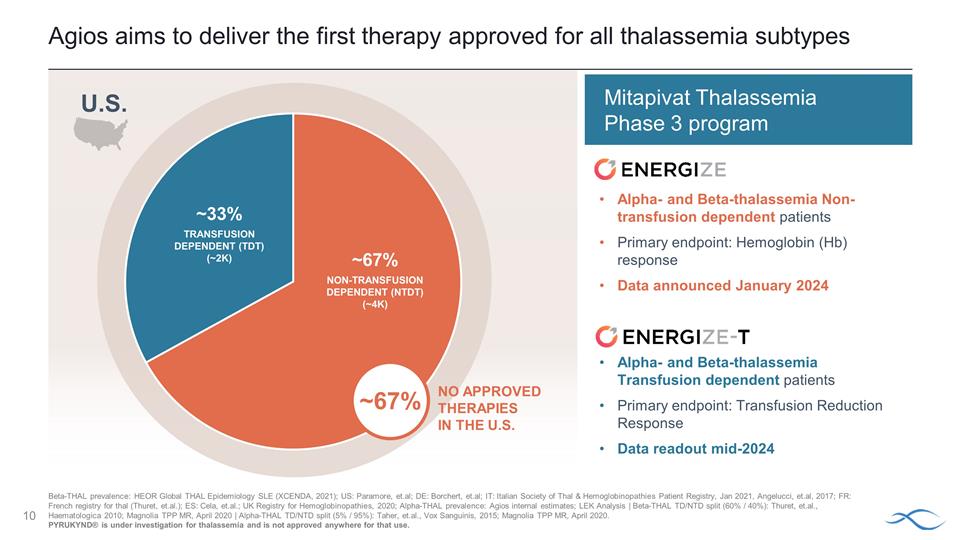
Agios 的目標是提供第一種獲準用於所有地中海貧血亞型的 療法美國未獲批准的療法 ~ 67% α-和 β-地中海貧血非輸血依賴患者主要終點:血紅蛋白 (Hb) 反應數據 2024 年 1 月公佈 α-和 β-地中海貧血 輸血依賴患者主要終點:2024 年中期輸血反應數據 Mitapivat 地中海貧血 3 期項目 ~ 67% 非輸血依賴性 (NTDT) (~4K) ~ 33% 輸血依賴性 (TDT) (~2K) 美國 β-Thal 患病率: HEOR 全球泰爾流行病學系統性紅斑狼瘡(XCENDA,2021);美國:帕拉莫爾等人;德國:Borchert 等人;IT:意大利塔爾與血紅蛋白病學會患者登記處,2021 年 1 月,Angelucci 等,2017 年;法國:法國塔爾登記處(Thuret 等);西班牙: Cela 等;英國 Hemoglobinglobinoshies 疾病,2020 年;α-thal 患病率:Agios 內部估計;LEK 分析 | β-thal TD/NTD 分裂(60%/40%):Thuret 等人,Haematologica 2010;Magnolia TPP MR,2020 年 4 月 | α-thal TD/NTD 分裂(5% /95%):Taher 等人,Vox Sanguinis,2015 年;Magnolia TPP MR,2020 年 4 月。PYRUKYND® 正在接受地中海貧血的研究,任何地方都未獲批准用於該用途。
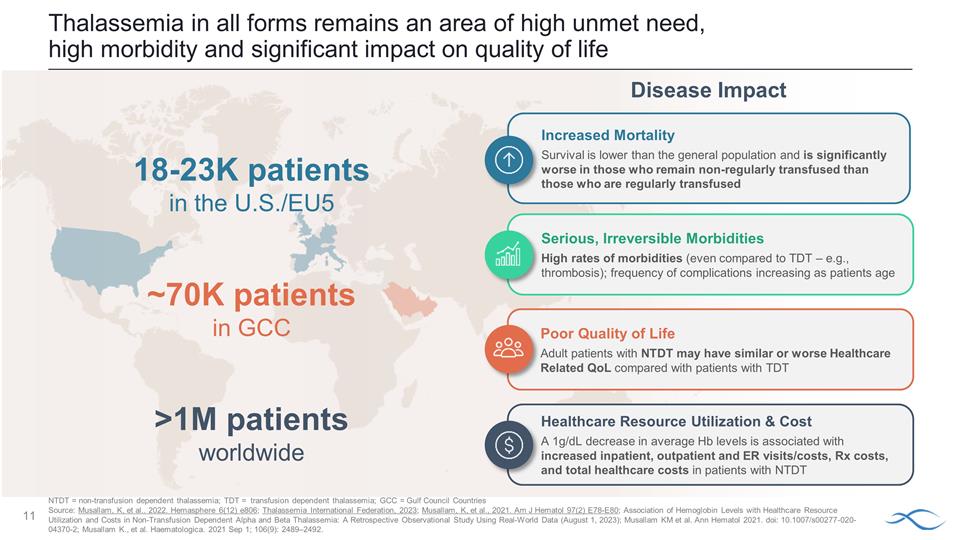
各種形式的地中海貧血仍然是需求未得到滿足、發病率高且對生活質量有重大影響的 領域疾病影響美國18-23萬名患者海灣合作委員會約7萬名患者全球超過100萬名患者嚴重不可逆的發病率與TDT相比(甚至 ,例如血栓形成);併發症的頻率隨着患者年齡的增長而增加與使用TDT的患者相比,NTDT患者的醫療保健相關生活質量可能相似或更差醫療保健資源 利用率和成本平均下降1g/dLHb 水平與住院、門診和急診就診/費用、Rx 費用和總醫療費用增加有關 NTD 患者的總醫療費用。增加的死亡率低於普通 人羣的存活率,比定期輸血的患者要差得多 NTDT = 非輸血依賴性地中海貧血;TDT = 輸血依賴性地中海貧血;GCC = 海灣委員會國家來源: Musallam、K 等人... 2022。Hemasphere 6 (12) e806;地中海貧血國際聯合會,2023 年;Musallam,K 等人,2021 年。Am J Hematol 97 (2) E78-E80;非輸血 依賴性 α 和 β 地中海貧血中血紅蛋白水平與醫療保健資源利用率和成本的關係:一項使用現實世界數據的回顧性觀察研究(2023 年 8 月 1 日);Musallam KM 等人Ann Hematol 2021. doi:10.1007/s00277-020-04370-2;Musallam K. 等人Haematologica. 2021 年 9 月 1 日;106 (9): 2489—2492。

ENERGIZE:在主要和所有關鍵次要終點上均取得了顯著成效 共有 194 名患者被隨機分配 2:1 至 100 mg migatipivat(n=130)或安慰劑(n=64)與服用安慰劑的患者(1.6%)相比,血紅蛋白反應率(42.3%)顯著增加 在此期間,平均面部疲勞評分和平均血紅蛋白濃度與基線相比有統計學上的顯著變化 24 周雙盲期,mitapivat 組的 4 名受試者出現不良事件 (AE),導致停藥; 安慰劑組無不良反應導致停藥與安慰劑相比,所有預先指定的亞組分析都偏向米塔匹伐治療組ENERGIZE試驗的關鍵發現完整數據集將在即將舉行的醫學會議上公佈 ENERGIZE T 讀數預計將在年底前共同提交給美國食品藥品管理局2025年美國可能推出下一步血紅蛋白反應定義為從第12周到第12周平均血紅蛋白濃度增加≥1.0 g/dL(10 g/L)第 24 周與基線相比。
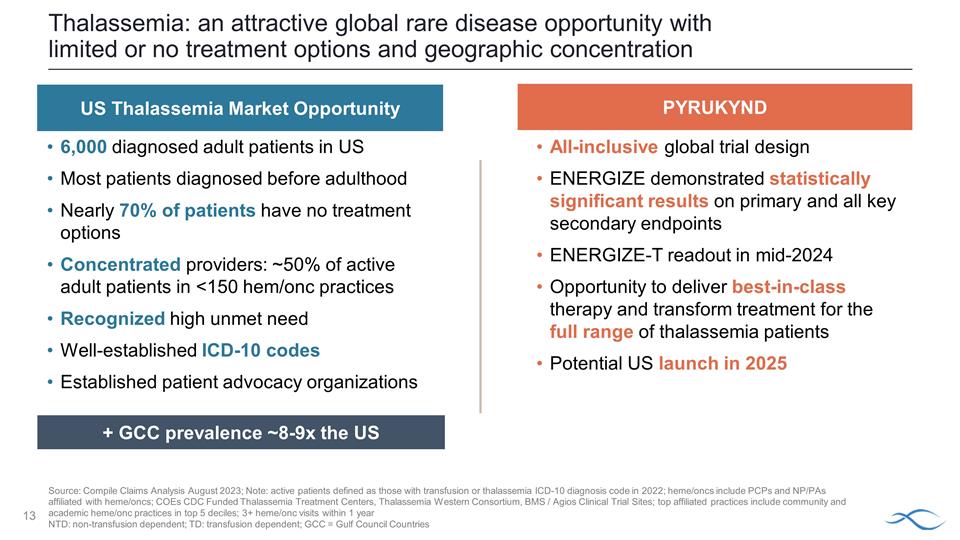
美國 有 6,000 名確診的成年患者大多數在成年前被診斷的患者將近 70% 的患者沒有治療選擇集中提供者: 約有 50% 的活躍成年患者
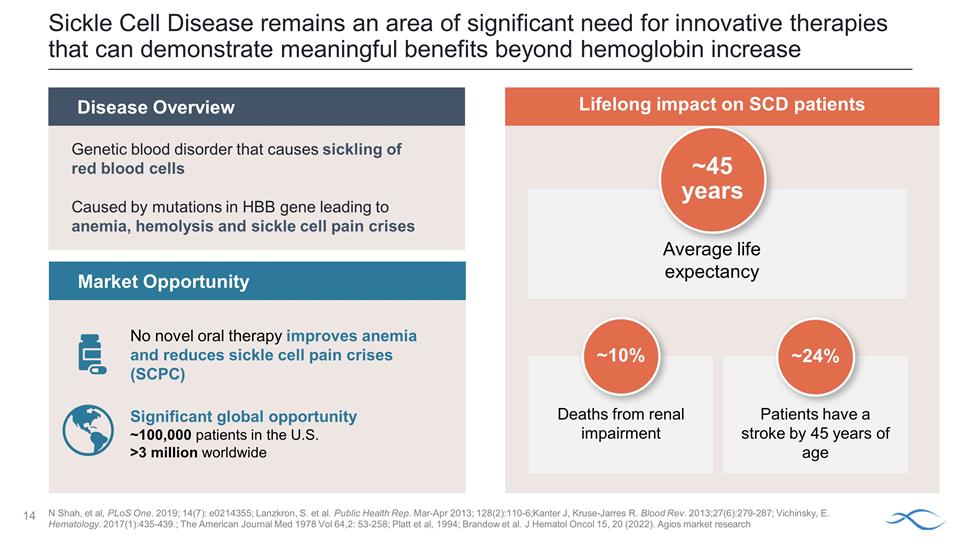
鐮狀細胞病仍然是迫切需要創新療法的領域,這些療法除了血紅蛋白增加之外還能顯示出有意義的益處疾病概述市場機會沒有新的口服療法可以改善貧血和減少鐮狀細胞疼痛危機(SCPC)對 SCD患者的終身影響平均預期壽命約為45歲患者在45歲之前出現中風~24%導致紅細胞鐮狀的遺傳性血液疾病由HBB基因突變引起到貧血、溶血和鐮狀細胞疼痛危機 重大的全球機遇美國約有10萬名患者全球超過300萬人 N Shah 等人,PLoS One。2019;14 (7):e0214355;Lanzkron、S. 等人公共衞生代表,2013 年 3 月至 4 月;128 (2): 110-6;Kanter J,Kruse-Jarres R. Blood Rev. 2013;27 (6): 279-287;維欽斯基,E. 血液學。2017 (1): 435-439。;1978 年《美國醫學雜誌》第 64,2 卷:53-258;Platt 等人,1994 年;Brandow 等人J Hematol Oncol 15、20 (2022)。Agios 市場研究腎功能受損死亡約 10%

與安慰劑相比,兩種劑量的血紅蛋白反應率 均有統計學上的顯著增加 與安慰劑相比,兩種劑量的溶血和紅細胞生成標誌物有所改善。與安慰劑相比,兩種劑量都觀察到鐮狀細胞疼痛危機減輕的趨勢 無不良事件 (AE) 導致停藥第 2 階段數據第 3 階段主要終點:血紅蛋白反應 (3) 和 sCS 的年化率 pcs N = 198 採用 2:1 隨機分配(100 mg migatipivat 和安慰劑)52 周雙盲期 然後是 216 周的開放標籤延期 PYRUKYND:一種新型口服療法,有可能成為改善貧血、減少短鏈氯化蛋白、改善患者的感覺和功能的 PYRUKYND 無縫2/3期全球研究,採用 社區意見設計的 mitapivat 有潛力:改善貧血減少鐮狀細胞疼痛危機改善患者的感受和功能預計2025年美國可能在2026年推出第 3 階段設計 (2) 縮寫:BID = 每日兩次;Hb = 血紅蛋白;SCPC = 鐮狀細胞疼痛危象 (1) 100mg 被選作研究的第 3 階段 (2) 第 2 階段第 3 階段成分是單項研究/方案的一部分 (3) 血紅蛋白反應的定義是,在第 24—52 周內,與基線相比,平均 Hb 濃度增加 ≥ 1.0 g/dL
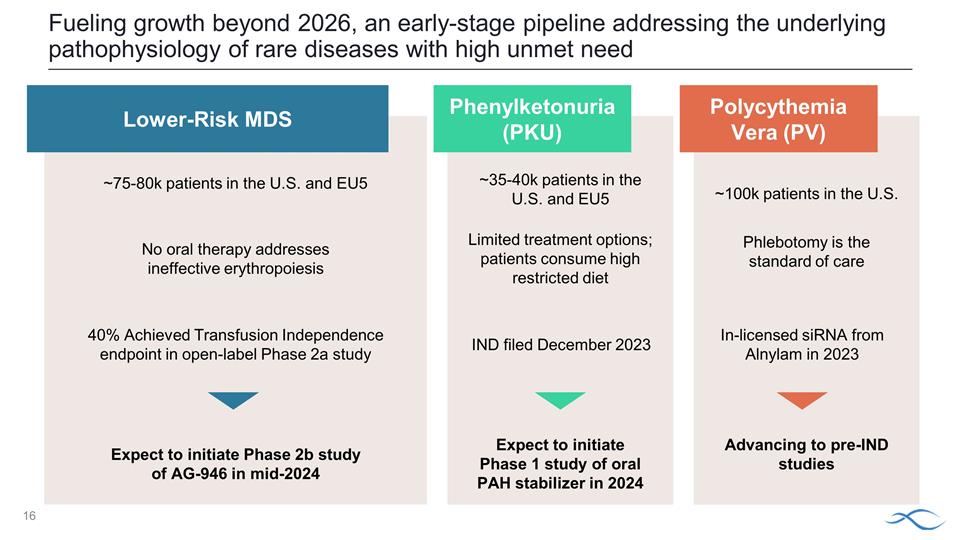
一項 針對需求高未得到滿足的罕見疾病的潛在病理生理學的早期研發項目推動了 2026 年以後的增長。低風險 MDS 40% 在開放標籤 2a 期研究中實現輸血獨立終點預計將於 2024 年中期啟動 AG-946 的 2b 期研究,美國約 75-8 萬名患者,美國大約 10 萬名患者進入獲得許可的 IND 前研究 2023 年來自 Alnylam 的 NA 沒有口服療法可以解決無效的紅細胞生成問題苯丙酮尿症 (PKU) 美國和歐盟五國 約35-4萬名患者預計將啟動2024 年口服多環芳烴穩定劑的 1 期研究 IND 於 2023 年 12 月提交,放血是治療的標準有限的治療選擇;患者嚴格限制飲食
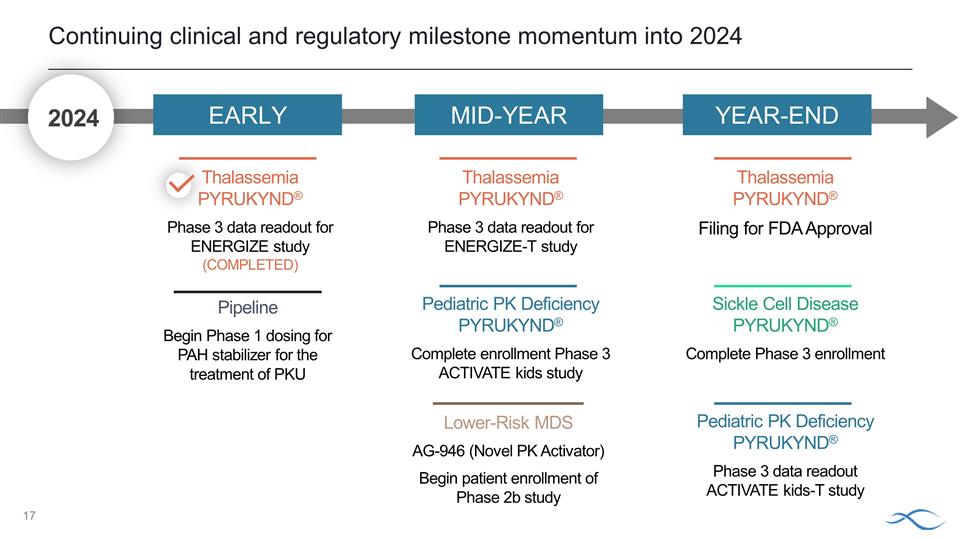
進入2024年的臨牀和監管 里程碑勢頭持續 PYRUKYND® 完成入組 3 期 ACTIVATE 兒童研究低風險 MDS AG-946(新型 PK 激活劑)開始患者入組 2b 期研究管道開始第 1 階段給藥用於治療 PKU 鐮狀細胞病的 PAH 穩定劑 PYRUKYND® 完成第 3 期入組地中海貧血 PYRUKYND® 申請美國食品藥品管理局批准地中海貧血 PYRUKYND® KYND® ENERGIZE-T 研究兒科 PK 缺乏 3 期數據讀取 PYRUKYND® 3 期數據讀出 ACTIVATE Kids-T 研究 2024 年早期年中地中海貧血 PYRUKYND® ENERGIZE 研究第 3 期數據讀取(已完成)
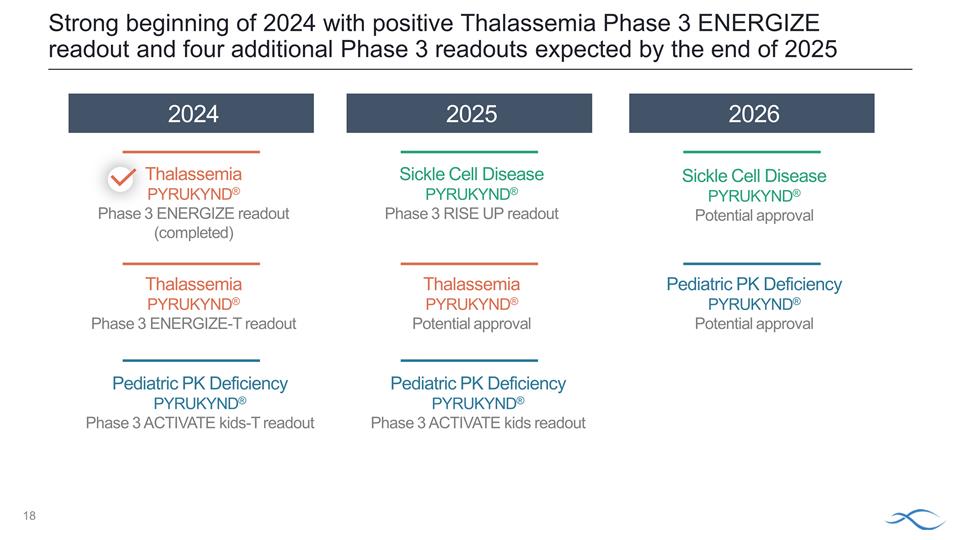
2024 年開局良好, 地中海貧血 3 期 ENERGIZE 讀數為陽性,預計到 2025 年底還會有四份第 3 期讀數 2026 2026 2026 2025 年地中海貧血 PYRUKYND® 第 3 階段 ENERGIZE 讀數(已完成)地中海貧血 PYRUKYND® 第 3 期 ENERGIZE-T 讀數 地中海貧血 PYRUKYND® 第 3 階段 ENERGIZE 讀數 地中海貧血 PYRUKYND® 第 3 階段 ENERGIZE 讀數 地中海貧血 PYRUKYND® 第 3 階段 out 鐮狀細胞病 PYRUKYND® 潛在批准兒科 PK缺乏 PYRUKYND® 可能獲得批准兒科 PK 缺乏 PYRUKYND® 3 期 ACTIVATE KIDS-T 讀數兒科 PK缺乏 PYRUKYND®第 3 階段:激活兒童讀物
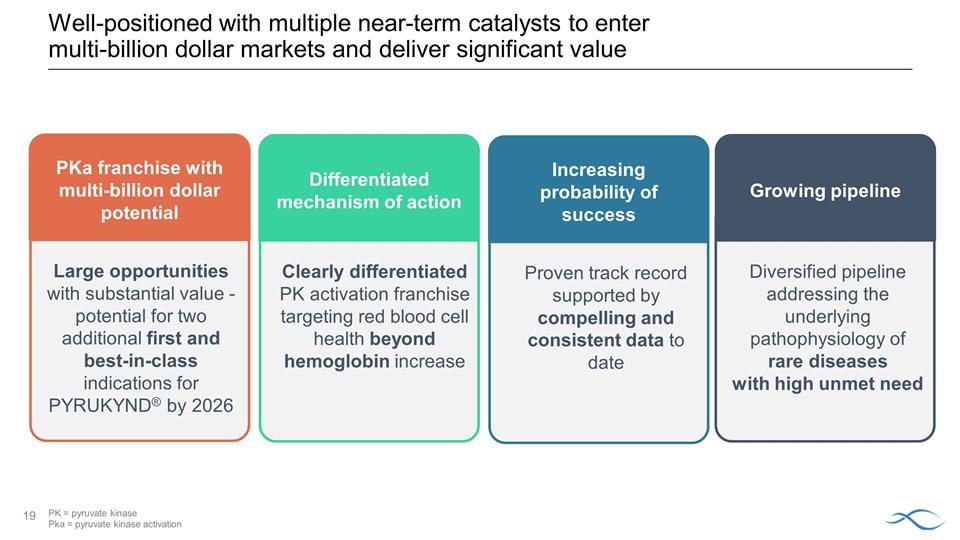
憑藉多種 的短期催化劑處於有利地位,可以進入數十億美元的市場並帶來可觀的價值 PK = 丙酮酸激酶 Pka = 丙酮酸激酶激活成功概率不斷提高迄今為止令人信服且一致的數據支持經過驗證的往績 差異化的行動機制,針對血紅蛋白增加以外的紅細胞健康 pKA 特許經營權具有數十億美元潛力具有巨大價值的大型機會- 兩個的潛力額外的第一名和最佳入圍者到2026年,PYRUKYND® 的類別適應症不斷增長的產品線多元化,可解決需求嚴重的罕見疾病的潛在病理生理學

謝謝

附錄

PYRUKYND®:第一個涵蓋全方位地中海貧血患者的三期計劃 BID = 每日兩次;Hb = 血紅蛋白;HbE = 血紅蛋白 E;hbH = 血紅蛋白 H;PK = 藥代動力學;PD = 藥效學。主要終點平均血紅蛋白比基線 ≥ 1 g/dL 次要 終點疲勞、血紅蛋白其他測量、溶血、患者報告的結局、體育活動、鐵代謝、安全性、PK/PD 24 周核心週期開放標籤延期(最多 5 年)100 mg BID 安慰劑 BID 關鍵納入標準 ≥ 18 年 b-貧血 ± a-globin 突變、Hbe b-地中海貧血或 a-地中海貧血(HbH 疾病)非輸血依賴性定義為在隨機分組前 24 周內 ≤5 個紅細胞單位,且無紅細胞輸血 ≤8 周 Hb ≤ 10.0 g/dL 初級終點在任何 12 周滾動週期內輸血負擔降低 50% 次要終點輸血減少量、安全性、PK/PD 48 周核心週期開放標籤 延期(最長 5 年)100 mg BID 安慰劑 BID N = 240 2:1 隨機分組關鍵納入標準 ≥ 18 年 b-地中海貧血 ± a-globin 突變、HbE b-地中海貧血或 a-地中海貧血(HbH 疾病)輸血依賴性 定義為在隨機分組前 24 周內輸注 6 到 20 個 RBC 單位且無輸血期 ≤6 周 N = 171 2:1 隨機分配
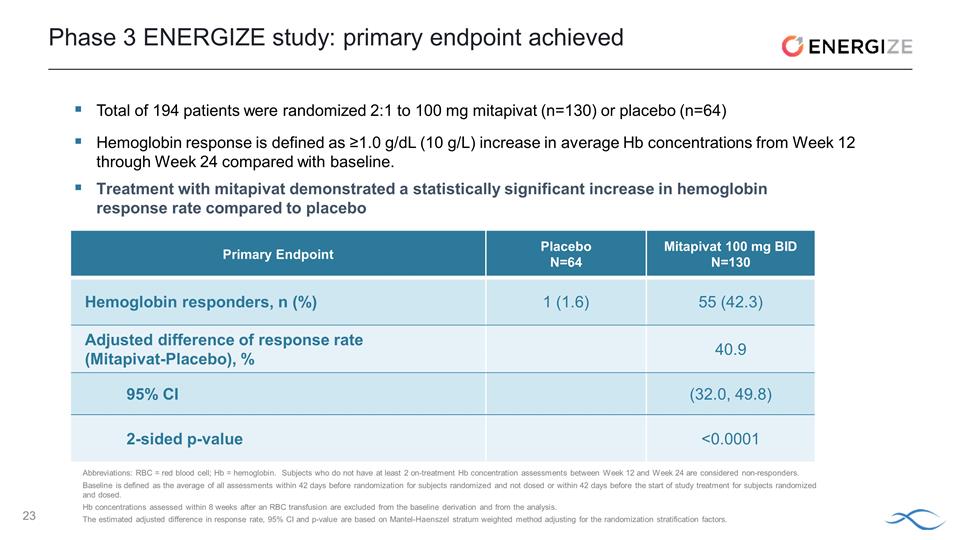
第 3 階段 ENERGIZE 研究:主要終點 達到主要終點安慰劑 N=64 Mitapivat 100 mg BID N=130 血紅蛋白響應者,n (%) 1 (1.6) 55 (42.3) 調整後的緩解率差 (Mitapivat-Placebo),% 40.9 95% 置信區間 (32.0, 49.8) 雙面 p 值

兩個關鍵次要終點也實現了統計學意義 關鍵次要終點:血紅蛋白濃度和Facit-疲勞評分均與基線的變化從基線的變化從第12周到第24周平均血紅蛋白濃度從基線的變化從第12周到第24周使用100 mg mitapivat進行治療的 平均事實疲勞(慢性病療法功能評估——疲勞)亞量表分數與基線相比變化 100 mg mitapivat 治療顯示兩個關鍵次要終點都有統計學上的顯著改善與 安慰劑相比,總體安全性,發病率mitapivat和安慰劑組的不良反應相似。在為期24周的雙盲期內,mitapivat組的4名(3.1%)受試者出現了導致停藥的不良事件(AE); 安慰劑組中沒有導致停藥的不良事件
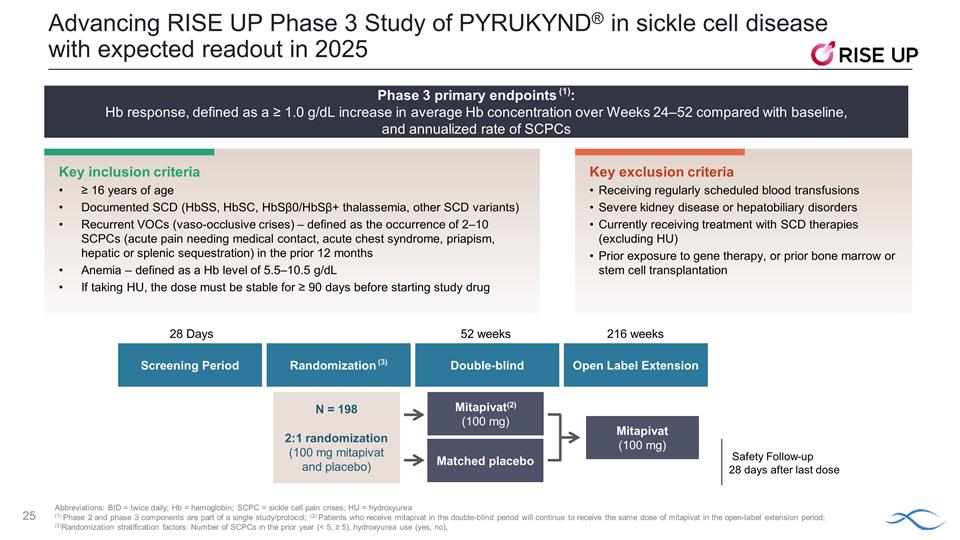
推進鐮狀細胞病中 PYRUKYND® 的 RISE UP 三期研究,預計在 2025 年公佈關鍵納入標準 ≥ 16 歲有記錄的 SCD(HBSs、HbsC、Hbs0/Hbsβ+ 地中海貧血、其他 SCD 變體)複發性揮發性有機化合物(血管閉塞危機)— 定義為 2—10 例短鏈氯化合物的發生(需要醫療接觸的急性疼痛,過去 12 個月的急性胸部綜合徵、陰莖異常勃起、肝臟或脾臟封存(貧血)——定義為 Hb 水平為 5.5—10.5 g/dL 如果服用 HU, 劑量在開始研究藥物前必須穩定 ≥ 90 天(關鍵排除)標準定期接受輸血嚴重腎臟疾病或肝膽疾病目前正在接受SCD療法(不包括 HU)的治療之前接受過基因療法,或之前的骨髓或幹細胞移植縮寫:BID = 每日兩次;Hb = 血紅蛋白;SCPC = 鐮狀細胞疼痛危象;HU = 羥基脲類(1)第 2 期和 3 期成分是單個 成分的一部分研究/方案;(2)在雙盲期接受mitapivat治療的患者將繼續在開放標籤中接受相同劑量的米塔皮瓦特延長期;(3) 隨機分層因素:上一年度的短鏈氯化石蠟數量 (
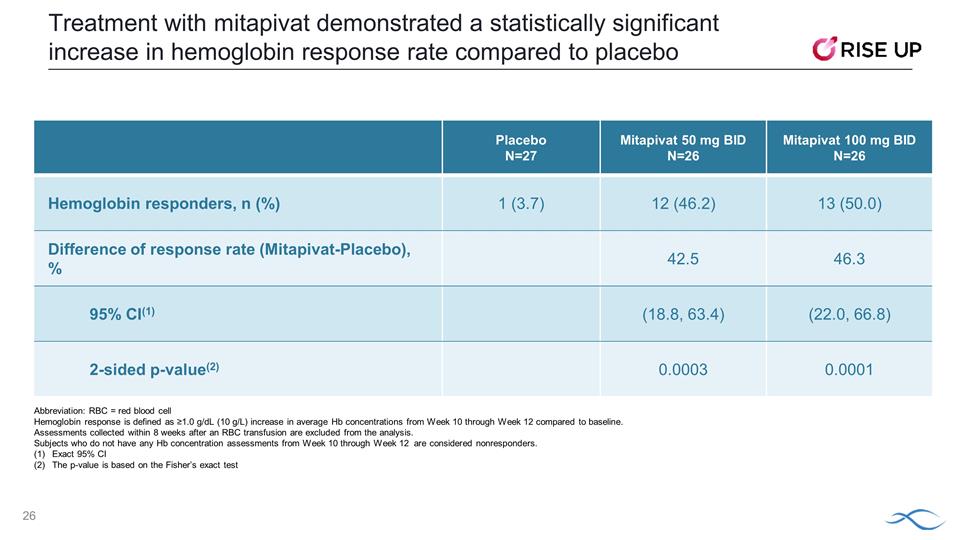
與安慰劑相比,使用mitapivat 治療顯示血紅蛋白反應率在統計學上顯著提高 N=27 Mitapivat 50 mg BID N=26 MITAPIVAT 100 mg BID N=26 血紅蛋白反應者,n (%) 1 (3.7) 12 (46.2) 13 (50.0) 差異 (Mitapivat-Placebo),% 42.5 46.3 95% 置信區間 (1) (18.8, 63.4) (22.0, 66.8) 雙面 p 值 (2) 0.0003 0.0001 縮寫:RBC = 紅細胞血紅蛋白反應定義為從第 10 周到第 12 周平均血紅蛋白濃度與基線相比增加 ≥1.0 g/dL (10 g/L)。在紅細胞輸血後 8 周內收集的評估不包括在分析中。從第 10 周到第 12 周沒有進行任何 Hb 濃度評估的受試者被視為無反應者。 精確 95% 置信區間 p 值基於費舍爾的精確檢驗
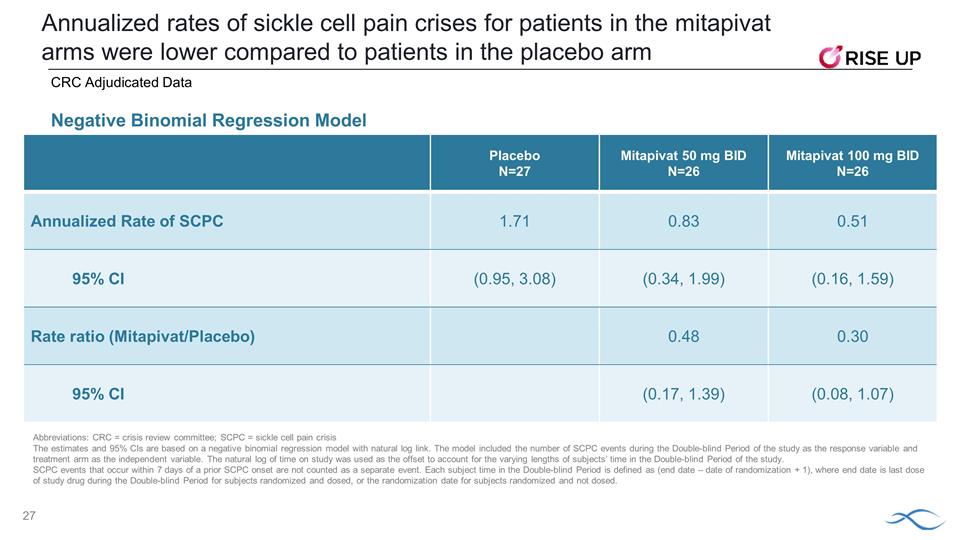
安慰劑 N=27 Mitapivat 50 mg BID N=26 Mitapivat 100 mg BID N=26 SCPC 年化率 1.71 0.83 0.51 95% 置信區間 (0.95, 3.08) (0.34, 1.99) (0.16, 1.59) (0.16, 1.59) 利率比率 (Mitapivat/安慰劑) 0.48 0.30 95% 置信區間 (0.17, 1.39) (0.08, 1.07) 與安慰劑組的患者相比, mitapivat 組患者的鐮狀細胞疼痛危機發生率較低負二項式迴歸模型 CRC 裁定數據縮寫:CRC = 危機審查委員會;SCPC = 鐮狀細胞疼痛危機估計值和 95% CI 基於 負二項迴歸模型使用自然日誌鏈接。該模型將研究雙盲期間的SCPC事件數量作為響應變量,將治療組作為自變量。 研究的自然時間對數被用作抵消量,以解釋研究雙盲期受試者時間長短的不同。在先前 SCPC 發病後 7 天內發生的 SCPC 事件不算作單獨事件。 雙盲期內的每個受試者時間定義為(結束日期 — 隨機化日期 + 1),其中,結束日期是隨機分配和給藥的受試者在雙盲期內最後一劑研究藥物,或隨機分配而不是 劑量的受試者的隨機分組日期。
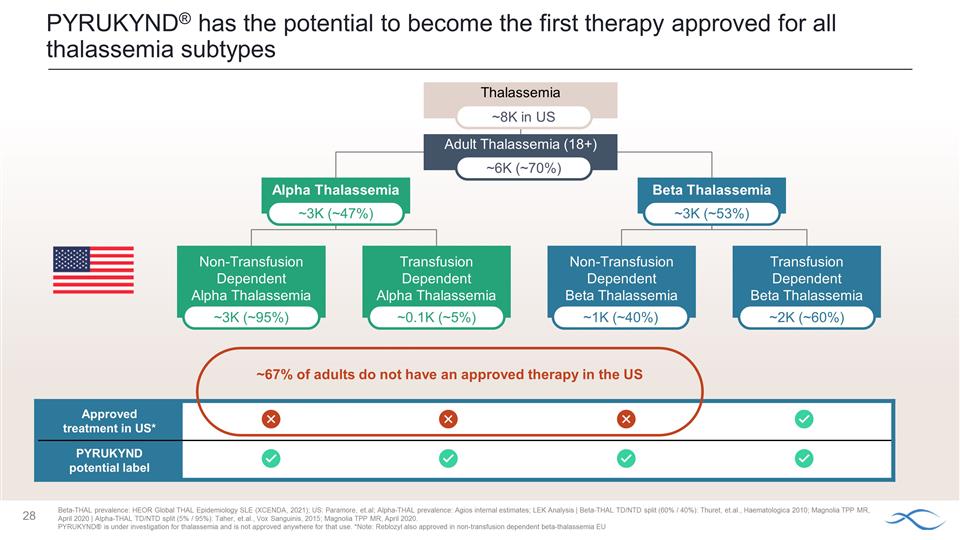
地中海貧血 PYRUKYND® 有潛力成為第一種獲準用於所有地中海貧血亞型的療法美國批准的治療方法* PYRUKYND 潛在標籤 α地中海貧血非輸血 依賴性 α地中海貧血依賴性 α地中海貧血輸液依賴性 β地中海貧血依賴性 β地中海貧血 ~3K (~ 95%) ~0.1K (~ 5%) ~1K(約 40%)~2K(約 60%)β-Thal 患病率:HEOR 全球 THAL 流行病學 SLE(XCENDA,2021 年);美國:帕拉莫爾等;α-THAL 流行率:Agios 內部估計;LEK 分析 | beta-thal TD/NTD 拆分(60%/40%):Thuret 等人,Haematologica 2010;Magnolia TPP MR,2020 年 4 月 | Alpha-thal TD/NTD 拆分(5%/95%):Taher, 等,Vox Sanguinis,2015 年;Magnolia TPP MR,2020 年 4 月。PYRUKYND® 正在接受地中海貧血的研究,任何地方都未獲批准用於該用途。*注意:Reblozyl 還批准用於非輸血依賴性 β-地中海貧血歐盟成人 地中海貧血 (18+) ~3K (~ 47%) ~3K (~ 53%) ~6K (~ 53%) ~6K (~ 70%) ~8K 在美國約有 67% 的成年人沒有批准的療法