

附錄 99.1 和 42 年度摩根大通醫療保健會議 JA NUA RY 9, 2 02 4

安全港聲明本演示文稿包含前瞻性 陳述。Crinetics Pharmaceutics, Inc.(“Crinetics”、“公司”、“我們” 或 “我們的”)提醒您,本演示文稿中有關非歷史事實事項的陳述是 前瞻性陳述。這些陳述基於公司當前的信念和期望。此類前瞻性陳述包括但不限於以下方面的陳述:帕替索汀對 肢端肥大症患者和類癌綜合徵患者的潛在益處;PATHFNDR 計劃支持所有需要藥物治療的肢端肥大症患者註冊帕替索汀的可能性; 帕圖索汀和 CRN04894 的臨牀開發計劃和時間表,包括治療潛力和臨牀益處或安全性其中;頭條數據的預期時間以及 PATHFNDR-2 研究的完整結果以及針對類癌綜合徵患者的二期研究 ,並與美國食品藥品管理局分享結果,以協調和設計第三階段計劃;提交用於治療肢端肥大症的帕圖索汀新藥申請和相關的開放標籤擴展研究的預期時間以及潛在的 監管機構批准;CRN04894 對庫欣氏病或先天性腎上腺增生症患者的潛在益處以及預期的計劃和計劃獲取正在進行的臨牀研究數據的時機;PTH 受體 拮抗劑的潛在益處甲狀旁腺功能亢進患者、促甲狀旁腺激素拮抗劑對格雷夫斯病或甲狀腺眼病的潛在益處;我們正在進行的任何臨牀研究顯示出安全性或有效性的可能性;我們 正在進行的發現工作有可能瞄準多囊腎病或糖尿病/肥胖的未來適應症,以及此類候選藥物選擇和臨牀開發的預期計劃和時機;我們識別和創建新候選藥物的計劃 其他疾病的候選藥物;以及我們的預期計劃和時機尚待監管部門批准的帕圖索汀和其他候選產品的商業化,包括處方者、市場研究、付款人 參與和分銷渠道方面的工作。在某些情況下,你可以通過諸如 “可能”、“相信”、“預期”、“可能”、“應該”、“估計”、 “期望”、“打算”、“計劃”、“項目”、“將”、“考慮”、“繼續”、“預測”、“奠定基礎”、“導致”、“目標” 等術語來識別前瞻性陳述 “潛力”、“抱負”、“目標” 或否定詞和其他類似用語。這些陳述僅代表截至本演講之日,涉及已知和 未知的風險、不確定性、假設和其他重要因素,這些因素可能導致我們的實際業績、業績或成就與 前瞻性陳述所表達或暗示的任何未來業績、業績或成就存在重大差異,包括但不限於:在對與臨牀研究和此類數據相關的數據進行更全面的審查後,我們報告的標題和初始數據可能會發生變化可能無法準確反映完成臨牀研究的 結果,FDA 和其他監管機構可能不同意我們對此類結果的解釋;臨牀前研究或臨牀研究的初步結果不一定能預測最終結果的風險 ,隨着患者入組的繼續、對數據進行更全面的審查之後,以及隨着更多患者數據的出現,一項或多項臨牀結果可能發生重大變化;可能出現不利的新臨牀數據以及 對現有臨牀數據的分析;潛力延遲開始、註冊和完成臨牀研究以及相關數據的報告;美國食品和藥物管理局或其他監管機構可能要求對 paltusotine進行額外的臨牀研究,或者建議在批准新藥申請或適用的外國監管批准之前修改我們計劃的3期臨牀研究;國際衝突可能會干擾我們的業務以及我們所依賴的 第三方的業務,包括延遲或以其他方式幹擾我們的業務臨牀研究和臨牀前研究,製造業和供應鏈,或降低員工工作效率;我們在產品 製造、研究、臨牀前和臨牀測試方面對第三方的依賴;我們對帕圖索汀、CRN04894 的臨牀研究、非臨牀研究和臨牀前研究的成功;我們在甲狀旁腺功能亢進、多囊腎、格雷夫斯 病和甲狀腺眼病或糖尿病/肥胖候選產品方面的發現工作;監管或價格的發展美國和國外的限制;意想不到的不良副作用或我們的候選產品的功效不足, 可能會限制其開發、監管批准和/或商業化;我們為候選產品獲得和維持知識產權保護的能力;我們可能比預期的更快地使用我們的資本資源;以及我們不時向美國證券交易委員會(“SEC”)提交的文件中 “風險因素” 標題下描述的其他風險 。由於前瞻性陳述本質上受風險和不確定性的影響,其中一些 無法預測或量化,有些是我們無法控制的,因此您不應依賴這些前瞻性陳述作為對未來事件的預測。我們的前瞻性陳述 中反映的事件和情況可能無法實現或發生,實際結果可能與前瞻性陳述中的預測存在重大差異。所有前瞻性陳述均受本警示聲明的全部限定,該聲明是根據1995年《私人證券訴訟改革法》的安全 港條款作出的,除非適用法律要求,否則我們不計劃公開更新或修改此處包含的任何前瞻性陳述,無論是由於任何新的 信息、未來事件、情況變化還是其他原因。本演示文稿還包含獨立方和我們提供的與可尋址患者和潛在市場規模和增長相關的估計和其他統計數據,以及 有關我們行業的其他數據。這些數據涉及許多假設和侷限性,提醒您不要過分重視此類估計。此外,對我們未來表現的預測、假設和估計以及我們經營所在市場的未來表現必然受到高度的不確定性和風險的影響。2 2

制定以內分泌為重點的首屈一指的全整合製藥公司 公司戰略方針以實現長期價值增長 3

2023 年 Paltusotine 的肢端肥大症 3 期陽性結果為 Paltusotine 類癌綜合徵的 2 期陽性結果奠定了 基礎 2024-2025 年第二期 3 期研究已完成註冊肢端肥大症啟動了第二項臨牀資產 (CRN04894) 3.5 億美元 股票發行 4 4

Crinetics Way:內分泌促進健康內分泌學的深層根基 精心打造的變革承諾 = 人們的生活藥物世界一流的內部研發帕圖索汀是目前正在臨牀研究中的在研候選藥物 5 |

研發變革性候選藥物的深度渠道臨牀前 第 1 期第 2 階段 3 期計劃預期里程碑肢端肥大症 (PATHFNDR-1) NDA 提交 (2H24) 肢端肥大症 (PATHFNDR-2) Paltusotine (SST2 激動劑) 主要結果 (24 年第 1 季度) 完整的 2 期數據發佈 (1H24) 類癌綜合徵庫欣的 疾病第 2 期數據 (1H24) CRN04894 (ACH) TH 拮抗劑) 2 期數據 (1H24) 先天性腎上腺增生甲狀旁腺功能亢進候選人選擇 (1H24) PTH 拮抗劑候選選擇 (1H24) 多囊腎病 SST3 激動劑(探索 全球夥伴關係) 擴展到高度流行的適應症格雷夫斯病和 TED 候選藥物選擇 (2024) 促甲狀腺激素拮抗劑糖尿病/肥胖口服 GLP-1 非肽候選藥物精選 (2025) 口服 GIP 非肽糖尿病/肥胖 SST: 生長抑素受體類型;ACTH:促腎上腺皮質激素;PTH:甲狀旁腺激素;TSH:甲狀腺刺激素;6 6 | TED:促甲狀腺激素眼部疾病;GLP-1:胰高血糖素樣肽 1 受體激動劑;GIP:胃抑制性多肽

世界一流的開發導致全球商業化 Paltusotine: 肢端肥大症和類癌綜合徵的主要臨牀資產 PATHFNDR-1 類癌綜合徵 3 期結果 2 期結果 7

Paltusotine:旨在讓肢端肥大症和類癌 綜合徵患者專注於可靠、不良的帕替蘇汀*護理的當前標準益處,症狀和持久控制控制 77% 報告沒有注射,VS 部位反應耐受良好 每日一次,口服片劑不方便的治療選擇 *等待帕圖索汀獲得監管部門的批准。支持監管部門批准申請的臨牀研究正在進行中。參考文獻 1.Geer EB、Sisco J、Adelman DT 等患者 報告了在常規臨牀實踐中接受可注射的生長抑素受體配體 (SRL) 治療的肢端肥大症患者的預後數據。BMC Endocr Disord. 2020;20 (1): 117. doi: 10.1186/s12902-020-00595-4;2.Strasburger CJ、Karavitaki N、 Störmann S 等人。8 位患者報告的195名肢端肥大症患者腸外生長抑素類似物注射的療效。Eur J Endocrinol。2016;174 (3): 355-62。doi: 10.1530/eje-15-1042;3.Fleseriu 等人《內分泌學前沿》;2021 年 3 月,第 12 卷

肢端肥大症第 3 階段的積極結果為 2025 年首次 商業發射*奠定了堅實的基礎 100% 83% (25/30) p
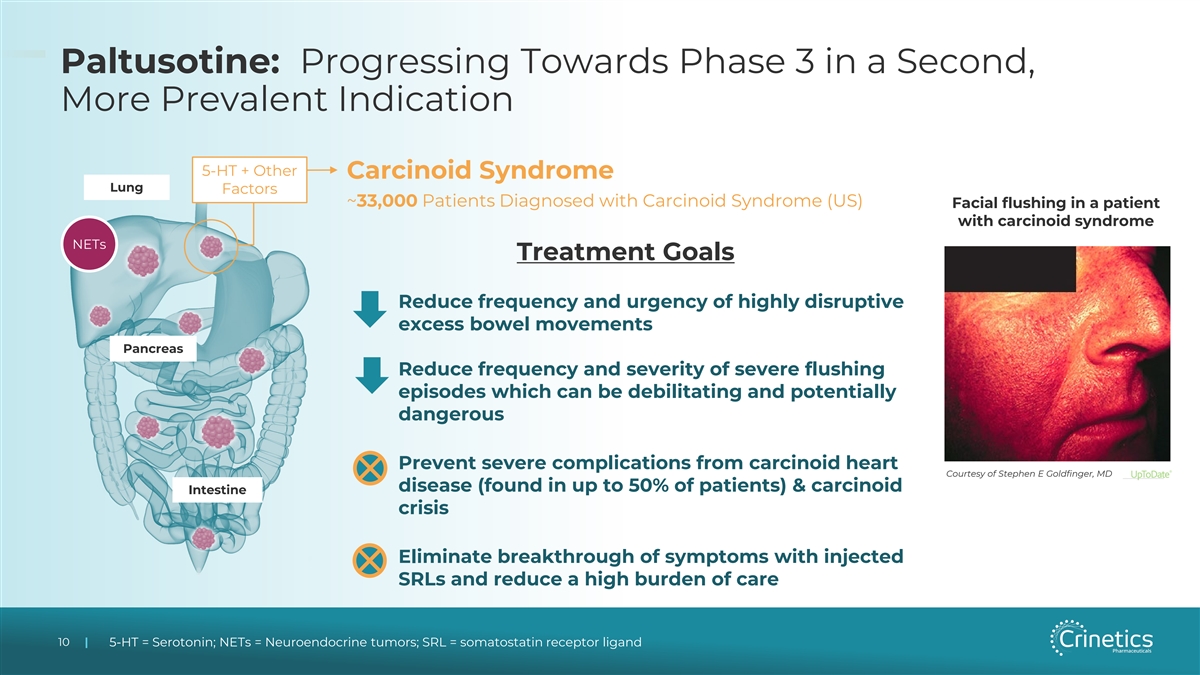
Paltusotine:第二個更普遍的 適應症 5-HT + 其他類癌綜合徵肺因子 ~33,000 名被診斷為類癌綜合徵的患者(美國)類癌綜合徵患者面部潮紅 NET 治療目標 1。降低高破壞性 過度排便的頻率和緊迫性 Pancreas 2.降低嚴重潮紅髮作的頻率和嚴重程度,這可能會使人衰弱並具有潛在危險 3.預防類癌心臟的嚴重併發症由醫學博士 Stephen E Goldfinger 提供(在多達 到 50% 的患者中發現)和類癌腸危機 4.注射 SRL 可消除症狀突破並減輕高額護理負擔 10 10 | 5-HT = 血清素;NET = 神經內分泌腫瘤;SRL = 生長抑素受體配體

類癌綜合徵研究參與者示例:消除潮紅 和體重正常化 10 9 8 帕圖索汀 80 mg/天 7 過量 BM 6 >3/d bmS 沖洗 5 4 3 No Prior 2 正常 BM 療法 3/d 至 3/w 1 0 -1 -30 -20 -10 0 10 20 30 40 50 60 研究日 11 BM = 排便頻率(每天)

Paltusotine 降低了兩種關鍵類癌綜合徵核心症狀的發生頻率 症狀:BM 過多和潮紅沖洗頻率過度排便* 基線 ≥1 天的患者的頻率 3.0 p 3/day 的患者,每日頻率(7d 平均值)每日頻率(7d 平均值)

Paltusotine: 肢端肥大症和類癌綜合徵的初始美國市場機遇為數十億美元肢端肥大症類癌綜合徵診斷患病率 27,000 33,000 名可尋患者 11,000 33,000 名未經手術治癒的 SRL 現有患者 10,000 名內分泌療法* 年均加息量** 7萬美元注射劑1萬美元當前市場7億美元用於內分泌治療(美國)內分泌療法的潛在市場總額為8億美元33億美元(美國)*內分泌療法包括SRL、多巴胺激動劑和生長激素 拮抗劑。13 **WAC:批發收購成本;來源:公司存檔數據

機密為帕圖索汀的多種 適應症奠定商業成功基礎地圖市場研究 • 200 個 HCP 啟動了 80% 的 • 營銷集團的骨幹肢端肥大症腳本已經到位 • 兩者有 40 個重疊中心 • 市場研究表明 垂體和 NCCN 的護理負擔是關鍵 • 擁有頂級處方者的廣告板克服慣性 • 擴大醫療事務團隊 • 引人注目的 PATHFNDR-1 數據正在增強分銷渠道付款人的認識參與 • 最終確定的第三方物流供應商合同醫療補助Medicare B 部分 • 談判專業藥房網絡合同 9.8% • 市場準入團隊的骨幹 1.1% • 建立 Crinetics 的提供商和患者服務中心 。• 聘請了 50% 的美國主要付款人 • 付款人對口服約 50 名首選期權付款人的價值品牌服務中心第三方專業醫療保健商業醫療保險 D 部分藥房從業人員 30.9% 57.9% 患者 NCCN: 全國綜合癌症網絡 14 來源:動力學訪談和市場研究

世界一流的發現將擴大臨牀管道世界一流的 發現將擴大臨牀管道遵循 Crinetics 開發藥物以幫助越來越多的人羣的方法 15

CRN04894:後期開發中的第二項臨牀資產巧妙 精心打造,旨在幫助患者實現治療目標壓力下丘腦主要適應症:先天性腎上腺增生 (CAH) 晝夜節律約27,000名患者流行/確診為經典 CAH(美國)CRF CRF 時鐘 AVP AVP 治療目標: 糖皮質激素 1.正常化/消除腎上腺雄激素的產生垂體 CRF 2.恢復女性的正常月經週期和生育能力 ✓ 拮抗劑 3.縮小睾丸腎上腺休息腫瘤,緩解疼痛,恢復 男性 CRN04894(ACTH 拮抗劑)4 的生育能力。✓預防兒童雄激素過多的後果:ACTH 非典型生殖器、性早熟、身材矮小、多毛症 5.避免糖皮質激素過多的併發症(體重增加、A4 高血壓、骨骼 疾病...),並啟用生理學的 17-OHP 腎上腺置換水平 AVP:精氨酸加壓素,CRF:促腎上腺皮質激素釋放因子;A4:雄烯二酮;16 | 17-OHP:17-羥孕酮,ACTH:促腎上腺皮質激素釋放因子;A4:雄烯二酮;16 | 17-OHP:17-羥孕酮,ACTH:促腎上腺皮質激素

CRN04894:旨在提供最大的 A4 抑制效果的瞄準機制。初步數據預計 24 年第二季度 A4 抑制和類固醇保留對不同作用機制的預期 700 服用糖皮質激素 600 平均 CRF 500 依賴性 A4 預期促腎上腺皮質激素 400 患者氣相色譜劑量減少取決於 GC + CRF A4 拮抗劑* 300 200 CRN04894 100(目標概況)正常範圍 0 0 5 10 15 20 2 GC 劑量(氫化可的鬆當量)(mg/m/天)17 | CRF:促腎上腺皮質激素釋放因子;GC:糖皮質激素;A4:雄烯二酮 17 | 機密 雄烯二酮水平 (A4) (ng/dL)

兩項新項目預計將於2024年開始首次人體授權研究 甲狀旁腺功能亢進的甲狀旁腺功能亢進的促甲狀旁腺激素拮抗劑和TED*車輛載體或/或拮抗劑拮抗劑 PO PO 2.0 1.8 載體 3 mg/kg 拮抗劑 M22 載體激動劑 10 mg/kg 拮抗劑 抗體 1.6 10 mg/kg 拮抗劑 30 mg/kg 抗體激動劑 30 mg/kg 拮抗劑 1.4 PTH 輸液 1.2 連續 SC 10 μg/kg/天 PTH (1-34) 0 -24 -12 0 12 24 36 48 60 時間 (h) 潛在主要候選藥物的臨牀前療效數據臨牀前療效 數據對於潛在候選人 18 18 | PTH:甲狀旁腺激素;TSH:甲狀腺刺激激素;TED:甲狀腺眼病電離鈣(mmol/L)

打造一家專注於內分泌的頂級全整合製藥公司 • 上半年開始 CAH 第 3 階段 • 2H Paltusotine 肢端肥大症 ** ** PDUFA 並上市 • 來自新藥的人類 POC • 2H 提交肢端肥大症新藥候選藥物 • 第二季度初始階段數據 • 新候選藥物在 CAH 中進入讀數,以及 • 2026 年其他多個-開發(肥胖)** Cushings 2030 商業發佈 • 2H Start Caricoid • 產品收入 * Syndrome 3 期銷售以支持增長 • 新候選藥物問世 • 持續開發(PTH、TSH)臨牀催化劑2025 • 從發現到開發的新資產到2024年的長期價值增長戰略方針 * 有待與 FDA 19 保持一致 ** 待提交保密協議和 監管部門批准

謝謝