
INF904:第一階段 MAD 研究的頭條結果,2024 年 1 月 4 日

重要聲明和免責聲明本演示文稿由InflarX
N.V.(“InflarX” 或 “公司”)編寫。本演示僅供參考,不構成賣出要約或購買證券要約的邀請。
購買或出售任何證券時不得依賴本演示文稿,也不得解釋為投資建議。前瞻性陳述本演示文稿包含前瞻性陳述。除歷史事實陳述以外的所有陳述均為
前瞻性陳述,通常用 “可能”、“將”、“應該”、“期望”、“計劃”、“預期”、“可能”、“打算”、“目標”、“項目”、“估計”、“預測”、“潛在” 或 “繼續” 等術語來表示。
前瞻性陳述出現在本新聞稿的多個地方,可能包括有關我們的意圖、信念、預測、展望、分析和當前預期的陳述,除其他外,涉及 COVID-19 患者和美國醫院對戈希比奇(維洛貝利單抗)作為 COVID-19 治療藥物的接受程度以及醫療/保健機構和其他第三方組織的相關治療建議、我們成功商業化的能力以及 Gobic 的接受程度 Hibic(維洛貝利單抗)作為治療方法COVID-19 患者和美國醫院或我們的其他候選產品的 COVID-19;我們對患者羣體規模、市場
機會、承保範圍和報銷、預計回報和應計回報以及其批准或授權適應症或維洛貝利單抗和任何其他候選產品的臨牀用途的預期,在
緊急使用授權下以及未來獲準商業用途後美國或其他地方;我們未來臨牀試驗的成功vilobelimab 對 COVID-19 和其他使人衰弱或危及生命的
炎症適應症(包括壞疽性膿皮病)和任何其他候選產品(包括 INF904)的治療,以及此類臨牀結果是否會反映先前進行的臨牀前研究和臨牀試驗的結果;
候選產品的臨牀前研究和臨牀試驗的時機、進展和結果,以及關於啟動和完成研究或試驗及相關試驗時機的聲明準備工作,在此期間
試驗結果將公佈,此類試驗的費用和我們的總體研發計劃;我們與監管機構就臨牀試驗結果和潛在的監管批准途徑進行的互動,
包括我們提交的維洛貝利單抗上市許可申請和我們提交的Gohibic(維洛貝利單抗)生物製劑許可申請,以及我們獲得和維持維洛貝利單抗全面監管批准的能力
或戈希比奇(維洛貝利單抗)以獲取任何適應症;無論是美國食品和藥物管理局、歐洲藥品管理局或任何類似的外國監管機構將接受或同意我們臨牀試驗的數量、設計、規模、進行或
實施,包括此類試驗的任何擬議主要或次要終點;我們對維洛貝利單抗任何批准適應症範圍的期望;我們利用專有的抗C5a
和 C5ar 技術來發現和開發治療補體介導的自身免疫療法的能力;以及炎症性疾病;我們保護、維持和對維洛貝利單抗和任何其他候選產品
及其保護範圍實施知識產權保護;我們的製造能力和戰略,包括製造方法和工藝的可擴展性和成本以及製造方法和工藝的優化,以及我們
繼續依賴現有第三方製造商的能力,以及我們聘請更多第三方製造商參與我們計劃的未來臨牀試驗和維洛貝利單抗商業供應的能力完成的產品
Gohibic(vilobelimab);我們對支出、持續損失、未來收入、資本要求以及我們獲得額外融資的需求或能力的估計;我們對候選產品在臨牀測試
或任何商業銷售獲得批准後提出的責任索賠進行辯護的能力;如果我們的任何候選產品獲得監管部門的批准,我們遵守和履行持續義務的能力以及持續的監管概述;我們的
在尋求時遵守已頒佈和未來立法的能力上市批准和商業化;我們未來的增長和競爭能力,這取決於我們留住關鍵人員和招聘更多合格人員;
和我們的競爭地位以及與競爭對手在開發C5a和C5ar抑制劑或我們的行業相關的發展和預測;以及我們向美國證券交易委員會提交的定期文件中 “風險
因素” 標題下描述的風險、不確定性和其他因素。這些陳述僅代表截至本演講之日,涉及已知和未知的風險、不確定性和其他重要因素,這些因素可能導致
我們的實際業績、業績或成就與前瞻性陳述所表達或暗示的任何未來業績、業績或成就存在重大差異。鑑於這些風險、不確定性和其他因素,您
不應過分依賴這些前瞻性陳述,除非法律要求,否則即使將來有新的信息,我們也沒有義務更新這些前瞻性陳述。

重要聲明和免責聲明信息和來源本演示文稿中包含的某些信息
涉及或基於從第三方來源獲得的研究、出版物、調查和其他數據以及InflarX自己的內部估計和研究。儘管InflarX認為截至本演示之日,這些第三方來源
是可靠的,但它尚未獨立核實,也沒有對從第三方來源獲得的任何信息的充分性、公平性、準確性或完整性做出任何陳述。此外,本演示文稿中包含的所有
市場數據都涉及許多假設和侷限性,無法保證此類假設的準確性或可靠性。此外,儘管我們認為我們自己的內部研究是可靠的,但此類研究尚未得到任何獨立來源的證實。Avacopan 數據我們尚未在臨牀試驗中對 Avacopan 與 INF904 進行正面比較,但已將 Avacopan 公佈的數據與
我們 INF904 一期臨牀試驗的數據進行了比較。為了進行臨牀前研究(倉鼠中性粒細胞減少症研究),我們合成了Avacopan並進行了並排比較。雖然我們認為這種與 Avacopan 的比較很有用且
是恰當的,但本演示文稿中這種比較以及與 Avacopan 的其他比較的價值可能有限,因為它們不是來自正面交鋒試驗,而是來自根據不同協議在不同的
地點和不同時間進行的試驗。如果沒有正面交鋒的數據,我們無法對 INF904 和 Avacopan 做出比較主張。關於InflarX InflarX GmbH(德國)和InflarX Pharmicals Inc.(美國)是
InflarX N.V.(合稱 “InflarX”)的全資子公司。InflarX(納斯達克股票代碼:IFRX)是一家生物技術公司,通過應用其專有的抗C5a和抗C5ar技術來發現、開發和商業化補體激活因子C5a及其受體C5ar的同類首創、強效和特異性抑制劑。C5a 是一種強大的炎症介質,參與各種炎症性疾病的進展。InflarX 的主要候選產品 vilobelimab 是一種新型的、靜脈注射的、同類首創的抗 C5a 單克隆抗體,可選擇性地與遊離 C5a 結合,並在不同適應症的多項
臨牀研究中顯示出改善疾病的臨牀活性和耐受性。InflarX成立於2007年,該集團在德國耶拿和慕尼黑以及美國密歇根州安娜堡設有辦事處和子公司。欲瞭解更多信息,請訪問 www.inflarx.com。

演講嘉賓第4頁郭仁峯教授,首席科學官,創始人,
InflarX 教授尼爾斯·裏德曼教授,醫學博士,首席執行官、創始人、InflarX 創始人託馬斯·塔普肯博士首席財務官 InflarX Camilla Chong,醫學博士 InflarX 演講嘉賓問答

INF904:第一階段多劑量遞增劑量 (MAD) 的主要結果第
5 AGENDA 安全結果 pk 成果 pk 結果 pd 結果研究設計背景和臨牀前工作摘要

INF904:第一階段多劑量遞增劑量 (MAD) 的主要結果
6 AGENDA 安全結果 pk 成果 pk 結果 pd 結果研究設計背景和臨牀前工作摘要

補體系統和 C5a 激活頁面
7 經典凝集素替代補體途徑膜攻擊複合物 (MAC) 觸發病原體裂解抗體結合甘露糖結合外來表面 C3 激活 C5b-9 =
MAC c5-轉化酶 c5b 終端互補激活 C5 Arg751/ Leu752 外在途徑是裂解 C55 的另一種途徑來自 C5 的 a---C5a 主要通過 C5ar 外在
“路徑” 酶學 C5 裂解炎症 c5ar C5L2 c5a = 強效過敏毒素 C5 凝血酶起作用,胰蛋白酶、彈性蛋白酶等。剪刀結合其他配體:C3a、ASP、C4a 等 Vilobelimab INF904 X X

第 8 頁 C5ar 是一種在粒細胞和
上高度表達的 G 蛋白偶聯受體,介導 C5a 的主要病理生理作用。在急性和慢性環境中的許多臨牀前疾病模型以及臨牀研究中,阻斷C5ar顯示出強大的抗炎作用。C5ar
拮抗劑有望成為各種炎症性疾病的獨立治療或輔助療法。只有一種上市的候選藥物,其PK/PD概況有待改進,根據I期臨牀
試驗的公佈數據 a. c5ar:一個有前途的藥物靶標 Abekker 等人。2016,PLOS ONE 11 (10):E0164646 c5ar 在臨牀前和臨牀研發中的作用 c5ar 是
炎症免疫皮膚病學腎臟/血管炎呼吸神經病學的有效藥物靶標及相關風濕病學及相關 CVS 和急性損傷其他
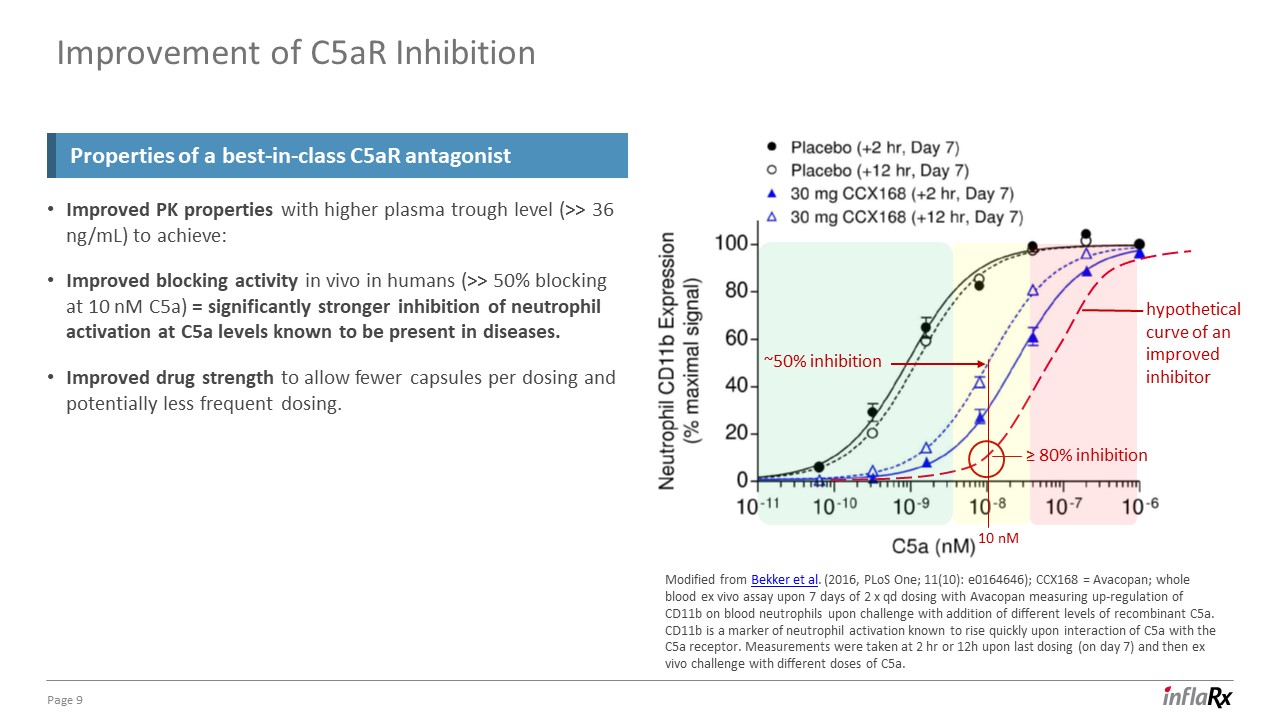
第 9 頁通過提高血漿槽水平(>> 36 ng/mL)來改善 PK 特性:改善人體體內阻斷活性(在 10 nM C5a 時阻斷 >50%)= 在已知疾病中存在的 C5a 水平下,對中性粒細胞激活的抑制力明顯增強。藥物強度提高到
可以減少每次給藥的膠囊,並可能降低給藥頻率。一流的 C5AR 拮抗劑的抑制特性改自 Bekker 等人(2016 年,pLoS One;11 (10):e0164646);CCX168 = Avacopan;使用 AvacoPan;使用 AvacoPan;在 7 天內進行全血 ex
活體試驗 Opan 通過添加不同水平的重組 C5a 來測量血液中性粒細胞上 CD11b 的上調情況。CD11b 是中性粒細胞激活的標誌物,已知在 C5a 與 C5a 受體相互作用時會迅速升高
。測量是在最後一次給藥(第 7 天)後的 2 小時或 12 小時進行的,然後使用不同劑量的 C5a 進行體外試驗。抑制劑改良的假設曲線改善 C5ar
抑制力約為 50%

INF904:臨牀前摘要 INF904 與
C5ar 中明確定義的變構位點結合。INF904 具有新穎的分子結構。美國專利於2021年10月頒發;其他特定國家(PCT)的專利處於全國階段。INF904 事實第 10 頁臨牀前發現即使在最高劑量
組(大鼠和猴子;最高 300 mg/kg)中也沒有明顯的毒性發現。體外效力高,符合所需的 IC50 (

第 11 頁 INF904 SAD 和 MAD 3mg SAD 的一期研究設計(N = 8,比例為 6:2)安全性評估安全性評估安全性評估安全性評估 30mg QD MAD N=8(按 6:2 比例)安全性評估安全性評估單次升序劑量(SAD)多次升序劑量
(MAD) 腳註:N= 每個給藥隊列的參與者,顯示了 INF904 的隨機化比例:匹配安慰劑;* 在交叉設計中測試了 3 種不同的膠囊強度 10mg SAD(N = 8,比例為 6:2)30mg SAD(N = 8,比例為 6:2)60mg* SAD(N = 22,比例為 18:4)120 mg SAD(N = 22,比例為 18:4)120mg SAD(N = 8,比例為 6:2)240mg SAD(N = 8,按照 6:2 的比例)30mg BID MAD N=8(按照 6:2 的比例)90mg BID MAD N=8(按 6:2 的比例)註冊總數:N = 62 註冊總數:N = 24

INF904:第一階段多劑量遞增劑量 (MAD) 的主要結果
12 AGENDA 安全結果 pk 成果 pk 結果 pd 結果研究設計背景和臨牀前工作摘要

第 13 頁 INF904 被發現耐受性良好,在 3 mg 到 240 mg 的單次遞增劑量下,沒有出現
安全隱患的信號。安慰劑組不良事件(AE)的總體百分比(85.7%)高於活躍治療的受試者(58.3%)。AE 嚴重程度:輕度:78;中度:9;重度:0。在任何劑量水平下,均未報告
嚴重不良反應(SAE)。1 名中度不良反應被評為可能與安慰劑(頭痛)有關,2 例輕度不良反應可能與研究藥物(腹瀉、脹氣)有關。1.4(60 mg)隊列中有1名受試者因無關的
AE 而退出。INF904 I 期研究:來自 MAD(和 SAD)部分的安全性結果——主要目標 INF904 被發現具有良好的耐受性,在涉及 30 mg QD、30 mg BID 和 90 mg
BID 的多個遞增劑量中,沒有出現安全隱患信號。安慰劑組中不良反應的總百分比為83.3%,而在活躍治療的受試者中,AE的總百分比為77.8%。AE 嚴重程度:輕度:52;中度:5;重度:0。在任何劑量水平下均未報告任何SAE。2例AE,均為輕度強度,且均在1名受試者(隊列3.3/90 mg BID)中,被評為可能與研究藥物(腹瀉、脹氣)有關。沒有受試者退出治療/研究。悲傷部分瘋狂部分

INF904:第一階段多劑量遞增劑量 (MAD) 的主要結果
14 AGENDA 安全結果 pk 成果 pk 結果 pd 結果研究設計背景和臨牀前工作摘要
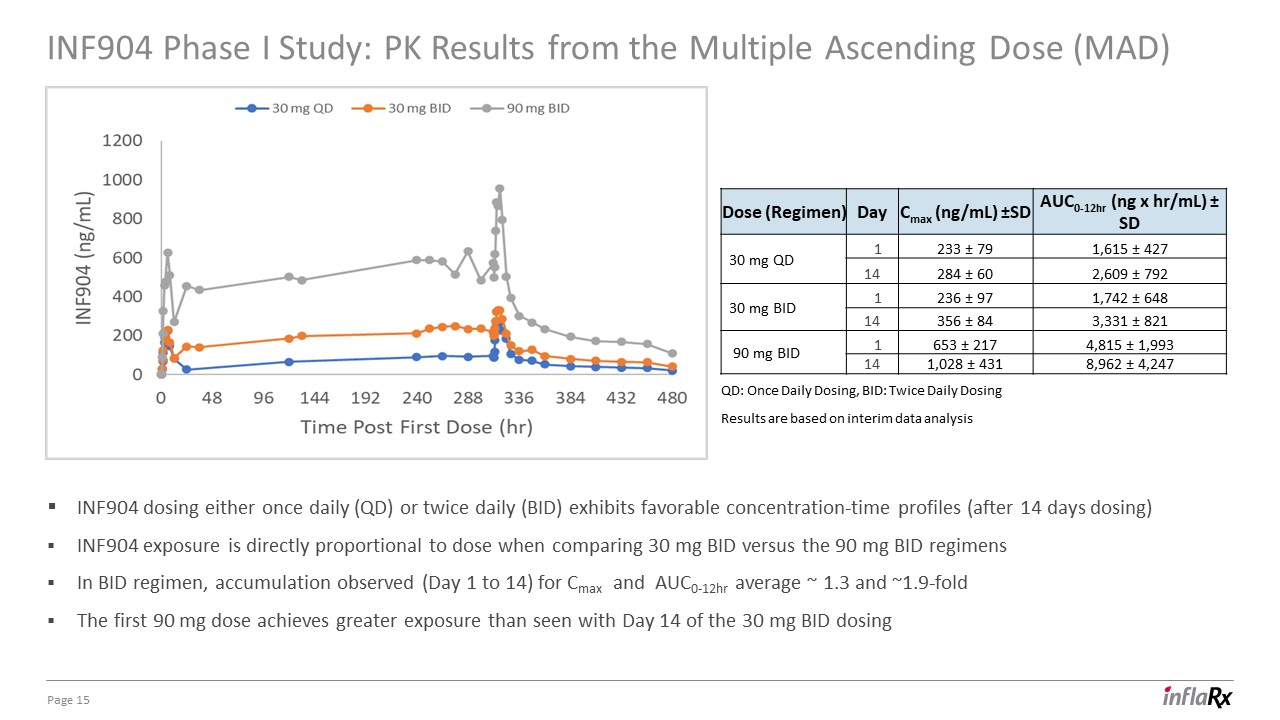
INF904 I 期研究:多重遞增劑量 (MAD) 的 PK 結果第
15 頁:每日一次,BID:每日兩次給藥結果基於中期數據分析 INF904 劑量每天一次 (QD) 或每天兩次 (BID) 的劑量表現出良好的濃度時間分佈情況(給藥 14 天后),在比較 30 mg BID 與 BID 90 mg BID 方案時,INF904 暴露
與劑量成正比方案,觀察到 Cmax 和 AUC0-12 小時的累積量(第 1 天到第 14 天)平均值約為 1.3 倍和約 1.9 倍。前 90 mg 劑量的暴露量大於
從 30 mg BID 給藥劑量(方案)第 14 天 Cmax (ng/mL) ±SD auc0-12hr (ng x hr/mL) ± SD 30 mg QD 1 233 ± 79 1,615 ± 427 B1 14 284 ± 60 2,609 ± 792 30 mg BID 1 236 ± 97 1,742 ± 648 B2 14 356 ± 821 mg 84 3,331 ± 821 mg 90 mg 出價 1 653 ± 217 4,815 ± 1,993 14 1,028 ± 431 8,962 ± 4,247

INF904:第一階段多劑量遞增劑量 (MAD) 的主要結果
16 AGENDA 安全結果 pk 成果 pk 結果 pd 結果研究設計背景和臨牀前工作摘要
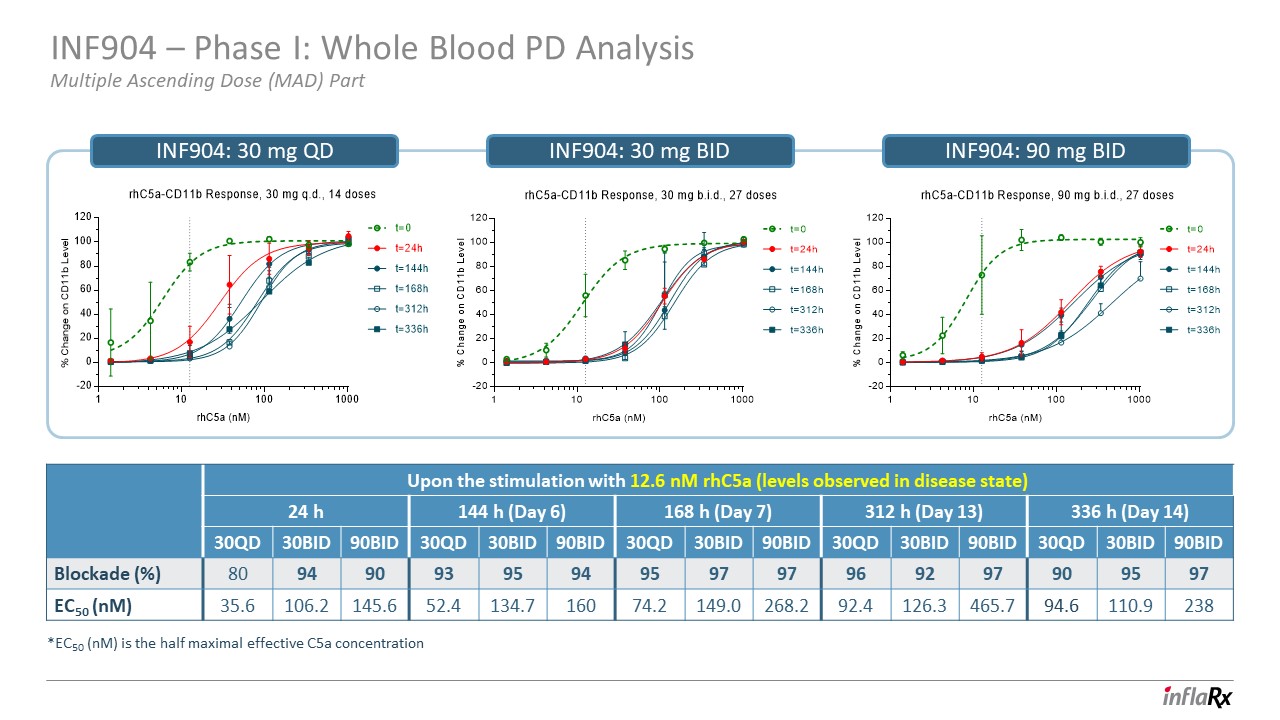
INF904 — 第一階段:全血 PD 分析多次遞增劑量 (MAD)
第 INF904 部分:30 mg QD INF904:30 mg BID INF904:90 mg BID 在 12.6 nM(疾病狀態下觀察到的水平)刺激後 24 h 144 h(第 6 天)168 h(第 13 天)336 h(第 14 天)c5a
(nM) 30QD 30BID 90BID 30QD 30BID 90BID 30QD 30BID 30QD 30BID 30QD 30BID 30QD 90BID 封鎖 (%) 80 94 90 93 95 95 97 97 97 97 97 97 97 97 97 97 97 95 97 95 97 EC50 (nM) 35.6 106.2 145.6 52.4 134.2 149.0 268.2 94.6 110.9 238 *EC50 (nM) 是半數最大有效 C5a專注

INF904:第一階段多劑量遞增劑量 (MAD) 的主要結果
18 AGENDA 安全結果 pk 成果 pk 結果 pd 結果研究設計背景和臨牀前工作摘要

摘要 INF904 I 期 MAD 研究的結果第 19 頁關鍵
結果 INF904 被發現耐受性良好,在從 30 毫克 QD 到 90 mg BID 不等的多個遞增劑量下,沒有安全隱患的信號。INF904 表現出良好的藥效特徵,有可能達到慢性免疫炎性疾病所需的治療暴露
(AUC 和 Cmax)。在人類疾病中觀察到的 C5a 濃度下,INF904 的 C5a 阻斷電位超過 90%。在這項
I 期多次遞增劑量研究中,INF904 證實了其同類最佳的 C5ar 抑制劑潛力

INF904:後續步驟第 20 頁進一步的藥物研發步驟:介紹
為二期臨牀項目開發的商業上可行的配方完成長期慢性毒理學研究計劃在 2024 年底啟動二期臨牀研究亮點

德國耶拿温澤拉爾街 207745 電子郵件:IR@inflarx.com 電話:
+49-3641-508180 傳真:+49-3641-508180 傳真:+49-3641-508181 InflarX N.V. www.inflarx.com

第 22 頁臨牀前數據(先前報告)附錄 SAD 數據
(先前報道)

INF904:8 小時採樣
的潛在同類最佳 C5AR 抑制劑血漿濃度:INF904 = 538 ng/mL Avacopan 樣分子 = 119 ng/mL 第 23 頁 INF904 與 AVACOPAN 的臨牀前體內療效比較* 與類阿瓦考潘相比 INF904 抑制體內中性粒細胞激活* 來源:InflarX 存檔數據。*Avacopan 根據已發佈的結構和公開數據合成。實驗:用C5a挑戰齧齒類動物會激活中性粒細胞,進而
中性粒細胞粘附(粘附)血管內皮細胞壁=模仿中性粒細胞減少症(載體)。當阻止 C5ar 激活時,此效果可以完全抑制。結果:INF904 在阻斷 C5aR 方面明顯優於相同劑量的 Avacopan*
,導致該齧齒動物模型體內中性粒細胞抑制作用大約翻了一番。注意:與 Avacopan* 的
相同劑量相比,本實驗中的 INF904 劑量在給藥 8 小時後施加的血漿水平高出約 4.5 倍。

INF904 I 期研究:來自 SAD 第 24 部分的 PK 結果與
公佈的 Avacopan 數據相比,INF904 在可比劑量(3、10、30 mg)下的 Cmax 高出大約 3 倍,全身暴露 (aucLast) 高 10 倍。參數單位劑量 INF904 Avacopan* AucinF h.ng/ml 3 mg 285 25 10 mg 1264 130 30 mg 5956 628 aucLast h.nlast h.nlast g/ml 3 mg 254 23 10 mg 1117 122 30 mg 5197 557 Cmax ng/ml 3 mg 21.5 9 10 mg 74.8 25 mg 289 79 tmax hr 3 mg 3.5 1.2 10 mg 4 1.7 30 mg 5.01 INF904 240mg INF904 60mg INF904 30mg INF904 120mg Avacopan* 30mg INF904 240mg INF904 60mg INF904 30mg INF904 120mg 來源:Bekker 等人(2016 年,PLoS One;11 (10):e0164646)*請注意:Avacopan 數據取自 Bekker 等人(2016 年,PLoS One;11 (10):
e0164646)在方向圖中疊加;Avacopan 未作為比較器納入 INF904 第一階段研究。

第 25 頁接受治療的健康志願者對 INF904 的耐受性良好,在從 3mg 到 240 mg 的單次遞增劑量中,
沒有出現令人擔憂的安全信號。安慰劑組不良事件(AE)的總體百分比高於活躍治療的受試者。AE 嚴重程度:81 中度:9 重度:0 在任何劑量水平下均未報告
嚴重急性腦炎(SAE)。1 名中度 AE 被評為可能與研究藥物(頭痛)有關,但受試者接受了安慰劑。隊列中有 1 名受試者因無關 AE 而退出 1.4(60 mg)。INF904 第一階段
研究亮點:SAD 部分的安全結果

INF904 I 期研究:給藥後 24 小時體外 SAD 部分 C5A 介導的 CD11b 上調
的 PD 結果第 26 頁 INF904 阻斷人血漿中 C5A 誘導的中性粒細胞激活的活性達到了設定目標,與唯一上市的
比較物 INF904 的阻斷活性有明顯區別:對於 12.64 nM 的 C5a,阻斷活性≥ 90% 為在 PD 分析中觀察到,在給藥後 24 小時的時間點劑量範圍為 30-240 mg。Avacopan:針對約12.64 nM的C5a,在給藥後12小時時間點發布的30mg給藥數據中,觀察到約50%的
阻斷活性。(貝克爾等人。PloS One 2016;11 (10):e0164646) 12.6 nM ≥ 90% 阻斷 c5a (nM) INF904(阻斷活性百分比與
安慰劑)c5a (nM) 3mg 10mg 30mg 60mg 60mg 120mg 240mg 12.6 9.6 74.7 95.7 95.2 98.7

INF904 證實了其在本期 I 期
單一遞增劑量研究中其同類最佳的 C5ar 抑制劑潛力。摘要 INF904 I 期 SAD 研究的標題結果第 27 頁關鍵結果 INF904 在接受治療的健康志願者中耐受性良好,在 3mg 至 240mg 的單次遞增劑量
中沒有出現任何令人擔憂的安全信號。INF904 表現出良好的 PK 特徵:Tmax 6 小時,劑量比例暴露在 3 到 240mg 之間。在人類疾病中觀察到的 C5a 濃度下,INF904 顯示出很強的 C5a 阻斷潛力。INF904 可以採用更高的藥物強度配製,每粒膠囊 30 毫克,而市售比較器每粒膠囊 10 毫克。