
附錄 99.2

用於1型神經纖維瘤病的米達美替尼-PN 2023 年 11 月 16 日 reneU 頭條業績

2 注意:除非另有説明,否則此處提供的信息截至2023年11月16日。本演示文稿可能包含經修訂的1995年《私人證券訴訟改革法》所指的 “前瞻性陳述”,涉及我們的業務、運營和財務狀況,包括但不限於當前對我們業務未來的信念、預期和假設、未來計劃和戰略、我們的發展計劃、我們的臨牀前和臨牀結果,以及nirogacestat有可能成為成人硬纖維瘤患者的重要新療法,獲得上市許可的可能性申請nirogacestat、對美國食品藥品監督管理局(FDA)對硝古司他新藥上市申請的時間和結果的期望,包括FDA的PDUFA新藥上市申請日期,以及NDA中包含的數據是否足以作為批准尼羅加司他治療成人硬纖維瘤的依據,可能得出2期結果 b reneU 臨牀試驗旨在支持米達美替尼的NDA申請,mirdametinib有可能成為患者的重要新療法在NF1—PN方面,我們為NF1—PN患者尋求監管部門批准並向其提供mirdametinib的計劃(如果獲得批准)、對評估復發卵巢顆粒細胞瘤患者的nirogacestat的2期試驗的時間和初始數據的預期,我們計劃在2023年提交SW-682的研究性新藥申請,我們計劃報告尼羅格司他聯合使用的其他臨牀數據使用BCMA——定向療法並啟動其他計劃中的1期合作者研究,我們對brimarafenib進入1b期劑量擴大階段的可能性,對我們主要資產的專利能否充分保護SpringWorks免受競爭的預期,以及與未來其他條件有關的預期。諸如但不限於 “期待”、“相信”、“期望”、“預期”、“估計”、“打算”、“計劃”、“會”、“應該” 和 “可以” 之類的詞語以及類似的表達方式或詞語,用於識別前瞻性陳述。新的風險和不確定性可能會不時出現,因此不可能預測所有風險和不確定性。本演示文稿中的任何前瞻性陳述均基於管理層當前的預期和信念,並受許多風險、不確定性和重要因素的影響,這些因素可能導致實際事件或結果與本演示文稿中任何前瞻性陳述所表達或暗示的事件或結果存在重大差異,包括但不限於與以下內容相關的風險:(i)我們產品開發活動的成功和時機,包括SpringWorks臨牀試驗的啟動和完成,(ii) 我們的期望關於mirdametinib對NF1—PN患者的潛在臨牀益處,(iii)臨牀研究的標題或中期數據可能無法預測此類研究的最終或更詳細結果,也無法預測其他正在進行或未來研究的結果,(iv)我們的合作伙伴正在進行和計劃進行的臨牀試驗的成功與時機,(iv)我們計劃提交監管文件和互動的時間安排,包括時間以及聯邦藥品管理局、歐洲藥品管理局(EMA)和其他機構做出的決定的結果監管機構、臨牀試驗場所的研究審查委員會和出版物審查機構,(vii) FDA、EMA或其他監管機構是否需要更多信息或進一步研究,或者可能未能或拒絕批准或可能延遲批准我們的候選藥物,包括lud ing nirogacestat和mirdametinib的批准,(vii) 我們獲得和維持監管部門對任何候選產品的批准的能力,(viii) 我們研究、發現和發現的計劃開發更多候選產品,(ix)我們的進入能力合作開發新候選產品以及我們實現此類合作預期收益的能力,(x)我們維持足夠的專利保護併成功執行鍼對第三方的專利索賠的能力,(xi)我們在本文規定的任何時間段內有足夠的現金狀況為我們的運營提供資金,(xii)我們建立製造能力的能力,以及我們和我們的合作伙伴生產候選產品和規模生產的能力,以及(xiii)我們的有能力滿足任何人此處列出了具體的里程碑。除非適用法律要求,否則我們不打算公開更新或修改此處包含的任何前瞻性陳述,無論是由於任何新信息、未來事件、情況變化還是其他原因。儘管我們認為此類前瞻性陳述中反映的預期是合理的,但我們無法保證這些預期會被證明是正確的。因此,提醒讀者不要過分依賴這些前瞻性陳述。有關可能導致SpringWorks預期與實際業績之間存在差異的風險、不確定性和其他因素的更多信息,您應查看我們向美國證券交易委員會提交的文件中的 “風險因素” 部分。本演示文稿中包含的某些信息涉及或基於第三方來源的研究、出版物、調查和其他數據,以及我們自己的內部估計和研究。儘管SpringWorks認為截至本演示文稿發佈之日這些第三方來源是可靠的,但我們尚未對從第三方來源獲得的任何信息的充分性、公平性、準確性或完整性進行獨立驗證,也未作任何陳述。此外,本文中包含的所有市場數據都涉及許多假設和限制,無法保證這些假設的準確性或可靠性。最後,儘管我們認為自己的內部研究是可靠的,但此類研究尚未得到任何獨立來源的證實。前瞻性陳述

3 今天的議程欄目主持人簡介 Saqib Islam 首席執行官 ReneU 2b 階段數據 Jim Cassidy,醫學博士,首席醫學官項目亮點和下一步行動 Badreddin Edris,博士首席運營官 Q&A 全部

簡介 Saqib Islam 首席執行官

來自 reneU 的 5 項正面標題結果表明,Mirdametinib 對 NF1-PN 患者的潛在變革性益處注:NF1-PN:1 型神經纖維瘤病——相關的叢樣神經纖維瘤。▪ Topline 數據表明,兒童和成人都具有領先的潛力-PN ▪ 盲目獨立中央評論證實了穩健的客觀反應率 ▪ 可管理的耐受性具有增強依從性的產品功能的概況 ▪ 由以下機構支持的抗腫瘤活性 ▪疼痛和生活質量的改善衡量標準 Kylie,1型神經纖維瘤病-PN 患者 Gus,1型神經纖維瘤病-PN 患者 Katie,NF1-PN 患者

6 NF1—PN患者對同類最佳療法的需求仍有大量未得到滿足來源:(1)SpringWorks市場研究;(2)Korf,《美國醫學遺傳學雜誌》,1999年;(3)Koselugo處方信息。Savanna,NF1—PN 患者由於神經浸潤性生長和長期解決方案不足,手術很困難 (1,2) 神經沿線的容貌損傷和高度病態生長,通常會導致慢性、致殘性疼痛。具有挑戰性的劑量/給藥、耐受性和標籤限制限制了目前批准的 MEK 抑制劑的效用 (3) 對患者和護理人員的生活質量產生重大影響,帶來情感和心理負擔

ReneU 2b 階段數據 Jim Cassidy,醫學博士,首席醫學官

8 期 2b 期 reneU 試驗摘要説明:reins:神經纖維瘤病和神經鞘瘤病的反應評估;BICR:盲目獨立中央審查;BID:每日兩次;QoL:生活質量。▪ 2b 期開放-標籤;n = 美國 50 個研究中心的 2 個隊列(兒科和成人)中的 114 名患者 ▪ 2 mg/m 2 BID 劑量,間歇療程(4 周,週期 3 周)開啟,休假 1 周),最多 24 個週期;最大劑量為 4 mg BID ▪ 在 2020 年下半年試用設計治療階段 Mirdametinib 2 BID 3 周/1 周推出兒科配方(分散片劑)關閉最多 24 個週期長期隨訪期 (LTFU) 隊列 1 2 — 17 歲隊列 2 ≥18 歲 PN 導致顯著發病率符合條件的患者 ▪ 經證實的客觀緩解率(按照 reinS 標準,腫瘤體積減少 20%)在治療階段結束時由 BICR 確定 ▪ 安全性和耐受性、緩解持續時間、生活質量和身體功能評估(包括疼痛測量)次要和探索性終點
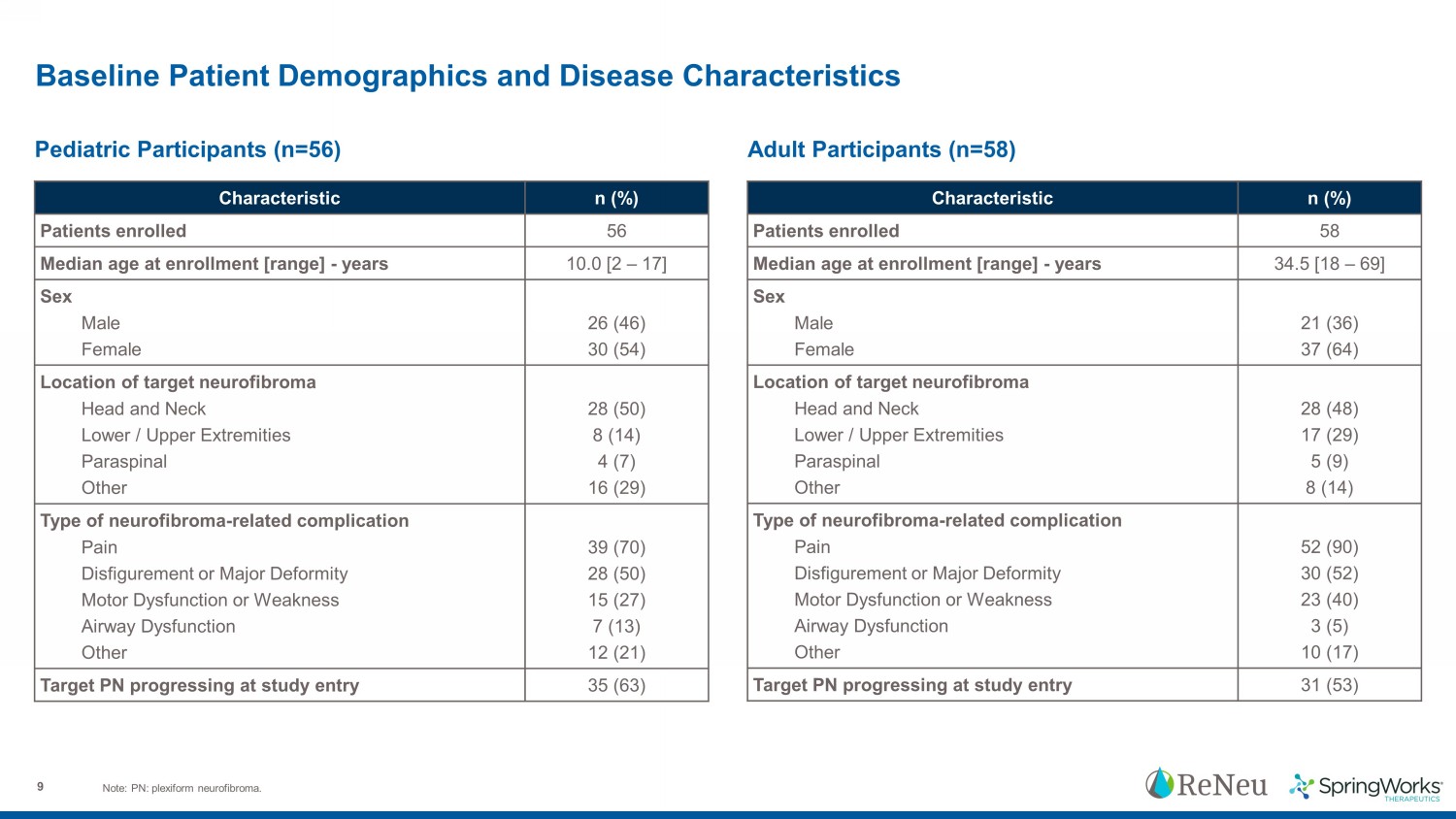
9 基線患者人口統計和疾病特徵注:PN:叢狀神經纖維瘤。特徵 n (%) 入組患者入組時平均年齡 56 [範圍]-年份 10.0 [2 – 17]性別男性女性 26 (46) 30 (54) 靶神經纖維瘤的位置頭部和頸部下肢/上肢副脊柱其他 28 (50) 8 (14) 4 (7) 16 (29) 神經纖維瘤類型相關併發症疼痛毀容或嚴重畸形運動功能障礙或虛弱氣道功能障礙其他 39 (70) 28 (50) 15 (27) 7 (13) 12 (21) 目標 PN 進入研究時進展 35 (63) 名兒科參與者 (n=56) 成人蔘與者 (n=58) 特徵 n (%) 入組患者平均年齡 58 [範圍]-34.5 年 [18 – 69]性別男性女性 21 (36) 37 (64) 靶神經纖維瘤的位置頭部和頸部下肢/上肢副脊柱其他 28 (48) 17 (29) 5 (9) 8 (14) 神經纖維瘤類型相關併發症疼痛毀容或嚴重畸形運動功能障礙或虛弱氣道功能障礙其他 52 (90) 30 (52) 23 (40) 3 (5) 10 (17) 目標 PN 在研究入門 31 (53) 時取得進展

10Best Tumber ResponsePetaric CohortNote:BICR:盲目獨立中心綜述;corR:經證實的客觀反應(1)顯示腫瘤體積在任何時候均達到最佳變化,包括未經證實的部分反應。(2)在進行任何治療磁共振成像評估之前停止研究的參與者。#Patient 仍在研究最佳總體確診反應狀態 (BICR) n (%) 部分反應29 (52) 穩定病22 (39) 進展性疾病3 (5) 失蹤 (2 (4) *1 患者在長期隨訪中得到確診反應且未包含在 orrMedian 最佳腫瘤體積變化的計算中 42 (n=確診反應率 (BICR) n (%) corr*29 (52)

11 治療持續時間和反應兒科隊列 ▪ 平均治療持續時間為 22.0 個月 ▪ 首次反應的平均時間為 7.9 個月 — 45% 的患者在第 5 週期評估中出現了確診反應(4.2 個月)▪ 中位緩解持續時間未達到 ▪ 截至數據截止時 28 名患者仍在接受治療 ▪ 完成治療階段的患者中 85% 選擇在研究的長期隨訪部分繼續接受治療 Evaluable Patients End 治療階段 (24 個週期 (1)) (1) 4-週週期 3 周開啟,休假 1 周。治療階段在最後一個週期 3 周後結束。× 進展性疾病客觀反應已確認 → 患者仍在接受治療

12 名患者-報告的結果兒科隊列量表 p-與基線相比的變化值 (1) 靶腫瘤疼痛——數字評分量表 (NRS-11) (2) (n=15) 0.003 疼痛幹擾指數 (PII) (3) 自我報告 (n=20) 家長代理 (n=18) 0.004 0.016 兒科生活質量清單 (PedsQL) (4) — 自我總分-報告 (n=20) 38) 家長代理 (n=43) 0.096 0.005 兒科生活質量清單 (PedsQL) (4) — 身體功能自我報告 (n=38) 家長代理 (n=43) 0.033 0.037 (1) 與第 13 週期基線相比的變化,對患者的預先規定評估-根據ReneU統計分析計劃報告的結果分析。最小二乘表示使用重複測量混合模型 (MMRM) 進行估計。(2) NRS-11 以從 0 — “無痛” 到 10 — “你能想象的最嚴重的疼痛” 的等級來評估靶區腫瘤疼痛。NRS-在就診前和就診當天連續六天進行了11次評估,但ET訪問除外,它僅在訪問當天進行。這七項評估的平均值被視為訪問分數。巴塞爾指數被定義為治療開始日期當天或之前的最新NRS分數為11分。(3)PII 評估疼痛對參與者日常活動的影響程度,範圍從 0(“完全沒有” 到 6)。個人身份信息評估是在訪問前連續六天以及訪問當天進行的,但ET 訪問除外,它僅在訪問當天進行。這七項評估的平均值被視為訪問分數。基線定義為在治療開始日期當天或之前得出的最新 PII 分數。(4) PedsQL 以 Likert 量表評估生活質量,範圍從 0 到 4。然後對這些項目進行反向評分併線性轉換為 0-100 s 等級,如下所示:0=100、1=75、2=50、3=25、4=0,分數越高表示生活質量越高。基線定義為在治療開始日期當天或之前得出的最新PedSQL分數。

13 安全性摘要兒科隊列 (1) 複合不良事件,包括痤瘡樣皮炎、皮疹、黃斑疹-丘疹、紅斑疹、痤瘡、脂溢性皮炎、剝脱性皮疹、丘疹、丘疹、皮疹、皮疹、皮疹、瘙癢。(2) 8名患者出現因治療導致劑量中斷的相關不良事件(14%)。注:TEAE:治療-緊急不良事件;TRAE:治療-相關不良事件。(n=56) TeaES ≥ 20% 科目 TraES 首選學期所有成績 — n (%) ≥ 3 級 — n (%) 所有成績 — n (%) ≥ 3 級 — n (%) 任何 TEAE 56 (100) 22 (39) 53 (95) 14 (25) 皮疹 (1) 36 (64) 2 (4) 腹瀉 31 (55) 3 (5) 21 (38)) 1 (2) 痤瘡皮炎 24 (43) 1 (2) 24 (43) 1 (2) 嘔吐 22 (39) 0 (0) 8 (14) 0 (0) 頭痛 19 (34) 1 (2) 6 (11) 0 (0) 甲溝炎 18 (32) 0 (0) 17 (30) 0 (0) 噁心 15 (27) 0 (0) 0 (0) 0) 腹痛 15 (27) 2 (4) 8 (14) 2 (4) 射精分數降低 15 (27) 1 (2) 11 (20) 1 (2) COVID-19 14 (25) 0 (0) 0 (0) 0 (0) 0 (0) 0 (0)上呼吸道感染 13 (23) 0 (0) 1 (2) 0 (0) 血肌酸磷酸激酶升高 12 (21) 4 (7) 11 (20) 4 (7) 咳嗽 12 (21) 0 (0) 0 (0) 0 (0) (n=56) n (%) TEAE 導致劑量中斷 (2) TEAE 導致劑量減少 TEAE 導致停藥 17 (30) 7 (13) 5 (9)

14Best Tumber ResponseAdult CohortNote:BICR:盲目獨立中心綜述;corR:經證實的客觀反應(1)顯示腫瘤體積在任何時候均達到最佳變化,包括未經證實的部分反應。(2)在進行任何治療磁共振成像評估之前停止研究的參與者。#Patient 仍在研究中*2 患者在長期隨訪中得到確診緩解且未包括在 OrrBest 總體確認反應狀態 (BICR) n (%) 部分反應24 (41) 穩定病26 (45) 進展性疾病0 (0) 缺失 (8 (14) 確診反應率 (BICR) n (%) corr*24 (41) 腫瘤容量最佳變化中位數為 41 (n=

15 治療持續時間和反應成人隊列可評估患者治療階段結束(24 個週期(1))× 進展性疾病死亡(2)確診客觀反應(1)4 週週週週期,休假 1 周。治療階段在最後一個週期 3 周後結束。(2) 在停止研究治療後的 30 天內,有一名患者因 COVID-19 死亡,被認為與米達美替尼無關。出現客觀反應 → 患者仍在接受治療 ▪ 中位治療持續時間為 21.8 個月 ▪ 首次反應的平均時間為 7.8 個月 ——在 5 週期(4.2 個月)評估中,有 46% 的患者出現了確診的緩解 ▪ 中位緩解持續時間未達到 ▪ 截至數據截止時 22 名患者仍在接受治療 ▪ 完成治療階段的患者中,有 84% 的患者選擇在研究的長期隨訪部分繼續接受治療

16 名患者-報告的結果成人隊列量表 p-與基線相比的變化值 (1) 靶向腫瘤疼痛數字評級量表 (NRS-11) (2) (n=21)

17 安全摘要成人隊列 (n=58) TeaES ≥ 20% 科目 TraES 首選學期所有成績 — n (%) ≥ 3 級 — n (%) 所有成績 — n (%) ≥ 3 級 — n (%) 任何 TEAE 58 (100) 21 (36) 9 (16) 皮疹 (1) 54 (93) 6 (10) 痤瘡樣皮炎 45 (78) 5 (9) 45 (78) 5 (9) 腹瀉 34 (59) 0 (0) 28 (48) 0 (0) 噁心 30 (52) 0 (0) 21 (36) 0 (0) 嘔吐 22 (38) 0 (0) 16 (28) 0 (0) 疲勞 17 (29) 1 (2) 12 (21) 1 (2) COVID-19 13 (22) 3 (5) 0 (0) 0 (0) SARS-COV-2 檢測呈陽性 12 (21) 2 (3) 0 (0) 0 (0) (1) 包括皮炎在內的複合不良事件痤瘡、皮疹、黃斑疹-丘疹、紅斑疹、痤瘡、脂溢性皮炎、剝脱性皮疹、丘疹、丘疹、皮疹、皮疹、黃斑疹、皮疹性瘙癢。(2) 治療導致劑量中斷-5例患者出現相關不良事件(9%)。注:TEAE:治療-緊急不良事件;TRAE:治療-相關不良事件。(n=58) n (%) TEAE 導致劑量中斷 (2) TEAE 導致劑量減少 TEAE 導致停藥 18 (31) 10 (17) 13 (22)

項目亮點和後續步驟 Badreddin Edris,博士首席運營官

19 資料來源:(1) Lammert 等人,Arch Dermat,2005 年。美國人口普查數據;(2)費舍爾等人,《神經—腫瘤學》,2022年。(3)SpringWorks市場研究。美國約有10萬名1型神經纖維瘤病確診患者(1)美國約有4萬名1型神經纖維瘤病患者(2,3)米達美替尼憑藉其差異化特徵為更廣泛年齡段的潛在治療選擇,有望解決有意義人羣仍未得到滿足的需求頻譜,包括兒科和成人患者 x 強大的抗腫瘤活性:兒科患者 BICR ORR 為 52%,成人患者 BICR ORR 為 41%有深度持久反應的證據 x 安全性可控,兩個隊列的3級以上毒性發生率都很低,這為現實世界提供了長期給藥潛力的機會 x 差異化產品配方,便於給藥 x 旨在提高依從性,無需禁食、優化劑量和限制藥物的便捷療法-藥物相互作用 x 在幾位重要患者中顯示的統計學意義-報告的與生活質量和疼痛相關的結果指標 x

20 監管狀態和後續步驟監管指定:▪ 美國食品藥品管理局和歐盟委員會授予的1型神經纖維瘤病孤兒藥稱號以及FDA授予的1型神經纖維瘤病快速通道稱號 ▪ 2023年7月獲得FDA批准的罕見兒科疾病稱號即將提交的文件:▪ 計劃要求在第一季度與FDA舉行保密協議前會議,並預計在下半年提交新藥上市數據:▪ 預計將公佈ReneU兒科和成人隊列的詳細研究結果在 2014 年 1 小時的醫學會議上進行試驗 ▪ 計劃為同行評審期刊提交稿件於 2024 年出版

21 來自 ReneuAdvance 的積極結果我們的目標是到 2025 年獲得兩項潛在批准 (1) Gounder 等人,NEJM,2023 年。注:PDUFA:處方藥使用費法;NF1-PN:與 1 型神經纖維瘤病相關的叢狀神經纖維瘤。21mirdametinib?如果獲得批准,會是第一個獲得美國食品藥品管理局批准的硬質腫瘤療法(PDUfaDate:2023 年 11 月 27 日)嗎?第 3 期 DeFi 試驗在主要和所有關鍵次要終點上取得了具有統計學意義且具有臨牀意義的結果 (1)?有機會改變硬腫瘤患者的護理標準嗎?Topline ReneuData 顯示出具有強大抗腫瘤活性和臨牀益處、安全性和耐受性以及便利性的潛力?兒科患者的差異化選擇以及首次獲得成人批准的可能性?如果獲得批准,則有機會在2025年之前為成人和兒科Nf1-PN患者提供一流的療法。NirogaceStat

謝謝

23 吉姆·卡西迪,醫學博士,首席醫學官 Q&A Saqib Islam 首席執行官 Badreddin Edris,PhD 首席運營官