附錄 99.4

1 公司簡報 GH Research PLC(納斯達克股票代碼:GHRS)2023 年 11 月 GH Research PLC

關於前瞻性陳述的免責聲明本演示文稿
由GH Research PLC(“GH Research”)編寫,僅供參考,不用於任何其他目的。本演示文稿中包含的任何內容均不是,也不應被解釋為
主持人或 GH Research 的任何董事、員工、代理人或顧問的推薦、承諾或陳述。本演示文稿並不旨在包羅萬象,也不是要包含您可能想要的所有信息。本演示文稿不構成
出售要約或招攬購買證券的要約,在根據任何此類州或司法管轄區的證券法進行註冊或
資格之前,此類要約、招標或銷售屬於非法的任何州或司法管轄區,也不得出售這些證券。本演示文稿包含前瞻性陳述,本警示聲明對所有這些陳述進行了全面限定。此處包含的許多前瞻性
陳述可以通過使用 “可能”、“預期”、“相信”、“可以”、“期望”、“應該”、“計劃”、“打算”、“估計”、“將”、“潛在” 和 “持續” 等前瞻性詞語來識別,儘管並非所有前瞻性陳述都包含這些識別詞。此處包含的任何未描述歷史事實的陳述均為前瞻性陳述,這些陳述基於管理層的預期,並受某些因素、風險和不確定性的影響,這些因素、風險和不確定性可能導致實際業績、結果、時機和業績與此類陳述所表達或暗示的存在重大差異。這些因素、風險和不確定性
包括但不限於:與GH Research的研發工作相關的成本和不確定性;與GH Research候選產品的非臨牀和臨牀
研究的進行、時間和結果相關的固有不確定性;GH Research 對 GH001 IND 的臨牀擱置的期望,包括推進任何非臨牀項目和任何其他提升臨牀
穩定的工作的計劃和預期,解除這種臨牀控制所需的時機以及與FDA的討論以及此類討論的結果和解決方案;GH Research獲得、維護、執行和捍衞已頒發專利的能力;
GH Research資本資源的充足性、額外資金的可用性以及GH Research向美國證券交易委員會提交的文件中描述的其他因素、風險和不確定性。
除非另有説明,否則這些前瞻性陳述僅代表截至本演示之日,GH Research沒有義務更新或修改任何此類陳述以反映本演示後發生的事件或情況
。由於前瞻性陳述本質上會受到風險和不確定性的影響,其中一些無法預測或量化,有些則超出了GH Research的控制範圍,因此
不應依賴這些前瞻性陳述作為對未來事件的預測。任何此類前瞻性陳述中反映的事件和情況都可能無法實現或發生,實際結果可能與前瞻性陳述中預測的
存在重大差異。GH Research 提醒你不要過分依賴本演示文稿中包含的前瞻性陳述。2023© GH Research PLC 2
關於前瞻性陳述的免責聲明本演示文稿由GH Research PLC(“GH Research”)編寫,僅供參考,不用於任何其他目的。本演示文稿中包含的任何內容都不是或不應被解釋為主講人或GH Research的任何董事、員工、代理人、
或顧問的推薦、承諾或陳述。本演示文稿並不旨在包羅萬象,也無意包含您可能想要的所有信息。本演示文稿不構成出售要約或徵求購買
證券的要約,在根據任何此類州或
司法管轄區的證券法進行註冊或獲得資格之前,此類要約、招標或出售屬於非法的任何州或司法管轄區也不得出售這些證券。2 本演示文稿包含前瞻性陳述,所有這些陳述均由本警示聲明完全限定。此處包含的許多前瞻性陳述可以通過使用
個前瞻性詞語來識別,例如 “可能”、“預期”、“可以”、“應該”、“計劃”、“打算”、“估計”、“將”、“潛在” 和 “持續” 等,儘管並非所有前瞻性陳述都包含這些識別性詞語。此處包含的任何未描述歷史事實的陳述均為前瞻性陳述,這些陳述基於管理層的預期,受某些因素、風險和不確定性的影響,這些因素、風險和不確定性可能導致
的實際業績、結果、時機和業績與此類陳述所表達或暗示的結果存在重大差異。這些因素、風險和不確定性包括但不限於:與GH
Research的研發工作相關的成本和不確定性;與GH Research候選產品的非臨牀和臨牀研究的進行、時間和結果相關的固有不確定性;GH Research獲得、維護、
執行和捍衞已頒發專利的能力;GH Research 資本資源的充足性、額外資金的可用性以及 GH Research 的現金渠道;以及描述的其他因素、風險和不確定性在 GH Research 向
美國證券交易委員會提交的文件中。除非另有説明,否則這些前瞻性陳述僅代表截至本演示之日,GH Research沒有義務更新或修改任何此類陳述以反映本演示後發生的事件或情況。由於前瞻性陳述本質上會受到風險和不確定性的影響,其中一些無法預測或量化,有些則超出了GH
Research的控制範圍,因此您不應依賴這些前瞻性陳述作為對未來事件的預測。任何此類前瞻性陳述中反映的事件和情況都可能無法實現或發生,實際結果可能與前瞻性陳述中的預測存在重大差異。GH Research 提醒你不要過分依賴本演示文稿中包含的前瞻性陳述。2023© GH Research PLC 2

在抑鬱症中尋求超快速、持久的緩解 3 2023© GH Research PLC 3

開發階段項目適應證臨牀前 1 期
2a 期 2b 期 3 期當前狀態 gh001mebufotenin (5-meo-DMT) 用於吸入給藥的耐藥性抑鬱症 (TRD) 2b 期 RDBPC 試驗啟動 (GH001-TRD-201) 雙極 II 型障礙* (BDII) 2a 期 POC 試驗
啟動 (GH001-BD-202) 產後抑鬱症 (PPD) 2a 期 POC 試驗已啟動 (GH001-PPD-203) 用於靜脈注射的 gh002mebufotenin (5-meo-DMT) 精神或神經系統疾病 1 期 HV 試驗
已啟動 (GH002-HV-105) gh003mebufotenin (5-meo-DMT) 用於鼻腔給藥精神或神經系統疾病臨牀前研發正在進行中 Pipeline 2023© GH Research PLC *目前有重度
抑鬱發作的雙相情感障礙 5-meo-dmt、5-甲氧基-N、N-二甲基色胺;靜脈注射;RDBPC,隨機,雙盲,安慰劑對照;POC,概念驗證;HV,健康志願者完成中 4
開發階段項目適應證臨牀前階段 1 期 2a 期 2b 期 3 期當前狀態 gh001mebufotenin
(5-meo-DMT) 用於吸入給藥耐藥性抑鬱症 (TRD) 2b 期 RDBPC 試驗啟動 (GH001-TRD-201) 雙極 II 型障礙* (BDII) 2a 期 POC 試驗啟動 (GH001-BD-202) 產後抑鬱症 (PPD) 2a 期
POC 試驗已啟動 (GH001-PPD-203) 用於靜脈注射的 gh002mebufotenin (5-meo-DMT) 精神或神經系統疾病 1 期 HV 試驗已啟動 (GH002-HV-105) gh003mebufotenin (5-meo-DMT) 用於鼻腔給藥精神病或
神經系統疾病臨牀前開發正在進行中 Pipeline 4 2023© GH Research PLC *目前有重度抑鬱發作的雙相情感障礙 5-meo-dmt、5-甲氧基-N、N-二甲基色胺;靜脈注射;RDBPC,隨機注射,
雙盲,安慰劑對照;POC,概念驗證;HV,健康志願者完整版正在進行中 4

...以 TRD 為單位的緩解率

歐盟和美國龐大而開放的抑鬱症市場 6 一線 MDD 二線 MDD 耐藥性抑鬱症
(TRD) 患者循環使用無效的 TRD 治療已診斷:約 4,800 萬人接受治療(藥物治療 ± 心理治療):約 2400 萬對第一線無反應:約 1300 萬條公司估計,基於:
https://www.nimh.nih.gov/health/statistics/major-depression.shtml;Wittchen 等人,規模和負擔《2010 年歐洲精神障礙和其他腦部疾病》,《歐洲神經心理藥理學》(2011);Rush 等人,需要一個或多個治療步驟的抑鬱門診患者的急性和
長期預後:STAR*D 報告,Am J Psychiatry 2006MDD,重度抑鬱症 2023© GH Research PLC 6

Mebufotenin(5-甲氧基-N、N-二甲基色胺、5-meo-DMT)來自色胺的天然精神活性物質
類對 5-HT1A 和 5-HT2A 受體 GH001 的高效激動劑(通過專有的肺部吸入方法給藥 Mebufotenin)起病速度超快(在幾秒鐘內)、持續時間短(5 到 30 分鐘)極易誘發峯值體驗(PE),可能是治療效果的替代標誌物每日個性化給藥方案(IDR),可最大限度地提高超快速和持久的緩解效果 Single初次就診
次治療,無需結構化心理治療可能方便且不經常進行二次治療 Mebufotenin (5-meo-DMT) 和 GH001 7 2023© GH Research PLC 甲布福汀 (5-meo-DMT) 基礎 IP 7

GH001 單劑量:人際差異 GH001 個性化給藥方案 (IDR):最大限度地提高超快速和耐久性
緩解 MADRS 分數 MADRS 分數 MADRS 分數 MADRS 分數 1 劑量 1 劑量 2 劑量 1 無緩解緩解緩解假設患者 1 假設患者 2 假設患者 2 無緩解無緩解無緩解劑量 1 GH001 — 最大限度地提高超快速和持久緩解的個性化給藥方案 (IDR) 8 2023© GH ResearchPLC
MADRS 分數劑量 1 MADRS,蒙哥馬利-奧斯伯格抑鬱評級量表 8

健康志願者的 1 期試驗 GH001-HV-101(已完成)9 ClinicalTrials.gov ID:NCT04640831 2023© GH Research PLC
9

GH001 第 1 天給藥第 7 天 GH001 2 mg (n=4) GH001 6 mg (n=6) GH001 12 mg (n=4) GH001 18 mg (n=4) HV (n=18) 部分
A(單劑量)B 部分(IDR)主要終點:第 7 天之前的安全峯值體驗量表(PE 量表)1 HV(n=4)主要終點:第 7 天之前的安全峯值體驗量表(PE 量表)) 1 GH001 IDR6、12、18 mg 達到 PE(最多 3 劑,間隔 3 小時)關鍵評估安全 PE 量表認知功能安全性認知功能 1PE 量表通過將視覺模擬量表標記為 0 到 100 之間的視覺模擬量表來平均受試者得分的答案以下
三個問題:1.體驗有多激烈;2.你在多大程度上失去了控制;3.這段經歷有多深刻(即深刻和重要)?健康志願者 (GH001-HV-101) 10 2023© GH
Research PLC HV,健康志願者;PE,Peak Experience;IDR,個性化給藥方案 10

研究安全組綜述否所有 ADR 均為輕度,兩種中度除外 (*) 所有 ADR 均自發消退吸入
耐受性良好,除了給藥 GH001 後不久心率和血壓出現暫時性的、與臨牀無關的升高外,安全實驗室
分析、精神安全評估或認知功能測量 ADR A 部分(單劑量)B 部分(IDR)沒有臨牀顯著變化 ADRs 2 mg (n=4) 6 mg (n=6) 12 mg (n=4) 18 mg (n=4) IDR1 (n=4) MedDra 的首選術語數
事件 n n n n 異常夢想 1 焦慮 1 1 笨拙 1 混亂狀態 1 欣快情緒 1 疲勞 1 1* 感覺
熱 1 倒敍 1 幻覺 1 頭部不適 1 頭痛 2 1 1 心率加快 1* 聽覺過敏 1 失眠 1 精神
疲勞 1 噁心 2 1 1 2 視力模糊 1 A 部分(單劑量)和 B 部分(IDR)— 安全 11 2023© GH Research PLC 16 mg (n=1);6-12 mg (n=2);6-12-18 mg (n=1) SAE,嚴重不良事件;ADR、不良
藥物反應、與研究產物關係代碼為確定、可能或的不良事件可能,或者缺少代碼的地方;IDR,個性化給藥方案 11

平均劑量組 PE 量表 peThreshold A 部分 — 峯值體驗 (PE) 劑量效應和人際差異 12 PE,
Peak Experience 2023© GH Research PLC 12

peThreshold B 部分 — 盤中個性化給藥方案 (IDR) 的峯值體驗 (PE) 影響 13 PE,Peak Experience 2023©
GH Research PLC 13

耐藥性抑鬱症 GH001-TRD-102 的 1/2 期試驗(已完成)14 ClinicalTrials.gov ID:NCT04698603 2023© GH
Research PLC 14

關鍵評估 MADRS H2 PE Scale 安全 MADRS D1 認知功能安全 MADRS D7 認知
功能安全 GH001 管理第 1 天第 7 天 TRD 第 1/2 期試驗的設計 (GH001-TRD-102) 15 1定義為對至少兩個足夠的藥物療程或一個足夠療程的
藥物治療以及至少一個足夠的循證心理治療療程 2023© GH Research PLC 第 1 階段(單劑量)第 2 階段 (IDR) GH001 12 mg (n=4) GH001 18 mg (n=4) TRD1 (n=8) 主要終點:直到天都是安全的
7 TRD1 (n=8)主要終點:MADRS 緩解第 7 天 (MADRS≤10) GH001 IDR6、12、18 mg 達到 PE(最多 3 劑,間隔 3 小時)TRD,耐藥性抑鬱症;PE,Peak Experience;MADRS,蒙哥馬利-奧斯伯格抑鬱評級
量表;IDR,個性化給藥方案;H,小時;D,第 15 天

第 1 階段(單劑量)和第 2 階段(IDR)— Safety 16 2023© GH Research PLC 研究安全小組審查否所有 ADR 均為輕度,
除三種中度外* 所有 ADR 均自發消退吸入耐受性良好,除了
給藥 GH001 後不久心率和血壓暫時升高無臨牀意義的安全實驗室分析,精神病學安全評估或認知功能測量沒有與自殺意念或自殺有關的安全信號行為,基於 C-SSRS
和 MADRS 子評分項目 “自殺念頭” ADR 第 1 階段(單劑量)第 2 階段(IDR)ADR 12 mg(n=4)18 mg(n=4)IDR1(n=8)MedDra 首選術語事件數量 n n 腹部不適 1 焦慮 2 抑鬱
症狀 1* 頭暈 1 倒敍 1 1 2 頭痛 2 1 3 肌肉不適 1 肌肉痙攣 1 噁心 2* 感覺異常 1 感官障礙 3 16-12 mg (n=6);6-12-18 mg
(n=2) SAE,嚴重不良事件;ADR,藥物不良反應,與研究產品相關代碼的不良事件明確、可能或可能的,或者代碼缺失的地方;IDR,個性化給藥方案;
C-SSRS,哥倫比亞自殺嚴重程度評級量表;MADRS,蒙哥馬利-奧斯伯格抑鬱評級表 16

MADRS 緩解/反應/改善率第 7 天第 1 階段(單劑量)— 功效(MADRS)17 PE,峯值體驗;MADRS,
蒙哥馬利—奧斯伯格抑鬱評級 scaleMadrs 緩解率 = MADRS 緩解率 ≤10;MADRS 任何改善 = 與 MADRS 基線相比有任何降低。2023© GH Research PLC 2 of 4 (50%) 在
組中,12 mg 組和 18 mg 組中 4 人中有 1 人(25%)在第 7 天獲得 MADRS 緩解,8 名患者中有 2 名患有 PE,且均在第 7 天獲得 MADRS 緩解 17

第 2 階段 (IDR) — 療效 (MADRS) 18 2023© GH Research PLC MADRS 緩解/反應/改善率第 7 天主要
終點達到:8 名患者中有 7 名(87.5%)在第 7 天獲得 MADRS 緩解,p

第 2 階段 (IDR) — 功效(MADRS 與基線相比有所變化)2023© GH Research PLC Baseline1 Hour 2 Day 1 Day
7 GH001 19 p=0.0018 p

MADRS 和 PE — 觀察到第 2 階段(IDR)與第 1 階段(單劑量)第 2 階段(IDR)第 1 階段(單劑量)的結果有所改善 12 mg 第 1 階段(單劑量)18 mg MADRS 緩解率第 7 天 87.5%(8 中的 7)50%(4 分之1)平均值 MADRS 變化第 7 天 -24.4(-76%)-21.0(-65%)-12.5 5 (-40%) Peak Experience 87.5%(8 中的 7)50%(4 分中的 2)0%(4 分中的 0)平均值
分數 90.4(最終劑量)58.2 59.1 2023© GH Research PLC 20 PE,Peak Experience;MADRS,蒙哥馬利-奧斯伯格抑鬱評級量表;IDR,個性化給藥方案 20

健康志願者的 1 期臨牀藥理學試驗 GH001-HV-103(已完成)21 2023© GH Research PLC
ClinicalTrials.gov ID:NCT05163691 21

GH001 給藥第 7 天 GH001 6 mg(n=8+2 安慰劑)GH001 12 mg(n=8+2 安慰劑)GH001 18 mg(n=8+2 安慰劑)HV(n=30)單劑量部分 IDR HV(n=16)GH001 IDR6、12、18 mg 達到 PE(最多 3 劑,間隔 1 小時,n=8)關鍵評估安全藥代動力學 PE 量表認知功能安全認知
功能安全性 22 天 30 GH001 IDR6、12、18 mg 達到 PE(最多 3 劑,間隔 2 小時,n=8)主要終點:甲布弗汀(5-meo-dmt)和布福汀的藥代動力學特徵 2023© GH Research PLC 第一期臨牀
藥理學試驗的設計健康志願者 (GH001-HV-103) HV,健康志願者;體育,峯值體驗;IDR,個性化給藥方案 22

安全審查 No SAEs 所有 ADR 均為輕度所有 ADR 均自發消退吸入耐受性良好
生命參數無明顯變化,但給藥 GH001 後不久心率和血壓暫時無臨牀相關變化心電圖、安全實驗室分析、峯值流量、認知
功能、精神安全性評估,包括 c-SSRS 進一步結果藥代動力學分析和精神作用評估 (PE Scale) 支持將個人之間的間隔縮短至 1 小時IDR 劑量
對於未來的臨牀試驗是可行的
單劑量和 IDR — 安全性及進一步結果 23 SAE,嚴重不良事件;藥物不良反應或 ADR,與確定的、可能的或
可能的研究產品有關聯或缺失代碼的不良事件;IDR,個性化給藥方案;C-SSRS,哥倫比亞自殺嚴重程度評級表;PE,峯值體驗 2023© GH Research PLC ADRs 單劑量 IDR 6 mg (n=8) 12 mg (n=8) 18 mg (n=8) 安慰劑
(n=6) 1h 間隔 (n=8) 1 2h 間隔 (n=8) 2 medDra 首選術語事件數 n n n n n n 異常夢想 1 胸部不適 1 哭泣 2 頭暈 1 口乾
口乾 1 運動障礙 1 疲勞 1 2 1 頭痛 3 1 1 1 感覺減退口服 1 睡意 1 心動過速 2 緊張 1 震顫 1 16 mg
(n=1),6-12-18 mg (n=3);6-12-18 mg (n=3) =4) 26-12 mg (n=3);6-12-18 mg (n=5) 23

耐藥性抑鬱症 GH001-TRD-201 的 2b 期試驗(已啟動)24 2023© GH Research PLC eudract 編號:
2022-000574-26 24
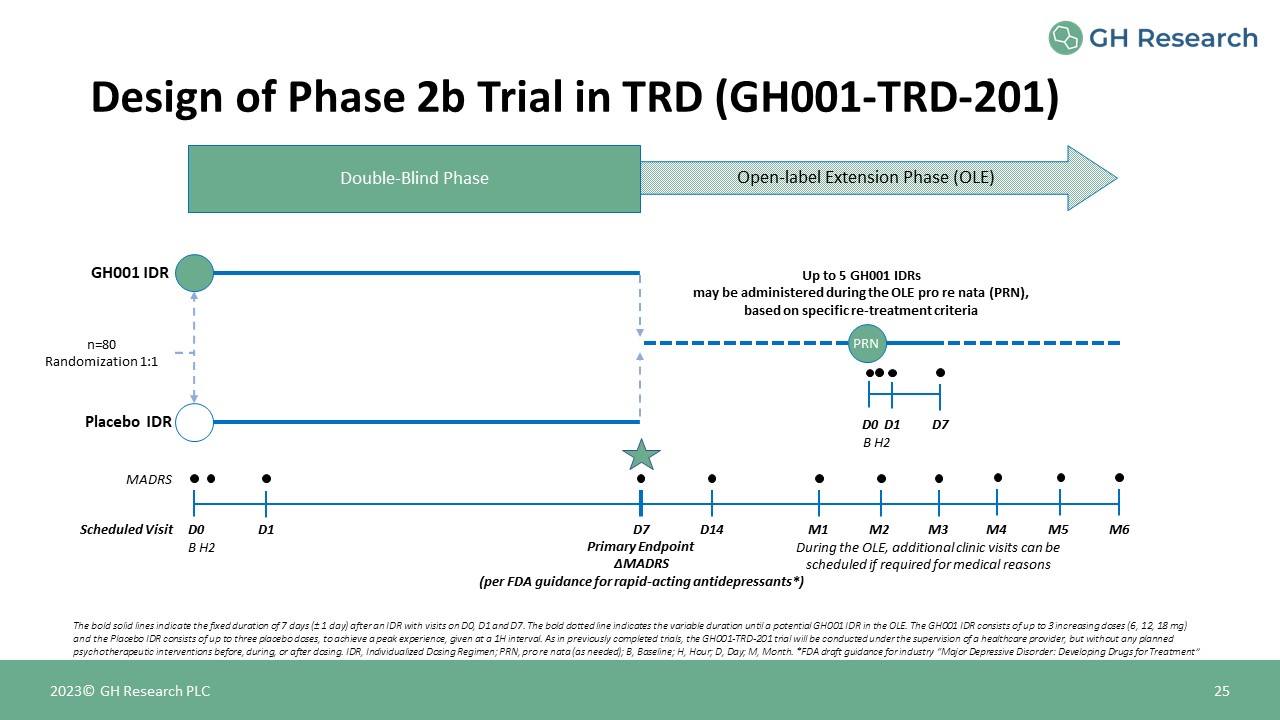
2023© GH Research PLC 25 GH001 IDR 安慰劑 IDR n=80 隨機化 1:1 根據特定的再治療標準 D0 MADRS 主要終點 ΔMADRS(根據美國食品藥品管理局的速效抗抑鬱藥指南*)D1 D7 B H2 定期就診雙盲期開放標籤延長期
(OLE) 粗體實線表示在 D0、D1 和 D7 上進行訪問的 IDR 之後 7 天(± 1 天)的固定時長。GH001粗體虛線表示 OLE 中可能出現 GH001 IDR 之前的可變持續時間。GH001 IDR 包括最多
至 3 次增加劑量(6、12、18 mg),而安慰劑 IDR 包含最多三劑安慰劑,以達到最佳體驗,間隔為 1H。與先前完成的試驗一樣,GH001-TRD-201 試驗將在醫療保健提供者的監督下進行,但在給藥之前、期間或之後不進行任何計劃的心理治療幹預。IDR,個性化給藥方案;PRN,pro re nata(視需要而定);B,基準;H,小時;D,日;M,月。*FDA
行業指南草案 “重度抑鬱症:開發治療藥物” D14 M2 M3 M4 M5 M6 M1 在 OLE 期間,如果出於醫療原因需要,可以安排更多診所就診 D0 D1 D7 B H2 PRN Design
TRD (GH001-TRD-201)

第 1 層:監管排他性 FDA:5 年(+2.5 年 IV 期限)EMA:10 年(新適應證為 +1 年)
第 3 層:TechnicalComplex 生物等效性,具有較高主體內和受試者間變異性的第 2 層:申請的與甲布福汀(5-meo-DMT)相關的專利家族,包括:
各種新用途疾病(包括吸入、鼻腔、頰部、舌下、靜脈注射、靜脈注射、靜脈注射、靜脈注射途徑)物質的新型氣溶膠成分新型製造方法和新型鹽形態新型設備相關方面三層
保護策略 26 2023© GH Research PLC 26

董事會和執行管理層 27 弗洛裏安·舍恩哈廷邁克爾·福爾理學碩士董事會主席,
聯合創始人文學士、法學學士學位董事會副主席 2023© GH Research PLC 德莫特·漢利·鄧肯·摩爾理學士、工商管理碩士、MBA 董事會成員 Theis Terwey PD med Dr.首席執行官、聯合創始人 Julie Ryan ACA、macC、bComm 財務副總裁 Magnus
Halle BSc 愛爾蘭董事總經理、聯合創始人 Aaron Cameron MSc、MBA 技術開發和運營規劃副總裁 Velichka (Villy) Valcheva MD、MSc 臨牀研究和醫學事務副總裁 27

科學顧問 28 邁克爾·塞斯醫學博士
佩雷爾曼醫學院精神病學教授
賓夕法尼亞大學馬杜卡爾·特里韋迪醫學博士
德克薩斯大學西南醫學中心精神病學和人類行為學教授
布朗大學精神病學和人類行為學教授
醫院精神病學系主任巴塞羅那教授 Michael Bauer 教授 dr. rer. nat.醫學博士。
德累斯頓工業大學精神病學和心理治療系主任 Malek Bajbouj 教授醫學博士
柏林慈善機構情感神經科學中心主任 Johannes Ramaekers 教授馬斯特裏赫特大學心理學系和神經科學系
教授 2023© GH Research PLC
科學顧問 28 邁克爾·塞斯醫學博士賓夕法尼亞大學佩雷爾曼醫學院精神病學教授馬杜卡爾·特里維迪醫學博士德克薩斯大學西南醫學中心精神病學教授馬克·齊默爾曼醫學博士布朗大學精神病學和人類行為學教授愛德華·維塔教授巴塞羅那診所
精神病學科主任 Michael Bauer 教授 rer. nat.醫學博士。德累斯頓工業大學精神病學和心理治療系主任 Malek Bajbouj 教授醫學博士柏林查理特情感神經科學中心主任 Johannes
Ramaekers 教授博士馬斯特裏赫特大學心理與神經科學系教授 2023© GH Research PLC 28

預期里程碑和財務概述 GH001 將於 2024 年第三季度在 TRD 完成歐洲多中心、隨機、
雙盲、安慰劑對照的 2b 期試驗的雙盲階段,預計將在 2024 年第三季度或第四季度提供有關美國 IND 臨牀暫停和計劃使用專有氣霧輸送
設備的 1 期臨牀藥理學試驗的最新完成時間表提供最新完成時間表 2024 年第一季度在 BDII 中進行 PPD 的 2a 期試驗 GH002 在健康志願者中完成 1 期臨牀藥理學試驗2023年第四季度 GH003 完成臨牀前開發財務概述截至2023年9月30日,現金、現金等價物、其他金融資產和有價證券為2.287億美元。我們相信,現有的現金、現金等價物、其他
金融資產和有價證券將足以為2026 29年的運營費用和資本支出需求提供資金 2023 年 29 © GH Research PLC 29

在抑鬱症中尋求超快速、持久的緩解 30 2023© GH Research PLC 30