| 納斯達克:PASG © 2023 Passage Bio。版權所有。 兑現 中樞神經系統疾病遺傳醫學的承諾 2023 年 11 月 |
| 2 前瞻性陳述 本演示文稿包括根據1995年《私人證券訴訟法》的安全港條款作出的 “前瞻性陳述”,包括但不限於:我們對預期里程碑的時間和執行的期望,包括我們的臨牀試驗進展和 此類試驗的臨牀數據可用性;我們對合作者和合作夥伴執行關鍵舉措的能力的期望;我們的期望關於我們的 製造計劃以及策略;有關我們現金預測的估計;以及我們的主要候選產品治療各自靶向中樞神經系統 疾病的能力。這些前瞻性陳述可能附有 “目標”、“預期”、“相信”、“可以”、“估計”、“預期”、“預測”、“目標”、 “打算”、“可能”、“可能”、“可能”、“將” 等詞語以及其他具有類似含義的詞語和術語。這些陳述涉及風險和 不確定性,可能導致實際結果與此類陳述中反映的結果存在重大差異,包括:我們為 PBGM01、PBFT02 和未來候選產品開發、獲得監管部門批准 和商業化的能力;臨牀前研究和臨牀試驗的時間和結果; 臨牀前研究或臨牀試驗的積極結果可能無法在後續試驗中複製,也可能無法在早期臨牀試驗中取得成功預測臨牀後期的結果 試驗;與臨牀試驗相關的風險,包括我們充分管理臨牀活動的能力、臨牀試驗期間獲得的額外數據或 分析可能產生的意外擔憂、監管機構可能要求提供更多信息或進一步研究,或者可能無法批准或可能延遲我們的 候選藥物的批准;不良安全事件的發生;未能保護和執行我們的知識產權和其他專有權利;未能成功 實現或實現預期收益的我們的戰略和增長計劃;與技術故障或違規相關的風險;我們依賴合作者 和其他第三方來開發候選產品以及我們業務的其他方面,這些方面超出了我們的完全控制範圍;與 當前和潛在的延遲、停工或供應鏈中斷相關的風險;與當前和潛在的未來醫療改革相關的風險;與 吸引和留住關鍵人員相關的風險;未能遵守法律規定和監管要求;相關風險進入資本和信貸市場;以及我們最近向美國證券交易委員會提交的文件的 “風險因素” 部分中描述的其他 風險和不確定性。這些陳述 基於我們當前的信念和期望,僅代表截至本演講之日。除非法律要求,否則我們沒有義務公開更新任何 前瞻性陳述。通過參加或接受本演講,您承認提醒您不要過分依賴這些前瞻性陳述,這些陳述僅代表截至此類陳述發表之日;您將對自己對 市場和我們的市場地位的評估承擔全部責任;您將自行進行分析,並全權負責對Passage Bio的未來 潛在表現形成自己的看法。 |
| 3 我們的願景 通過 為患有毀滅性中樞神經系統疾病的患者開發變革性 療法 來兑現 遺傳醫學的承諾 FTD 和 GM1 的兩項激動人心的領先基因治療項目 與賓夕法尼亞大學的基因療法項目合作 建立了製造和加工 分析能力 |
| 4 PBFT02 全球 uplift-D 劑量遞增研究下一里程碑 來自三名隊列 1 患者的初始安全性和生物標誌物數據 推進兩項主要臨牀項目 前期痴呆 (FTD) 一種有害的成人中樞神經系統疾病 我們所處的位置 令人鼓舞的數據 } 來自臨牀前 模型 Global Imagine-1 劑量遞增研究 PBGM01 GM1 神經節苷脂症 一種致命的兒科中樞神經系統疾病 下一個里程碑 從劑量 3 到中期的初始安全性和生物標誌物數據 -2024 我們在哪裏 勢頭強勁 ,來自前 8 名接受治療的患者的中期 數據為陽性 以 3 劑量接受治療的首批患者 ,並且 正在積極招募 其他患者 |
| 5 • 候選藥物:PBAL05 • 基因靶標:c9orf72 • 方法:miRNA 和 cDNA 組合 • 20202 年,全球 40% 的家族和 的散發性肌萎縮性側索硬化症病例中有 發現己核苷酸重複 側向 硬化症 (ALS) • 候選藥物:未命名 • 基因靶標:HTT 和 未公開 • 由亨廷頓 (HTT) 基因 的常染色體 顯性三核苷酸 (CAG) 擴張引起 • 估計美國有 41,000 名患者,另有 20 萬名患者面臨風險 3 亨廷頓氏病 成人中樞神經系統疾病臨牀前研究前研究方向 在與賓夕法尼亞大學GTP的戰略合作支持下,賓夕法尼亞大學是尖端AAV基因療法研究領域無與倫比的領導者 • 候選藥物:未命名 • 基因靶點:未公開 • 在美國影響約61.6萬例的常見局灶性癲癇 4 • 沒有通用治療目標 已被識別 顳葉癲癇 (TLE) 1.Majounie 等人《柳葉刀》11:323-33,2012;2.布朗等人,《神經流行病學》55:342-353,2021 3 3.HDSA;Fisher and Hayden,2014 年,Mov Disord。29:105-14。4.Asadi-Pooya 等人,2017 年 World Neurosurg.99:662-666 |
| 6 Discovery uPenn GTP 研究分析 和矢量 工程 過程/分析 開發 通道 CMC 研發實驗室 成熟的分析 能力 開發 GMP 質量控制能力 與 Catalent 端到端臨牀 供應鏈 通過混合方法實現領先的 CMC 能力 外部 製造 合作伙伴關係和 端到端 供應鏈 合作伙伴關係 內部最先進的 CMC 能力 內部合作伙伴關係 確保產品供應,同時保持內部關鍵分析能力 |
| PBFT02 額室痴呆 — GRN |
| 8 FTD-GRN:一種毀滅性的成人病 一種毀滅性的痴呆形式,由 a GRN 基因突變導致 progranlin (PGRN) 缺乏和單倍體功能不全。 大約 5-10% 的 FTD 是 由 GRN 突變引起的。 疾病進展迅速且呈退行性 ,包括言語喪失、表情喪失、 嚴重的行為變化和行動不便。 罕見且服務不足的人羣 ,估計美國患病率約為3,000至6,000名患者。目前沒有批准任何改善疾病的療法 。 |
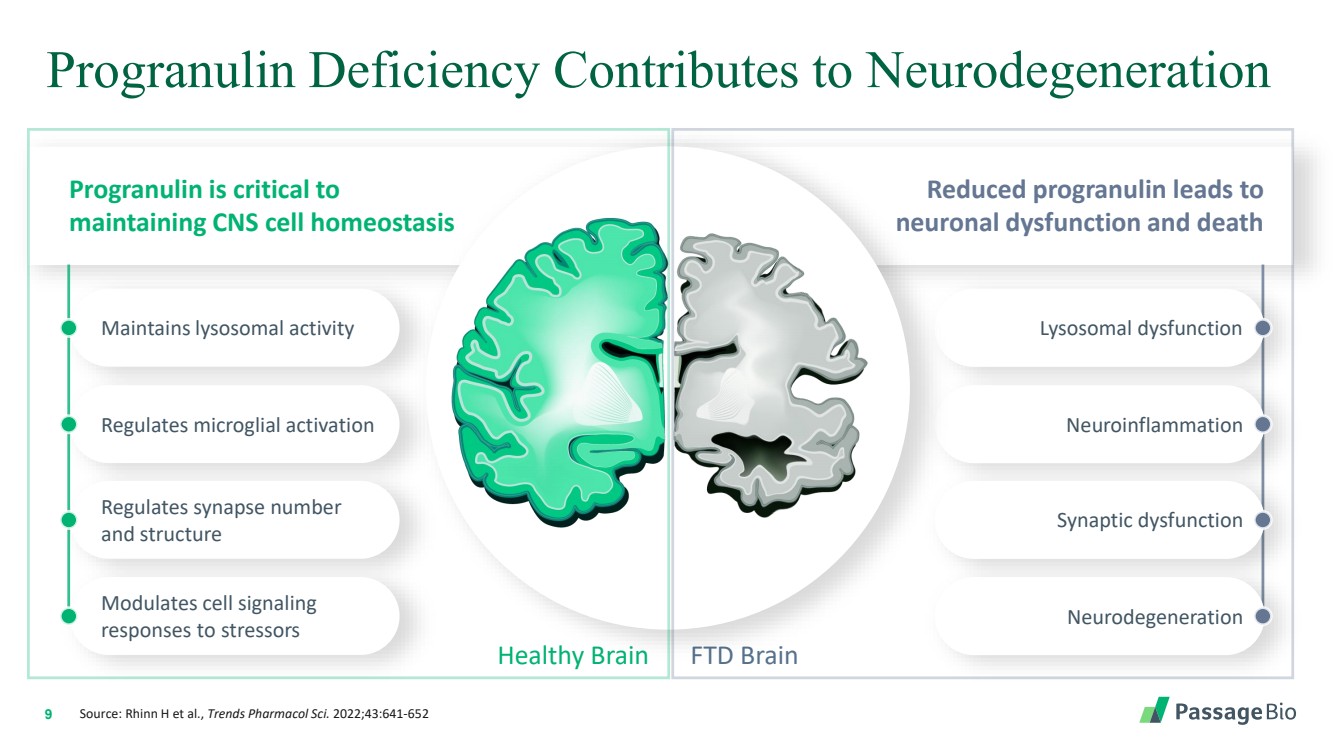
| 9 維持溶酶體活性 顆粒原蛋白缺乏會導致神經退化 Healthy Brain FTD Brain 降低原粒蛋白會導致 神經元功能障礙和死亡 Progranilin 對 維持中樞神經系統細胞動態平衡至關重要 調節突觸數 和結構 調節細胞信號 br} 對壓力源的反應 溶酶體功能障礙 神經炎症 突觸功能障礙 神經變性 來源:Rhinn H 等人,《Trends Pharmacol Sci. 2022》;43:641-652 |
| 10 PBFT02 我們的方法 專有結構提供功能性 GRN 基因編碼原粒蛋白 (PGRN) ,具有一次性基因治療方法的潛在治療益處 臨牀前證據 來自 NHP 研究的令人信服的臨牀前證據 • 大腦的廣泛轉導,包括室管膜細胞的高轉導 • 與水平相比,PGRN 達到超生理學腦脊液水平健康 人類志願者 臨牀發展 • 正在進行的全球 1/2 期 uplift-D 試驗側重於早期症狀 FTD-GRN • 令人鼓舞來自首次接受治療的患者的數據顯示 臨牀前模型的翻譯結果 治療罕見、服務不足的疾病的潛在變革性療法 |
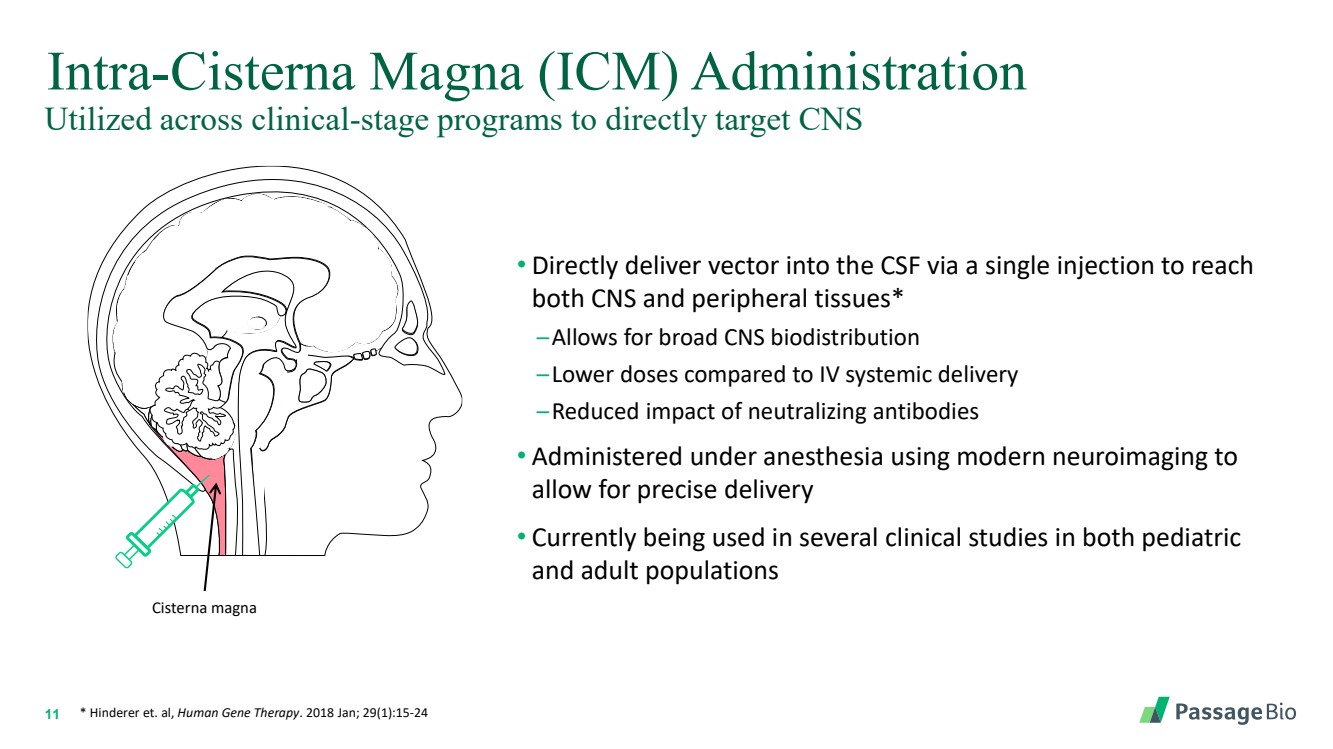
| 11 Cisterna Magna (ICM) 內給藥 • 通過單次注射將載體直接輸送到腦脊液,達到 中樞神經系統和外周組織* —允許廣泛的中樞神經系統生物分佈 —與靜脈注射相比,劑量更低 —減少了中和抗體的影響 • 在麻醉下使用現代神經影像學到 可實現精確輸送 br} • 目前正在兒科 和成人羣體的多項臨牀研究中使用 cisterna magna * Hinderer 等人,《人類基因療法》。2018 年 1 月;29 (1): 15-24在臨牀階段項目中使用,直接靶向中樞神經系統 |
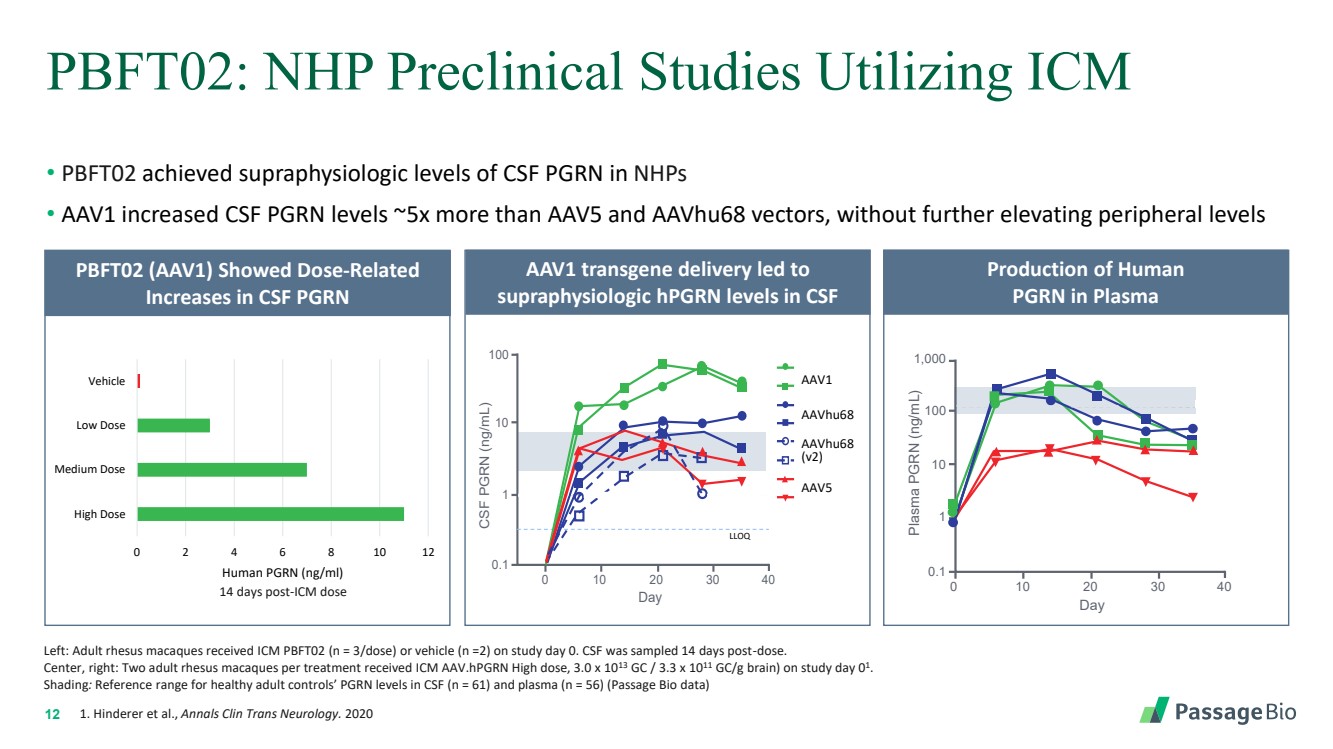
| 12 PBFT02:NHP 臨牀前研究利用 ICM • PBFT02 實現了 NHP 中腦脊液 PGRN 的超生理學水平 • AAV1 將腦脊液 PGRN 水平提高了 AAV5 和 aavHu68 載體的約 5 倍,而外周水平沒有進一步提高 1。Hinderer 等人,Annals Clin Trans Neurology。2020 年左:成年恆河猴在研究第 0 天接受了 ICM PBFT02(n = 3 劑量)或載體(n =2)。腦脊液在給藥 14 天后採樣。 中,右:每次治療有兩隻成年恆河猴在第 1 天接受了 ICM aav.hpgrn 高劑量,3.0 x 1013 GC/3.3 x 1011 gc/g brain)。 陰影:健康成人對照組腦脊液(n = 61)和血漿(n = 56)中的 PGRN 水平的參考範圍(通道生物數據) 血漿中人類 PGRN 的產生 AAV1 轉基因輸送導致 CSF PGRN (ng/mL) 0 20 30 40 CSF 0.1 1 10 100 LLOQ Normal Day RA2981 RA2982 RA3027 RA3153 RA3151 RA3170 RA3155 RA3160 aavHu68 (v2) AAV1 AAV5 br tive e vaVHu68 (v2) AAV1 AVHU68 (v2) 170 RA3155 RA3160 aavhu68 aavHU RA2981 RA2982 RA3027 RA3153 RA3151 RA3170 RA3155 RA3160 RA2981 RA2982 RA3027 RA315368 (v2) AAV1 aavHu68 AAVHU68 (v2) AAV5 AAV1 正常 LLOQ 血漿 Pgrn (ng/mL) 0 20 30 40 0.1 10 100 正常 天 1,000 PBFT02 (AAV1) 顯示劑量增加 F PGRN 0 2 4 6 8 10 12 高劑量 中劑量 低劑量 車輛 人類 PGRN (ng/ml) 給藥後 14 天 |
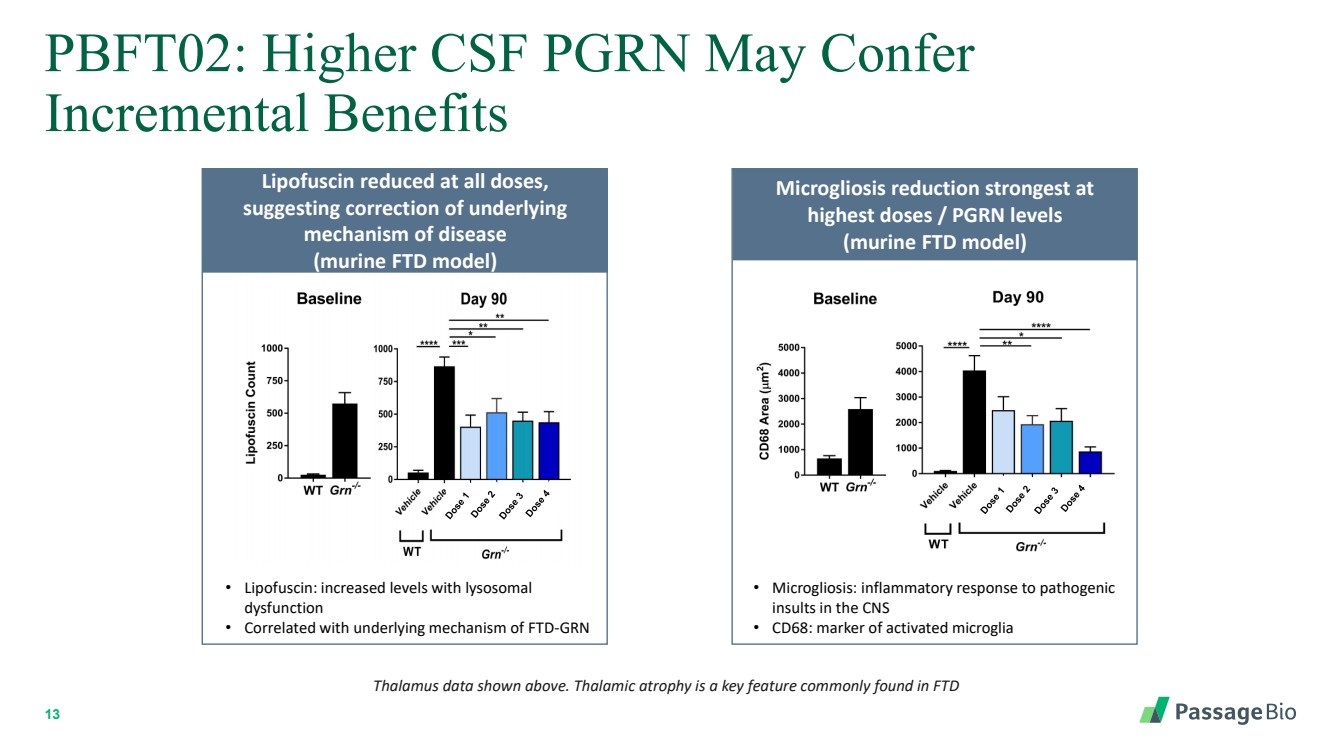
| 13 PBFT02:較高的腦脊液 PGRN 可能帶來 增量益處 最高劑量/PGRN 水平時減少小膠質細胞增多效果最強 (小鼠 FTD 模型) • 小膠質細胞增生症:對中樞神經系統中致病性 損傷的炎症反應 • CD68:激活小膠質細胞的標誌物 丘腦數據。丘腦萎縮是 FTD 中常見的關鍵特徵 脂褐素在所有劑量下都會降低, 提示潛在的 疾病機制得到糾正 (小鼠 FTD 模型) • Lipofuscin:溶酶體 功能障礙水平升高 • 與 FTD-GRN 的潛在機制相關 |
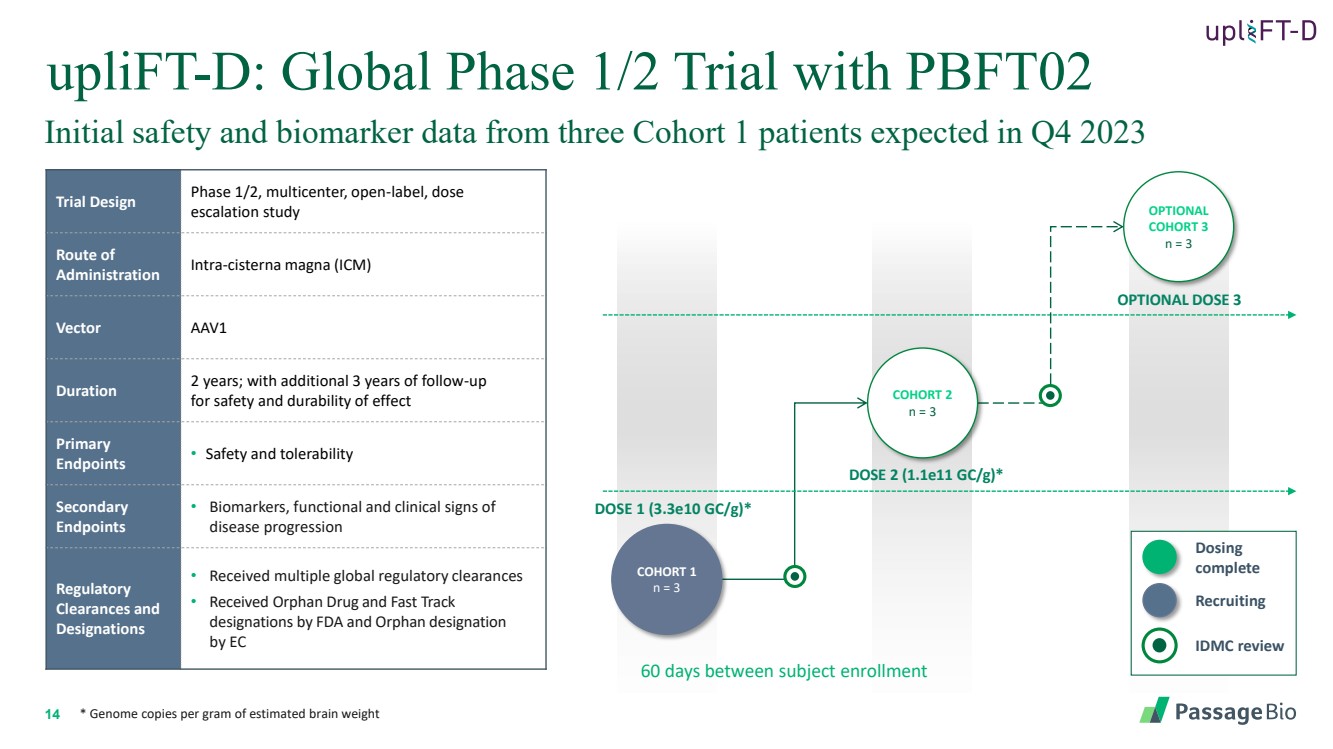
| 14 uplift-D:全球半期試驗,PBFT02 可選劑量 3 劑量 2 (1.1e11 gc/g) * 劑量 1 (3.3e10 gc/g) * 受試者入組 60 天 隊列 1 n = 3 個可選 隊列 3 n = 3 個試驗設計階段 1/2,多中心,開放標籤,劑量 遞增研究 } 給藥途徑 cisterna magna (ICM) Vector AAV1 持續時間 2 年;還有 3 年的隨訪 以保證效果的安全性和持久性 終點 • 安全性和耐受性 次要 終點 • 生物標誌物、功能和臨牀 疾病進展跡象 監管機構 許可和 稱號 • 獲得多項全球監管許可 • 獲得 FDA 孤兒藥和 Fast Track 稱號,以及 EC 的孤兒稱號 * 每克估計腦重的基因組副本 IDMC 審查 招聘 劑量 完成 初始安全以及預計在 2023 年第四季度將從三名 1 隊列患者那裏獲得的生物標誌物數據 |
| PBGM01 GM1 神經節苷酸多症 |
| 16 GM1 神經節苷酸增多症:一種致命的兒科疾病 致命的兒科神經系統溶酶體 貯積症,由 GLB1 基因 突變引起,其特徵是大腦和脊髓 神經元被破壞。 的特徵是快速進行性神經系統 衰退,導致肌肉張力減退、 進行性中樞神經系統功能障礙、耳聾、 失明、僵硬和骨骼發育不良。 罕見且服務不足的人羣 ,全球每 100,000 名 活產兒的發病率高達約 1 例。目前沒有批准任何改善疾病的 療法。 來源:美國國立衞生研究院、CHOP、《美國神經放射學雜誌》 |
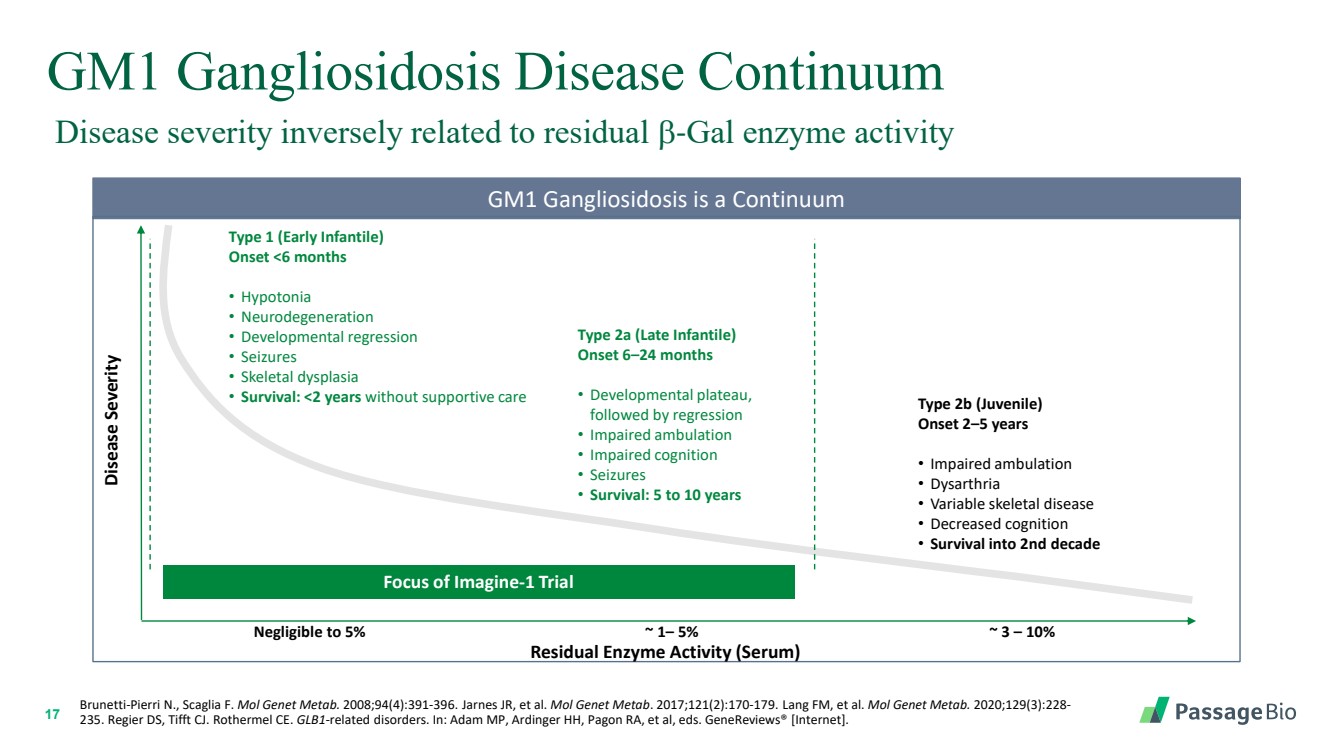
| 17 GM1 神經節苷酸綜合症 Continuum 疾病嚴重程度與殘留 b-gal 酶活性成反比 Brunetti-Pierri N.,Scaglia F. Mol Genet Metab。2008;94 (4): 391-396。Jarnes JR 等人Mol Genet Metab。2017;121 (2): 170-179。Lang FM 等人Mol Genet Metab。2020;129 (3): 228- 235。Regier DS,Tifft CJ。Rothermel CE。GLB1 相關疾病。載於:Adam MP、Ardinger HH、Pagon RA 等人編輯。基因評論® [因特網]。 GM1 神經節苷酸增多症是一種連續性 疾病嚴重程度 殘留酶活性(血清) Imagine-1 試驗的重點 可以忽略到 5% ~ 1— 5% ~ 3 — 10% 1 型(嬰兒早期) 發病率 |
| 18 PBGM01 OUR APPROACH 下一代專有衣殼向大腦和外周組織提供功能性 GLB1 基因編碼 臨牀前證據 在敲除小鼠模型中提供令人信服的臨牀前數據 • 劑量相關組織學校正、神經系統功能、 和存活率 • 中樞神經系統和關鍵外周器官的有意義轉導 全球 1/2 期 Imagine-1 試驗側重於嬰兒早期和晚期 GM1 • 測試的前兩個劑量水平的安全性呈陽性,劑量 2 能夠達到 腦脊液 β-gal 活性和 GM1 神經節苷脂的健康控制水平* 針對罕見、未得到充分治療的疾病的潛在變革性療法 * 基於羣組 1-4 的中期結果 |
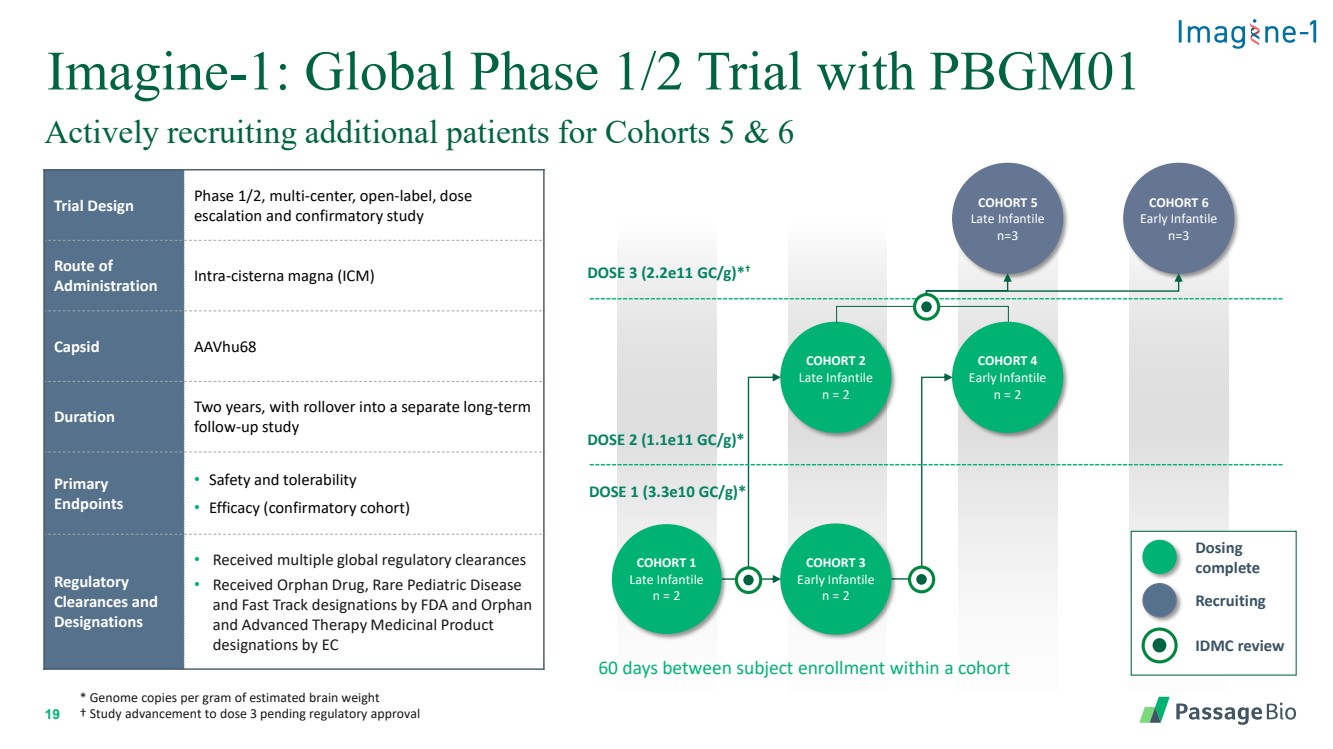
| 19 Imagine-1:PBGM01 的全球 1/2 期試驗積極招募更多患者參加 5 和 6 組試驗設計 1/2 期、多中心、開放標籤、劑量 升級和確認性研究 給藥路線 cisterna magna (ICM) 持續時間兩年,然後延續到單獨的長期 後續研究 終點 br} • 安全性和耐受性 • 療效(確認隊列) 監管許可 許可和 稱號 • 獲得多項全球監管許可 • 收到孤兒藥,FDA 和 Orphan 的罕見兒科疾病 和快速通道稱號以及 EC 隊列的高級療法藥物 隊列 4 早期嬰兒 n = 2 劑量 2 (1.1e11 gc/g) * 劑量 1 (3.3e10 gc/g) * 隊列 6 早期嬰兒 n=3 羣組 5 晚期嬰兒 n=3 COHORT 2 晚期嬰兒 n = 2 羣組 3 早期嬰兒 n = 2 羣組 1 晚期嬰兒 n = 2 IDMC 評論 招聘 給藥 完成 * 每克估計腦重的基因組拷貝 † 研究進展至 3 劑量,等待監管部門批准 隊列中的受試者註冊人數 劑量 3 (2.2e11 gc/g) *† |
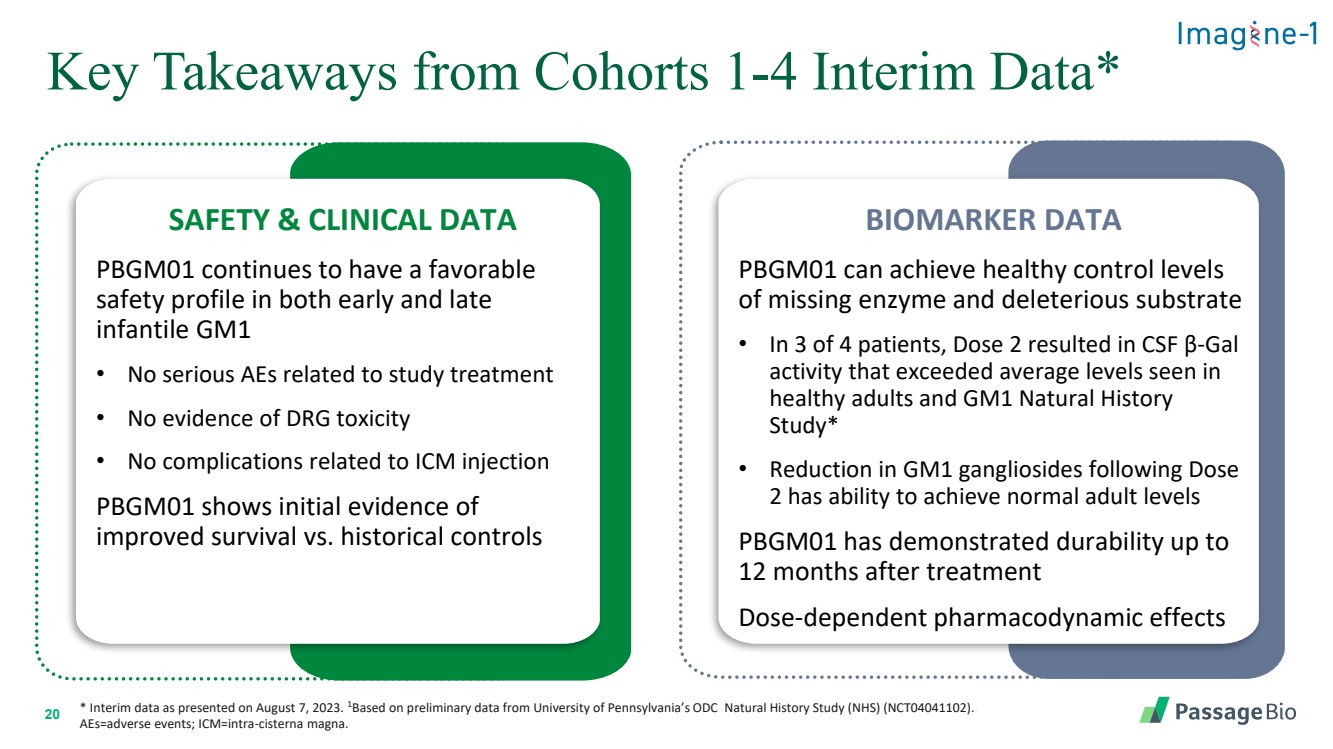
| 20 * 2023 年 8 月 7 日公佈的中期數據。1 基於賓夕法尼亞大學 ODC 自然歷史研究 (NHS) (NCT04041102) 的初步數據。 aes=不良事件;icm=intra-cisterna magna。 來自隊列的關鍵要點 1-4 中期數據* 安全與臨牀數據 PBGM01 在早期和晚期都繼續保持良好的安全性 gm1 • 沒有與研究治療相關的嚴重不良事件 • 沒有證據 DRG 毒性 • 沒有與 ICM 注射相關的併發症 PBGM01 顯示 與歷史相比存活率提高的初步證據對照 BIOMARKER DATA PBGM01 可以達到缺失酶和有害底物的健康控制水平 • 在四分之三的患者中,劑量 2 導致腦脊液 β-gal 活性超過 健康成人和GM1自然史研究中的平均水平 研究* • 劑量 2 後GM1神經節苷脂的減少能夠達到正常的成人水平 PBGM01 在治療 12 個月後表現出耐久性 劑量依賴性藥效學作用 |
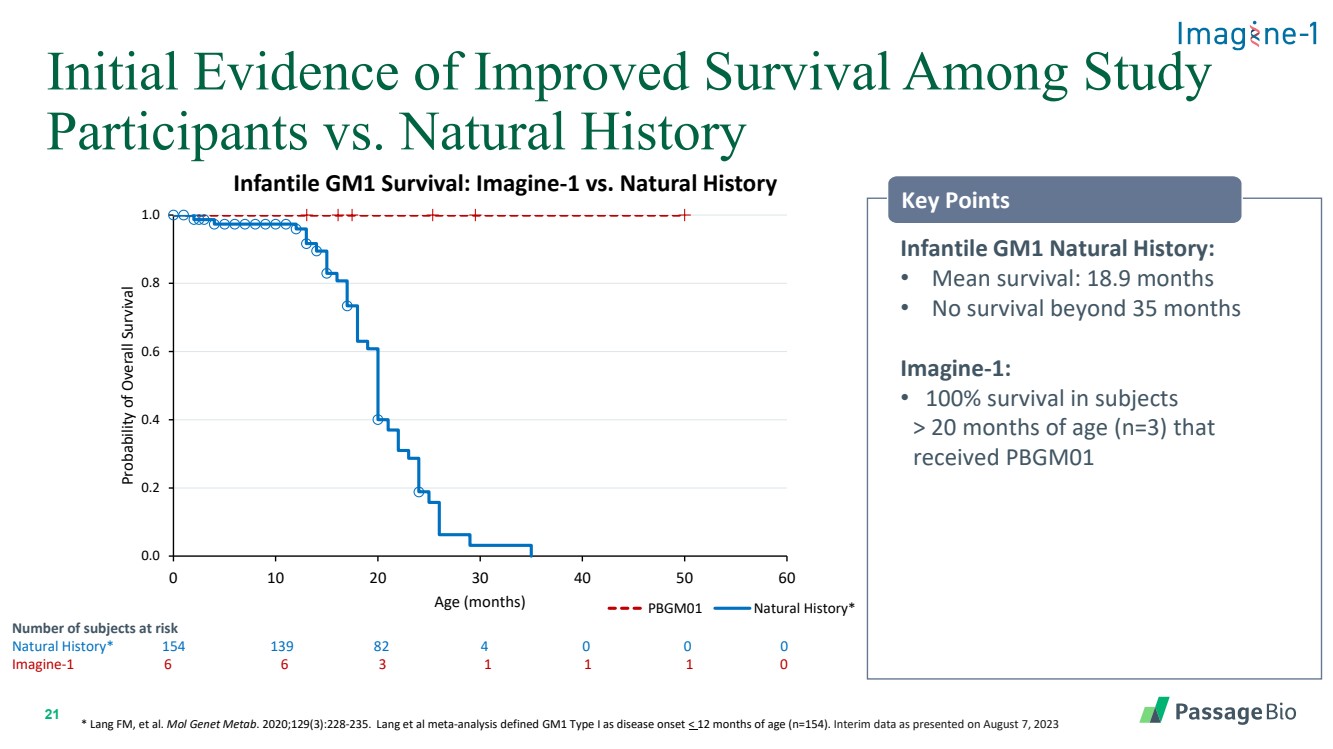
| 21 項研究參與者存活率提高的初步證據 * Lang FM 等人Mol Genet Metab。2020;129 (3): 228-235。Lang 等人的薈萃分析將 GM1 I 型定義為 獲得 PBGM01 要點的 20 個月大(n=3)發病 |
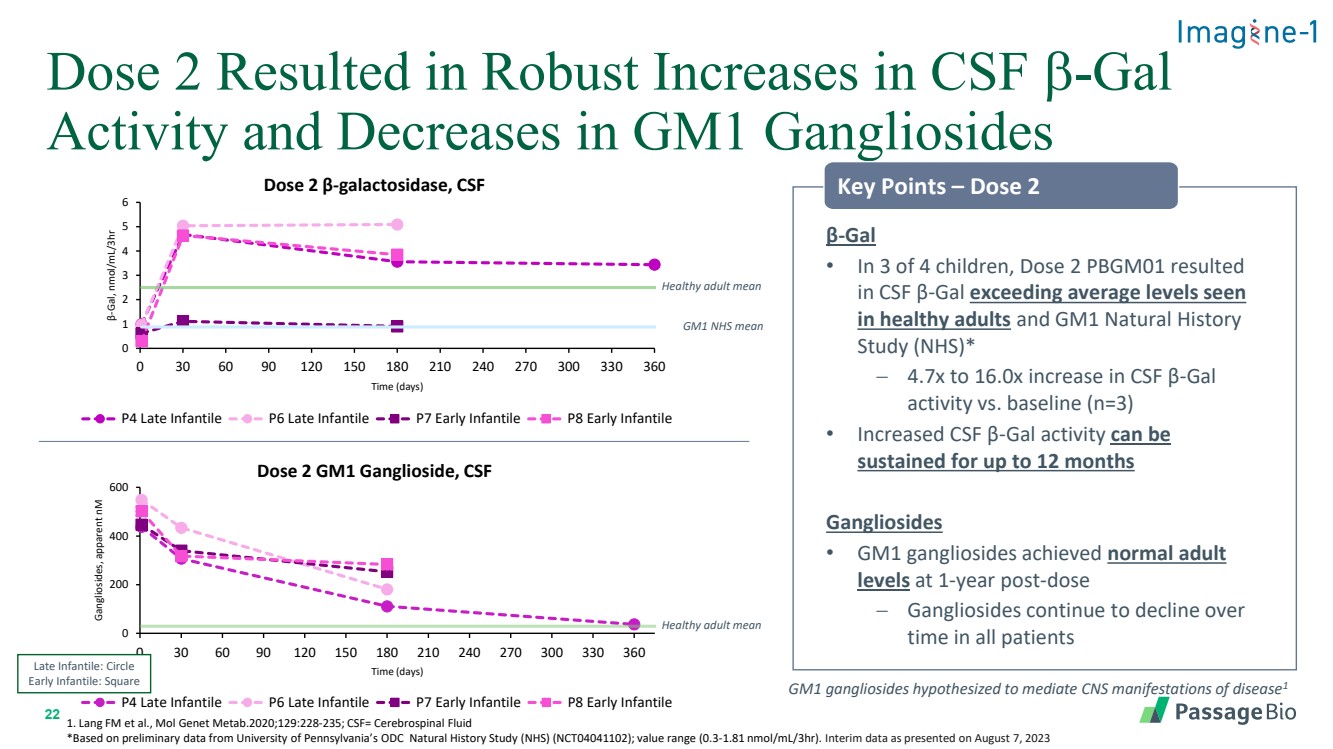
| 22 劑量 2 導致腦脊液 b-gal 活性大幅增加並降低 GM1 神經節苷脂 0 200 400 600 60 90 120 150 210 240 300 330 360 神經節苷脂,表觀值 nM 時間(天) 劑量 2 GM1 神經節苷酸,CSF P4 晚期嬰兒 P6 晚期嬰兒 P7 幼兒 P8 Early Infantile β-gal • 在四分之三的兒童中,劑量 2 PBGM01 導致 腦脊液 β-gal 超過健康成年人和 GM1 自然史 研究 (NHS) * -腦脊液 β-gal 活性與基線相比增加 4.7 倍至 16.0 倍 (n=3) • F β-Gal 活性可持續 長達 12 個月 galliosides • GM1 神經節苷在服藥 1 年後達到正常的成人 水平 − 所有患者的神經節苷脂在 時間內持續下降健康成人平均值 1。Lang FM 等人,Mol Genet Metab.2020;129:228-235;CSF= 腦脊液 *基於賓夕法尼亞大學 ODC 自然歷史研究 (NHS) (NCT04041102) 的初步數據;值範圍(0.3-1.81 nmol/ml/3HR)。2023 年 8 月 7 日公佈的中期數據 GM1 神經節苷脂假設可以介導疾病的中樞神經系統表現1 0 1 2 3 4 5 6 0 30 60 90 120 150 240 270 300 330 β-gal,nmol/ml/3HR 時間(天) 劑量 2 β-半乳糖苷酶,CSF P4 晚期 Infantile P7 Early Infantile P8 Early Infantile Early Infantile Early Infantile pointile:Circle Early Infantile:Square |
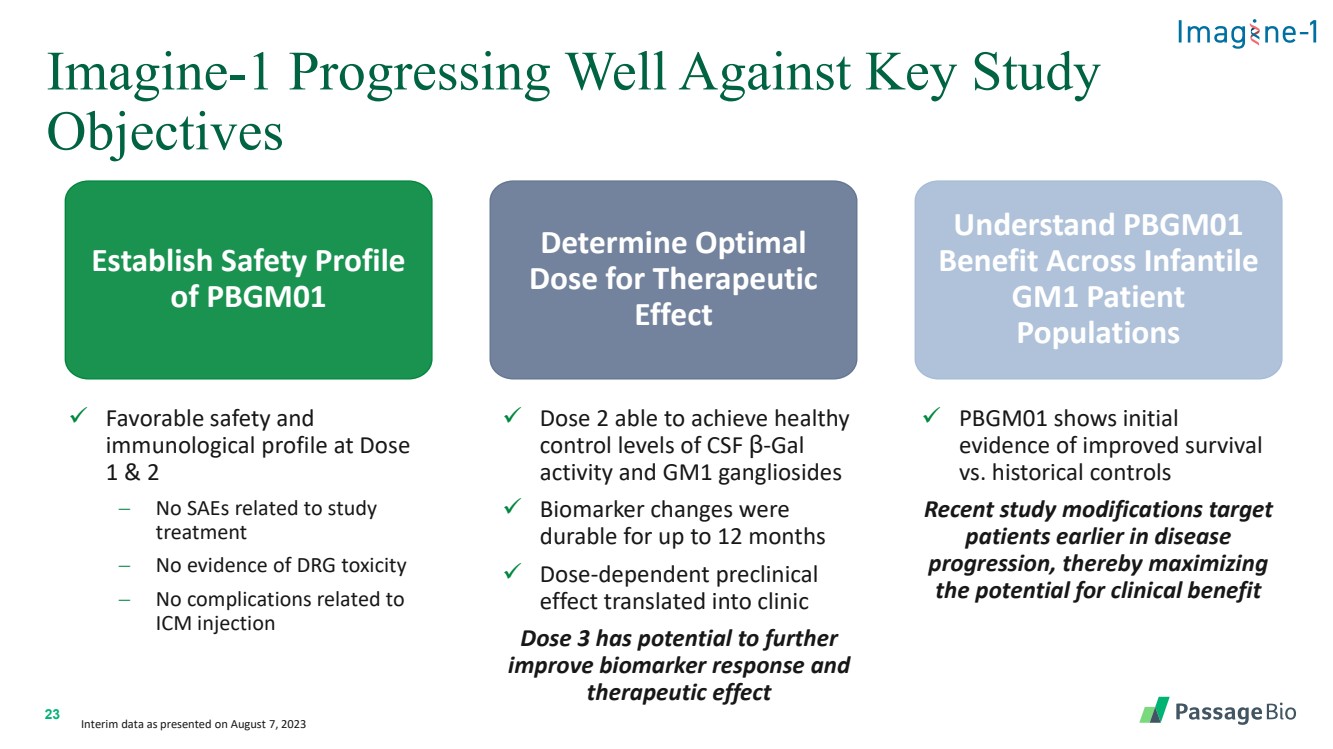
| 23 Imagine-1 在關鍵研究中進展良好 目標 建立 PBGM01 的安全性檔案 確定治療效果的最佳 劑量 瞭解 PBGM01 對嬰兒 患者 人羣 人羣 人羣 的益處 ✓ 良好的安全性和 劑量下的免疫學特徵 -沒有證據 DRG 毒性 − 無與 ICM 注射有關的併發症 ✓ 劑量 2 能夠達到健康的 控制腦脊液 β-gal 活性水平和 GM1 神經節苷脂 ✓ 生物標誌物變化最多可持續 12 個月 ✓ 劑量依賴性臨牀前 效應轉化為臨牀 劑量 3 有可能進一步 改善生物標誌物反應, ✓ PBGM01 顯示出 與歷史對照組相比存活率提高 的初始證據 。如 2023 年 8 月 7 日發佈的那樣 |
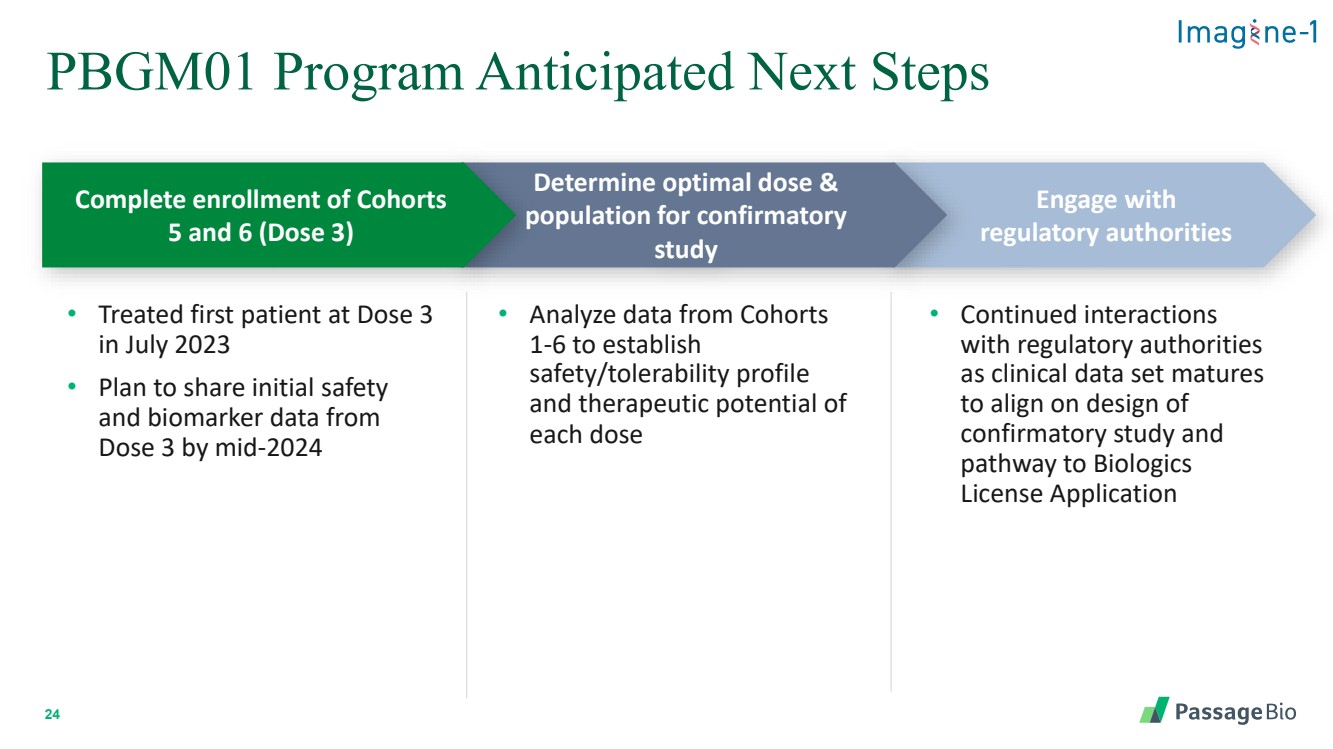
| 24 PBGM01 計劃預計下一步行動 • 2023 年 7 月首例劑量 3 的患者接受治療 • 計劃在 2024 年中期之前共享 劑量 3 的初始安全性 和生物標誌物數據 • 分析來自同組 1-6 的數據,以確定 每劑 的安全性/耐受性概況 和治療潛力 • 作為臨牀數據與監管機構 設定成熟度 ,使 確認性研究的設計和 獲得生物製劑 許可證申請的路徑保持一致 與 監管機構合作 確定最佳劑量和 人羣確認性 研究 完成羣組 5 和 6(劑量 3)的入組 |
| 展望未來 |
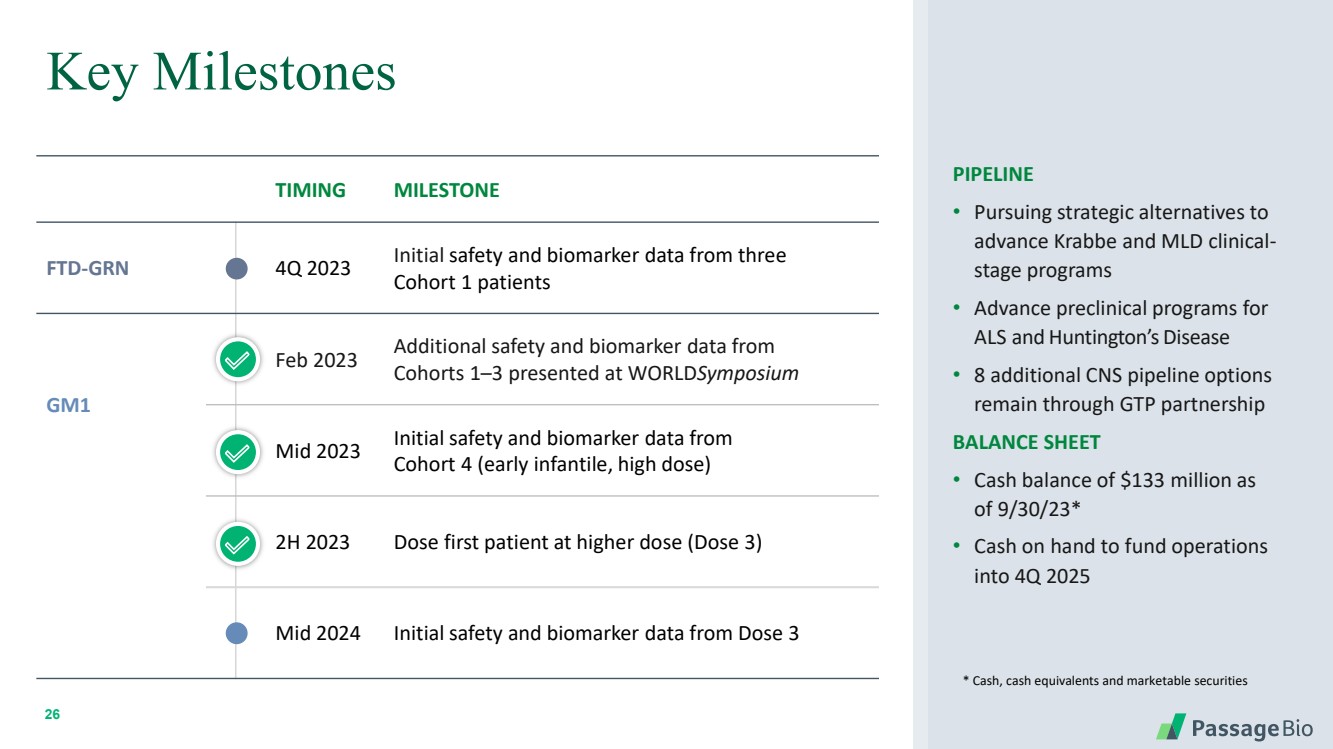
| 26 Timing Milestone FTD-GRN 2023 年第 4 季度來自三名 隊列 1 患者的初始安全性和生物標誌物數據 GM1 2023 年 2 月來自 羣組 1—3 的其他安全性和生物標誌物數據 2023 年中期來自 隊列 4(幼兒,高劑量) 2H 2023 給藥第一位患者更高劑量(劑量 3) 2024 年中期來自劑量 3 的初始安全性和生物標誌物數據關鍵里程碑 PIPELINE • 尋求 的戰略替代方案推進 Krabbe 和 MLD 臨牀階段項目 • 推進 的臨牀前項目ALS 和亨廷頓氏病 • 另外 8 箇中樞神經系統管道期權 仍有待通過 GTP 合作伙伴關係 資產負債表 • 現金餘額為 1.33 億美元/23 年 9 月 30 日* • 用於為 2025 年第四季度運營提供資金的手頭現金 * 現金、現金等價物和有價證券 |
| 27 Our Vision To fulfill the promise of genetic medicine by developing transformative therapies for people with devastating CNS diseases Two exciting lead gene therapy programs in FTD and GM1 Innovative research partnership with Penn’s Gene Therapy Program Established manufacturing and process analytics capabilities Strong cash position with runway into 4Q 2025 |
| Thank You passagebio.com | NASDAQ GS: PASG |
| 29 Demonstrated Leadership LEADERSHIP TEAM Deep experience in rare disease, CNS disorders and genetic medicines Chip Cale General Counsel & Corporate Secretary Eden Fucci SVP Technical Operations BOARD OF DIRECTORS Maxine Gowen, Ph.D. Chairwoman Athena Countouriotis, M.D. Avenzo Therapeutics Derrell Porter, M.D. cTRL Therapeutics Dolan Sondhi, Ph.D. Weill Cornell Medicine Sandip Kapadia Harmony Biosciences Saqib Islam, J.D. SpringWorks William Chou, M.D. President & Chief Executive Officer William Chou, M.D. President & Chief Executive Officer Stuart Henderson SVP Corporate Development & Investor Relations Kathleen Borthwick SVP Finance & Interim CFO Mark Forman, M.D., Ph.D. Chief Medical Officer |