

開發解決癌症免疫耐藥性的下一代免疫療法 KA(納斯達克)2023 年 11 月附錄 99.2

免責聲明和其他信息關於前瞻性陳述的警示聲明本演示文稿包含1995年《私人證券訴訟改革法》所指的 “前瞻性陳述”。使用但不限於 “相信”、“期望”、“估計”、“計劃”、“打算”、“未來”、“潛力”、“繼續”、“可能”、“可能”、“計劃”、“將”、“應該”、“尋求”、“預期” 或 “可能” 等詞語以及其他類似的詞語或表達方式旨在識別前瞻性陳述。前瞻性陳述既不是歷史事實,也不是對未來表現的保證。相反,它們基於Kineta當前對Kineta業務未來、未來計劃和戰略、臨牀結果和其他未來狀況的信念、預期和假設。新的風險和不確定性可能會不時出現,因此不可能預測所有風險和不確定性。對任何此類前瞻性陳述的準確性不作任何陳述或保證(明示或暗示)。此類前瞻性陳述存在許多重大風險和不確定性,包括但不限於:Kineta的資本是否足以支持其未來運營(包括其完成先前披露的第二批私募配售的能力)及其成功啟動和完成臨牀試驗的能力;預測Kineta候選產品開發的時間和成本的困難;Kineta研究、開發和商業化其當前和未來的計劃候選產品,包括但不限於 KVA12123;Kineta 計劃中的臨牀前研究和臨牀試驗的時間和預期結果,以及 Kineta 的臨牀前研究和臨牀試驗結果可能無法預測未來與未來研究或臨牀試驗相關的結果的風險;Kineta 臨牀試驗數據可用的時間;任何計劃中的研究性新藥申請或新藥申請的時間;停止或延遲任何正在進行的研究性新藥申請或新藥申請的風險或計劃對Kineta或其進行臨牀試驗合作者;Kineta候選產品的臨牀效用、潛在收益和市場接受度;Kineta的商業化、營銷和製造能力及戰略;與Kineta競爭對手及其行業相關的發展和預測;政府法律法規的影響;Kineta計劃與監管機構互動的時間和結果;Kineta保護其知識產權地位的能力;Kineta對未來收入、支出、資本要求和額外需求的估計融資;2023年4月和2023年10月完成的註冊直接發行所得收益的預期用途;以及Kineta於2023年3月31日向美國證券交易委員會(“SEC”)提交的最新10-K表年度報告和2023年5月11日和2023年8月11日向美國證券交易委員會提交的10-Q表季度報告以及關於潛在風險、不確定性和其他問題的討論中以 “風險因素” 為標題列出的風險 Kineta隨後向美國證券交易委員會提交文件中的重要因素。任何前瞻性陳述僅代表其發表之日。除非法律要求,否則Kineta沒有義務公開更新或修改任何前瞻性陳述,無論是由於新信息、未來事件還是其他原因。

KVA12123:在TME 1/2期臨牀研究中,VISTA阻斷單抗以解決免疫抑制問題,該研究評估了晚期實體瘤中單獨使用 KVA12123 以及與pembrolizumab聯合治療的初始單一療法數據:清除了前 3 個隊列,無劑量限制毒性,VISTA 受體佔有率> 90% 臨牀前抗 CD27 激動劑 maB 以解決耗盡的 T 細胞預計現金流將持續到 2025 年初* 1,030 萬股流通股(KA:納斯達克)4QQ 23:初始單一療法療效數據 2Q24:其他單一療法安全性和療效數據 2Q24:初始聯合療法數據以先天免疫為重點的管道預期 KVA12123 催化劑的財務狀況 Kineta 正在開發解決癌症免疫抵抗問題的下一代免疫療法,潛在的里程碑付款約為 13 億美元,加上淨銷售額的特許權使用費 *包括截至第 23 季度的 780 萬美元現金、10 月 23 日收到的 300 萬美元默沙東裏程碑款項以及預計於 4 月 24 日完成的 2250 萬美元的 PIPE 融資
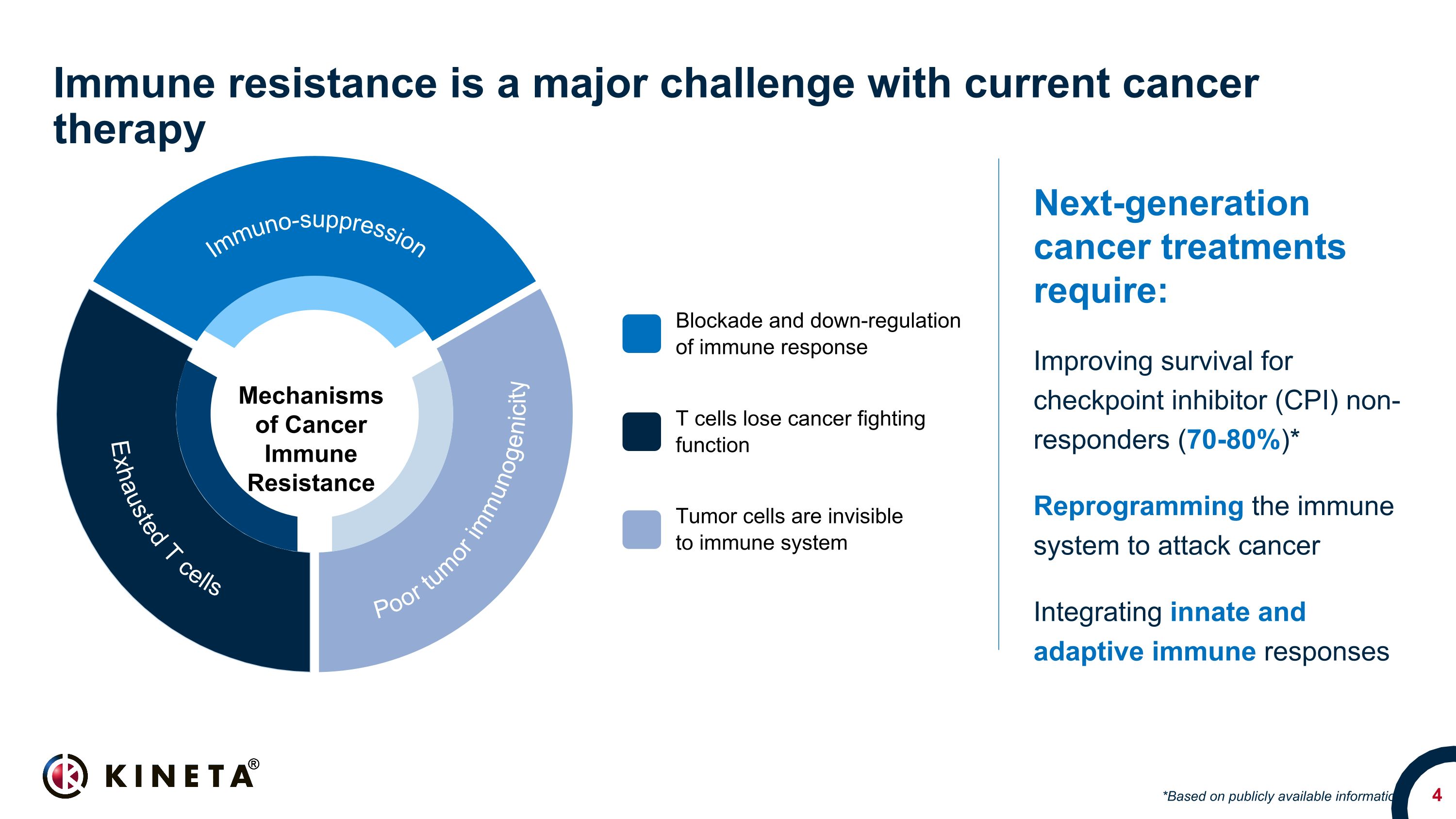
免疫耐藥性是當前癌症治療面臨的主要挑戰下一代癌症治療需要:提高檢查點抑制劑(CPI)無應答者的存活率(70-80%)* 重新編程免疫系統以攻擊癌症整合先天和適應性免疫反應 *基於公開信息 T細胞失去抗癌功能腫瘤免疫抵抗機制腫瘤免疫原性差免疫抑制

Kineta 產品線整合了先天免疫和適應性免疫以解決抗癌機制先天免疫參與癌症早期反應參與適當適應性免疫的必要驅動因素抗癌的重要原因適應性免疫大多數競爭對手的藥物開發僅專注於 T 細胞適應性免疫固有免疫適應性免疫樹突狀細胞巨噬細胞巨噬細胞嗜酸性粒細胞 basphil Natural Killer tcell B 細胞抗體 CD4 T 細胞 CD8 T 細胞 ab T 細胞
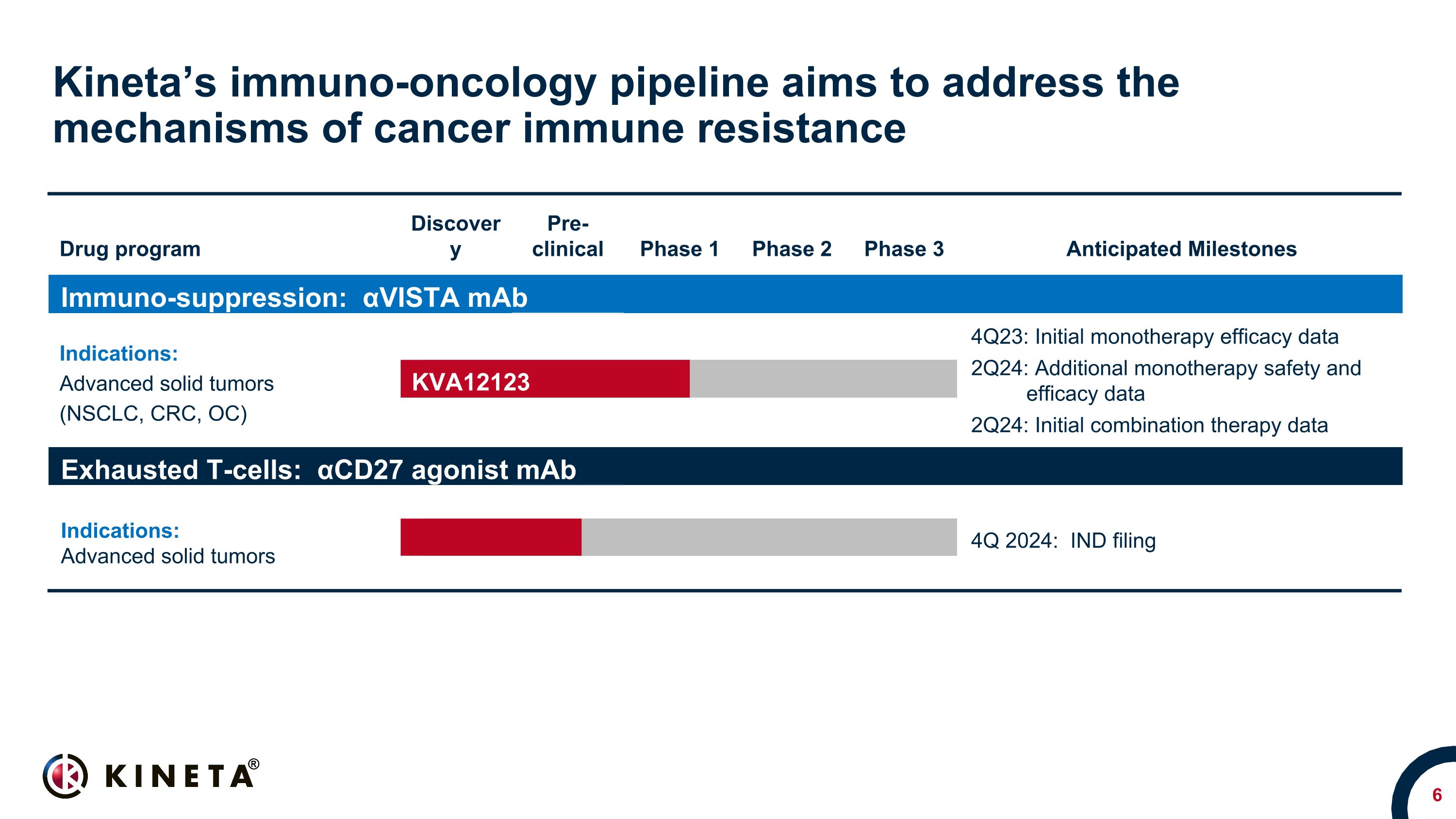
Kineta 的免疫腫瘤學產品線旨在解決癌症免疫耐藥藥物項目的機制臨牀前 1 期 2 期 3 期預期里程碑免疫抑制:αVista 單抗適應症:晚期實體瘤(NSCLC、CRC、OC)晚期實體瘤 NSCLC、CRC、OC 和 SCCHN* 4Q23:單一療法初始療效數據 2Q24:其他單一療法安全性和有效性數據 2Q24:初始組合治療數據耗盡 T 細胞:αCD27 激動劑 maB 適應症:晚期實體瘤晚期實體瘤 2024 年第四季度:IND 申報 KVA12123

kva12123 潛在的差異化 VISTA 阻斷免疫療法

VISTA 是腫瘤微環境中免疫抑制的關鍵驅動因素骨髓細胞上表達的免疫抑制蛋白在包括肺癌、結腸癌和卵巢癌在內的感冒腫瘤中高度表達 CPI 治療後預後上調與治療失敗相關人類腫瘤中 VISTA 陰性 Brown 染色表明 VISTA 表達 VISTA 患者存活率在 pembrolizizi 期間黑色素瘤患者 VISTA 表達增加 umab 復發/進展 2 參考文獻:1.Kuklinski 等人。2018;2.Kakavand 等人。2017
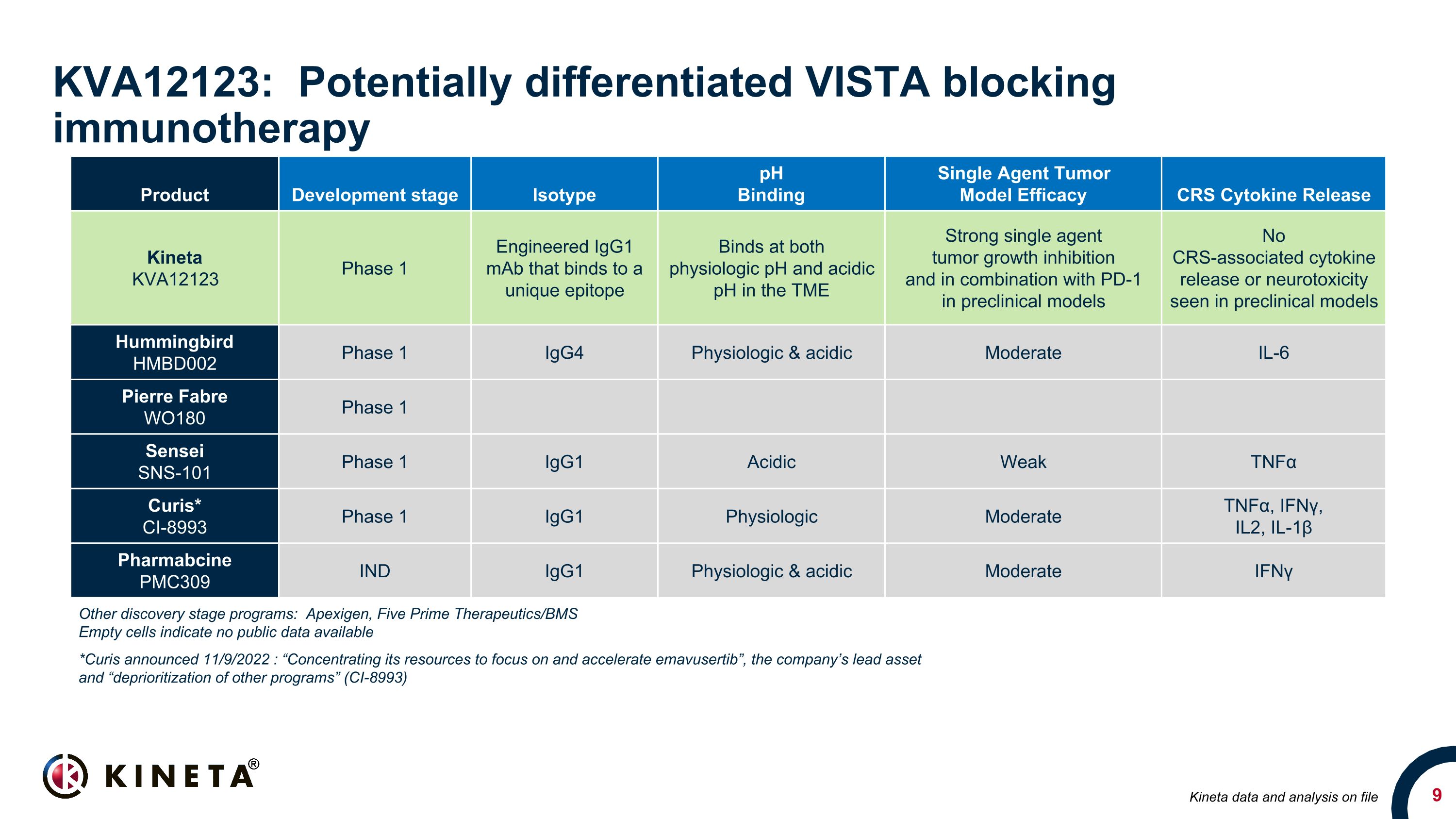
KVA12123:潛在差異化 VISTA 阻斷免疫療法產品開發階段同型 pH 結合單劑腫瘤模型功效 CRS 細胞因子釋放 Kineta KVA12123 1 期工程化的 IgG1 單抗結合獨特的表位在 TME 的生理 pH 值和酸性 pH 值下結合強烈的單藥腫瘤生長抑制以及在臨牀前模型中與 PD-1 聯合使用臨牀前模型中未出現與 CRS 相關的細胞因子釋放或神經毒性模型 Hummingbird HMBD002 第 1 期 IgG4 生理學和酸性中度 IL-6 Pierre Fabre WO180 第 1 階段 SenseiSNS-101 第 1 期 Igg1 酸性弱腫瘤壞死因子 α Curis* CI-8993 第 1 期 Igg1 生理中度腫瘤壞死因子 α、IFNγ、IL-1β Pharmaccine PMC309 IND Igg1 生理和酸性中度 IFNγ其他發現階段項目:Apexigen、Five Prime Therapeutics/BMS 空細胞表示沒有可用的公開數據 *Curis 於 2022 年 9 月 11 日宣佈:“將其資源集中於關注並加速公司的主要資產 “emavusertib” 和 “降低其他程序的優先級” (CI-8993) Kineta 數據和存檔分析
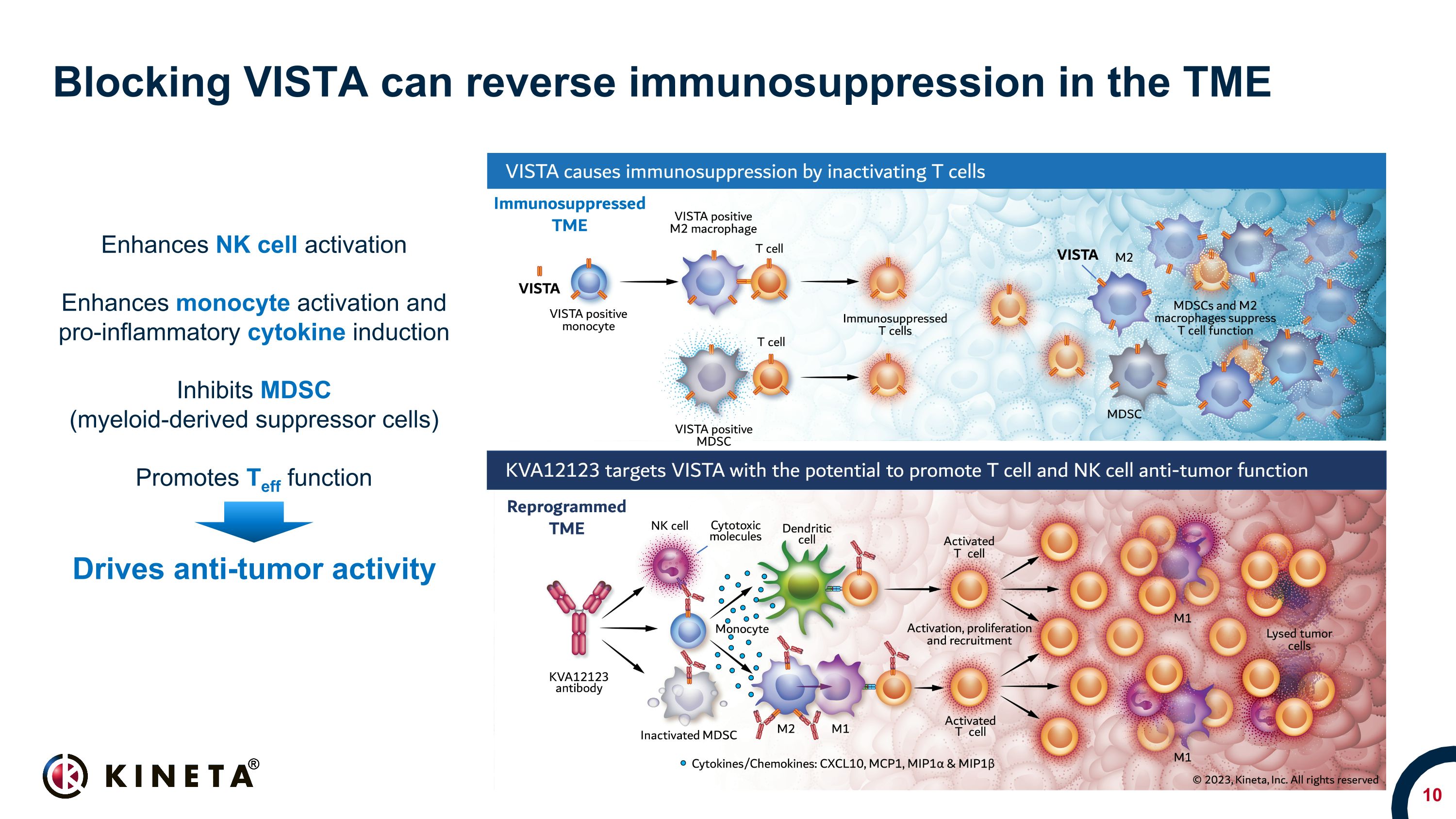
阻斷 VISTA 可以逆轉 TME 中的免疫抑制增強 NK 細胞活化增強單核細胞激活和促炎細胞因子誘導抑制 MDSC(髓系衍生抑制細胞)促進 Teff 功能推動抗腫瘤活性
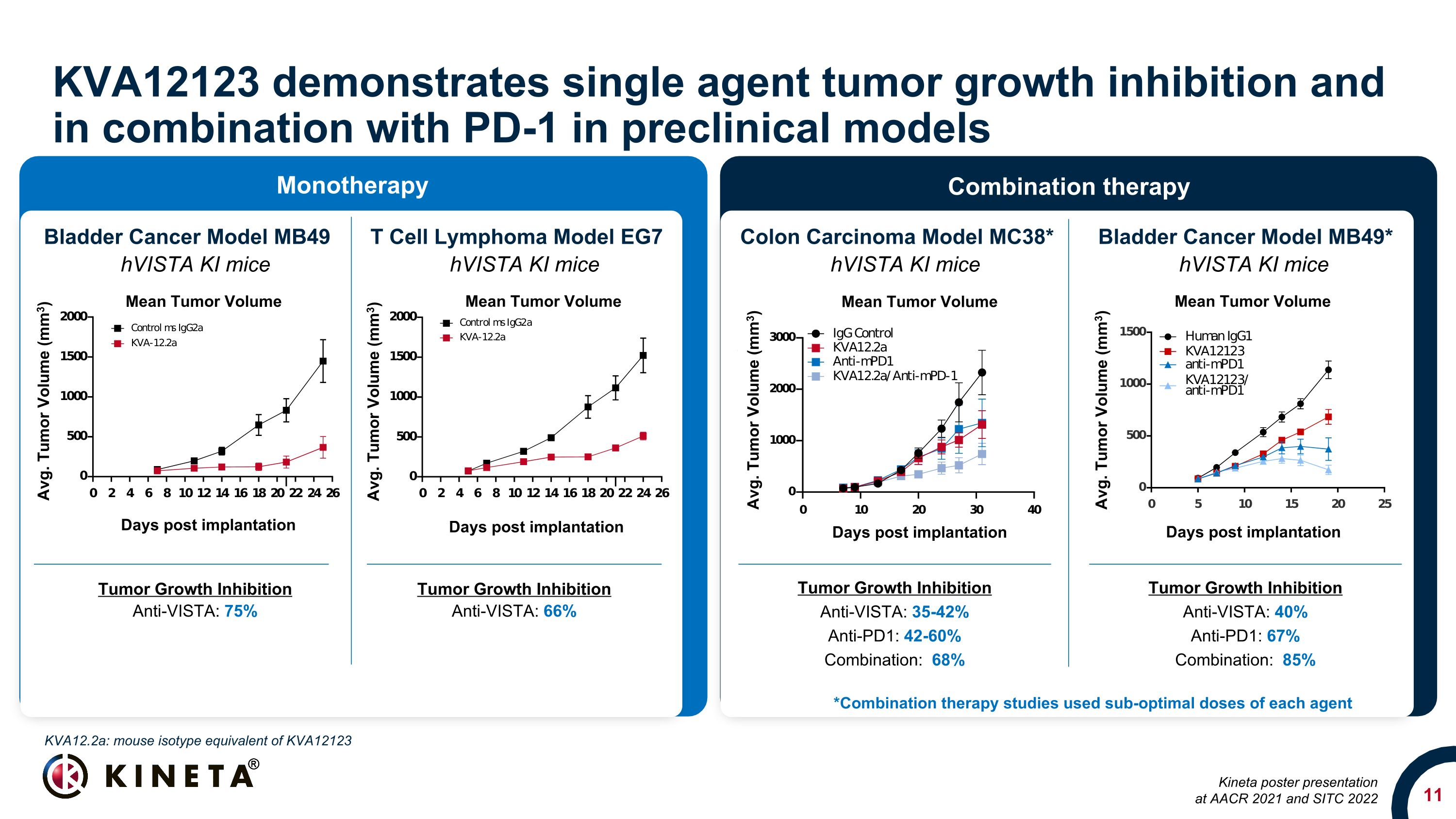
KVA12123 表現出單藥腫瘤生長抑制作用,在臨牀前模型中與 PD-1 聯合使用腫瘤生長抑制劑 Anti-Vista:35-42% 抗 PD1:42-60% 組合:68% 結腸癌模型 MC38* 膀胱癌模型 MB49 T 細胞淋巴瘤模型 MB49* HVista KI 小鼠腫瘤生長抑制抗Vista:40% Anti-PD1:67% 組合:85% 腫瘤生長抑制劑 AntiVista:75% 腫瘤生長抑制劑 AntiVista:66% *聯合療法研究使用了每種藥物的次優劑量kva12.2a:小鼠同型相當於 KVA12123 Kineta 海報在 AACR 2021 和 SITC 2022 單一療法聯合療法植入後平均腫瘤體積天數平均值。腫瘤體積 (mm3) 植入後平均腫瘤體積天數腫瘤體積 (mm3) 平均值腫瘤體積 (mm3) 植入後天數平均值腫瘤體積 (mm3) 植入後平均腫瘤體積天數腫瘤體積 (mm3) 平均腫瘤體積
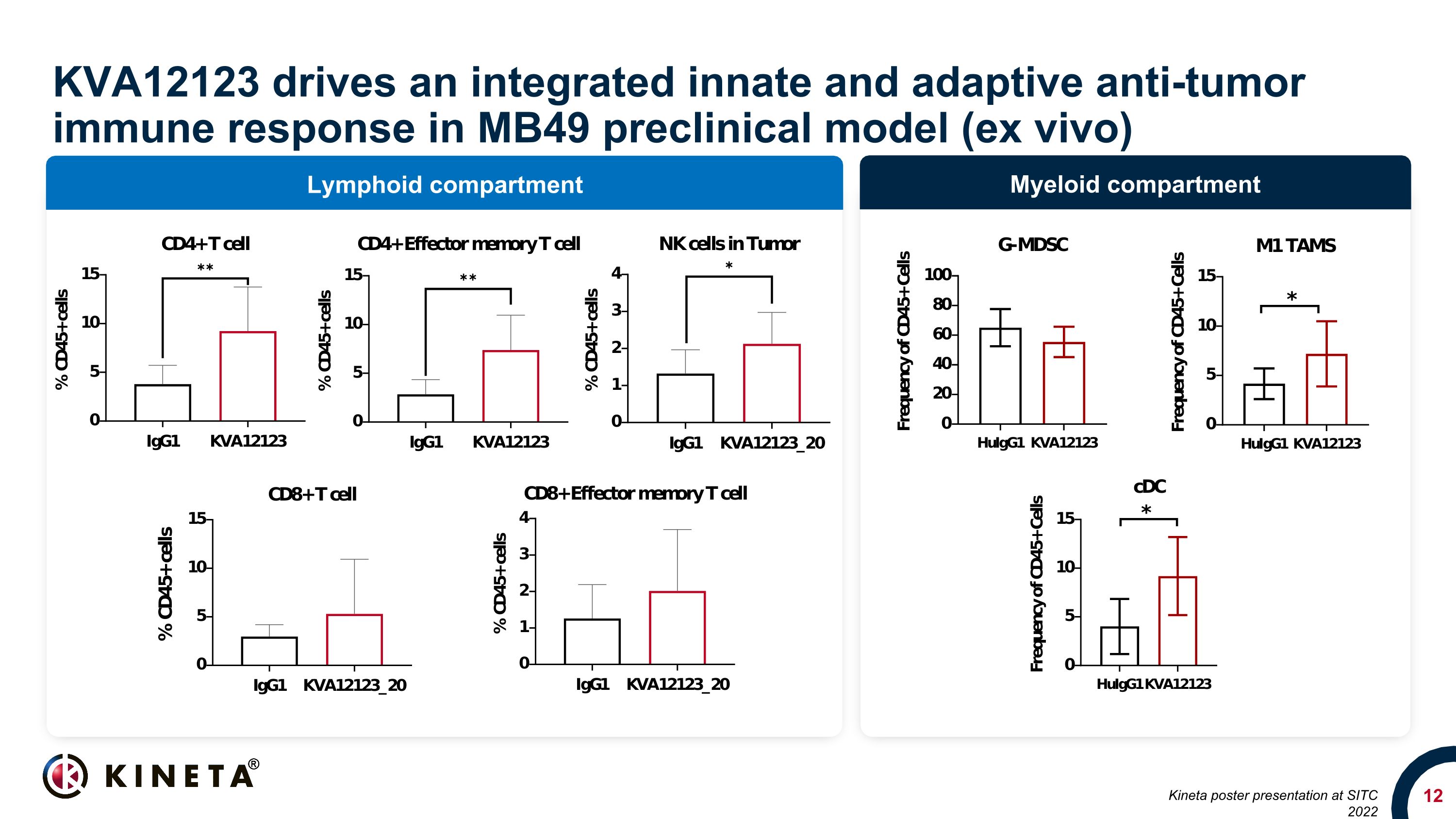
骨髓隔室 Lymphoid 隔間 KVA12123 在 MB49 臨牀前模型(體外)中推動 Kineta 海報在 SITC 2022 上發佈的綜合先天和適應性抗腫瘤免疫反應
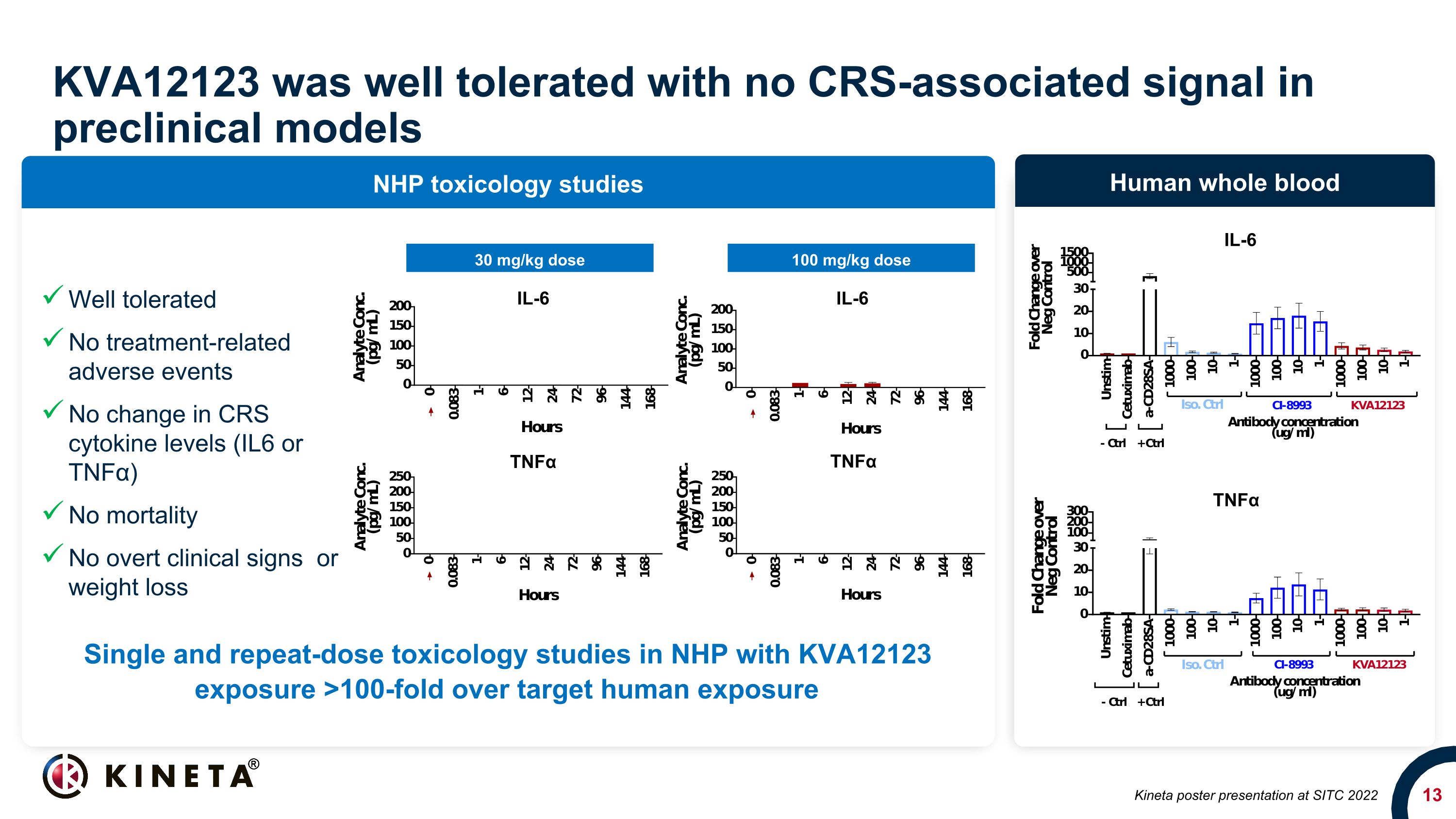
KVA12123 耐受性良好,臨牀前模型中沒有 CRS 相關信號 NHP 毒理學研究人類全血 30 mg/kg 劑量 100 mg/kg 劑量 TNFα IL-6 Kineta 海報在 SITC 2022 上進行單劑量和重複劑量毒理學研究中 KVA12123 暴露量比目標人體暴露量高出 100 倍耐受性良好無治療相關不良事件 CRS 細胞因子水平(IL6 或 TNFα)無死亡率沒有明顯的臨牀症狀或減肥 IL-6 IL-6 TNFα 腫瘤壞死因子α
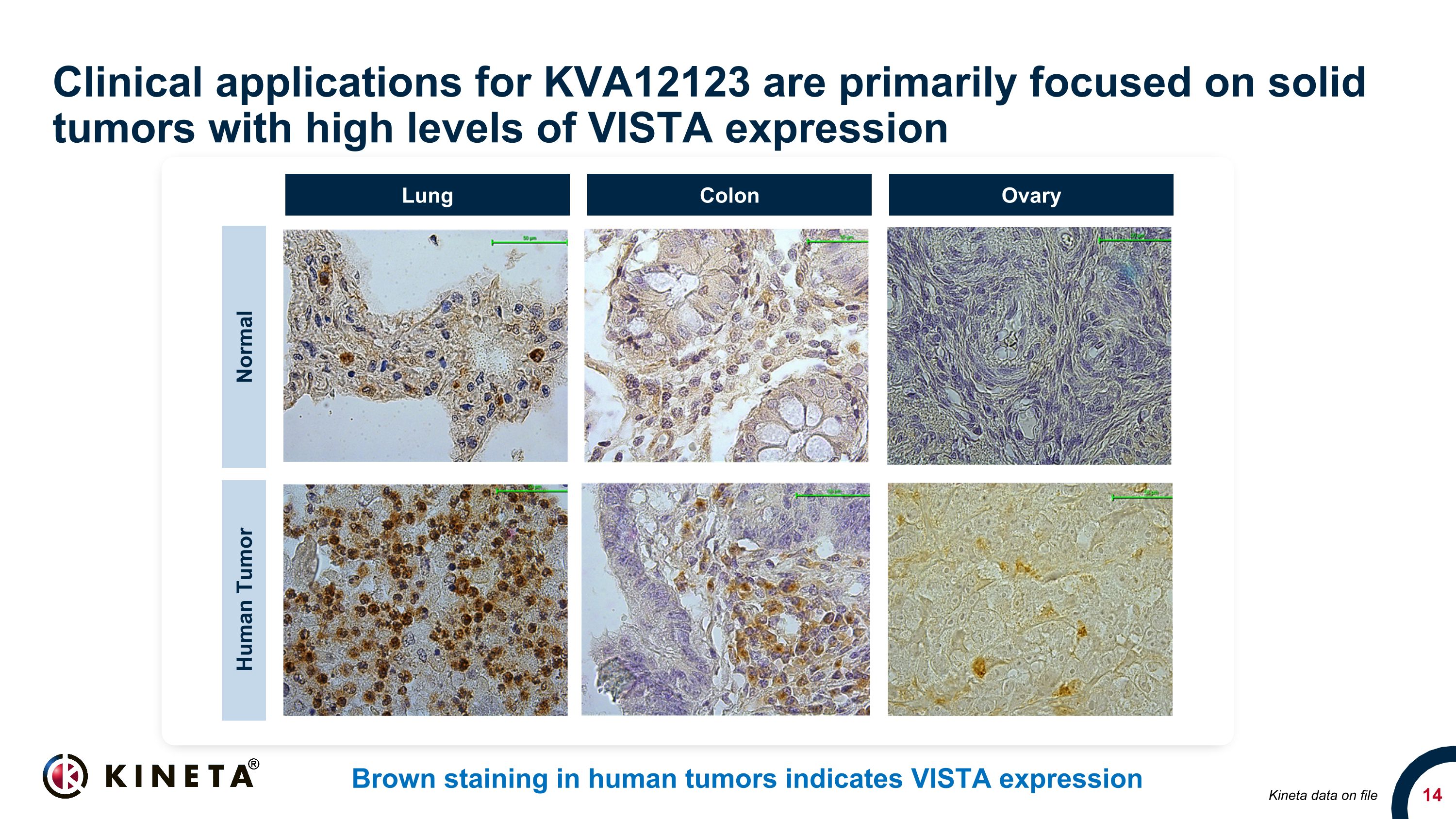
KVA12123 的臨牀應用主要集中在 VISTA 表達水平高的實體瘤上。人類腫瘤中的棕色染色表明 VISTA 表達 20x 20x 正常人類腫瘤肺結腸子房 Kineta 數據存檔

VISTA-101:在晚期實體瘤患者中單獨使用 KVA12123 以及與派姆博利珠單抗聯合使用的 1/2 期開放標籤臨牀試驗患者羣體:針對晚期實體瘤患者(最多 60 名患者)的 1 期籃子試驗 NSCLC、HNSCC、OC、CRC、RCC 和 TBD 其他患者 2 期研究目標:主要:安全性和耐受性、推薦的 2 期劑量(RP2D)或最大耐受劑量(MTD)) of KVA12123 次要:ireCist (ORR) 中晚期實體瘤受試者的藥代動力學、免疫原性、腫瘤反應探索性:生物標誌物和受體佔用默沙東研究合作臨牀試驗合作和 KEYTRUDA® 供應協議
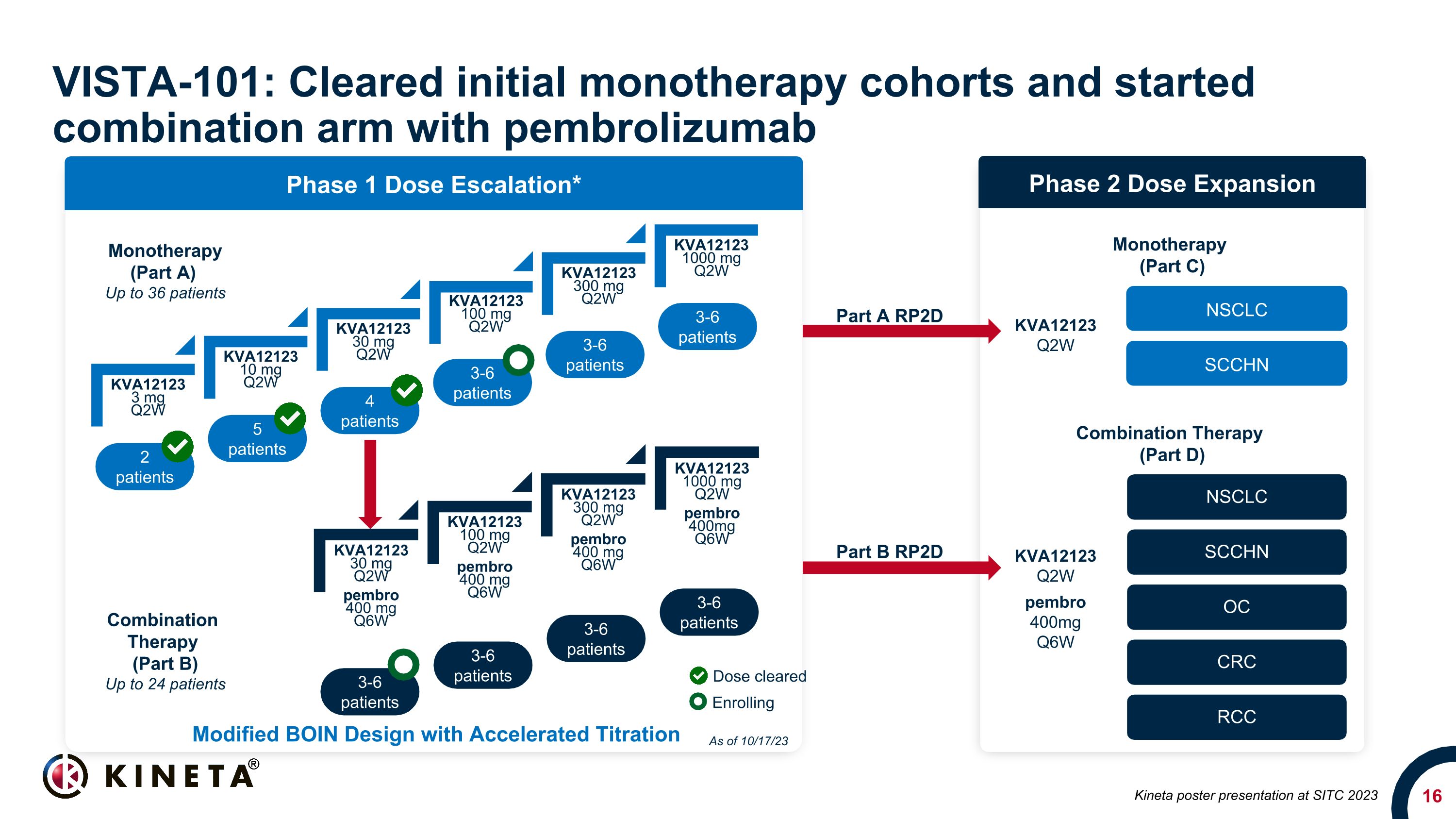
KVA12123 3 mg Q2W KVA12123 10 mg Q2W KVA12123 30 mg Q2W KVA12123 100 mg Q2W KVA12123 300 mg Q2W KVA12123 1000 mg Q2W VISTA-101:清理了最初的單一療法隊列並開始聯合使用 pembrolizumab 2 名患者 5 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名患者 3-6 名CLC SCCHN OC CRC RCC NSCLC SCCHN 單一療法(A 部分)最多 36 名患者聯合療法(B 部分)最多 24 名患者單一療法(C 部分)組合療法(D 部分)A 部分 RP2D 部分B RP2D KVA12123 Q2W pembro 400mg Q6W KVA12123 Q2W 經過修改的 BOIN 設計已批准加速滴定劑量正在註冊 KVA12123 30 mg Q2W pembro 400 mg q6W KVA12123 100 mg Q2W pembro 400 mg Q6W KVA12123 300 mg Q2W pembro 400 mg q6W 截至 10 月 17 日 Kineta 海報在 2023 年國際貿易標準大會上的演講 KVA12123
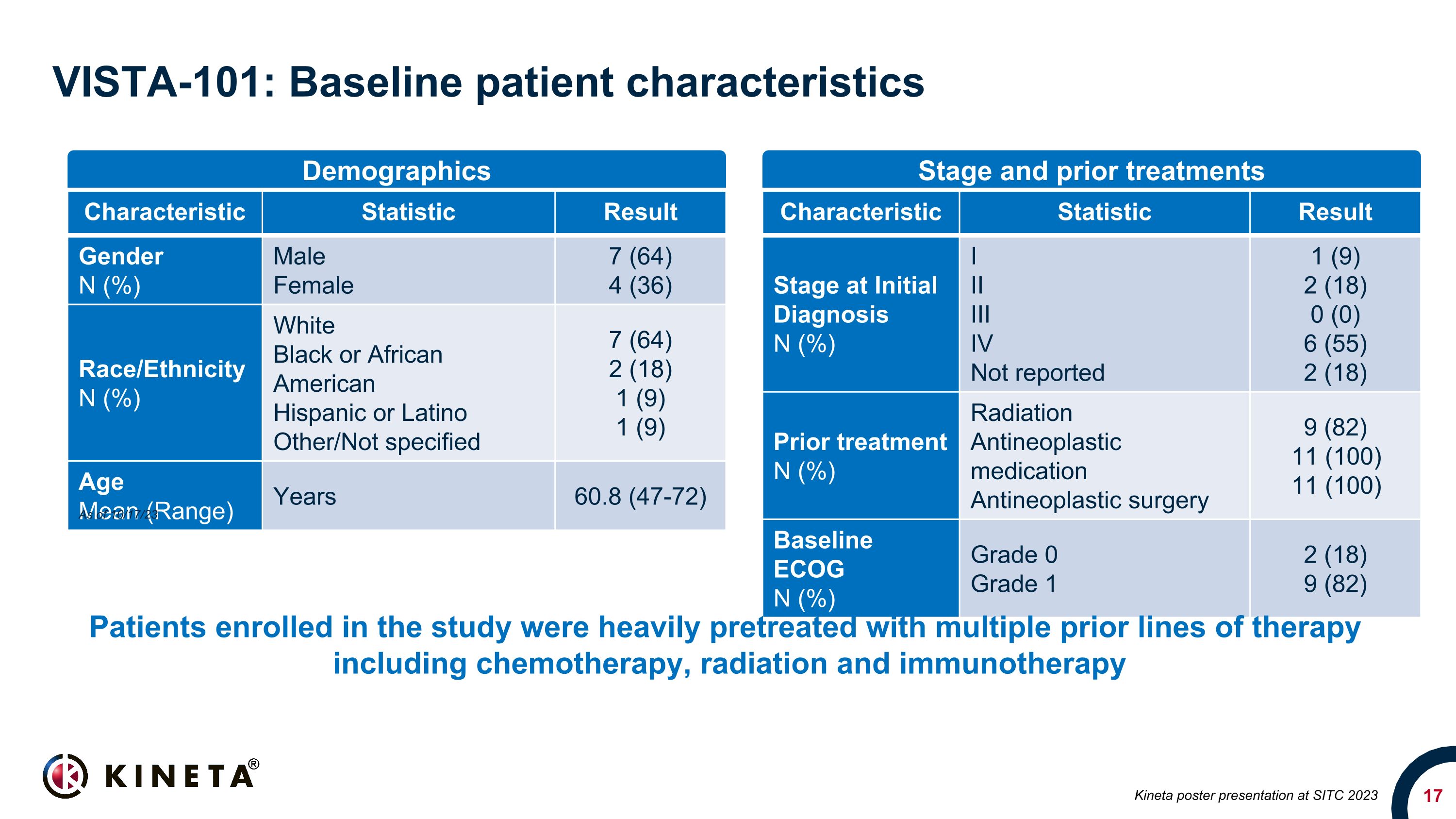
VISTA-101:基線患者特徵特徵統計結果性別 N (%) 男女 7 (64) 4 (36) 種族/民族 N (%) 白人黑人或非裔美國人西班牙裔或拉丁裔其他/未指定 7 (64) 2 (18) 1 (9) 1 (9) 年齡平均值(範圍)年齡 60.8 (47-72) 初始診斷時的特徵統計結果階段 N (%) I III IV 未報告 1 (9) 2 (18) 0 (0) 6 (55) 2 (18) 之前的治療 N (%) 放射抗腫瘤藥物抗腫瘤手術 9 (82) 11 (100) 11 (100) 基線 ECOG N (%) 0 級 1 2 (18) 9 (82) 人口統計階段和之前的治療 Kineta 在 SITC 2023 上的海報展示截至 23 年 10 月 17 日,參加該研究的患者接受了包括化療、放射治療和免疫療法在內的多種先前療法的大量預治療
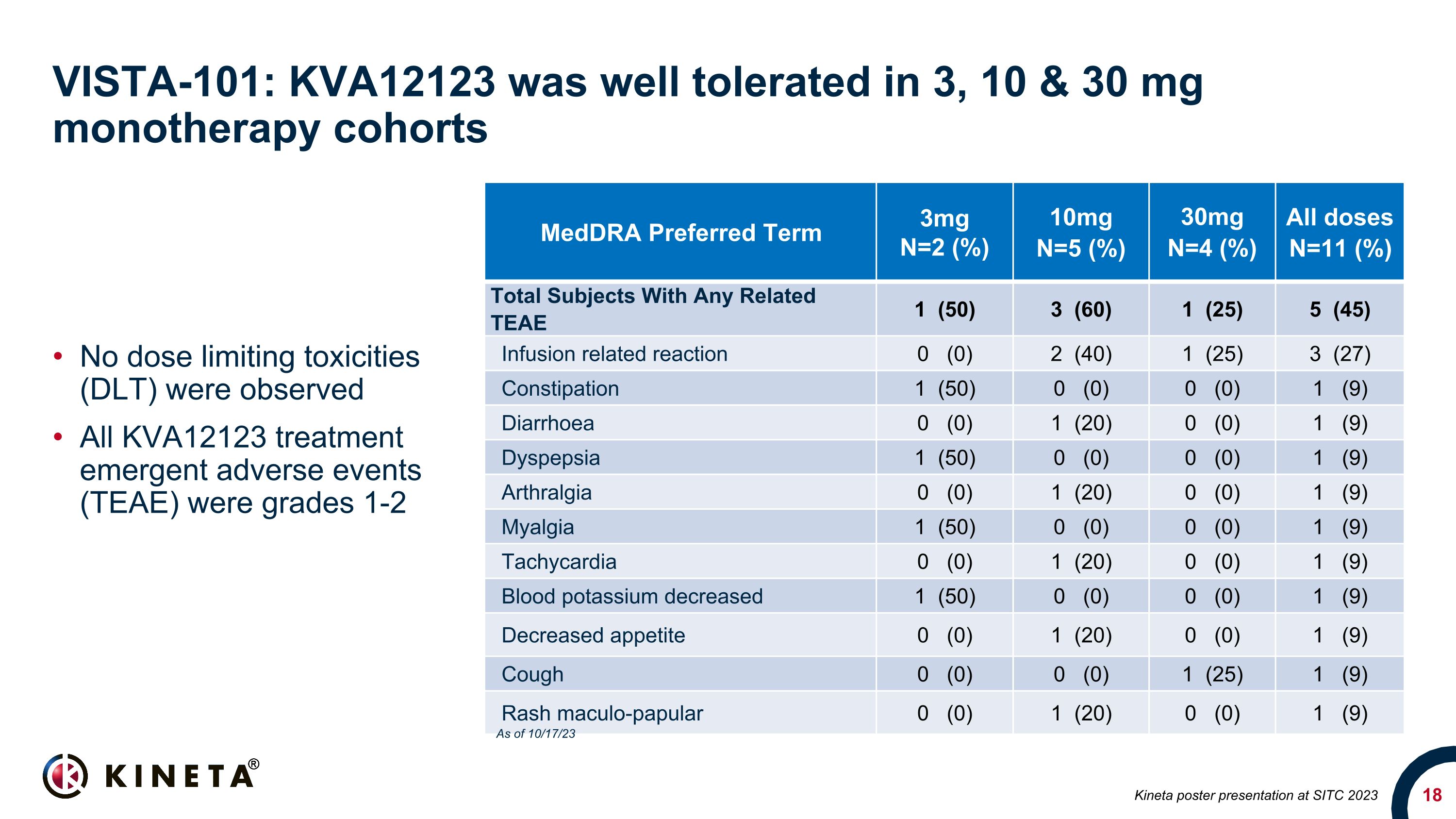
VISTA-101:KVA12123 在 3、10 和 30 mg 的單一療法隊列中耐受性良好。未觀察到劑量限制毒性 (DLT) 所有 KVA12123 治療緊急不良事件 (TEAE) 均為 1-2 級 medDra 優先週期 3mg N=2 (%) 10mg N=4 (%) 所有劑量n=11 (%) 任何相關的 Teae 的受試者總數 1 (50) 3 (60) 1 (25) 5 (45) 輸液相關反應 0 (0) 2 (40) 1 (25) 3 (27) 便祕 1 (50) 0 (0) 0 (0) 1 (9) 腹瀉 0 (0) 1 (0) 0 (0) 0 (0) 0 (0) 1 (9) 消化不良 1 (50) 0 (0) 0 (0) 1 (9) 關節痛 0 (0) 1 (0) 1 (20) 0 (0) 1 (9) Myalgia 1 (50) 0 (0) 0 (0) 1 (9)心動過速 0 (0) 1 (20) 0 (0) 1 (9) 血鉀降低 1 (50) 0 (0) 0 (0) 0 (0) 1 (9) 食慾下降 0 (0) 1 (0) 0 (0) 0 (0) 0 (0) 0 (0) 0 (0) 0 (0) 0 (9) 0 (0) 0 (0) 1 (0) 1 (0) 1 (0) 1 (0) (9) 截至 23 年 10 月 17 日,在 SITC 2023 上發佈 Kineta 海報
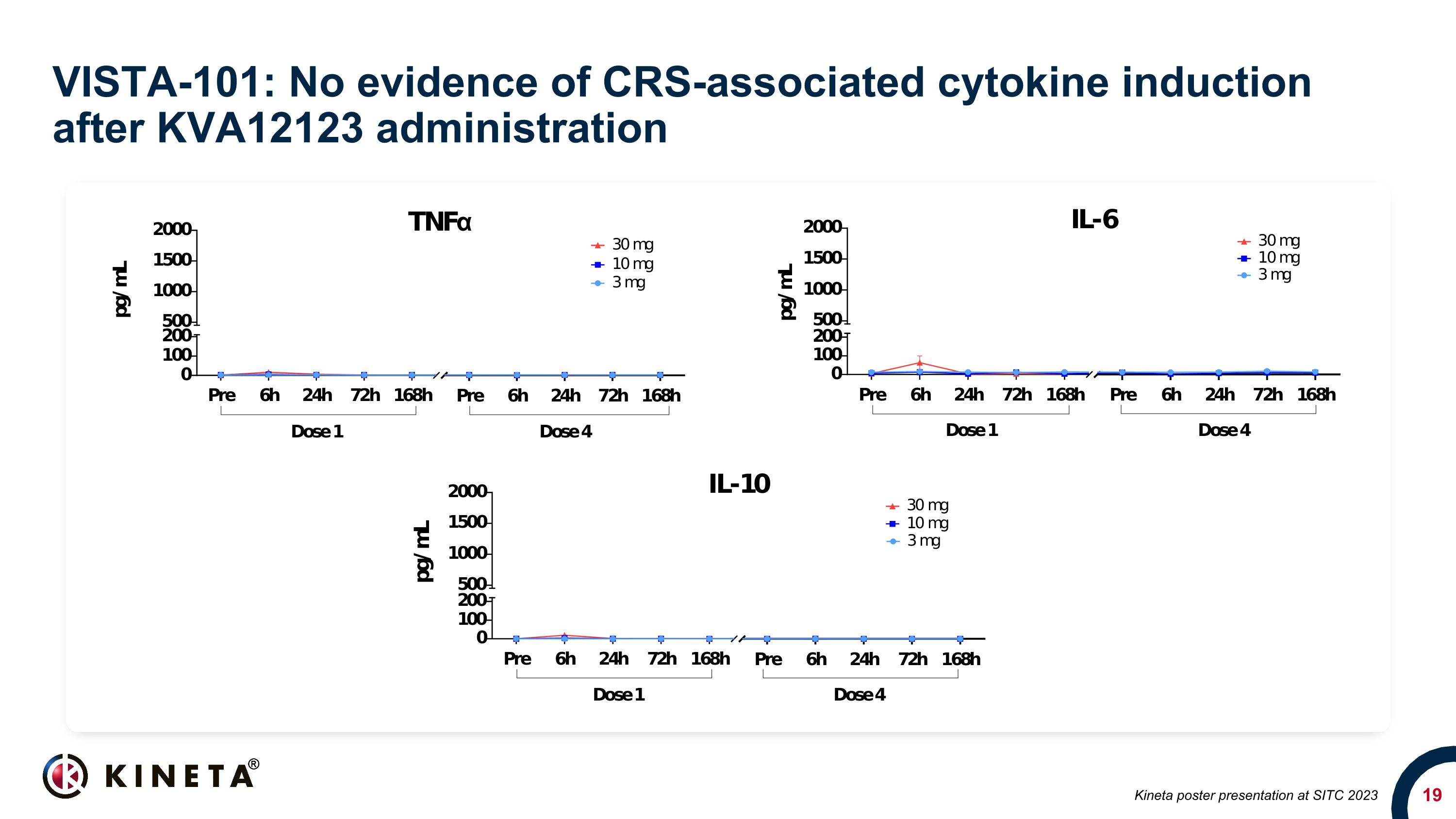
VISTA-101:使用 KVA12123 後沒有證據顯示 CRS 相關的細胞因子誘導 Kineta 在 SITC 2023 上發佈海報

VISTA-101:KVA12123 表現出大於劑量比例的 PK 曲線,在 30 mg 隊列中,VISTA 受體佔有率 (RO) 的患者的 VISTA RO 超過 90% * 藥代動力學 *單次給藥 KVA12123 後 11 名患者循環單核細胞的 Vista 受體佔有率。Kineta 利用專有方法評估 VISTA 受體佔用率。*** p
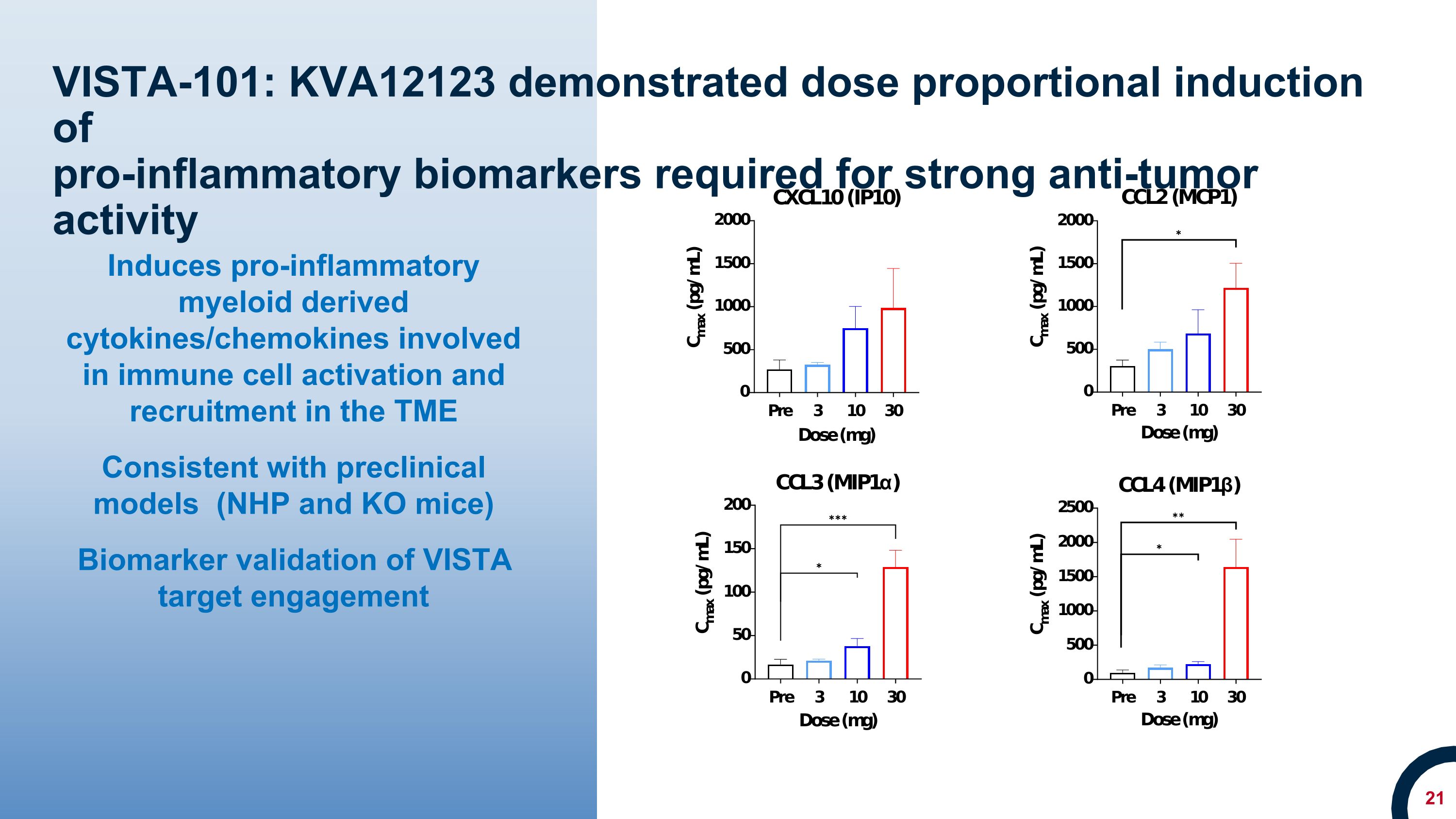
VISTA-101:KVA12123 證明瞭強抗腫瘤活性所需的促炎生物標誌物的劑量成比例誘導促炎髓系衍生的細胞因子/趨化因子參與免疫細胞在 TME 中的激活和招募與臨牀前模型(NHP 和 KO 小鼠)一致 VISTA 靶標參與度的生物標誌物驗證
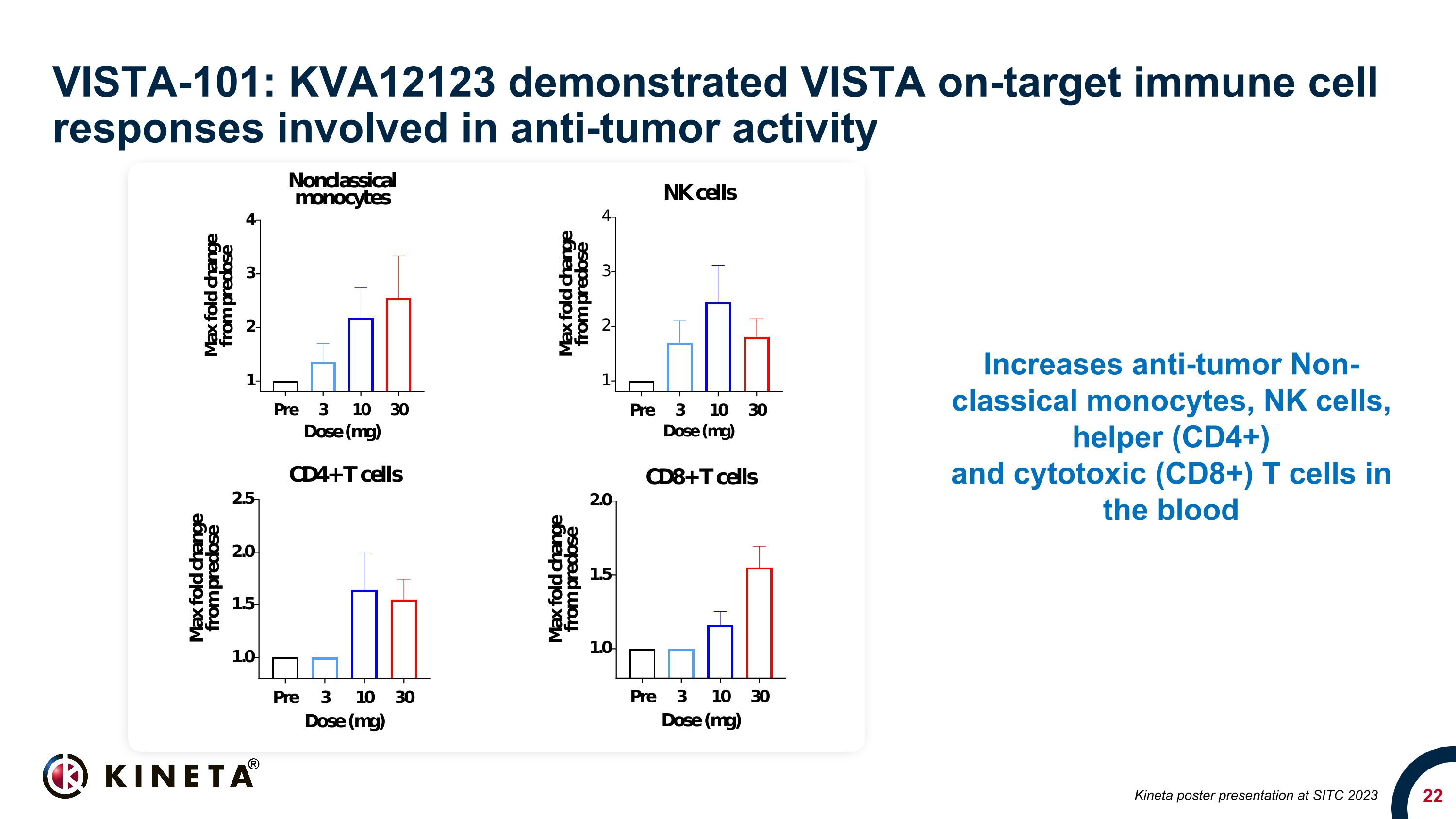
VISTA-101:KVA12123 在 SITC 2023 上展示了參與抗腫瘤活性的 VISTA 靶向免疫細胞反應增加血液中的抗腫瘤非經典單核細胞、NK 細胞、輔助細胞 (CD4+) 和細胞毒性 (CD8+) T 細胞

VISTA-101:KVA12123 臨牀概況摘要安全性通過前三組 KVA12123 單一療法隊列(3、10、30 mg),其中 11 名患者給藥耐受性良好,無劑量限制毒性(DLT)未檢測到與 CRS 相關的細胞因子(IL-6、TNFα 和 IL-10)的證據。藥代動力學分析顯示,藥代動力學和受體佔用 (RO) KVA12123 的劑量達到 90% 以上 VISTA RO在所有評估劑量中,藥物暴露量的增加均大於劑量成比例,這與靶向介導的藥物處置一致低劑量生物標誌物顯示 CXCL10、MCP1、MIP1α 和 MIP1β 與療效相關的細胞因子分泌,治療後觀察到抗腫瘤免疫細胞亞羣發生了顯著變化
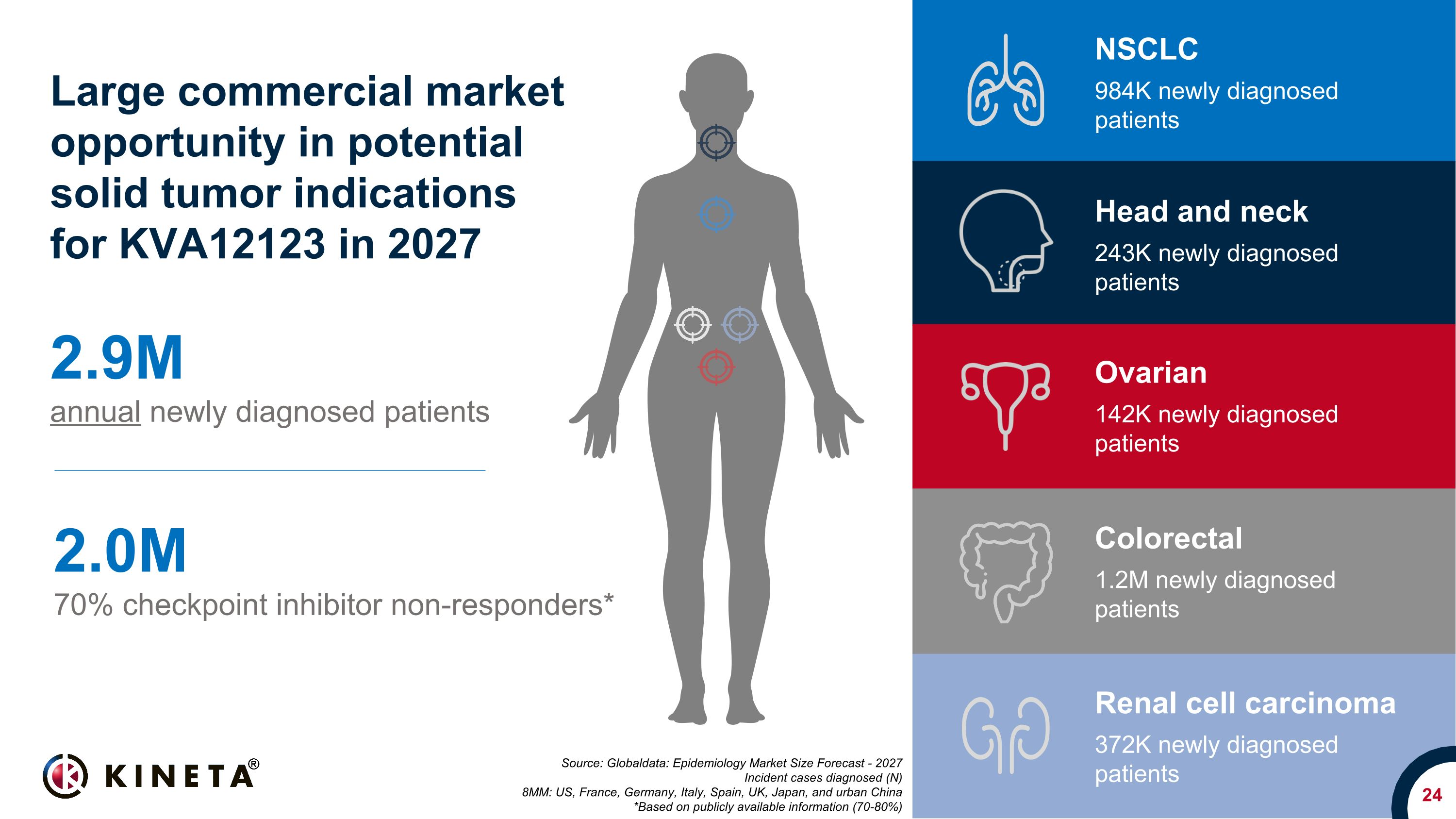
24 來源:全球數據:流行病學市場規模預測——2027 年確診的事故病例(N)8MM:美國、法國、德國、意大利、西班牙、英國、日本和中國城市 *基於公開信息(70-80%)每年新增確診患者 290萬人 70% 檢查點抑制劑無反應者* 2027 年 KVA12123 潛在實體瘤適應症的巨大商業市場機會 NSCLC 984K 新診斷患者結直腸癌 120萬新診斷的患者卵巢 142K 新診斷的患者頭部和頸部 243K 新診斷的患者腎細胞癌 372K新診斷的患者
抗CD27激動劑單抗免疫療法
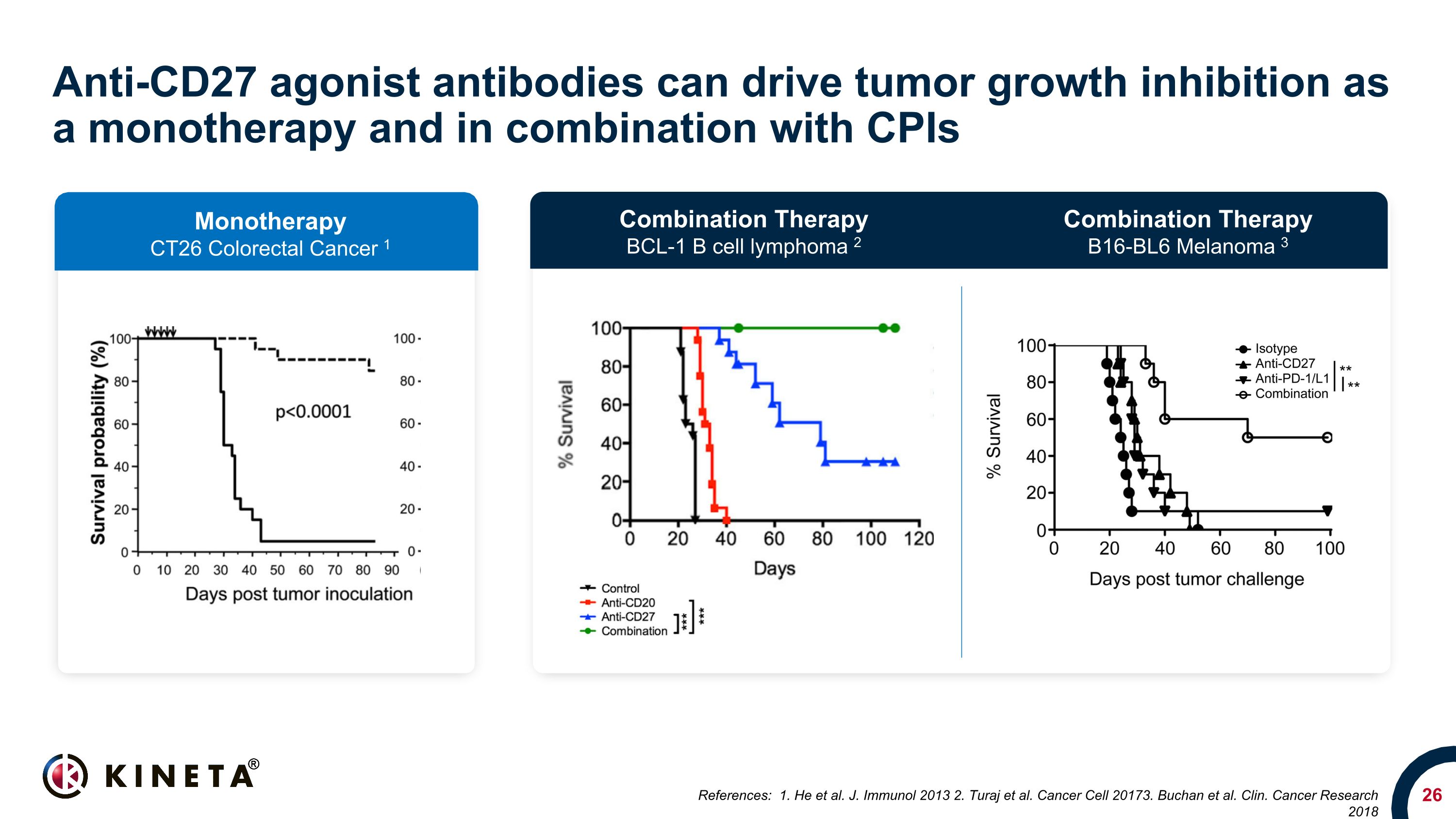
抗CD27激動劑抗體可作為單一療法驅動腫瘤生長抑制,並與CPIs聯合使用參考文獻:1.他等。J. Immunol 2013 2.Turaj 等人Cancer Cell 20173。Buchan 等。克林。Cancer Research 2018 單一療法 CT26 結直腸癌 1 聯合療法 BCL-1 B 細胞淋巴瘤 2 聯合療法 B16-BL6 黑色素瘤 3
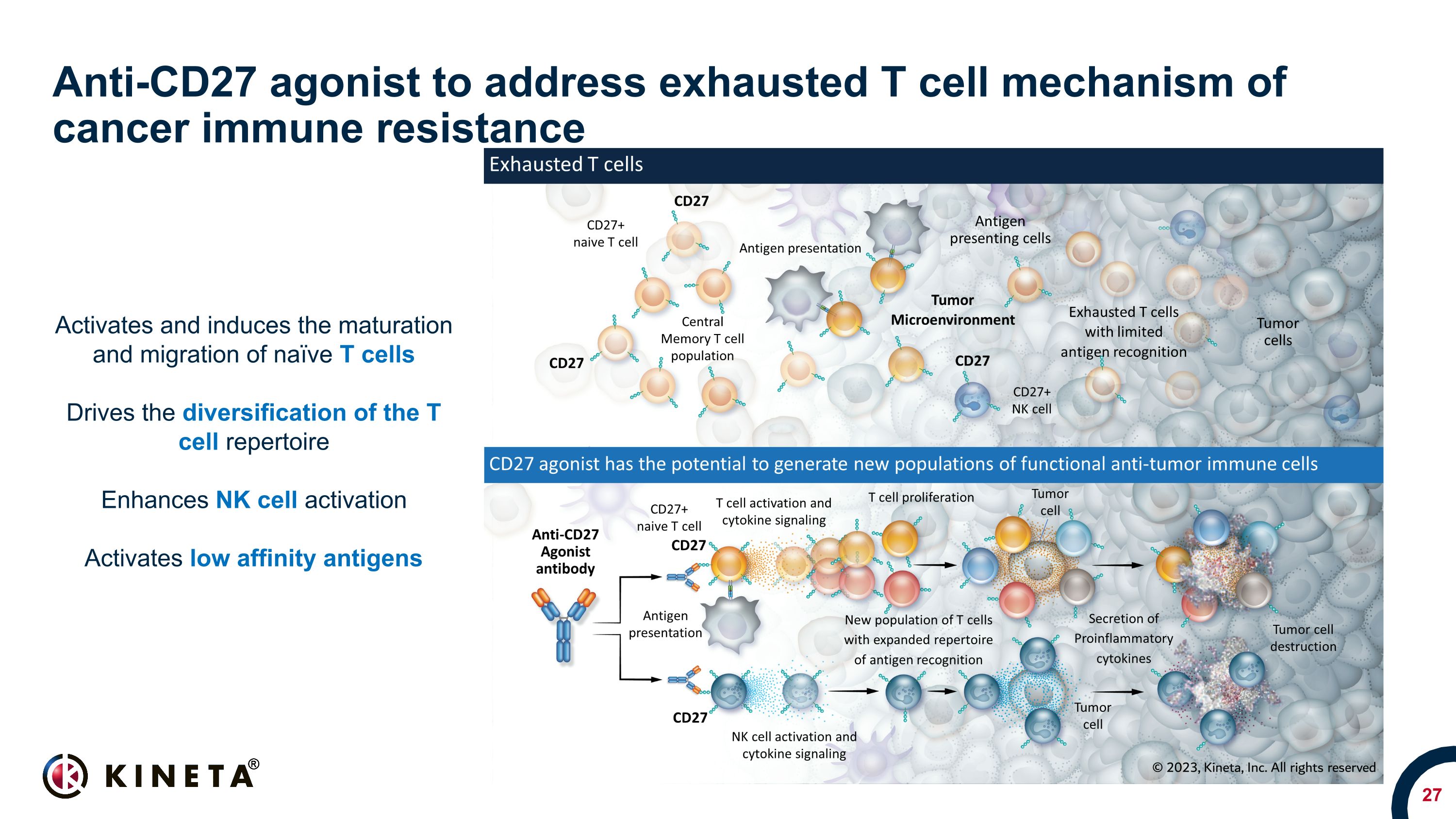
抗CD27激動劑可解決耗盡的T細胞癌症免疫抵抗機制激活和誘導幼稚T細胞的成熟和遷移推動 T 細胞庫的多樣化增強 NK 細胞激活激活低親和力抗原
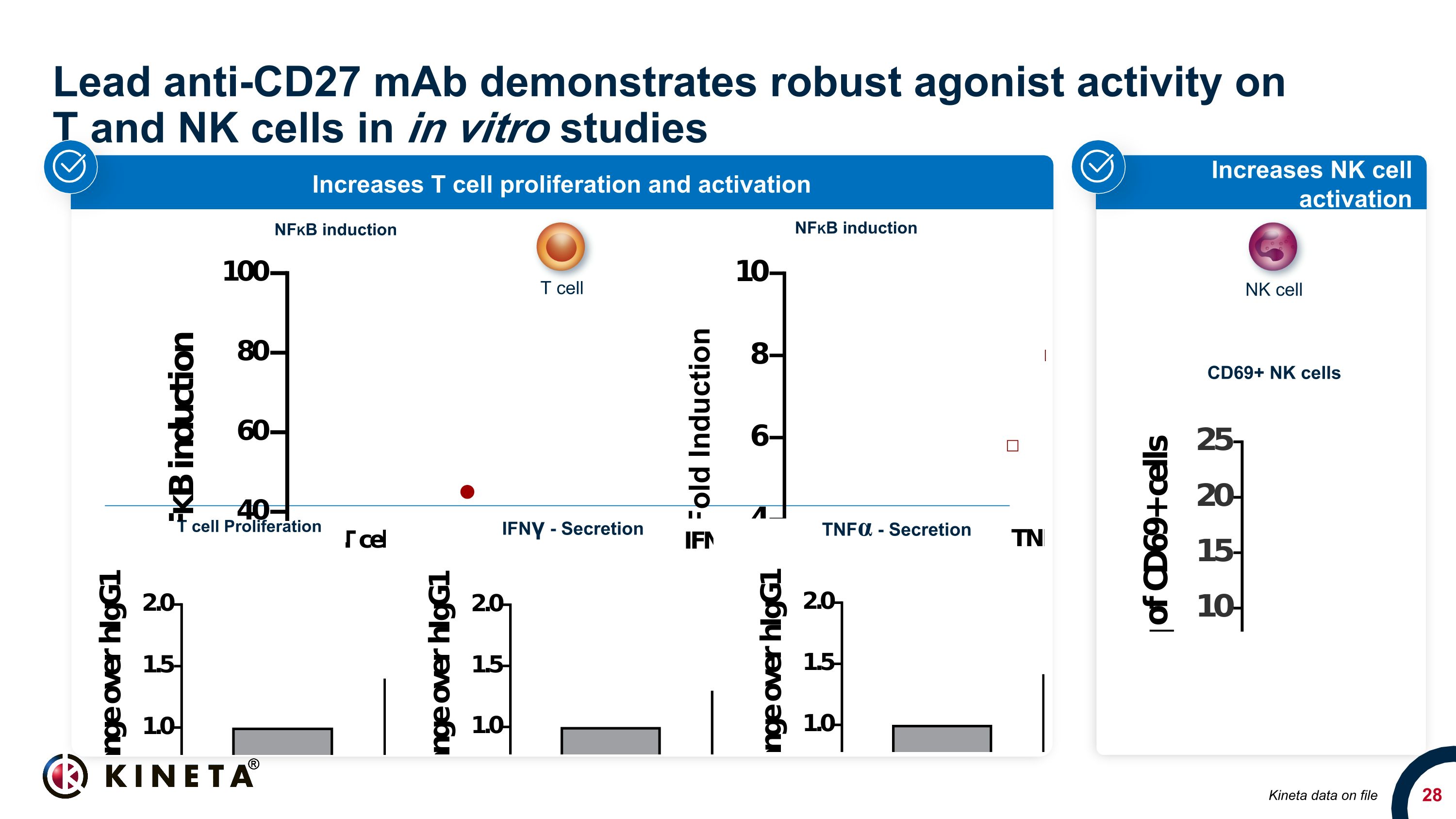
Lead Anti-CD27 單抗體在體外研究中顯示出對 T 和 NK 細胞的強大激動劑活性提高 NK 細胞活化增加 T 細胞增殖和激活 T 細胞增殖 IFNγ-分泌物 TNFα-分泌 Kineta 數據存檔 CD69+ NK 細胞 T 細胞 NFKB 誘導 NFKB 誘導
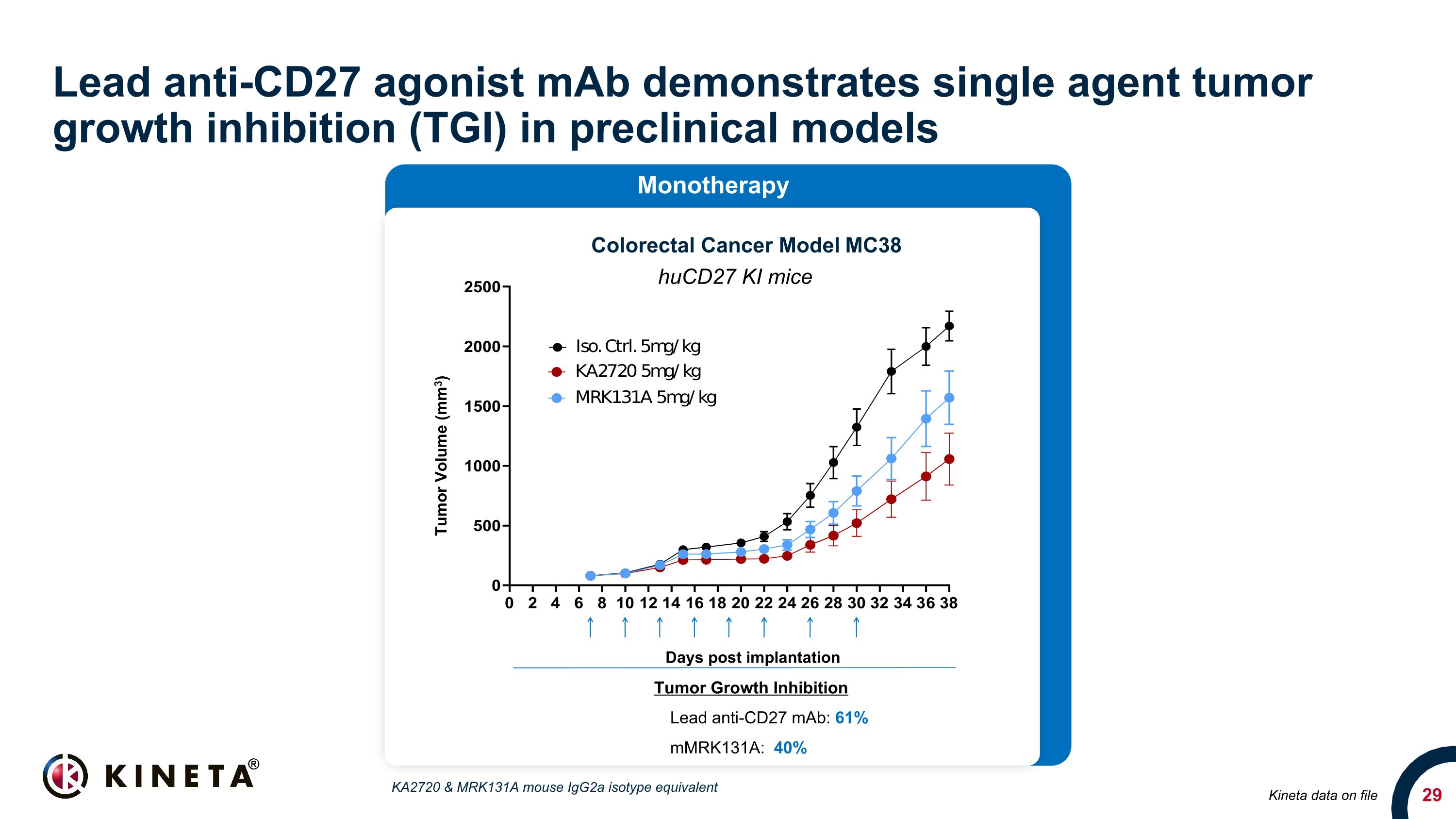
主要抗 CD27 激動劑 maB 在臨牀前模型中表現出單藥腫瘤生長抑制 (TGI) Kineta 數據存檔結直腸癌模型 MC38 Hucd27 KI 小鼠腫瘤生長抑制鉛抗:61% mmrk131a:40% 植入後單藥天數腫瘤體積 (mm3) KA2720 和 MRK131A 小鼠 Igg2a 同種型
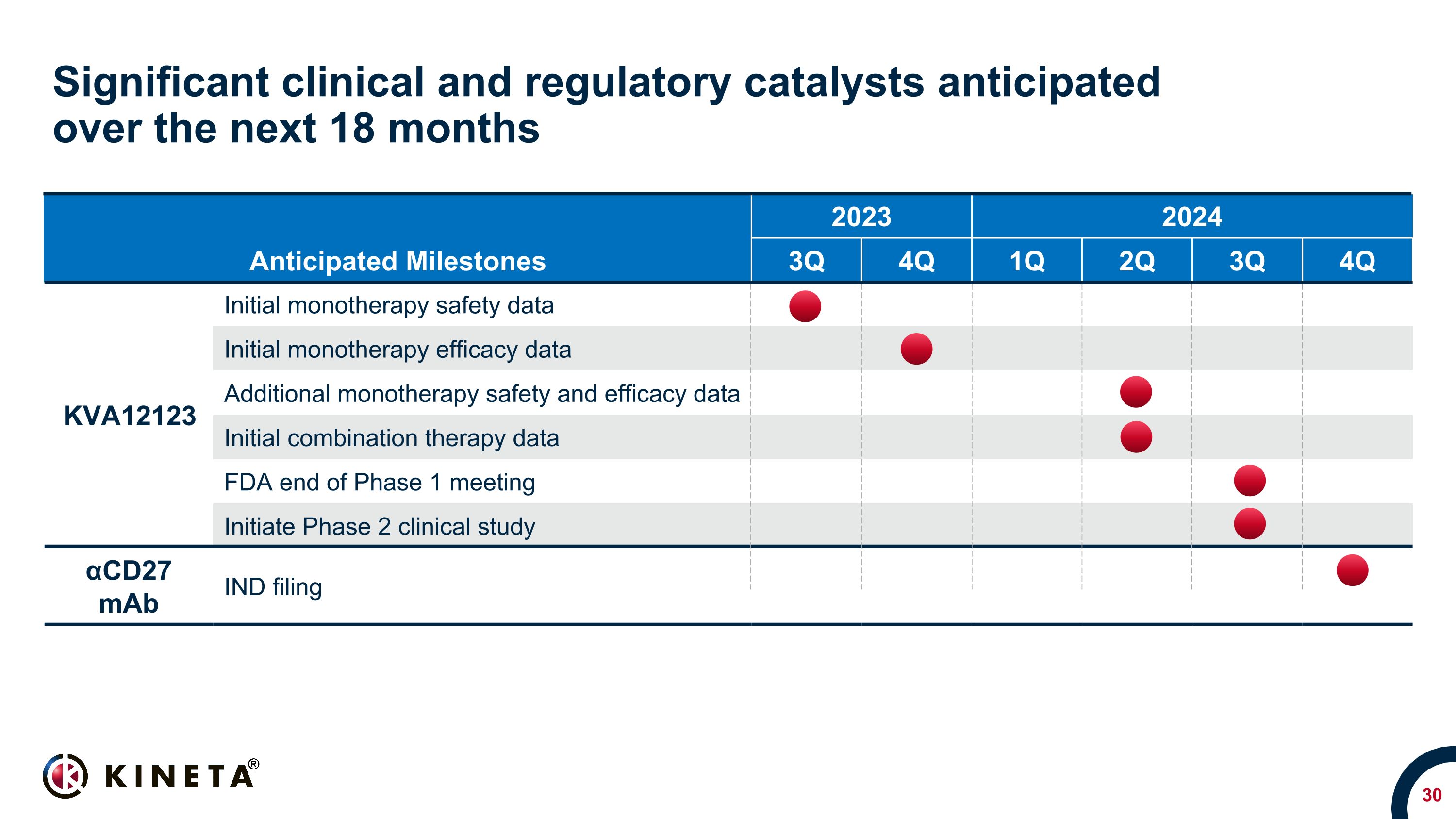
預計在未來 18 個月內將出現重要的臨牀和監管催化劑預期里程碑 2024 年 2024 年 2024 年 3 季度 4Q 第 1 季度第 2 季度 4Q KVA12123 單一療法初始安全性數據單一療法初始療效數據其他單一療法安全性和療效數據初始聯合療法數據 FDA 第 1 階段結束會議啟動 2 期臨牀研究 αCD27 maB IND 備案

項目神經肌肉疾病-ALS 腫瘤學囊性纖維化合作伙伴關鍵交易條款2023年7月收到500萬美元里程碑付款高達2.55億美元里程碑淨銷售特許權使用費高達9600萬美元里程碑淨銷售特許權使用費僅限商業里程碑淨銷售特許權使用費次級許可付款的收入份額約13億美元加上淨銷售許可協議的特許權使用費

肖恩·艾多納託,博士首席執行官 Vinny Hayreh,醫學博士臨牀研究副總裁 Thierry Guillaudeux,博士首席科學官 Jacques Bouchy 投資者關係與業務發展執行副總裁經驗豐富的領導團隊克雷格·飛利浦總裁基思·貝克首席財務官 Pauline Kenny 法律顧問

KVA12123:在TME 1/2期臨牀研究中,VISTA阻斷單抗以解決免疫抑制問題,該研究評估了晚期實體瘤中單獨使用 KVA12123 以及與pembrolizumab聯合治療的初始單一療法數據:清除了前 3 個隊列,無劑量限制毒性,VISTA 受體佔有率> 90% 臨牀前抗 CD27 激動劑 maB 以解決耗盡的 T 細胞預計現金流將持續到 2025 年初* 1,030 萬股流通股(KA:納斯達克)4QQ 23:初始單一療法療效數據 2Q24:其他單一療法安全性和療效數據 2Q24:初始聯合療法數據以先天免疫為重點的管道預期 KVA12123 催化劑的財務狀況 Kineta 正在開發解決癌症免疫抵抗問題的下一代免疫療法,潛在的里程碑付款約為 13 億美元,加上淨銷售額的特許權使用費 *包括截至第 23 季度的 780 萬美元現金、10 月 23 日收到的 300 萬美元默沙東裏程碑款項以及預計於 4 月 24 日完成的 2250 萬美元的 PIPE 融資

為癌症患者開發下一代免疫療法 www.kinetabio.com

附錄
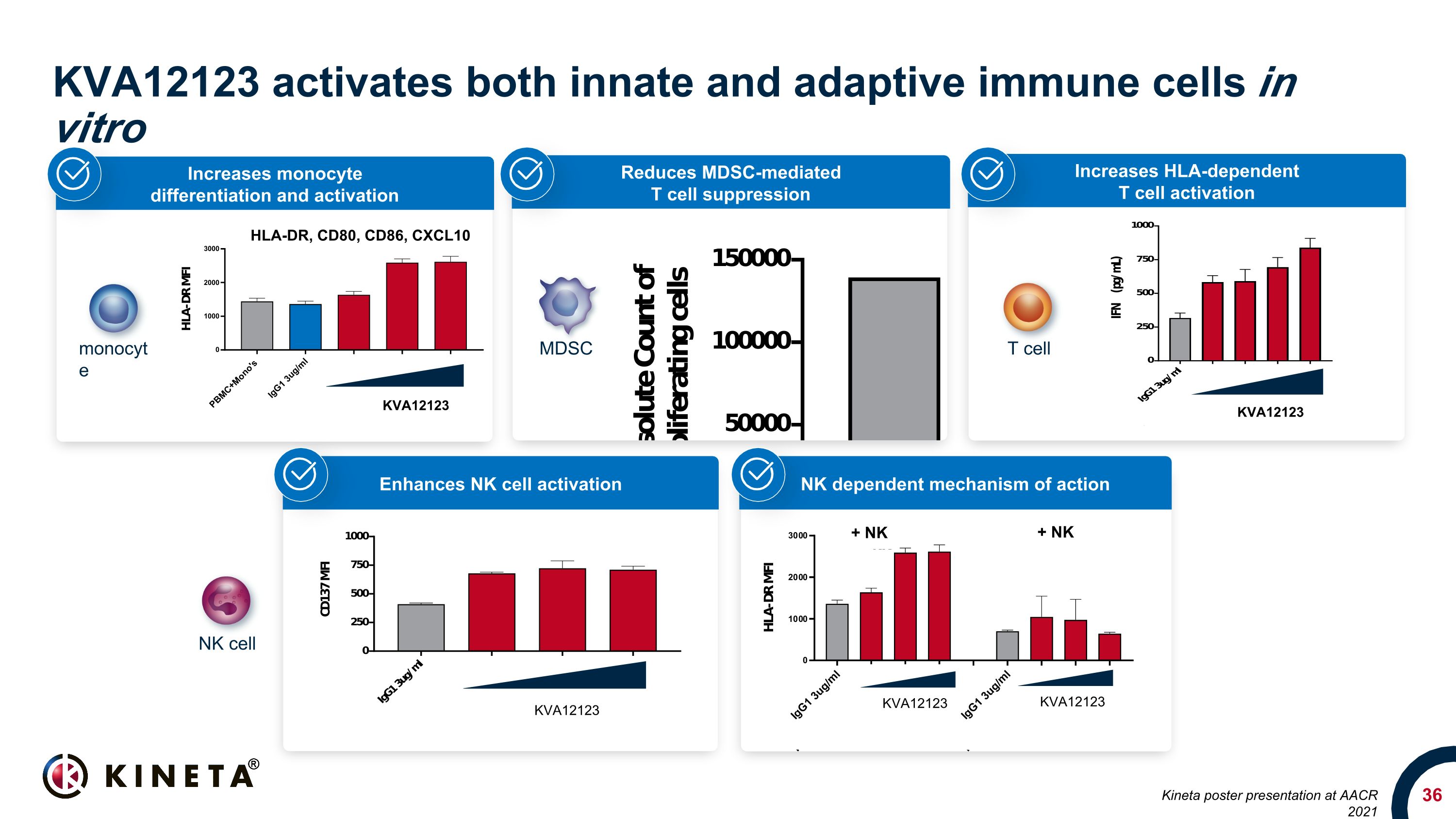
增加 HLA 依賴性 T 細胞活化降低 mdsc 介導的 T 細胞抑制 KVA12123 在體外激活先天和適應性免疫細胞 HLA-DR、CD80、CD86、CXCL10 KVA12123 增加單核細胞分化和激活 KVA12123 KVA12123 NK 依賴作用機制增強 NK 細胞激活 MDSC T 細胞 NK 細胞單核細胞 KVA12123 KVA12123 + NK + NK Kineta 在 AACR 上發佈海報

KVA12123 在生理學和酸性 pH 上結合 ELISA 和 Octet 的結合研究表明,從 pH 7.4 到 pH 6.0 ELISA Octet Kineta 數據在文件 0.5 0.4 0.1 0.2 0 nm 0 50 100 150 250 300 Time 350 450 500 600 KVA12123 pH 6.0 KVA12123 pH 6.0 pH 6.0 pH 7.0 各種 pH 關聯和解離 pH 7.0 pH 6.0 6.5 pH 7.4 KVA12123 綁定 KVA 濃度 (ng/mL) OD 450 KVA12123 KVA12123