目錄
限制。有關Alexion協議的進一步描述,請參閲附註8, 重要協議,以及本10-Q表季度報告其他地方包含的未經審計的簡明合併財務報表,標題為 “——Alexion期權和許可協議(前身為輝瑞期權和許可協議)”。
2022 年 3 月,我們與合作伙伴諾華簽訂了期權和許可協議,即諾華協議。根據諾華協議,我們已授予諾華期權或諾華許可期權,許可TRACER Capsids或諾華許可的Capsids專用於某些靶標,用於開發和商業化某些腺相關病毒基因療法候選藥物,包括諾華許可衣殼和指向該靶標的有效載荷。 自 2023 年 3 月 1 日起,諾華行使諾華許可期權,對我們的 TRACER Capsid 發現平臺生成的新型衣殼進行許可,用於針對兩個未公開靶標的基因治療項目。在適用的諾華許可證期權到期之前,諾華選擇不為諾華協議下的第三個目標提供上層許可。與該目標有關的所有權都歸還給了我們。 有關諾華協議的更多描述,請參閲附註8, 重要協議,以及本10-Q表季度報告其他地方包含的未經審計的簡明合併財務報表,標題為 “—諾華期權和許可協議”。
2022 年 11 月,我們與 Touchlight IP Limited(簡稱 Touchlight)簽訂了許可協議或《觸摸燈許可協議》,授權我們在歷史上使用某個 DNA 製備過程或受體 DNA 製備流程,並授權對使用受體 DNA 製備工藝創建的 TRACER Capsids 進行潛在開發。
我們的管道概述
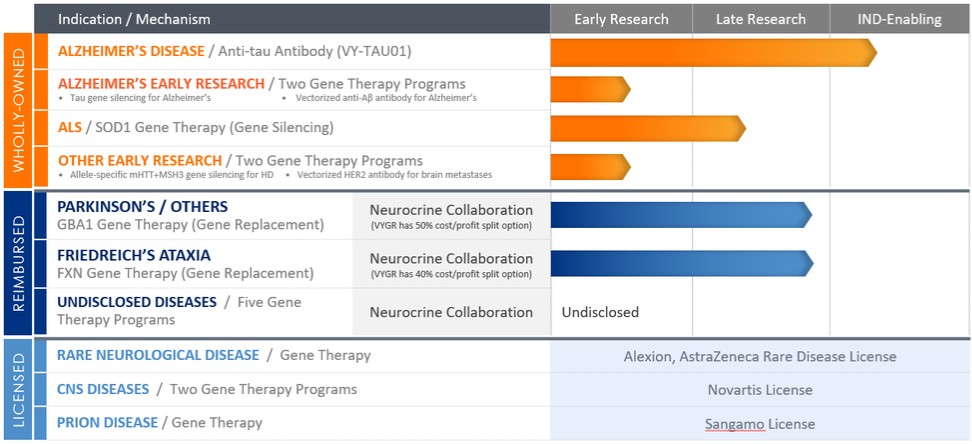
我們利用我們的TRACER發現平臺和其他基因治療平臺、我們在專有抗體方面的專業知識以及我們的矢量化抗體平臺,組裝了一系列專有的AAV基因療法和其他遺傳藥物,用於治療我們認為有大量未得到滿足的醫療需求的神經系統疾病。根據疾病的不同,我們正在尋求開發使用基因替代或基因沉默方法的AAV基因療法,以及使用被動給藥或向量化遞送方法的抗體。我們的目標是通過顯著增加或減少靶組織中相關蛋白質的表達,解決特定疾病的根本原因或主要表現。
下表總結了我們的項目管線,所有這些項目都在臨牀前開發中:
33