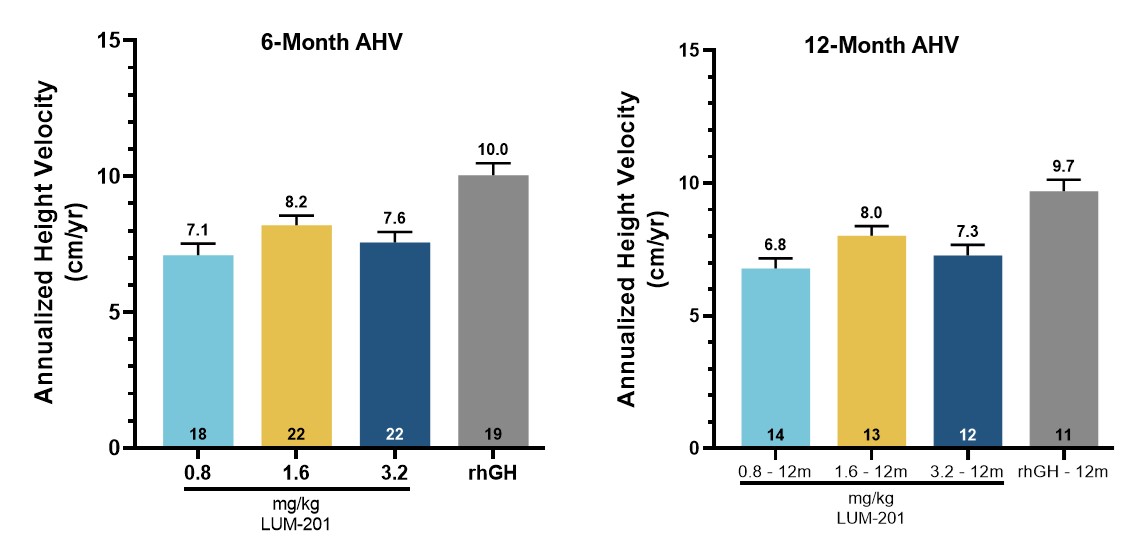
•Oragrowth210 結果顯示,1.6 mg/kg 的 LUM-201 劑量在 6 個月時達到了 8.2 釐米/年的年化身高速度 (AHV),12 個月時達到了 8.0 釐米/年,與中等 PGHD 人羣的增長率相當
•在最佳 LUM-201 劑量 1.6 mg/kg 和 rhGH 比較器臂之間 6 個月和 12 個月的增量處於非劣勢區間內 (
•來自 oraGrowth210 和 Oragrowth212 合併試驗的初始 24 個月的 LUM-201 數據表明,從第 1 年到第 2 年,AHV 效應持續
•達到預先指定的預測性富集標記 (PEM) 驗證主要終點和次要終點,證明 PEM 陽性分類可重複性為 100%
•Oragrowth212 證明,在注射用 rhGH 濃度僅為 20% 的情況下,LUM-201 達到了預期的 AHV,同時展示了 LUM-201 獨特的脈動作用機制
•迄今為止 LUM-201 還沒有安全信號
公司將於美國東部時間明天上午 8:30 舉行電話會議
德克薩斯州奧斯汀,2023年11月7日——Lumos Pharma, Inc.(納斯達克股票代碼:LUMO)今天宣佈,其2期Oragrowth210劑量發現試驗和2期Oragrowth212藥代動力學/藥效學(PK/PD)試驗的最終結果符合所有主要和次要終點。來自Oragrowth210試驗的數據顯示,口服1.6 mg/kg劑量的 LUM-201 在治療六個月時年化身高速度為8.2釐米/年,12個月時為8.0釐米/年,*與中度兒科生長激素缺乏症(PGHD)患者的歷史數據一致,在比較注射重組生長激素(rhGH)組的目標2釐米/年範圍內。數據還初步驗證了預測性富集標記(PEM)策略,其中預先指定了主要策略
並且次要結果得到滿足,降低了我們為第三階段計劃選擇患者的風險。來自 Oragrowth212 試驗的數據證實,LUM-201 獨特的脈動機制可提高生長率,同時將生長激素和 IGF-1 的分泌恢復到正常範圍†,其水平大大低於外源注射 rhGHH 產生的水平。†† 此外,在 Oragrowth210 和 Oragrowth212 試驗中,來自一小部分 10 名受試者的數據表明 AHV up 具有持續的有效性到 24 個月。LUM-201此外,LUM-201 的安全性在兩項 2 期研究中都保持清晰明瞭,在我們迄今為止進行的兩項 2 期試驗中均未發現任何安全問題。
“我們的 OragroWth 試驗結果為我們提供了明確的概念證明,即口服 LUM-201 有可能作為中度生長激素缺乏患者的注射療法的可行替代方案。Lumos Pharma董事長兼首席執行官裏克·霍金斯説,我們的數據表明,LUM-201 可以根據接受生長激素治療的中度PGHD患者的既定標準增強AHV,從而顯示出強大而持久的反應。“我們期待在預計於2024年上半年舉行的第二階段會議結束時與FDA討論這些數據並最終確定我們的3期關鍵試驗計劃。”
著名兒科內分泌學家羅恩·羅森菲爾德博士也是我們的臨牀和科學顧問委員會主席,他對數據發表了見解,他説:“這些發現不僅符合治療的歷史增長預期,而且凸顯了 LUM-201 獨特脈動機制的獨特優勢。與每天注射生長激素相比,口服 LUM-201 能夠實現預期的生長激素,而患者每天只接觸 20% 的生長激素,這是一項重大的科學突破,有可能徹底改變治療中度生長激素缺乏症兒童的方法。”
Oragrowth210 頭條業績亮點
OraGrowth210試驗實現了其主要目標,6個月的AHV數據為8.2 cm/年,支持將1.6 mg/kg作為3期臨牀試驗的最佳劑量。* 6個月和12個月的AHV為1.6 mg/kg/日,符合增長預期,與注射用rhGH隊列相比,不遜於2.0釐米/年的目標範圍。
ANCOVA 示範條款:治療、劑量 1 的年齡、性別、基線 HT SDS、基準體重指數 SDS、基線 IGF-1 SDS、LUM-201 PEM、
基線 BA 延遲,HT SDS-MPH SDS 條代表最小二乘均值 (LSM),誤差條表示 LSM 的標準誤差
•劑量為 1.6 mg/kg 時,LUM-201 AHV 在六個月零 12 個月時最高
•1.6 mg/kg LUM-201 劑量與 rhGH 對照組在 12 個月時的年差異為 1.7 釐米/年,屬於歷史非劣勢階段 3 的幅度
•LUM-201 AHV 與具有相似特徵的患者羣體中 rhGH 的歷史增長率一致。
•針對50/81名受試者提供12個月的AHV數據:增長率維持在12個月內
在 1.6 mg/kg 劑量的 LUM-201 組中觀察到的 6 個月和 12 個月時的平均 AHV 分別為 8.2 cm/yr 和 8.0 cm/年。這些 AHV 符合該公司預期,即在中度 PGHD 患者羣體中接受了 rhGH 治療 12 個月後觀察到的每年 8.3-8.6 cm/AHV。1,2,3
在Oragrowth210試驗的rhGH控制組中接受治療的中度PGHD人羣中,AHV高於預期,這與多項歷史試驗不一致,這些試驗預測中度 PGHD1-4 的增長幅度在8.3-8.6釐米/年區間內。在這項研究的每日生長激素組中觀察到的這種獨特的生長模式可能是由於更高的劑量和異常值的存在。我們預計,在一項規模更大、統計學上更可靠的3期試驗中,與rhGH治療相關的AHV將更接近中等患者羣體的歷史值。
Oragrowth210試驗滿足了預先設定的響應者富集百分比,提供了對PEM策略的初步驗證。此外,我們在滿足預先確定的結果方面實現了 100% 的成功率,從而實現了積極的 PEM 規格分類的可重複性。
oragrowth212 頭條業績亮點
Oragrowth212 試驗的最高結果顯示,使用注射 rHGH 觀察到的生長激素 (GH) 濃度僅為 20%,LUM-201 達到了預期的 AHV。這一結果是通過 LUM-201 的自然脈動機制實現的,促進了符合歷史規範的中等 PGHD 受試者的生長。值得注意的是,LUM-201 將循環中的生長激素水平提高到接近正常生理範圍的水平,而使用注射性生長激素治療已被證明可以將生長激素水平提高到普通健康兒童的四到五倍。此外,必須強調的是,在 LUM-201 治療的前 12 個月中,沒有任何 IGF-1 值與平均值超過 2 個標準差。
來自 oragrowth210 和 oragrowth212 試驗的 24 個月合併數據
•來自Oragrowth210和Oragrowth212試驗的10名受試者的18個月和24個月的生長數據可供選擇,這些受試者在12個月時符合每個方案的AHV標準。
•來自兩項試驗的1.6 mg/kg和3.2 mg/kg隊列的綜合數據表明,與之前在輝瑞第四階段 KIGS 數據集中觀察到的 rhGH AHV 從 12 個月到 24 個月內下降約 20% 相比,生長速度沒有顯著下降。3
安全性和耐受性亮點
Oragrowth210和Oragrowth212試驗的最高結果均顯示出無明顯的安全記錄,其特徵是沒有與治療相關的嚴重不良事件(SAE),沒有參與者因不良事件(AE)而停止治療的情況,並且在實驗室值、不良事件數據或心電圖(ECG)讀數等各種參數中沒有任何重大安全問題。
† Zadik 等人 Horm Res 1992
†† 改編自 Albertson-Wikland 等人 JCEM 1994 中的數據;列出的 24 小時暴露量反映了給藥劑量約 60% 的吸收率/生物利用度,
* 對於所有 OragroWth 試驗 AHV 值,ANCOVA 模型術語:治療、劑量年齡 1、性別、基線 HT SDS、基線 BMI SDS、基線 IGF-1 SDS、LUM-201 PEM、基線 BA 延遲,對於圖表 HT SDS-MPH SDS 條表示最小二乘均值 (LSM),誤差條表示 LSM 的標準誤差
1 Blum 等人 JES 2021,
2 Lechuga-Sancho 等人 JPEM 2009,
3 Ranke 等人 JCEM 2010、4 Bright 等人 JES 2021
電話會議和網絡直播詳情
日期:2023 年 11 月 8 日
時間:美國東部時間上午 8:30
撥入:1-877-407-9716 或 1-201-493-6779(國際)
會議編號:13742617
或者撥號註冊(在預定開始時間前 15 分鐘可用):https://callme.viavid.com/viavid/?callme=true&passcode=13742617&h=true&info=company-email&r=true&B=6
網絡直播鏈接:https://viavid.webcasts.com/starthere.jsp?ei=1642841&tp_key=d9efda8a69
幻燈片可在Lumos Pharma網站上的 “投資者與媒體” 部分的 “活動和演示” 鏈接下找到:https://investors.lumos-pharma.com/events-presentations。
電話重播將在通話結束大約兩小時後播出,並且可以在通話結束後的兩週內使用與上述相同的號碼進行重播。
虛擬KOL活動已計劃
該公司計劃在12月6日舉辦一場虛擬的KOL活動,更詳細地討論Oragrowth210和Oragrowth212試驗的主要結果,並提供臨牀和企業戰略的最新信息。以下三位內分泌學領域備受尊敬的思想領袖將加入管理層的行列:
•安德魯·道伯,醫學博士,華盛頓特區國家兒童醫學中心內分泌科主任
•費爾南多·卡索拉,醫學博士,智利大學母嬰研究所兒科內分泌科主任
•Leslie A. Soyka,醫學博士,麻省大學紀念醫學中心兒科內分泌科主任;馬薩諸塞州伍斯特麻省大學陳醫學院副教授
有關KOL活動的訪問信息將在稍後提供。
Oragrowth210 試用設計
Oragrowth210 試驗是一項全球性的多地點研究,評估了在三種不同劑量水平(0.8、1.6、3.2 mg/kg/天)下口服給藥與每天注射 34 微克/天的重組人類生長激素 (rhGH) 的效果。LUM-201該試驗涉及82名被診斷患有中度兒科生長激素缺乏症(PGHD)的參與者。為了豐富試驗人羣,增加可能對 LUM-201 有反應的個體,在篩選過程中應用了特定的 PEM 標準。這些標準包括將 IGF-1 的基線值高於 30 納克/毫升,以及在給未接受治療的 PGHD 患者服用 0.8 mg/kg 劑量的 LUM-201 後,生長激素的峯值達到 5 納克/毫升或更高。值得注意的是,與每日生長激素治療相比,這項研究的主要目的不是確定療效或證明其不遜色。
oragrowth212 試用版設計
Oragrowth212 試驗是一項單點開放標籤研究,旨在評估口服 LUM-201 的藥代動力學 (PK) 和藥效學 (PD) 影響。該試驗包括多達 24 名未接受過兒科生長激素缺乏症 (PGHD) 治療的人,他們按兩種不同的劑量水平服用 LUM-201,
具體來説是 1.6 和 3.2 毫克/千克/天。Oragrowth212 試驗的每位參與者都符合患者 PEM 陽性的標準,從而確保了他們對 LUM-201 的潛在反應。
關於 Lumos Phar
Lumos Pharma, Inc. 是一家臨牀階段的生物製藥公司,專注於罕見病療法的開發和商業化。該公司成立並由一支在罕見病藥物開發方面擁有長期經驗的管理團隊領導。Lumos Pharma的主要候選治療藥物 LUM-201 是一種新型的口服生長激素(GH)促分泌劑,旨在將約34億美元的全球生長激素市場從注射療法轉變為口服療法。LUM-201 目前正在多項兒科生長激素缺乏症 (PGHD) 的 2 期臨牀研究中進行評估,並已在美國和歐盟獲得孤兒藥認定。欲瞭解更多信息,請訪問 https://lumos-pharma.com/。
關於前瞻性陳述的警示説明
本新聞稿包含Lumos Pharma, Inc.的前瞻性陳述,涉及重大風險和不確定性。本新聞稿中包含的所有此類聲明均為1995年《私人證券訴訟改革法》所指的前瞻性陳述。如果事實證明我們的預測不正確,這項法律在一定程度上使我們有機會分享我們的未來展望,而不必擔心會提起訴訟。
我們對我們的業務充滿熱情,包括 LUM-201 及其可能為臨牀患者提供幫助的潛力。這種激情使我們感到樂觀,相信我們的努力將取得成功,為患者帶來有意義的改變。請記住,實際業績或事件可能與我們在前瞻性陳述中披露的計劃、意圖和預期存在重大差異。
我們試圖通過使用 “預期”、“即將到來”、“將”、“計劃”、“打算”、“預期”、“大約”、“預期”、“潛力”、“臨近” 等詞語來識別前瞻性陳述,以及對未來時期或這些術語的負面提法的類似提法。並非所有前瞻性陳述都包含這些識別性詞語。除其他外,前瞻性陳述的示例包括我們就第二階段數據發表的聲明,為口服 LUM-201 推進到第 3 期提供了支持證據,明確證明口服 LUM-201 有可能作為中度生長激素缺乏患者的注射療法的可行替代方案,LUM-201 有可能根據接受生長激素治療的中度 PGHD 患者的既定標準提高 AHV,期待討論這些數據並最終確定我們的階段計劃 3 項關鍵試驗美國食品藥品管理局在預計將於2024年上半年舉行的第二階段會議結束時表示,這是一項重大的科學突破,有可能徹底改變治療中度生長激素缺乏症患兒的方法,來自Oragrowth210試驗的數據支持將1.6 mg/kg劑量作為3期試驗的最佳劑量,該研究的每日生長激素組中觀察到的這種獨特的生長模式可能是由於劑量較高和存在異常情況 liers,在一項規模更大、統計學上更可靠的 3 期試驗中,AHV LUM-201與生長激素治療相關的中等患者羣體的歷史價值以及除歷史事實陳述以外的任何其他陳述將更加一致。
我們希望我們能夠以 100% 的準確度預測未來,但這是不可能的。我們的前瞻性陳述既不是歷史事實,也不是對未來表現的保證。您不應依賴任何這些前瞻性陳述,為了幫助您自己確定風險,我們對可能導致實際結果與我們的前瞻性陳述存在重大差異的風險進行了廣泛討論,包括與持續分析 LUM-201 試驗數據相關的風險、我們未來與監管機構互動(包括我們與美國食品藥品管理局的第二階段會議結束)的時機和結果、Lumos 根據需要籌集額外股權資本的時機和能力我們的 3 期試驗,我們預測未來或有負債和業務運營所需的現金使用情況和儲備的能力,有效和及時地組織我們的三期試驗的能力,成功開發候選產品的能力,大流行的影響,其他普遍的健康問題或軍事衝突,包括烏克蘭-俄羅斯衝突和
中東衝突和其他可能導致實際結果與此類前瞻性陳述中表達或暗示的事項存在重大差異的風險,包括 “風險因素” 部分和Lumos Pharma截至2023年6月30日的10-Q表季度報告以及向美國證券交易委員會提交的其他報告,包括我們隨後的10-Q表季度報告和8-K表的最新報告。所有這些文件都可以在我們的網站上找到。在就我們的股票做出任何決定之前,您應該閲讀並理解這些文件。
我們預計,隨後的事件和事態發展將導致我們的看法發生變化。我們可能會選擇在未來的某個時候更新這些前瞻性陳述,但是,我們不承擔任何這樣做的義務。因此,在本新聞稿發佈之日之後的任何日期,您都不應依賴這些前瞻性陳述來代表我們的觀點。
###
投資者和媒體聯繫人:
麗莎米勒
Lumos Parma 投資者關係
512-792-5454
ir@lumos-pharma.com