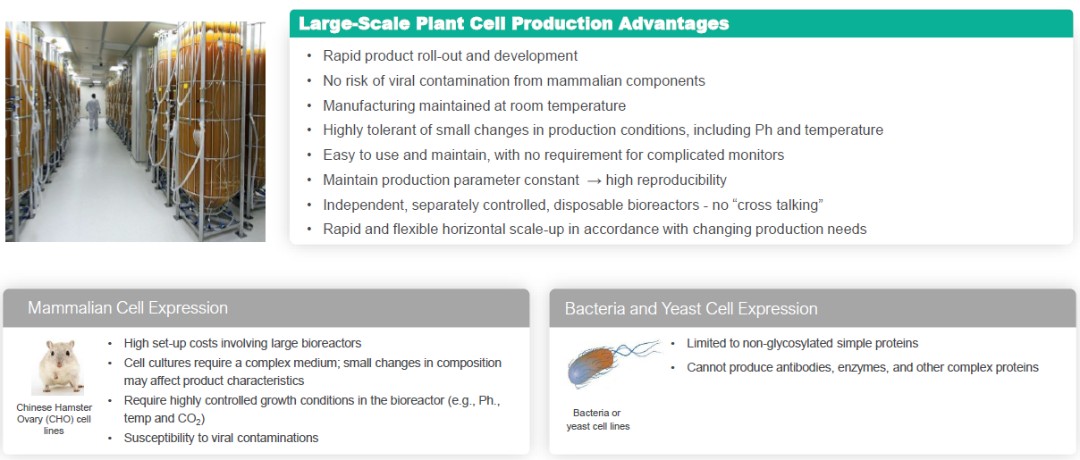
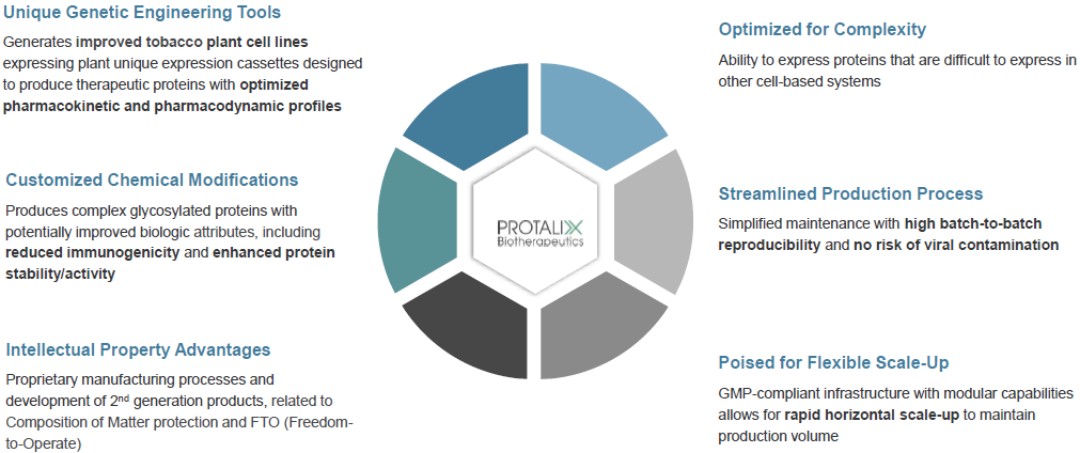
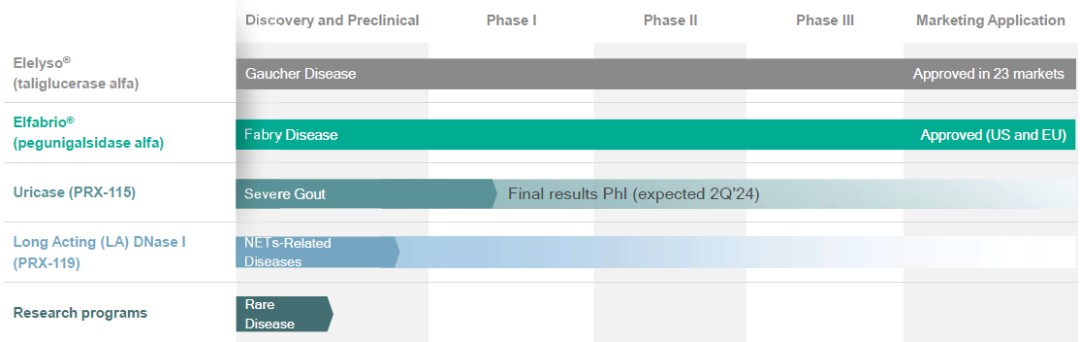
在截至2023年9月30日的三個月中,我們記錄的所得税約為10萬美元,這主要是為TCJA第174條編列當期税款準備金的結果。
截至2023年9月30日的九個月與截至2022年9月30日的九個月相比
銷售商品的收入
在截至2023年9月30日的九個月中,我們的商品銷售收入為3,030萬美元,與截至2022年9月30日的九個月的2,120萬美元收入相比增長了910萬美元,增長了43%。增長的主要原因是銷售額增加了1,440萬美元 致基耶西, 在獲得美國食品藥品管理局和Elfabrio的EMA批准之後,這是 由於時間差異,輝瑞對巴西的銷售額減少了330萬美元,部分抵消了部分抵消。
許可和研發服務收入
我們的許可證和研發服務收入為24.7美元 截至2023年9月30日的九個月中,收入為1,780萬美元,增長了690萬美元,增長了39%,而截至2022年9月30日的九個月的收入為1,780萬美元。這一增長是由於Chiesi在FDA批准Elfabrio時支付了2,000萬美元的監管里程碑,但與基西協議相關的確認收入減少了1,310萬美元,部分抵消了這筆款項。來自許可和研發服務的收入主要由我們在基耶西協議中確認的收入組成。
銷售商品的成本
截至2023年9月30日的九個月中,銷售商品成本為1,410萬美元,較截至2022年9月30日的九個月的1,720萬美元的商品銷售成本減少了310萬美元,下降了18%。 銷售成本的下降主要是由於對巴西和輝瑞的商品銷售減少,但Elfabrio對基耶西的銷售增加部分抵消了這一下降。向Chiesi的銷售包括某些藥物的成本,這些成本已被確認為研發費用,因為它是作為研發活動的一部分生產的。因此,所售商品的相關成本不包括此類藥物的成本。
研究和開發費用
在截至2023年9月30日的九個月中,我們的研發費用總額約為1,400萬美元,其中包括約620萬美元的分包商相關費用、約550萬美元的工資和相關費用、約50萬美元的材料相關費用和約180萬美元的其他費用。在截至2022年9月30日的九個月中,我們的研發費用總額約為2370萬美元,其中包括約1,510萬美元的分包商相關費用、約540萬美元的工資和相關費用、約120萬美元的材料相關費用和約200萬美元的其他費用。
與截至2022年9月30日的九個月相比,截至2023年9月30日的九個月中,研發費用總額減少了970萬美元,下降了41%。研發費用的減少主要是由於我們的Fabry臨牀計劃以及相關監管機構完成了與BLA和MAA對Elfabrio的審查相關的監管程序。
我們預計,隨着某些候選產品的臨牀前和臨牀試驗進入更高級階段,研發費用將繼續成為我們的主要支出。
銷售、一般和管理費用
截至2023年9月30日的九個月中,銷售、一般和管理費用為1,080萬美元,與截至2022年9月30日的九個月的860萬美元相比,增加了220萬美元,增長了26%。增長的主要原因是一次性現金獎金和股票薪酬的增加使工資和相關費用增加了約150萬美元,專業費用增加了20萬美元,差旅、會議和員工培訓費用增加了30萬美元。
財務費用,淨額
截至2023年9月30日的九個月中,財務支出淨額為110萬美元,與截至2022年9月30日的九個月的70萬美元相比,增加了40萬美元,增長了57%。增加的主要原因是減少了60萬美元