附錄 99.1

Ocuphire 2023 年 11 月公司簡報

本演示文稿包含
1995 年《私人證券訴訟改革法》所指的 “前瞻性陳述”。此類聲明包括但不限於有關計劃監管申報和批准的成功與時機、商業化前活動、商業化
戰略和時間表、業務戰略、產品標籤、現金跑道、可擴展性、老花眼 (P)、昏暗光/夜視障礙 (DLD) 和糖尿病視網膜病變 (DR) /糖尿病黃斑水腫 (DME) 的未來臨牀試驗,包括
酚妥拉明眼用溶液(POS)有可能成為 “同類最佳” 的老花眼藥水,以及計劃在未來進行臨牀治療的時機APX3330、APX2009 和 APX2014 的試驗,APX3330 的第三階段註冊路徑的進展,美國食品藥品管理局
關於特殊協議評估的協議,計劃中的監管申報的成功與時機,業務戰略,現金跑道,可擴展性,APX3330 有可能成為最先進和第一線的DR患者治療方法,以及
APX3330 減緩 DR 進展的潛在市場機會和能力。這些前瞻性陳述基於公司當前的預期,涉及的假設可能永遠無法實現或可能被證明是
不正確的。由於各種風險和不確定性,實際結果和事件發生時間可能與此類前瞻性陳述中的預期存在重大差異,包括但不限於:(i)監管申報以及臨牀前和臨牀試驗(包括註冊和數據讀取)的成功、成本和
時間;(ii)監管要求或發展;(iii)臨牀試驗設計和監管路徑的變化;(iv)資本資源要求的變化;(v) 與 Ocuphire 無法獲得相關的風險足夠的額外資本來繼續推進其候選產品及其臨牀前項目;(vi)立法、監管、政治和
經濟發展,(viii)市場機會的變化,(viii)與Viatris的合作可能無法促進Ocuphire候選產品的商業化或市場接受的風險;(ix)任何Ocuphire候選產品的成功與時機,包括可擴展性 Ocuphire 的候選產品以及 (x) Ocuphire 知識的維護財產權。上述對可能
導致實際事件與預期不同的重要因素的審查不應被解釋為詳盡無遺,應與本文和其他地方包含的陳述一起閲讀,包括公司可能不時向美國證券交易委員會提交的
文件中詳述的風險因素。本演示文稿中包含的所有前瞻性陳述僅代表其發表之日。公司沒有義務更新此類陳述,以
反映在聲明發表之日後發生的事件或存在的情況。公司對本演示文稿中包含或
以引用方式納入的信息的準確性或完整性不作任何明示或暗示的陳述或保證。本演示文稿中包含或以引用方式納入的任何內容都不是公司對過去或未來的承諾或陳述,也不得作為其依據。公司
對任何此類信息的準確性或完整性不承擔任何責任。本演示文稿還包含獨立各方以及我們做出的與市場份額有關的估計和其他統計數據,以及我們
行業的其他數據。這些數據涉及許多假設和侷限性,提醒您不要過分重視此類估計。此處包含的商標是其所有者的財產,僅用於參考目的
。此類使用不應被解釋為對此類產品的認可。披露和前瞻性陳述

Ocuphire Pipeline 候選產品適應症臨牀前 1 期
2 期 3 期監管批准即將到來的里程碑 APX3330 口服藥糖尿病視網膜病變 (DR) EOP2 Mtg 2023 年 10 月特殊方案評估 (SPA) 提交 APX3330 局部分娩視網膜精選視網膜藥物輸送技術 0.75% 眼藥水藥理學誘發的散瞳藥獲批 (RYZUMVI™) 2023 年 9 月 Presbyopia (P) VEGA-2 第 3 階段頭條數據 2023 年第四季度昏暗的光線 APX2009 APX2014或夜視障礙 (DLD) SPA 已提交 LYNX-2 第二階段 3 期試驗 (n=150+) SPA 與 Viatris 合作

擁有數十年藥物研發經驗的管理團隊 Drey ColemanVP、
臨牀運營副總裁 Amy Rabourn、CPA、財務高級副總裁查理·霍夫曼、工商管理碩士高級副總裁、企業發展米奇·布里格爾、博士臨牀開發和戰略負責人丹妮拉·奧尼修博士、研發、化學和產品開發全球主管 Ronil Patel,mTech,運營和業務拓展高級副總裁 Chris Ernst 全球負責人制造業 Barbara Withers,博士副總裁,臨牀和監管策略 Bindu Manne 市場開發和商業化主管 Laura
Gambino 項目管理總監喬治·馬格拉思,醫學博士,工商管理碩士首席執行官

企業亮點視網膜疾病的後期候選臨牀藥物
代表數十億美元機會用於屈光障礙酚妥拉明眼用溶液 0.75% (POS) 與 Viatris 簽訂的全球許可協議,為酚妥拉明適應症的所有開發和商業化提供資金:用於治療藥理誘發的散瞳孔病的 RYZUMVI™
(酚妥拉明眼用溶液)0.75% 於 2023 年 9 月獲得美國食品藥品管理局批准里程碑付款老花眼和昏暗光線幹擾目前處於階段
3經驗豐富的視網膜藥物研發團隊將 APX3330 推向第 3 期 APX3330:改變模式、非侵入性、安全的口服片劑適用於數百萬目前未接受治療的 NPDR 患者 Ref-1,一種針對視網膜疾病的新型雙靶點
(血管生成和炎症)ZETA-1 第 2 期顯示 APX3330 可預防或減緩糖尿病視網膜病變 (DR) 的進展 EOP2 成功與 FDA 會面並進行特別方案評估 (SPA) 被提交

糖尿病視網膜病變市場和未滿足的需求

糖尿病眼病是導致失明的常見原因糖尿病和糖尿病
視網膜病變 (DR) https://webeye.ophth.uiowa.edu/eyeforum/tutorials/diabetic-retinopathy-med-students/Classification.htm https://www.mayoclinic.org/diseases-conditions/type-1-diabetes/symptoms-causes/syc-20353011 https://www.mayoclinic.org/diseases-conditions/type-2-diabetes/symptoms-causes/syc-20351193 兩種類型的 DR 非增生性糖尿病視網膜病變 (NPDR) ——最常見的 DR 形式——水腫和滲出液的早期階段、中央
視力模糊增生性糖尿病視網膜病變 (PDR) — DR 的後期階段,以視網膜血管和疤痕組織異常為標誌糖尿病黃斑水腫 (DME) 可發生在 DR 的任何階段。糖尿病是一組以高血糖水平為特徵的疾病
。糖尿病是由人體產生和/或使用胰島素的能力缺陷引起糖尿病視網膜病變 (DR) 發生在血糖水平的波動或不穩定損害
視網膜 1 型糖尿病 (T1D) 中的血管時:人體產生的胰島素很少或根本不產生,這意味着患者需要每天注射胰島素來維持血糖水平 2 型糖尿病 (T2D):最常見的糖尿病-無論是
身體無法產生足夠的胰島素或對胰島素產生抵抗正常視網膜糖尿病視網膜

美國糖尿病協會;國際糖尿病聯合會;Healthline;
*Ocuphire 內部分析和假設 Das UN。DME、視網膜病變和年齡相關性黃斑變性是炎症性疾病。Arch Med Sci. 2016;12 (5): 1142-1157。doi: 10.5114/aoms.2016.61918 患者調查改編自獅子會
國際基金會和國際糖尿病基金會——歐洲;Meltzer 2000 Guidehouse 全球數據、市場範圍和投資者預測三角測量(2020)AMD = 年齡相關性黃斑變性;DME = 糖尿病性黃斑水腫;
BRVO = 分支視網膜靜脈閉塞國家慢性病預防與健康促進中心。慢性病的健康和經濟成本。亞特蘭大(喬治亞州):美國衞生部疾病控制與預防中心
和公共服務部;2018年玻璃體內Aflibercept預防糖尿病視網膜病變威脅視力併發症的隨機試驗的四年視覺結果(協議W)。”JAMA。2023 年 2 月 7 日糖尿病視網膜病變
概覽當前的治療格局表明需要非侵入性療法。預計到 2050 年,患有 DR 的人數將增加 1400 萬在美國,患有 NPDR DR 的成年人中約有 800 萬是導致失明的主要原因,發病年齡中位數為 45-50 歲。大多數中度至重度 DR 患者未接受抗血管內皮生長因子治療由於注射負擔且對視力沒有好處,患有慢性病的
付款人偏愛預防進展,例如糖尿病是醫療成本增加的主要驅動力,醫生沒有非侵入性的NPDR選擇,目前的標準是等待監測

美國糖尿病協會;國際糖尿病聯合會;Healthline;
*Ocuphire 內部分析和假設;Spherix Global Insights 患者調查改編自獅子會國際基金會和國際糖尿病基金會歐洲分會;Meltzer 2000 估算值由美國國家眼科研究所、
概況介紹、全球數據和研究與市場提供。估計值四捨五入。美國的估計患病率;DME-糖尿病性黃斑水腫;年齡相關性黃斑變性;地理萎縮;視網膜靜脈閉塞美國糖尿病
視網膜病變市場大多數 DR 患者是 APX3330 1000萬糖尿病視網膜病變 (DR) 的 NPDR 嚴重程度目標人羣 8MNPDR 患者美國市場機會目標患者
人羣 8% NPDR 非增生 DR 增殖性 DR 真實世界圖表對美國 DR 患者的綜述患者百分比 DR 類型

Spherix Global Insights:DR Market DYNAMIX 2022 年 10 月早期治療
糖尿病視網膜病變研究小組。眼科。1991;98(5 補編): 823-33。糖尿病控制和併發症試驗研究組。N Engl J Med. 1993;329 (14): 997-86。Fathy C、Patel S、Sternberg P Jr、Kohanim S.
美國糖尿病視網膜病變篩查指南遵守情況存在差異:全面回顧和未來方向指南。Semin Ophythalmol。2016;31 (4): 364—377。doi:10.3109/08820538.2016.1154170 DR 嚴重程度的進展
由於治療負擔,NPDR 患者很少接受抗血管內皮生長因子注射的治療 1 年隨訪 3 年隨訪 5 年隨訪無論嚴重程度如何,所有
隨着時間的推移,眼睛會惡化 DR 嚴重程度(DRSS 評分)APX3330 的早期幹預可能會減緩非增生性糖尿病視網膜病變向增生性糖尿病視網膜病變的進展

糖尿病視網膜病變治療格局
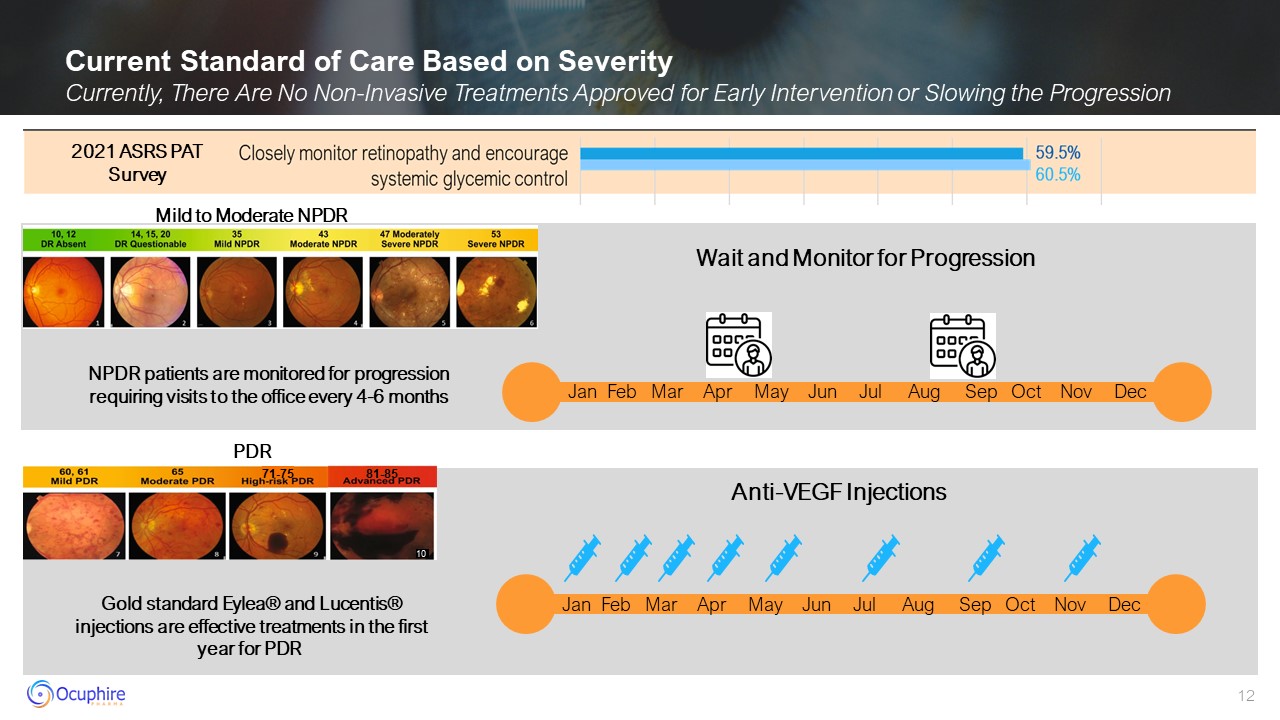
基於嚴重程度的當前護理標準目前,沒有批准用於早期幹預或減緩進展的非侵入性
治療方法等待並監測進展輕度至中度 NPDR Anti-vegf
注射 PDR 一月二月三月四月五月六月七月九月十月十一月十月十二月 10 月 81-85 71-75 一月三月四月五月六月七月九月 NPDR 患者接受監測,要求每 4-6 個月就診一次黃金標準 Eylea® 和 Lucentis® 注射劑在 2021 年 PDR 的第一年是有效的治療方法 ASRS PAT 調查

糖尿病視網膜病變研究非侵入性療法概況
視網膜病變的 APX3330 是最先進的口服候選藥物公司藥物靶點/MOA 適應症給藥途徑第 1 階段 2 期 3 期主要終點/次要終點 APX3330 Ref-1 抑制劑(抗血管生成和抗炎)口服 ✓ ✓ 2022 2020:2 步 DRSS @wk24 RG7774 CB2 受體(大麻素)口服 ✓ X 2023 2020:2 步 DRSS @wk36 BAY1101042 鳥苷酸環化酶
激活劑 DR 口服 ✓ 2021:2 步 DRSS @wk24 OPL-0401 ROCK 1/2 抑制劑 DR 口服 ✓ 2021:2-step DRSS @wk24 VX-01 AOC-3 抑制劑 DR Oral ✓ 2022:未公開 OTT166 整合素抑制劑 DR Eyedrop ✓ 2022:
兩步 DRSS @wk24 ✓ 已完成正在進行中 ✕ 已停產注意:由於劑量限制不良事件(例如肝臟和心血管),兩種酪氨酸激酶和一種血漿激肽抑制劑在第 2 期口服失敗 APX3330 是唯一具有經驗證的視網膜通路的
候選藥物新生和炎症。人體暴露 >10,000 個受試者日全身暴露,劑量為 600 mg/天,具有良好的安全性和耐受性。

糖尿病視網膜病變侵入性療法(IVT/suprachoroidal)概覽
Eylea® /Lucentis® 獲得批准,但未用於NPDR患者;很少用於輕度 PDR 公司藥物靶點/MOA 給藥途徑第 1 階段 2 階段 3 期商用 Eylea® (aflibercept) VEGF-A/B;
PIGF Intravitreal ✓ ✓ ✓ ✓ *1 Lucentis ranibizumab)VEGF-A Intravitreal ✓ ✓ ✓ ✓ *2 KSI-301(他可西單抗)VEGF Intravitreal ✓ N/A EYP-1901 Voloronib* (TKI) Intravitreal ✓ bi 764524 Anti-Sema3A 缺血
調節劑 Intravitreal ✓ OTX-TKI Axitinib* (TKI) Intravitreal ✓ RGX-314AAV8-VEGF Suprachoroidal(基因療法)✓ ✓ *支持批准的試驗 1 全景臨牀試驗 2 協議 I 和 Rise & Ride ✓
已完成正在進行 X 已停產 * 由於劑量限制毒性導致視網膜口服/全身治療失敗公司網站和 www.clinicaltrials.gov(截至 2023 年 10 月 31 日)Eylea® 是 Regeneron 的商標,Lucentis® 是 Geneneron 的
商標科技

APX3330 背景

Logsdon 等人(2018)、Li 等人(2014 年)。APX3330-靶向
Ref-1 抑制 ref-1 的作用機制參與導致糖尿病視網膜病變和糖尿病黃斑水腫的關鍵途徑 Ref-1(還原氧化效應因子-1)視網膜疾病的新靶點,是
血管生成 (VEGF) 和炎症 (nfKB) 作用機制的轉錄因子調節劑 — Ref-1 抑制缺氧 Ref-1 HIF-1α VEGF(信號級聯)炎症 ref-1 NF-²B 其他生長因子(信號
級聯)腫瘤壞死因子趨化因子新生血管化 Lucentis® EYLEA® Anti-vegf 類固醇 APX3330 獨特MOA 可減少異常血管生成和炎症 APX3330 不會消耗 VEGF 水平,而是將 VEGF 水平正常化至
生理水平抗 VEGF 注射不針對炎症

APX3330:藥物研發歷史和專利支持人體安全、MOA 和 PK 12的重要臨牀前和
臨牀數據* 1 期和第 2 期試驗人體暴露量 >10,000 個受試天數 600mg 的專利 to2035+ 在炎症/肝炎和癌症患者中研究(分別由衞材
和 Apexian 研究)APX3330 新化學實體臨牀前療效和毒理學套餐 APX3330 IND 6 第一期試驗 5 期二期試驗 2 期試驗第 3 階段註冊 NDA 申請側重於眼科包括衞材先前開發的
ZETA-1 試驗肝炎症適應症和Apexian在11項1期和2期試驗中對實體瘤進行了廣泛研究,在20多項體外和動物研究中進行了廣泛研究,取得了良好的療效和安全性
結果

Tao Yan 等APX3330 可促進
一型糖尿病大鼠中風後的神經恢復作用。衰老與疾病。第 9 卷,2018 年 10 月 Apurinic/Apyrimidinic 內切核酸酶 1 調節巨噬細胞的炎症反應。Jedinak A、Dudhgaonkar S、Kelley MR、Sliva D. Anticancer Res.2011 年 2 月;31 (2): 379-85。PMID:
21378315 Fehrenbacher、J.C.、Guo、C.、Kelley、M.R. & Vasko、M.R. DNA 損傷介導炎症介質 MCP-1 和 LPS 誘發的神經元靈敏度變化,可以通過增強
APE1 的 DNA 修復功能來逆轉。神經科學 366、23-35、doi: 10.1016/j.neuroscience.2017.09.039 (2017) 作用機制的體外驗證 APX3330 降低 VEGF 水平和炎症細胞因子;提供神經元保護 APX3330 可降低 VEGF 蛋白
在臨牀前中風模型中的表達 APX3330 減少 LPS 刺激巨噬細胞中的促炎細胞因子增加 APX3330 劑量 VEGF 控制 APX3330 APX3330 可增強 Ref-1 內切酶背根神經節
神經元的活性 APX3330 可提高 DNA 氧化修復和神經元保護
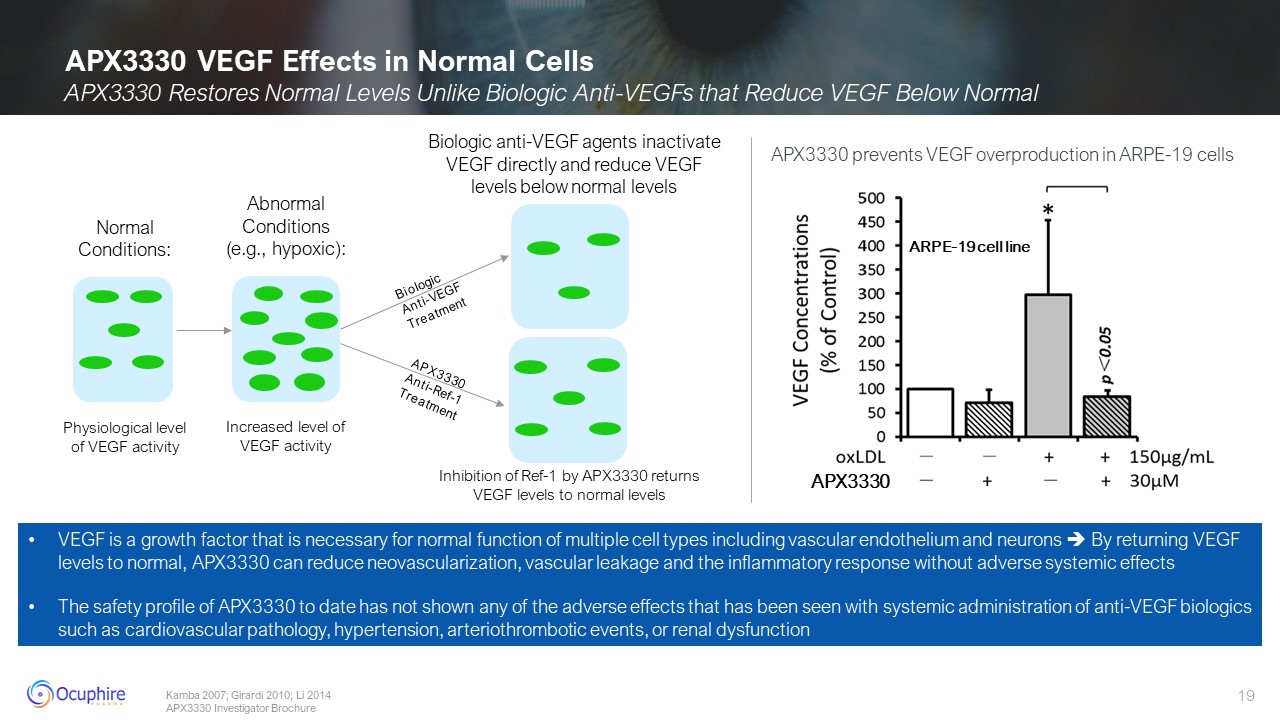
APX3330 血管內皮生長因子對正常細胞的影響異常狀態(例如
缺氧):血管內皮生長因子活性水平升高正常情況:血管內皮生長因子活性的生理水平 Kamba 2007;Girardi 2010;Li 2014 APX3330 研究者手冊生物抗血管生長因子治療 APX3330 Anti-Ref-1 治療 Biologic
抗血管內皮生長因子會直接失活 VEGF 並將血管內皮生長因子水平降至正常水平以下 APX3330 抑制 Ref-1 VEGF 水平達到正常水平 VEGF 是一種生長因子,是包括血管細胞在內的多種細胞類型正常功能所必需的內皮細胞和神經元通過使血管內皮生長因子水平恢復正常,APX3330 可以減少新生血管形成、血管滲漏和炎症反應,而不會產生不良的全身影響。迄今為止,APX3330 的安全性概況
尚未顯示出系統使用抗血管生長因子生物製劑(例如心血管病理、高血壓、動脈血栓形成事件或腎功能障礙 APX3330 ARPE-19 cell
系 APX3330 可防止 VEGF ARPE-19 細胞的產量過剩 APX3330 可恢復正常水平與生物抗體不同將 VEGF 降低到正常水平以下的 VEGF

APX3330 ZETA-1 臨牀試驗

ZETA-1:對糖尿病
視網膜病變受試者口服 APX3330 的第 2 期試驗多中心、隨機、雙面罩、安慰劑對照 24 周試驗初級:第 24 周 DRSS(糖尿病視網膜病變嚴重程度量表 1)改善≥2步的受試者百分比次要:DRSS 改善 ≥1、≥2、≥3、≥4 研究眼、同眼、雙眼 DRSS 惡化 ≥1,≥2、≥3、≥4,研究眼睛、同行眼睛、雙眼發展為視力威脅併發症中央亞視場厚度 (CST) 最佳校正距離視力 (BCDVA) DME 同伴
眼睛狀態安全和耐受性探索性:炎症細胞因子終點 25 個美國站點 N = 103 名中度至重度 NPDR 或輕度 PDR 的參與者(DRSS 47、53、61)關鍵納入對象:≥ 18 歲 DRSS 47、53 或
61 允許非中部 DME 允許使用2 ETDRS BCVA ≥ 60 個字母(20/63)關鍵排除:OCT CST >320 µm2 受試者允許在同伴眼中使用 DME 過去 6 個月內的 Anti-vegf 3 Hba1c ≥ 12.0% 資格標準 103 名受試者入學(FPFV
2021 年 4 月至 LPLV 2022 年 8 月)2023 年 1 月公佈的頭條數據 1:1 作者:中央閲讀中心參與的 DMEFellow Eye 是可以接受的包括全身性或 IVT VEGF www.clinicaltrials.gov (NCT04692688);Eylea® 是 Regeneron 的
註冊商標 = 非增殖性糖尿病視網膜病變 PDR = 增殖性糖尿病視網膜病變第 0 周 12 周 24 周主要終點 APX3330 600mg/天 (BID) 安慰劑 BID 隨機化

ZETA-1:基準人口統計學和系統特徵在
Arms 中均衡 ZETA-1 臨牀試驗 APX3330 n=51 安慰劑 n=52 年齡(歲)平均值(範圍)54.3(26-81)58.3(24-78)性別:男性 n(%)24(47%)26(50%)種族:西班牙裔或拉丁裔 n (%) 40 (78%) 28 (55%) 41 (79%) 23 (44%) 糖尿病狀態(年份)平均值(範圍)15(0-36)16(0-58)收縮壓(mmHg)平均值 136 139 舒張壓(mmHg)平均值 82 80 心率(次數/分鐘)平均值 77 76 血紅蛋白 A1C
(%) 平均值 8.4 8.3 體重指數 (kg/m^2) 平均值 3131 人口統計 DRSS 分數 APX3330 n=51 安慰劑 n=52 總計 n=103 BCVA 研究眼信(平均值)81 78 80(20/25 Snellen)BCVA 同伴眼信(平均值)76 77 77(20/32 Snellen)OCT CST 研究眼(µm)292 286 289 SE Y 中心視網膜內液體 — 21 N — 26 Y — 12 N — 31 Y — 33 N — 57 SE 中央凹中心的視網膜內積液 Y — 1 N —
20 Y — 1 N — 11 Y — 2 N — 31 研究眼的眼內壓力 (mmHg) 15 16 15 APX3330 n=49 安慰劑 n=52 DRSS 分數 — 研究眼 47(中度至重度 NPDR)22 (43%) 18 (35%) 53(中度重度至
重度 NPDR)25(49%)28(54%)61(輕度增生性糖尿病視網膜病變)4(8%)6(12%)DRSS 分數 — Fellow Eye 43 或更低(輕度至中度 NPDR 或更高)15(31%)13(25%)47(中度至重度 NPDR)15(31%)20 (38%) 53(中度至重度 NPDR)12(25%)10(19%)61(輕度增生性糖尿病視網膜病變)1(2%)4(8%)65 或以上(中度至重度 prolif。DR) 6 (12%) 5 (10%) 關鍵視覺指標 Good Visual
Acuity Fluid 低於 320µm 注意:15 只同伴的眼睛 CST>320 微米(中樞介入 DME 的眼睛)

DR 系統性藥物中具有臨牀意義的註冊終點應
評估雙眼 DRSS 的變化;在 EOP2 FDA 會議上正式確認來源:ZETA-1 臨牀試驗 1。Nair P、Aiello LP、Gardner TW、Jampol LM、Ferris FL III。來自NEI/FDA糖尿病視網膜病變臨牀試驗設計和
終點研討會的報告。Invest Opthalmol Vis Sci。2016 年 10 月 1 日;57 (13): 5127-5142。doi:10.1167/iovs.16-20356。PMID:27699406;PMCID:PMC6016432。10 81-85 71-75 本地藥物(玻璃體內注射)系統性藥物的先例可批准終點
DRSS 在 DR 中:研究眼部 DRSS 改善 ≥ 2 步 Aflibercept(全景試驗)雷尼珠單抗(RISE/RIDE 試驗)DR 中系統性藥物的可批准終點包括:≥ 3 步 DRSS 改善雙眼量表上的改善
≥三步 DRSS 在雙眼量表上惡化對於口服給藥,由於給藥不同,雙眼 DRSS 終點與抗 VEGF IVT 先例不同接受疾病的改善或惡化(減緩或
預防進展)1,DRSS 是 DR 的既定替代終點

第 2 階段末會議成果

FDA 接受第 3 階段 APX3330 DR
計劃的雙眼 DRSS 人體量表。在雙眼人體量表中,對較差的眼睛進行加權,而不是計算雙眼總和 FDA 等級(視力變差/眼睛更好)描述量表
描述量表
第 10/10 步 No DR 1 20/

DRSS 惡化 DRSS 改善 ZETA-1:雙目人體量表 (LOCF) 第 24 周 DRSS 改善
或惡化的受試者百分比 FDA EOP2 會議 2023 年 10 月,數據使用人體量表

ZETA-1:在
雙目人體量表(觀察到的病例)上第 24 周 DRSS 改善或惡化的受試者百分比 DRSS 改善 DRSS 惡化 FDA EOP2 會議 2023 年 10 月會議,數據使用人體量表

APX3330 減少了出現 PDR 的受試者的百分比和丟失 BCVA 的受試者在第 24 周發作 PDR(MitT 人羣)的百分比 APX3330 降低了在 24 周內出現 PDR 的受試者的百分比 BCVA 在第 24 周(安全人羣)丟失 BCVA 數據
顯示在第 24 周臨牀試驗中失去視力的受試者比安慰劑少於安慰劑。APX3330 ZETA-1APX3330 防止了結構性視網膜異常的進展

APX3330 SaEs:運動障礙、TIA、胸痛安慰劑 SAE:眩暈、乏力、
多器官功能障礙、心動過緩、冠心病、膽石症、COVID-19 肺炎、蜂窩組織炎、呼吸衰竭、皮膚潰瘍、外周栓塞 AE → 戒斷 APX3330:先兆性咽痛、呼吸困難;安慰劑:DME(雙眼)*器官類別 ZETA-1 中的首選術語
: 急性不良事件的治療口服 APX3330 顯示出良好的安全性和耐受性與先前的試驗一致安慰劑 (n=52) APX3330 (n=51) 總活性 120 91 Ae 35 受試者 (67%) 29 (57%)與治療相關的不良反應 17 (14%) 14 (15%) 嚴重不良症 11 (9%) 3 (3%) 受試者因不良反應 1 (2%) 2 (4%) 死亡 1 (2%) 0 (0%) > 5% 的受試者出現不良反應* 糖尿病視網膜水腫 5 (10%) 2 (4%) 糖尿病
視網膜病變 6 (12%) 1 (2%) 玻璃體脱落 3 (6%) 0 (0%) 白內障 1 (2%) 3 (6%) 瘙癢 1 (2%) 6 (12%) 皮疹 1 (2%) 3 (6%) COVID-19 5 (10%) 1 (2%) APX3330 安全性簡介:AE 有限,嚴重程度最輕的瘙癢炎:
輕度且無需 APX3330 劑量降低或停藥即可消退 AE 與安慰劑相似或小於安慰劑的嚴重治療相關性很少AE,均與研究用藥無關除預期的 DR 進展之外沒有眼部不良反應降低 APX3330 患者的臨牀 DR/DME 惡化的發生率患者繼續使用常規藥物來控制糖尿病合併症 | 眼部疾病 |

APX3330 摘要 EOP2 FDA 會議於 2023 年 10 月成功結束;
同意對雙眼人體表進行三步變更是可批准的註冊終點提交特殊方案評估 (SPA) 將 APX3330 推進到長期暴露(最長 2 年)的 3 期計劃 APX3330 里程碑對減緩或預防糖尿病視網膜病變患者視力喪失的可能性產生臨牀意義的影響我們的患者的目標 30

DR 是視網膜最大的市場之一,在美國有 1000 萬患者,全球有 1 億
多數 NPDR 患者不是經批准的生物製劑治療候選人,只能接受治療 APX3330 同類首創口服藥物,該藥物具有抑制 Ref-1 的獨特 MOA,可將 VEGF 和炎性細胞因子降至正常
生理水平預防惡化是具有臨牀意義的潛在註冊終點 APX3330 顯示出良好的安全性和耐受性在糖尿病患者中,EOP2 成功與美國食品藥品管理局和特別會議
方案評估 (SPA) 待提交 APX3330 有可能成為對 800 萬 NPDR 患者的早期非侵入性預防性治療方法,由於具有良好的安全性,DR 和 APX3330 關鍵要點,因此有望治療受糖尿病影響的其他器官(例如腎臟疾病、
周圍神經病變)廣泛的處方基礎,包括普通眼科、驗光和初級保健

酚妥拉明眼用溶液 0.75%

與 Viatris 合作開發酚妥拉明眼用溶液 0.75%
Viatris 已選擇 POS 作為其全球眼部護理部門的關鍵要素為所有 3 種酚妥拉明適應症的開發和商業化成本提供全額資金支持全球商業化合作夥伴允許 Ocuphire 專注於
APX3330 的開發在 2025 年前期資金充足的所有 3 種適應症的開發和商業化 1.3 億美元的監管和銷售里程碑
FDA批准後,首次獲得1000萬美元的里程碑式付款藥理誘發的散瞳適應症 2040 年之前分級兩位數的特許權使用費

使用LDP輔助療法將藥物誘發的散瞳孔散大 P DLD 老花眼暗光
或夜視障礙 (DLD) POS 作為單滴 POS 治療 1 0.4% 2 RM 酚妥拉明眼用溶液 0.75% 三種適應症與 VIATRIS 的新合作伙伴關係獲批 ryzumVL™(酚妥拉明眼科
溶液)0.75% 用於治療藥理誘發的由腎上腺素激動劑(例如去氧腎上腺素)或副交感神經分解劑(例如託匹卡胺)引起的

酚妥拉明眼用溶液摘要 0.75% 試驗結果全面
整套臨牀數據支持 3 種適應症的療效和安全性主要終點療效數據關鍵次要終點安全性和耐受性擴張後 90 分鐘恢復到基線瞳孔直徑滿足 3 期主要終點 MIRA-3:58% POS 與 6% 安慰劑 MIRA-2:49% POS 與 7% 安慰劑 (p

企業亮點強勁的財務狀況可為
2025 年後期視網膜管道的運營提供資金,這代表着未得到滿足的 NPDR 患者全球許可協議中數十億美元的機會,該協議旨在為酚妥拉明眼科解決方案的開發和商業化提供資金,該協議適用於所有屈光性
適應症 0.75% 的 APX 管道由視網膜病變範式雙靶向 Ref-1 平臺 APX3330 — 治療糖尿病視網膜疾病的新型、非侵入性、安全的口服片劑肌肉病

席爾瓦等ARVO 2021 年年會 *在 EYLEA 上發佈了數據。這項研究
獨立於 APX3330 研究進行,是一項跨研究比較。**Li 2014;*** Pasha 2018;****Jiang 2011(Vldlr-/-:超低密度脂蛋白受體基因敲除小鼠)臨牀前數據:小鼠激光 CNV 模型中口服 APX3330 可阻隔
新生血管病變容量降低與 EYLEA® 數據相似 *使用 APX3330 以 25 mg/kg 口服灌精量治療的 L-CNV 模型中的眼睛病變大小和相應的熒光染色 L-55% CNV
小鼠視網膜模型 Silva 等人,2021 年 Vehicle 25 mg/kg 50 mg/kg APX3330 Gavage OCT 病變體積 L-CNV 小鼠視網膜模型 APX3330 在單次玻璃體內注射後也可以看到療效 APX3330在小鼠 L-CNV
模型中注射 20µM APX3330 ** 在小鼠 L-CNV 模型中每天兩次 50 mg/kg 的腹膜內注射,5 天/休息 2 天,持續 2 周後也可看到療效*** 在 Vldlr 中單次玻璃體內注射 20µm APX3330 後也可看到療效**** -44%

恢復視力與清晰度 www.ocuphire.com ir@ocuphire.com Ocuphire
Pharma 附錄 38

在不影響虹膜括約肌或
睫狀肌的情況下(適度)減小瞳孔大小 505 (b) (2) 監管途徑得到先前在非眼科適應症中獲得酚妥拉明批准的插圖用於教育目的的酚妥拉明眼用溶液 0.75% 的差異化 MOA 作為 α-1 阻滯劑不參與睫狀肌、無頭痛和降低視網膜脱落風險酚妥拉明是其中的活性成分 POS:非選擇性 α 拮抗劑酚妥拉明可阻斷虹膜擴張肌上的 α1 受體長達 24 小時

第 2 階段 1 期 Ocuphire Phentolamine 眼用溶液 0.75% + 0.4%
pilo Visus Brimochol®(carbachol + brim)其他膽鹼能激動劑*(pilocarpine)Lenz Aceclidine;Aceclidine + brim Eyenovia MicroLine(2% pilo)α拮抗劑和低劑量 pilocarpinepinetine * Alpha
拮抗劑 NDA Allergan VUITYTM;(1.25% pilo)Orasis CSF-1(低劑量 pilo)第 3 期 POS 的潛在差異化:全新 MOA 類別(虹膜擴張肌抑制劑)良好的安全性和耐受性(例如:不頭痛、沒有
調節性痙攣、無視網膜脱落風險)24 小時耐久性包括高度近視在內的多種患者夜視障礙改善 POS+LDP 可以增加療效和可調性 Ocuphire Phentolamine
眼科溶液 0.75% 瞳孔調製 MOA 組合藥物鏡片軟化 MOA X Novartis EV-006 鏡片軟化* 以劑量依賴方式作用於括約肌和睫狀肌公司網站,
Grzyzymic A、A、Markeviciute A、Zemaitiene R. 藥理學老花眼治療綜述。2020 年一項全新的差異化 MOA 和聯合療法優惠可調性

Ocuphire 世界級醫學顧問委員會首席醫學顧問,Ocuphire
屈光專家 Jay Pepose,醫學博士,加州大學洛杉磯分校醫學院屈光專家 Y. Ralph Chu,醫學博士,西北大學屈光專家 Zaina Al-Mohtaseb,醫學博士,貝勒醫學院屈光專家 James Katz,醫學博士,伊利諾伊大學屈光專家瑪格麗特·麥克唐納,醫學博士屈光專家 Mitch Jackson,MD 芝加哥大學屈光/青光眼專家 Thomas Samuelson,醫學博士
明尼蘇達大學屈光/青光眼專家英德·保羅·辛格,醫學博士芝加哥醫學院艾略特·拉扎爾,醫學博士喬治敦大學埃爾康視網膜醫學專家彼得·凱澤,醫學博士哈佛醫學院視網膜專家大衞·拉利,醫學博士
範德比爾特大學視網膜專家邁克爾·阿林漢姆,博士北卡羅來納大學視網膜專家大衞·博耶,醫學博士芝加哥醫學院視網膜專家大衞·布朗,醫學博士貝勒大學視網膜專家傑弗裏
Heier,MD 波士頓大學視網膜專家 Anat Lowenstein,MD,PhD 希伯來大學視網膜專家卡羅琳·鮑馬爾,醫學博士多倫多大學醫學院驗光道格拉斯·德弗里斯,OD
內華達大學驗光學院保羅·卡爾佩基,OD 印第安納大學驗光學院賈斯汀·施韋策,OD 太平洋大學驗光學院驗光學院賽琳娜·麥吉,OD Salus
大學聯合創始人 Apexian/apx3330 Mark Kelley,印第安納大學博士

Ocuphire 董事會肖恩·安斯沃思,MBA 首席獨立董事,
董事會董事傑伊·佩波斯,醫學博士,博士理事會董事蘇珊·本頓,工商管理碩士理事會主席,董事會董事詹姆斯·馬努索,博士/工商管理碩士理事會董事喬治·馬格拉思,MBA
首席執行官兼董事會董事事