目錄
我們當前的產品線
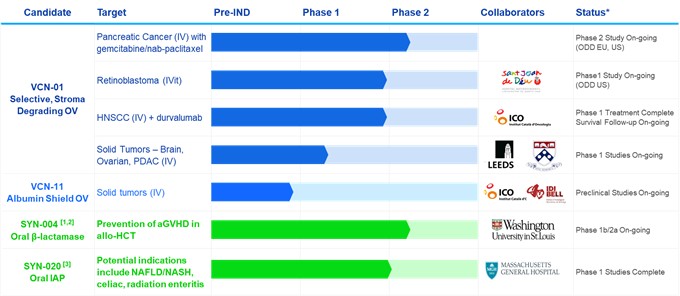
*基於管理層當前的信念和期望
Allo-HCT 異體造血細胞移植。CPI 免疫檢查點抑制劑。HNSCC 頭頸部鱗狀細胞癌。靜脈注射。iViT 玻璃體腔注射。ODD 孤兒藥稱號。其他縮寫見文本。
¹其他具有臨牀前概念驗證的產品包括用於預防 agvHD 和耐碳青黴烯腸球菌感染的 SYN-006(碳青黴烯酶)和使用口服 β-內酰胺抗生素預防抗生素相關腹瀉的 SYN-007(ribaxamase)DR。
²取決於資金/合作關係。SYN-004 可能會進入美國食品藥品管理局同意的 CDI 治療的 3 期臨牀試驗。
²我們與馬薩諸塞州綜合醫院簽訂了期權許可協議,用於開發與炎症和腸道屏障功能障礙相關的幾種潛在適應症的 SYN-020。
最近的臨牀進展
2023年8月2日,我們宣佈患者給藥已在美國啟動,在美國開放了四個研究中心,在西班牙開設了八個研究中心,該試驗仍有望在2024年第一季度全面招生。西班牙於 2023 年 1 月開始給藥,第一批患者現在已經接受了第二劑靜脈注射 VCN-01。在美國開始給藥觸發了收購協議中規定的里程碑的實現,該協議要求公司在60天內向Grifols支付325萬美元,
2023 年 6 月 27 日,我們宣佈,美國食品藥品監督管理局 (FDA) 已將我們的主要臨牀候選藥物 VCN-01 授予孤兒藥稱號,這是我們用於治療胰腺癌的系統性、選擇性、基質降解溶瘤腺病毒。
2023年2月16日,我們發佈了一份新聞稿,宣佈了正在進行的1b/2a期隨機、雙盲、安慰劑對照臨牀試驗的盲目安全性和藥代動力學(PK)數據,該試驗針對異基因造血細胞移植(HCT)接受者進行了預防急性移植物抗宿主病(AgvHD)的治療。SYN-004這些數據出現在2023年2月15日至19日在佛羅裏達州奧蘭多舉行的2023年Tandem Meetings:ASTCT和CIBMTR的移植和細胞療法會議的海報展示中。
2023 年 1 月 9 日,我們發佈了一份新聞稿,宣佈在研究者贊助的靜脈注射 VCN-01 臨牀試驗中,第一位患者已接受劑量,該試驗針對計劃接受手術切除的高級別腦腫瘤患者。
25