

附錄 99.2 PALTUSOTINE 3 期 PATHFNDR-1 研究的 TOPLINE 結果一項 隨機、安慰劑對照、多中心研究,旨在評估巴妥西汀對接受長效生長抑素受體配體治療的肢端肥大症受試者的安全性和有效性

安全港聲明本演示文稿包含前瞻性 陳述。Crinetics Pharmicals, Inc.(“Crinetics”)提醒您,本演示文稿中包含的關於非歷史事實的事項的陳述是前瞻性陳述。這些陳述基於 公司當前的信念和期望。此類前瞻性陳述包括但不限於以下方面的陳述:巴妥西汀對肢端肥大症患者和類癌綜合徵患者的潛在益處;PATHFNDR 計劃支持所有需要藥物治療的肢端肥大症患者註冊帕妥西汀的可能性;PATHFNDR-2 研究以及 類癌綜合徵患者的 2 期和 3 期研究的預期頭條數據發佈時間以及提交用於治療巴妥西汀的新藥申請的預期時間肢端肥大症和相關的開放標籤擴展研究。在某些情況下,你可以用 等術語來識別前瞻性陳述,例如 “可能”、“相信”、“預期”、“可以”、“應該”、“估計”、“預期”、“打算”、“計劃”、“項目”、“將”、 “預測”、“奠定基礎”、“有抱負”、“目標” 和類似的術語。這些陳述涉及已知和未知的風險、不確定性和其他重要因素,這些因素可能導致我們的實際結果、 業績或成就與前瞻性陳述所表達或暗示的任何未來業績、業績或成就存在重大差異,包括但不限於:在 對與臨牀研究相關的數據進行更全面的審查之後,我們報告的頂線數據可能會發生變化,這些數據可能無法準確反映臨牀研究的完整結果,而美國食品藥品管理局和其他監管當局可能不同意我們對這些 結果的解釋;臨牀前研究或臨牀研究的初步結果不一定能預測最終結果,並且隨着患者入組的繼續、對數據進行更全面的審查以及更多患者數據的獲得,一個或多個臨牀結果可能會發生重大變化;臨牀研究的開始、註冊和完成以及由此產生的數據的報告可能會出現延遲;美國食品藥品管理局或其他監管機構可能需要額外 在批准新藥申請或適用的外國監管機構批准之前,對帕妥西汀進行臨牀研究或建議更改我們計劃的 3 期臨牀研究;COVID-19 疫情可能會擾亂我們的 業務和我們所依賴的第三方的業務,包括延遲或以其他方式幹擾我們的臨牀研究和臨牀前研究、製造和供應鏈,或者損害員工的工作效率;我們在產品方面對第三方的依賴 製造、研究和臨牀前以及臨牀試驗;我們對巴妥西汀的臨牀研究、非臨牀研究和臨牀前研究的成功;美國 州和國外的監管發展或價格限制;我們的候選產品出現意想不到的不良副作用或療效不足,可能會限制其開發、監管部門批准和/或商業化;我們獲得和維持候選產品的知識產權 保護的能力;我們可能比預期更快地使用我們的資本資源;以及下文所述的其他風險標題”風險因素” 出現在我們不時向美國證券交易委員會 (“SEC”)提交的文件中。由於前瞻性陳述本質上會受到風險和不確定性的影響,其中一些風險和不確定性無法預測或量化,有些是我們無法控制的,因此您不應依賴這些前瞻性 陳述作為對未來事件的預測。我們的前瞻性陳述中反映的事件和情況可能無法實現或發生,實際結果可能與前瞻性陳述中的預測存在重大差異。所有 前瞻性陳述均受本警示聲明的全部限制,該聲明是根據1995年《私人證券訴訟改革法》的安全港條款作出的,除非適用法律要求,否則我們不計劃 公開更新或修改此處包含的任何前瞻性陳述,無論是由於任何新信息、未來事件、情況變化還是其他原因。本演示文稿還包含 獨立方和我們做出的與市場規模和增長有關的估計值和其他統計數據,以及有關我們行業的其他數據。這些數據涉及許多假設和侷限性,提醒您不要過分重視此類估計。此外, 對我們未來業績和我們運營所在市場的未來表現的預測、假設和估計必然會受到高度的不確定性和風險的影響。CRINETICS 藥品 | 2

達到主要終點和所有次要終點而帕圖索汀是 耐受性良好的主要終點 83% 服用帕圖索汀的參與者維持 IGF-1 ≤ 1.0xULN,而安慰劑的受試者為 4% ✓ (p

什麼是肢端肥大症?肢端肥大症是由良性垂體腫瘤引起的 分泌物 • 高血壓 • 頭痛 • 面部過量生長激素 (GH) 改變 • 垂體功能減退 • 視力缺陷特徵肢端肥大症不受控制會使人衰弱並增加過早死亡的風險 • 肝腫大 • 汗水 • 產前症 • 受損 • 關節痛 • 手部腫大 • 葡萄糖 • 腫脹 • 心臟隧道 • 甲狀腺 • 呼吸 • 關節炎肥大問題 Somatotroph 腺瘤生長抑素受體配體 (SRL) 抑制生長激素分泌生長激素肝臟垂體分泌過多的生長激素是由垂體引起的肝臟分泌過多 IGF-1 IGF-I CRINETICS PHARMICALS | 4 個來源:http://www.fipapatients.org;Bex M、Abs R、 T'sJoen G 等Eur J Endocrinol。2007;157 (4): 399-409
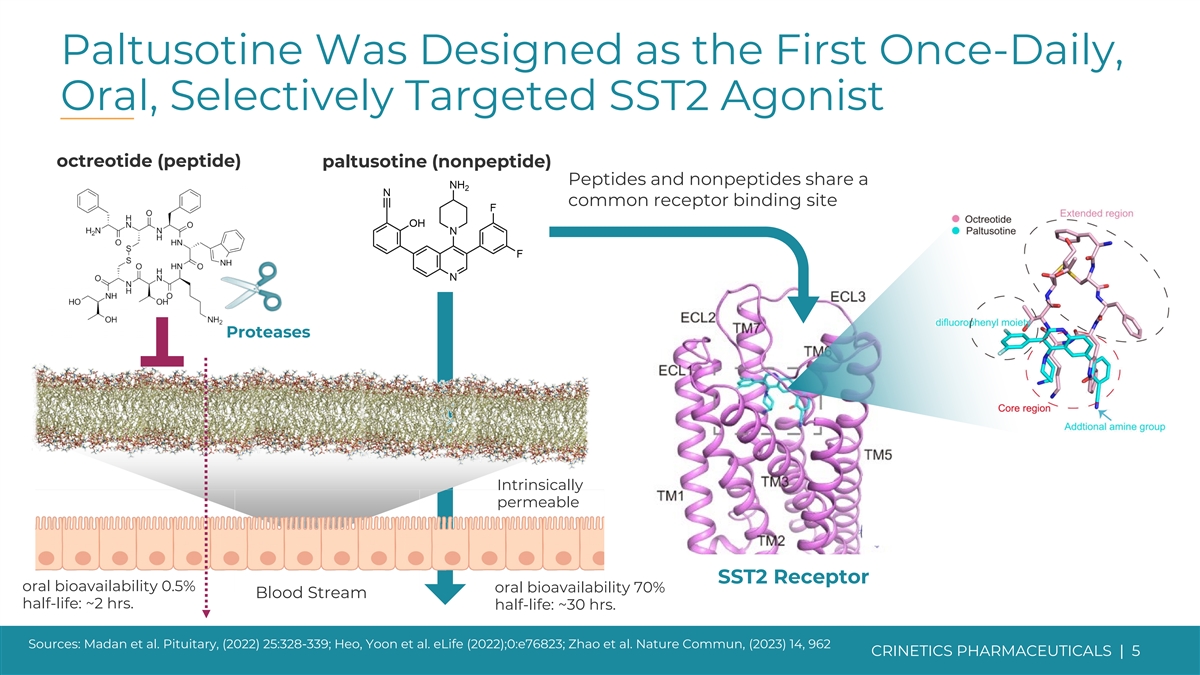
Paltusotine 被設計為第一種每日一次、口服、選擇性 靶向 SST2 激動劑奧曲肽(肽)paltusotine(非肽)肽和非肽具有共同的受體結合位點蛋白酶本質可滲透性 SST2 受體口服生物利用度 0.5% 口服生物利用度 70% 血流 半衰期:約 2 小時。半衰期:約 30 小時。資料來源:Madan 等人。垂體,(2022) 25:328-339;Heo、Yoon 等人。eLife (2022);0:e76823;Zhao 等人Nature Commun,(2023) 14、962 CRINETICS PHARMICALS | 5
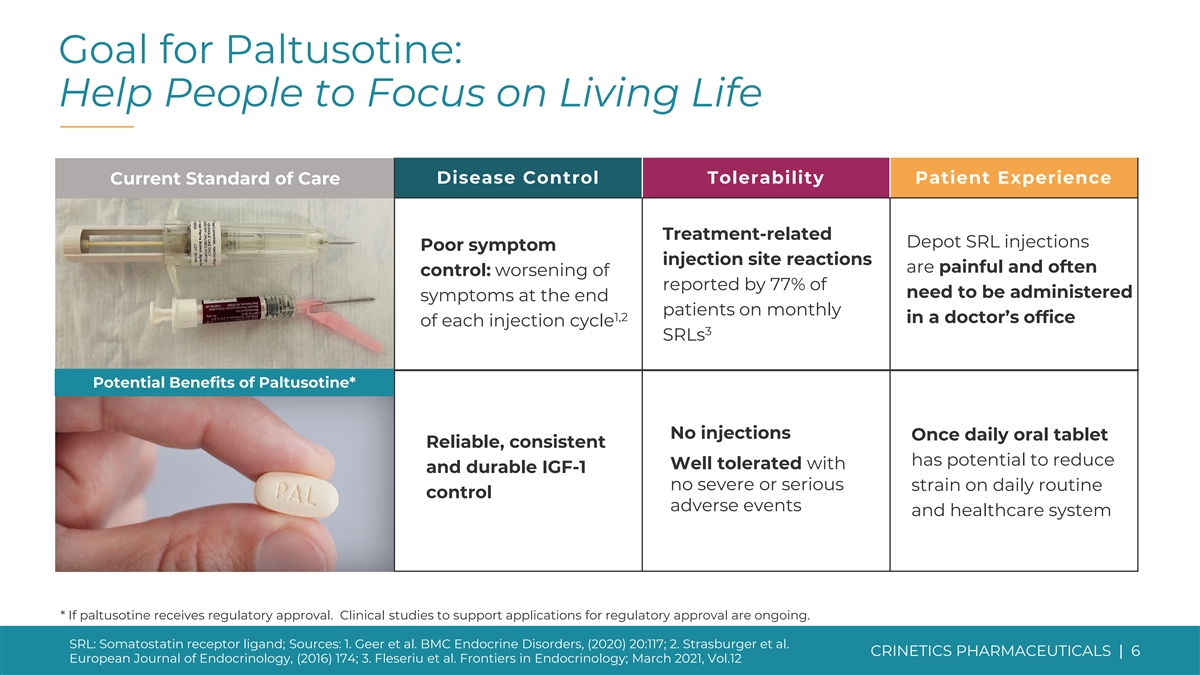
Paltusotine 的目標:幫助人們專注於生活疾病 控制耐受性患者體驗當前的護理標準治療相關的 Depot SRL 注射不良症狀注射部位反應很痛苦而且往往會得到控制:77% 的患者每月 1,2 在每個注射週期的醫生辦公室 3 SRL 巴妥西汀的潛在益處*不注射每天口服一次平板電腦可靠、一致有可能降低耐受性良好且耐用 IGF-1 不嚴重或 如果paltusotine獲得監管部門的批准,則日常控制不良事件和醫療保健系統將面臨嚴重壓力。支持監管部門批准申請的臨牀研究正在進行中。SRL:生長抑素受體配體;來源:1. Geer 等人BMC 內分泌失調,(2020) 20:117;2.Strasburger 等人CRINETICS PHARMICALS | 6《歐洲內分泌學雜誌》,(2016)174;3.Fleseriu 等人《內分泌學前沿》;2021年3月,第12卷
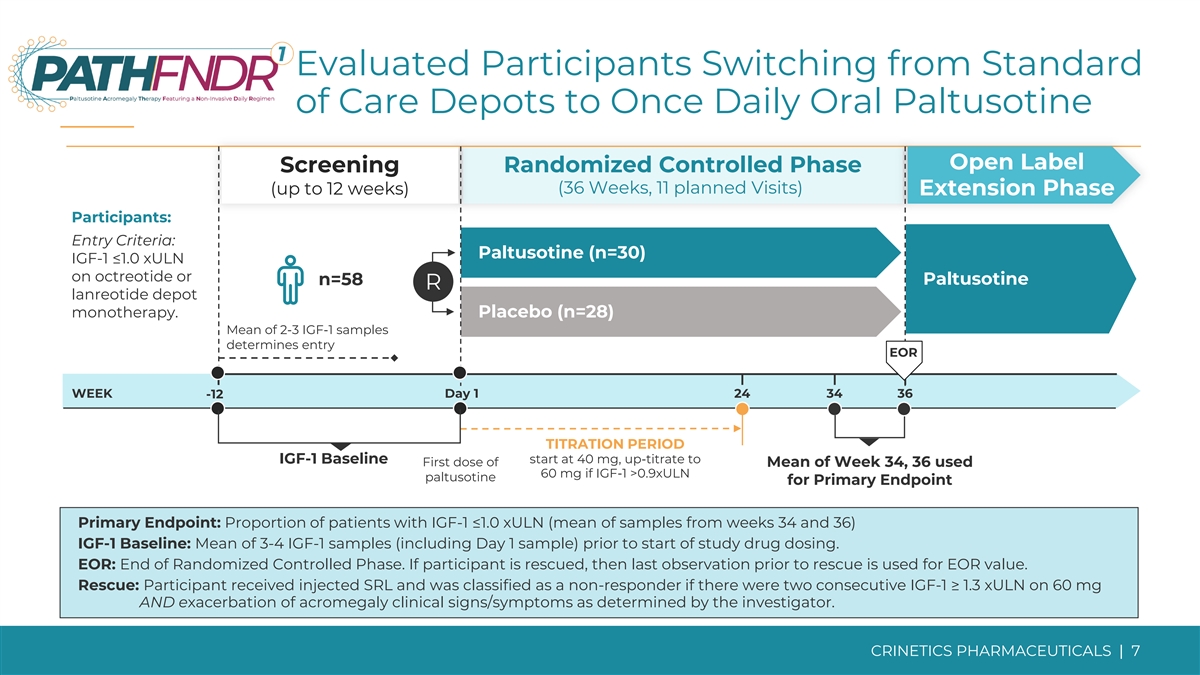
評估了從標準護理倉庫切換到每日一次 口服帕圖西汀開放標籤篩查隨機對照期(36 周,11 次計劃就診)(最長 12 周)延期參與者:入學標準:帕圖西汀(n=30)使用奧曲肽或 n=58 Paltusotine R 蘭瑞肽庫單一療法 IGF-1 ≤1.0 xULN 或 n=58 Paltusotine R lanreotide depot 單一療法。安慰劑 (n=28) 2-3 個 IGF-1 樣本的平均值決定了入口 EOR 第 1 天 24 34 36 -12 滴定期 IGF-1 基線起始於 40 mg,上滴至第 34 周平均值的第一劑量,36 個使用 60 mg 如果 IGF-1 >0.9xULN paltusotine 作為主要終點主要終點:IGF-1 ≤1.0 xuLN 的患者比例(第 34 周和第 36 周樣本的平均值)IGF-1 基線:在研究開始給藥之前,平均有 3-4 IGF-1 個樣本(包括第 1 天的樣本)。EOR: 隨機對照階段結束。如果參與者獲救,則使用救援前的最後一次觀察來計算 EOR 值。救援:參與者接受了注射 SRL,如果連續兩次 IGF-1 ≥ 1.3 xuLN 服用 60 mg,且研究人員確定肢端肥大症臨牀體徵/症狀惡化,則被歸類為無反應者。CRINETICS 藥品 | 7
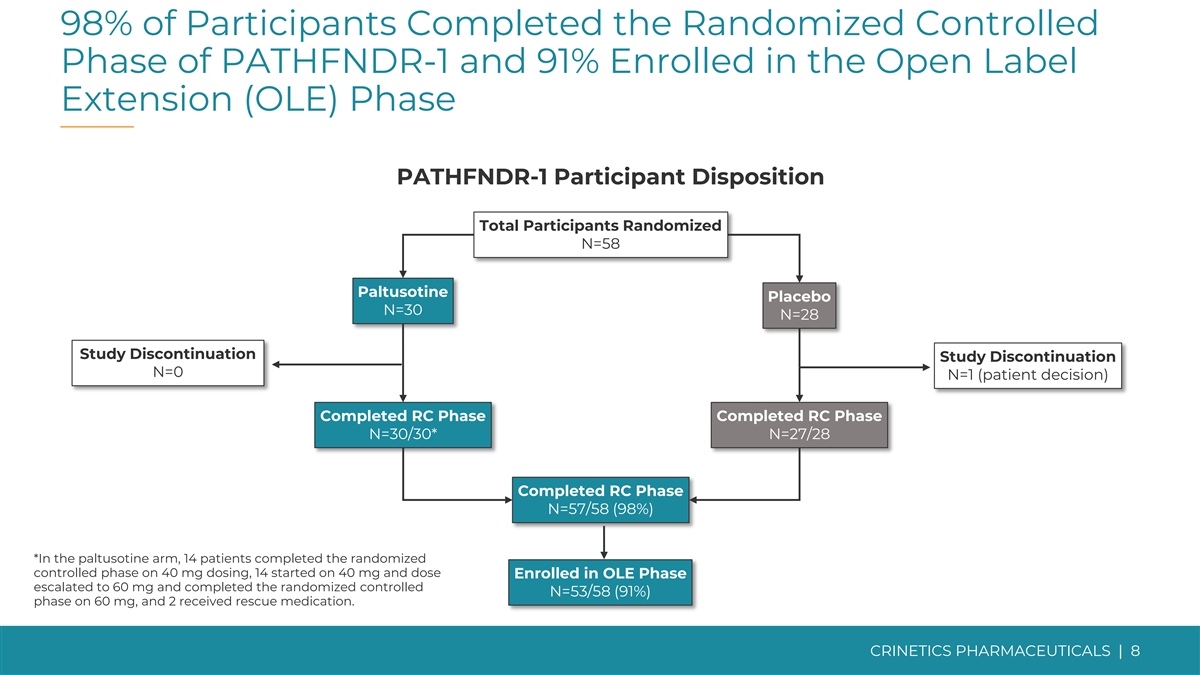
98% 的參與者完成了 PATHFNDR-1 的隨機對照階段,91% 的參與者進入了開放標籤擴展 (OLE) 階段 PATHFNDR-1 受試者性格總參與者隨機化 N=58 Paltusotine 安慰劑 N=30 N=28 研究停止 N=0 N=1(患者決定)已完成 RC 階段已完成 RC 階段 N=30/30* N=27/28 已完成 RC 期 N=57/58 (9=57/58) 8%) *在帕圖西汀組中,有14名患者在給藥40毫克時完成了隨機對照期,14名患者開始服用40 mg,劑量進入OLE期的患者升級到60 mg而且 服用 60 mg 完成了隨機對照 N=53/58 (91%) 階段,2 人接受了救援藥物。CRINETICS 藥品 | 8
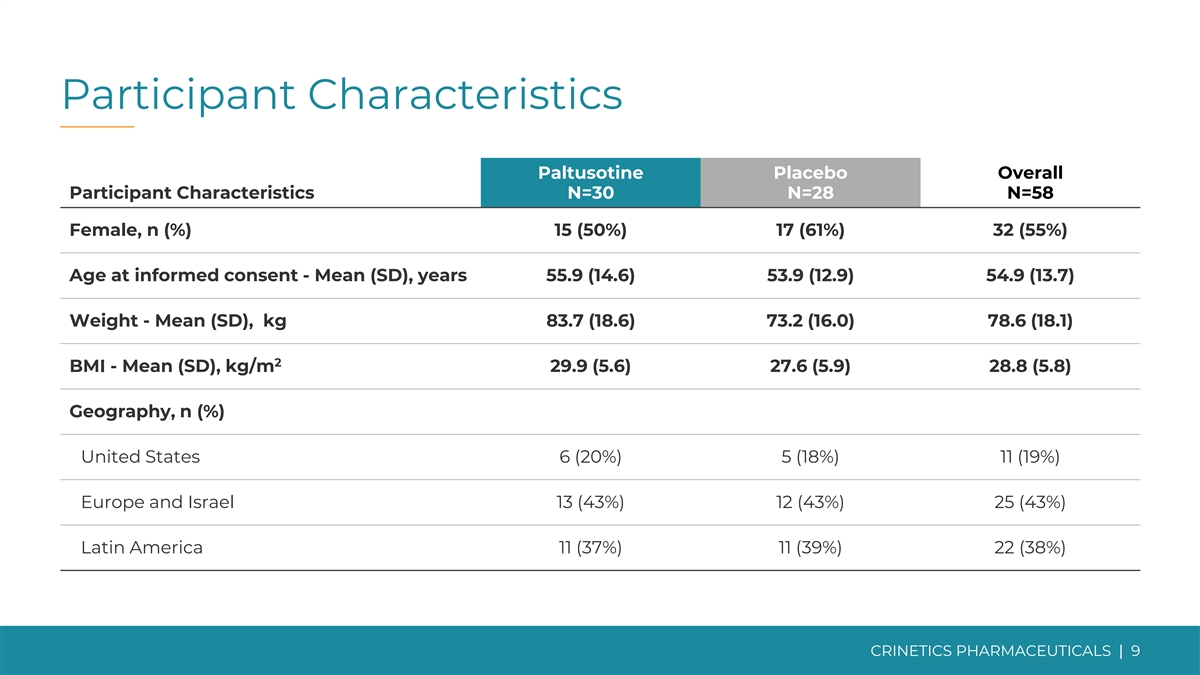
參與者特徵帕爾圖索汀安慰劑總體參與者 特徵 N=30 N=28 N=58 女性,n (%) 15 (50%) 17 (61%) 32 (55%) 知情同意年齡——平均值 (SD),55.9 (14.6) 53.9 (12.9) 54.9 (12.9) 54.9 (13.7) 體重-平均值 (SD),kg 83.7 (18.6) 78.0 (16.0) 78.8 6 (18.1) 2 體重指數——平均值 (SD),kg/m 29.9 (5.6) 27.6 (5.9) 28.8 (5.8) 地理,n (%) 美國 6 (20%) 5 (18%) 11 (19%) 歐洲和以色列 13 (43%) 12 (43%) 25 (43%) 拉丁美洲 11 (37%) 11 (39%) 22 (38%) CRINETICS | 9
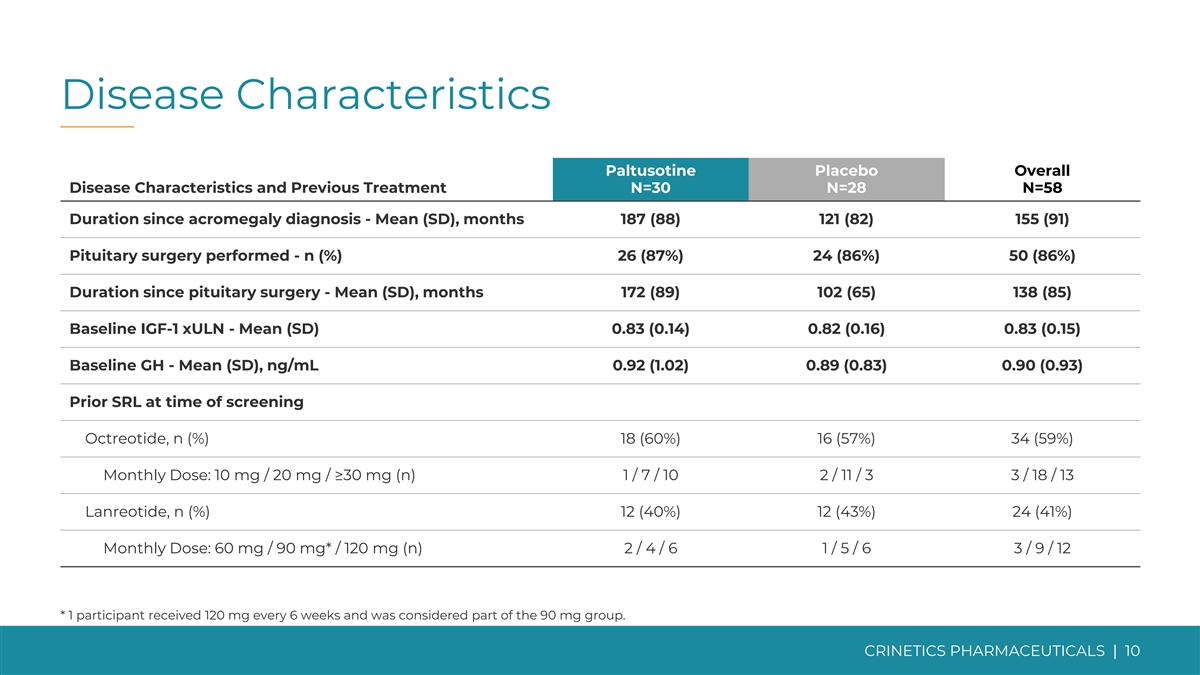
疾病特徵帕圖索汀安慰劑總體疾病 特徵和既往治療 N=30 N=28 N=58 肢端肥大症診斷以來的持續時間——平均值(SD),187(88)121(82)155(91)進行的垂體手術——n(%)26(87%)24(86%)50(86%)垂體手術以來的持續時間——平均值(SD), 個月(172)89) 102 (65) 138 (85) 基線 IGF-1 xULN——平均值 (SD) 0.83 (0.14) 0.82 (0.16) 0.83 (0.15) 基線 GH——平均值 (SD),ng/mL 0.92 (1.02) 0.89 (0.83) 0.90 (0.93) 篩選奧曲肽時先前的 SRL,n (%) 18 (60%) 16 (57%) 34 (57%) 34 (57%) 9%) 每月一次劑量:10 mg/20 mg/≥30 mg (n) 1/ 7/ 10 2/ 11/3 3/ 18/13 蘭瑞肽,n (%) 12 (40%) 12 (43%) 24 (41%) 每月劑量:60 mg/90 mg*/120 mg (n) 2/ 4/ 6 1/ 5/6 3/ 9/ 12 * 1 名參與者每 6 周服用 120 毫克而且 被認為是 90 mg 組的一部分。CRINETICS 藥物 | 10
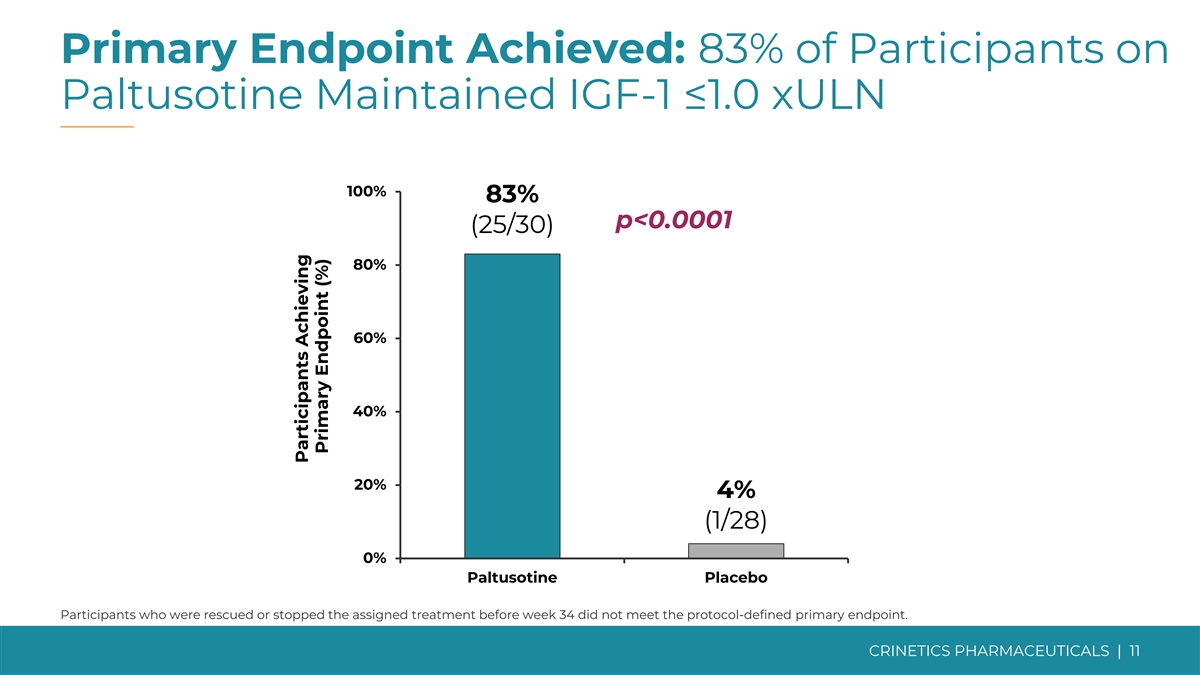
主要終點已實現:服用 Paltusotine 的參與者中有 83% 維持 IGF-1 ≤1.0 xuLN 100% 83% p
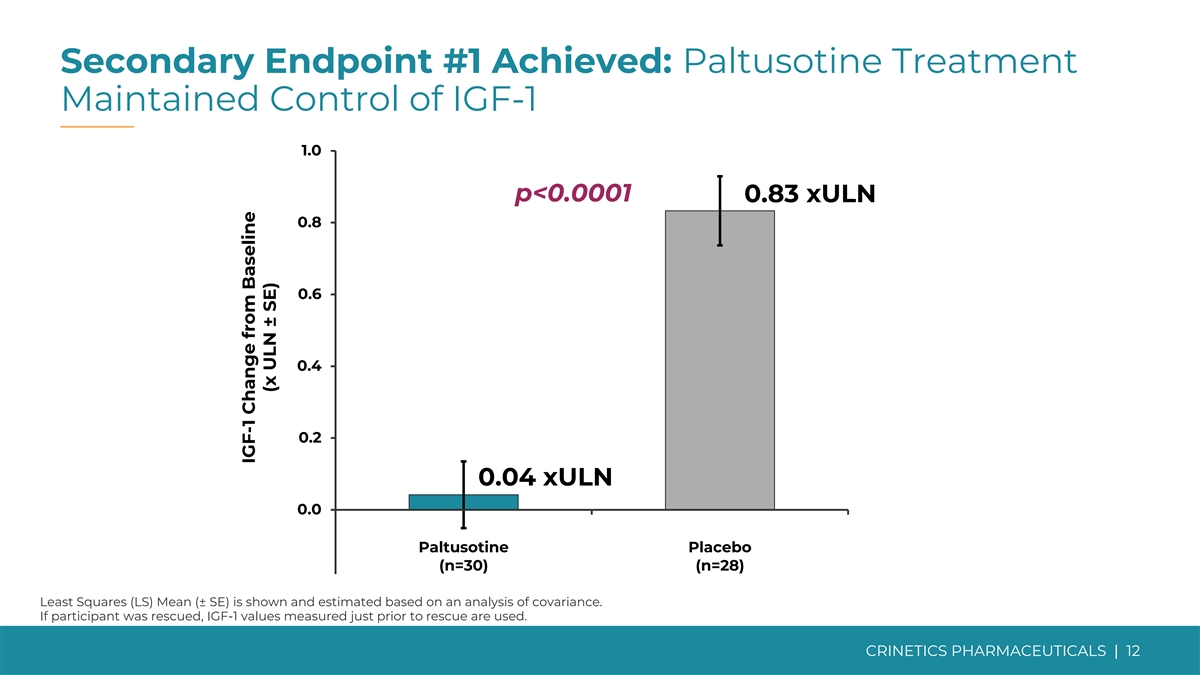
次要終點 #1 已實現:Paltusotine 治療維持 對 IGF-1 1.0 p 的控制
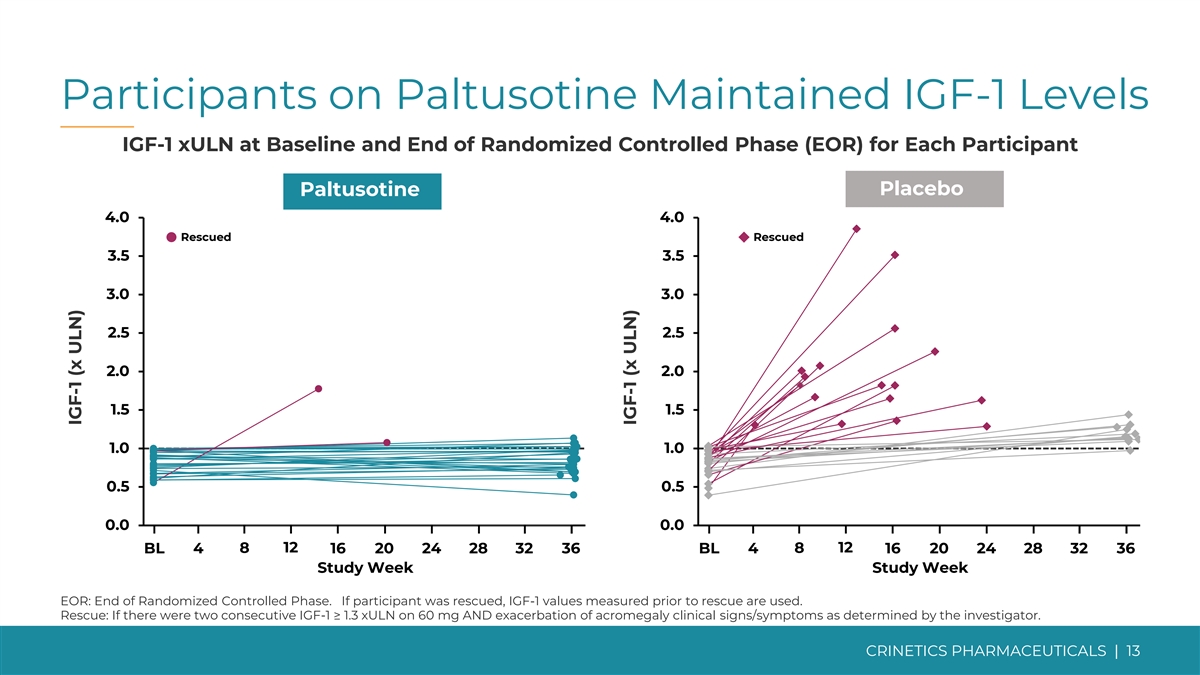
Paltusotine 的參與者將 IGF-1 水平 IGF-1 xULN 維持在 基線和每位參與者的隨機對照階段 (EOR) 結束安慰劑 paltusotine 4.0 4.0 獲救 3.5 3.0 3.0 2.5 2.0 2.0 1.5 1.0 1.0 0.5 0.0 0.0 0.0 12 12 BL 4 8 16 20 24 28 32 36 研究周 EOR:隨機對照結束 研究周 EOR:隨機對照結束階段。如果參與者獲救,則使用救援前測量的 IGF-1 值。救援:如果研究人員確定,如果連續出現兩次 IGF-1 ≥ 1.3 xuLN,且肢端肥大症臨牀體徵/症狀惡化 CRINETICS PHARMICALS | 13 IGF-1 (x ULN) IGF-1 (x ULN)

患者使用肢端肥大症狀日記 (ASD) 報告症狀嚴重程度在 ASD 中評估的症狀 • ASD 是根據美國食品藥品管理局頭痛指南制定的,用於評估關節疼痛臨牀研究中的肢端肥大症症狀 * 出汗疲勞 • 七種症狀的評分從 0(無症狀)到 10(最嚴重的症狀);ASD 總分為 0 到 70 腿部無力腫脹 • 之前收集了每日症狀清單到麻木/刺痛以及研究期間的治療總分 (0-70) 數字量表(每個症狀)沒有最壞症狀症狀 0 1 2 3 4 5 6 7 89 10 *Martin 等人患者報告結果雜誌 (2023) 7:15;https://doi.org/10.1186/s41687-023-00541-7 CRINETICS PHARMICALS | 14
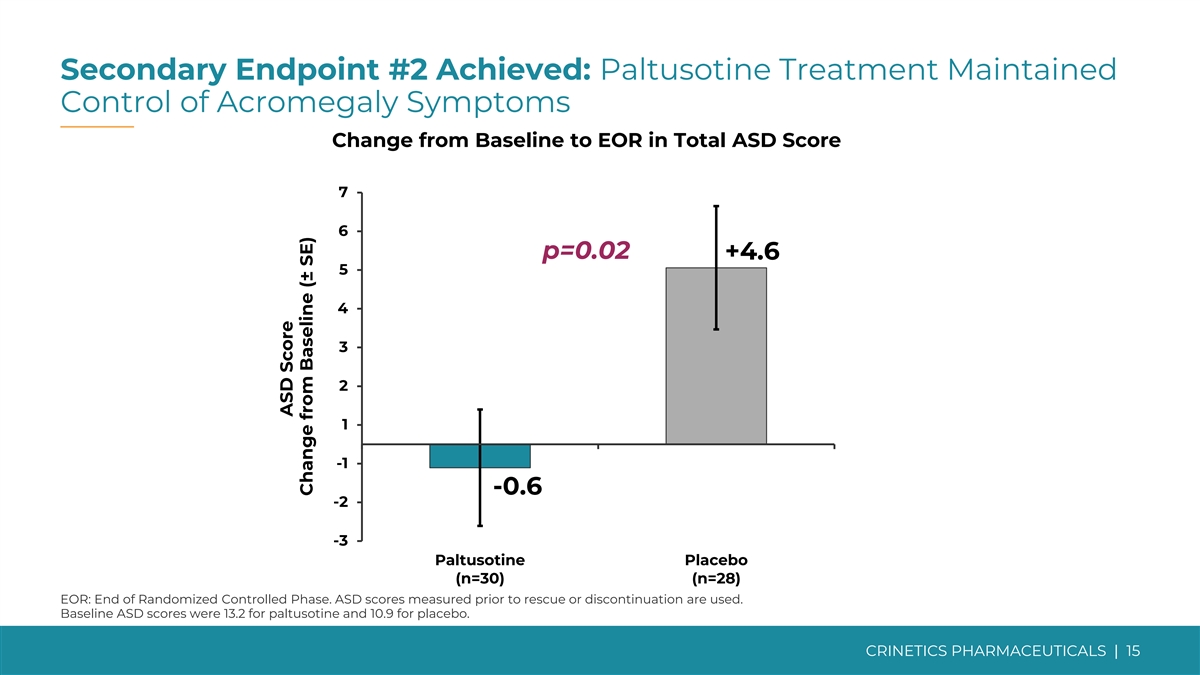
次要終點 #2 已實現:帕圖索汀治療維持 控制肢端肥大症狀從基線變為 EOR 的自閉症總分為 7 6 p=0.02 +4.6 5 4 3 2 1 -0.6 -0.6 -2 -3 帕圖索汀安慰劑 (n=30) (n=28) EOR:隨機對照階段結束。使用在搶救或停藥之前測量的 ASD 分數 。paltusotine的基線自閉症障礙評分為13.2,安慰劑的基線ASD評分為10.9。CRINETICS PHARMICALS | 自閉症障礙評分較基線變化 15 (± SE)
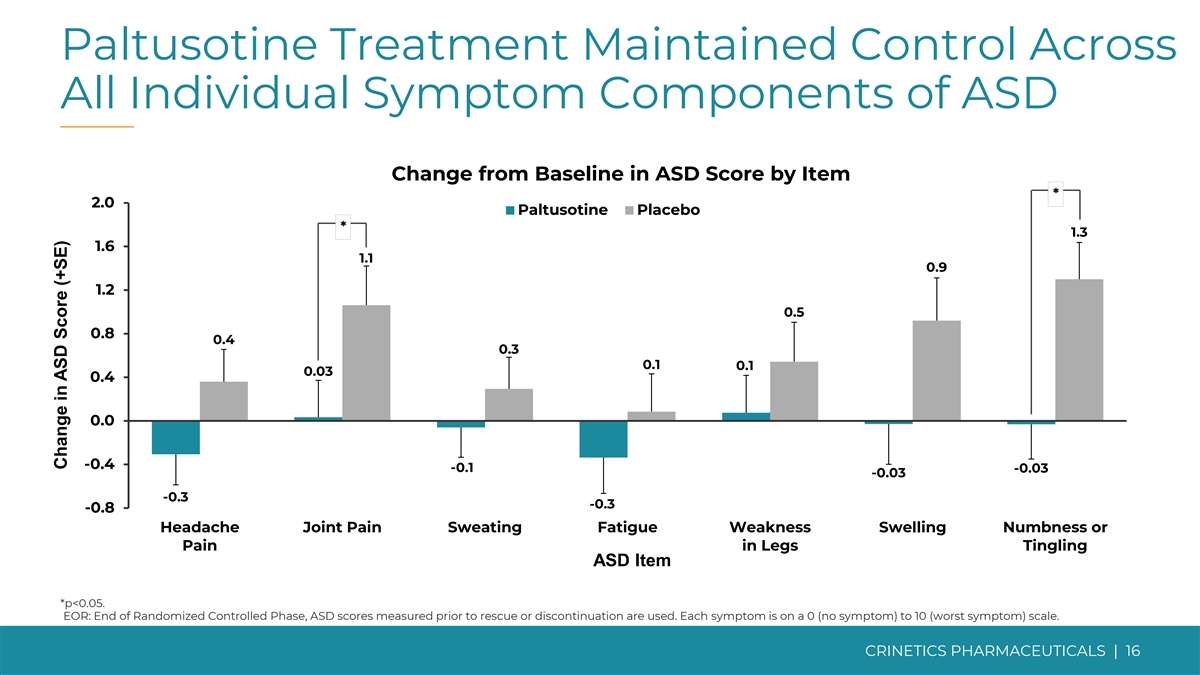
帕圖西汀治療維持了對所有個體症狀的控制 自閉症障礙成分與基線相比的變化 2.0 帕圖索汀安慰劑 1.3 1.6 1.1 0.9 1.2 0.5 0.8 0.4 0.1 0.1 0.1 0.1 0.3 0.1 0.3 0.3 -0.3 -0.8 頭痛關節疼痛出汗疲勞無力腫脹麻木或疼痛 腿部刺痛自閉症障礙項目 *p
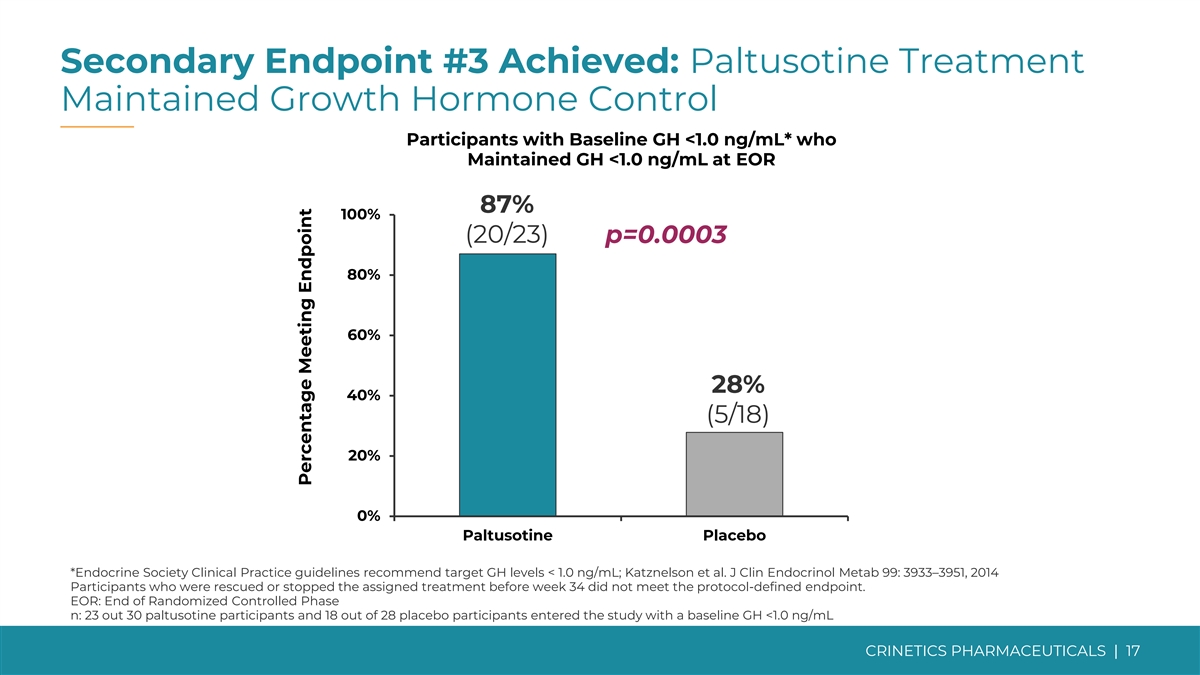
次要終點 #3 已實現:巴妥西汀治療維持生長 基線 GH 的激素控制參與者
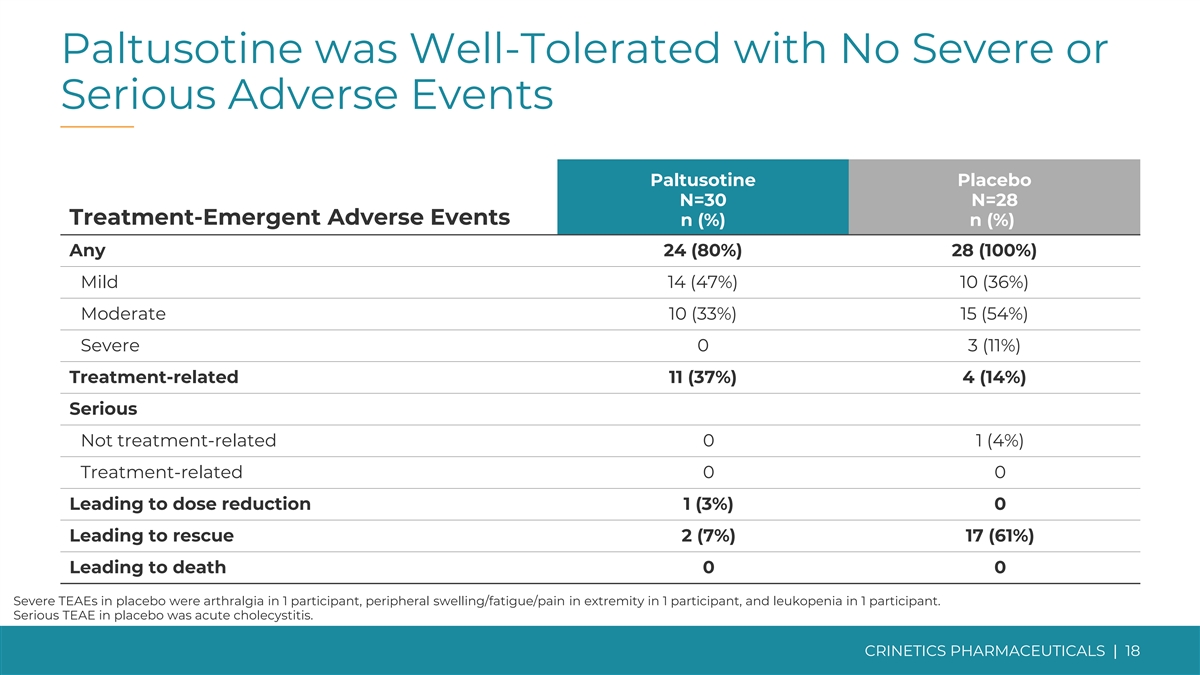
帕圖索汀耐受性良好,無嚴重或嚴重不良事件 帕圖西汀安慰劑 N=30 N=28 治療緊急不良事件 n (%) n (%) 任何 24 (80%) 28 (100%) 輕度 14 (47%) 10 (36%) 中度 10 (33%) 15 (54%) 嚴重 0 3 (11%) 治療相關 11 (37%) 4 (14%) 嚴重與治療無關 0 1 (4%) 治療相關 0 0 導致劑量減少 1 (3%) 0 導致救援 2 (7%) 17 (61%) 導致死亡 0 0 安慰劑中的嚴重 TEAE 是 1 名受試者的關節痛、1 名參與者的外周腫脹/疲勞/四肢疼痛以及白細胞減少症 在 1 名參與者中。安慰劑中嚴重的TEAE為急性膽囊炎。CRINETICS 藥品 | 18

PATHFNDR-1 不良事件摘要帕圖索汀安慰劑治療 Emergent N=30 N=28 不良事件 ≥ 5% n (%) n (%) 常見肢端肥大症症狀關節痛 8 (27%) 16 (57%) 頭痛 6 (20%) 10 (36%) 外周腫脹 2 (7%) 10 (36%) 疲勞 2 (7%) 5 (18%) 肌肉無力 1 (3%) 3 (11%)) 感覺異常 0 7 (25%) 不良事件發生頻率多汗症 0 4 (14%) 被認為與腹瀉相關的常見 SRL 副作用 7 (23%) 4 (14%) 肢端肥大症在腹痛中明顯較低 5 (17%) 3 (11%) 噁心 3 (10%) 2 (7%) 腹部治療的受試者擴張 2 (7%) 1 (4%) paltusotine 與安慰劑 Flatulence 2 (7%) 1 (4%) 其他(分別為 30% 對 86%)。便祕 2 (7%) 4 (14%) 尿路感染 2 (7%) 2 (7%) 鼻咽炎 2 (7%) 1 (4%) 呼吸困難 1 (3%) 2 (7%) 高血糖 1 (3%) 2 (7%) 頭暈 1 (3%) 2 (7%) 背痛 1 (3%) 2 (7%) COVID-19 0 6 (21%) 乏力 0 4 (14%) 四肢疼痛 0 3 (11%) 包括在救援期間發生的 AE。如果不包括救援期,則費率相似。CRINETICS PHARMICALS | 19

PATHFNDR-1 安全摘要 • Paltusotine 耐受性良好, 活躍組未報告嚴重或嚴重的不良事件 • 最頻繁(> 10%)報告的不良事件包括關節痛、腹瀉、頭痛、腹痛和噁心 • 在使用帕圖西汀治療期間,生命體徵、 心電圖或實驗室值中未觀察到安全信號 • 測量的垂體腫瘤大小未觀察到臨牀上顯著的變化核磁共振成像 • PATHFNDR-1 的安全性結果與迄今為止在整個臨牀 項目中觀察到的結果相當 CRINETICS藥品 | 20
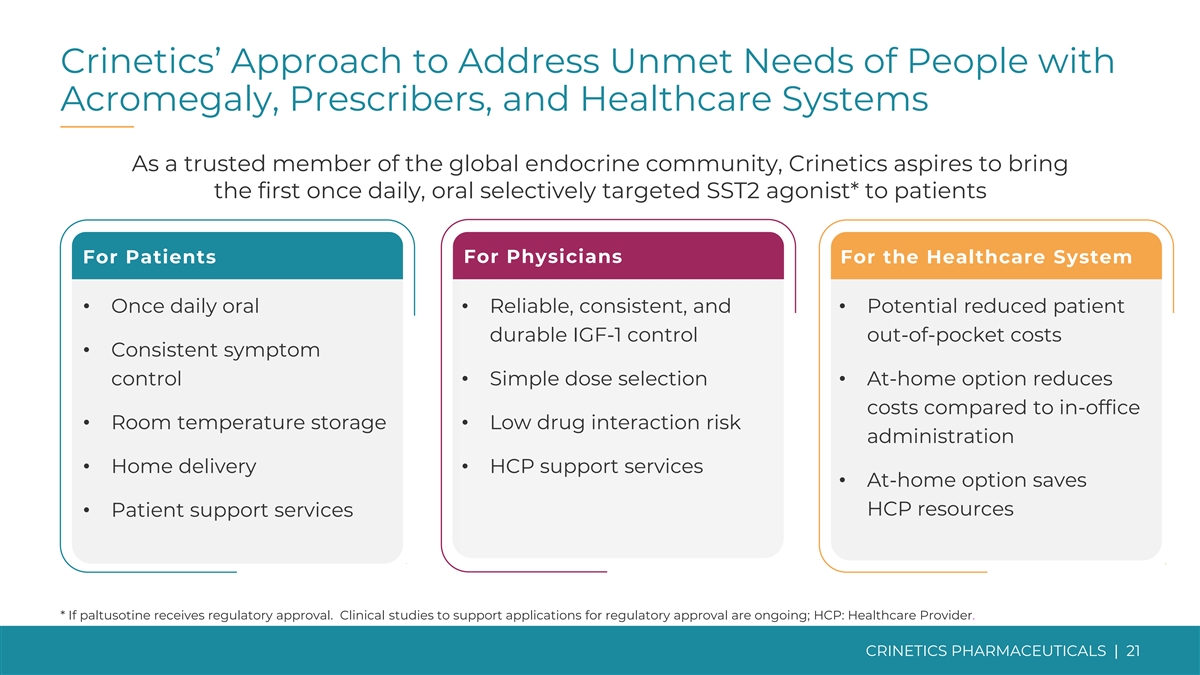
Crinetics 解決肢端肥大症患者、處方者和醫療保健系統未滿足需求的方法作為全球內分泌界值得信賴的成員,Crinetics 渴望為患者帶來第一款每日一次的口服選擇性靶向 SST2 激動劑*功效商業潛力 Crinetics Approack Crinetics 今天為什麼是內分泌學?患者供醫師用於醫療保健系統 • 每天口服一次 • 可靠、一致且 • 有可能降低患者耐用 IGF-1 控制自付費用 • 一致的症狀控制 • 簡單的劑量選擇 • 與辦公室相比,在家選項可降低成本 • 室温儲存 • 藥物相互作用風險管理低 • 送貨上門 • HCP 支持服務 • 在家選項可節省 HCP 資源 • 患者支持服務 * 如果帕圖西汀獲得監管部門的批准。支持監管部門批准申請的臨牀研究正在進行中;HCP:醫療保健提供者。CRINETICS PHARMICALS | 21
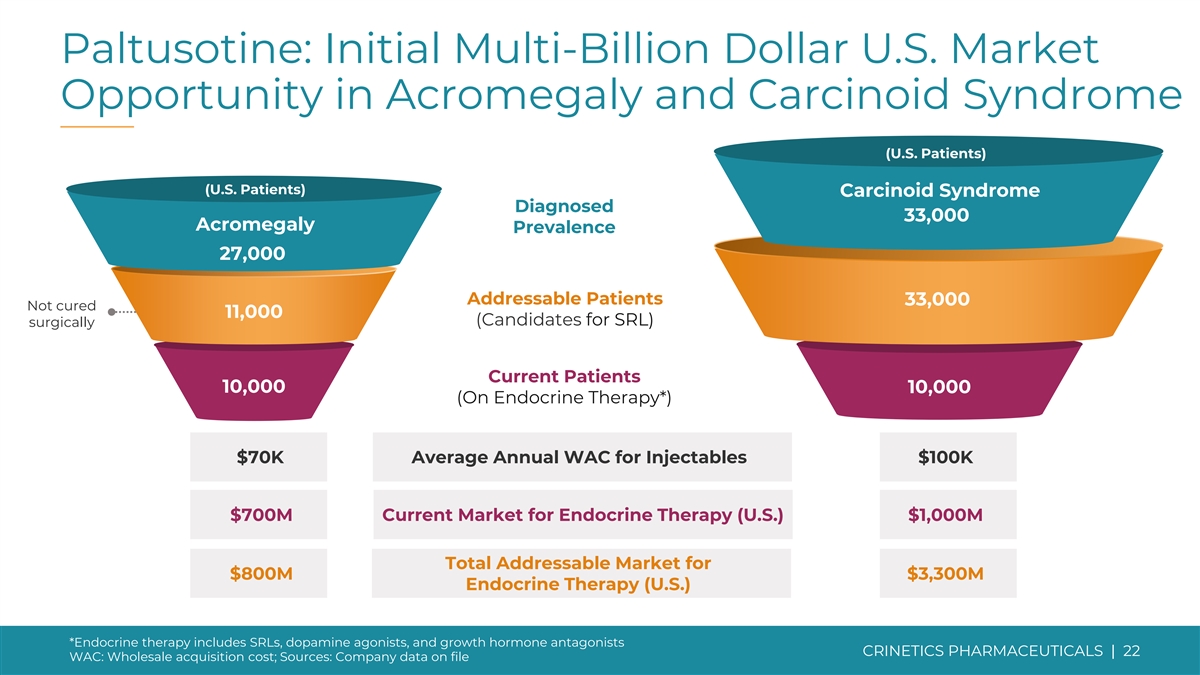
Paltusotine: 肢端肥大症和類癌綜合徵(美國患者)(美國患者)的初始市場機會數十億美元被診斷為類癌綜合徵 33,000 例肢端肥大症患病率 27,000 名可治療患者 33,000 名未治癒患者 11,000(SRL 候選人)目前正在接受手術的患者 10,000 名(在 內分泌治療*)注射劑每年 WAC 平均為 7 萬美元 7億美元當前內分泌療法市場(美國)10億美元總潛在市場8億美元33億美元內分泌療法(美國)*內分泌療法包括 SRL、多巴胺激動劑和 生長激素拮抗劑 CRINETICS PHARMICALS | 22 WAC:批發收購成本;來源:公司存檔的數據

Paltusotine 的預期里程碑 • 23 年第 4 季度類癌綜合徵 2 期研究的初步結果 • 2014 年第 1 季度未經治療的肢端肥大症患者的 PATHFNDR-2 3 期研究結果 • 2024 年肢端肥大症新藥上市申請已提交 • 2024 年預期類癌綜合徵第 3 期開始 • 正在進行中:肢端肥大症 開放標籤擴展研究 • N > 120 且還在增加 • 一些 2 期患者接受了長達 paltusotine 的治療 3 年 CRINETICS PHARMICALS | 23

問答斯科特·斯特魯瑟斯,博士創始人兼首席執行官 Dana Pizzuti,醫學博士首席開發官艾倫·克拉斯納,醫學博士首席醫學官