| PBGM01 在 Infantile GM1 神經節苷脂中毒的研究 1-4 隊列的中期臨牀結果和 Imagine-1 臨牀研究的項目更新 2023 年 8 月 7 日 |
| 2 前瞻性陳述 本演示文稿包括1995年 《私人證券訴訟改革法》所指並根據其安全港條款作出的 “前瞻性陳述”,包括但不限於:我們對預期 里程碑的時間和執行的期望,包括Imagine-1臨牀研究的進展和研究臨牀數據的可用性;我們對 合作者和合作夥伴執行能力的期望關鍵舉措;我們對製造計劃的期望還有策略;我們 對現金跑道的期望;以及我們的主要候選產品治療各自靶向單基因中樞神經系統疾病的能力。 這些前瞻性陳述可能附有 “目標”、“預期”、“相信”、“可能”、“估計”、“預期”、 “預測”、“目標”、“打算”、“可能”、“可能”、“計劃”、“潛在”、“可能”、“可能”、“將” 等詞語以及其他含義相似的詞語和術語。 這些陳述涉及風險和不確定性,可能導致實際結果與這類 陳述中反映的結果存在重大差異,包括:我們開發候選產品並獲得監管部門批准的能力; 臨牀前研究和臨牀試驗的時間和結果;與臨牀試驗相關的風險,包括我們充分管理臨牀活動的能力, 監管機構可能要求的在臨牀試驗期間獲得的其他數據或分析可能引起的意想不到的問題 額外信息或進一步研究,或者可能未能批准或可能推遲批准我們的候選藥物; 不良安全事件的發生;臨牀前研究或臨牀試驗的積極結果可能無法在隨後的試驗中複製或成功進行 早期臨牀試驗的成功可能無法預測後期臨牀試驗的結果;未能保護和執行我們的知識產權 和其他專有權利;我們對合作者和其他人的依賴用於開發和製造 產品的第三方候選人以及我們業務中其他不受我們完全控制的方面;與冠狀病毒疫情造成的當前和潛在的 延誤、停工或供應鏈中斷相關的風險;以及公司不時向美國證券交易委員會 (SEC) 提交的文件中 以及向美國證券交易委員會提交的其他報告中 部分描述的其他風險和不確定性。Passage Bio沒有義務公開更新可能不時發表的任何前瞻性陳述,無論是書面陳述還是口頭陳述,無論是由於新信息、未來發展還是其他原因。 |
| 3 內容提要 Mark Forman,醫學博士,博士 |
| 4 歡迎和議程 歡迎 Will Chou,醫學博士 內容提要 Mark Forman,醫學博士,博士 Imagine-1 中期臨牀結果和項目更新 Samiah Al-Zaidy,醫學博士 閉幕詞 Will Chou,醫學博士 Passage Bio 首席執行官 Mark Forman,醫學博士,博士 Passage Bio Samiah Al-Zaidy,醫學博士 臨牀開發副總裁 Passage Bio Passage Bio |
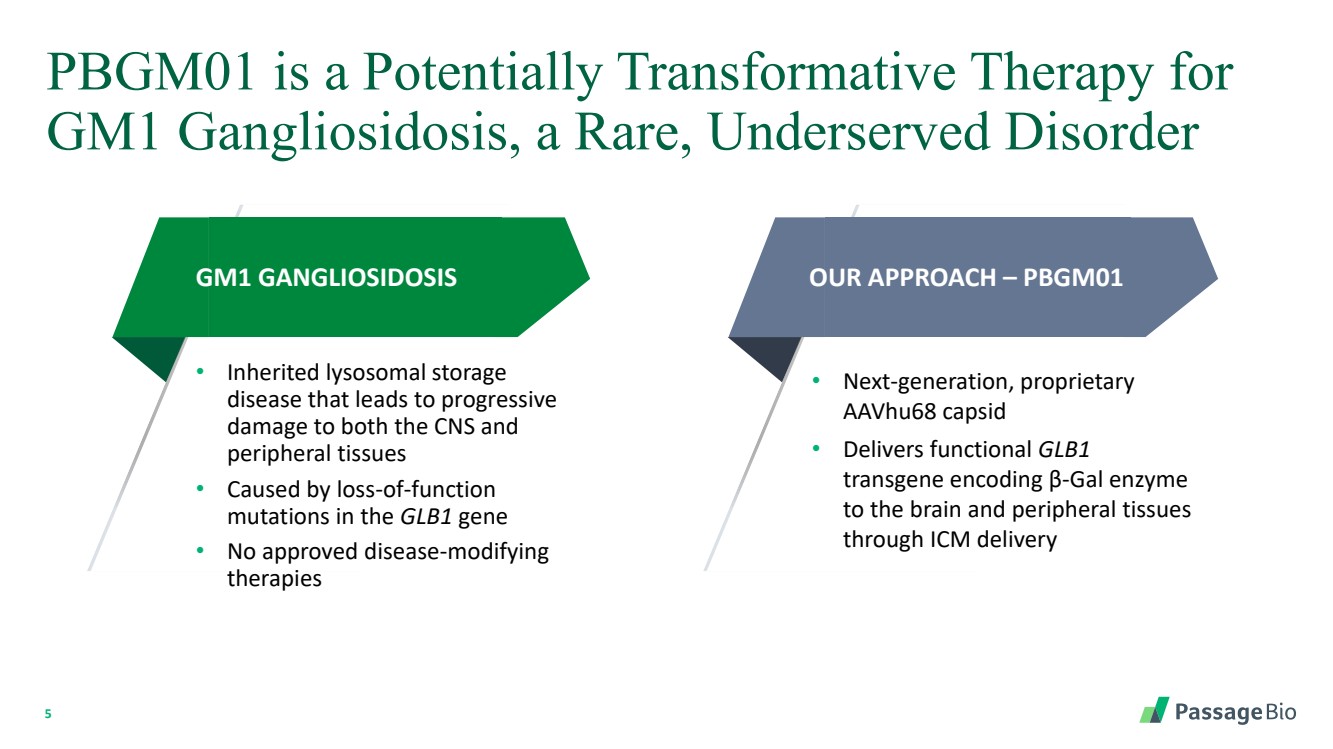
| 5 PBGM01 是 GM1 神經節苷脂中毒的潛在變革性療法,這是一種罕見、服務不足的疾病 GM1 神經節苷脂沉積症 • 遺傳性溶酶體儲存 疾病會導致中樞神經系統和 外周組織進行性 損傷 • 由 GLB1 基因的功能喪失 突變引起 br} • 尚無獲批准的疾病改善 療法 我們的方法 — PBGM01 • 下一代專有 aavHu68 capsid • 通過 ICM 輸送向大腦和外周組織 提供編碼 β-gal 酶的功能性 GLB1 轉基因 |
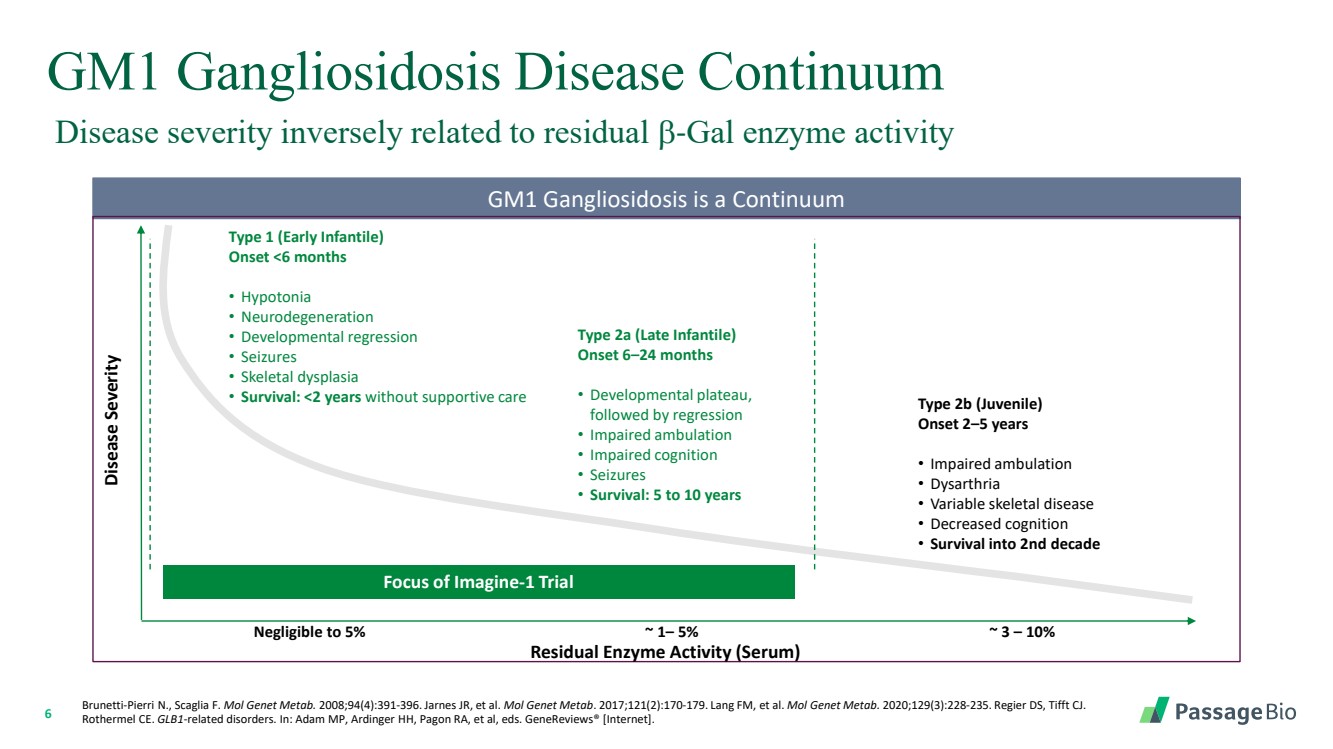
| 6 GM1 神經節苷脂沉積症疾病連續體 GM1 神經節苷脂中毒是一種連續性 疾病嚴重程度 殘留酶活性(血清) Imagine-1 試驗的焦點 可以忽略到 5% ~ 1— 5% ~ 3 — 10% 1 型(嬰兒早期) 發作 |
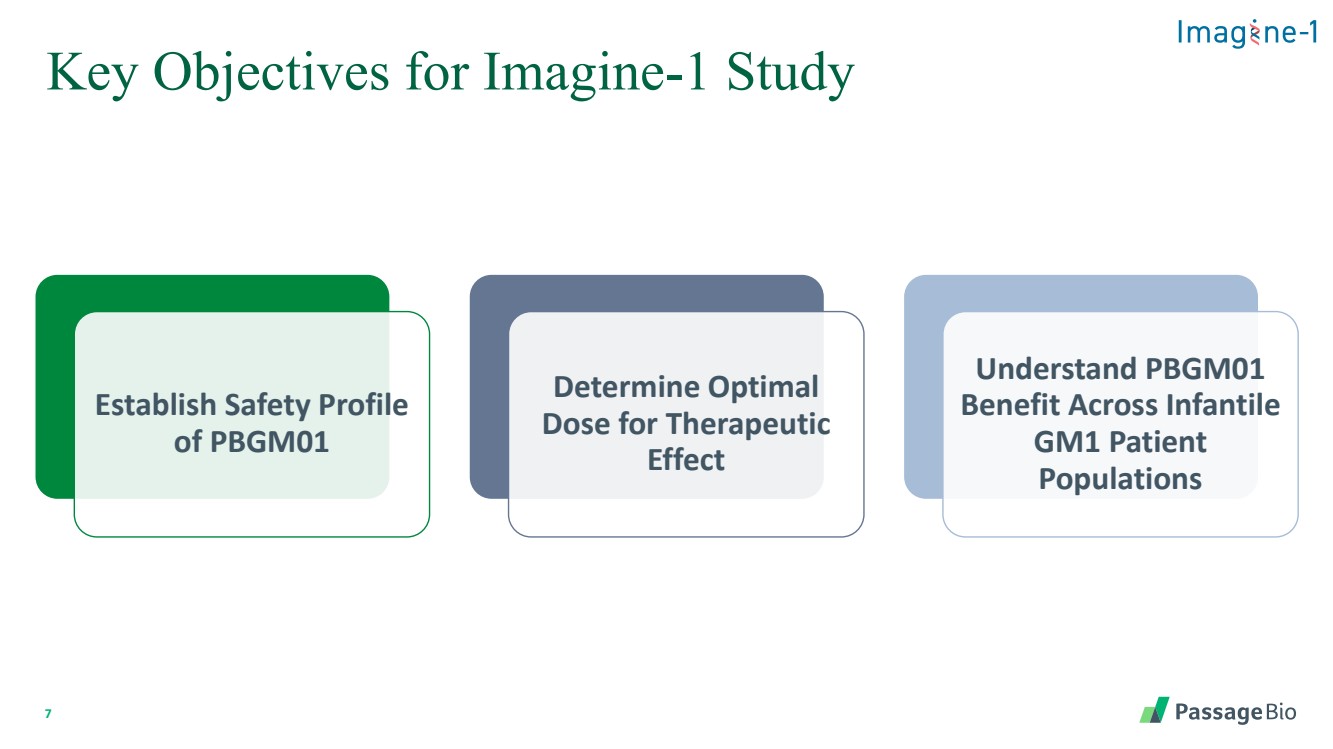
| Imagine-1 研究的 7 個關鍵目標 建立 PBGM01 的安全概況 確定治療效果的最佳 劑量 瞭解 PBGM01 在嬰兒 GM1 患者 人羣中的益處 |
| 來自前 8 名接受治療的患者的 8 份有希望的中期數據 良好的安全性和耐受性良好 研究參與者的存活率提高的初步證據 腦脊液 β-gal 活性因劑量依賴性增加,持續增加 腦脊液中 β-gal 底物(GM1 神經節苷脂)的劑量依賴性降低, 劑量 2 能夠達到健康的控制水平 |
| 9 Imagine-1 中期臨牀結果 Samiah Al-Zaidy,醫學博士 |
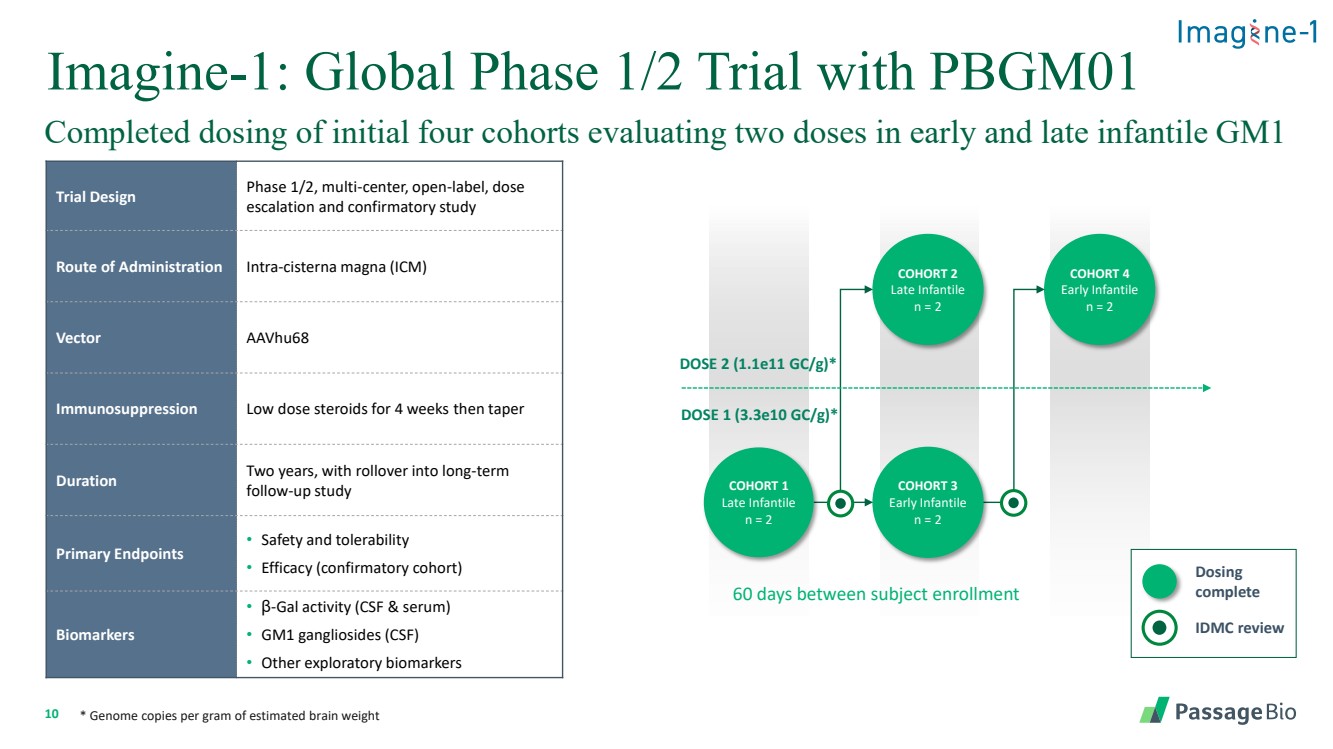
| 10 Imagine-1:PBGM01 隊列 4 早期嬰兒 n = 2 劑量 2 (1.1e11 gc/g) * DOSE 1 (3.3e10 gc/g) * 羣組 2 晚期 Infantile n = 2 隊列 3 早期嬰兒 n = 2 隊列 1 個晚期 infantile n = 2 個隊列 1 個晚期 infantile n = 2 個隊列在受試者入組之間 IDMC review 給藥 完成 * 每克估計腦重的基因組拷貝 完成了最初四個隊列的劑量,評估了嬰兒早期和晚期的兩個劑量 GM1 試驗設計階段 1/2,多中心,開放標籤,劑量 遞增和確認性研究 途徑給藥 intra-cisterna magna (ICM) Vector aavhu68 免疫抑制低劑量類固醇持續 4 周然後逐漸減少 持續時間兩年,延續到長期 後續研究 • 主要終點 • 安全性和耐受性 • 療效(確認性隊列) • 生物標誌物 • β-gal 活性(腦脊液和血清) • GM1 神經節苷脂 (CSF) • 其他探索性生物標誌物 |
| 11 Imagine-1 基線患者特徵 患者 1 患者 2 患者 3 患者 4 患者 5 患者 6 患者 7 患者 8 診斷髮病遲發早起發遲發早起早發作 接受的劑量水平劑量 1 劑量 1 劑量 1 劑量 2 劑量 2 劑量 2 隊列 1 1 3 3 2 2 4 性別男性女性男性男性女性男性 症狀發作 (月) 14 12 5 13 出生 12 4 出生 年齡 基線 (月) (月) 14 31 15 18 6 17 7 6 DBS β-gal 活性 (nmol/ml/hr) (1) 0.0 0.2 0.0 0.0 0.1 0.0 0.4 0 Genotype c.601c>t, c.601c>t c.601c>t, c.1733aa>g c.694dupc, c.694dupc c.1370g>a, c.168c>g c.1577dup, c.1577dup, c.1577dup c.1733a>g, c.802g>c c.765g>c, c.841c>t c.176g>a, c.176g>a DBS,幹血斑。 1正常值下限: |
| 12 Imagine-1 研究:羣組 1-4 安全性與耐受性 沒有與治療相關的嚴重不良事件 (SAE) 所有與治療相關的不良事件 (AE) 的嚴重程度均為輕度至中度 肝功能沒有臨牀上顯著的變化需要幹預 沒有通過神經傳導研究衡量的 DRG 毒性的證據 沒有與 ICM 給藥相關的併發症 免疫學特徵良好沒有臨牀上顯著的免疫反應1 PBGM01 耐受性良好,在中期分析中具有良好的安全性* *患者截至2023年6月26日的數據截止日期,隨訪時間為給藥後的8至28個月 1 沒有患者需要調整免疫抑制方案。 |
| 13 項研究 參與者存活率與自然歷史相比提高的初步證據 * 來自 Lang FM 等人Mol Genet Metab。2020;129 (3): 228-235。Lang 等人的薈萃分析將 GM1 I 型定義為 獲得 PBGM01 關鍵點的 20 個月大(n=3)發病 |
| 14 劑量 1 對關鍵腦脊液 生物標誌物的影響不大 0 500 1,000 1,500 2,500 2,500 3,500 3,500 0 0 0 30 60 90 120 180 240 270 300 330 360 420 420 450 神經節苷脂,表現 nM 時間(天) 劑量 1 GM1 神經節苷脂、腦脊液 P1 晚嬰兒 P2 晚嬰兒 P3 P5 Early Infantile Late Infantile:Circle 早期嬰兒:Square 健康成人平均值 CSF= 腦脊液 0 1 2 3 4 5 6 0 30 60 90 120 240 300 330 360 390 420 450 β-gal,nmol/ml/3HR 時間(天) 劑量 1 半乳糖苷酶,腦脊液 P1Late Infantile P2 晚期嬰兒 P3 早期嬰兒 P5 早期嬰兒 健康成人平均值 GM1 NHS 平均值 b-gal • 劑量 1 PBGM01 導致第 30 天腦脊液 b-gal 活性相對於 基線略有增加(1.5 至 4.8倍)• 沒有患者保持正常的成人 b-gal 活性水平 神經節苷脂 • 劑量 1 PBGM01 未導致 GM1 神經節苷脂降低 • 患者 3(br} 活性適度增加): GM1 神經節苷脂水平升高與 臨牀惡化有關 關鍵點 — 劑量 1 |
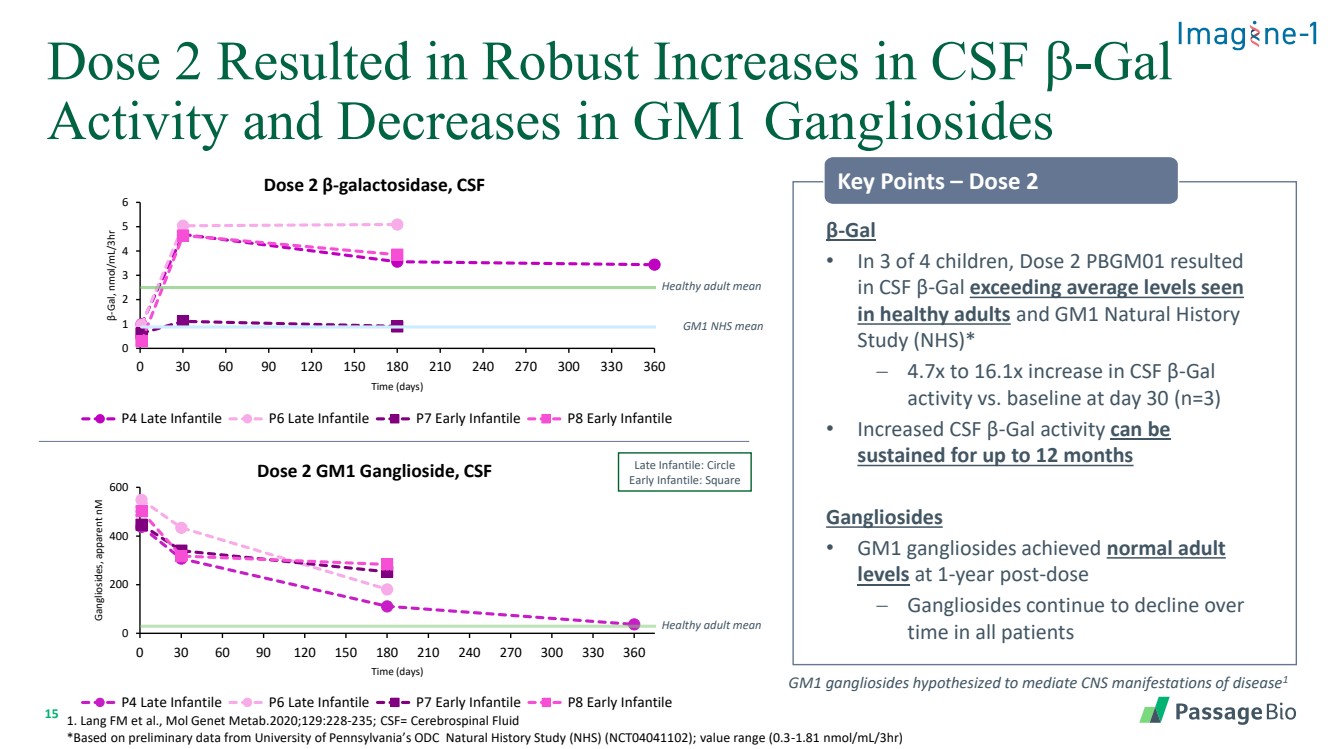
| 15 劑量 2 導致腦脊液 b-gal 活性大幅增加,GM1 神經節苷脂活性降低 0 200 600 0 30 60 90 90 120 180 210 240 270 300 330 360 神經節苷脂,表現 nM 時間(天) 劑量 2 GM1 神經節苷脂、CSF P4 晚期嬰兒 P6 晚期嬰兒 P7 嬰兒早期 P7 Le P8 Early Infantile • 在 4 名兒童中,劑量 2 PBGM01 導致 腦脊液 β-gal 超過了健康成人 和 GM1 自然史 研究 (NHS) * − 第 30 天腦脊液 β-gal 活性與基線相比增加 4.7 倍至 16.1 倍 (n=3) •腦脊液 β-gal 活性的增加可以持續長達 12 個月 神經節苷脂 • GM1 神經節苷脂在給藥 1 年後達到正常的成人 水平 − 所有患者的神經節苷脂在 時間內持續下降健康成人平均值 1。Lang FM 等人,Mol Genet Metab.2020;129:228-235;CSF= 腦脊液 *基於賓夕法尼亞大學 ODC 自然歷史研究 (NHS) (NCT04041102) 的初步數據;值範圍 (0.3-1.81 nmol/ml/3HR) GM1 神經節苷脂假設可以介導疾病的中樞神經系統表現 1 0 1 2 3 4 5 6 0 30 60 60 90 120 180 210 240 270 300 330 360 β-gal,nmol/ml/3HR 時間(天) 劑量 2 β-半乳糖苷酶,腦脊液 P4 晚期嬰兒 P6 晚嬰兒 P7 早期嬰兒 P8 早期嬰兒 健康成人 mean GM1 key Key 積分 — 劑量 2 延遲Infantile:圓圈 Early Infantile:Square |
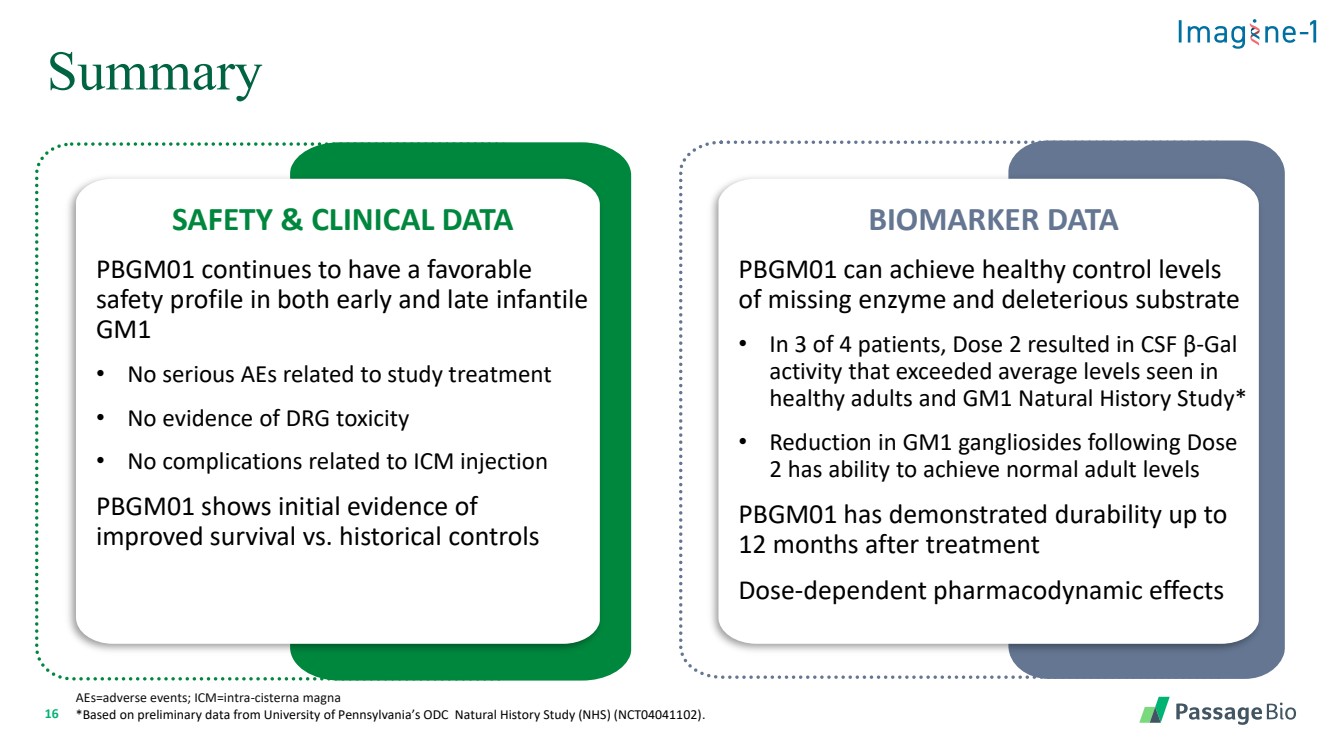
| 16 摘要 aes=不良事件;icm=intra-cisterna magna *基於賓夕法尼亞大學ODC自然歷史研究(NHS)(NCT04041102)的初步數據。 安全和臨牀數據 PBGM01 在嬰兒早期和晚期仍然具有良好的 安全性 GM1 • 沒有與研究治療相關的嚴重不良事件 • 沒有藥物毒性的證據 • 沒有與ICM注射相關的併發症 PBGM01 顯示 與歷史對照組相比,存活率有所提高的初步證據 BIOMARKER DATA PBGM01 可以實現健康控制酶缺失水平 和有害底物 • 在 4 名患者中,有 3 名患者中,劑量 2 導致腦脊液 β-gal 活性超過 健康成年人和 GM1 的平均水平自然史研究* • 劑量後 GM1 神經節苷脂的減少 2 能夠達到正常的成人水平 PBGM01 在治療 12 個月後已顯示出耐久性 劑量依賴性藥效學效學作用 |
| 17 節目更新 Samiah Al-Zaidy,醫學博士 |
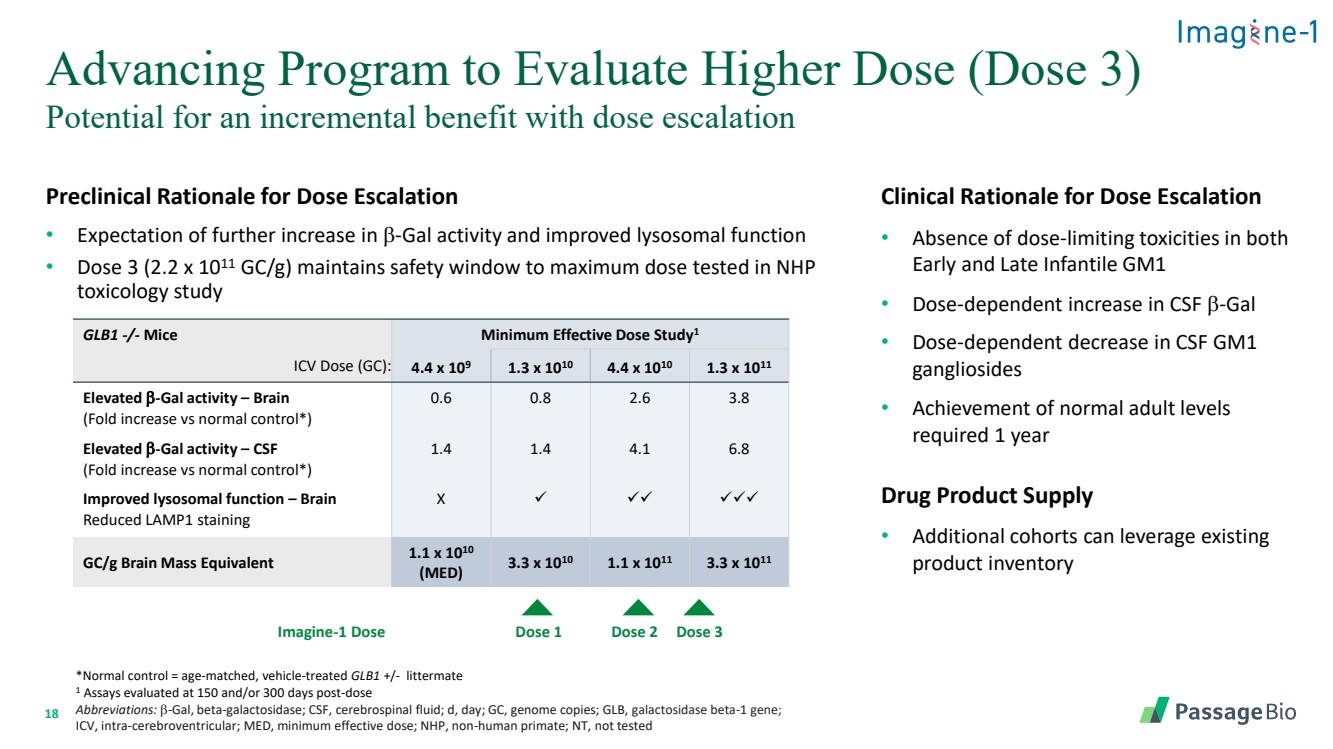
| 18 劑量遞增的臨牀前理由 • 預期 b-gal 活性進一步增加和溶酶體功能得到改善 • 劑量 3(2.2 x 1011 gc/g)將安全窗口保持在 NHP 毒理學研究中測試的最大劑量 評估更高劑量(劑量 3)的推進計劃 GLB1-/-小鼠最小有效劑量 stub dy1 ICV 劑量 (GC):4.4 x 109 1.3 x 1010 4.4 x 1010 x 1010 1.3 x 1011 b-gal 活性升高 — 大腦 (與正常對照相比摺疊增加*) 0.6 0.8 2.6 3.8 b-gal 活性升高 —腦脊液 (與正常對照相比摺疊增加*) 1.4 1.4 4.1 6.8 改善溶酶體功能 — 大腦 減少 LAMP1 染色 X ✓ ✓✓ ✓✓✓ gc/g 腦質量當量 1.1 x 1010(MED)3.3 x 1010 1.1 x 1011 3.3 x 1011 劑量 1 劑量 2 劑量 3 *正常對照 = 年齡匹配、車輛治療的 GLB1 +/-litterleter mate 1 在給藥後 150 天和/或 300 天評估的測定 縮寫:b-gal,β-半乳糖苷酶;腦脊液;d,天;GC,基因組拷貝;GLB,半乳糖苷酶 β-1 基因; ICV,腦室內;MED,最低有效劑量;NHP,非人類靈長類動物;NT,未經過測試 劑量遞增的臨牀依據 • 嬰兒早期和晚期 GM1 均無劑量限制毒性 • 腦脊液 b-gal 的劑量依賴性增加 • 腦脊液 GM1 神經節苷脂的劑量依賴性降低 • 需要一年 藥品供應 • 額外補充 horts 可以利用現有的 產品庫存 Imagine-1 Dose |
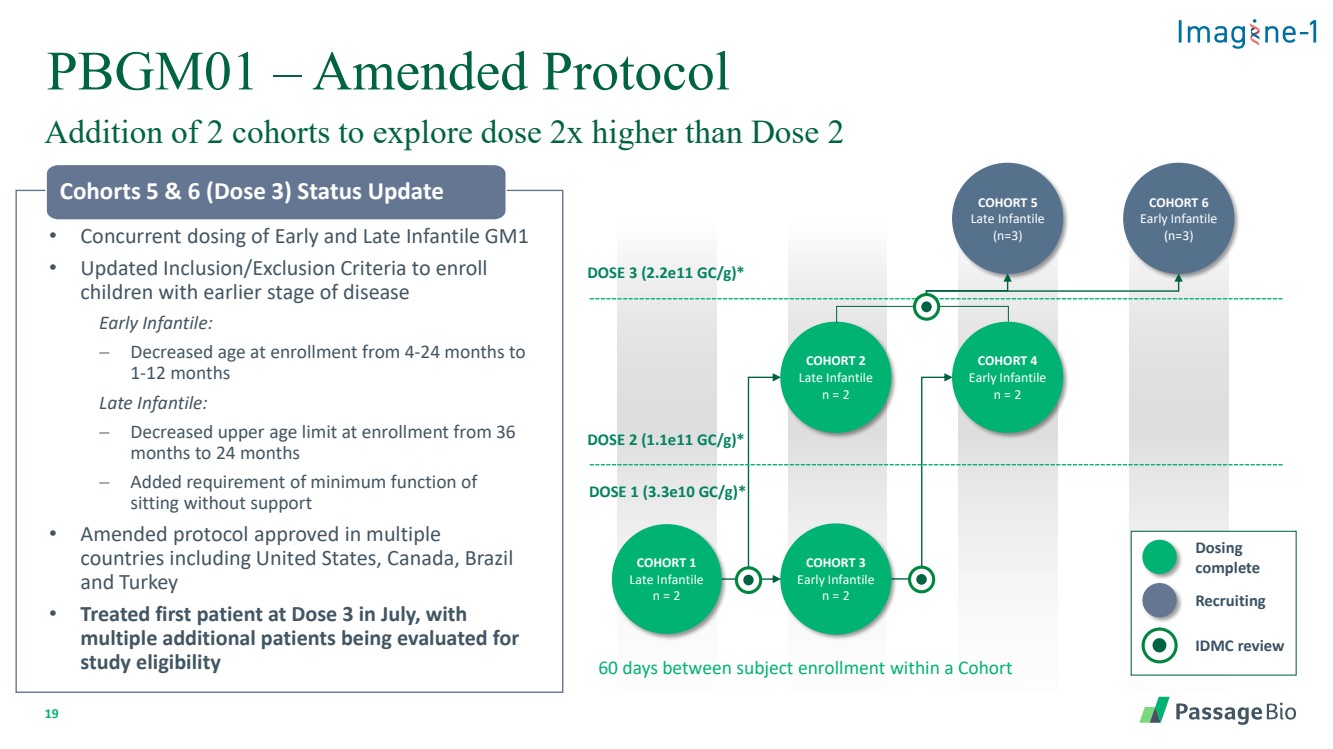
| 19 PBGM01 — 修訂後的協議 增加 2 個隊列以探索劑量比 2 劑量高 2 倍 • 同時服用早期和晚期嬰兒 GM1 • 更新了納入/排除標準,以招收患有早期疾病的 兒童 早期嬰兒: − 入學年齡從 4-24 個月降至 1-12 個月 晚期 降低 − 入學年齡上限從 36 個月到 24 個月 − 增加了在沒有支撐的情況下坐着的最低功能要求 • 修訂後的協議已在包括美國在內的多個 國家獲得批准,加拿大、巴西 和土耳其 • 7 月份在第 3 劑量治療了第一位患者, 另外還有多名患者正在接受評估 第 5 和 6 組(劑量 3)狀態更新 隊列 4 早期嬰兒 n = 2 劑量 2 (1.1e11 gc/g) * 劑量 1 (3.3e10 gc/g) * COHORT 6 Early Infantile (n=3) 羣組 5 Late Infantile (n=3) 羣組 2 晚期嬰兒 n = 2 羣組 3 早期嬰兒 n = 2 IDMC 評論 招募 完成 br {} 隊列中受試者入學間隔 60 天 劑量 3 (2.2e)11 gc/g) * |
| 20 閉幕詞 Will Chou,醫學博士 |
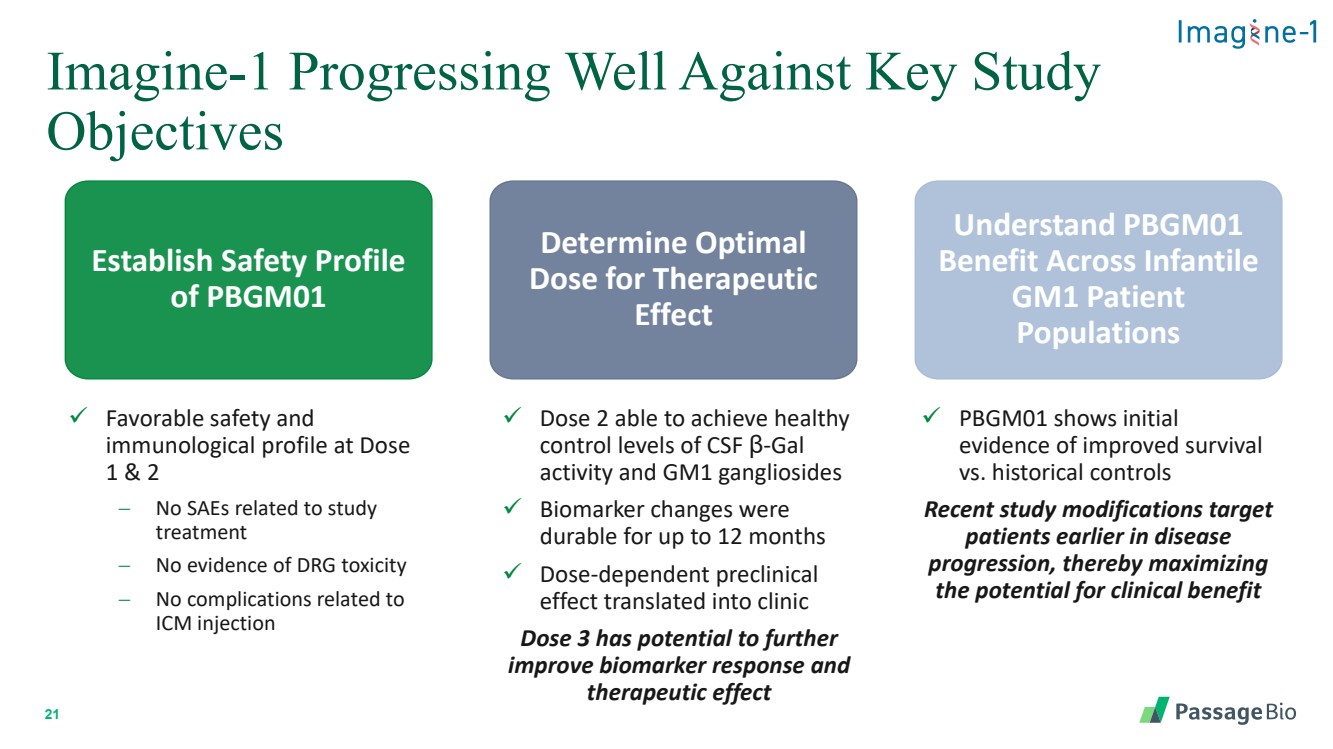
| 21 Imagine-1 在關鍵研究 目標方面進展良好 建立 PBGM01 的安全概況 確定治療效果的最佳 劑量 瞭解 PBGM01 對嬰兒的益處 GM1 患者 人羣 ✓ 劑量 1 和 2 時的安全性和 免疫學特徵 − 沒有與研究 治療相關的 SAE 沒有證據的 DRG 毒性 − 沒有與 ICM 注射相關的併發症 ✓ 劑量 2 能夠達到健康的 腦脊液 β-gal 活性和 GM1 神經節苷脂 控制水平 ✓ 生物標誌物的變化在 的持續時間長達12 個月 ✓ 劑量依賴性臨牀前 效應轉化為臨牀 劑量 3 有可能進一步改善生物標誌物反應而 治療效果 ✓ PBGM01 顯示了存活率與歷史對照組相比提高的初始 證據 最近的研究修改針對的是疾病 進展早期的 患者,從而最大限度地提高了 獲得臨牀益處的潛力 |
| 22 PBGM01 Program Anticipated Next Steps • Treated first patient at Dose 3 in July • Plan to share initial safety and biomarker data from Dose 3 by mid-2024 Complete enrollment of Cohorts 5 and 6 • Analyze data from Cohorts 1-6 to establish safety/tolerability profile and therapeutic potential of each dose Determine optimal dose for confirmatory study • Continued interactions with regulatory authorities as data set matures to align on design of confirmatory study and pathway to Biologics License Application Continue engagement with regulatory authorities |
| Q&A |