
mesoblast 炎症性疾病異體細胞藥物全球領導者 2023 年 8 月澳大利亞證券交易所:MSB;納斯達克:截至2023年6月30日止年度的MESO財務業績和運營更新

關於前瞻性陳述的警示説明本演示文稿包括與未來事件或我們未來財務業績相關的前瞻性陳述,涉及已知和未知的風險、不確定性和其他因素,這些因素可能導致我們的實際業績、活動水平、業績或成就與這些前瞻性陳述所表達或暗示的任何未來業績、活動水平、業績或成就存在重大差異。我們根據1995年《私人證券訴訟改革法》和其他聯邦證券法的安全港條款發表此類前瞻性聲明。除本演示文稿中包含的歷史事實陳述外,所有陳述均為前瞻性陳述。諸如但不限於 “相信”、“期望”、“預期”、“估計”、“打算”、“計劃”、“目標”、“可能”、“可能”、“可能” 之類的詞語以及類似的表達方式或短語來標識前瞻性陳述。這些前瞻性陳述主要基於我們當前的預期和未來事件、監管法的最新變化以及我們認為可能影響我們的財務狀況、經營業績、業務戰略和財務需求的財務趨勢。這些陳述可能涉及但不限於:對Mesoblast成體幹細胞技術的安全性、有效性或潛在應用的期望;對Mesoblast知識產權實力的期望、Mesoblast的監管批准程序的時間表以及製造過程的可擴展性和效率;對Mesoblast業務增長能力的期望以及關於其與當前和潛在未來業務合作伙伴的關係以及這些合作伙伴的未來收益的聲明關係;有關Mesoblast股價或潛在市值的聲明;以及有關Mesoblast資本要求和未來籌集資金能力的聲明等。不應將前瞻性陳述視為對未來業績或業績的保證,實際結果可能與這些前瞻性陳述中的預期結果有所不同,差異可能是重大的,也是不利的。您應在我們最近向美國證券交易委員會提交的報告中或在我們的網站上閲讀本演示文稿以及我們的財務報表和相關附註以及風險因素。可能導致Mesoblast的實際結果、業績或成就與此類陳述可能表達或暗示的結果、業績或成就存在重大差異的不確定性和風險包括但不限於:潛在產品的開發和商業化固有的風險;臨牀試驗結果或監管部門批准或許可的不確定性;政府監管;對未來資本的需求;對合作者的依賴;以及對我們知識產權的保護等。因此,您不應過分依賴這些前瞻性陳述。我們不承擔任何義務公開更新或修改任何前瞻性陳述,無論是由於新信息、未來發展還是其他原因。

我們的使命 Mesoblast 致力於將創新的細胞藥物推向市場,以治療嚴重和危及生命的疾病
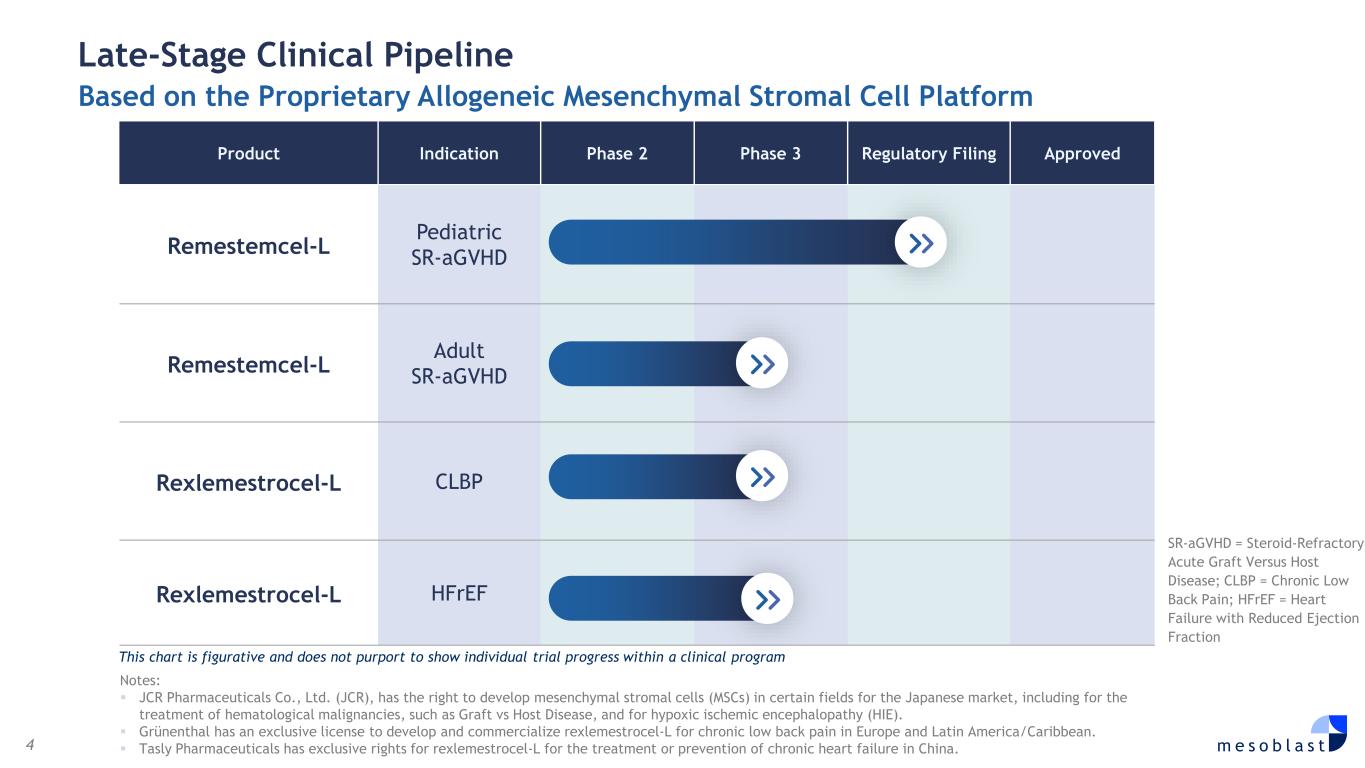
4 m e s o b l a s t 基於專有的同種異體間充質基質細胞平臺的後期臨牀管線產品適應症 2 期 3 期監管備案獲批 remestemcel-L 兒科 sr-agvHD rexlemestemcel-L 成人 sr-agvHD Rexlemestrocel-L CLBP Rexlemestrocel-L hfref sr-agvHD = 類固醇難治急性 GravHD = 類固醇難治性急性 GravHD 對比宿主病;CLBP = 慢性腰痛;hfreF = 心力衰竭伴射血分數減少此圖表具有比喻性,並不旨在顯示臨牀項目中的個別試驗進展注意:JCR Pharmicals有限公司(JCR)有權在某些領域為日本市場開發間充質基質細胞(MSC),包括用於治療血液系統惡性腫瘤,例如移植物抗宿主病和缺氧缺血性腦病(HIE)。Grünenthal擁有開發和商業化治療慢性腰背的Rexlemestrocel-L的獨家許可歐洲和拉丁美洲/加勒比地區的疼痛。天士力製藥擁有Rexlemestrocel-L在中國治療或預防慢性心力衰竭的專有權。

5 m e s o b l a s t 投資亮點 remestemcel-L for sr-AgvHD Rexlemestrocel-L for CLBP 新型異體細胞療法平臺財務正在為類固醇難治性急性移植物抗宿主病(sr-AGVHD)兒童開發領先適應症即將與美國食品藥品管理局舉行A型會議,討論產品批准策略椎間盤源性慢性腰痛(CLBP)的第一階段3已完成。美國食品藥品管理局批准的 RMAT。啟動第二階段3期研究開發基於專有間充質基質細胞(MSC)技術平臺的現成異體細胞藥物,無需捐贈者配對或免疫抑制即可進行治療過去12個月的750萬美元特許權使用費收入為7,130萬美元。截至2023年6月30日,HFREF的Rexlemestrocel-L為7,130萬美元。f) 二級/三級患者。美國食品藥品管理局為患有 LVAD 的終末期 hFreF 患者發放的 RMAT BLA = 生物製劑許可證申請 FDA = 美國食品藥品監督管理局 PDUFA = 處方藥使用者費用法 RMAT = 再生醫學高級療法 LVAD = 左心室輔助設備

6 m e s o b l a s t 在為期六個月的BLA審查中,我們在將這種尖端產品推向市場方面取得了實質性進展,完成了美國食品藥品管理局對我們製造過程的全面檢查。2023年8月,美國食品藥品管理局對重新提交的用於治療兒科sr-AgvHD的remestemcel-L的生物製劑許可證申請(BLA)做出了完整的迴應。美國食品和藥物管理局提供了完整的迴應,要求Mesoblast證明在3期試驗中使用的產品與計劃商業發佈的產品相似,根據標準化效力測定,美國食品藥品管理局表示,如果該公司無法通過額外的效力測定工作來建立這種聯繫,則需要進行額外的臨牀試驗來建立這種聯繫。定於9月中旬與美國食品藥品管理局舉行的A型會議提議向美國食品藥品管理局提供額外的效力測定數據,以提供兩者之間的聯繫第 3 階段產品和商業庫存 Mesoblast提議向美國食品藥品管理局提供新的成人臨牀試驗數據,這也可能支持Remestemcel-L在SR-AgvHD小兒A型患者中的兒科適應症監管狀況美國食品藥品管理局會議定於9月中旬舉行的FDA會議

7 m e s o b l a s t 根據我們向成人患者羣體(其人數約為兒童多5倍)的總體商業戰略,Mesoblast 打算對死亡風險高的成年人進行有針對性的對照研究 sr-AgvHD 患者中至少一種藥物(例如魯索利替尼)失效的成年人的存活率在 100 天之前仍低至 20-30% 1,2 相比之下,100-100 71名年齡在12歲及以上的sr-AgvHD患者中,使用remestemcel-L治療後,日存活率為63%,但未獲得迴應至少另一種藥物,例如ruxolitinib Mesoblast正在與負責美國所有移植手術80%的血液和骨髓臨牀試驗網絡(BM CTN)的世界領先研究人員討論開展這項新的臨牀試驗。這項有針對性的研究的費用預計將由財務部分 “Remestemcel-L在srag患者中的監管狀況” 中概述的計劃削減支出來支付 vHD 在成人中生成新的臨牀數據 1.Jagasia M 等人魯索利替尼用於治療類固醇難治性急性移植物抗宿主病(REACH1):一項多中心、開放標籤的2期試驗。Blood。2020 年 5 月 14 日;135 (20):1739—1749 2.Abedin S 等人魯索利替尼在類固醇難治性急性移植物抗宿主病中的耐藥性或不耐受性——一項真實世界的結果分析。《英國血液學雜誌》,2021 年;195:429 —43。

8 m e s o b l a s t© Lonza,經許可轉載截至 2023 年 6 月 30 日的期間製造業 Remestemcel-L

9 m e s o b l a s t 第一年的財務摘要。TEMCELL® HS Inj. 是 JCR Pharmicals Co. 的註冊商標Ltd. 2.為了計算支付給Mesoblast的特許權使用費,我們的被許可方的TEMCELL銷售額以日元記錄,然後再折算成美元。業績已根據美元兑日元匯率從截至2022年6月30日止年度的1美元:122.14日元至截至2023年6月30日年度的1美元:139.76日元的變動進行了調整。FY2023 中經營活動的淨現金使用量為6,330萬美元;與 FY2021 相比,減少了37%,與2022財年相比減少了4%。截至2023年6月30日止年度,Cash Burn特許權使用費收入為750萬美元。按固定貨幣計算,截至2023年6月30日止年度,我們的被許可方在日本銷售TEMCELL® HS Inj.1的特許權使用費為812萬美元,而截至2022年6月30日的年度為870萬美元。截至2023年6月30日,手頭現金為7,130萬美元,從我們現有的融資機制中再增加4,000萬美元,這取決於某些里程碑和可用性的延期。現金儲備

10 m e s o b l a s t 減少研發支出,改善税前虧損:收入主要來自我們的被許可方在日本銷售的 TEMCELL® HS Inj.1 的特許權使用費。研發支出減少:截至2023年6月30日的年度減少了560萬美元(17%),降至2720萬美元。研發費用主要用於支持重新提交remestemcel-L BLA的準備工作以及Rexlemestrocel-L關鍵研究的準備工作。減少製造業支出:減少300萬美元(10%),至截至2023年6月30日止年度的2770萬美元。在截至2023年6月30日的一年中,我們繼續進行上市前的製造活動。財務成本包括截至2023年6月30日止年度的1,520萬美元非現金支出,包括應計利息和借款成本。截至2023年6月30日的季度損益(百萬美元)2022年6月30日總收入 7.5 10.2 研發(27.2)(32.8)製造業(27.7)(30.8)管理與行政(25.4)(27.2)或有對價的重估 8.8 0.9 重估認股權證負債(2.2)5.9 其他營業收入和支出 4.2(0.5)財務成本(20.1)(17.3)税前虧損 (82.1) (91.6) 所得税優惠 0.2 0.2 税後虧損 (81.9) (91.4) 數字已四捨五入。1.TEMCELL® HS Inj. 是 JCR Pharmicals Co. 的註冊商標有限公司

1100 萬 e s o b l a s t FY2023 的淨運營現金使用量與 FY2021 相比減少了 37%,與 FY2022 相比減少了 4%。此外,通過減少研究、銷售和營銷、商業庫存和薪資方面的支出,將 FY2024 的年度淨運營現金支出從 FY2023 的 6,330 萬美元減少到 4,830 萬美元,這將部分被我們對 sr-AGVHD 第三階段計劃的投資所抵消到2024年2月,CLBP的工資按年計算減少40%,其中包括基本工資、STI補助金和承包商費 o 首席執行官和首席營銷官已推遲了整個2023財年的短期激勵措施(STI),自願將24財年的基本工資降低了30%以保留現金,而是將獲得長期非現金激勵(LTI)以進一步與股東保持一致 o 2023財年所有員工的短期激勵措施(STI)已完全延期 o 管理層有資格獲得LTI以代替工資減少30%非執行董事自願推遲了100%的現金支付並同意收取其價值的50%長期非現金激勵措施中的薪酬 (LTI) 財務報表從 FY2024 的季度報告轉為半年報告以及持續的季度附錄 4C 現金和運營報告,符合澳大利亞證券交易所上市實體未來 12 個月的成本控制計劃減少運營活動和薪資支出

12 m e s o b l a s t 類固醇難治性急性移植物抗宿主病 (sr-agvHD)

13 m e s o b l a s t 急性移植物抗宿主病 (AgvHD) 同種異體骨髓移植 (BMT) 的嚴重和致命併發症 1 期 BMT 調理引起的宿主組織損傷第 2 階段免疫細胞激活和細胞因子風暴第 3 階段炎症和終末器官損傷調理方案、化療或放射性組織損傷 CD4 和 CD8 T 細胞激活 TNF、IL-1 6 ifnγ、IL-2、IL-12、IL-21、IL-22、IL-23 巨噬細胞輸入細胞因子風暴 Macrophage 改自 Blazar 等人,《自然評論》免疫學 12:443 — 458

14 m e s o b l a s t 1。Westin,J.,Saliba,RM.,Lima,M.(2011)類固醇難治性急性 GVHD:預測因子和結果。血液學的進展。2.Anthem-Healthcore/Mesoblast 索賠分析(2016 年)。存檔數據 3.Niederwieser D、Baldomero H、Szer J.(2016)2012 年全球造血幹細胞移植活動以及包括全球調查在內的全球血液和骨髓移植網絡集團的 SWOT 分析。4.HRSA 移植活動報告,CIBMTR,2020 年 5.Axt L、Naumann A、Toennies J(2019)對異基因造血細胞移植後類固醇難治性移植物抗宿主病的預後、危險因素和治療的回顧性單中心分析。骨髓移植。每年在全球範圍內進行3萬多例異基因骨髓移植(>2萬例美國/歐盟),約20%兒科3,4 每年在美國進行約9,000-10,000例異基因骨髓移植在美國的兒童和青少年中約有1,500例異體骨髓移植4 Remestemcel-L:類固醇難治性急性移植物抗宿主病(sr-AgvHD)sr-agvHD 與死亡率有關高達 90% 急性 GVHD 是一種危及生命的併發症,在接受異體骨髓移植 (BMT) 的患者中,約有 50% 會出現 1 急性 GVHD 主要影響皮膚、胃腸道和肝臟類固醇難治性AgvHD 與高達 90% 的死亡率相關 1,5 以及顯著的延長住院費用2 治療選擇疾病負擔市場機會皮質類固醇是 AgvHD 的一線療法。只有一種經批准的類固醇難治性疾病治療藥物,美國沒有批准的 12 歲以下兒童的治療方法在日本,Mesoblast 的被許可方獲得了兒童和成人 sr-AgvHD 的唯一產品批准

15 m e s o b l a s t 1。GVHD001 有 55 名隨機患者,但是有一名患者在接受任何劑量的 remestemcel-L 之前就退出了;2.西奈山急性移植物抗宿主病國際聯盟(MAGIC)——由遍佈美國和歐洲的十個骨髓移植中心組成的小組,其目的是對移植物抗宿主病進行開創性的臨牀試驗,包括開發信息豐富的生物儲存庫,以幫助開發可以指導移植物抗宿主病治療的治療方法;3.MAGIC 隊列中有兩名受試者進行了隨訪
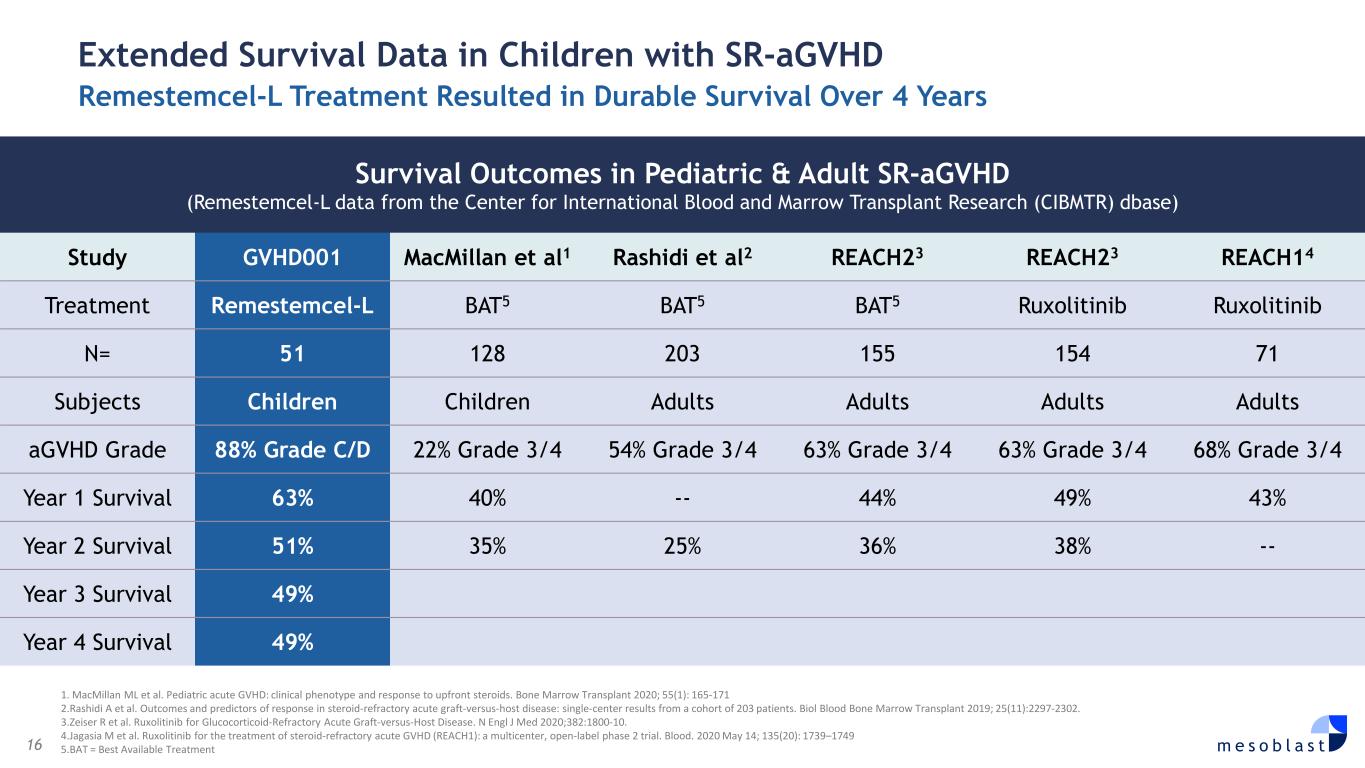
16 m e s o b l a s t 1。MacMillan ML 等人小兒急性 GVHD:臨牀表型和對預付類固醇的反應。2020 年骨髓移植;55 (1):165-171 2.Rashidi A 等人類固醇難治性急性移植物抗宿主病的結果和反應預測指標:來自203名患者的單中心結果。2019 年 Biol Blood 骨髓移植;25 (11): 2297-2302。3.Zeiser R 等人Ruxolitinib 治療糖皮質激素難治性急性移植物抗宿主病。N Engl J Med 2020;382:1800-10。4.Jagasia M 等人魯索利替尼用於治療類固醇難治性急性移植物抗宿主病(REACH1):一項多中心、開放標籤的2期試驗。血液。2020 年 5 月 14 日;135 (20):1739—1749 5.BAT = 最佳可用療法 sr-AGVHD Remestemcel-L 治療兒童延長存活率數據,兒童和成人 sr-AGVHD(來自國際血液與骨髓移植研究中心 (CIBMTR) dbase 的 Remestemcel-L 數據)研究 GVHD001 MacMillan 等人 1 Rashidi et al2 REACH23 REACH23 REACH14 治療 remestemcel-L BAT5 BAT5 BAT5 ruxolitinib ruxolitinib Ruxolitinib N= 51 128 203 155 154 71 71 個受試者兒童成人成人成人 agvHD 等級 88%C/D 級 22% 3/4 年級 54% 3/4 年級 63% 3/4 年級 63% 3/4 年級 68% 3/4 年級 1 生存率 63% 40% — 44% 49% 43% 二年級存活率 51% 35% 25% 36% 38% — 三年級生存率 49% 四年級生存率 49%

17 m e s o b l a s t 商業策略是發展類固醇失敗的成年人和一線藥物,包括魯索利替尼的市場機會大約是兒科的五倍。大約 45% 的魯索利替尼患者沒有反應 1 在至少一種額外藥物(例如魯索利替尼)中失效的 sr-agvHD 成人存活率為 20-30% 1,2 相比之下,71名12歲及以上的sr-AgvHD患者在富有同情心的護理下使用remestemcel-L治療後,100天存活率為63%,但對以下患者沒有反應至少還有一種藥物,例如ruxolitinib Mesoblast,正在與負責美國所有移植手術80%的血液和骨髓臨牀試驗網絡(BM CTN)的世界領先研究人員討論進行這項新的臨牀試驗。這項有針對性的研究的費用預計將由財務部分Remestemcel-L針對sr-AgvHD的成年人所概述的削減支出中概述的計劃支出削減支出 1。Jagasia M 等人魯索利替尼用於治療類固醇難治性急性移植物抗宿主病(REACH1):一項多中心、開放標籤的2期試驗。Blood。2020 年 5 月 14 日;135 (20):1739—1749 2.Abedin S 等人魯索利替尼在類固醇難治性急性移植物抗宿主病中的耐藥性或不耐受性——一項真實世界的結果分析。《英國血液學雜誌》,2021 年;195:429 —43。
18 m e s o b l a s t 椎間盤退行性疾病 (CLBP) 引起的慢性腰痛

19 m e s o b l a s t 1。Williams、J.、NG、Nawi、Pelzter、K.(2015)低收入和中等收入國家老年人腰痛相關的危險因素和殘疾。世衞組織全球老齡化與成人健康研究(SAGE)的結果。PloS One。2015;10 (6):e0127880。,2.決策資源:慢性疼痛 2015 年 12 月。,3.LEK 和 NCI 意見領袖訪談和二次分析。,4.Navigant:美國和歐盟三國基於細胞的專有DD療法的商業評估——2014年8月。椎間盤退行性疾病(CLBP)引起的慢性腰痛影響 7M+ Rexlemestrocel-L 代表了治療慢性腰痛的潛在新模式。據估計,美國和歐盟各有超過700萬患者因椎間盤退行性疾病(DDD)而患有 CLBP 和歐盟5 2-4 保守治療失敗的慢性腰痛(CLBP)患者的最低治療選擇包括阿片類藥物和手術 50% 的阿片類藥物和手術類藥物處方適用於 CLBP2 持續改善疼痛有可能減少阿片類藥物的使用並防止手術幹預疾病負擔治療選擇市場機會背痛造成的殘疾比任何其他疾病都要多1 給醫療保健系統帶來可觀的直接和間接成本,1 包括該患者羣體中過度使用阿片類藥物
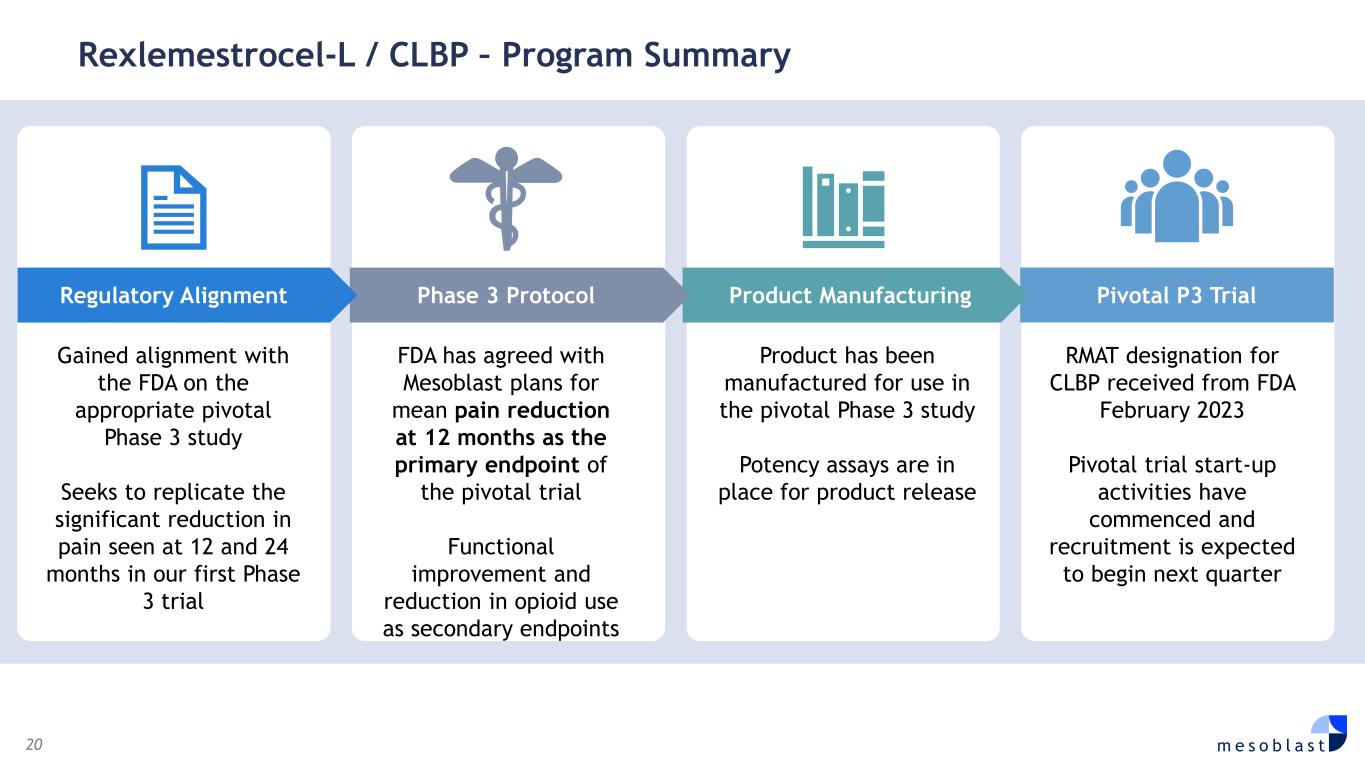
20 m e s o b l a s t Rexlemestrocel-L/CLBP — 項目摘要在適當的關鍵性 3 期研究上與美國食品藥品管理局保持一致尋求複製我們的第一項 3 期試驗中 12 個月和 24 個月時疼痛的顯著減輕 FDA 已同意 Mesoblast 的計劃,將在 12 個月時平均減輕疼痛作為關鍵試驗的主要終點功能改善和減少阿片類藥物的使用作為次要終點產品是為之製造的在關鍵的 3 期研究中使用效能測定法可用於產品發佈 RMAT 指定為CLBP 於 2023 年 2 月從 FDA 收到的 Pivotal 試驗啟動活動已經開始,預計將在下個季度開始招聘 Pivotal P3 試用產品製造第 3 階段協議監管調整

21 m e s o b l a s t RMAT 認證提供了突破和快速通道認定的所有好處,包括滾動審查和提交生物製劑許可申請 (BLA) 時獲得優先審查的資格。試驗結果顯示:與所有受試者在12個月和24個月時的鹽水控制相比,在腰椎間盤中單次注射Rexlemestrocel-l+HA可顯著減輕疼痛(n=400 4) 在基線使用阿片類藥物(n=168)並使用rexlemestrocel-l+HA的患者中,疼痛在36個月內得到緩解與生理鹽水對照組相比,所有時間點的減少幅度都要大得多在基線服用阿片類藥物的患者中,儘管有指示在整個試驗期間維持現有療法,但接受Rexlemestrocel-l+HA治療的患者中,有28%沒有服用阿片類藥物,而接受Rexlemestrocel-L+HA治療CLBP的對照組為8% 的再生醫學高級療法(RMAT)被美國食品藥品管理局授予Rexlemestrocel-L治療CLBP的稱號

22 m e s o b l a s t LS LS 下背痛與基線相比的平均值 VAS 變化——持續時間 CLBP

23 m e s o b l a s t 慢性心力衰竭減少射精分數 (hfreF)
24 m e s o b l a s t Rexlemestrocel-L/hfref — 項目摘要定義美國食品藥品管理局批准的監管途徑心血管疾病仍然是美國的主要死因 CHF 是一種進行性疾病,5 年時死亡率高達 50%,首次住院後死亡率至少為 75% DREAM-HF P3 試驗的最新數據顯示,在所有接受治療的 MACE 事件長期減少之前,LVEF 在 12 個月內有所改善患者 LVEF 是一個潛在的早期替代終點,活躍患者對 LVEF 和 MACE 結局的影響會增強從 II 類到終末期 hfreF 的炎症試驗結果現在支持 Rexlemestrocel-L 逆轉炎症相關內皮功能障礙的 MoA Mesoblast 計劃與其 RMAT 指定的 FDA CY2023 會面,討論潛在的批准途徑美國食品藥品管理局會議瞄準炎症有希望的數據重要需求

25 m e s o b l a s t 患者出現進行性血管功能障礙和心力衰竭 Rexlemestrocel-L 有可能改善 II 類至 IV 類患者的內皮功能障礙早期死亡 • 他汀類藥物 • β受體阻滯劑 • 再血管化或瓣膜手術 • RAAS 拮抗劑 • 用於液體滯留的利尿劑 • 肼屈嗪/二硝酸異山梨酯 • Digitalis NYHA I 級 NYHA IIIB/IVNYHA II 級 NYHA IIB/IIIA 級 NYHA IIIB/IIA 級 Pts 帶末期 hfreF • 最佳醫療管理 • LVAD 植入 • 心臟移植 • 人造心臟NYHA IIB 或 IIIA 類持續性 hFreF 患者 • 心律復律除顫器 (ICD) +/-• CRT-D 或可穿戴心臟復律除顫器(如果需要的話)HFREF DREAM HF-1 試驗 537 名患者最近針對失代償 hfreF 住院和體液超負荷的新口服療法 • sacubitril /valsartan • SGLT2 抑制劑 • Vericiguat 指導指南藥物療法 (GDMT) LVAD MPC 研究 189 名患者心血管疾病風險連續性 Mesoblast 的發展計劃
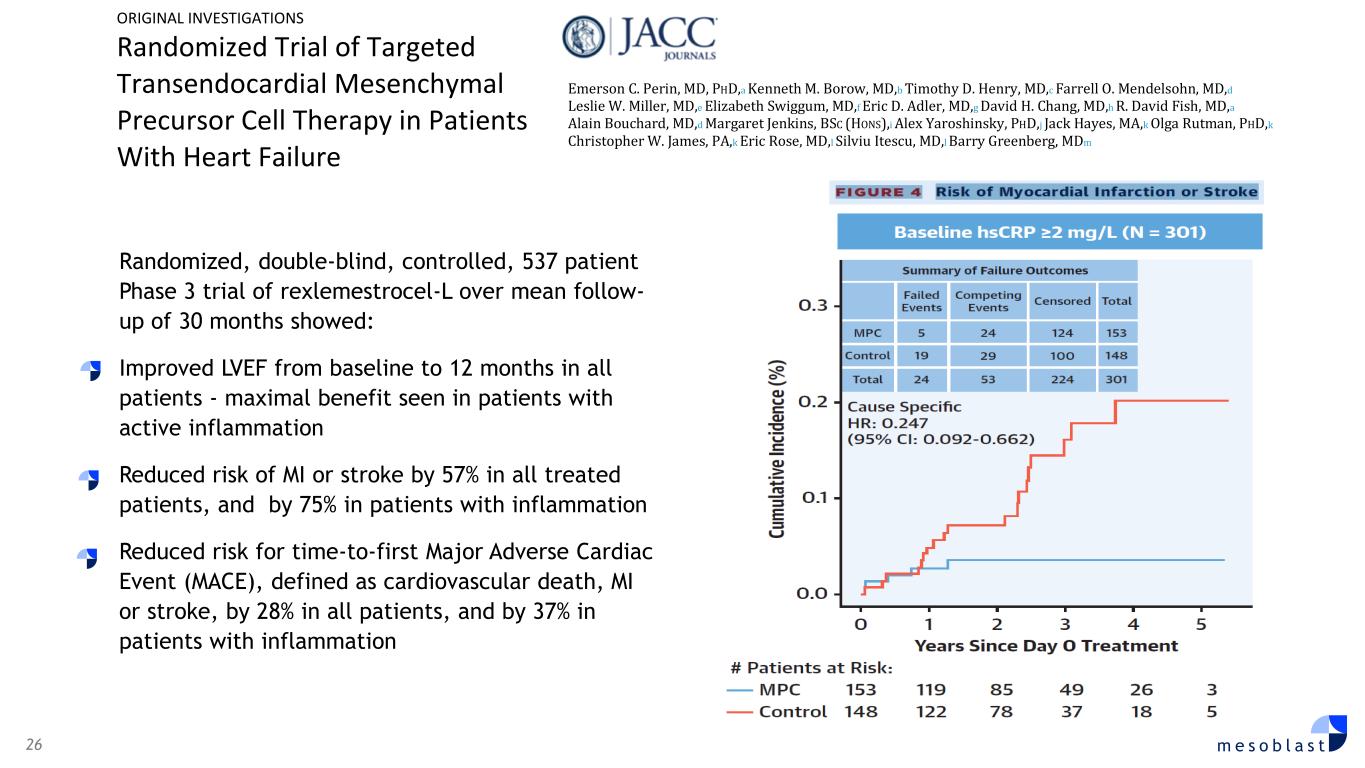
26 m e s o b l a s t 537 名患者 Rexlemestrocel-L 的隨機、雙盲、對照 3 期試驗顯示,平均隨訪時間為 30 個月:所有患者 LVEF 從基線改善至 12 個月——活動性炎症患者獲得最大益處所有接受治療的患者心肌梗死或中風的風險降低 57%,炎症患者發生心肌梗死或中風的風險降低 75% 降低首次發生重大心臟不良事件的風險(MACE),定義為心血管死亡、心肌梗死或中風,所有患者中下降28%,炎症患者下降37%原始調查心力衰竭患者靶向經心臟間充質前體細胞療法的隨機試驗艾默生 C. Perin,醫學博士,a Kenneth M. Borow,醫學博士,b Timothy D. Henry,醫學博士,c Farrell O. Mendelson,醫學博士,d Leslie W. Miller,醫學博士,e Eric D. Adler,醫學博士,g David H. Chang,醫學博士,h R. David Fish,醫學博士,a Alain Bouchard,醫學博士,d 瑪格麗特·詹金斯,理學士(榮譽),i 亞歷克斯·雅羅辛斯基,博士,j Jack Hayes,MD,k Christopher W. James,k Eric Rose,醫學博士,l Silviu Itescu,醫學博士,l Barry Greenberg,mdM
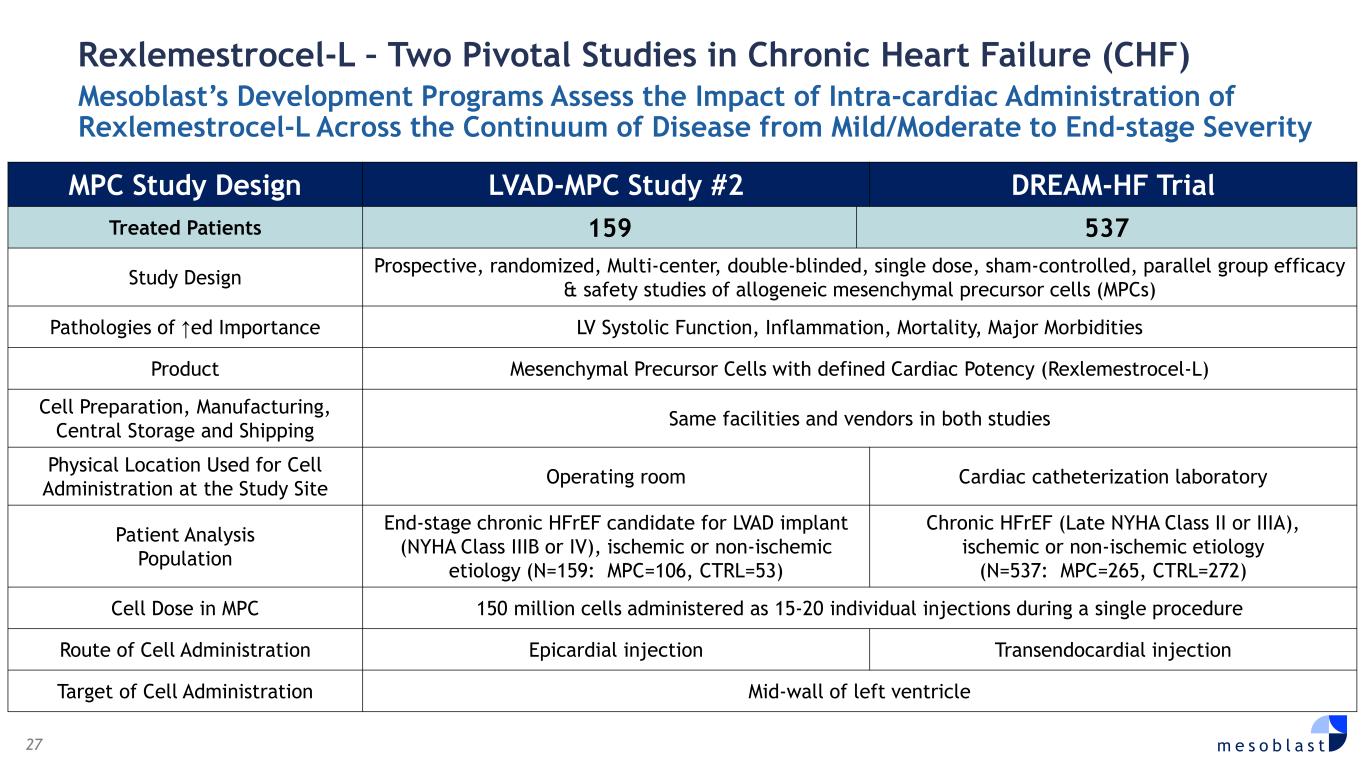
27 m e s o b l a s t Rexlemestrocel-L — 兩項關於慢性心力衰竭 (CHF) 的關鍵研究 Mesoblast 的開發項目評估了心內給藥瑞克美曲賽-L 對從輕度/中度到終末嚴重程度的疾病過程的影響 MPC 研究設計 LVAD-MPC 研究 #2 DREAM-HF 試驗治療患者 159 537 研究設計前瞻性、隨機、多中心、雙盲同種異體間充質前體細胞 (MPC) 的單劑量、sham 對照、平行組療效和安全性研究 ↑ed 病理學重要性 LV收縮功能、炎症、死亡率、主要發病率產品具有明確心臟效力的間充質前體細胞(Rexlemestrocel-L)細胞製備、製造、中央存儲和運輸兩項研究中相同的設施和供應商兩項研究中用於細胞給藥的物理位置手術室心導管檢查實驗室患者分析人羣終末期慢性 hfref 候選人羣 LVAD 植入物(NYHA IIIB 或 IV 級),缺血缺血性或非缺血性病因(N=159:MPC=106,CTRL=53)慢性 hfreF(晚期 NYHA II 類或IIIA),缺血性或非缺血性病因(N=537:MPC=265,CTRL=272)MPC 中的細胞劑量 MPC 中的細胞劑量 1.5 億個細胞在單次手術中以 15-20 次單獨注射方式進行細胞給藥途徑心外側注射經心內注射細胞給藥靶左心室中壁

28 m e s o b l a s t mesoblast 謝謝