
MESOBLAST公佈了截至2023年6月30日的澳大利亞墨爾本;8月31日和美國紐約;2023年8月30日的財務業績和運營最新情況:炎症性疾病異體細胞藥物領域的全球領導者Mesoblast Limited(澳大利亞證券交易所股票代碼:MSB;納斯達克股票代碼:MESO)今天公佈了截至2023年6月30日的財務業績和運營最新情況,並概述了即將到來的里程碑。Mesoblast首席執行官西爾維烏·伊特斯庫説:“我們原本預計remestemcel-L將獲得美國食品藥品監督管理局(FDA)的批准,用於治療小兒類固醇難治性急性移植物抗宿主病(sr-AgvHD),這種疾病的死亡率很高,沒有針對12歲以下兒童的批准療法。在為期六個月的BLA審查中,我們在將這種尖端產品推向市場方面取得了實質性進展,完成了美國食品藥品管理局對我們製造過程的全面檢查。在得到完整的答覆之後,計劃於9月中旬與美國食品藥品管理局舉行A型會議,我們將討論通過額外的效力測定數據或新的成人臨牀數據獲得批准的潛在途徑。我們仍然致力於為患有這種毀滅性疾病的患者提供這種挽救生命的療法。”Itescu博士繼續説:“我們已經實施了重大的成本控制戰略,並頒佈了大幅削減工資的措施,以保護我們的現金儲備並確保我們在財政上謹慎行事。以身作則,我推遲了整個短期激勵措施(STI),並將年薪降低了30%,我們的首席營銷官埃裏克·羅斯博士也同意了同樣的舉措。我也很高興我們的非執行董事同意推遲所有現金薪酬。”“這些降低成本的策略加上運營精簡將使公司能夠節省現金,同時在我們推進針對患有SR-AGVHD的成年人和慢性炎症性腰痛患者的第三階段計劃的同時,提高價值。”截至2023年6月30日的財務業績 (FY2023) • 截至2023年6月30日的現金儲備為7,130萬美元,現有融資機制最多可額外增加4000萬美元,前提是某些里程碑的實現以及實現這些里程碑的時間表是否延長。• FY2023 的經營活動淨現金使用量為6,330萬美元,與 FY2021 相比減少了37%,與 FY2022 相比減少了4%。• FY2022 降至1,020萬美元,減少的主要原因是一次性的里程碑 FY2023武田為日本批准在 FY2022 中治療肛周瘻管的 Alofisel®(darvadstrocel)提供的 120 萬美元。• 按固定貨幣計算,我們的被許可方在日本出售的 TEMCELL® HS Inj.1 的特許權使用費為 810 萬美元,而 2022 財年為870萬美元。2 未來12個月的成本控制計劃以及運營活動和薪資支出減少淨額 • FY2023 的運營現金使用量與 FY2021 相比減少了37%,與 FY2022 相比減少了4%。• 進一步目標是從63.3美元減少23%(1500萬美元)FY2023通過減少研究、銷售和營銷、商業庫存和薪資方面的支出,FY2023 中的預計年度淨運營現金支出為4,830萬美元,這將部分被我們對SR-AGVHD和CLBP第三階段計劃的投資所抵消。• 目標是到2024年2月將工資按年計算減少40%,其中包括基本工資、短期激勵措施(STI)付款和承包商費用。• 首席執行官和首席營銷官已推遲了整個 23 財年的工資。• 首席執行官和首席營銷官已推遲整個 2013 財年短期激勵措施(STI)自願將其24財年的基本工資降低了30%至 FY2024保留現金,改為獲得長期非現金激勵(LTI),以進一步與股東保持一致,但須經股東批准。

• 2023財年所有員工的短期激勵措施(STI)已完全延期。• 管理層有資格獲得LTI以代替工資減少30%。• 非執行董事自願推遲了100%的董事費現金支付,並同意在LTI中獲得50%的費用,但須經股東批准。REMESTEMCEL-L 戰略更新 • 美國食品和藥物管理局提供了完整的迴應,要求Mesoblast證明在3期試驗中使用的產品與以標準化效力測定法衡量的商業化產品相似。• 美國食品藥品管理局表示,如果該公司無法通過額外的效力測定工作來建立這種聯繫,則需要進行額外的臨牀試驗來建立這種聯繫。• 定於9月中旬與美國食品藥品管理局舉行的SR-A型會議定於9月中旬舉行 AgvHD 適應症。• Mesoblast 提議向 FDA 提供額外的效力測定數據以提供3 期產品與商業庫存之間的聯繫。• Mesoblast 提議向美國食品藥品管理局提供新的成人臨牀試驗數據,這也可能支持兒科適應症。• 根據我們向成人患者羣體(其人數約為兒童多 5 倍)的總體商業戰略,3 Mesoblast 打算對死亡風險高的成年人進行有針對性的對照研究。• 至少另一種藥物失敗的 sr-AGVHD 成人的存活率,例如魯索利替尼,在100天后仍低至20-30%。4,5 • 相比之下,在71名12歲及以上的sr-AgvHD患者中,使用remestemcel-L治療後的100天存活率為63%,這些患者對至少一種額外的藥物(例如ruxolitinib)沒有反應。• Mesoblast正在與血液和骨髓臨牀試驗網絡(BM CTN)的世界領先研究人員進行討論,該機構負責美國所有移植的80%,進行新的臨牀試驗。• 這項有針對性的研究的費用預計將通過上述支出削減來支付。REXLEMESTROCEL-L 策略更新 • 該產品已用於一項關鍵研究,該研究在美國各地招募患者,以支持Rexlemestrocel-L在治療椎間盤退行性疾病引起的慢性腰痛(CLBP)中的潛在上市批准。• 關鍵試驗啟動活動已經開始,預計將於下個季度開始招募。• 主要終點是與安慰劑相比,12個月後疼痛減輕。• Rexlemestrocel-L 有獲得了 CLBP 的再生醫學高級療法 (RMAT) 稱號。• Rexlemestrocel-L 有此外還獲得了 RMAT 認證,用於治療左心室輔助設備(LVAD)患者的心力衰竭。• Mesoblast 將與美國食品藥品管理局會面,尋求根據共同的作用機制和潛在的上市批准途徑,將 RMAT 擴大到沒有 LVAD 的 hfREF 患者。截至2023年6月30日的財務業績詳情 (FY2023) • FY2023 的研發費用減少了560萬美元(17%),降至2720萬美元,而 FY2022 的研發費用為3,280萬美元。研發費用主要用於支持重新提交remestemcel-L BLA的準備工作以及Rexlemestrocel-L關鍵研究的準備工作,因為臨牀試驗招募和數據分析現已完成,我們的候選產品的臨牀試驗活動減少了。

• FY2023 的製造支出減少了300萬美元(10%),降至2770萬美元,而 FY2022 的製造支出為3,070萬美元。在這一年中,我們繼續進行 remestemcel-L 的發佈前製造活動和產品測試。• FY2023 的管理和行政費用減少了180萬美元(7%),降至2540萬美元,而 FY2022 的管理和行政費用為2720萬美元,這主要是由於對 FY2023 中的法律費用進行了一次性調整以及與 FY2022 發生的一次性公司活動相關的專業費用增加。• 重新衡量或有對價確認的收益為880萬美元,反映了 FY2023 的減少在未來的第三方付款中,與 a 相比FY2022 的收益為90萬美元,這主要是由於重估了未來的第三方付款。• 認股權證的公允價值變動確認了 FY2023 虧損220萬美元,而 FY2022 的收益為590萬美元。• FY2023 中的其他營業收入包括350萬美元的研發税收優惠收入。該期間記錄的收入與截至2021年6月30日、2022年6月30日和2023年6月30日的年度根據澳大利亞政府激勵計劃應退還的符合條件的支出有關。• 借款安排的財務成本包括 FY2023 的1,520萬美元非現金支出,包括應計利息和借款成本。FY2023 的税後虧損為8190萬美元,而 FY2022 的税後虧損為9,130萬美元。FY2023 歸屬於普通股股東的淨虧損為每股11.08美分,而 FY2022 的淨虧損為每股14.08美分。電話會議今天將進行網絡直播,從美國東部標準時間上午8點30分(8月31日星期四)和美國東部時間下午6點30分(8月30日星期三)開始。可通過以下方式訪問:https://webcast.openbriefing.com/msb-fyr-2023/ 存檔的網絡直播將在公司網站的投資者頁面上播出:www.mesoblast.com 關於Mesoblast Mesoblast(該公司)是開發用於治療嚴重和危及生命的炎症性疾病的同種異體(現貨)細胞藥物的全球領導者。該公司利用其專有的間充質譜系細胞療法技術平臺建立了廣泛的後期候選產品組合,這些候選產品通過釋放抗炎因子來應對嚴重炎症,這些因子可以對抗和調節免疫系統的多個效應分支,從而顯著減少破壞性的炎症過程。Mesoblast擁有強大而廣泛的全球知識產權組合,所有主要市場的保護範圍至少延續到2041年。該公司的專有製造工藝生產出工業規模、低温保存、現成的細胞藥物。這些細胞療法具有明確的藥物釋放標準,計劃隨時可供全球患者使用。Mesoblast正在基於其remestemcel-L和Rexlemestrocel-L同種異體基質細胞技術平臺開發針對不同適應症的候選產品。Remestemcel-L正在開發用於兒童和成人的炎症性疾病,包括類固醇難治性急性移植物抗宿主病、耐生物性炎症性腸病和急性呼吸窘迫綜合徵。Rexlemestrocel-L正在開發用於治療晚期慢性心力衰竭和慢性腰痛。Mesoblast的被許可方已在日本和歐洲將兩種產品商業化,該公司已在歐洲和中國就某些第三階段資產建立了商業合作伙伴關係。Mesoblast在澳大利亞、美國和新加坡設有分支機構,並在澳大利亞證券交易所(MSB)和納斯達克(MESO)上市。欲瞭解更多信息,請參閲 www.mesoblast.com、LinkedIn:Mesoblast Limited 和 Twitter:@Mesoblast 參考文獻/腳註 1。TEMCELL® HS Inj. 是 JCR Pharmicals Co. 的註冊商標有限公司

2。為了計算支付給Mesoblast的特許權使用費,我們的被許可方的TEMCELL銷售額以日元記錄,然後再折算成美元。業績已根據美元兑日元匯率從截至2022年6月30日止年度的1美元:122.14日元至截至2023年6月30日年度的1美元:139.76日元的變動進行了調整。3.HRSA 移植活動報告,CIBMTR,2020 年 4.Jagasia M 等人魯索利替尼用於治療類固醇難治性急性移植物抗宿主病(REACH1):一項多中心、開放標籤的2期試驗。Blood。2020 年 5 月 14 日;135 (20):1739—1749 5.Abedin S 等人魯索利替尼在類固醇難治性急性移植物抗宿主病中的耐藥性或不耐受性——一項真實世界的結果分析。《英國血液學雜誌》,2021 年;195:429 —43。前瞻性陳述本新聞稿包括與未來事件或我們未來財務業績相關的前瞻性陳述,涉及已知和未知的風險、不確定性和其他因素,這些因素可能導致我們的實際業績、活動水平、業績或成就與這些前瞻性陳述所表達或暗示的任何未來業績、活動水平、業績或成就存在重大差異。我們根據1995年《私人證券訴訟改革法》和其他聯邦證券法的安全港條款做出此類前瞻性陳述。不應將前瞻性陳述視為對未來業績或業績的保證,實際結果可能與這些前瞻性陳述中的預期結果有所不同,差異可能是重大的,也是不利的。前瞻性陳述包括但不限於以下方面的陳述:Mesoblast的臨牀前和臨牀研究的啟動、時間、進展和結果,以及Mesoblast的研發計劃;Mesoblast推動候選產品進入、註冊併成功完成臨牀研究(包括跨國臨牀試驗)的能力;Mesoblast提高其製造能力的能力;監管部門申報和批准的時間或可能性(包括我們提出的申請與美國食品和藥物管理局舉行的 A 型會議,結果此類會議,以及美國食品和藥物管理局未來可能就針對SR-AgvHD兒科患者Remestemcel-L的BLA做出的任何決定)、製造活動和產品營銷活動(如果有的話);Mesoblast候選產品的商業化(如果獲得批准);監管或公眾對使用幹細胞療法的看法和市場接受度;Mesoblast的候選產品(如果有的話)被撤回的可能性由於患者不良事件或死亡而從市場上消失;戰略合作的潛在好處協議以及Mesoblast建立和維持既定戰略合作的能力;Mesoblast建立和維護其候選產品的知識產權的能力,以及Mesoblast在涉嫌侵權的情況下成功為這些候選產品進行辯護的能力;Mesoblast能夠建立和維護涵蓋其候選產品和技術的知識產權的保護範圍;對Mesoblast支出、未來收入、資本需求及其額外融資需求的估計;Mesoblast 的支出、未來收入、資本需求及其對額外融資的需求;Mesoblast 能夠建立和維護的保護範圍;的財務業績;與Mesoblast的競爭對手和行業相關的發展;以及Mesoblast候選產品的定價和報銷(如果獲得批准)。您應該在我們最近向美國證券交易委員會提交的報告中或在我們的網站上閲讀本新聞稿以及我們的風險因素。可能導致Mesoblast的實際業績、業績或成就與此類陳述可能表達或暗示的業績、業績或成就存在重大差異的不確定性和風險,因此,您不應過分依賴這些前瞻性陳述。我們不承擔任何義務公開更新或修改任何前瞻性陳述,無論是由於新信息、未來發展還是其他原因。由行政長官授權發佈。欲瞭解更多信息,請聯繫:企業傳播/投資者媒體 Paul Hughes BlueDot Media T:+61 3 9639 6036 Steve Dabkowski E:investors@mesoblast.com T:+61 419 880 486 E:steve@bluedot.net.au
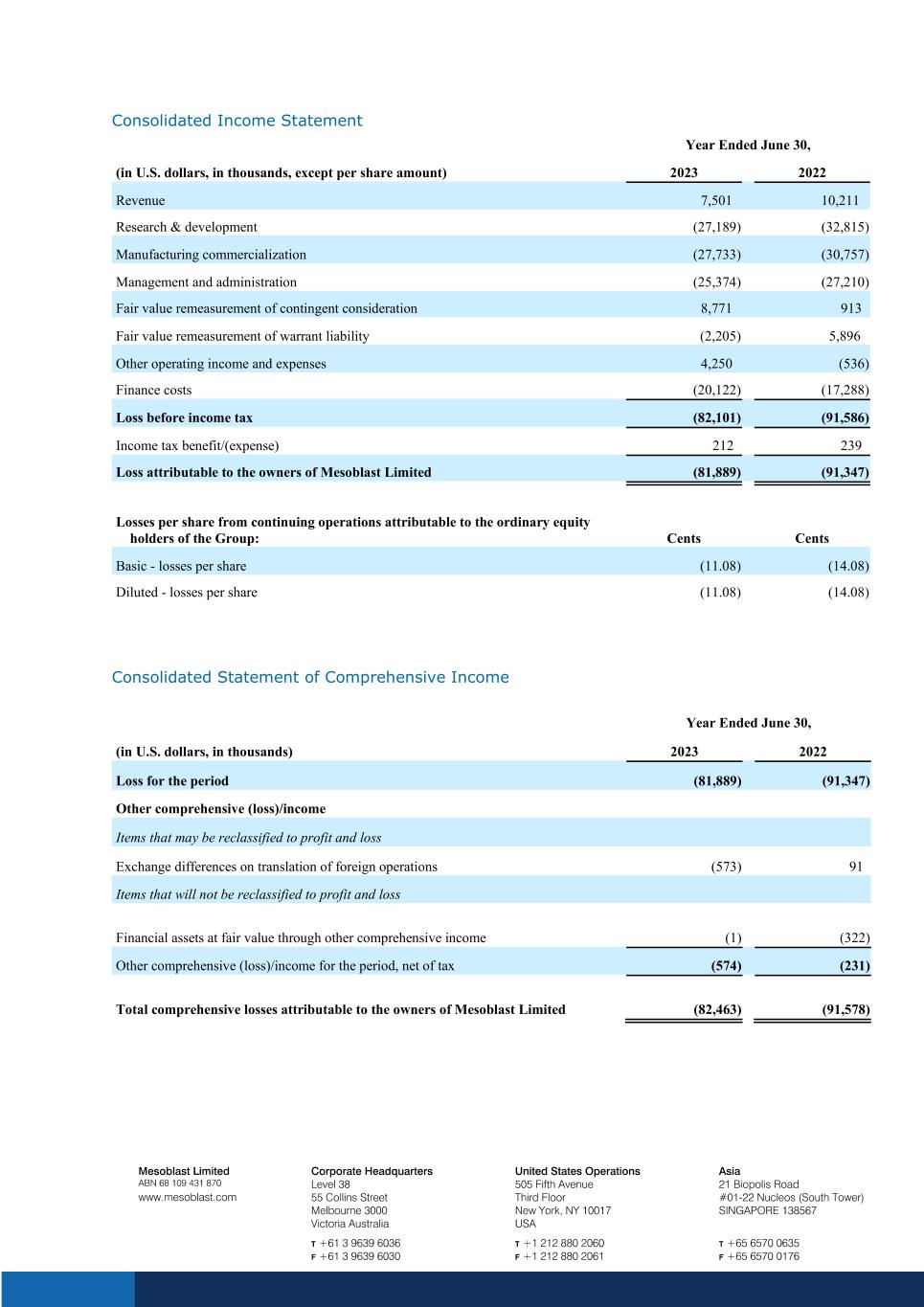
截至6月30日的合併損益表年度(以千美元計,每股金額除外)2023 年收入 7,501 10,211 研發(27,189)(32,815)製造業商業化(27,733)(30,757)管理和行政(25,374)(27,210)或有對價的公允價值調整 8,771 913 認股權證負債的公允價值調整(2,205)5,887 96 其他營業收入和支出 4,250 (536) 財務成本 (20,122) (17,288) 所得税前虧損 (82,101) (91,586) 所得税優惠/ (支出) 212 239 虧損歸屬於Mesoblast Limited(81,889)(91,347)集團普通股持有人的持續經營每股虧損:美分基本虧損(11.08)(14.08)攤薄後——每股虧損(11.08)(14.08)截至6月30日的合併綜合收益表,(以千美元計)2023年同期虧損(81,889)) (91,347) 其他可重新歸類為損益的綜合(虧損)/收益項目國外業務折算後的匯兑差額 (573) 91 項目不會重新歸類為損益通過其他綜合收益按公允價值計算的金融資產 (1) (322) 該期間扣除税款的其他綜合(虧損)/收益(574)(231)歸屬於Mesoblast Limited所有者的綜合虧損總額(82,463)(91,578)
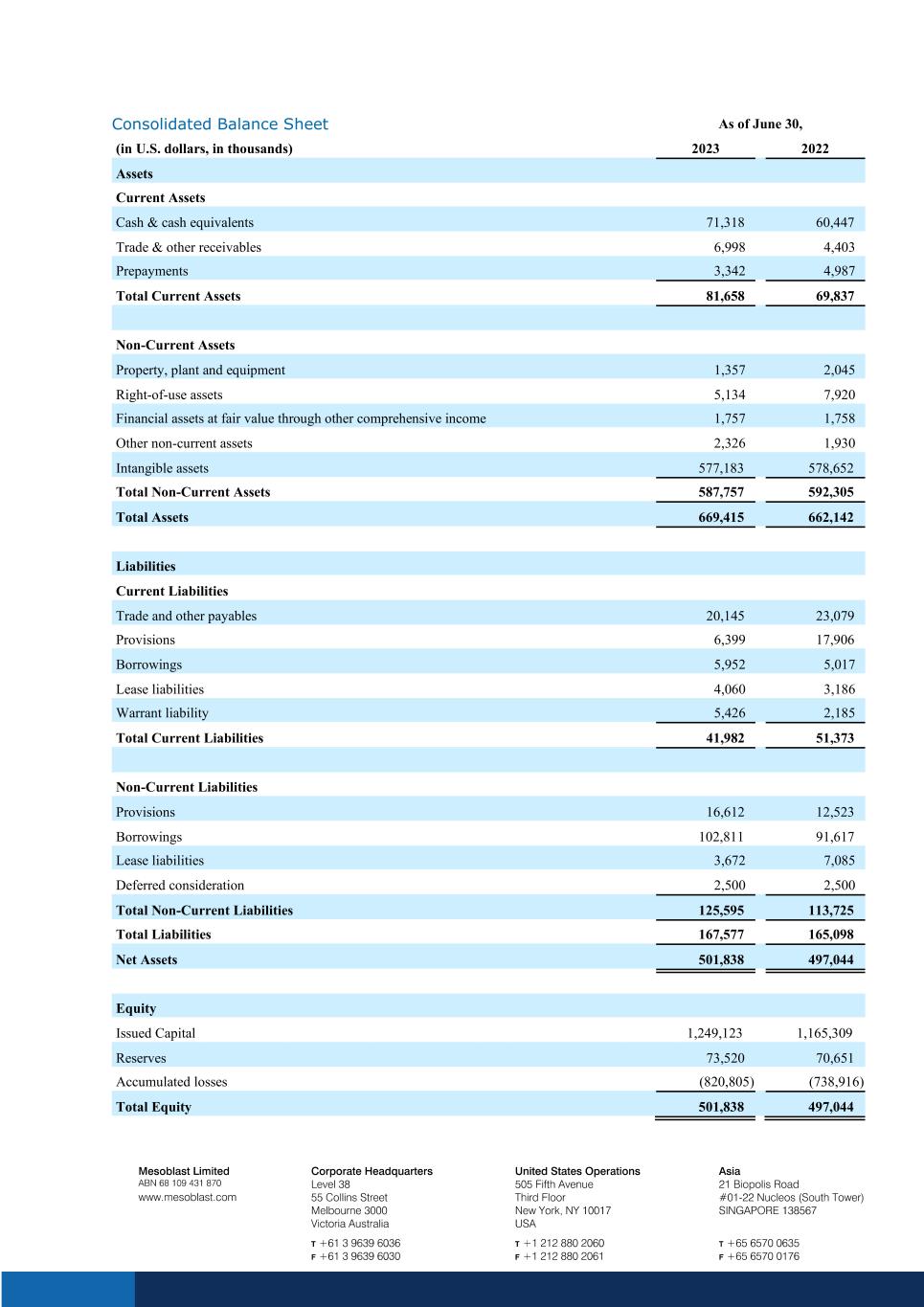
截至6月30日的合併資產負債表(以千美元計)2023年資產流動資產現金及現金等價物 71,318 60,447 貿易和其他應收賬款 6,998 4,403 預付款 3,342 4,987 流動資產總額 81,658 69,837 非流動資產不動產、廠房和設備 1,357 2,045 使用權資產 5,134 7,920 通過其他方式按公允價值計算的金融資產 5,134 7,920 按公允價值計算的金融資產綜合收益 1,757 1,758 其他非流動資產 2,326 1,930 無形資產 577,183 578,652 非流動資產總額 587,757 592,305 總資產 669,415 662,142 負債流動負債貿易和其他應付賬款 20,145 23,079 準備金 6,399 17,906 借款 5,952 5,017 租賃負債 4,060 3,186 認股權證負債 5,426 2,185 流動負債總額 41,982 51,373 非流動負債準備金 16,612 12,523 借款 102,811 91,617 租賃負債 3,672 7,085 遞延對價 2,500 非流動負債總額 125,595 113,725 總負債 167,577 165,098 淨資產 501,838 497,044 股票發行資本 1,249,123 1,165,309 儲備 73,520 70,651 累計虧損 (820,805) (738,916) 總權益501,838 497,044

截至6月30日的合併現金流量表(以千美元計)2023 年經營活動現金流商業化收入收到7,480 980筆政府補助金和税收優惠收到1,118 24 向供應商和員工付款(包括商品和服務税)(72,683) (75,769) 已收利息 796 7 已收所得税/ (已支付) 20 (24) 經營活動淨現金(流出)(63,269) (65,782) 來自投資活動的現金流固定資產投資 (264) (157) 轉租投資收入 120— 許可證付款 (50) (75) 投資活動中的淨現金(流出)(194)(232)融資活動現金流借款收益 — 51,919 借款還款 —(55,458)借款交易成本支付(574)(5,527)支付的利息和其他財務成本(6,014)(6,084)股票發行收益 88,635 收益來自發行認股權證 — 8,081 支付股票發行成本 (4,889) (222) 租賃負債付款 (2,656) (2,788) 按融資活動劃分的淨現金流入/ (流出) 74,502 (9,870) 淨增長/ (現金及現金等價物減少)11,039(75,884)期初現金及現金等價物 60,447 136,881 外國銀行賬户折算後的外匯(虧損)/收益(168)(550)期末現金及現金等價物 71,318 60,447