附錄 99.2

Eblasakimab Phase 2b Trek-AD Topline 讀數
2023 年 7 月 6 日
重述 2023 年 8 月 18 日
納斯達克:ASLN
Eblasakimab Phase 2b Trek-AD Topline 讀數
2023 年 7 月 6 日
重述 2023 年 8 月 18 日
納斯達克:ASLN
附錄 99.2

Eblasakimab Phase 2b Trek-AD Topline 讀數
2023 年 7 月 6 日
重述 2023 年 8 月 18 日
納斯達克:ASLN
Eblasakimab Phase 2b Trek-AD Topline 讀數
2023 年 7 月 6 日
重述 2023 年 8 月 18 日
納斯達克:ASLN

法律免責聲明
此
演示文稿包含前瞻性陳述。這些聲明基於ASLAN Pharmicals Limited(以下簡稱 “公司”)管理層當前的信念和期望。這些前瞻性陳述可能包括但不限於有關以下內容的陳述
公司的業務戰略、公司開發和商業化候選產品的計劃、公司候選產品的安全性
和有效性,包括其成為同類最佳產品的潛力、公司在臨牀試驗、臨牀試驗註冊和臨牀試驗結果方面的計劃和預期時機
候選產品的臨牀試驗、臨牀試驗註冊和臨牀試驗結果、公司的計劃和監管申請和批准方面的預期時機、公司市場的規模和增長潛力的候選產品,以及其潛力eblasakimab 可治療
特應性皮炎。公司的估計、預測和其他前瞻性陳述基於管理層對未來事件和趨勢的當前假設和預期,這些事件和趨勢會影響或可能影響公司的業務、戰略、運營或財務業績,本質上涉及已知和未知的重大風險和不確定性,包括在臨牀前或臨牀研究中觀察到的意外安全性或有效性數據;早期研究和試驗的
結果可能無法預測未來的試驗結果;臨牀網站激活低於預期的比率或臨牀試驗註冊率;COVID-19 疫情對公司業務
和全球經濟的影響;總體市場狀況;競爭格局的變化;以及公司獲得足夠融資為其戰略和臨牀開發計劃提供資金的能力。由於這些風險和不確定性,實際業績和事件發生時間
可能與此類前瞻性陳述中的預期存在重大差異,其中包括但不限於公司向美國證券交易委員會
提交的文件和報告(委員會文件編號001-38475)中描述的風險因素,包括公司於2023年3月24日向美國證券交易委員會(SEC)提交的20-F表格。本演示文稿討論了正在進行
臨牀研究但尚未獲得美國食品藥品監督管理局批准上市的候選產品。對於正在研究的候選產品
的用途,未就這些候選產品的安全性或有效性作出任何陳述。在比較不同產品和候選產品的試驗數據時,應謹慎行事。試驗設計與患者羣體和特徵之間存在差異。此類試驗的結果可能對我們現有或未來的結果沒有解釋價值。除歷史事實陳述以外的所有陳述均為前瞻性陳述。這些術語中的相信、觀點、可能、可能、
可以、目標、估計、繼續、預期、預期、打算、預期、計劃或否定詞以及傳達
未來事件或結果不確定性的類似表述旨在識別估計、預測和其他前瞻性陳述。估計、預測和其他前瞻性陳述僅代表截至其發表之日,而且,除非法律要求
,否則公司沒有義務更新或審查任何估計、預測或前瞻性陳述。2

在特應性
皮炎 (AD) 的 2b 期陽性研究中,Eblasakimab 每月給藥顯示出一流療法的潛力
第一個具有競爭療效和安全性的月度給藥方案
如果獲得批准,有可能成為治療過敏性疾病的領先療法
Eblasakimab
每 4 周給藥一次 600 毫克,在 TREK-AD 中達到主要終點,EASI-75 為 52.0%,EASI-90 為 27.6%,Viga-ad 0/1 為 31.2%,每兩週給藥一次 Eblasakimab 也達到了具有統計學意義的主要終點,並且
達到關鍵次要終點獨特的劑量加載方案起效迅速,EASI 有統計學上的顯著改善在第 4 周之前降低分數通常在所有劑量水平下耐受性良好,結膜炎發生率低和
注射部位反應支持這種潛力為了實現差異化的安全概況數據支持在2024年進入第三階段
中度至重度 AD 中度至重度 AD 中首款表現出競爭療效的生物製劑,從一開始就每月給藥一次,相當於每兩週給藥一次。通過提供 IL-4 和 IL-13 信號傳導的雙重阻斷,有可能在
其他主要疾病(例如慢性阻塞性肺病和哮喘)中表現出令人信服的特徵
3
EASI-75 和 EASI-90 數據
已於 2023 年 8 月 18 日重報

儘管已有且即將獲得批准的療法,但仍存在大量未得到滿足的需求
與之相關的屬性
功效
安全
劑量和便利性
治療合併症
理想的
dupilumab Tralokinumab Lebrikizumab1 Oral jaKi 屬性
療效概況與 dupilumab2 相當或
好於 dupilumab2 疾病發作迅速改善3?在不影響 1 型受體的情況下完全抑制 2 型受體 4 被證明可以阻斷人類瘙癢神經元對 IL-13 和 IL-45 的敏化無盒裝警告或監測 6 × 結膜炎發生率低
和 1 型驅動效應7 便捷給藥:從治療開始或口服開始每月注射8 靈活給藥的可能性9 在室温下穩定(無需冷藏)10?
對其他過敏性疾病有效11
1。Lebrikizumab 是一種候選藥物,未獲準用於
AD
2。基於單一療法 3 期研究的 EASI-75 和 IGA 終點
3。
對於已批准的藥物,標籤是否聲稱對疾病嚴重程度有任何形式的快速或快速影響(EASI-75 或 IGA)。候選藥物的批准標籤聲明尚不清楚。
4。基於已發佈的臨牀前和機制數據。
5。基於已公佈的臨牀前
數據。
6。對於已批准的藥物,根據標籤。對於候選藥物,基於第三階段藥物相關SAE的監測要求和報告
7。對於已批准的藥物,根據顯示單一療法結膜炎發病率低於 5% 的標籤。對於候選藥物,基於單一療法第三階段顯示結膜炎發病率低於 5%
8。對於已批准的藥物,基於批准的給藥方案。對於候選藥物,基於開始治療時(在
加載劑量之後)在第三階段計劃中測試的方案
9。對於批准的藥物,基於成人給藥時間表,可以根據反應、安全性或其他患者特徵進行調整。對於
候選藥物,基於單一療法第 3 階段測試的劑量調整 10。對於已批准的藥物,根據標籤上的建議儲存期為一個月或更長時間。候選藥物的儲存要求尚不清楚。
11。基於已提供積極數據的臨牀試驗。
僅用於
説明目的。不是正面交鋒的比較。在比較不同產品和候選產品的試驗數據時,應謹慎行事。試驗設計與患者羣體和
特徵之間存在差異。此類試驗的結果可能對我們現有或未來的結果沒有解釋價值。
4

Eblasakimab 是臨牀上唯一靶向 的單克隆抗體IL-13 受體 IL-4 IL-13 Eblasakimab IL-4R 13R 1 2 型受體過敏性炎症 IL-4 和 IL-13 是引發過敏和特應性皮炎症狀的核心 eblasakimabs 新方法通過靶向 IL-13 受體,阻斷 2 型受體,阻止通過 IL-4 和 IL-13 進行信號傳導,同時保護 1 型受體最近發表的翻譯數據 顯示了對受體的阻斷 IL-13 與阻斷 IL-4 相比,可以在不增加 Th1 細胞因子的情況下更有效地減少 Th2 細胞因子受體 5
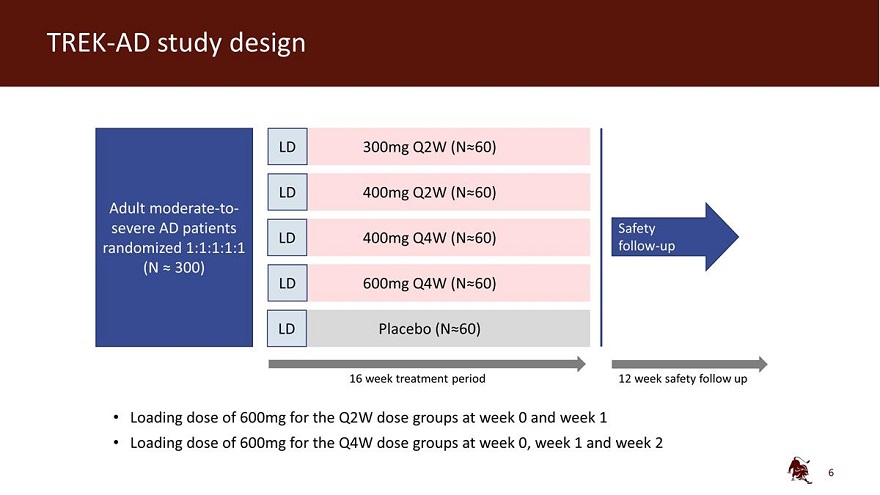
TREK-AD 研究設計 LD 300mg Q2W (N 60) LD 400mg Q2W (N 60) 成人 中度至重度AD 患者 Safety LD 400mg Q4W (N 60) 隨機 1:1:1:1 隨訪 (N 300) LD 600mg Q4W (N 60) LD 安慰劑 (N 60) 16 周治療期 12 周安全隨訪第 0 周和第 1 周 Q2W 劑量組加載 600 毫克劑量組第 0 周、第 1 周和第 2 周的劑量為 600 毫克

TREK-AD 研究設計主要終點:EASI 研究終點中與 基線相比的變化百分比次要終點:EASI-75、EASI-90、viga-AD 0/1、pros、BSA、SCORAD EASI 16 viga-AD 3 關鍵納入標準 BSA 10% 對 TCS/TCI 的反應不足或禁忌症試驗能夠證明主要終點在雙面 5% 顯著性水平上的統計學意義由 MMRM 分析的連續終點(主要 分析)和帶有 MCMC-MI 的 ANCOVA 用於處理缺失數據(靈敏度分析)。開始救援後的數據統計方法藥物治療或停藥後的數據均設置為缺失 通過CMH方法分析的二進制終點,缺少使用MCMC-MI估算的數據,但服用救援藥物或因缺乏療效而停藥的患者除外,他們被視為無反應者 BSA:體表面積,EASI:濕疹面積和嚴重程度指數,Viga-ad:研究人員驗證的全球評估特應性皮炎,TCS:外用皮質類固醇,TCI:局部鈣調神經素抑制劑, MMRM:混合模型重複測量,MCMC:馬爾可夫鏈蒙特卡洛,密歇根州:多重歸因,CMH:Cochran-Mantel-Haenszel 7
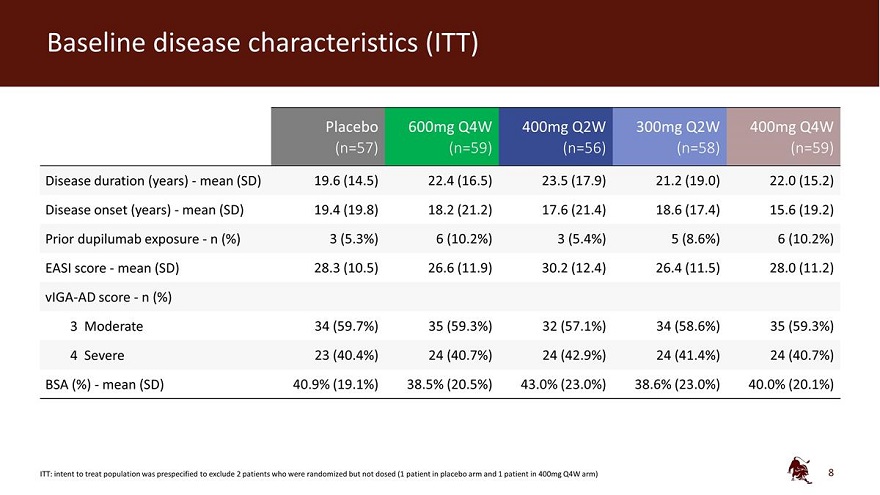
基線疾病特徵 (ITT) 安慰劑 600mg Q4W 400mg Q2W 300mg Q2W 400mg Q2W 400mg Q4W (n=57) (n=59) (n=58) (n=59) 疾病持續時間(年)——平均值(SD)19.6(14.5)22.4(16.5)23.5(17.9)21.2(19.0)22.0(15.2)) 疾病發作(年份)——平均值(SD)19.4(19.8)18.2(21.2)17.6(21.4)18.6(17.4)15.6(19.2)先前接觸杜皮盧單抗——n(%)3(10.2%)3(10.2%)3(5.4%)5(8.6%)6(10.2%)EASI 分數——平均值(SD)28.3(26.5)(11.9) 30.2 (12.4) 26.4 (11.5) 28.0 (11.2) Viga-AD 分數——n (%) 3 中度 34 (59.7%) 35 (59.3%) 32 (57.1%) 34 (58.6%) 35 (59.3%) 4嚴重 23 (40.4%) 24 (40.7%) 24 (42.9%) 24 (41.4%) 24 (41.4%) 24 (40.7%) BSA (%)-平均值 (SD) 40.9% (19.1%) 38.0% (23.0%) 38.6% (23.0%) 40.0% (20.1%) ITT:預先指定意向排除 2 名隨機患者已服用但未給藥(安慰劑組有 1 名患者,400 毫克 Q4W 組中有 1 名患者)8
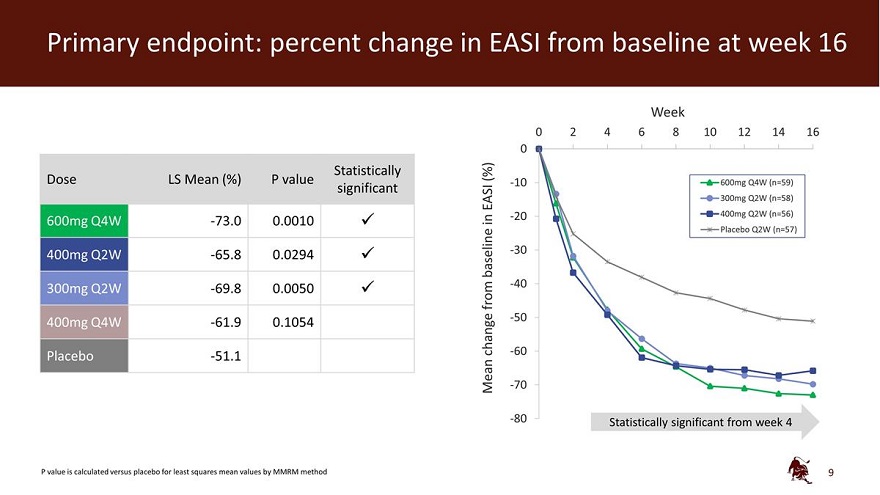
主要終點:第 16 周 EASI 與基線相比的變化百分比 0 周 2 4 6 8 10 12 14 16 0 統計學上 (%) 劑量 LS 平均值 (%) P 值 -10 600mg Q4W (n=59) 在-20 中顯著 EASI 300mg Q2W (n=58) 400mg Q2W (n=56) 600mg Q4W -73.0 0.0010 安慰劑 Q2W (n=57) 400mg Q2W -65.8 0.0294 基線 -30 -40 300mg Q2W -69.8 0.0050 來自 -50 400mg Q4W W -61.9 0.1054-change -60 安慰劑 -51.1-Mean -70 -80 Mean -70 -80 使用 MMRM 方法 9 計算出與安慰劑相比的最小二乘均值 P 值具有統計學意義
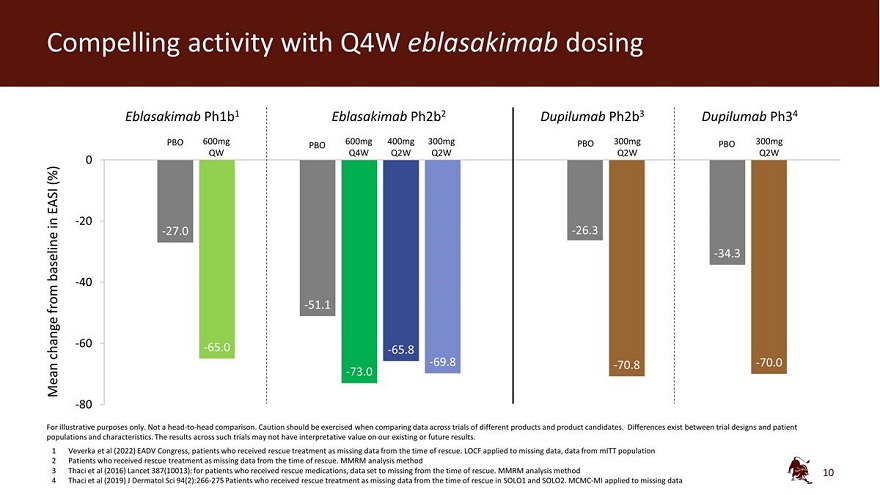
Q4W eblasakimab 給藥 Eblasakimab ph1b1 Eblasakimab ph1b1 Eblasakimab ph2b2 dupilumab ph2b3 dupilumab ph34 PBO 600mg 400mg 300mg PBO 300mg PBO 300mg QBO 300mg QBO 300mg QBO 300mg QBO 300mg QBO Q4W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W Q2W -20 -27.0 -26.3 基線 -34.3 -40 從 -51.1 -60 -65.0 變動 -65.8 -69.8 -70.8 -70.8 -70.0 Mean -73.0 -73.0 -80 僅用於説明目的。不是 正面交鋒比較。在比較 不同產品和候選產品的試驗數據時,應謹慎行事。試驗設計與患者羣體和特徵之間存在差異。此類試驗的結果可能對我們現有或未來的結果沒有解釋價值。1 Veverka等人 (2022)EADV國會,因搶救時缺少數據而接受救援治療的患者。LOCF 應用於缺失的數據,即來自 MitT 人羣的數據 2 接受救援治療的患者,因為搶救時的數據缺失。MMRM 分析方法 3 Thaci 等人(2016)《柳葉刀》387(10013):對於接受救援藥物的患者,從救援時起數據集就會丟失。MMRM 分析方法 4 Thaci 等人(2019)J Dermatol Sci 94 (2): 266-275 因缺少 SOLO1 和 SOLO2 救援時的數據而接受救援治療的患者。MCMC-MI 應用於缺失的數據 10
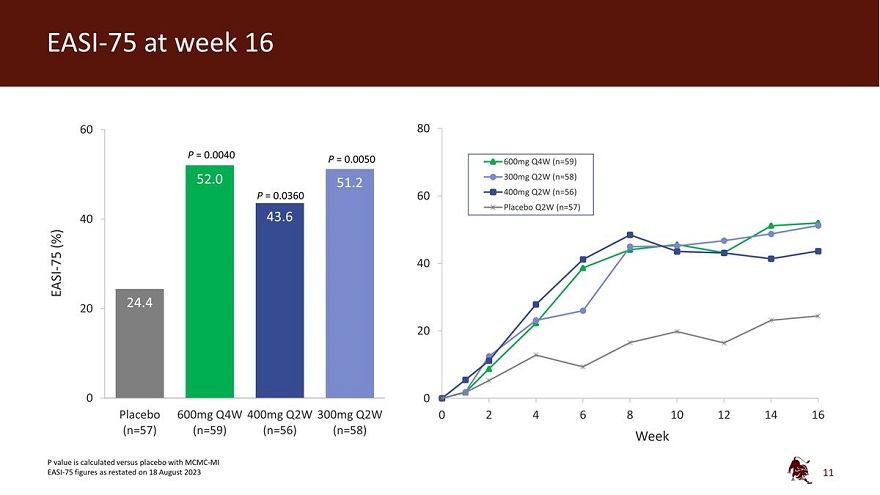
60 80 P = 0.0040 P = 0.0050 600mg Q4W (n=59) 300mg Q2W (n=58) P = 0.0360 60 400mg Q2W (n=56) 安慰劑 Q2W (n=57) 40 (%) -75 40 EASI 20 0 0 安慰劑 600mg Q4W 400mg Q2W 0 2 4 6 8 10 12 14 16 (n=57) (n=59) (n=56) (n=58) Week P 值是與安慰劑相比計算的 2023 年 8 月 18 日重報的 MCMC-MI EASI-75 數字 11
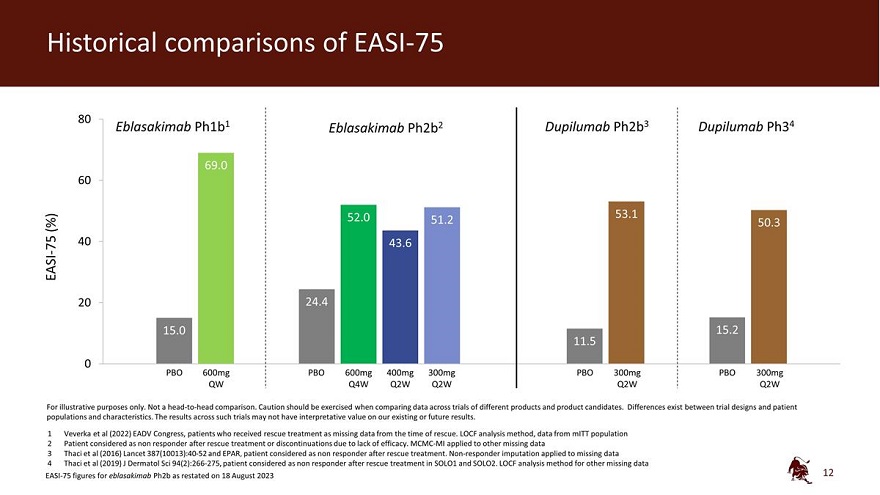
EASI-75 80 Eblasakimab ph1b1 Eblasakimab ph2b2 dupilumab ph2b3 dupilumab ph34 69.0 60 52.0 53.1 (%) 51.2 50.3 40 75 43.6 EASI-20 24.4 15.0 15.2 11.5 0 PBO 600mg PBO 600mg 300mg PBO 300mg Q4W Q4W 2W Q2W Q2W Q2W Q2W 僅用於説明目的。不是 正面交鋒比較。在比較不同產品和候選產品的試驗數據時,應謹慎行事。試驗 設計與患者羣體和特徵之間存在差異。此類試驗的結果可能對我們現有或未來的結果沒有解釋價值。1 Veverka等人(2022年)EADV國會,因搶救時缺少 數據而接受救援治療的患者。LOCF 分析方法,來自 MitT 人羣的數據 2 患者在搶救治療或因缺乏療效而停藥後被視為無反應者。MCMC-MI 適用於其他 缺失的數據 3 Thaci 等人(2016)《柳葉刀》387(10013): 40-52 和 EPAR,患者在搶救治療後被視為無反應者。無反應者歸咎於 缺失數據 4 Thaci 等人(2019)J Dermatol Sci 94 (2): 266-275,患者在 SOLO1 和 SOLO2 中接受救援治療後被視為無反應者。其他缺失數據的 LOCF 分析方法 2023 年 8 月 18 日重述的 eblasakimab ph2b 的 EASI-75 數據 12
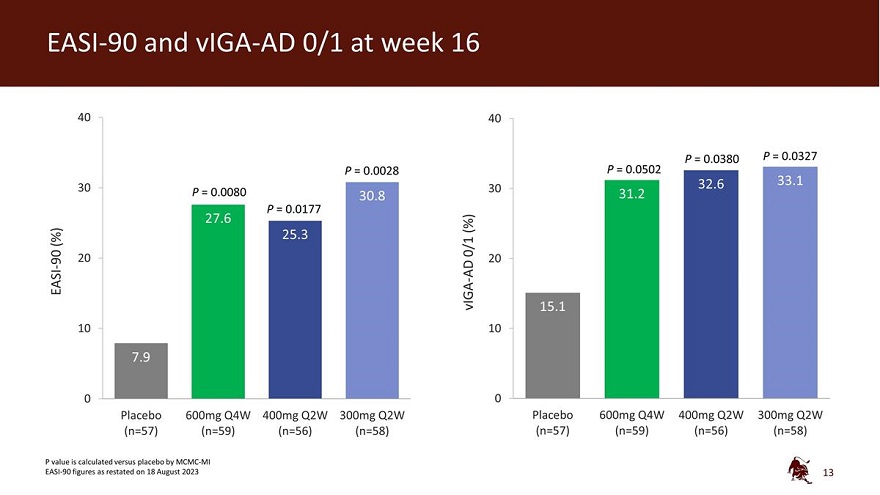
EASI-90 和 viga-ad 0/1 第 16 周 40 40 P = 0.0380 P = 0.0327 P = 0.0028 P = 0.0502 32.6 33.1 30 P = 0.0080 30 30.8 31.2 P = 0.0177 27.6 (%) (%) 25.3 0/1 90 20 20-AD EASI viga-15.1 10 7.9 0 0 安慰劑 600mg Q4W 400mg Q2MG W 300mg Q2W 安慰劑 600mg Q4W 400mg Q2W 300mg Q2W (n=57) (n=59) (n=59) (n=56) (n=58) (n=57) (n=59) (n=59) (n=56) (n=58) P值是根據2023年8月18日公佈的 MCMC-MI EASI-90 數據與安慰劑對比計算的

EASI-90 Eblasakimab ph1b1 Eblasakimab ph2b2 dupilumab ph2b3 dupilumab ph2b3 dupilumab ph34 40 38.0 30 32.8 30.8 29.7 (%) 27.6 90 25.3 Elbasakimab ph2b2 dupilumab ph2b3 dupilumab ph2b3 dupilumab ph2b3 dupilumab ph34 40 38.0 30.8 30.8 29.7 (%) 27.6 90 25.3 Esi-20 15.0 10 7.9 7.9 7.4 3.3 Q2W Q2W Q2W Q2W 僅用於説明目的。不是 正面交鋒比較。在比較不同產品和候選產品的試驗數據時,應謹慎行事。試驗 設計與患者羣體和特徵之間存在差異。此類試驗的結果可能對我們現有或未來的結果沒有解釋價值。1 Veverka等人(2022年)EADV國會,因搶救時缺少 數據而接受救援治療的患者。LOCF 分析方法,來自 MitT 人羣的數據 2 患者在搶救治療或因缺乏療效而停藥後被視為無反應者。MCMC-MI 適用於其他 缺失的數據 3 Thaci 等人(2016)《柳葉刀》387(10013): 40-52 和 EPAR,患者在搶救治療後被視為無反應者。將無反應者歸因應用於 缺失的數據。4 Thaci 等人(2019)J Dermatol Sci 94(2): 266-275,無反應者歸咎於:在 2023 年 8 月 18 日重報的 eblasakimab ph2b 的 SOLO1 和 SOLO2 EASI-90 數據中,經搶救治療或退出研究的患者被視為非反應者 14
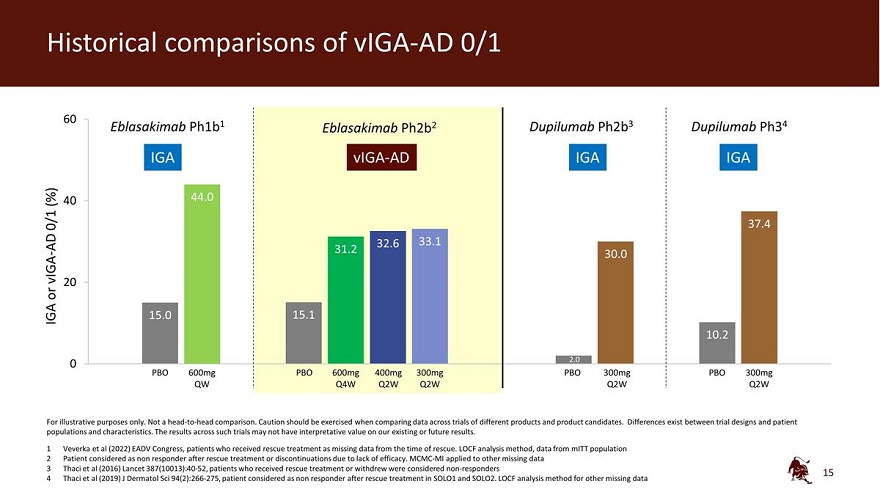
viga-ad 0/1 60 Eblasakimab ph1b1 Eblasakimab ph2b2 dupilumab ph2b3 dupilumab ph34 IGA viga-ad IGA IGA (%) 40 44.0 0/1 37.4 AD 32.6 33.1 31.2 viga-30.0 20 或 IGA 15.0 10.2 0 600mg PBO 600mg 400mg 300mg PBO 300mg PBO 300mg QBO 300mg Q4W Q2W Q2W Q2W Q2W Q2W Q2W 僅用於説明目的。不是 正面交鋒比較。在比較不同產品和候選產品的試驗數據時,應謹慎行事。試驗設計與患者羣體和 特徵之間存在差異。此類試驗的結果可能對我們現有或未來的結果沒有解釋價值。1 Veverka等人(2022年)EADV國會,因搶救時缺少數據而接受救援治療的患者。LOCF 分析方法,來自 MitT 人羣的數據 2 患者在搶救治療後或因缺乏療效而停藥後被視為無反應者。MCMC-MI 適用於其他缺失的數據 3 Thaci 等人 (2016)《柳葉刀》387 (10013): 40-52,接受救援治療或退出的患者被視為無反應者 4 Thaci 等人 (2019) J Dermatol Sci 94 (2): 266-275,患者在 SOLO1 和 SOLO2 中進行搶救治療後被視為無反應者。其他缺失數據的LOCF分析方法 15
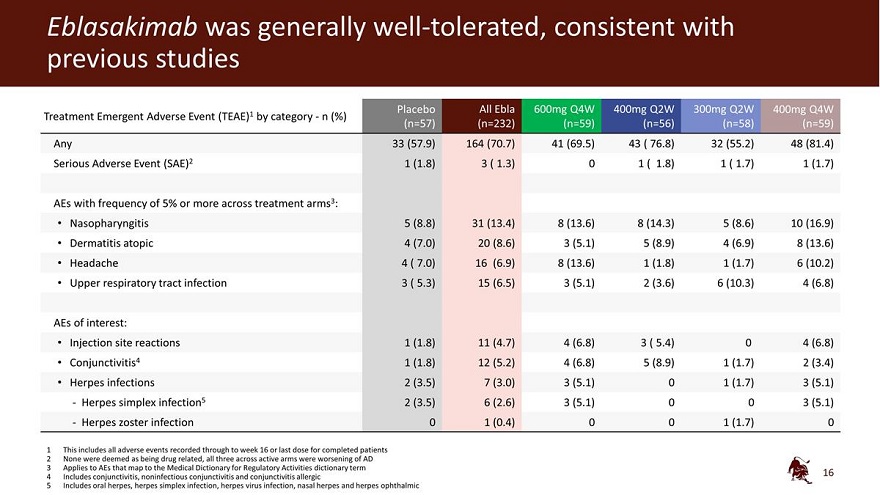
Eblasakimab 總體耐受性良好,與先前的研究一致 Analebo All Ebla 600mg Q4W 400mg Q2W 300mg Q2W 400mg Q4W 治療緊急不良事件 (TEAE) 1 按類別劃分——n (%) (n=57) (n=57) (n=232) (n=59) (n=59) 任何 33 (57.5) 9) 164 (70.7) 41 (69.5) 43 (76.8) 32 (55.2) 48 (81.4) 嚴重不良事件 (81.4) 嚴重不良事件 (SAE) 2 1 (1.8) 3 (1.3) 0 1 (1.8) 1 (1.7) 各治療組頻率為 5% 或更高的 AE 3:鼻咽炎 5 (8.8) 31 (13.4) 8 (14.3) 5 (8.6) 10 (16.9) 特應性皮炎 4 (7.0) 20 (8.6) 3 (5.1) 5 (8.9) 4 (6.9) 8 (13).6) 頭痛 4 (7.0) 16 (6.9) 8 (13.6) 1 (1.8) 1 (1.8) 1 (1.7) 6 (10.2) 上呼吸道感染 3 (5.3) 15 (6.5) 3 (5.1) 2 (3.6) 6 (10.3) 4 (6.8) 感興趣的 AE:注射部位反應 1 (1.8) 11 (4.7) 4 (6.8) 4 (6.8) 4 (6.8) 結膜 tis4 1 (1.8) 12 (5.2) 4 (6.8) 5 (8.9) 1 (1.7) 2 (3.4) 皰疹感染 2 (3.5) 7 (3.0) 3 (5.1) 0 1 (1.7) 3 (5.1)-單純皰疹感染 5 2 (3.5) 6 (2.6) 3 (5.1) 0 3 (5.1) 0 3 (5.1)-帶狀皰疹感染 0 1 (0.4) 0 1 (1.7) 0 (1.7) 0 0 (1.7) 0 0 0 (1.7) 0 0 0 (1.7) 0 0 0 0 (1.7) 0 0 0 0 (1.7) 0 0 0 0 (1.7) 0 0 0 0 (1.7) 0 0 0 0 (1.7) 0 0 0 0 (1.7) 0 這包括在 16 周之前記錄的所有不良事件或已完成的最後一劑劑量患者 2 沒有人被視為與藥物有關,所有三名活躍組均在 AD 惡化 3 適用於映射到《監管活動醫學詞典》詞典術語的 AE 4 包括 結膜炎、非感染性結膜炎和結膜炎過敏性 5 包括口腔皰疹、單純皰疹感染、皰疹病毒感染、鼻皰疹和眼部皰疹 16
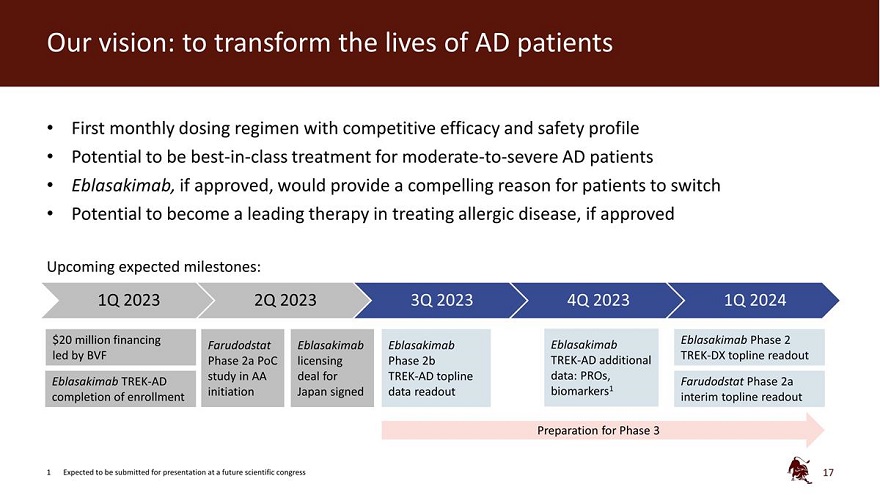
我們的願景:改變 AD 患者的生活第一個具有競爭療效和 安全特徵的每月給藥方案有潛力 一流的治療 中度至重度AD患者 Eblasakimab 如果獲得批准,將為患者提供一個令人信服的理由,如果獲得批准,有可能成為治療過敏性疾病的領先療法即將到來的預期里程碑:2023年第一季度2023年第二季度2023年第四季度2024年第一季度2000萬美元 融資 Eblasakimab 2期 Farudodstat Eblasakimab Eblasakimab Eblasakimab 由 BVF TREASAKIMAB 牽頭 K-DX topline readout 第 2a 階段 PoC 許可 2b 階段 TREK-AD 附加研究 在 TREK-AD Topline 數據協議中:Pros、Eblasakimab TREK-AD Farudodstat 第 2a 階段完成入學啟動日本簽署data readout biomarkers1 臨時 topline 讀出第 3 階段的準備工作 1 預計將在未來的科學大會上提交演講 17

問答 18
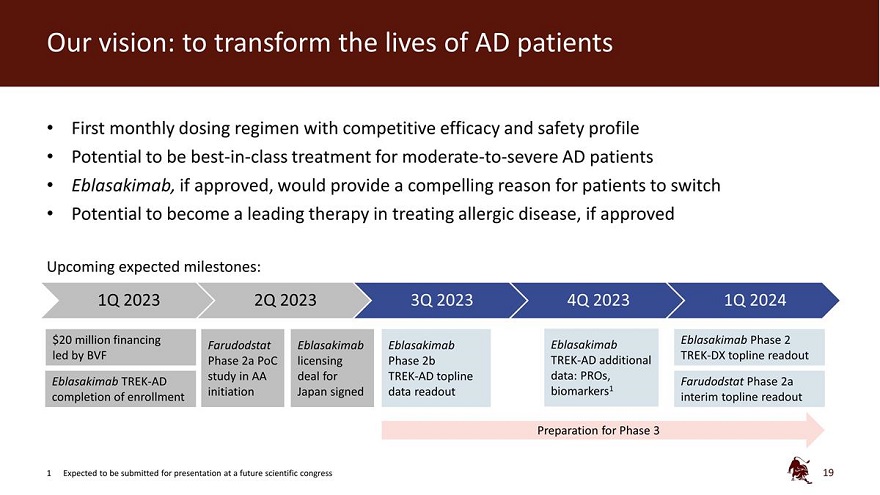
我們的願景:改變 AD 患者的生活第一個具有競爭療效和 安全特徵的每月給藥方案有潛力 一流的治療 中度至重度AD患者 Eblasakimab 如果獲得批准,將為患者提供一個令人信服的理由,如果獲得批准,有可能成為治療過敏性疾病的領先療法即將到來的預期里程碑:2023年第一季度2023年第二季度2023年第四季度2024年第一季度2000萬美元 融資 Eblasakimab 2期 Farudodstat Eblasakimab Eblasakimab Eblasakimab 由 BVF TREASAKIMAB 牽頭 K-DX topline readout 第 2a 階段 PoC 許可 2b 階段 TREK-AD 附加研究 在 TREK-AD Topline 數據協議中:Pros、Eblasakimab TREK-AD Farudodstat 第 2a 階段完成入學啟動日本簽署data readout biomarkers1 臨時 topline 讀出第 3 階段的準備工作 1 預計將在未來的科學大會上提交演講 19

Eblasakimab 2b 期 TREK-AD Topline 讀數 2023 年 7 月 6 日重述 2023 年 8 月 18 日納斯達克:ASLN ASLAN PHARMICALS