附錄 99.1

新聞稿
(重報於 2023 年 8 月 18 日)
EBLASAKIMAB 的每月給藥量顯示出潛力 同類最佳治療特應性皮炎 2B 期陽性研究
| | Eblasakimab是第一個生物製劑 中度至重度特應性皮炎表現出競爭療效,從一開始就每月給藥一次,相當於每兩週給藥一次,支持進入第三階段。 |
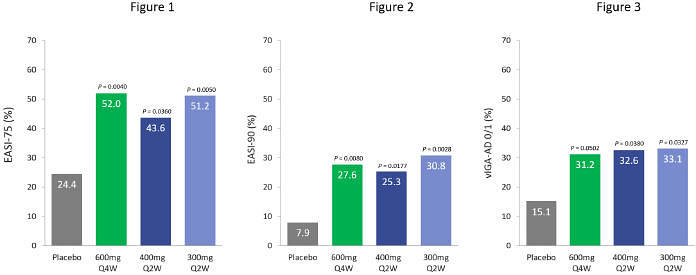
| | 600 毫克 eblasakimab 劑量 在 TREK-AD 研究中,每四周一次達到具有統計學意義的主要終點,其中 52.0% 的患者達到 EASI-75,27.6% 的患者達到 EASI-90,31.2% 的患者達到 Viga-AD 為 0 或 1。 |
| | 每兩週給藥一次的方案也滿足了具有統計學意義的主要終點,並且 滿足關鍵的次要終點。 |
| | 觀察到獨特的負荷劑量方案可以快速起作用,到第 4 周,EASI 評分有統計學上的顯著提高 。 |
| | Eblasakimab 總的來説 在所有劑量水平下都具有良好的耐受性,結膜炎和注射部位反應的發生率低 ,這為差異化安全特徵提供了可能性。 |
| | 管理層將於今天,即美國東部時間7月6日上午 8:30 /新加坡標準時間晚上 8:30 主持網絡直播。 |
加利福尼亞州聖馬特奧和新加坡,2023年7月6日,ASLAN Pharmicals(納斯達克股票代碼:ASLN)是一家處於臨牀階段、以免疫學為重點的生物製藥公司,正在開發改變患者生活的創新療法。該公司今天宣佈了其2b期劑量範圍研究的積極頂線數據 eblasakimab在患有 的成年患者中中度至重度特應性皮炎(AD),TREK-AD(使用eblasakimab治療特應性皮炎的試驗)研究。 Eblasakimab 在三個給藥組中,濕疹區域和嚴重程度指數(EASI)評分在第16周達到與基線相比變化百分比的主要終點,安慰劑具有統計學意義:每4周給藥600mg(600mg Q4W),從數字上講,這是 表現最好的組,每2周給藥400mg(400mg Q2W),每2周給藥300mg(300mg Q2W),每2周給藥300mg(300mg Q2W)W)。
Eblasakimab是一種靶向 2 型受體的 IL-13 受體亞基的新型單克隆抗體,這是 驅動幾種過敏性炎症性疾病的關鍵途徑。Eblasakimab已觀察到一種獨特的作用機制,可以對2型受體進行特異性阻斷,防止通過白細胞介素4(IL-4)和白細胞介素13(IL-13)傳導信號,這兩者是AD炎症的關鍵驅動因素,同時避免了1型受體。
這是我們第一次看到 每月一次俄勒岡健康與科學大學弗朗西斯·斯托爾斯醫學皮膚病學教授、TREK-AD研究首席研究員埃裏克·辛普森醫學博士説,治療方案 提供了具有競爭力的療效數據,這將改變AD患者的遊戲規則。自推出以來,我們在進步方面還沒有看到太多進展 dupilumab,而且患者所承受的疾病負擔仍然很大,尚未得到滿足。這些結果支持 eblasakimab如果獲得批准,有可能成為治療AD的領先療法。
我們很高興地宣佈來自 TREK-AD 研究的這些積極的 topline 數據,這些數據支持了我們最近發表的轉化研究 eblasakimabs獨特的作用機制可以為阻斷導致過敏性炎症的2型信號傳導提供更有效、更有針對性的方法 。基於這些結果,我們認為 eblasakimabASLAN Pharmicals首席執行官Carl Firth博士説,如果獲得批准,可以讓更多的患者服用 EASI-75 或 EASI-90,不良副作用更少,起效迅速,而且每月給藥一次的便利性獨一無二。我們期待迅速進入AD 3期項目,並探索我們期望這種候選藥物取得成功的廣泛適應症。我們感謝 為發展做出如此重要貢獻的患者、研究人員和我們的團隊 eblasakimab.