目錄表
神經科學課程
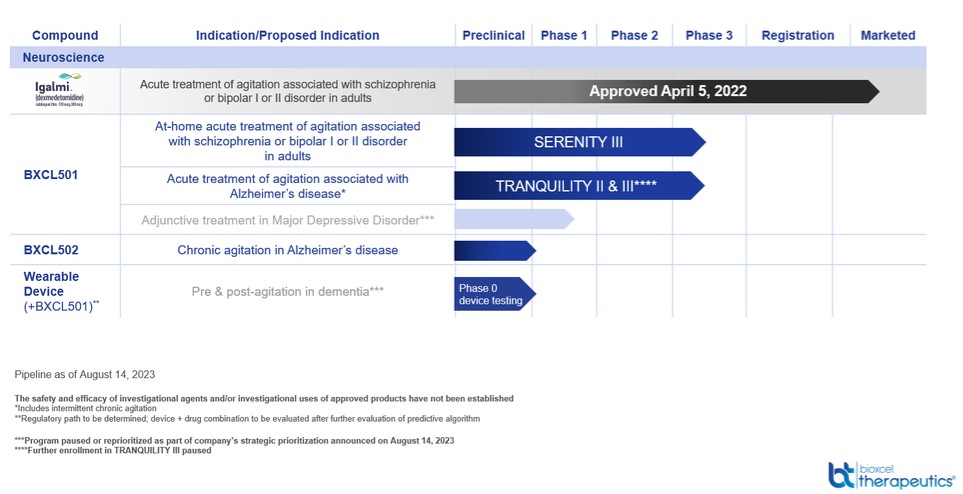
BXCL501開發
在FDA批准為IGALMI的其他適應症中,BXCL501仍然是選擇性α-2受體激動劑Dex的一種研究、專利、口腔溶解膜劑,針對應激相關行為的症狀,如激動。BXCL501是我們最先進的神經科學臨牀程序,正在接受評估,用於雙相情感障礙或精神分裂症相關激越的家庭急性治療,以及ALF或家庭環境中與輕至中度阿爾茨海默病相關的激越的急性治療。如上所述,該公司最近在機構環境中實施了IGALMI™的商業戰略轉變,減少了醫院內的商業化費用,暫停了不再被視為公司業務核心的計劃,並將重點轉向開發用於家庭和輔助生活設施環境的BXCL501,用於治療精神分裂症、雙相情感障礙和日常生活障礙的躁動。
作為一種具有舌下或口腔給藥途徑的選擇性腎上腺素能藥物,BXCL501設計為易於給藥,與可能需要幾天或幾周的藥物相比,在包括研究精神分裂症、雙相情感障礙和阿爾茨海默病患者的多個臨牀試驗中顯示出相對較快的起效。我們認為,這些研究的結果表明,BXCL501具有在不產生過度鎮靜的情況下減少焦慮的潛力。我們還認為,BXCL501與抗精神病藥物有很大的區別,後者目前被用作一線護理標準治療,儘管經常產生有害的副作用,如過度鎮靜或額外的錐體運動效應。在神經精神疾病和神經退行性疾病中管理患者的焦慮對醫生和照顧者來説是一個巨大的挑戰。我們相信BXCL501有潛力解決這些挑戰,同時為患者提供有效的治療方案。
BXCL501臨牀試驗
寧靜計劃:與雙相情感障礙或精神分裂症相關的激動症(在家使用)
在我們的寧靜III研究中,我們目前正在評估BXCL501在與雙相情感障礙或精神分裂症相關的躁動患者中的潛在家庭使用情況,該研究由兩部分組成。第一部分與我們的關鍵的寧靜I和II研究相當。在控制良好的住院環境下,使用類似的納入和排除標準,急性激越的精神分裂症或雙相情感障礙患者被隨機分為
34