
2023 年 8 月公司簡報 1

前瞻性陳述 2 本演示文稿包含1995年《私人證券訴訟改革法》所指的前瞻性陳述。任何描述Acumen的目標、預期、財務或其他預測、意圖或信念的陳述均為前瞻性陳述,應被視為風險陳述。諸如 “相信”、“期望”、“預期”、“可以”、“將”、“尋求”、“目標”、“計劃”、“潛力”、“意志” 等詞語旨在識別前瞻性陳述,儘管並非所有前瞻性陳述都包含這些識別詞。前瞻性陳述包括關於 Acumen 業務、Acumen 實現其戰略和財務目標的能力(包括其現金、現金等價物和有價證券的預計使用情況及其現金資源的充足性)以及 Acumen 候選產品 ACU193 的治療潛力的陳述,包括與正在開發的其他單克隆抗體相比,其安全性和有效性得到提高的可能性,以及對 INCTERPT-AD 試驗和 Acumen 計劃中的第 2 階段試驗的預期 3 項臨牀試驗,包括預計啟動試驗的時間。這些陳述基於Acumen管理層當前的信念和期望,受某些因素、風險和不確定性的影響,尤其是發現、開發和商業化安全有效的人類療法過程中固有的因素、風險和不確定性。COVID-19 疫情的影響可能會加劇此類風險。Acumen向美國證券交易委員會(“SEC”)提交的文件中更詳細地描述了與Acumen計劃有關的這些風險和其他風險,包括Acumen最新的10-K年度報告表以及Acumen未來的文件和報告。這些文件和其他文檔的副本可從 Acumen 獲得。Acumen不時向美國證券交易委員會提交的其他文件中將提供更多信息。這些前瞻性陳述僅代表截至本文發佈之日,Acumen明確聲明不承擔任何更新或修改任何前瞻性陳述的義務,除非法律另有要求,無論是由於新信息、未來事件還是其他原因。在本列報中,提及的現金還包括現金等價物。

3 推進針對早期阿爾茨海默氏病 (AD) 的潛在同類最佳抗體產品 • 市場龐大 • 需求未得到滿足 • 最近的科學和監管勢頭 • β澱粉樣蛋白低聚物 (aβOS) 被視為毒性最強的 Aβ • 潛在有效的 AD 治療的新靶標 ACU193:第一種選擇性靶向 AβOS 的臨牀階段單克隆抗體 (mAb) • 經驗豐富的領導團隊 • AD 臨牀、藥物開發和監管禮來公司的領導者 • 7 月份公佈的針對早期 AD 患者 1 期臨牀試驗的積極結果2023 • 強勁的資產負債表:截至 6 月 23 日,現金約為 1.72 億美元 • 2023 年 7 月 FPO 淨收益約為 1.22 億美元我們相信 Acumen 擁有將 ACU193 推進 2026 年下半年的組織專業知識和財政資源

Acumen Business Strategy:2023-2026 4 → 通過對早期 AD 患者的臨牀開發快速推進 ACU193;→ 評估組合方法以補充我們的核心 ACU193 單一療法戰略;→ 通過許可和/或開發更多候選藥物和/或替代配方或衍生物 ACU193 來擴大我們的產品組合;→ 優化 ACU193 和未來候選藥物在主要市場的價值。

AD、澱粉樣蛋白和 Abeta 低聚物

6 阿爾茨海默病病理學中的β澱粉樣蛋白低聚物 (AβOS)

毒性 aβO 代表理想的阿爾茨海默病藥物靶標 7 AβOS 在 AD 1Cleary 等人,2005 年;Townsend 等人,2006 年;Poling 等人,2008 年;Reed 等人,2011 年;Batista 等人,2018 年。2Shankar 等人,2007 年。3Ferreira,S. T. 和 Klein,W. L.,2011 年。4Lambert 等人,2011 年。4Lambert 等人,2011 年。al.,1998;Walsh 等人,2002 年;Wang 等人,2002 年;Klyubin 等人,2005 年;Townsend 等人,2006 年;Shankar 等人,2007 年、2008 年。5De Felice 等人,2008 年;Zempel 等人,2010 年;Ochalek 等人,2017 年。突觸功能受損1 大鼠器官型切片中的金字塔神經元在暴露於 picomolar 水平的可溶性低聚物後,樹突刺的密度和電生理活性突觸的數量明顯下降2 1 導致記憶和認知受損3 已發現可溶性 AβO(但不是單體)會阻斷海馬長期增強(LTP),a 記憶與學習的突觸相關性4 2 誘導 tau 過度磷酸化5 2008 年證明 aβOS 能夠誘導 tau 過度磷酸化沒有纖維的神經元5 3

• 為靶向毒性 Aβ 低聚物而開發的人源化、親和力成熟的單克隆抗體 • AβOS 的選擇性比 Aβ 單體高 >500 倍 • ABO 的選擇性大於 Ab 原纖維 85 倍 • 效應器功能降低的 IgG2 亞類 mAB • 與 Aβ 斑塊定向的 maB 相比,AβOS 的選擇性更高,ARIA-E 可能更具選擇性 • ACU193 是 Acumen 研究合作的一部分還有 Merck & Co. • 目前由禮來公司全球阿爾茨海默氏症開發團隊的幾位前高級成員開發 • ACU193 已獲得 Fast Track美國食品藥品管理局指定用於治療早期阿爾茨海默氏病 ACU193:一種選擇性結合毒性 AβOS 的單克隆抗體 ACU193 對毒性 AβOS 的高選擇性,可以提供有意義的認知功效,提高安全性和耐受性 8

9 ABO 可能由 2 到 >200 個 Ab 肽組成 Ab 肽什麼是 Aβ 低聚物?____________________ 資料來源:Kelley 等人《化學物理學雜誌》2008。圖 1。由 3 (a) 和 18 (b) Ab 肽組成的 ABO 如下所示。____________________ 來源:Relini 等人Biomolecules 2014。圖 2。澱粉樣蛋白聚集代表性步驟的原子力顯微鏡圖像:(A)低聚物;(B)原原纖維;(C)成熟原纖維。掃描尺寸 1.0 微米。Z 範圍 (A) 8.0 nm;(B) 15 nm;(C) 20 nm。Aβ 低聚物、原纖維和原纖維的四元結構 (a) (b)

10 * 結合澱粉樣蛋白斑塊的 IgG1 單克隆抗體與 ARIA-E 的高發率有關。例如,參見 Plotkin,《疾病神經生物學》,2020 年。• 上面列出的任何候選產品之間都沒有進行過正面交鋒的臨牀試驗。每種候選產品的研究設計和方案都不同,候選產品的結果可能無法比較。1 AAP:加速批准 solanezumab igG1、ph3 stop、A4、DIAN 陰性 lecanemab igG1 Ph3 陽性 3Q22 已獲批准 (AAP1) 2023 年 7 月 aducanumab* iGG1 批准 (AAP1),CMS CED 商業停止 ACU193 iGG2 Ph1 陽性 3Q23 bapineuzumab* Igg1,ph3 stop gantenerumab* igG1 Ph3 陰性 4Q22 crenezumab igG4,ph3 停止,API 陰性 Aβ 低聚物 donanemab* Igg1 Ph2 陽性 CRL 1Q23 (AAP1) Ph3 陽性 2Q23 Aβprotofibrils ACU193 相對於後期階段和經批准的 Anti-Ab/Place mAbs 的定位 ACU193 對 AβOS 的高選擇性,加上後續研究中預期的 ARIA 發生率較低,預計與抗斑塊單克隆抗體相比,將提供更好的安全性和有效性

藥物:ACU193 是一種人源化、親和力成熟的單克隆抗體,對毒性 aβOS 與 Aβ 單體(>500x)具有很高的選擇性,ABO 的選擇性大於 Ab fibrils 的 85 倍 ACU193 是一種 IgG2 亞類 mAb,效應器功能降低。人羣:早期 AD — AD 引起的輕度認知障礙和輕度痴呆劑量:每 4 周靜脈輸注一次,計劃持續時間:AD 早期 AD 期間的慢性治療價值主張:與非選擇性抗 aβ/斑塊單克相比,毒性 aβO 的選擇性可能提供有意義的認知功效以及更高的安全性和耐受性,包括:• 減緩 AD 早期記憶力和認知能力下降 • 減少 AβO 誘導的記憶力和耐受性突觸和神經元網絡毒性 • 減緩疾病進展和對下游的影響tau、神經變性和神經炎症 • 在隨後的研究中,ARIA 的發病率預計較低 • 作為獨立療法或與其他有症狀、抗炎和/或 tau 定向的療法聯合使用可能有效 ACU193 目標產品簡介:同類最佳、一線、抗 AβO、疾病改良免疫療法,適用於 AD 11 早期

(1) 上面列出的任何候選產品之間都沒有進行過正面交鋒的試驗。每種候選產品的研究設計和方案都不同,候選產品的結果可能無法比較。(2)Goure等人(2014)。靶向適當的β澱粉樣蛋白神經元毒素:阿爾茨海默病免疫治療的前進道路。阿爾茨海默氏症的研究與治療。6:42。DOI:http://alzres.com/content/6/4/42。(3) 第 3 階段因主要 AD 適應症而停止。(4) van Dyck,C. (2017)。阿爾茨海默病的抗澱粉樣蛋白B單克隆抗體:陷阱與希望。生物精神病學。83:4,311-319。DOI:https://doi.org/10.1016/j.biopsych.2017.08.010。mAb 表位/isotype (4) Ab 靶點選擇性 (1) (2) 安全概況公司資產單體斑塊纖維低聚物 ARIA-E (4) 功效概況 ACU193 N 期,確診性 IgG2-+ ++++ 預計第二階段處於低位 Eisai /Biogen leqembitM N 期,確認 IgG1-+++ + protofibrils +++ 低陽性 ph2 和 ph3 CLARITY-AD Lilly donanemab n3pg igg1-++++ ++-高陽性 ph2 和 ph.3 開拓者 Biogen AduhelmtM n-term Igg1-++++ phig ph3 呈陽性,與負面羅氏交戰gantenerumab (3) n-term + Mid domain Igg1-++++ ++ ++ High ph3 負值禮來索拉尼珠單抗 (3) Mid domain /igG1 +++----無 ph3 負值,沒有趨勢輝瑞/Janssen bapineuzumab (3) n-term IgG1 ++ ++ ++ ++ ++ ++ 最近和目前正在開發的抗 Ab 抗體的高 pH3 陰性比較特徵 12

ACU193:價值主張 13 阿爾茨海默氏病市場正處於關鍵轉折點,最近和預期的批准為 AD 的治療鋪平了新的道路... 而 ACU193 完全有能力成為潛在的首選治療方法。在未來幾年中,隨着Abo療法成為主要治療選擇,市場可能會保持整合,利益相關者對AD治療領域的進步感到鼓舞,他們正在共同努力實現更廣泛的患者獲得機會。由於aBo選擇性具有潛在的臨牀和安全益處,ACU193 有機會成為更廣泛的早期 AD 人羣的首選治療方法

ACU193 的 INCTERCT-AD 第 1 階段結果呈陽性

INCERT-AD:AD 早期患者的隨機安慰劑對照 1 期 15 Q2W:每兩週給藥一次;Q4W:每四周給藥一次。A 部分:單次遞增劑量 n = 每隊列 8(總共 32 個)B 部分:多重遞增劑量 n = 每隊列 10 劑(總共 30 次)3 次藥物或安慰劑;每隊列 8:2 1:2 mg/kg ACU193 或安慰劑 2mg 隊列 2:10 mg/kg ACU193 或安慰劑 10mg 隊列 3:25 mg/kg ACU193 或安慰劑 25mg 隊列 4:60 mg/kg ACU193 或安慰劑 60mg 隊列 5:10 mg/kg ACU193 或安慰劑 (Q4W) 10mg 隊列 6:60 mg/kg ACU193 或者安慰劑 (Q4W) 60mg 隊列 7:25 mg/kg ACU193 或安慰劑 (Q2W) * ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk ≥ 1wk

16 在研究的更高劑量(60 mg/kg Q4W 和 25 mg/kg Q2W 隊列)下觀察到的快速、劑量相關、具有統計學意義的澱粉樣蛋白斑塊減少* • 與目前批准的臨牀開發相似時間點的 Aβ 單克隆抗體可與劑量相關的第一種以劑量相關方式展示靶向參與的抗體 • 血清和腦脊液暴露劑量成正比;抗體濃度明顯超過腦脊液中內源性低聚物的水平 • 研究的最高劑量(25 mg/kg Q2W 和 60mg/kg Q4W)接近最大目標參與度(23.2 au/mL Emax)令人信服的總體安全性,ARIA-E 的比率很低 • 沒有已知的藥物相關的 SAE;治療新發的 ADAS 滴度一直很低 • 在 10 mg/kg Q4W 劑量時沒有出現症狀 ARIA-E • 在 Apoe4 純合子 (n=6) 廣泛治療指數中沒有觀察到 ARIA-E;通往更方便的每月給藥方案的明確途徑 1 2 3 4 *羣組內從基線到終點的統計學顯著降低 (p = 0.01) INCTERCT-AD 結果證實 ACU193 的機制證明以及證明在研究的更高劑量下澱粉樣蛋白斑塊會減少

機制證明表明 ARIA-E 水平低,與劑量相關的靶標參與度,CSF ACU193 水平超過 abO 水平,支持 Q4W 給藥 17 種潛在的治療劑量終點關鍵成功因子 10mg/kg 25mg/kg 60mg/kg 安全性和耐受性 • 死亡、與研究藥物相關的 SAE 無任何• 任何 ARIA-E 1/14 (7.1%) 3/14 (21.4%) • 有症狀 ARIA-E 0/14 (21.4%) (21.4%) (21.4%) (0.0%) 0/14 (0.0%) 1/14 (7.1%) PK • 劑量相關 PK • 腦脊液暴露量達到內源性腦脊液低聚物水平以上(明顯高於報告的 Aβ 低聚物水平)已實現(比報告的 Aβ 低聚物水平高几個數量級)已實現(比報告的 Aβ 低聚物水平高几個數量級)目標參與度 • 腦脊液測量中對 acu193-Ab 寡聚物複合物的測量實現劑量相關;接近最大目標參與度劑量相關;接近最大目標參與度澱粉樣蛋白 PET • MAD 隊列中澱粉樣蛋白 PET 減少未觀察到減少(p = 0.01) MAD 同類羣組內的減少 (p = 0.01)
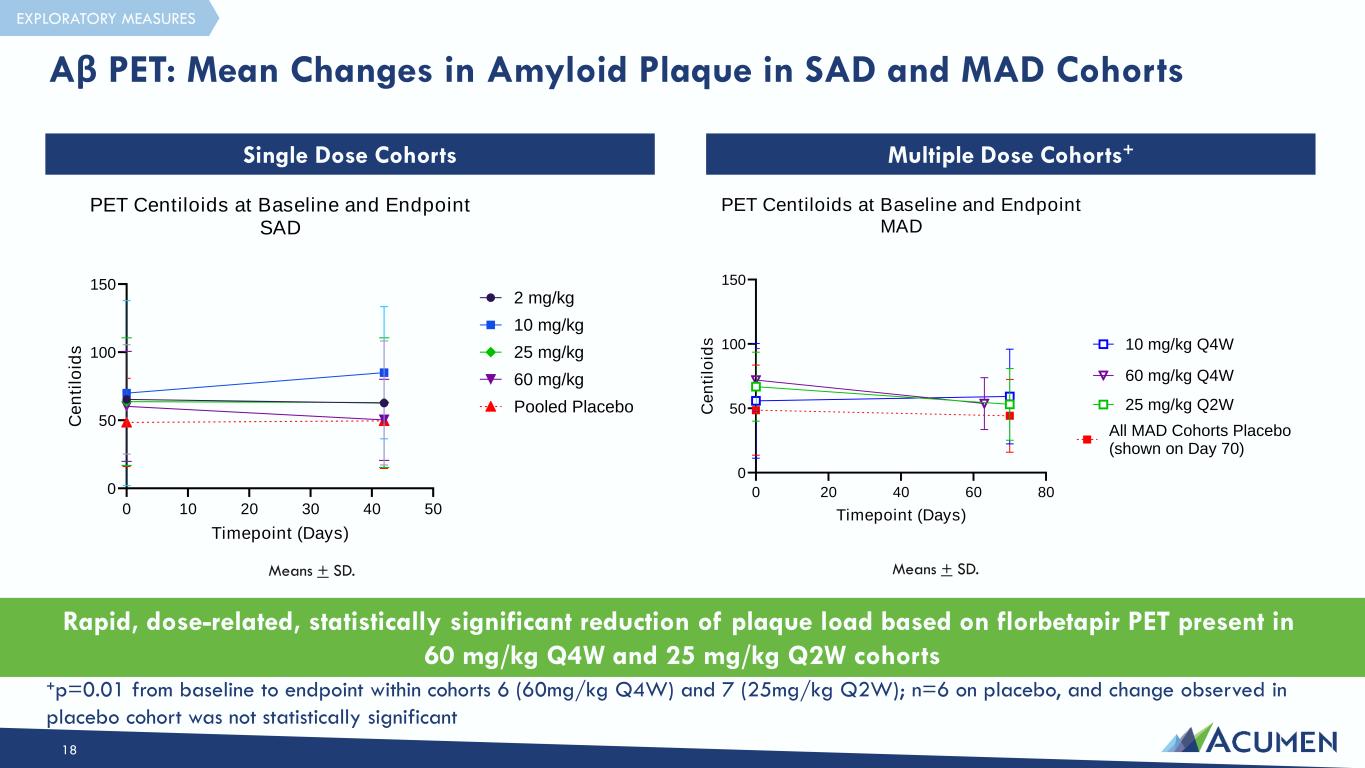
根據存在於 60 mg/kg Q4W 和 25 mg/kg Q2W 羣組 Means + SD 中的 florbetapir PET,可以快速、劑量相關且具有統計學意義的斑塊負荷降低。意思是 + SD。+p=0.01 在羣組 6(60mg/kg Q4W)和 7(25mg/kg Q2W)中從基線到終點;使用安慰劑 n=6,在安慰劑隊列中觀察到的變化在統計學上並不顯著 Aβ PET:SAD 和 MAD 隊列中澱粉樣蛋白斑塊的平均變化 18 單劑量隊列多劑量隊列+ 探索性措施 0 20 40 60 80 0 50 100 150 PET centiloids 在基線和終點 MAD 時間點(天)C e n ti lo id s 所有 MAD 隊列安慰劑(顯示在第 70 天)25 mg/kg Q2W 60 mg/kg Q4W 10 20 30 40 50 50 100 150 PET centiloids 在基線和終點 SADTimepoint (Days) C e n ti lo id s 2 mg/kg 10 mg/kg 25 mg/kg 60 mg/kg 彙集安慰劑

Aβ PET:個體患者在 60 mg/kg Q4W 時的 60 mg/kg Q4W 和 7 隊列在 25 mg/kg Q2W 時澱粉樣蛋白斑塊的變化 19 在 60 mg/kg Q4W 和 25 mg/kg Q2W 隊列中,大多數患者在 63 或 70 天后斑塊負荷有所減少。探索性措施

30 40 50 60 70 80 90 天 0 天 63 天 70 天 90 最高劑量的 ACU193 表明澱粉樣蛋白斑塊減少速度快可與 Lecanemab(處於第 3 階段)相當 20 澱粉樣斑塊(centiloids)的平均減少 ACU193 60 mg/kg Q4W (n=8) * ACU193 25 mg/kg Q2W (n=8) * Lecanemab 10 mg/kg Q2W (n=344) 索引值絕對值(p=0.01 表示澱粉樣蛋白斑塊在 ACU193 隊列中從基線到終點的變化)-30 -25 -20 -15 -5 0 第 0 天 63 天 70 天 (25.3%) (20.6%) (25.7%) (18.1) (13.7) (20.0) p=0.01P=0.01 *統計學隊列內從基線到終點的顯著減少(p = 0.01)。資料來源:Acumen Pharmicals,存檔數據;van Dyck(2023),NEJM(根據圖表估算澱粉樣蛋白 PET 減少量);累計給藥藥物:ACU193 60mg/kg = 180 mg/kg(給藥三劑);ACU193 25mg/kg = 75mg/kg(給藥三劑)注意:上面列出的候選產品之間沒有正面交鋒的臨牀試驗。每種候選產品的研究設計和方案都不同,因此,候選產品的結果可能無法比較。探索性措施

SAD MAD 10 mg/kg Cohorts 2、5 25 mg/kg 同組 3、7 60 mg/kg 同組 4、6 NO ARIA-E 無症狀 ARIA-E 有症狀 ARIA-E 已停產 ApoE D21 3,4 3,4 PBO 3,4 3,4 PBO 3,4 d126 3,4 3,4 PBO D126 3,4 3,4 PBO PBO 3,3 3,4 3,4 3,4 PBO PBO 3,3 Apoe D28 D70 D196 2,3 3,3 3,3 3,3 3,3 PBO PBO 3,4 3,3 3,4 3,4 PBO PBO 3,3 3,3 PBO 3,3 3,3 Apoe D70 98 3,3 3,4 3,4 3,4 3,4 PBO PBO 3,3 3,4 PBO PBO 4,4 4,4 Apoe D21 D140 4,4 PBO 3,4 3,4 PBO 3,3 3,4 2,4 2mg/kg Cohort 1 ApoE D21 D140 3,4 3,3 PBO 3,4 2,3 3,4 PBO 3,3 3,3 ARIA-E INCTERCT-AD 21 沒有 ε4 純合子儘管在研究中佔 13% 但仍會出現 ARIA-E;4/5 ARIA-E 病例是 ε4 雜合子,佔我們研究人羣的 47% PBO:服用安慰劑安全的患者

ACU193 Serum PK 22 單劑量隊列多劑量隊列血清暴露量與劑量成正比,沒有積累 PHARMAKINETICS 估計血清末端 T1/2 為 5-7 天

與劑量相關的腦脊液 ACU193 暴露量:高於內源性腦脊液 aβO 水平 23 個單劑量隊列多劑量隊列* 腦脊液暴露量與劑量方案成正比 *排除了來自隊列 5(10 mg/kg Q4W)的一名患者,因為只服用了一次藥物(空隙性梗塞後研究藥物停用)。藥代動力學

ACU193 藥物特異性捕獲(抗 acu193 idiotype maB)24 通過測量 CSF 中的 acu193-Abo 複合物來評估目標參與度 abO 選擇性檢測(抗 ABO maB)只有藥物/ABO 複合物是可測量的新型測定配置,專為選擇性檢測腦脊液中的 acu193-Abo 複合物作為靶點參與度的直接衡量標準 acu193-Abo 複合物 MSD S-Plex (Turbo) 免疫分析靶點參與度而量身定製的新型測定配置

ACU193 與 aβOS 的目標參與是劑量比例 25 個單劑量隊列多劑量隊列* 2 mg/kg 10 mg/kg 25 mg/kg 60 mg/kg 0 10 20 30 ACU193 IV 輸液劑量 C S F A C U 1 9 3-a β O li g o m e r c o m le x (A U /m L) a t V 是 8 (D a y 2 1) 劑量相關目標參與度 *一名患者從第5組羣(10 mg/kg Q4W)中排除在外,因為只服用了一次藥物(研究藥物在空隙性梗塞後停用)。目標參與度 p = 0.001 p = 0.03 p = 0.0007沒有顯著差異

劑量為 25 mg/kg Q2W 和 60 mg/kg Q4W 26 單劑和多劑量隊列——暴露反應關係(Emax 模型)Emax:23.2 au/mL acu193-aβO 複合物 EC50:1.43 x 105 pg/mL ACU193 目標參與度 *排除了來自隊列 5(10 mg/kg Q4W)的一名患者,因為只服用了一次藥物(研究藥物在 lack 後停藥)月球梗塞)。再加上令人信服的安全特徵和快速減少斑塊,接近最大TE的劑量應指導下一個研究階段的劑量選擇

第 1 階段數據支持進入第 2/3 期在較高劑量隊列中觀察到的快速、劑量相關、具有統計學意義的澱粉樣蛋白斑塊減少 Topline 結果表明 ACU193 的機制證明,第一臨牀階段 aβO 靶向抗體 ACU193 在早期 AD 患者中耐受性良好;沒有與藥物相關的 SAE;ARIA-E ACU193 的低比率接近毒性 aβO 的最大中心靶點參與度,確立了廣泛的中心靶點參與度治療指數和每月方便給藥的途徑探索性措施:— 正如預期的那樣,在這項持續時間短的小型研究中,臨牀認知測量沒有觀察到任何效果——正如預期的那樣,在這項持續時間短的小型研究中,使用核磁共振ASL脈衝序列沒有觀察到任何效果——預計2023年第四季度流體生物標誌物數據 27 令人信服的機制證明瞭下一步行動:預計2023年第四季度美國食品藥品管理局互動;預計在2024年上半年啟動第二階段

ACU193:臨牀前數據

ACU193:支持開發的大量數據包 ACU193 是一種很有前途的早期 AD 免疫療法,有望提供有意義的認知和功能益處,減緩疾病進展,並提供有吸引力的安全性。AβOS 的納米摩爾親和力,AβOS 的選擇性比 Aβ 單體高出 500 倍以上,與血管澱粉樣蛋白或密集的核心澱粉樣蛋白斑塊的結合有限或根本沒有可辨別的內源性 Aβ,從二聚體到高分子量 aβOS 大腦滲透和生物分佈,在多個物種中都得到了證實表現與其他外周給藥的中樞神經單克隆抗體在多種體外神經保護測定中的劑量依賴性效應 AD IgG2 亞類的多個體內轉基因小鼠模型的積極記憶和行為效應缺乏炎症效應器功能信號(fcγR 結合)非臨牀微出血研究顯示微出血風險沒有增加 GLP 研究顯示出可接受的安全性支持臨牀給藥計劃,包括 Ph 2/3 SELECTIVITY PHARMACTIOLOGY PK/PD SAFETY 29

與 Aβ 單體相比,Aβ 低聚物具有很高的選擇性即使存在大量過量的 Aβ 單體,ACU193 與 AβOS 的結合也不會改變 ACU193 與 AβOS 的結合 >500 倍與 Aβ 單體的結合 Log [競爭抗原]μM ACU193 Selectivity ACU193 在 5μM 單體存在下的選擇性 Aβ ACU193 Log μM SELECTIVITY ACU193 是第一款為選擇性靶向 aβOS 而開發的單克隆抗體 ACU193 即使在存在大量過量的 Aβ 單體(例如大腦中存在的單體)的情況下也能保留,從而限制 “靶向分散注意力” 30

比較 SEC 分數中的 Aβ 物種-MAB 複合物信號 SELECTIVITY ACU193 與 Ab 的低聚物種結合,這些物種與 hu266(solaneuzumab)或 Hu3D6(bapineuzumab)ACU193 結合的低聚物種 Ab 31 有區別

AD Hippocampus thios/Amyloid 斑塊 AD Hippocampus acu193/ABOS 物種 ____________________ 來源:E. Cline 等人CTAD 2019。ACU193 對人類 AB 腦切片中的 aβOS versues Aβ 斑塊 32 ACU193 染色具有很高的選擇性 ACU193(紅色)結合非硫黃素 S 陽性 Ab(綠色)選擇性 ACU193 與人類 AD 腦組織中的硫黃素 S 陽性原纖維 Aβ 斑塊的結合很少或根本沒有

藥理學選擇性與神經元結合後,ABO 會破壞長期增強 (LTP),導致細胞內鈣的病理性增加,從而對細胞造成破壞。aβOS 與神經元結合並有毒;ACU193 的小鼠類似物可防止毒性 33 ACU3B3 可防止 AβO 抑制海馬 LTP 體外控制 Aβ42 (50 nM) Aβ42 (50 nM) + ACU3B3 (100 pM) ACU3B3 可防止 AβO 介導的細胞培養物升高注意:(1) 是小鼠單克隆抗體前體和等效於人源化 ACU193 ACU3B3 的變化異常的神經元活動被認為是 AD 記憶力減退的基礎,可以防止 aBo 介導的神經元培養中鈣穩態的中斷 ACU3B3

ACU193 (ACU3B3) 的小鼠親本版本用於治療有沉積斑塊的年輕小鼠或斑塊豐富的年齡較大的小鼠治療 AD 的轉基因小鼠模型可改善行為 34 治療可顯著減少年輕(5-7 個月)的轉基因小鼠的缺陷藥理學選擇性缺陷 MWM 游泳速度異常(**p
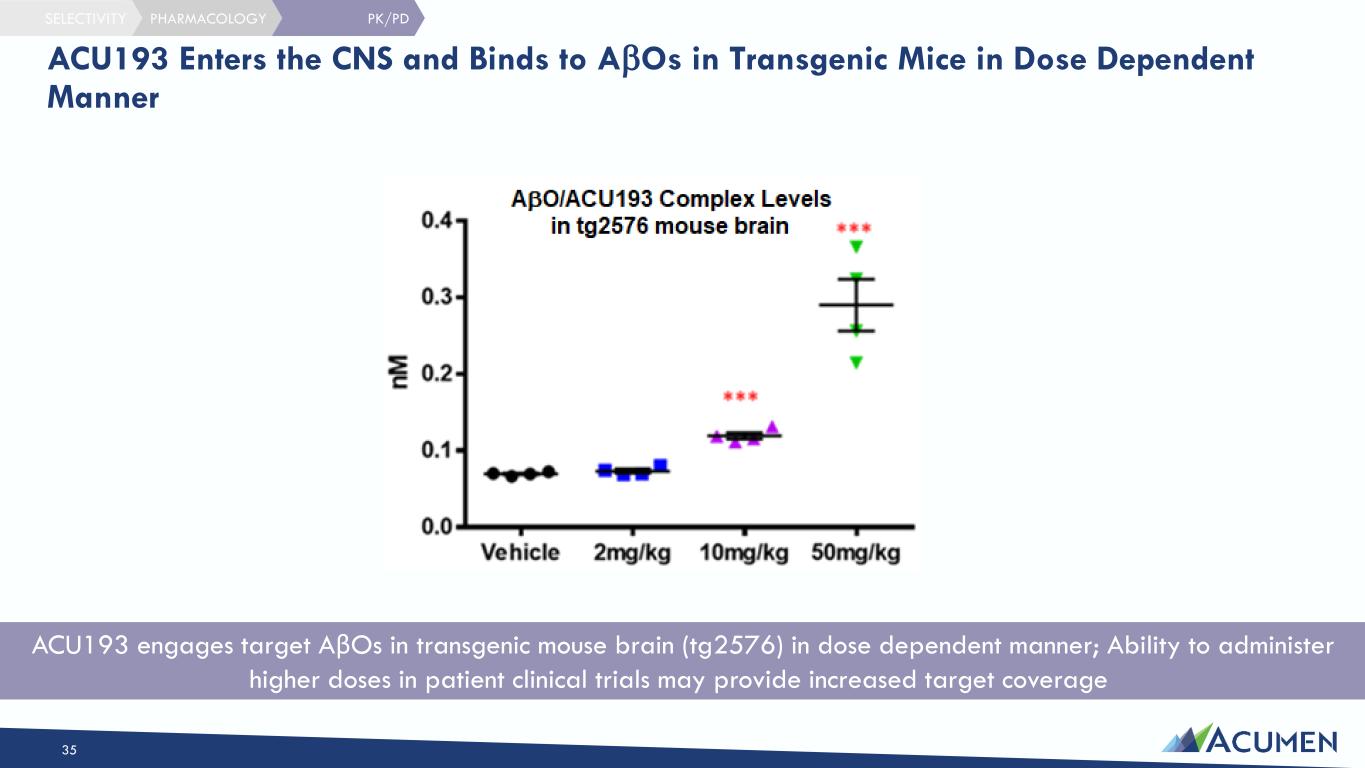
ACU193 以劑量依賴性的方式利用轉基因小鼠大腦 (tg2576) 中的靶點 AβO;能夠在患者臨牀試驗中施用更高劑量可以增加靶標覆蓋率 PK/PD ACU193 進入中樞神經系統並以劑量依賴方式與 ABO 結合 35 藥理學選擇性

臨牀開發計劃和戰略考慮

Acumen 領導團隊在 AD/Neuro 藥物開發方面經驗豐富 Acumen 團隊在阿爾茨海默氏症藥物發現和開發方面擁有數十年的經驗 JANICE HITCHCOCK,博士,監管事務副總裁 ROBERT DEAN,醫學博士,生物標誌物和分析方法高級開發顧問 JASNA JERECIC,博士分析方法負責人,研究科學家 ERIC SIEMERS,醫學博士,首席醫學官 MATT ZUGA 首席財務官兼首席商務官羅素·巴頓首席運營官 DANIEL O'CONNN ELL 總裁兼首席執行官 LIEAN SCHENK 副總裁、CMC 負責人 SIEW TIN GAN 臨牀主管運營 37 DEREK MEISNER,JD 首席法務官 JULIE BOCKENSTETTE 執行副總裁、人力資源主管

ACU193 開發摘要 38 差異化特徵:非臨牀和 1 期數據與 Ab 低聚物的毒性以及 ACU193 與 Ab 低聚物的選擇性結合一致評估安全性、PK 和靶點參與度的 Phase1 研究的積極頂線結果預計在 2023 年第四季度美國食品藥品管理局互動之後,從 2 期研究開始,根據中期分析,有可能擴展到 3 期註冊研究

ACU193 知識產權和市場排他性 • 默克對其澱粉樣蛋白衍生的擴散配體 (ADDL) IP 的獨家、永久、不可撤銷、全球免版税許可,包括已頒發的 ACU193 專利 • ACU193 全球知識產權:✓ 在 19 個國家頒發的專利 ✓ 物質專利組成和使用方法有效期可能延長 3-5 年,具體取決於司法管轄區 • 生物製劑市場預計將獨家經營權 ACU193 作為一種新型生物藥物 ✓ 美國為新型生物製劑提供 12 年的市場獨家經營權 ✓ 歐洲提供 10 年的市場獨家經營權 ✓新型生物製劑的市場獨家經營權 39

Acumen 資本充足,預計將在 2026 年下半年出現現金和有價證券。我們相信 Acumen 手頭有足夠的現金和有價證券將 ACU193 推進 2026 年下半年,截至 2023 年 6 月 30 日約1.27億美元現金、現金等價物和有價證券 2023 年 7 月擴大公開後續發行的額外淨收益 40 個里程碑狀態/預期時間機制證明業績 ✓ 生物標誌物第一階段研究的結果 2023 年第四季度預計與 FDA 的互動 2023 年第四季度預計將於 2024 年上半年啟動 2 期試驗

ABOS:關鍵要點經驗豐富的AD藥物開發團隊AD 的大量未得到滿足的需求、最近的有利趨勢和累積的學習領域 2023 年即將到來的行業催化劑針對有毒的 ABO 藍籌股投資者的差異化候選產品、非常強勁的資產負債表和 2026 年下半年的現金跑道 2023 年 7 月公佈的 1 期臨牀正面數據 41

附錄 www.acumenparm.com 42

Lecanemab 第 2 階段表明,僅減少澱粉樣蛋白斑塊不足以優化阿爾茨海默氏病減速 * 43 *治療後 ban2401 介導的澱粉樣蛋白減少的持續性:對早期阿爾茨海默氏病受試者 BAN2401-G000-201 核心階段和開放標籤延期基線之間的澱粉樣蛋白狀態的初步比較(1330);Chad J. Swanson 等神經病學 2020 年 4 月,94(15 份補編)1330;*在 2020 年 4 月的美國神經病學會(AAN)會議上發表。• Lecanemab(BAN2401)研究 201 — 開放標籤擴展(OLE)研究開始前的 “間隔” 期證實,儘管澱粉樣斑塊(Ab PET suvR)持續減少,但停用 Lecanemab 後認知結果(CDR-SB)惡化。Ab PET 可測量大腦中的澱粉樣蛋白斑塊,但不能測量可溶性 Ab 物種,例如低聚物或原原纖維在 CDR-SB 中的變化:研究 201 核心與 OLE 基線變化澱粉樣蛋白 PET suvR:研究 201 核心與 OLE 基線表明可溶性 Ab 聚集物種(例如原原原纖維、低聚物)在臨牀下降中起作用 Core Baseline 18m OLE 基線基線 18m OLE 基線安慰劑每月 10 mg/kg 10 mg/kg biWeeklyTreation On 治療關閉治療關閉治療 W o rs e n in g im p ro v in g

實測結果** solanezumab EXPERTIONAB 3(第 3 階段)aducanumab EMERGE(第 3 期)aducanumab ENGAG(第 3 期)lecanemab Clarity-ad(第 3 階段)+ donanemab TRAILBLAZER-2(中級 Tau)adas-CoG -11% -27% -26% -20% -32% S-ADL -15% -40% -18% -37% -28% -40% CDR-SB -15% -23% -29% -36% MMSE -13% -15% N.A. N.A. iadrs -11% N.A. N.A. N.A. N.A. N.A.-A.-A. -11% N.A. N.A. N.A. N.A. N.A. A.A.-A.-A. -22-35% 來自最近 3 期抗澱粉樣蛋白單抗體ADRs研究的陽性信號和概念驗證認知/功能減緩百分比 TRAILBLAZER-2Decline* 注意:ENGAGE 協議後版本 4 — 至少 14 劑量 10 mg/kg,與安慰劑相比,高劑量隊列的 CDR-SB 改善了 27% * 減緩百分比 = P[1- [(終點分數-基線分數)active/(終點分數-基線分數)安慰劑]]* 100% * (-1) ** ADAS-COG:阿爾茨海默氏病評估量表 — 認知子量表 ADCS-ADL:阿爾茨海默氏病合作研究 — 日常生活活動 CDR-SB:臨牀痴呆評級 — 盒子總和 MMSE:迷你精神狀態檢查 iADR:阿爾茨海默氏病綜合評級量表 “我們正在尋找可以再接再厲的對抗阿爾茨海默氏症的生物學立足點。所以,這些影響很小,但我認為它們很有意義,我希望它們是我們可以增加的過程的開始。”-Stephen Salloway,布朗大學醫學博士 ++ __________________ + 來源:衞材/Biogen 新聞稿,2022 年 9 月 28 日。++ 來源:禮來公司 2023 年 5 月 3 日新聞稿。++來源:《華爾街日報》,Biogen詳細介紹有爭議的阿爾茨海默氏症藥物案例,2019年12月5日出版。例如,參見 Plotkin,《疾病神經生物學》,2020年。上面列出的任何候選產品之間都沒有進行過正面交鋒的臨牀試驗。每種候選產品的研究設計和方案都不同,候選產品的結果可能無法比較。44

靶向 AB 單體 solanezumab EXPEDITION 3(第 3 階段)aducanumab EMERGE(第 3 期)aducanumab(第 3 階段)donanemab(第 3 期)++ pc 處理 pc 低高 PC 處理 ARIA-E 0.2% 0.1% 2.2% 26.1% 34.4% 3.0% 25.6% 35.7% 0.8% 24% 0.8% 9.9% 1.7% 12.6% 有症狀 6% 3% ApoE ε4 攜帶者 1.9% 29.8% 42.5% 41.8% 44.0% 14.6% 2.8% ApoE ε4 非載體 2.9% 18.1% 17.7% 0.0% 5.4% 任何一個ARIA E 或 H 10.3% 32.8% 41.2% 9.8% 30.7% 40.3% 8.0% 38.9% 31% 9.5% 21.5% 抗斑塊單克抗體顯示劑量相關的 ARIA 可能會限制其使用 45 * PC = 安慰劑,低 = 低劑量;高 = 高劑量表明使用靶向 Aβ 單體(solanezumab)的抗體(solanezumab)治療後不存在 ARIA,而在增加劑量時,ARIA 的存在率會增加靶向澱粉樣蛋白斑塊(aducanumab、BAN2401 和 donanemab)的抗體的水平表明 ARIA 是由去除血管周圍澱粉樣蛋白斑塊引起的,而且可能確實如此不是使用靶向其他物種 Aβ(即 Aβ 單體和 AβOS)的抗體治療所致。抗Aβ/斑塊mabs的ARIA事件百分比* ARIA-E代表了與澱粉樣斑塊結合的單抗的劑量限制不良反應;我們認為,表現出較低ARIA-E的抗體應該更安全、更可行,可能在更高的劑量下給藥。上面列出的任何候選產品之間都沒有正面交鋒的臨牀試驗。每種候選產品的研究設計和方案都不同,候選產品的結果可能無法比較。+ 來源:衞材/Biogen 新聞稿,2022 年 9 月 28 日。++ 來源:禮來公司新聞稿 2023 年 5 月 3 日。45 靶向原纖維靶向澱粉樣蛋白斑塊