目錄
下表彙總了我們的項目渠道,全部處於臨牀前開發階段:
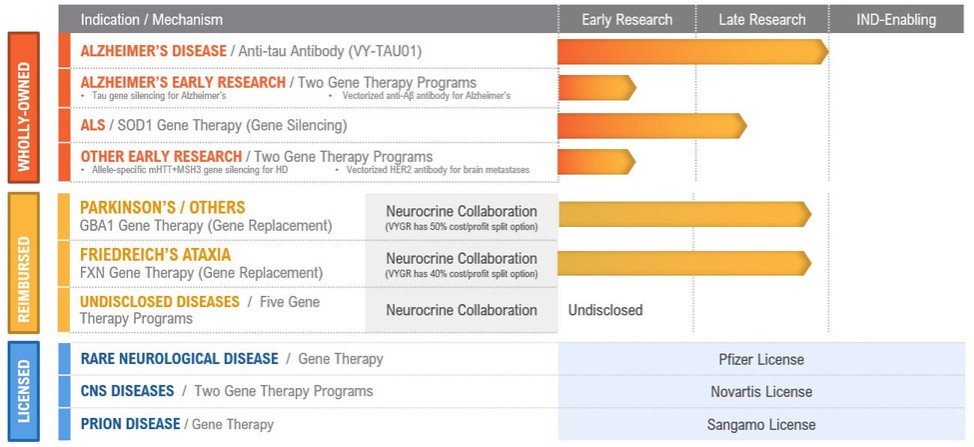
全資項目
用於治療 AD 的抗 Tau 抗體項目
疾病概述
我們正在開發專有抗體,這些抗體可以選擇性地靶向和減少病理性tau的傳播,用於治療tauopathes,我們的主要適應症是AD。tau病理學的傳播與AD的疾病進展和認知能力下降密切相關,AD影響了美國約600萬人,是社會的醫療保健負擔越來越大。最近,抗澱粉樣蛋白抗體已獲準用於治療AD,但仍有大量醫療需求未得到滿足。
我們的治療方法
長期以來,我們一直專注於開發專有和互補的方法來阻斷 tau 病理的進展,tau 病理被認為是 AD 和其他牛皮病的核心。減少有毒的 tau 聚集體可能會減緩這些疾病的疾病進展和認知能力下降。我們正在探索抗tau抗體的被動給藥。我們的抗tau抗體具有差異化的特性,包括改善對tau蛋白特定區域的靶向,與第一代方法相比,可以提供更好的特徵。我們認為,我們的靶向 C 末端的抗體與其他方法有很大的區別。此外,我們認為,在IND申請獲得批准後,利用人類tau的正電子發射斷層掃描(PET)成像以及測量血漿和腦脊液生物標誌物的臨牀評估有可能使人類生物學證明的有效和加速演示成為可能。
臨牀前研究
在2022年8月的阿爾茨海默氏症協會國際會議上,我們公佈了我們專有的抗tau抗體的數據,這些抗體以高親和力靶向中結構域和C端,在小鼠模型的臨牀前研究中表現出良好的生物物理特徵和強勁的活性。在 P301S 種子繁殖 tauotha 小鼠模型中,我們的 C 末端靶向抗 tau 抗體阻斷了絲狀 tau 的播種/繁殖
31