

2023 年 7 月 Larimar Therapeutics CTI-1601 計劃更新

本演示文稿包含基於Larimar Therapeutics, Inc.(“公司”)的信念和假設以及管理層目前獲得的信息的前瞻性陳述。除歷史事實陳述外,本演示文稿中包含的所有陳述均為前瞻性陳述,包括但不限於 Larimar 開發和商業化 CTI-1601 和其他計劃中的候選產品的能力、Larimar 計劃中的研發工作,包括其 CTI-1601 臨牀試驗和總體開發計劃的時機,以及與 Larimar 的業務戰略、籌集資金的能力、資本使用、運營業績和財務狀況以及未來運營計劃和目標有關的其他事項。在某些情況下,你可以用 “可能”、“將”、“可以”、“將”、“應該”、“期望”、“打算”、“計劃”、“預期”、“相信”、“估計”、“預測”、“項目”、“潛力”、“繼續”、“持續” 或這些術語或其他類似術語的負面詞來識別前瞻性陳述,儘管並非所有前瞻性陳述都包含這些詞語。這些陳述涉及風險、不確定性和其他因素,這些因素可能導致實際業績、業績或成就與這些前瞻性陳述所表達或暗示的信息存在重大差異。這些風險、不確定性和其他因素包括 Larimar 產品開發活動的成功、成本和時機、非臨牀研究和臨牀試驗,包括 CTI-1601 臨牀里程碑以及就部分臨牀暫停與美國食品藥品管理局的持續互動;初步的臨牀試驗結果可能與最終的臨牀試驗結果不同;早期的非臨牀和臨牀數據以及對 CTI-1601 的測試可能無法預測後來的臨牀試驗的結果或成功以及評估;潛在的影響的Larimar 未來的臨牀試驗、製造、監管、非臨牀研究時間表和運營以及總體經濟狀況的公共衞生危機;Larimar 和第三方製造商 Larimar 參與、優化和擴展 CTI-1601 製造流程的能力;Larimar 獲得 CTI-1601 和未來候選產品的監管部門批准的能力;Larimar 有能力單獨或與潛在的未來合作者一起發展銷售和營銷能力,以及成功商業化任何經批准的產品候選人;Larimar為開展產品開發活動籌集必要資金的能力;以及Larimar向美國證券交易委員會(SEC)提交的文件中描述的其他風險,包括但不限於拉里瑪的定期報告,包括10-K表的年度報告、10-Q表的季度報告和8-K表的最新報告,這些報告已提交給美國證券交易委員會或提供給美國證券交易委員會,可在www.sec.gov上查閲。這些前瞻性陳述基於Larimar目前已知的事實和因素及其對未來的預測,對此尚不確定。因此,前瞻性陳述可能不準確。本演示文稿中的前瞻性陳述僅代表拉里瑪管理層截至本文發佈之日的觀點。除非法律要求,否則Larimar沒有義務出於任何原因更新任何前瞻性陳述。前瞻性陳述

CTI-1601 獲美國食品藥品管理局批准,用於推進臨牀開發 FDA 對 Larimar 的審查對其部分臨牀暫停的完全反應允許在 2 期劑量探索試驗和 OLE 試驗 2 期試驗中啟動 50 毫克隊列 OLE 試驗獲準啟動後續步驟 FDA 在審查 50 毫克隊列參與者的非盲數據後,批准啟動 50 毫克隊列,持續 14 天,然後每隔一天給藥一次第 28 天 1 期試驗或 2 期劑量探索試驗的參與者均有資格獲得篩查劑量:每天 25 毫克,皮下注射自行給藥或由護理人員給藥(數據在第 1 年定期收集,之後每 3 個月收集一次)繼續準備將 CTI-1601 臨牀計劃擴展到美國以外的地區。向美國食品藥品管理局提交第二組的第 2 期數據,以獲得在 2 期研究或 OLE 研究中可能增加劑量的許可 OLE:開放標籤延期

投資亮點臨牀階段的生物技術公司專注於滿足弗裏德賴希共濟失調(FA)和其他潛在的複雜罕見疾病中未滿足的需求,其基礎是強大的知識產權組合支持的平臺技術。主要候選藥物 CTI-1601 是一種重組融合蛋白,旨在通過將蛋白輸送到線粒體來直接解決弗雷他辛缺乏的問題。CTI-1601 已獲得孤兒藥(美國和歐盟)、罕見兒科疾病(美國)、Fast Track(美國)和 PRIME(歐盟)稱號 FA 兩項雙盲、安慰劑對照的 1 期試驗表明 CTI-1601 在每天給藥長達 13 天時耐受性總體良好;在所有評估的組織中,觀察到 frataxin (FXN) 水平與安慰劑相比的劑量依賴性增加。正在進行中的第 2 階段,安慰劑對照,4 周 FA 的劑量探索研究;25 mg 隊列數據顯示 CTI-1601 總體耐受性良好,與安慰劑相比,皮膚中的 FXN 水平比基線高還有口腔細胞;試驗推進到50毫克隊列,預計數據將在2024年上半年公佈;每日劑量為25毫克的OLE試驗將於2024年第一季度獲準啟動。為了有可能增加2期研究或OLE研究的劑量,請向FDA提交來自50毫克隊列的2期數據,因為臨牀持續停滯不前。1.115億美元的現金餘額(2023年3月31日),預計現金流將持續到2024年第四季度新型蛋白質替代療法平臺有史以來第一種提高frataxin水平的療法已完成第一階段概念驗證2期和OLE研究的財務基礎雄厚的財務基礎

由導致弗拉他辛水平低的遺傳缺陷引起 FA 患者產生的弗拉他辛水平僅為正常水平的 20-40% 左右,具體取決於組織、採樣技術和所考慮的測定。1 影響全球約 20,000 名患者,美國約有 5,000 名患者,其餘大多數患者在歐盟 14 歲之前出現初始症狀可能包括姿勢不穩定、經常跌倒和行走困難。當症狀出現時,可能已經發生心臟損傷。進行性疾病:症狀惡化,患者最終只能坐在輪椅上,言語變得猶豫不決和生澀(通常被稱為 “掃描語音”)預期壽命為30-50歲通常由心臟病引起的早期死亡沒有可用的療法會增加弗雷他辛水平只有批准用於FA的治療無法解決弗雷他辛缺乏症弗雷德賴希的共濟失調(FA)罕見和進行性疾病 5 1.E.C. Deutsch 等人分子遺傳學與代謝 101 (2010) 238—245 LRMR 繼續與弗裏德賴希的共濟失調研究聯盟保持着密切的關係,專注於 FA 治療的 FA 患者倡導小組
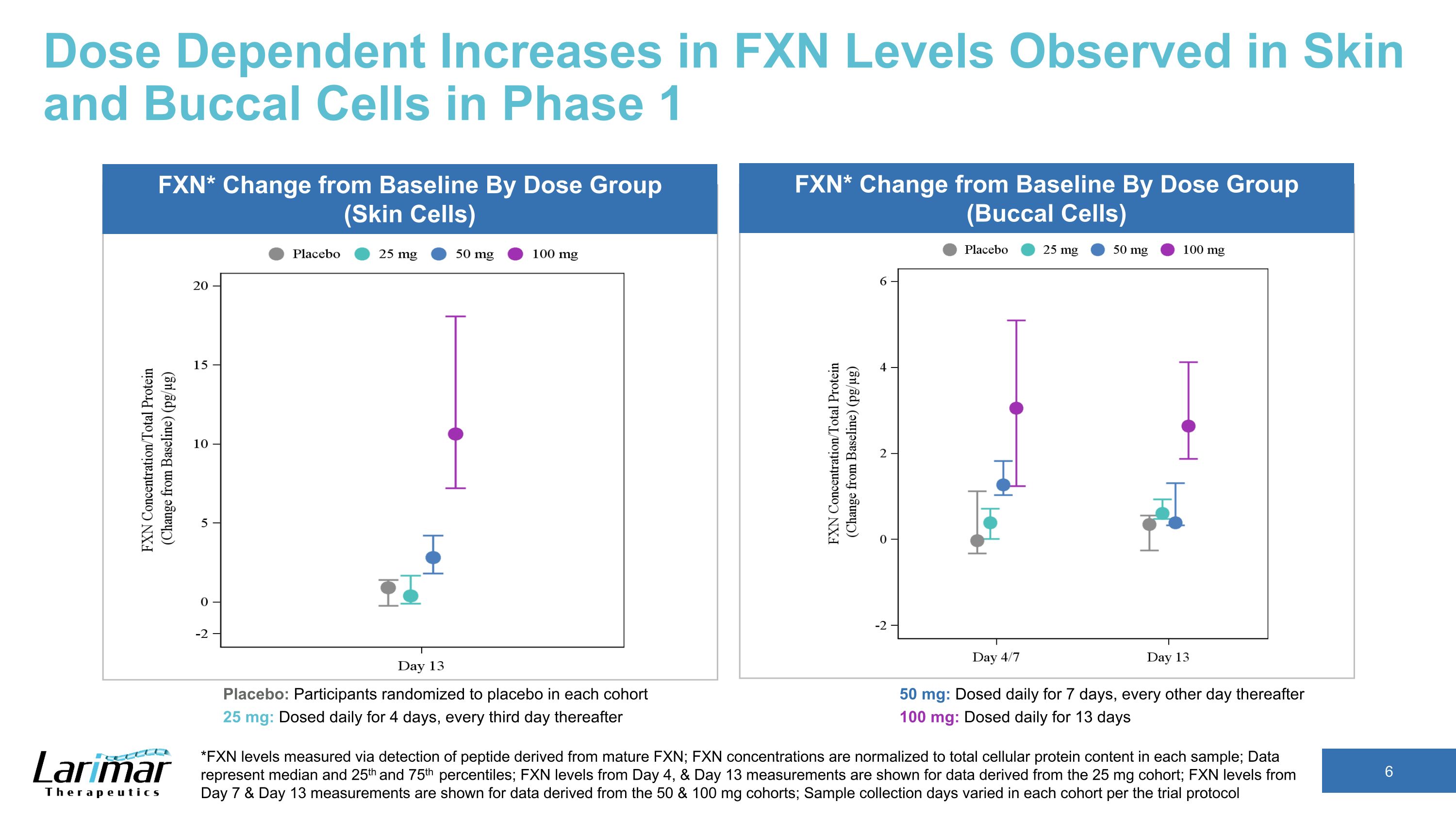
第 1 階段在皮膚和頰細胞中觀察到的 FXN 水平的劑量依賴性增加 *FXN 水平通過檢測來自成熟 FXN 的肽來測量;FXN 濃度歸一化為每個樣本中的細胞蛋白總含量;數據代表中位數以及第 25 個和第 75 個百分位數;顯示了從 25 mg 隊列中得出的第 4 天和第 13 天的FXN水平;顯示了數據中第7天和第13天的FXN水平源自 50 和 100 毫克隊列;根據試驗方案,每個隊列的樣本採集天數各不相同 FXN* Change從基線按劑量組(皮膚細胞)FXN* 與基線的變化按劑量組(口腔細胞)安慰劑:每個隊列中隨機分配到安慰劑的參與者 25 mg:每天給藥 4 天,之後每三天給藥 50 mg:每天給藥 7 天,之後每隔一天 100 mg:每天給藥,持續 13 天
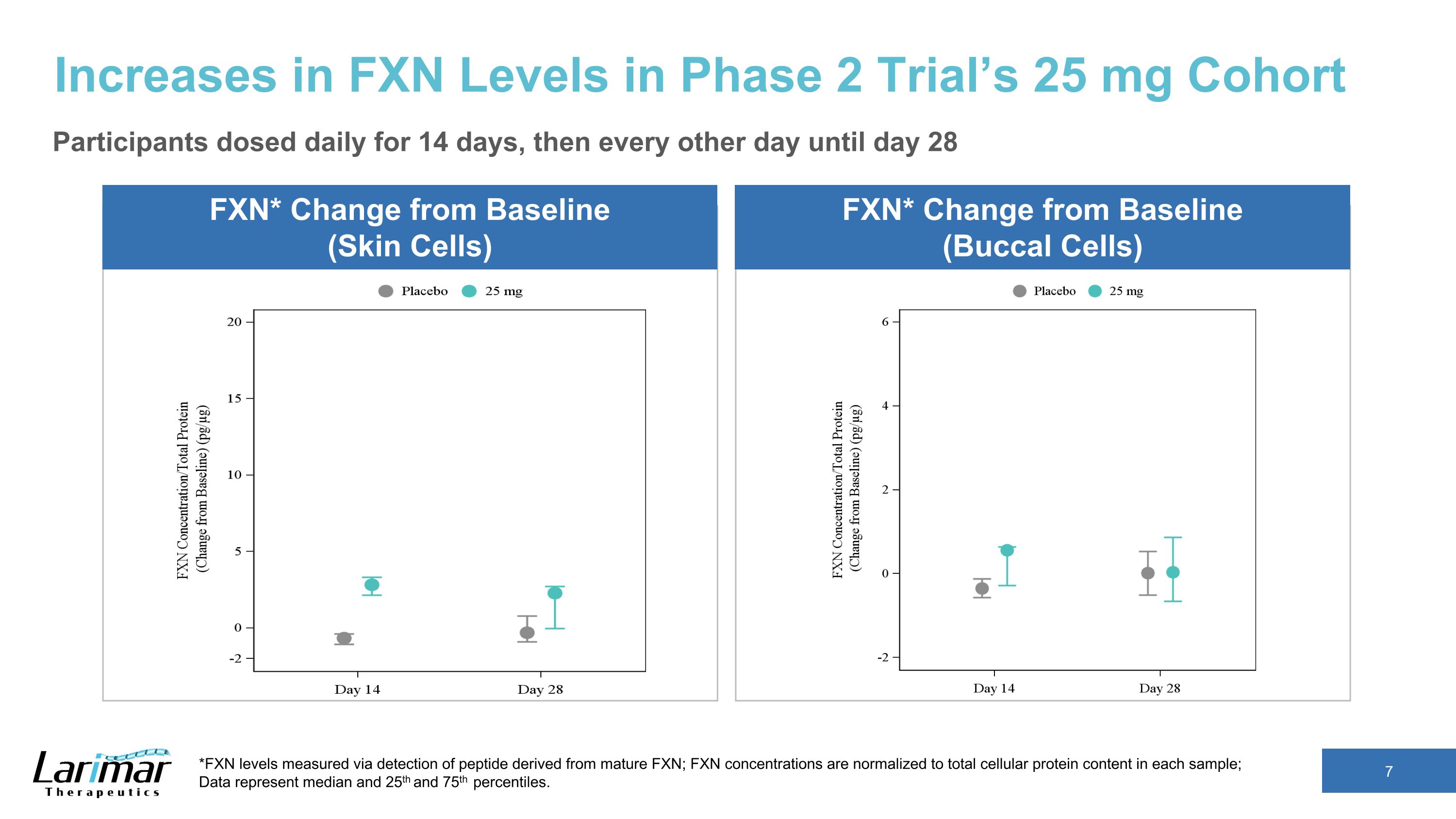
2期試驗的25毫克隊列FXN水平升高*與基線的變化(皮膚細胞)*通過檢測源自成熟FXN的肽來測得的FXN水平;FXN濃度歸一化為每個樣本中的細胞蛋白總含量;數據代表中位數以及第25和第75個百分位數。FXN* 與基線(Buccal Cells)相比的變化參與者每天服藥,持續 14 天,然後每隔一天服藥一次,直到第 28 天

臨牀數據表明 CTI-1601 的耐受性總體良好 CTI-1601 在多項研究中向 37 名不同的 FA 成年人注射 37 名臨牀試驗參與者中,有 35 人完成了各自的研究。一名 2 期參與者因過敏反應通過標準治療得以緩解而退出 50 mg 隊列中的一名 1 期參與者因輕度至中度噁心和嘔吐而退出。任何 CTI-1601 臨牀試驗中沒有嚴重的不良事件或重要醫學事件一項嚴重不良事件(過敏反應)消退了 CTI-1601上面提及的標準治療方法)最常見的不良事件(aE)是輕度和中度注射部位反應(ISR)在所有試驗中,100% 接受CTI-1601治療的參與者和接受安慰劑治療的參與者中,除ISR外,AE的數量和嚴重程度沒有隨着劑量的增加而增加,沒有因ISR而終止,所有不良反應的數量和嚴重程度均未隨劑量增加而增加

第 2 階段劑量探索研究推進到 50 mg 隊列目標:進一步表徵 PK/PD 並評估安全性,以告知長期劑量和劑量方案治療時間表 28 天治療期 16 17 18 19 15 21 22 23 24 25 27 28 2 3 4 5 1 6 7 8 9 10 11 13 14 = 服用 CTI-1601 或安慰劑 = 無給藥研究詳情人羣流動和非活動性弗裏德賴希共濟失調患者 ≥ 18 歲年齡。CTI-1601 治療天真或參與了之前的 Larimar 研究(如果符合條件)。劑量隊列 1:25 mg 隊列 2:50 mg 關鍵終點外周組織中的 Frataxin 水平、PK、PD、安全性和耐受性。PD 終點包括脂質譜和基因表達數據。患者人數隊列 1:入組 13 名參與者(9 人服用 CTI-1601;4 人服用安慰劑)。羣組 2:旨在招收大約 12-15 名參與者,隨機分配 2:1 接受 CTI-1601 或安慰劑。第 1 組的定時給藥已完成。第 2 組已獲準啟動。預計將於 2024 年上半年發佈第 2 期羣組的頂級數據。
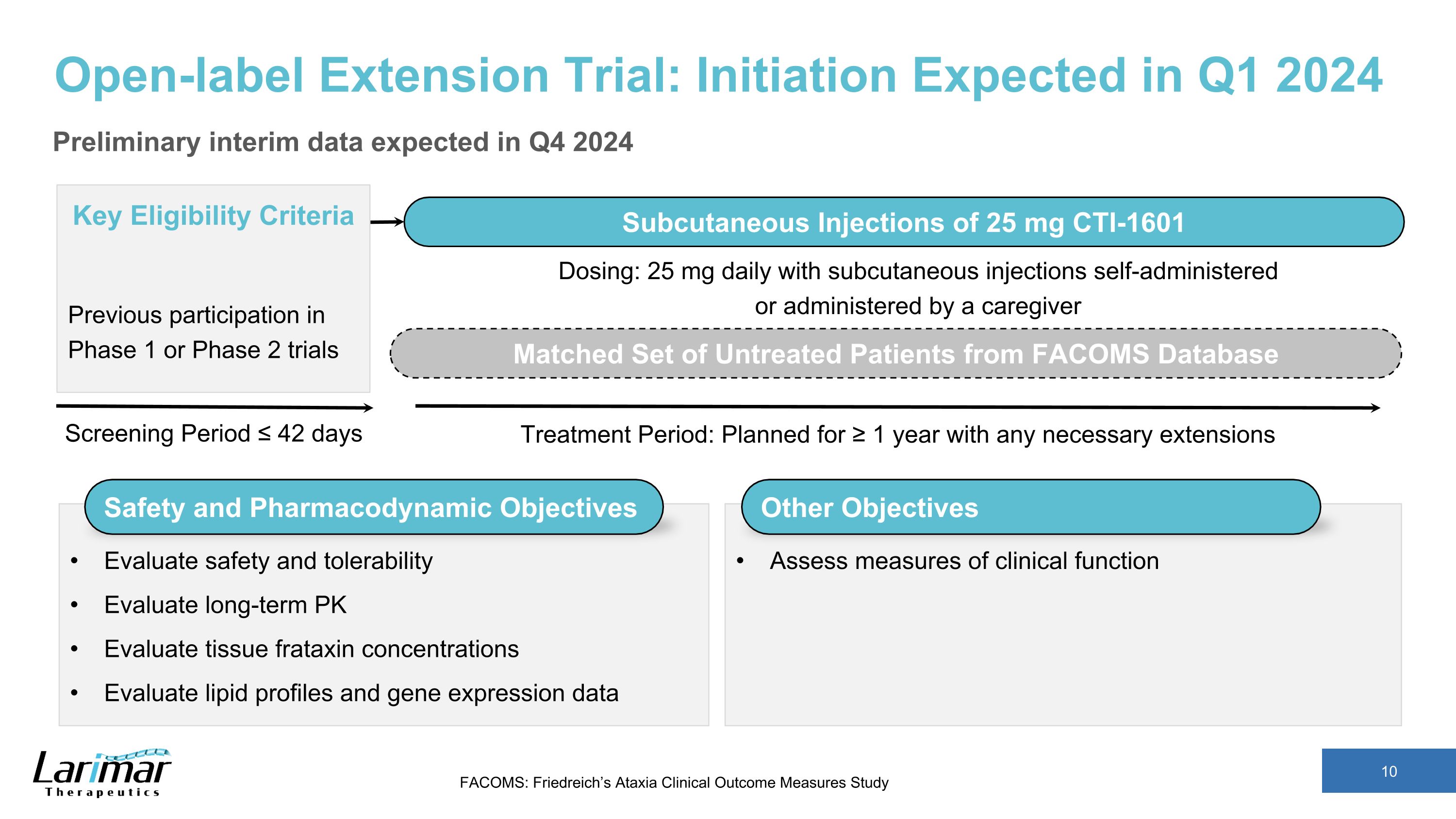
開放標籤延期試驗:預計於 2024 年第 1 季度啟動初步中期數據預計於 2024 年第四季度篩選期 ≤ 42 天關鍵資格標準先前參與的 1 期或 2 期試驗皮下注射 25 mg CTI-1601 治療期:計劃持續 ≥ 1 年,並進行必要的延長 FACOMS 數據庫中匹配的一組未經治療的患者評估安全性和耐受性評估長期 PK 評估組織 frataxin 濃度評估脂質譜和基因表達數據劑量:25 毫克每天皮下注射自行給藥或由護理人員給藥其他目標評估臨牀功能的衡量標準 FACOMS:Friedreich 的共濟失調臨牀結果測量研究

CTI-1601 臨牀開發計劃正在進行和計劃中的試驗* 包括:全球雙盲安慰劑對照關鍵試驗*** 開放標籤延長試驗,對參加 SAD、MAD 和/或為期四周的劑量探索研究的符合條件的患者,每天給藥 25 毫克。預計於 2024 年第一季度啟動。在 2 至 17 歲患者中進行 MAD 試驗**。參與者有資格篩選 OLE 試用。第二階段,為期四周的劑量探索研究,旨在確定長期研究的劑量和劑量方案。晉升至 50 毫克隊列。預計將於2024年上半年進行的50毫克2期劑量探索試驗的頂線數據 *其他美國臨牀試驗的啟動取決於成年患者因部分臨牀擱置而向美國食品和藥物管理局提交的額外數據。**公司正計劃與FDA討論如何最好地將2至17歲的患者納入臨牀開發***公司計劃與FDA就適當的關鍵試驗終點(包括FXN水平的價值)展開討論。此外,該公司正計劃與美國以外的監管機構和研究人員進行討論,將臨牀項目擴展到國際地區。

2023 年第三季度監管更新:2024 年第 1 季度啟動 50 毫克隊列 2 期劑量探索試驗:2024 年上半年啟動開放標籤延期試驗:2024 年第 4 季度第 2 期試驗 50 毫克隊列的頂線數據:來自開放標籤延期試驗的中期數據 FA 的 CTI-1601 第 2 期劑量探索試驗獲準進入 50 毫克隊列開放標籤延期試驗,每日劑量 25 毫克已獲準開始擴大 CTI-1601 臨牀計劃的準備工作至美國以外地區摘要:CTI-1601 已獲美國食品藥品管理局批准晉級 CTI-1601臨牀開發總體耐受性良好 1 期所有評估組織中 FXN 水平的劑量依賴性增加 2 期所有評估組織(皮膚和口腔細胞)中與安慰劑相比,FXN 比基線增加